中国海洋湖沼学会主办。
文章信息
- 王涵颖, 张心月, 彭怀云, 杨君烨, 邱浩宇, 黄玲, 陶晨智, 王萍. 2024.
- WANG Han-Ying, ZHANG Xin-Yue, PENG Huai-Yun, YANG Jun-Ye, QIU Hao-Yu, HUANG Ling, TAO Chen-Zhi, WANG Ping. 2024.
- 球形赖氨酸芽孢杆菌(Lysinibacillus sphaericus)对斑马鱼幼鱼生长、肠道菌群及代谢的影响
- EFFECTS OF LYSINIBACILLUS SPHAERICUS ON GROWTH, INTESTINAL FLORA AND METABOLISM OF JUVENILE ZEBRAFISH (DANIO RERIO)
- 海洋与湖沼, 55(1): 265-278
- Oceanologia et Limnologia Sinica, 55(1): 265-278.
- http://dx.doi.org/10.11693/hyhz20230900188
文章历史
-
收稿日期:2023-09-21
收修改稿日期:2023-11-04
2. 浙江海洋大学海洋科学与技术学院 浙江舟山 316022
2. College of Marine Science and Technology, Zhejiang Ocean University, Zhoushan 316022, China
目前, 我国水产养殖量逐年攀升, 养殖集约化日益严重, 导致养殖水体恶化、养殖动物病害增加、养殖生态系统失衡, 极大的限制了水产养殖的健康可持续发展(杨卫等, 2018)。抗生素因其促生长且能预防、治疗疾病而广泛运用于水产养殖, 但长期使用抗生素会导致养殖动物易产生耐药性、肠道微生物系统损伤、免疫力低下, 同时抗生素的残留也会对环境造成一定影响(Chen et al, 2020)。传统的抗生素疗法已不能满足绿色健康的养殖理念, 因此, 寻找绿色健康的添加剂势在必行。
近年来, 益生菌在水产中的应用越来越广泛, 使用方式也多种多样, 比如添加到饲料或者养殖水体中。益生菌可调节宿主体内的生态环境、提高抗病力的同时对养殖水体起到改善作用(闫子豪等, 2022)。因其安全有效、环境友好等特点渐渐代替了副作用较多的抗生素。芽孢杆菌与其他益生菌的显著区别在于其培养的最后阶段会在细胞内形成厚壁芽孢, 也称内生孢子, 具有耐高温、高pH、高盐、干燥和抗氧化等特点, 可保护芽孢杆菌免受不良环境的影响(张宇柔等, 2022)。芽孢杆菌作为饲料添加剂具有以下益处(Srisapoome et al, 2017; Shi et al, 2020): 1) 促进鱼类生长与消化; 2) 抑制鱼体内病原菌生长、增强免疫力; 3) 调节其肠道微生物区系; 4) 显著改善代谢途径。养殖水体或饲料中添加益生菌后对鱼类的健康养殖具有重要的意义, 因此益生菌可作为绿色健康的添加剂之一, 为水产养殖提供新的可持续解决方案。
斑马鱼(Danio rerio)是一种热带淡水鱼, 作为重要的模式脊椎动物之一, 斑马鱼模型具有以下显著优点(Qin et al, 2017; 王之怡等, 2020): 1) 斑马鱼早期体色较透明, 易于观察微生物在体内的定植情况; 2) 与体外细胞培养模式相比, 斑马鱼有完整的生命特征与功能, 是真正意义上的模式生物; 3) 斑马鱼具有先天性免疫系统, 并在4周龄时能够发展适应性免疫; 4) 斑马鱼基因数据库较为完善, 具有良好的研究基础。近年来, 斑马鱼也被广泛应用于益生菌在体功能的检测。例如: 乳酸菌通过增强斑马鱼免疫应答从而提高其抗病能力(Qin et al, 2017); 益生菌浸浴斑马鱼幼鱼促进其肠道蠕动, 改善其炎症相关的黏膜损伤(Wang et al, 2020); 枯草芽孢杆菌浸浴斑马鱼后, 改变宿主肠道微生物群, 减少潜在致病菌的丰度(Castro et al, 2023)。因此, 本研究使用球形赖氨酸芽孢杆菌, 探讨其对斑马鱼幼鱼生长、肠道菌群及代谢的影响, 为其在鱼类养殖中的应用提供一定的理论基础。
1 材料与方法 1.1 球形赖氨酸芽孢杆菌制剂的制备及添加方式实验用芽孢杆菌制剂是由本实验室从大黄鱼肠道分离获得的球形赖氨酸芽孢杆菌(Lysinibacillus sphaericus)菌株。将保存在–80 ℃冰箱的菌株进行活化培养后, 挑取单菌落放入Luria-Bertani (LB)液体培养基中, 经37 ℃、180 r/min振荡培养制得菌液。按照OD600值与细菌剂量的线性关系进行培养(吴振超, 2020), 确定浓度的菌液通过直接加入养殖水体的方式, 使养殖缸内终浓度分别达到105、107 CFU/mL。菌液的添加量要与缸内水体的容量进行换算后加入。
1.2 实验鱼的养殖与管理选取AB品系斑马鱼中生长状况良好、规格均匀的雌雄鱼, 雌鱼与雄鱼按2︰1交配产卵, 收取鱼卵当天记为第0天。培养至24 d时, 挑取270尾初体重为(0.019±0.003) g的斑马鱼, 随机均分为3组, ZF0组(对照组, 基础饲料)、ZF5组(基础饲料+105 CFU/mL球形赖氨酸芽孢杆菌)与ZF7组(基础饲料+107 CFU/mL球形赖氨酸芽孢杆菌), 每组3个平行。每日饲喂2次(09:00和15:00), 每隔48 h换去养殖缸内1/2养殖水, 进行为期33 d的饲养。饲养期间水温(27.5±1) ℃、pH为7.3~7.8、光暗周期为14 h: 10 h。
1.3 样品制备养殖实验结束后, 对实验鱼进行24 h饥饿处理。取样前用丁香酚(1︰1 000)对斑马鱼幼鱼进行麻醉, 并进行各组的称重与计数。每组取20尾鱼放置于无菌操作台中, 冰上解剖取出肠道和肝脏于无酶无菌EP管中后迅速放入液氮, 并–80 ℃保存, 用于肝脏与肠道生化指标、肠道菌群与代谢的测定。另外每组取3尾鱼放置于无菌操作台中, 取出的肠道放置装有4%多聚甲醛的离心管中固定, 便于进行后续的肠道组织学分析。
1.4 指标测定 1.4.1 生长数据处理各生长参数按下列公式计算:
 (1)
(1)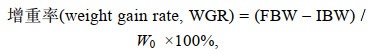 (2)
(2) (3)
(3)上述公式中, IBW、FBW分别表示实验鱼初始体重和终末体重; No、Nt分别表示养殖实验开始时网箱中鱼的尾数和养殖实验结束时网箱中鱼的尾数; t表示实验天数。
1.4.2 肝脏与肠道的生化指标肝脏抗氧化相关酶包括总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD); 肝脏免疫相关酶包括碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、谷草转氨酶(GOT)、谷丙转氨酶(GPT); 肠道消化酶包括胰蛋白酶、脂肪酶, 均使用南京建成生物工程研究所的相关试剂盒进行测定。
1.4.3 肠道组织学观察将4%多聚甲醛溶液固定的组织送往杭州厚爱生物科技有限公司进行组织切片的后续制作, 用Image-Pro Plus 6.0软件, 分别测量绒毛长度(mm)、隐窝深度(mm), 每张切片选取5根完整的绒毛, 计数每根完整绒毛上的杯状细胞。
1.4.4 肠道菌群的测序将–80 ℃保存的肠道送去上海元莘生物公司进行肠道菌群的测序, 包括样品的DNA提取、测序建库与多样性分析。首先通过Illumina Novaseq 6000进行测序; 其次对测序序列进行质控、聚类/去噪, 划分Feature, 并根据Feature的序列组成得到其物种分类, 从而获得各样品的物种分布图、物种聚类热图、属分类学水平系统进化发育树; 最后使用QIIME2软件进行样品的Alpha、Beta多样性分析。
1.4.5 肠道代谢物的测定将–80 ℃冰箱内保存的肠道送去上海元莘生物公司进行肠道代谢物的分析, 采用UHPLC超高效液相色谱系统(Thermo)分离后, 用Q Exactive系列质谱仪(Thermo)进行质谱分析, 检测样本中的代谢物, 通过与本地数据库中代谢物的保留时间、分子质量(误差在10 ppm内, ppm为质谱仪的精度单位part per million)、二级碎裂谱图、碰撞能等信息进行匹配, 对生物样本中的代谢物进行结构鉴定, 并对鉴定结果进行严格的人工二次核对、确认。原始数据经ProteoWizard转换成mzXML格式, 然后采用XCMS软件进行峰对齐、保留时间校正和提取峰面积。对XCMS提取得到的数据首先进行代谢物结构鉴定、数据预处理, 然后进行实验数据质量评价, 最后进行数据分析。
1.5 数据分析本实验所有数据使用Excel 2019处理并采用SPSS 26.0进行方差分析, P < 0.05表示差异显著, P > 0.05表示差异不显著, 所有数据用平均值±标准差表示。
2 实验结果 2.1 球形赖氨酸芽孢杆菌对斑马鱼幼鱼生长性能的影响由表 1可知, 各组间的终末体重、增重率、存活率和特定生长率都没有显著性差异(P > 0.05), 但ZF7组的终末体重和增重率相对ZF0组有所升高。
| 项目 | 组别 | P值 | ||
| ZF0 | ZF5 | ZF7 | ||
| 存活率 Survival/% | 0.84±0.04 | 0.88±0.02 | 0.80±0.03 | 0.32 |
| 初体重 IBW/g | 0.018±0.002 | 0.022±0.001 | 0.016±0.001 | 0.25 |
| 终体重 FBW/g | 0.07±0.16 | 0.07±0.05 | 0.08±0.02 | 0.26 |
| 增重率 WGR/% | 2.27±0.18 | 2.02±0.22 | 3.01±0.39 | 0.11 |
| 特定生长率 SGR/% | 0.04±0.003 | 0.03±0.001 | 0.04±0.003 | 0.06 |
| 注: 同行数据肩标无字母或相同字母表示差异不显著(P > 0.05), 不同小写字母表示差异显著(P < 0.05)。下同 | ||||
由表 2可知, ZF5、ZF7组GPT活性相比ZF0组显著提高(P < 0.05), ZF5组AKP活性显著高于其余两组(P < 0.05); 各组间的SOD、T-AOC、GOT与ACP活性均无显著性差异(P > 0.05)。
| 项目 | 组别 | P值 | ||
| ZF0 | ZF5 | ZF7 | ||
| 超氧化物歧化酶 SOD/(U/mg prot) | 1.57±0.163 | 1.21±0.164 | 1.19±0.009 | 0.15 |
| 总抗氧化能力 T-AOC/(U/mg prot) | 0.08±0.01 | 0.11±0.04 | 0.20±0.06 | 0.22 |
| 谷丙转氨酶 GPT/(U/g prot) | 3.05b±0.94 | 13.09a±2.81 | 12.51a±2.01 | 0.02 |
| 谷草转氨酶 GOT/(U/g prot) | 1.59±0.99 | 3.04±0.98 | 0.79±0.04 | 0.22 |
| 酸性磷酸酶 ACP/(金氏单位/g prot) | 1.75±0.17 | 1.53±0.60 | 1.61±0.18 | 0.61 |
| 碱性磷酸酶 AKP/(金氏单位/g prot) | 1.24b±0.22 | 4.38a±0.15 | 0.99b±0.25 | < 0.001 |
由表 3可知, ZF7组的脂肪酶、胰蛋白酶活性显著高于ZF0组(P < 0.05); ZF7组肠道蛋白含量显著高于ZF5与对照组(P < 0.05)。
| 项目 | 组别 | P值 | ||
| ZF0 | ZF5 | ZF7 | ||
| 胰蛋白酶/(U/mL) | 2.61b±1.11 | 1.95b±0.46 | 7.18a±0.41 | 0.01 |
| 脂肪酶/(U/g prot) | 0.05b±0.011 | 0.07b±0.011 | 0.19a±0.006 | < 0.001 |
| 肠道蛋白含量/(μg/mL) | 63.32b±3.19 | 87.24ab±15.08 | 90.95a±7.41 | 0.03 |
如表 4所示, 各组之间的绒毛高度、绒毛高度/隐窝深度具有显著性差异(P < 0.05); ZF7组的隐窝深度显著低于其他两组(P < 0.05); 实验组杯状细胞的数量与对照组没有显著性的差异(P > 0.05)。
| 项目 | 组别 | P值 | ||
| ZF0 | ZF5 | ZF7 | ||
| 绒毛高度/μm | 111.48b±3.64 | 73.96c±6.73 | 161.04a±9.88 | < 0.001 |
| 隐窝深度/μm | 22.20a±1.28 | 22.48a±1.52 | 16.78b±1.25 | 0.01 |
| 绒毛高度/隐窝深度(V/C) | 5.09b±0.33 | 3.35c±0.36 | 10.01a±1.26 | < 0.001 |
| 杯状细胞数量/(个/根) | 5.20±0.80 | 4.40±0.92 | 4.40±0.748 | 0.73 |
通过单样本的多样性分析(Alpha多样性)可以反映微生物群落的丰度和多样性。反映细菌群落丰富度的Ace指数、Chao指数随着指数数值的增大, 丰富度增加。表 5可知, 对照组的丰富度(Ace、Chao)低于试验组, ZF5、ZF7组Ace指数显著高于对照组(P < 0.05); ZF7组Chao指数显著高于对照组(P < 0.05)。Simpson与Shannon指数常用于反映群落多样性, Simpson指数值越大, 群落多样性越低; Shannon指数值越大, 群落多样性越高。与对照组相比, 试验组群落丰富度显著升高(P < 0.05)。Coverage是指各样本文库的覆盖率, 其数值越高, 样本中序列被测出的概率越高, 由表 5可知, 本试验中各组Coverage指数接近于1, 表明样本中几乎所有序列都被检测到了。
| 项目 | 组别 | P值 | ||
| ZF0 | ZF5 | ZF7 | ||
| Ace 指数 | 108.33b±22.42 | 192.33a±3.18 | 210.67a±15.76 | 0.008 |
| Chao 指数 | 101.00b±19.22 | 188.33ab±1.20 | 207.33a±13.91 | 0.03 |
| Coverage 指数 | 0.999 8±0.000 05 | 0.999 5±0.000 09 | 0.999 7±0.000 1 | 0.14 |
| Shannon 指数 | 1.56b±0.02 | 2.99a±0.03 | 3.02a±0.04 | < 0.001 |
| Simpson 指数 | 0.268a±0.005 | 0.095b±0.005 | 0.099b±0.002 | < 0.001 |
如图 1所示, 在第一主成分(PC1, 83.39%)对照组与试验组相距较远, 且试验组样品分布较紧密; 对照组在第二主成分(PC2, 8.34%)跨度较大, 但试验组仍保持紧密分布。根据图 2可以看出对照组与试验组距离较远, 各组之间都有较好重复性。
 |
| 图 1 主成分分析图 Fig. 1 Principal Component Analysis |
 |
| 图 2 聚类树状图 Fig. 2 Clustering tree diagram |
为了清晰地看到斑马鱼的肠道菌群组成, 运用统计学方法计算各样品的群落组成, 主要分析门水平和属水平的微生物种群类别。由图 3a所示, 门水平上, 斑马鱼肠道微生物主要由变形菌门(Proteobacteria)、梭杆菌门(Fusobacteriota)和放线菌门(Actinobacteriota)组成, Others由物种丰度低于1%的各门类组成。对照组与各试验组的优势菌门都是变形菌门, 试验组中放线菌门的丰度显著提高。
 |
| 图 3 群落结构组分图 Fig. 3 Map of community structure components 注: a. 基于门水平的物种分布图; b. 基于属水平的物种分布图 |
基于属水平的肠道菌群组成(图 3b)所示, 对照组优势菌属为鲸杆菌属(Cetobacterium), 其中还含有大量的邻单胞属(Plesiomonas)。试验组优势菌群仍为鲸杆菌属, 但戈登氏菌(Gordonia)、细杆菌属(Microbacterium)、副球菌属(Paracoccus)等有益菌属有所增加, 且邻单胞属大幅减少, ZF7组气单胞属含量在菌群组成中也显著降低。
2.6 球形赖氨酸芽孢杆菌对斑马鱼幼鱼肠道代谢物的影响 2.6.1 单变量统计分析单变量统计方法通过变异倍数分析与T检验/非参数检验对两组样本进行差异分析。火山图横坐标代表该组对比物质的差异表达倍数(Flod Change)log2的对数值, 纵坐标代表T检验P值的-lg的对数值。图中红色表示显著上调的差异代谢物(FC > 1.5, P < 0.05), 蓝色表示显著下调的差异代谢物(FC < 0.67, P < 0.05)。黑色表示不显著的差异代谢物(P > 0.05)。ZF0与ZF5两组共检测到270个差异代谢物, 相比ZF0组, ZF5组显著上调172个差异代谢物, 显著下调98个差异代谢物(图 4a)。ZF0与ZF7两组共检测到183个差异代谢物, 相比ZF0组, ZF7组显著上调110个差异代谢物, 显著下调73个差异代谢物(图 4b)。ZF7与ZF5两组共检测到231个差异代谢物, 相比ZF5组, ZF7组显著上调67个差异代谢物, 显著下调164个差异代谢物(图 4c)。
 |
| 图 4 组间差异代谢物表达火山图 Fig. 4 Volcanic plot of differential metabolite between control and treatment groups 注: a. ZF5 vs. ZF0的火山图; b. ZF7 vs. ZF0的火山图; c. ZF7 vs. ZF5的火山图 |
OPLS-DA模型得到的变量权重值(variable importance for the projection, VIP)能够用于衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力, 通常VIP > 1的代谢物被认为在模型解释中具有显著贡献。以OPLS-DA VIP > 1和P < 0.05为标准筛选显著性差异代谢物。基于筛选结果, 我们列出了ZF5和ZF7组中显著上调和下调的前5位差异表达代谢物(表 6)。ZF5和ZF7处理组共同上调的差异代谢物有Lipoxin a4、Prostaglandin g2和11-dehydrothromboxane b2, 共同下调的差异代谢物有5'-phosphoribosyl-5-amino-4-imidazolecarboxamide (aicar)。与ZF5相比, ZF7显著上调的前两位差异代谢物是Sulfobacin b、5-Hydroxytryptophan; 显著下调的前两位差异代谢物是11-dehydrothromboxane b2和Prostaglandin i2。
| 代谢物名称 | 变量投影重要度 | 差异倍数 | P值 |
| ZF5 vs. ZF0 | |||
| Up-regulated | |||
| Acadesine (drug) | 1.35 | 182.29 | < 0.001 |
| Lipoxin a4 | 4.76 | 86.03 | < 0.001 |
| Prostaglandin f2.beta. | 2.11 | 70.83 | < 0.001 |
| 11-dehydrothromboxane b2 | 3.15 | 53.20 | 0.003 |
| Prostaglandin g2 | 1.55 | 49.79 | < 0.001 |
| Down-regulated | |||
| 5'-phosphoribosyl-5-amino-4-imidazolecarboxamide (aicar) | 1.42 | 0.09 | < 0.001 |
| Phenylpyruvate | 8.21 | 0.14 | < 0.001 |
| Hetisine | 2.77 | 0.17 | < 0.001 |
| 5-Hydroxytryptophan | 4.81 | 0.18 | < 0.001 |
| 7-ethyl-10-(4-n-aminopentanoic acid)-1-piperidino)carbonyloxycamptotheci n | 1.63 | 0.20 | < 0.001 |
| ZF7 vs. ZF0 | |||
| Up-regulated | |||
| 2'-Deoxy-D-ribose | 12.70 | 584.79 | < 0.001 |
| Prostaglandin i2 | 1.36 | 21.43 | 0.03 |
| Lipoxin a4 | 1.97 | 11.32 | < 0.001 |
| Prostaglandin g2 | 1.01 | 9.32 | < 0.001 |
| 11-dehydrothromboxane b2 | 1.00 | 5.01 | 0.033 |
| Down-regulated | |||
| Cetirizine | 1.02 | 0.09 | < 0.001 |
| N-tris(hydroxymethyl)methyl-2-aminoethanesulfonic acid | 2.70 | 0.20 | < 0.001 |
| 5'-phosphoribosyl-5-amino-4-imidazolecarboxamide (aicar) | 1.70 | 0.21 | < 0.001 |
| (z)-9, 12, 13-trihydroxyoctadec-15-enoic acid | 2.51 | 0.29 | < 0.001 |
| D-turanose | 2.05 | 0.31 | 0.003 |
| ZF7 vs. ZF5 | |||
| Up-regulated | |||
| Sulfobacin b | 2.38 | 6.17 | 0.02 |
| 5-Hydroxytryptophan | 4.06 | 4.05 | < 0.001 |
| Val-Ile | 8.74 | 3.73 | < 0.001 |
| Ng, ng-dimethyl-l-arginine | 11.7 | 3.48 | < 0.001 |
| Leu-Leu | 8.96 | 3.46 | < 0.001 |
| Down-regulated | |||
| 11-dehydrothromboxane b2 | 3.30 | 0.09 | 0.005 |
| Prostaglandin i2 | 3.45 | 0.11 | 0.01 |
| 13-cis-retinoic acid | 1.75 | 0.13 | < 0.001 |
| Prostaglandin f2.beta. | 2.17 | 0.14 | < 0.001 |
| Sepiapterin | 11.1 | 0.16 | < 0.001 |
KEGG通路富集分析是以KEGG通路为单位, 通过计算各个通路代谢物富集度的显著性水平, 从而确定受到显著影响的代谢和信号转导途径。P值越小, 则该代谢通路的差异性越显著。图 5所示, ABC转运蛋白(ABC transporters)、神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)和丙氨酸、天冬氨酸和谷氨酸(alanine, aspartate and glutamate metabolism)通路中包含的差异表达代谢物数目较多且富集程度极显著, 氨基酸的生物合成(biosynthesis of amino acids)通路中包含的差异表达代谢物数目较多, 富集程度较显著。
 |
| 图 5 KEGG富集通路图 Fig. 5 KEGG enrichment pathway diagram 注: 气泡图中每一个气泡代表一个代谢通路(根据P value选择显著性最高的前20条), 气泡所在横坐标和气泡大小表示该通路在拓扑分析中的影响因子大小, 大小越大影响因子越大; 气泡所在纵坐标和气泡颜色表示富集分析的P值(取负常用对数, 即-lg P-value), 颜色越深P值越小, 富集程度越显著 |
益生菌在水产养殖中应用广泛, 常通过向饲料或养殖水体中添加益生菌制剂的方法来探究益生菌对于水产养殖动物生长性能的影响(Li et al, 2019; Sumon et al, 2022)。大量研究表明, 益生菌对水产养殖动物生长性能有促进作用, 如在Padeniya等(2022)的研究中发现, 益生菌浸浴斑马鱼幼鱼后加快其对卵黄的吸收, 增强其生长性能。Snega Priya等(2021)的实验结果表明, 饲喂添加枯草芽孢杆菌的饲粮可以提高斑马鱼幼鱼的生长性能, 饲粮中添加枯草芽孢杆菌和榴莲皮PG混合补充剂具有更高的效益。本试验结果表明, ZF5和ZF7组虽然没有显著增强斑马鱼幼鱼的生长性能, 但实验组末体重相比对照组有所提高, ZF7组的WGR相比ZF0也有所提高, 总的来说, 添加球形赖氨酸芽孢杆菌后鱼体终末体重与增重率有上升趋势。本试验结果与上述研究结果相似, 表明球形赖氨酸芽孢杆菌可以改善斑马鱼幼鱼的生长状况, 具体的作用效果还要根据益生菌的种类、剂量与补充持续时间而定。
3.2 球形赖氨酸芽孢杆菌对斑马鱼幼鱼肝脏抗氧化免疫指标的影响抗氧化酶的调节是改善宿主机体防御机制所必需的(Midhun et al, 2019b)。机体的健康状况主要取决于活性氧(ROS)的代谢和免疫系统的功能。ROS代谢涉及SOD、GPx、GR和CAT等酶, 它们是调节自由基发生和保护机体免受氧化应激的第一道防线(Ramos et al, 2015)。在Giri等(2013)的研究中, 用含植物乳杆菌的饲料饲喂露斯塔野鲮(Labeo rohita)养殖30 d后SOD活性没有得到显著性改善, 养殖60 d后108 CFU/g处理组的SOD活性显著增强, 这表明饲料中添加菌液浓度的高低与养殖周期的长短都会得到不同的养殖效益。本研究中, 处理组SOD活性相比于对照组没有显著性差异, 推测可能由于养殖周期问题, 球形赖氨酸芽孢杆菌在斑马鱼体内还没有激发免疫组织增强其抗氧化作用。谷丙转氨酶(GPT)和谷草转氨酶(GOT)是肝脏内活性较高的2种转氨酶, 主要参与机体的转氨基作用, 当机体GPT和GOT活性较高时, 转氨作用相应增强, 容易进行联合脱氨作用, 增强氨基酸氧化分解从而减少氨基酸代谢产物对机体的毒害, 保持机体稳定(刘盼等, 2022)。本试验中, ZF5、ZF7组GPT活性显著高于对照组(P < 0.05), 表明添加球形赖氨酸芽孢杆菌后对斑马鱼机体具有保护作用。碱性磷酸酶(AKP)主要存在于肝脏与肠上皮, 是鱼体内巨噬细胞溶酶体的标志酶, 主要参与磷酸基团的转移和代谢(郭文静, 2020)。本试验中, 与其他两组相比ZF5处理组的AKP活性显著升高(P < 0.05)。Wang等(2021)饲喂乳酸乳球菌Z-2后, 显著增加鲤鱼(Cyprinus carpio)体内的AKP活性, 与本试验结果相同。试验表明添加球形赖氨酸芽孢杆菌能够增强斑马鱼幼鱼机体的免疫能力。
3.3 球形赖氨酸芽孢杆菌对斑马鱼幼鱼肠道消化酶的影响肠道是鱼类主要的消化器官, 肠道中的各种消化酶对蛋白质、脂质、碳水化合物等重要营养物质的消化吸收起主要作用(Giri et al, 2013)。芽孢杆菌作用机制之一是能够产生多种降解有机物的酶类(于瑞河, 2020)。当饲料中添加的益生菌在肠道成功定植后可产生细胞外酶, 从而促进营养物质的消耗与吸收(Nedaei et al, 2019)。大量研究表明, 添加益生菌有助于鱼类肠道消化酶的提高。例如, 添加不同剂型的乳酸乳球菌提高了鲤鱼肠道消化酶活性(淀粉酶、脂肪酶和蛋白酶) (Wang et al, 2021)。与对照组相比, 饲喂含有宿主相关益生菌乳酸菌(HAP)饲料的拟鲤(Rutilus rutilus caspicus)幼鱼体内淀粉酶、脂肪酶和蛋白酶活性显著提高(Tarkhani et al, 2020)。本研究中, ZF7组脂肪酶、胰蛋白酶显著高于其他两组(P < 0.05), 表明球形赖氨酸芽孢杆菌对提高斑马鱼肠道消化酶活性有积极的作用。消化酶是鱼类对营养物质消化能力的重要指标(胡亚军等, 2016)。使用益生菌多黏类芽孢杆菌HGA4C可以通过增加尼罗罗非鱼(Oreochromis niloticus)的脂肪酶、淀粉酶和蛋白酶来提高鱼的消化能力(Midhun et al, 2019a)。本研究中, ZF7组消化酶活性显著提高增强了斑马鱼幼鱼肠道的消化能力, 这与ZF7组的绒毛高度与v/c显著增高相呼应, 表明球形赖氨酸芽孢杆菌有助于鱼类肠道的消化吸收。
3.4 球形赖氨酸芽孢杆菌对斑马鱼幼鱼肠道组织的影响鱼类肠道不仅是消化吸收的重要场所, 具有容纳和运输、消化食物、吸收营养的功能, 还是具有生物、物理、化学、免疫屏障等多功能的免疫器官(涂永锋等, 2004)。肠道结构功能的完整对鱼类的生长和消化吸收至关重要(王颖, 2022)。对肠道进行组织观察可进一步了解鱼类对食物消化吸收的能力(刘君恒等, 2021)。绒毛高度是判断肠道消化吸收能力的重要指标, 且绒毛高度与肠道的吸收能力呈正相关(王子旭等, 2003)。隐窝深度的深浅可以体现出肠道的发育情况, 隐窝深度变浅, 肠道的消化吸收能力增强(欧红霞等, 2020)。绒毛高度与隐窝深度的比值则是肠道综合功能的评价指标, 体现为比值上升, 肠道黏膜消化吸收功能增强, 机体生长加快; 反之, 比值降低, 肠黏膜出现破损, 其消化吸收能力减弱, 机体表现出生长缓慢(徐光科, 2007)。绒毛长度越长, 隐窝深度越浅, V/C值越大, 肠道吸收营养的能力越强。本研究中, ZF7组的绒毛高度与v/c显著高于其他两组(P < 0.05); ZF7组的隐窝深度显著低于对照组与ZF5组(P < 0.05), 这与杨智仁等(2023)的结果一致, 表明添加球形赖氨酸芽孢杆菌有助于肠道对营养物质的消化吸收。在斑马鱼肠道化学屏障中, 杯状细胞分泌的黏蛋白可作为润滑性黏液, 对肠道上皮细胞具有保护作用(刘娜娜等, 2015)。大鼠(哺乳动物)创伤性休克后的肠黏膜重建过程中, 有大量的杯状细胞占据肠黏膜表面并呈现分泌状态来促进重建的完成(常建星等, 2005)。本研究显示养殖水体添加球形赖氨酸芽孢杆菌后杯状细胞数量减少, 这与刘娜娜等(2015)的研究结果相一致, 说明添加益生菌后有助于提高肠道屏障的完整性, 加强肠道上皮细胞的保护作用。
3.5 球形赖氨酸芽孢杆菌对斑马鱼幼鱼肠道菌群的影响鱼类肠道菌群是一个动态的微生态系统, 养殖环境、饮食、宿主遗传等因素都会影响肠道微生物的组成(Egerton et al, 2018)。本试验通过高通量测序对斑马鱼幼鱼的肠道微生物进行分析, 从而探究养殖水体添加球形赖氨酸芽孢杆菌对斑马鱼幼鱼肠道菌群的影响。试验通过Alpha和Beta对斑马鱼幼鱼肠道菌群进行多样性分析, 结果表明, 添加球形赖氨酸芽孢杆菌后斑马鱼幼鱼肠道微生物群落的丰度与多样性都显著提高(P < 0.05), 这与林艾影(2019)的研究结果相似。在蒋广志等(2023)的研究中发现, 添加益生菌后改变了宿主肠道微生物的多样性。本试验Beta分析的PCA图可清晰地看出在试验组与对照组中斑马鱼幼鱼肠道样品的物种丰度有一定的差别, 而两试验组样本间的物种相似度较高, 这也与本试验中斑马鱼幼鱼肠道菌群组成的结果相呼应。研究表明, 斑马鱼肠道主要由变形菌门(Proteobacteria)与梭杆菌门(Fusobacteriota)组成(Roeselers et al, 2011)。在本研究中, 对照组也得出相同结果, 试验组在此基础上显著提高了放线菌门(Actinobacteriota)的丰度。与之相似的是, 汪磊(2022)使用复合益生菌饲喂眼斑双锯鱼(Amphiprion ocellaris)后提高其肠道菌群中放线菌门的丰度。放线菌门是一类具有广泛应用前景的微生物类群, 有抗菌活性(杨子文, 2018)。属水平上, 相比于对照组, 试验组肠道菌群中的物种多样性明显增加, 其中戈登氏菌属(Gordonia)、细杆菌属(Microbacterium)、赖氏菌属(Leifsonia)、副球菌属(Paracoccus)的相对丰度有所提高。Sheikhzadeh等(2017)发现戈登氏菌显著增强虹鳟(Oncorhynchus mykiss)的生长与免疫性能。细杆菌属对丰年虾的生长发育有良好的影响(Suo et al, 2017)。本研究中相比对照组, 试验组的生长与免疫能力都有所改善, 推测可能与肠道中益生菌属相对丰度提高有关。由此表明, 添加球形赖氨酸芽孢杆菌可改善斑马鱼的肠道微生物组成。但在本试验中, 球形赖氨酸芽孢杆菌所属的菌属不是优势菌属, 可能是由于肠道定植数量较少不足以显示菌株的变化, 在Zhang等(2020)的研究中使用柠檬酸杆菌作为饲料添加剂对鱼类肠道菌群进行探索也得出相同结果。综上所述, 斑马鱼养殖水体中添加球形赖氨酸芽孢杆菌可以改善其肠道微生物多样性, 调节肠道菌群。
3.6 球形赖氨酸芽孢杆菌对斑马鱼幼鱼肠道代谢的影响本研究中虽然斑马鱼肠道中有机酸及其衍生物在总代谢物中占比较大, 但脂质和类脂质分子中差异代谢物变化更为明显。Lipoxin a4 (LXA4)是肠道差异代谢物中上调最明显的, 在ZF5和ZF7组分别上调到ZF0的86和11倍。LXA4属于脂质和类脂质分子中脂肪酰类(Fatty Acyls)的类花生酸(Eicosanoids), 主要参与花生四烯酸代谢中的新陈代谢与脂质代谢。研究表明, 花生四烯酸通过抑制脂肪细胞的增殖分化和凋亡来促进脂肪的水解, 降低炎症相关化学因子(Burns et al, 2018)。Sepulcre等(2016)在斑马鱼及其他硬骨鱼中发现, 鱼体内中性粒细胞凋亡前会产生LXA4, LXA4在抑制巨噬细胞呼吸爆发的同时加强了对凋亡细胞的吞噬活性。本研究中, 添加球形赖氨酸芽孢杆菌后LXA4表达量明显上调, 从而可以降低炎性因子的表达, 这与孙学亮等(2023)用屎肠球菌对斑节对虾(Penaeus monodon)的研究结果相一致。与ZF5相比, ZF7上调最明显的代谢物是Sulfobacin b (磺脲霉素B), 上调到ZF5的6.17倍。属于脂质和类脂质分子中脂肪酰类的脂肪酰胺(Fatty amides), 在Maeda等(2010)的研究中发现, 将磺脲霉素B通过腹腔注射到lps诱导的急性炎症模型的小鼠体内, 可抑制小鼠血清TNF-α的产生, 表明磺脲霉素B是一种潜在的炎症化疗药物。其次5-Hydroxytryptophan (5-羟色氨酸)上调到ZF5的4.05倍。5-羟色氨酸(5-HTP)属于有机杂环化合物中吲哚衍生物(indoles and derivatives)的色胺衍生物(tryptamines and derivatives)。5-HTP是一种天然氨基酸(AA), 目前, 5-HTP主要从天然产品中提取, 但随着生物技术的发展, 微生物合成5-羟基色氨酸的新策略被提出。Liu等(2021)提出大肠杆菌是原核生物的模型菌株, 具有明确的遗传信息和良好的发酵条件。本研究中ZF7相比ZF5组5-HTP明显上调可能的原因是由于较高浓度的球形赖氨酸芽孢杆菌更适合5-HTP的产生。与ZF5组相比, ZF7组下调最明显的代谢物是11-dehydrothromboxane b2 (11-脱氢血栓素B2), 其次是Prostaglandin i2 (前列腺素I2), 分别下调到0.09和0.11。其同属于脂质和类脂质分子中脂肪酰类的类花生酸。11-脱氢血栓烷B2 (11-dhTXB2)是体内形成的血栓烷A2的标记化合物(Takasaki et al, 1991)。在Lukianets等(2022)的研究中发现, 人体尿液中11-dhTXB2的含量升高表明血栓素在持续产生, 造成动脉粥样硬化血栓形成从而增加心血管疾病的风险。前列腺素I 2 (PGI 2)是一种脂质介质, 对免疫细胞具有有效的抗炎作用(Norlander et al, 2021)。PGI2信号也对免疫系统产生强大的抗炎作用(Toki et al, 2013)。大量研究证明, PGI2不仅对treg的形成和发展很重要, 反过来, 在某些疾病模型中, treg又促进了PGI2的生物利用度(Tamosiuniene et al, 2018)。在Norlander等(2021)的研究中发现, PGI2信号转导可以直接或间接的促进treg的形成和treg功能, 从而治疗炎症性疾病或者自身免疫病。这可能与本试验中ZF5组的非特异性免疫酶AKP显著高于ZF7组有关。
KEGG中ABC转运蛋白通路、神经活性配体-受体通路和丙氨酸、天冬氨酸和谷氨酸通路中的差异表达代谢物数目较多且富集程度极显著。ABC转运蛋白催化ATP的水解, 将反应中释放的能量与其他细胞功能耦合, 实现肠道内各物质的输入与输出(Bieczynski et al, 2021), 这与本研究中肠道消化酶和肠道组织的结果相呼应。Xia等(2020)对罗非鱼的研究表明, 添加乳酸菌对其肠道差异代谢物的代谢途径具有显著影响, 包括ABC转运蛋白、蛋氨酸和半胱氨酸的代谢、氨基酸的生物合成、蛋白质的消化吸收、花生四烯酸的代谢等。丙氨酸、天冬氨酸和谷氨酸代谢途径是主要参与神经传递的氨基酸代谢途径, 其代谢途径是由多种代谢物变化的结果。其中γ-氨基丁酸(GABA)是中枢神经系统中主要的抑制性神经递质, 在促进摄食、调节能量代谢、参与内分泌调节和免疫防御等方面发挥着重要作用(Xie et al, 2017)。在中华绒螯蟹的日粮中添加GABA后, 影响了其摄食相关基因的表达, 促进了消化酶活性(Zhang et al, 2022)。这也与本研究中肠道消化酶显著升高的结果相一致, 其原因可能是添加球形赖氨酸芽孢杆菌后增强了丙氨酸、天冬氨酸和谷氨酸的代谢途径, 有助于其肠道消化吸收代谢物的富集, 从而增强了其消化吸收的能力。
4 结论养殖水体中添加球形赖氨酸芽孢杆菌后提高了斑马鱼幼鱼肠道微生物的多样性, 使其肠道代谢产物发生显著变化, 调节免疫能力的Lipoxin a4显著上调, 促进了斑马鱼幼鱼抗氧化和免疫能力的提升。同时ABC转运蛋白通路与丙氨酸、天冬氨酸和谷氨酸的代谢通路的富集促进了斑马鱼幼鱼肠道消化能力的提高, 有利于改善斑马鱼幼鱼的生长性能。
于瑞河, 2020. 益生菌蜡样芽孢杆菌对彭泽鲫生长、营养代谢、抗氧化性及炎症反应的影响[D]. 南昌: 南昌大学.
|
王之怡, 钱烨, 陈怡然, 等, 2020. 腐乳来源乳酸菌的分离及其对斑马鱼生长发育的影响[J]. 生物学杂志, 37(5): 76-80. |
王子旭, 佘锐萍, 陈越, 等, 2003. 日粮锌硒水平对肉鸡小肠黏膜结构的影响[J]. 中国兽医科技, (7): 18-21. |
王颖, 2022. 黄鳝肠道菌群分析及益生菌应用的研究[D]. 南昌: 江西农业大学.
|
刘君恒, 冯晓飒, 张源, 2021. 锦鲤与草金鱼杂交子代肠道形态和酶学特性[J]. 水产科学, 40(6): 905-910. |
刘盼, 杨慕, 贾成霞, 等, 2022. 恩诺沙星对西伯利亚鲟血清和肝脏中转氨酶活性的影响[J]. 水产科学, 41(2): 273-279. |
刘娜娜, 赵钰, 任真真, 等, 2015. 芽孢乳酸菌胞外产物对养殖大黄鱼贮藏的影响研究[J]. 食品科技, 40(4): 199-204. |
闫子豪, 刘洋, 李月红, 2022. 枯草芽孢杆菌对鱼类气单胞菌的拮抗作用[J]. 中国兽医杂志, 58(1): 103-105. |
孙学亮, 于宏, 张震, 等, 2023. 屎肠球菌对斑节对虾肠道代谢组学及炎性因子的影响[J]. 微生物学通报, 50(5): 1958-1972. |
杨卫, 王春苗, 张英丽, 等, 2018. 我国大黄鱼养殖产业现状及对策研究(下)[J]. 科学养鱼, 40(7): 1-3. |
杨子文, 2018. 沙特阿拉伯沙漠可培养放线菌多样性及抗菌活性的研究[D]. 广州: 中山大学.
|
杨智仁, 王兰, 谢正军, 等, 2023. 共生益生菌酵素制剂对断奶仔猪肠道形态和肠黏膜免疫能力的影响[J]. 中国畜牧杂志, 59(4): 247-251. |
吴振超, 2020. 洛氏鱥肠道产酶益生菌的筛选及其粘附特性分析[D]. 长春: 吉林农业大学.
|
汪磊, 2022. 复合益生菌对眼斑双锯鱼和锦鲤生长及免疫指标水平的影响[D]. 大连: 大连海洋大学.
|
张宇柔, 陈玉珂, 于梦楠, 等, 2022. 益生芽孢杆菌对鱼类生长与抗病力影响的研究进展[J]. 水产科学, 41(2): 325-335. |
林艾影, 2019. 两种乳酸菌对军曹鱼幼鱼生长和肠道菌群的影响[D]. 湛江: 广东海洋大学.
|
欧红霞, 王广军, 李志斐, 等, 2020. 不同饲料对大口黑鲈肠道组织结构的影响[J]. 水产科学, 39(6): 902-907. |
胡亚军, 李昭林, 田芊芊, 等, 2016. 饲料中添加复合益生菌对黄鳝生长、消化酶活性、部分血清生理生化指标以及体成分的影响[J]. 中国饲料, (17): 27-31. |
徐光科, 2007. 清凉冲剂对鸡肠黏膜结构和黏膜免疫相关细胞的影响[D]. 乌鲁木齐: 新疆农业大学.
|
郭文静, 2020. 芝麻素对氟暴露斑马鱼肝脏免疫功能的影响[D]. 太原: 山西农业大学.
|
涂永锋, 宋代军, 2004. 鱼类肠道组织结构及其功能适应性[J]. 江西饲料, (4): 16-19. |
常建星, 陈双, 蒋龙元, 等, 2005. 小肠杯状细胞在大鼠休克后肠黏膜重建中的作用[J]. 中华胃肠外科杂志, 8(6): 510-512. |
蒋广志, 戴茜茜, 陈梅香, 等, 2023. 复合益生菌对猪生长性能、腹泻率、肠道菌群及代谢物和猪舍氨气浓度的影响[J]. 动物营养学报, 35(2): 834-844. |
BIECZYNSKI F, PAINEFILÚ J C, VENTURINO A, et al, 2021. Expression and function of ABC proteins in fish intestine[J]. Frontiers in Physiology, 178: 791834. |
BURNS J L, NAKAMURA M T, MA D W L, 2018. Differentiating the biological effects of linoleic acid from arachidonic acid in health and disease[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 135: 1-4. DOI:10.1016/j.plefa.2018.05.004 |
CASTRO C G, MEIRELLES M G, AZEVEDO R, et al, 2023. Bacillus subtilis KM0 impacts gut microbiota profile and transcription of genes related to transcellular transport in zebrafish (Danio rerio)[J]. Current Microbiology, 80(5): 136. DOI:10.1007/s00284-023-03240-0 |
CHEN J M, SUN R X, PAN C G, et al, 2020. Antibiotics and food safety in aquaculture[J]. Journal of Agricultural and Food Chemistry, 68(43): 11908-11919. DOI:10.1021/acs.jafc.0c03996 |
EGERTON S, CULLOTY S, WHOOLEY J, et al, 2018. The gut microbiota of marine fish[J]. Frontiers in Microbiology, 9: 873. DOI:10.3389/fmicb.2018.00873 |
GIRI S S, SUKUMARAN V, OVIYA M, 2013. Potential probiotic Lactobacillus plantarum VSG3 improves the growth, immunity, and disease resistance of tropical freshwater fish, Labeo rohita[J]. Fish and Shellfish Immunology, 34(2): 660-666. DOI:10.1016/j.fsi.2012.12.008 |
LI Z Q, BAO N, REN T J, et al, 2019. The effect of a multi-strain probiotic on growth performance, non-specific immune response, and intestinal health of juvenile turbot, Scophthalmus maximus L.[J]. Fish Physiology and Biochemistry, 45(4): 1393-1407. DOI:10.1007/s10695-019-00635-4 |
LIU X X, ZHANG B, AI L Z, 2021. Advances in the Microbial Synthesis of 5-Hydroxytryptophan[J]. Frontiers in Bioengineering and Biotechnology, 9: 624503. DOI:10.3389/fbioe.2021.624503 |
LUKIANETS K, VASILKOVA V, PCHELIN I, et al, 2022. MO403: the association between urinary 11-dehydrothromboxane B2 and laboratory parameters in aspirin-treated patients with cardiorenal syndrome[J]. Nephrology Dialysis Transplantation, 37(S3): gfac070.017. |
MAEDA J, NISHIDA M, TAKIKAWA H, et al, 2010. Inhibitory effects of sulfobacin B on DNA polymerase and inflammation[J]. International Journal of Molecular Medicine, 26(5): 751-758. |
MIDHUN S J, ARUN D, NEETHU S, et al, 2019a. Administration of probiotic Paenibacillus polymyxa HGA4C induces morphometric, enzymatic and gene expression changes in Oreochromis niloticus[J]. Aquaculture, 508: 52-59. DOI:10.1016/j.aquaculture.2019.04.061 |
MIDHUN S J, NEETHU S, ARUN D, et al, 2019b. Dietary supplementation of Bacillus licheniformis HGA8B improves growth parameters, enzymatic profile and gene expression of Oreochromis niloticus[J]. Aquaculture, 505: 289-296. DOI:10.1016/j.aquaculture.2019.02.064 |
NEDAEI S, NOORI A, VALIPOUR A, et al, 2019. Effects of dietary galactooligosaccharide enriched commercial prebiotic on growth performance, innate immune response, stress resistance, intestinal microbiota and digestive enzyme activity in Narrow clawed crayfish (Astacus leptodactylus Eschscholtz, 1823)[J]. Aquaculture, 499: 80-89. DOI:10.1016/j.aquaculture.2018.08.076 |
NORLANDER A E, PEEBLES R S, 2021. Prostaglandin I2 and T regulatory cell function: broader impacts[J]. DNA and Cell Biology, 40(10): 1231-1234. DOI:10.1089/dna.2021.0515 |
PADENIYA U, LARSON E T, SEPTRIANI S, et al, 2022. Probiotic treatment enhances pre-feeding larval development and early survival in zebrafish Danio rerio[J]. Journal of Aquatic Animal Health, 34(1): 3-11. DOI:10.1002/aah.10148 |
QIN C B, ZHANG Z, WANG Y B, et al, 2017. EPSP of L. casei BL23 protected against the infection caused by Aeromonas veronii via enhancement of immune response in zebrafish[J]. Frontiers in Microbiology, 8: 2406. DOI:10.3389/fmicb.2017.02406 |
RAMOS M A, GONÇALVES J F M, BATISTA S, et al, 2015. Growth, immune responses and intestinal morphology of rainbow trout (Oncorhynchus mykiss) supplemented with commercial probiotics[J]. Fish & Shellfish Immunology, 45(1): 19-26. |
ROESELERS G, MITTGE E K, STEPHENS W Z, et al, 2011. Evidence for a core gut microbiota in the zebrafish[J]. ISME Journal, 5(10): 1595-608. DOI:10.1038/ismej.2011.38 |
SEPULCRE M P, MULERO V, 2016. Editorial: Fish neutrophils meet proresolving eicosanoids[J]. Journal of Leukocyte Biology, 99(2): 227-229. DOI:10.1189/jlb.3CE0715-319R |
SHEIKHZADEH N, TAHAPOUR K, NOFOUZI K, et al, 2017. Can heat‐killed Gordonia bronchialis enhance growth and immunity in rainbow trout (Oncorhynchus mykiss)?[J]. Aquaculture Nutrition, 23(4): 788-795. DOI:10.1111/anu.12445 |
SHI F, ZI Y J, LU Z J, et al, 2020. Bacillus subtilis H2 modulates immune response, fat metabolism and bacterial flora in the gut of grass carp (Ctenopharyngodon idellus)[J]. Fish & Shellfish Immunology, 106: 8-20. |
SNEGA PRIYA P, ASHWITHA A, THAMIZHARASAN K, et al, 2021. Synergistic effect of durian fruit rind polysaccharide gel encapsulated prebiotic and probiotic dietary supplements on growth performance, immune-related gene expression, and disease resistance in Zebrafish (Danio rerio)[J]. Heliyon, 7(4): e06669. DOI:10.1016/j.heliyon.2021.e06669 |
SRISAPOOME P, AREECHON N, 2017. Efficacy of viable Bacillus pumilus isolated from farmed fish on immune responses and increased disease resistance in Nile tilapia (Oreochromis niloticus): Laboratory and on-farm trials[J]. Fish & Shellfish Immunology, 67: 199-210. |
SUMON T A, HUSSAIN A, SUMON A A, et al, 2022. Functionality and prophylactic role of probiotics in shellfish aquaculture[J]. Aquaculture Reports, 25: 101220. DOI:10.1016/j.aqrep.2022.101220 |
SUO Y T, LI E C, LI T Y, et al, 2017. Response of gut health and microbiota to sulfide exposure in Pacific white shrimp Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 63: 87-96. |
TAKASAKI W, NAKAGAWA A, TANAKA Y, et al, 1991. Enzyme immunoassay of human plasma 11-dehydrothromboxane B2[J]. Thrombosis Research, 63(3): 331-341. DOI:10.1016/0049-3848(91)90136-K |
TAMOSIUNIENE R, MANOUVAKHOVA O, MESANGE P, et al, 2018. A dominant role for regulatory T cells in protecting females against pulmonary hypertension[J]. Circulation Research, 122(12): 1689-1702. DOI:10.1161/CIRCRESAHA.117.312058 |
TARKHANI R, IMANI A, HOSEINIFAR H S, et al, 2020. Comparative study of host-associated and commercial probiotic effects on serum and mucosal immune parameters, intestinal microbiota, digestive enzymes activity and growth performance of roach (Rutilus rutilus caspicus) fingerlings[J]. Fish & Shellfish Immunology, 98: 661-669. |
TOKI S, GOLENIEWSKA K, HUCKABEE M M, et al, 2013. PGI2 signaling inhibits antigen uptake and increases migration of immature dendritic cells[J]. Journal of Leukocyte Biology, 94(1): 77-88. DOI:10.1189/jlb.1112559 |
WANG T, DAI M Z, LIU F S, et al, 2020. Probiotics modulate intestinal motility and inflammation in zebrafish models[J]. Zebrafish, 17(6): 382-393. DOI:10.1089/zeb.2020.1877 |
WANG J L, FENG J C, LIU S S, et al, 2021. The probiotic properties of different preparations using Lactococcus lactis Z-2 on intestinal tract, blood and hepatopancreas in Cyprinus carpio[J]. Aquaculture, 543: 736911. DOI:10.1016/j.aquaculture.2021.736911 |
XIA Y, YU E M, LU M X, et al, 2020. Effects of probiotic supplementation on gut microbiota as well as metabolite profiles within Nile tilapia, Oreochromis niloticus[J]. Aquaculture, 527: 735428. DOI:10.1016/j.aquaculture.2020.735428 |
XIE S W, LI Y T, ZHOU W W, et al, 2017. Effect of γ-aminobutyric acid supplementation on growth performance, endocrine hormone and stress tolerance of juvenile Pacific white shrimp, Litopenaeus vannamei, fed low fishmeal diet[J]. Aquaculture Nutrition, 23(1): 54-62. DOI:10.1111/anu.12358 |
ZHANG C, WANG X D, SU R Y, et al, 2022. Dietary gamma-aminobutyric acid (GABA) supplementation increases food intake, influences the expression of feeding-related genes and improves digestion and growth of Chinese mitten crab (Eriocheir sinensis)[J]. Aquaculture, 546: 737332. DOI:10.1016/j.aquaculture.2021.737332 |
ZHANG M L, LI M, SHENG Y, et al, 2020. Citrobacter species increase energy harvest by modulating intestinal microbiota in fish: nondominant species play important functions[J]. mSystems, 5(3). |
 2024, Vol. 55
2024, Vol. 55


