中国海洋湖沼学会主办。
文章信息
- 杜倩平, 谢广婷, 钟仲轩, 张明清, 吴锦辉, 舒琥. 2024.
- DU Qian-Ping, XIE Guang-Ting, ZHONG Zhong-Xuan, ZHANG Ming-Qing, WU Jin-Hui, SHU Hu. 2024.
- 两种重要经济石斑鱼肠道微生物群落结构及代谢功能的比较分析
- COMPARISON OF INTESTINAL MICROBIAL COMMUNITY STRUCTURE AND PREDICTIVE METABOLIC FUNCTION OF TWO IMPORTANT ECONOMIC GROUPERS
- 海洋与湖沼, 55(1): 253-264
- Oceanologia et Limnologia Sinica, 55(1): 253-264.
- http://dx.doi.org/10.11693/hyhz20230900190
文章历史
-
收稿日期:2023-09-24
收修改稿日期:2023-11-25
2. 中山大学生命科学学院 广东广州 510275;
3. 广东省农业技术推广中心 广东惠州 516081
2. School of Life Sciences, Sun Yat-Sen University, Guangzhou 510275, China;
3. Guangdong Province General Station for Agriculture Technology Extension, Huizhou 516081, China
肠道微生物群落可以通过发酵宿主难以消化的食物成分、代谢多种化合物参与宿主的生长、代谢以及免疫反应等生理过程, 并能与中枢神经系统相互作用, 影响大脑功能, 是宿主体内的重要组成部分(Flint et al, 2012; Clarke et al, 2014; Liu et al, 2023)。Lee等(2022)研究发现, 提高肠道微生物来源的短链脂肪酸能够缓解老年脑卒小鼠的神经缺损与炎症。Duca等(2012)研究结果表明, 缺乏肠道微生物的无菌小鼠其瘦素和生长素释放肽水平明显降低, 即使摄入更多的热量, 仍然比对照组小鼠更瘦。在鱼类中, 肠道微生物同样与营养物质的消化、吸收以及免疫反应息息相关。Abid等(2013)揭示了肠道微生物对大西洋鲑(Salmo salar)肠黏膜细胞的保护作用: 肠道微生物可以改善肠道黏膜细胞的形态并刺激先天性免疫反应。Li等(2023)证明, 宿主遗传学与肠道微生物群落的相互作用能够改善杂交鱼(Megalobrama amblycephala ♀ × carnivorous Culter alburnus ♂)的摄食行为, 厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和绿菌门(Chloroflexi)的丰度与宿主生长水平呈正相关。因此, 对鱼类肠道微生物进行表征, 在解析其性状方面具有重要的意义。
与淡水养殖相比, 海水养殖不受土地稀缺和水资源供应不足的影响, 其在满足日益增长的食物需求方面具有巨大的潜力(Wu et al, 2021a)。自2000年起, 中国海水养殖产量稳步增长, 产值逐年提高: 2020年中国海水养殖产量达到2 135.31万t, 产值达到3 836.20亿元(农业农村部渔业渔政管理局等, 2021)。石斑鱼因其营养价值高、肉质细嫩、味道鲜美等优点深受消费者喜爱, 是重要的海水养殖鱼种。2020年, 中国石斑鱼产量为19.20万t, 相较2016年增长77.3%, 其中虎龙杂交斑(Epinephelus fuscoguttatus ♀ × E. lanceolatus ♂)占市场份额的70%以上(Yang et al, 2021)。虎龙杂交斑继承了其亲本生长速度快、抗逆性能强的优点, 并且口感极佳、经济效益高, 能够承受较高的养殖密度, 是水产养殖户和消费者的首选种类(Sun et al, 2016; Tan et al, 2019; Amoah et al, 2022)。此外, 斜带石斑鱼(E. coioides)亦是东南亚国家常见的经济养殖石斑鱼品种, 同样具有营养丰富、味道鲜美、易于饲养的特点(Bai et al, 2021; Xiao Joe et al, 2021; Lai et al, 2022)。
目前, 虎龙杂交斑和斜带石斑鱼作为具有重要经济价值的石斑鱼养殖品种, 相关研究主要集中在其营养、摄食、生长、免疫等方面, 关于其肠道微生物群落的结构与功能的比较研究暂未见报道。因此, 本研究利用16S rDNA高通量测序技术, 对虎龙杂交斑和斜带石斑鱼肠道微生物群落进行解析, 探究两种石斑鱼肠道微生物组成与功能上的差异。本研究将为石斑鱼肠道微生物与性状关联研究提供理论基础, 为选择合适的石斑鱼养殖品种提供参考, 进而提高石斑鱼养殖业的经济效益。
1 材料与方法 1.1 样品采集虎龙杂交斑[(47.47±5.92) g]和斜带石斑鱼[(43.26± 2.33) g]购自广东省海洋渔业试验中心。在解剖前, 使用250 mg/L丁香酚(生工生物, 中国)将鱼麻醉。使用75%乙醇对鱼表面消毒, 用无菌解剖工具无菌解剖, 打开腹腔, 取鱼的全肠, 去除表面附着物。随后, 将肠道置于无菌2 mL离心管中, 立即用液氮冷冻并保存于–80 ℃, 直至提取DNA。每种鱼各5个重复。
1.2 16S rDNA的提取及测序使用细菌基因组DNA提取试剂盒(诺唯赞, 中国)提取细菌基因组DNA, 利用Thermo NanoDrop One (Thermo Fisher Scientifif, USA)检测DNA的纯度与浓度。
以基因组DNA为模板, 使用带标签序列的特异引物(515 F: GTGCCAGCMGCCGCGGTAA和806R: GGAC-TACHVGGGTWTCTAAT)及TaKaRa Premix Taq® Version 2.0 (TaKaRa Biotechnology Co., China)通过PCR扩增16S rDNA V4区。
PCR反应条件如下: 94 ℃ 5 min; 94 ℃ 30 s, 52 ℃ 30 s, 72 ℃ 30 s, 30个循环; 72 ℃ 10 min。按照NEBNext® UltraTM Ⅱ DNA Library Prep Kit for Illumina® (New England Biolabs, USA)标准流程进行建库操作, 使用Illumina Nova 6000平台对构建的扩增子文库进行PE250测序(广东美格基因科技有限公司, 中国)。
1.3 生物信息学分析使用fastp (https://github.com/OpenGene/fastp)和cutadapt (https://github.com/marcelm/cutadapt/)处理Paired-end Raw Reads得到质控后的paired-end Clean Reads。利用usearch-fastq_mergepairs (http://www.drive5.com/usearch/)拼接paired-end Clean Reads以获得Raw Tags。利用fastp (https://github.com/OpenGene/fastp)对Raw Tags进行质量过滤得到Clean Tags。
使用UPARSE将相似度≥97%的Clean Tags分配到相同的操作分类单元(OTU) (Edgar, 2013)。随后, 利用usearch-sintax将每个OTU的代表序列与SILVA数据库进行比对获得物种注释信息。利用Mothur生成稀释曲线并计算Alpha多样性指数, 包括Chao1指数、Robbins指数、Shannon指数和Simpson指数。采用Kruskal-Wilcox检验计算各组间Alpha多样性指数的显著性差异。Beta多样性使用非度量多维尺度分析(NMDS)进行可视化(Cui et al, 2018)。采用线性判别分析(LDA)差异大小(LEfSe)法(http://huttenhower.sph.harvard.edu/lefse)对虎龙杂交斑和斜带石斑鱼肠道微生物进行鉴定, 以揭示标志微生物。LEfSe方法使用Kruskal-Wallis秩和检验检测各组的显著性差异丰度特征, 并使用归一化的相对丰度矩阵进行LDA以估计每个特征。饼图及百分比堆积图使用Origin 2018 (OriginLab, USA)进行绘制。
1.4 网络分析及功能预测采用网络分析评价肠道中微生物群落之间的相互作用(Zhou et al, 2021)。基于细菌类群间的Spearman相关系数, 建立了微生物群落的相关性网络, 构建网络的标准为r > 0.6和p < 0.05。使用Gephi软件进行网络可视化。
采用基于未观察状态重建的群落系统发育研究(PICRUSt)预测微生物群落的功能。对16S rRNA基因拷贝数进行归一化后, 参考京都基因和基因组百科全书(KEGG)同源性(KO)数据库预测微生物区系功能(Ma et al, 2019)。使用主成分分析(PCA)对肠道微生物区系功能多样性进行可视化。
2 结果 2.1 16S rDNA测序数据及Alpha多样性分析通过将测序所获得的序列进行筛选和聚类, 共获得1 952个操作分类单元(OTUs)。虎龙杂交斑样品含有1 568个OTUs, 斜带石斑鱼样品含有1 283个OTUs。二者有共同899个OTUs, 虎龙杂交斑特有669个OTUs, 斜带石斑鱼特有384个OTUs (图 1a)。稀释曲线显示, 各曲线随着序列数的增加而趋于平缓, 说明测序深度足以提供样品中所有微生物的信息(图 1b)。Alpha多样性结果显示, 虎龙杂交斑肠道微生物的Chao1指数高于斜带石斑鱼, 但无显著性差异(P > 0.05), Simpson指数则显著高于斜带石斑鱼(P < 0.05); 斜带石斑鱼肠道微生物的Robbins指数、Shannon指数高于虎龙杂交斑, 差异不显著(P > 0.05, 表 1)。
 |
| 图 1 虎龙杂交斑和斜带石斑鱼肠道微生物OTU数目和稀释曲线 Fig. 1 OTU number and dilution curve of gut microbes of hybrid grouper and orange-spotted grouper 注: a. HG为虎龙杂交斑, OG为斜带石斑鱼; b. S1~S5为虎龙杂交斑, S7~S10为斜带石斑鱼 |
| 指数 | HG | OG |
| Chao1指数 | 678.56±97.62a | 599.38±101.93a |
| Robbins指数 | 0.28±0.03a | 0.29±0.04a |
| Shannon指数 | 1.50±0.59a | 1.88±0.57a |
| Simpson指数 | 0.56±0.17b | 0.35±0.11a |
| 注: 数据以mean ± SD表示, 同一行中具有不相同字母的值表示具有显著性差异(P < 0.05) | ||
在两种石斑鱼肠道中共鉴定出7个主要的门类(相对丰度 > 0.1%)和21个属类(相对丰度 > 0.1%), 优势门类为变形菌门(Proteobacteria, 68.14%)、厚壁菌门(19.18%)和梭杆菌门(Fusobacteria, 10.00%) (图 2); 优势属类为弧菌属(Vibrio, 45.26%)、罗姆布茨菌属(Romboutsia, 13.50%)和鲸杆菌属(Cetobacterium, 9.99%) (图 3)。
 |
| 图 2 石斑鱼肠道微生物在门水平的组成(相对丰度 > 0.1%) Fig. 2 Composition of gut microbes of grouper at the phylum level (relative abundance > 0.1%) |
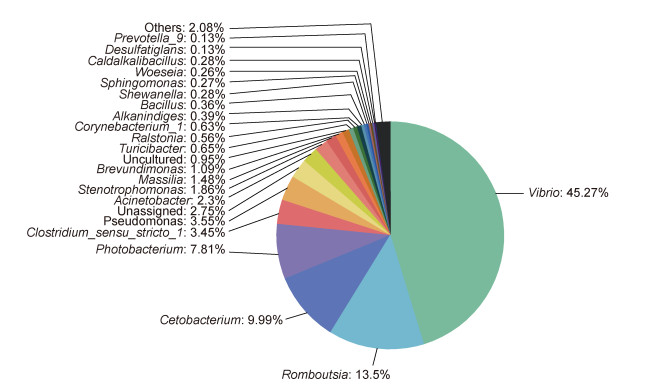 |
| 图 3 石斑鱼肠道微生物在属水平的组成(相对丰度 > 0.1%) Fig. 3 Composition of gut microbes of grouper at the the genus level (relative abundance > 0.1%) |
在虎龙杂交斑中, 变形菌门(63.89%)和厚壁菌门(32.65%)是其肠道中的优势门类, 而在斜带石斑鱼肠道中为变形菌门(73.72%)和梭杆菌门(22.72%) (图 4a)。在属类水平中, 虎龙杂交斑的优势属类为弧菌属(52.39%)、罗姆布茨菌属(24.74%)和狭义梭菌属1 (Clostridium sensu stricto 1, 5.94%), 斜带石斑鱼的优势属类为弧菌属(40.04%)、鲸杆菌属(22.71%)和发光杆菌属(Photobacterium, 15.00%) (图 4b)。
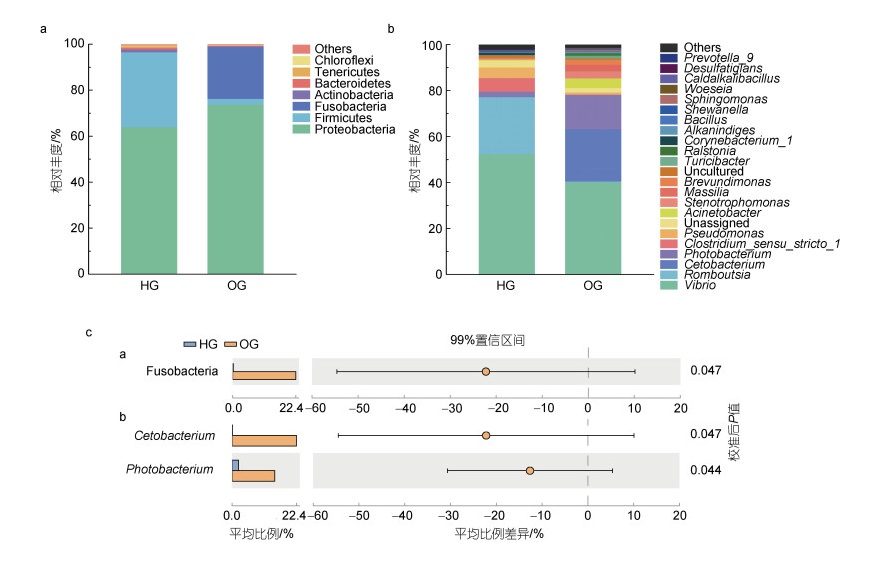 |
| 图 4 虎龙杂交斑和斜带石斑鱼的肠道微生物组成 Fig. 4 Composition of gut microbes of hybrid grouper and orange-spotted grouper 注: a. 在门水平上的群落组成(相对丰度 > 0.1%); b. 在属水平上的群落组成(相对丰度 > 0.1%); c. 存在显著性差异的门(a)和属(b) |
与虎龙杂交斑相比, 斜带石斑鱼肠道中梭杆菌门、鲸杆菌属和发光杆菌属的相对丰度显著更高(P < 0.05, 图 4c)。LEfSe分析表明, 鲸杆菌属、发光杆菌属以及丙酸菌属(Propionigenium)是斜带石斑鱼肠道中的标志微生物, 虎龙杂交斑肠道中的标志微生物为狭义梭菌属7 (Clostridium sensu stricto 7)、棒状杆菌属1 (Corynebacterium 1)和瘤胃菌属(Ruminococcaceae UCG 008)。
与斜带石斑鱼不同, 虎龙杂交斑三个标志性属类的相对丰度较低, 且其肠道内的标志微生物源自更多不同的分类分支(图 5)。此外, NMDS显示虎龙杂交斑和斜带石斑鱼肠道微生物群落基本分离(图 6)。
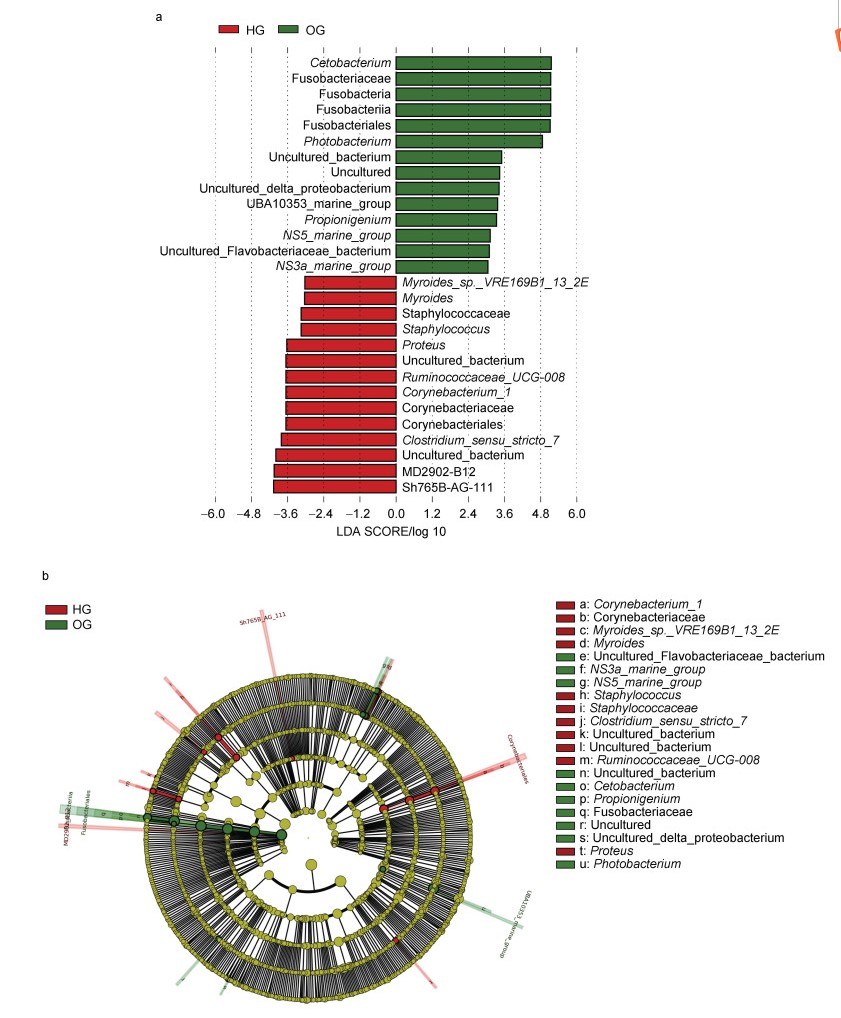 |
| 图 5 虎龙杂交斑和斜带石斑鱼的LDA得分图(a)和LEfSe分支图(b) Fig. 5 Histogram of the LDA scores (a) and the LEfSe cladogram (b) of hybrid grouper and orange-spotted grouper 注: a. 展示了具有显著性差异的微生物, LDA评分 > 3.0; b. 每个圆点与给定分类群的相对丰度相关, 黄色表示差异不显著, 红色表示虎龙杂交斑, 绿色表示斜带石斑鱼, 同心圆从外到内表示从门到种的分类水平 |
 |
| 图 6 虎龙杂交斑和斜带石斑鱼的非度量多维尺度分析 Fig. 6 Non-metric multidimensional scaling (NMDS) analysis of gut microbes of hybrid grouper and orange-spotted grouper |
采用微生物相关性网络分析, 评估肠道微生物群落的相互作用。虎龙杂交斑肠道中微生物的相互作用以一个模块为主, 而斜带石斑鱼中包含多个孤立模块(图 7a, 7b)。据图 7c、图 7d可见, 变形菌门主导着两种石斑鱼的肠道微生物网络。此外, 厚壁菌门也在虎龙杂交斑肠道微生物网络中发挥着较重要的作用(图 7c)。
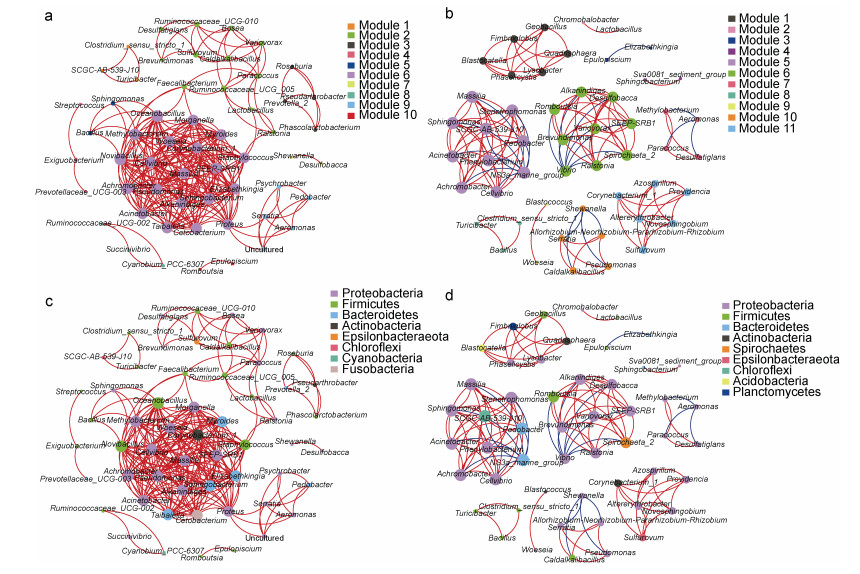 |
| 图 7 虎龙杂交斑(a、c)和斜带石斑鱼(b、d)的肠道微生物共现网络 Fig. 7 Co-occurrence network of gut microbes in hybrid grouper (a, c) and orange-spotted grouper (b, d) 注: 红线表示正相关, 蓝线表示负相关; a、b节点以模块标注, c、d节点以门标注, 每个节点的大小与其值呈正相关 |
PCA显示, 虎龙杂交斑和斜带石斑鱼肠道微生物群落的功能基本分离。PCA中, PC1占总变异的77.9%, PC2占总变异的10.7%, 两个PCA轴解释了虎龙杂交斑和斜带石斑鱼肠道微生物群落之间88%以上的总变异(图 8a)。
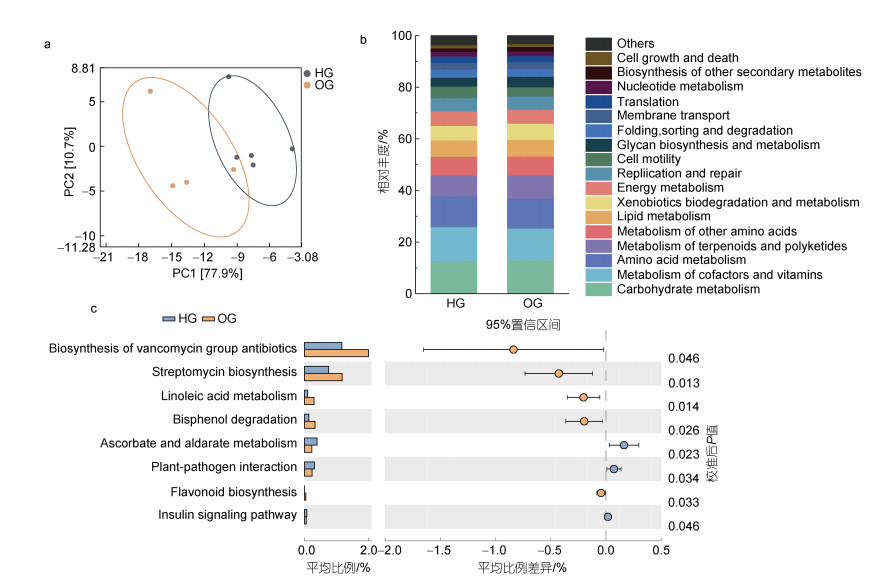 |
| 图 8 虎龙杂交斑和斜带石斑鱼肠道微生物的预测功能 Fig. 8 The predicted function of gut microbes of hybrid grouper and orange-spotted grouper 注: a. 基于KEGG 3级通路的肠道微生物功能的主成分分析(PCA); b. 基于KEGG 2级通路的肠道微生物的功能组成; c. 在KEGG 3级通路中具有显著差异的通路 |
图 8b展示了基于2级KEGG通路的微生物群落功能组成, 结果显示虎龙杂交斑和斜带石斑鱼肠道微生物群落的功能组成类似, 主要由碳水化合物、辅因子和维生素、氨基酸、萜类化合物与聚酮类化合物、其他氨基酸和脂类代谢组成, 占比将近60%。基于3级KEGG通路, 本研究发现了两种石斑鱼肠道中具有显著差异的功能通路。抗坏血酸和糖醛酸代谢、植物-病原体相互作用和胰岛素信号通路在虎龙杂交斑肠道中显著更高, 而斜带石斑鱼中以万古霉素类抗生素和链霉素的生物合成、亚油酸代谢、双酚降解和类黄酮的生物合成通路显著更高(图 8c, 表 2)。
| KEGG通路 | HG | OG | ||
| 1级通路 | 2级通路 | 3级通路 | ||
| 代谢 | 萜类化合物和聚酮酸的代谢 | 万古霉素组抗生素的生物合成 | 1.18% | 2.02% |
| 其他次级代谢物的生物合成 | 链霉素生物合成 | 0.76% | 1.19% | |
| 脂类代谢 | 亚油酸代谢 | 0.10% | 0.30% | |
| 异生素生物降解和代谢 | 双酚降解 | 0.14% | 0.34% | |
| 碳水化合物代谢 | 抗坏血酸和糖醛酸代谢 | 0.40% | 0.23% | |
| 其他次级代谢物的生物合成 | 类黄酮生物合成 | 0.02% | 0.05% | |
| 有机体系统 | 环境适应 | 植物-病原体相互作用 | 0.31% | 0.24% |
| 内分泌系统 | 胰岛素信号通路 | 0.07% | 0.06% | |
肠道微生物能够参与营养代谢并影响宿主免疫系统, 在宿主健康中发挥着重要的作用, 其组成受到环境因素、摄食和宿主遗传学的影响(O'Hara et al, 2006; Marques et al, 2010; Zhang et al, 2019; Li et al, 2023)。肠道微生物的比较分析在疾病防控(Dai et al, 2020; Wu et al, 2021b; Mondal et al, 2022)、环境适应(Lin et al, 2022)以及摄食管理(Peng et al, 2019; Salas-Leiva et al, 2020)方面具备重要意义, 相关研究在林氏异腕虾(Heterocarpus hayashi)、长鳍鰤(Seriola rivoliana)、凡纳滨对虾(Litopenaeus vannamei)、黄鳝(Monopterus albus)及克氏原螯虾(Procambarus clarkia)中均有报道, 但对石斑鱼肠道微生物群落的研究甚少。本研究对两种具有重要经济价值的养殖石斑鱼品种的肠道微生物群落进行了表征, 并对其共现模式和预测功能进行了探究。
以往许多研究表明, 变形菌门和厚壁菌门在海洋鱼类肠道微生物群落中占主导地位(Dong et al, 2020; Johny et al, 2022; Yu et al, 2022)。本研究结果显示, 石斑鱼肠道微生物群落的优势门类为变形菌门、厚壁菌门以及梭杆菌门, 与花斑刺鳃鮨(Plectropomus leopardus)、虹鳟鱼(Oncorhynchus mykiss)、军曹鱼(Rachycentron canadum)、尖吻鲈(Lates calcarifer)和布氏鲳鲹(Trachinotus blochii)的结果相一致(Michl et al, 2017; Rasheeda et al, 2017; Mekuchi et al, 2018)。但两种石斑鱼肠道的优势门丰度有所不同, 两种石斑鱼肠道中变形菌门的相对丰度最高; 其次, 在虎龙杂交斑中相对丰度较高的门是厚壁菌门(32.65%)和放线菌门(1.03%), 在斜带石斑鱼中则是梭杆菌门(22.72%)和厚壁菌门(2.49%)。两个石斑鱼品种肠道微生物群落中门水平相对丰度的差异, 表明肠道微生物群落的组成可能与宿主的遗传背景相关。Li等对四种重要经济亚洲鲤鱼的肠道微生物群落的研究揭示了亚洲鲤鱼肠道微生物群落结构的影响因素, 其研究表明, 即使不同的物种生存在同一环境中, 各物种的肠道微生物群落仍具有物种特异性(Li et al, 2018)。对匙吻鲟(Polyodon spathala)和鳙鱼(Aristichthys nobilis)的研究也得出了类似的结果, 宿主遗传背景可能是导致同一养殖环境中摄食相似的养殖物种肠道微生物群落存在差异的主要因素(Li et al, 2014)。
值得注意的是, 在属水平上, 两个石斑鱼品种均以弧菌属为相对丰度最高的属。在大西洋鳕(Gadus morhua)、凡纳滨对虾、军曹鱼和布氏鲳鲹等养殖物种中也曾观察到较高的弧菌属丰度(Reid et al, 2009; Rasheeda et al, 2017; Zoqratt et al, 2018)。弧菌属常作为具有巨大影响力的致病菌而广受关注, 副溶血性弧菌(Vibrio parahaemolyticus)、溶藻弧菌(V. alginolyticus)和哈维弧菌(V. harveyi)等常见的弧菌属致病菌可引起海洋鱼类和贝类严重疾病(Ina-Salwany et al, 2019; Triga et al, 2023)。早期的数据显示, 石斑鱼易受弧菌属感染(Ina-Salwany et al, 2019)。在本研究中, 石斑鱼肠道中含有较高丰度的弧菌属却未见疾病的发生, 可能与弧菌属致病菌的条件致病性以及弧菌属存在潜在益生菌相关(Thompson et al, 2004; Egerton et al, 2018; Zhu et al, 2023)。Ringø等已分离出能够大量产生二十碳五烯酸的海弧菌(Vibrio pelagius) (Ringø et al, 1992), Zhu等(2023)则已分离出可作为饲料添加剂增强宿主免疫能力的河流弧菌(Vibrio fluvialis) (Zhu et al, 2023)。此外, 也有研究表明, 弧菌属可以分泌淀粉酶、蛋白酶、卵磷脂酶和几丁质酶, 帮助宿主消化体内的营养物质, 如脂肪、蛋白质和碳水化合物(Hansen et al, 1999)。总而言之, 弧菌属在石斑鱼肠道中的作用机制仍有待进一步研究。
斜带石斑鱼肠道中的鲸杆菌属及发光杆菌属相对丰度较高, 与虎龙杂交斑相比差异显著, 是LEfSe证实的肠道标志微生物。已有报道显示, 鲸杆菌属具有产生维生素B12的能力, 并且对鱼类的葡萄糖稳态具有有益作用(Wang et al, 2021; Zhang et al, 2022a)。维生素B12在DNA合成与调节、神经系统功能、红细胞形成等生物过程中至关重要。发光杆菌属则与弧菌属相同, 是具有生产多不饱和脂肪酸能力的主要微生物之一(Moi et al, 2018)。虎龙杂交斑肠道中相对丰度较高的属与标志微生物不相一致, 相对丰度较高的罗姆布茨菌属可能在维持宿主肠道健康状况方面发挥关键作用(Mangifesta et al, 2018)。罗姆布茨菌属主要利用单糖和双糖形成乙酸、甲酸和乳酸, 通过上调或下调多种代谢产物以达到调控宿主免疫功能的作用(Song et al, 2022)。另一相对丰度较高的狭义梭菌属1则被认为能够抑制条件致病性埃希菌属(Escherichia)细菌(Liang et al, 2023)。
虎龙杂交斑肠道中的标志微生物棒状杆菌属1、变形杆菌属(Proteus)、葡萄球菌属(Staphylococcus)以及类香菌属(Myroides)值得关注, 人们通常将其视为致病菌(Hamilton et al, 2018; Ning et al, 2020; Beathard et al, 2021; Lisowska-Łysiak et al, 2021)。虎龙杂交斑具备的较强抗病性可能是本研究中未出现疾病或死亡的原因(Tan et al, 2018)。值得注意的是, 一些研究显示上述菌属的物种在病原菌抑制、水体净化、宿主保护等方面也存在一定的功效, 可能有助于虎龙杂交斑抗病能力的增强(Nayak et al, 2011; Hamza et al, 2018; Apines-Amar et al, 2022)。此外, 共现网络显示, 棒状杆菌属1和类香菌属是网络中主要模块的重要组成部分, 变形杆菌属及葡萄球菌属则起到连接模块的作用, 它们的生长与代谢受到其他各类微生物的影响, 这可能使其稳定在一定水平而不致引起相关疾病。因此, 该四种菌属的有益功能可能是通过连接及丰富微生物网络, 使虎龙杂交斑肠道微生物群落更加复杂, 帮助虎龙杂交斑适应更广泛的生存环境(Peng et al, 2019)。总之, 虎龙杂交斑肠道标志微生物与宿主生理之间的关系值得进一步探索。
PICRUSt通过将测序数据与参考基因组进行比较来预测微生物群落的功能潜力(Langille et al, 2013)。根据预测, 最丰富的功能类别是与碳水化合物、辅因子和维生素以及氨基酸代谢相关的功能类别, 虎龙杂交斑与斜带石斑鱼的KEGG通路存在显著差异。在虎龙杂交斑肠道中, 抗坏血酸和糖醛酸代谢与胰岛素信号通路更为丰富。抗坏血酸和糖醛酸代谢是抗氧化防御相关途径的组成部分, 参与超氧化物的清除, 有助于增强免疫系统(Bi et al, 2023)。此外, 抗坏血酸在提高存活率和生长性能方面也具有一定的作用(Liao et al, 2023)。在鱼类中, 胰岛素信号通路参与葡萄糖摄取和糖原、脂质与蛋白质的合成, 在调节细胞生长和分化方面具重要意义(Jia et al, 2022)。因此, 虎龙杂交斑肠道中上述两个通路的富集可能会进一步增强其生长表现和抗病性。不同的是, 在斜带石斑鱼中, 与亚油酸代谢、双酚降解相关的KEGG通路显著富集。亚油酸是鱼类必需的膳食营养素(Glencross, 2009), 而接触双酚化合物(BPs), 包括双酚A (BPA)、双酚AF (BPAF)、双酚F (BPF)和双酚S (BPS)等可能会对水生脊椎动物的发育、生殖和性别比例产生影响(Jiao et al, 2010; Zhang et al, 2022b; Huang et al, 2023)。值得注意的是, 在斜带石斑鱼肠道中万古霉素类抗生素和链霉素的生物合成以及类黄酮生物合成相关通路也被显著富集, 这些通路均与抗菌相关, 可能会增加肠道微生物群对病原菌的抑制能力。然而, 由于功能通路分析是根据微生物群落预测的, 因此需要进一步分析以确定肠道微生物的功能。
4 结论本研究揭示了虎龙杂交斑和斜带石斑鱼肠道微生物的组成及功能差异。在两种石斑鱼肠道中变形菌门、厚壁菌门和梭杆菌门占主导地位。在属水平, 丰度较高的鲸杆菌属和发光杆菌属是斜带石斑鱼肠道中的标志微生物, 虎龙杂交斑肠道标志微生物为相对丰度较小的棒状杆菌属1、变形杆菌属、葡萄球菌属和类香菌属, 该四种菌属的作用可能是增加肠道微生物群落的复杂性, 进而增强虎龙杂交斑的环境适应性。功能预测显示, 肠道微生物群可能与虎龙杂交斑较好的生长表现以及抗病性相关, 而斜带石斑鱼需要肠道微生物参与亚油酸代谢、双酚降解以及抗菌物质合成。总的来说, 本研究支持了肠道微生物群落结构与宿主遗传背景相关的观点, 加深了对养殖石斑鱼肠道微生物群落的认识, 为后续的宿主相关益生菌筛选、养殖品种选择提供了参考。
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2021. 2021中国渔业统计年鉴[M]. 北京: 中国农业出版社.
|
ABID A, DAVIES S J, WAINES P, et al, 2013. Dietary synbiotic application modulates Atlantic salmon (Salmo salar) intestinal microbial communities and intestinal immunity[J]. Fish & Shellfish Immunology, 35(6): 1948-1956. |
AMOAH K, DONG X H, TAN B P, et al, 2022. Ultra-performance liquid chromatography-mass spectrometry-based untargeted metabolomics reveals the key potential biomarkers for castor meal-induced enteritis in juvenile hybrid grouper (Epinephelus fuscoguttatus ♀ × E. lanceolatus ♂)[J]. Frontiers in Nutrition, 9: 847425. DOI:10.3389/fnut.2022.847425 |
APINES-AMAR M J S, CAIPANG C M A, LOPEZ J D M, et al, 2022. Proteus mirabilis (MJA 2.6S) from saline-tolerant tilapia exhibits potent antagonistic activity against Vibrio spp., enhances immunity, controls NH3 levels and improves growth and survival in juvenile giant tiger shrimp, Penaeus monodon[J]. Aquaculture Research, 53(16): 5510-5520. DOI:10.1111/are.16033 |
BAI F K, WANG X X, NIU X J, et al, 2021. Lipidomic profiling reveals the reducing lipid accumulation effect of dietary taurine in groupers (Epinephelus coioides)[J]. Frontiers in Molecular Biosciences, 8: 814318. DOI:10.3389/fmolb.2021.814318 |
BEATHARD W A, PICKERING A, JACOBS M, 2021. Myroides cellulitis and bacteremia: A case report[J]. IDCases, 24: e01061. DOI:10.1016/j.idcr.2021.e01061 |
BI B L, YUAN Y, ZHAO Y, et al, 2023. Effect of crowding stress on growth performance, the antioxidant system and humoral immunity in hybrid sturgeon[J]. Aquaculture Reports, 28: 101468. DOI:10.1016/j.aqrep.2023.101468 |
CLARKE G, STILLING R M, KENNEDY P J, et al, 2014. Minireview: Gut microbiota: the neglected endocrine organ[J]. Molecular Endocrinology, 28(8): 1221-1238. DOI:10.1210/me.2014-1108 |
CUI H, LIU L L, DAI J R, et al, 2018. Bacterial community shaped by heavy metals and contributing to health risks in cornfields[J]. Ecotoxicology and Environmental Safety, 166: 259-269. DOI:10.1016/j.ecoenv.2018.09.096 |
DAI W F, SHENG Z L, CHEN J, et al, 2020. Shrimp disease progression increases the gut bacterial network complexity and abundances of keystone taxa[J]. Aquaculture, 517: 734802. DOI:10.1016/j.aquaculture.2019.734802 |
DONG H B, SUN Y X, DUAN Y F, et al, 2020. The effect of teprenone on the intestinal morphology and microbial community of Chinese sea bass (Lateolabrax maculatus) under intermittent hypoxic stress[J]. Fish Physiology and Biochemistry, 46(5): 1873-1882. DOI:10.1007/s10695-020-00838-0 |
DUCA F A, SWARTZ T D, SAKAR Y, et al, 2012. Increased oral detection, but decreased intestinal signaling for fats in mice lacking gut microbiota[J]. PLoS One, 7(6): e39748. DOI:10.1371/journal.pone.0039748 |
EDGAR R C, 2013. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
EGERTON S, CULLOTY S, WHOOLEY J, et al, 2018. The gut microbiota of marine fish[J]. Frontiers in Microbiology, 9: 873. DOI:10.3389/fmicb.2018.00873 |
FLINT H J, SCOTT K P, LOUIS P, et al, 2012. The role of the gut microbiota in nutrition and health[J]. Nature Reviews Gastroenterology & Hepatology, 9(10): 577-589. |
GLENCROSS B D, 2009. Exploring the nutritional demand for essential fatty acids by aquaculture species[J]. Reviews in Aquaculture, 1(2): 71-124. DOI:10.1111/j.1753-5131.2009.01006.x |
HAMILTON A L, KAMM M A, NG S C, et al, 2018. Proteus spp. as putative gastrointestinal pathogens[J]. Clinical Microbiology Reviews, 31(3): e00085-17. |
HAMZA F, KUMAR A R, ZINJARDE S, 2018. Coculture induced improved production of biosurfactant by Staphylococcus lentus SZ2: Role in protecting Artemia salina against Vibrio harveyi[J]. Enzyme and Microbial Technology, 114: 33-39. DOI:10.1016/j.enzmictec.2018.03.008 |
HANSEN G H, OLAFSEN J A, 1999. Bacterial interactions in early life stages of marine cold water fish[J]. Microbial Ecology, 38(1): 1-26. DOI:10.1007/s002489900158 |
HUANG Z Y, GAO J H, CHEN Y B, et al, 2023. Toxic effects of bisphenol AF on the embryonic development of marine medaka (Oryzias melastigma)[J]. Environmental Toxicology, 38(6): 1445-1454. DOI:10.1002/tox.23779 |
INA-SALWANY M Y, AL-SAARI N, MOHAMAD A, et al, 2019. Vibriosis in fish: A review on disease development and prevention[J]. Journal of Aquatic Animal Health, 31(1): 3-22. DOI:10.1002/aah.10045 |
JIA R, WANG L, HOU Y R, et al, 2022. Effects of stocking density on the growth performance, physiological parameters, redox status and lipid metabolism of Micropterus salmoides in integrated rice-fish farming systems[J]. Antioxidants, 11(7): 1215. DOI:10.3390/antiox11071215 |
JIAO B W, CHENG C H K, 2010. Disrupting actions of Bisphenol A and malachite green on growth hormone receptor gene expression and signal transduction in seabream[J]. Fish Physiology and Biochemistry, 36(2): 251-261. DOI:10.1007/s10695-008-9227-0 |
JOHNY T K, PUTHUSSERI R M, BHAT S G, 2022. Metagenomic landscape of taxonomy, metabolic potential and resistome of Sardinella longiceps gut microbiome[J]. Archives of Microbiology, 204(1): 87. DOI:10.1007/s00203-021-02675-y |
LAI X X, ZHANG C P, WU Y X, et al, 2022. Comparative transcriptome analysis reveals physiological responses in liver tissues of Epinephelus coioides under acute hypoxia stress[J]. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 43: 101005. DOI:10.1016/j.cbd.2022.101005 |
LANGILLE M G I, ZANEVELD J, CAPORASO J G, et al, 2013. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J]. Nature Biotechnology, 31(9): 814-821. DOI:10.1038/nbt.2676 |
LEE J, D'AIGLE J, ATADJA L, et al, 2020. Gut microbiota-derived short-chain fatty acids promote poststroke recovery in aged mice[J]. Circulation Research, 127(4): 453-465. DOI:10.1161/CIRCRESAHA.119.316448 |
LI X H, YU Y H, LI C, et al, 2018. Comparative study on the gut microbiotas of four economically important Asian carp species[J]. Science China Life Sciences, 61(6): 696-705. DOI:10.1007/s11427-016-9296-5 |
LI W H, ZHOU Z X, LI H Q, et al, 2023. Successional changes of microbial communities and host-microbiota interactions contribute to dietary adaptation in allodiploid hybrid fish[J]. Microbial Ecology, 85(4): 1190-1201. DOI:10.1007/s00248-022-01993-y |
LI X M, ZHU Y J, YAN Q Y, et al, 2014. Do the intestinal microbiotas differ between paddlefish (Polyodon spathala) and bighead carp (Aristichthys nobilis) reared in the same pond?[J]. Journal of Applied Microbiology, 117(5): 1245-1252. DOI:10.1111/jam.12626 |
LIANG Y F, ZHANG H J, TIAN L, et al, 2023. Gut microbiota and metabolic profile as affected by Maillard reaction products derived from bighead carp meat hydrolysates with galactose and galacto-oligosaccharides during in vitro pig fecal fermentation[J]. Food Chemistry, 398: 133905. DOI:10.1016/j.foodchem.2022.133905 |
LIAO M Z, LIAO X Z, LONG X X, et al, 2023. Host-microbiota interactions and responses of Metapenaeus ensis infected with decapod iridescent virus 1[J]. Frontiers in Microbiology, 13: 1097931. DOI:10.3389/fmicb.2022.1097931 |
LIN G M, HUANG J R, LUO K W, et al, 2022. Bacterial, archaeal, and fungal community structure and interrelationships of deep-sea shrimp intestine and the surrounding sediment[J]. Environmental Research, 205: 112461. DOI:10.1016/j.envres.2021.112461 |
LISOWSKA-ŁYSIAK K, LAUTERBACH R, MIĘDZOBRODZKI J, et al, 2021. Epidemiology and pathogenesis of Staphylococcus bloodstream infections in humans: a Review[J]. Polish Journal of Microbiology, 70(1): 13-23. DOI:10.33073/pjm-2021-005 |
LIU L C, TONG F, LI H H, et al, 2023. Maturation, morphology, and function: The decisive role of intestinal flora on microglia: A review[J]. Journal of Integrative Neuroscience, 22(3): 70. DOI:10.31083/j.jin2203070 |
MA C, CHEN C X, JIA L, et al, 2019. Comparison of the intestinal microbiota composition and function in healthy and diseased Yunlong Grouper[J]. AMB Express, 9(1): 187. DOI:10.1186/s13568-019-0913-3 |
MANGIFESTA M, MANCABELLI L, MILANI C, et al, 2018. Mucosal microbiota of intestinal polyps reveals putative biomarkers of colorectal cancer[J]. Scientific Reports, 8(1): 13974. DOI:10.1038/s41598-018-32413-2 |
MARQUES T M, WALL R, ROSS R P, et al, 2010. Programming infant gut microbiota: influence of dietary and environmental factors[J]. Current Opinion in Biotechnology, 21(2): 149-156. DOI:10.1016/j.copbio.2010.03.020 |
MEKUCHI M, ASAKURA T, SAKATA K, et al, 2018. Intestinal microbiota composition is altered according to nutritional biorhythms in the leopard coral grouper (Plectropomus leopardus)[J]. PLoS One, 13(6): e0197256. DOI:10.1371/journal.pone.0197256 |
MICHL S C, RATTEN J M, BEYER M, et al, 2017. The malleable gut microbiome of juvenile rainbow trout (Oncorhynchus mykiss): Diet-dependent shifts of bacterial community structures[J]. PLoS One, 12(5): e0177735. DOI:10.1371/journal.pone.0177735 |
MOI I M, LEOW A T C, ALI M S M, et al, 2018. Polyunsaturated fatty acids in marine bacteria and strategies to enhance their production[J]. Applied Microbiology and Biotechnology, 102(14): 5811-5826. DOI:10.1007/s00253-018-9063-9 |
MONDAL H K, MAJI U J, MOHANTY S, et al, 2022. Alteration of gut microbiota composition and function of Indian major carp, rohu (Labeo rohita) infected with Argulus siamensis[J]. Microbial Pathogenesis, 164: 105420. DOI:10.1016/j.micpath.2022.105420 |
NAYAK S K, MUKHERJEE S C, 2011. Screening of gastrointestinal bacteria of Indian major carps for a candidate probiotic species for aquaculture practices[J]. Aquaculture Research, 42(7): 1034-1041. DOI:10.1111/j.1365-2109.2010.02686.x |
NING Y G, YANG G M, CHEN Y C, et al, 2020. Characteristics of the urinary microbiome from patients with gout: A prospective study[J]. Frontiers in Endocrinology, 11: 272. DOI:10.3389/fendo.2020.00272 |
O'HARA A M, SHANAHAN F, 2006. The gut flora as a forgotten organ[J]. EMBO Reports, 7(7): 688-693. DOI:10.1038/sj.embor.7400731 |
PENG M, XUE J J, HU Y, et al, 2019. Disturbance in the homeostasis of intestinal microbiota by a high-fat diet in the rice field eel (Monopterus albus)[J]. Aquaculture, 502: 347-355. DOI:10.1016/j.aquaculture.2018.12.062 |
RASHEEDA M K, RANGAMARAN V R, SRINIVASAN S, et al, 2017. Comparative profiling of microbial community of three economically important fishes reared in sea cages under tropical offshore environment[J]. Marine Genomics, 34: 57-65. DOI:10.1016/j.margen.2017.04.003 |
REID H I, TREASURER J W, ADAM B, et al, 2009. Analysis of bacterial populations in the gut of developing cod larvae and identification of Vibrio logei, Vibrio anguillarum and Vibrio splendidus as pathogens of cod larvae[J]. Aquaculture, 288(1/2): 36-43. |
RINGØ E, SINCLAIR P D, BIRKBECK H, et al, 1992. Production of Eicosapentaenoic Acid (20: 5 n-3) by Vibrio pelagius Isolated from Turbot (Scophthalmus maximus (L.)) Larvae[J]. Applied and Environmental Microbiology, 58(11): 3777-3778. DOI:10.1128/aem.58.11.3777-3778.1992 |
SALAS-LEIVA J, MAZÓN-SUÁSTEGUI J M, TELES A, et al, 2020. Structure and predictive metabolic contribution of intestinal microbiota of Longfin yellowtail (Seriola rivoliana) juveniles in aquaculture systems[J]. Molecular Biology Reports, 47(12): 9627-9636. DOI:10.1007/s11033-020-05970-x |
SONG B C, LI P, YAN S J, et al, 2022. Effects of dietary astragalus polysaccharide supplementation on the Th17/Treg balance and the gut microbiota of broiler chickens challenged with necrotic enteritis[J]. Frontiers in Immunology, 13: 781934. DOI:10.3389/fimmu.2022.781934 |
SUN Y, HUANG Y, HU G J, et al, 2016. Comparative transcriptomic study of muscle provides new insights into the growth superiority of a novel grouper hybrid[J]. PLoS One, 11(12): e0168802. DOI:10.1371/journal.pone.0168802 |
TAN X H, SUN Z Z, LIU Q Y, et al, 2018. Effects of dietary ginkgo biloba leaf extract on growth performance, plasma biochemical parameters, fish composition, immune responses, liver histology, and immune and apoptosis-related genes expression of hybrid grouper (Epinephelus lanceolatus ♂ × Epinephelus fuscoguttatus ♀) fed high lipid diets[J]. Fish & Shellfish Immunology, 72: 399-409. |
TAN X H, SUN Z Z, YE C X, et al, 2019. The effects of dietary Lycium barbarum extract on growth performance, liver health and immune related genes expression in hybrid grouper (Epinephelus lanceolatus♂×E. fuscoguttatus♀) fed high lipid diets[J]. Fish & Shellfish Immunology, 87: 847-852. |
THOMPSON F L, IIDA T, SWINGS J, 2004. Biodiversity of vibrios[J]. Microbiology and Molecular Biology Reviews, 68(3): 403-431. DOI:10.1128/MMBR.68.3.403-431.2004 |
TRIGA A, SMYRLI M, KATHARIOS P, 2023. Pathogenic and opportunistic Vibrio spp. associated with vibriosis incidences in the Greek Aquaculture: the role of Vibrio harveyi as the principal cause of vibriosis[J]. Microorganisms, 11(5): 1197. DOI:10.3390/microorganisms11051197 |
WANG A R, ZHANG Z, DING Q W, et al, 2021. Intestinal Cetobacterium and acetate modify glucose homeostasis via parasympathetic activation in zebrafish[J]. Gut Microbes, 13(1): 1-15. |
WU J, DEL VALLE T M, RUCKELSHAUS M, et al, 2021a. Dramatic mariculture expansion and associated driving factors in Southeastern China[J]. Landscape and Urban Planning, 214: 104190. DOI:10.1016/j.landurbplan.2021.104190 |
WU Z B, ZHANG Q Q, ZHANG T L, et al, 2021b. Association of the microbiota dysbiosis in the hepatopancreas of farmed crayfish (Procambarus clarkii) with disease outbreaks[J]. Aquaculture, 536: 736492. DOI:10.1016/j.aquaculture.2021.736492 |
XIAO JOE J T, TSENG Y C, WU J L, et al, 2021. The alteration of intestinal microbiota profile and immune response in Epinephelus coioides during pathogen infection[J]. Life (Basel), 11(2): 99. |
YANG Y, WANG T, CHEN J F, et al, 2021. First construction of interspecific backcross grouper and genome-wide identification of their genetic variants associated with early growth[J]. Aquaculture, 545: 737221. DOI:10.1016/j.aquaculture.2021.737221 |
YU C, ZHANG C, SALISU A, et al, 2022. Comparison of the intestinal bacteria between black seabass Centropristis striata reared in recirculating aquaculture system and net pen[J]. Current Microbiology, 79(4): 109. DOI:10.1007/s00284-022-02789-6 |
ZHANG Z Y, FAN Z J, YI M M, et al, 2022a. Characterization of the core gut microbiota of Nile tilapia (Oreochromis niloticus): indication of a putative novel Cetobacterium species and analysis of its potential function on nutrition[J]. Archives of Microbiology, 204(12): 690. DOI:10.1007/s00203-022-03301-1 |
ZHANG Y Y, JIANG Y N, WANG Z Y, et al, 2022b. Effects of dietary resveratrol, bile acids, allicin, betaine, and inositol on recovering the lipid metabolism disorder in the liver of rare minnow Gobiocypris rarus caused by Bisphenol A[J]. Aquaculture Nutrition, 2022: 6082343. |
ZHANG Z, ZHANG W W, HU Z G, et al, 2019. Environmental factors promote pathogen-induced skin ulceration syndrome outbreak by readjusting the hindgut microbiome of Apostichopus japonicus[J]. Aquaculture, 507: 155-163. DOI:10.1016/j.aquaculture.2019.03.054 |
ZHOU L, QU Y Y, QIN J G, et al, 2021. Deep insight into bacterial community characterization and relationship in the pond water, sediment and the gut of shrimp (Penaeus japonicus)[J]. Aquaculture, 539: 736658. DOI:10.1016/j.aquaculture.2021.736658 |
ZHU Y T, LI W, ZHANG M Q, et al, 2023. Screening of host gut-derived probiotics and effects of feeding probiotics on growth, immunity, and antioxidant enzyme activity of hybrid grouper (Epinephelus fuscoguttatus♀ × E. lanceolatus♂)[J]. Fish & Shellfish Immunology, 136: 108700. |
ZOQRATT M Z H, ENG W W H, THAI B T, et al, 2018. Microbiome analysis of Pacific white shrimp gut and rearing water from Malaysia and Vietnam: implications for aquaculture research and management[J]. PeerJ, 6: e5826. DOI:10.7717/peerj.5826 |
 2024, Vol. 55
2024, Vol. 55


