中国海洋湖沼学会主办。
文章信息
- 郭锋, 王玉霞, 董震宇, 姚荣辉, 王伟峰, 叶莹莹, 严小军, 郭宝英. 2024.
- GUO Feng, WANG Yu-Xia, DONG Zhen-Yu, YAO Rong-Hui, WANG Wei-Feng, YE Ying-Ying, YAN Xiao-Jun, GUO Bao-Ying. 2024.
- 高温胁迫下厚壳贻贝(Mytilus coruscus)消化腺代谢组学研究
- METABOLOMICS OF THE DIGESTIVE GLAND OF MYTILUS CORUSCUS UNDER HIGH-TEMPERATURE STRESS
- 海洋与湖沼, 55(1): 171-181
- Oceanologia et Limnologia Sinica, 55(1): 171-181.
- http://dx.doi.org/10.11693/hyhz20230900183
文章历史
-
收稿日期:2023-09-06
收修改稿日期:2023-10-28
2. 浙江海洋大学海洋科学与技术学院 浙江舟山 316022
2. College of Marine Science and Technology, Zhejiang Ocean University, Zhoushan 316022, China
近几十年来, 全球变暖现象持续加剧, 海水温度长期以来一直被认为是影响潮间带海洋生物生长、生存、发育和繁殖的重要非生物因素(Jansen et al, 2007; Guo et al, 2020)。潮间带贝类生活在岩石上, 活动范围有限, 而贝类作为变温动物, 适应环境温度变化的能力被认为是它们适应自然环境的主要决定因素。预计到22世纪末, 全球海洋温度将上升1~4 ℃, 可能导致贝类产生生理应激反应(Maulvault et al, 2018; Alfonso et al, 2021)。气温持续上升, 极端热浪事件频率增加(Smith et al, 2023)等全球变暖正影响着世界各地的动物群落, 而潮间带贝类对温度等环境因素的变化极为敏感(姜高伟等, 2021)。为了预测在全球气候变化背景下海洋生物的命运, 特别是对于生活在极端或温度波动环境中的生物, 需重点研究它们对栖息地的生理适应。由于气候变化, 季节性水温持续上升, 导致温度变化和极端事件变得日益频繁, 尤其是夏季温度和极端热浪事件的频率正在增加(Sokolova et al, 2012; Vasseur et al, 2014; Jacox et al, 2020), 在贻贝和藤壶等物种中观察到与热相关的大规模死亡事件, 这些物种调节体温和行为的能力有限。潮间带贝类成为适应极端温度的模式物种。对这些物种的研究可能对变温动物应对全球变暖的机制提供重要启示。因此, 由人类活动引起的气候变化正在进一步加剧全球平均温度和极端温度事件的频率, 导致生物多样性和生物地理分布的变化, 温度适应性问题变得越来越重要(Zippay et al, 2012; van de Pol et al, 2017; Zhang et al, 2020)。
代谢组研究是一种系统性的方法, 通过对生物样本中的小分子化合物进行分析和比较, 可以揭示生物体在不同生理状态下的代谢特征(Courant et al, 2014; Zhao et al, 2014)。生物代谢组学分析已被用于包括生态毒理学在内的许多领域, 用于评估暴露于不同污染物的生物体的亚致死变化, 揭示新的生态毒理学效应, 并假设暴露的生物标志物(Lankadurai et al, 2013; Serra-Compte et al, 2019)。Costa等(2008)的研究表明, 水温等环境条件的变化或贻贝的繁殖周期可能会影响它们对化学污染的反应。代谢组学分析已经被广泛应用在海洋无脊椎动物的检测中, 例如, Gui等(2016)在运用代谢组学发现绿唇贻贝(Perna canaliculus)采捕后和运输后, 贻贝血淋巴和肝胰腺中大量代谢物与对照相比存在差异。这些代谢产物一般参与能量代谢、氨基酸代谢、蛋白质降解和脂肪酸代谢等过程(Gui et al, 2016)。Yang等(2019)基于代谢组学的分析, 探究马氏珠母贝(Pinctada fucata martensii)在不同饲料喂养下代谢物的变化, 综合关键代谢途径分析表明, C45P25调节淀粉和蔗糖代谢、甘氨酸、谷氨酸代谢、天冬氨酸、丙氨酸以及丝氨酸和苏氨酸代谢, 以满足能量需求, 增加生糖氨基酸。Dumas等(2020)应用代谢组学方法揭示了地中海贻贝暴露于污水处理厂废水提取物的代谢途径, 突出的代谢物主要是氨基酸代谢(如脯氨酸、酪氨酸、亮氨酸、苯丙氨酸等)与神经激素(多巴胺和5-羟色胺代谢物)等, 还有一种成分涉及氧化应激防御(氧化谷胱甘肽) (Dumas et al, 2020)。在厚壳贻贝(Mytilus coruscus)代谢组研究方面, 范孝俊等(2023)通过开展厚壳贻贝外套膜进行急性酸性环境下的我代谢组的分析, 推测厚壳贻贝通过促进尿素合成, 增强细胞膜流动性, 并加强渗透压调节和钙离子运输等方式来应对海洋酸化威胁的代谢途径。这些代谢产物的调节可以反映能量代谢、DNA和RNA合成、免疫系统、渗透调节、足丝形成和生殖等生物过程的变化, 这些变化可能会对生物体的适应性造成一些负面影响(Götze et al, 2020; 范孝俊等, 2023)。
厚壳贻贝隶属于软体动物门(Mollusca), 双壳纲(Bivalvia), 贻贝目(Mytilida), 贻贝科(Mytilidae), 贻贝属(Mytilus), 主要分布于东亚温带海域, 包括我国东海、黄海、渤海等, 主要集中在浙江省舟山市嵊泗县养殖, 是我国具经济价值的海洋养殖贝类之一(常抗美等, 2007; 袁文斌等, 2017; 刘硕博等, 2019)。温度是影响水生动物生理过程的重要因素之一, 温度变化对软体动物生理代谢和基因表达有显著影响(姚翠鸾等, 2015; 杨东敏等, 2017; 姜高伟等, 2021; 张元等, 2022)。在全球变暖的环境下, 海洋暖化、海洋热浪事件也偶有发生, 由此造成的贝类大量死亡事件也越来越多, 给水产养殖业带来巨大损失(江天棋等, 2020)。尽管许多研究表明高温严重影响着海洋生物的各种生命过程, 但对于海洋双壳贝类如何应对热应激的研究仍然不足。基于此, 本研究选取厚壳贻贝作为研究对象, 对厚壳贻贝消化腺响应热应激的代谢途径进行研究, 为阐明厚壳贻贝消化腺应对热应激的调节机制提供一定启示, 也为其耐热品种的选育提供丰富的遗传材料和理论基础。
1 材料与方法 1.1 实验样品材料采集与处理厚壳贻贝是由中国浙江舟山市嵊泗县的养殖基地购买, 并在温度为(18±0.5) ℃的100 L充气水箱中驯化。在驯化期间, 水箱内的海水用气泵进行不间断的充气, 水箱内的海水每天更换一次, 以螺旋藻粉为饲料(1 g/m3), 定时投饲(18:30)。驯化时间为一周, 驯化期间光照与黑暗控制在12 h : 12 h, 海水盐度为25, pH 8±0.2, 溶解氧(7±0.5) mg/L。将其从温度为18 ℃的暂养水箱随机分到实验水箱中, 一共三个实验组, 分别为: 热应激组33 ℃, 缓温胁迫组26 ℃和对照组18 ℃, 温度设定是根据水产养殖经验和自然环境实际情况得出的理想温度范围(15~25 ℃, 26 ℃为缓慢应激温度)。在特别低潮期间, 水温接近于周围空气的温度。在低潮与恶劣天气条件同时出现的情况下, 贻贝栖息地的水温有可能骤升至30 ℃甚至更高。每组三个水箱, 在热应激12 h取样, 然后使用干冰将温度处理然后使用干冰将温度处理过的厚壳贻贝消化腺组织运输至华大基因完成非靶向代谢组测序。
1.2 代谢物的提取在提取厚壳贻贝消化腺组织的代谢物时, 需要进行预冷处理, 所有提取试剂将被置于–20 ℃。首先, 我们在组织样本加入标签为(L-2-氯苯丙氨酸, 浓度为0.06 mg/mL)的甲醇溶液中, 并加入比例为4︰1的甲醇与混合水溶液。然后, 使用研磨器以60 Hz的频率进行研磨处理(持续2 min), 之后将样品离心(10 000×g, 4 ℃, 持续10 min), 并取上清液进行冷冻干燥。随后, 使用甲醇与混合水溶液将冷冻干燥后的样品复溶。将复溶后的样品在–20 ℃下静置2 h, 然后再次离心(10 000×g, 4 ℃, 持续10 min), 取其上清液。为了分析提取的代谢物, 使用0.22 μm滤膜对上清液进行过滤, 然后将样品进行超高液相色谱-串联质谱分析。在分析过程中, 我们对两种不同条件下的贻贝(对照组和实验组)的消化腺组织进行了6次独立的重复实验。每一组实验代表了一次独立的实验, 共进行了6次独立的实验, 并且使用了由全样本混合制备的质控样品。
1.3 LC-MS/MS分析LC-MS/MS (液相色谱与串联质谱联用)技术是一种分析化学技术。本实验的样品分离和检测采用了UPLC串联QExactive高分辨质谱仪。仪器每10个样本穿插一个QC样本。采用LECO公司的ChromaTOF4. 33x软件和LECO-fiehnRtx5数据库进行对峰进行分析。具体的实验步骤参考Zhang等(2021)的研究方法。
1.4 数据处理与分析LC-MS/MS技术能够获得大量的质谱原始数据, 这些数据需要经过数据处理才能得到有用的信息。本实验使用了Thermo Fisher Scientific公司的Compound Discoverer 3.1软件对实验数据进行处理。在代谢物鉴定方面结合了BMDB数据库(华大代谢组数据库)、mzCloud、HMDB、ChemSpider、LipidMaps和KEGG等多个数据库进行鉴定。筛选条件为母离子的质量偏差(Precursor Mass Tolerance) < 5 ppm (Part Per Million, 质谱仪的精度单位), 碎片离子的质量偏差(Fragment Mass Tolerance) < 10 ppm, 保留时间偏差(RT Tolerance) < 0.2 min, 确保鉴定结果的准确性和可靠性。将Compound Discoverer 3.1导出的结果, 导入metaX进行数据预处理。本实验采用了log2对数转换和Pareto scaling的方法进行数据处理, 应用Pareto scaling的方法对数据进行比例调整。PCA (主成分分析)和OPLS-DA (潜在结构鉴别分析的正交投影)由SIMCA14软件包(Umetrics, Umea, 瑞典)执行。运用OPLS-DA对分组进行有效分离, 采用PCA对原始数据进行分布。本文通过构建代谢产物变化的热图, 运用直观的可视化来获取这些代谢产物的丰度(低/高)。PLS-DA模型第一主成分的VIP值(Variable Importance in the Projection, VIP > 1)被认为是筛选差异代谢物的第一参数。对剩余变量的评价采用T检验(Student’s T检验), FC (fold change)值为两组之间的差异倍数, 去掉两组之间P > 0.05的差异代谢物。研究使用KEGG数据库对差异代谢物进行信号通路的富集分析, 筛选代谢通路为显著富集的代谢通路的标准为P < 0.05。
2 结果 2.1 多元统计分析结果对所有组的消化腺组织样本进行PCA分析, 置信区间为95%。在正离子检测模式下, 研究结果表明CT-18 VS ST-26、CT-18 VS HT-33和ST-26 VS HT-33的第一主成分和第二主成分呈显著分离, 每个主成分分别解释了26.17%和17.28%、26.26%和13.73%、22.61%和18.26%的变异(图 1a); 在负离子检测模式下, 研究结果表明CT-18 VS ST-26、CT-18 VS HT-33和ST-26 VS HT-33的第一主成分和第二主成分呈显著分离, 每个主成分分别解释了27.04%和16.93%、27.25%和14.28%、23.94%和17.31%的变异(图 1b), 表明对照组和实验组样品中的代谢物存在显著变化。
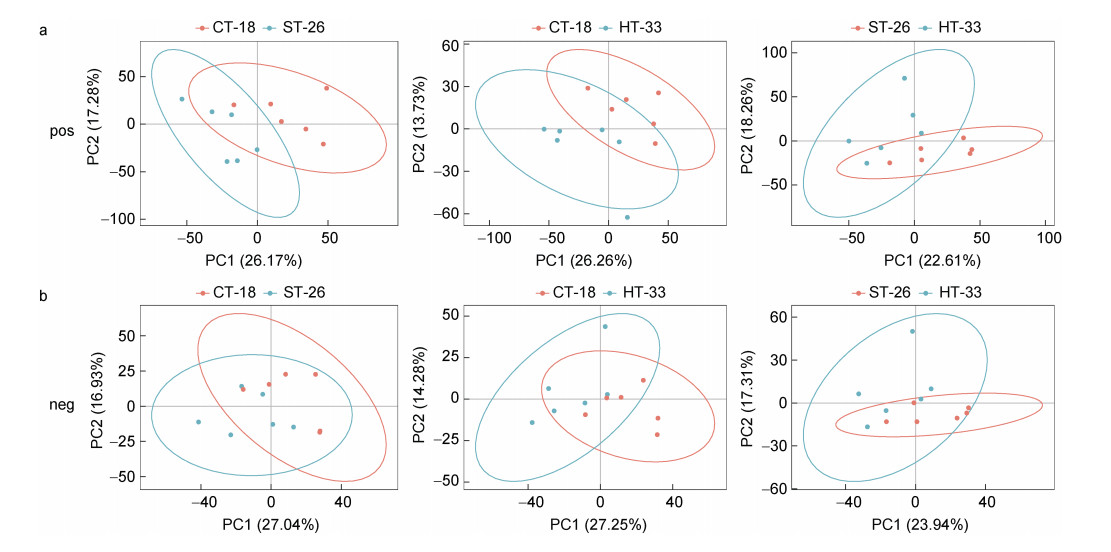 |
| 图 1 经过热胁迫处理后, 实验组和对照组厚壳贻贝消化腺组织的代谢物在正负离子模式下PCA得分图 Fig. 1 PCA score plots of metabolites from digestive gland tissues of M. coruscus in experimental and control groups in positive and negative ion mode after heat stress treatment 注: a. 不同温度组两两对比的正离子PCA评分图; b. 不同温度组两两对比的负离子PCA评分图 |
PLS-DA是一种有监督的统计方法, 它是根据样品中代谢物的表达量来进行分类预测。通过这种方法可以有效地将不同样品分到不同的组别中, 从而更好地理解样品之间的差异和分类情况。PLS-DA模型分析进一步显示, 在正负两种离子模式下, 不同的组别间均存在显著差异, 说明热应激引起了厚壳贻贝消化腺代谢表型的改变。在正离子检测和鉴定下, CT-18 VS ST-26、CT-18 VS HT-33和ST-26 VS HT-33的R2和Q2的截距值分别为0.98和–0.77, 0.98和–0.69, 0.98和–0.67 (图 2a); 在负离子检测和鉴定下, CT-18 VS ST-26、CT-18 VS HT-33和ST-26 VS HT-33的R2和Q2的截距值分别为0.98和–0.810.99和–0.74、0.98和–0.80 (图 2b), 表明模型可靠稳定, 且没有过拟合。
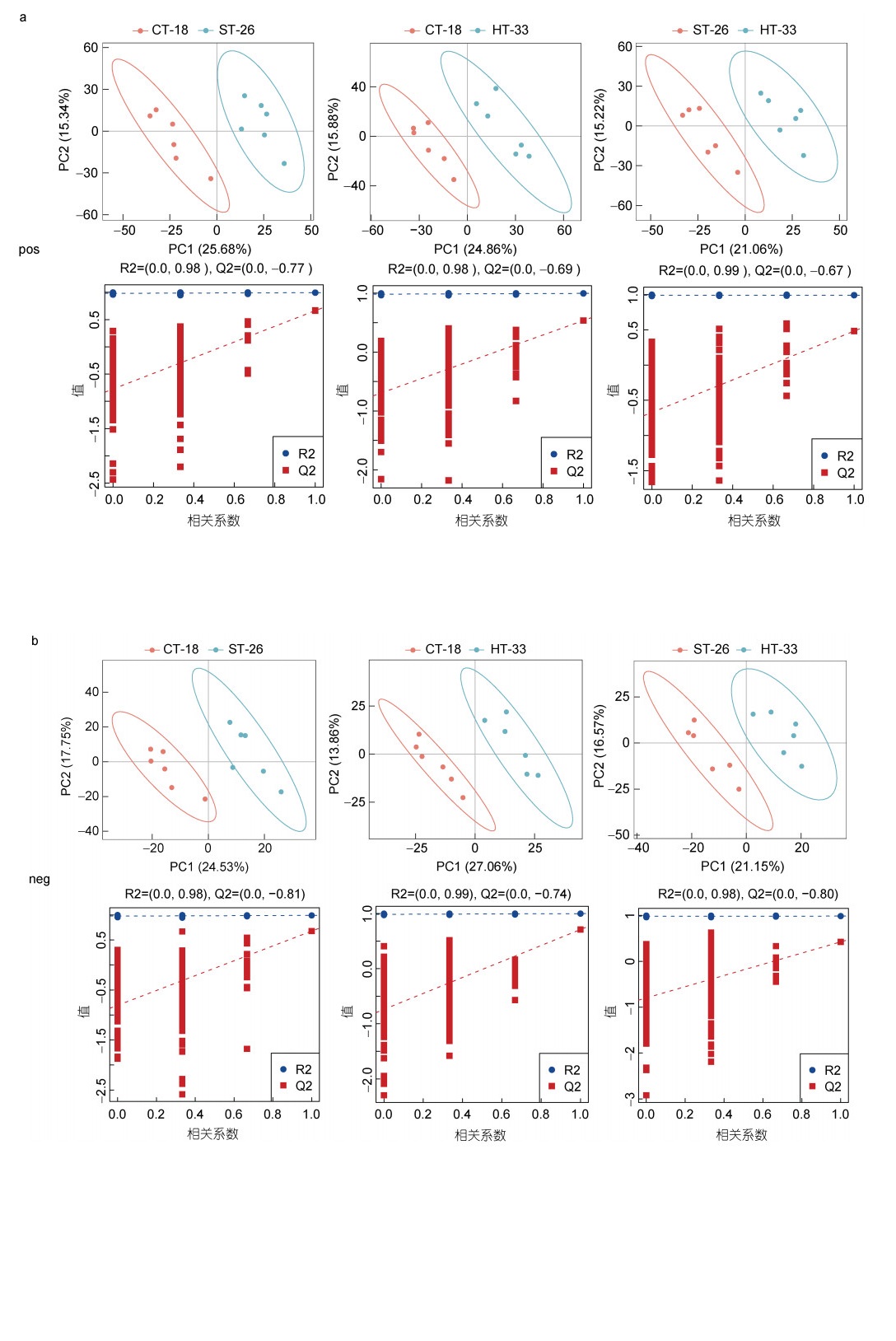 |
| 图 2 厚壳贻贝消化腺中的代谢物在正、负离子模式下对照组和实验组两两比较的PLS-DA分析模型的得分图 Fig. 2 Score plots of PLS-DA analytical model for two-by-two comparison of metabolites in digestive glands of thick-shelled mussels in positive and negative ion modes for control and experimental groups 注: CT-18表示对照组, ST-26和HT-33表示实验组; 横轴、纵轴分别为第一、第二主成分; 括号中数字表示对应主成分解释总体方差的百分比; A、B分别是正、负离子模式下对照组和实验组两两比较的PLS-DA分析模型的响应排序检验图(R2和Q2为响应排序检验时, R2和Q2回归直线Y轴的截距, 一般要求Q2小于0) |
与热刺激过实验组贻贝和对照组贻贝相比, 热刺激导致了厚壳贻贝机体内许多代谢物的改变。在正离子和负离子检测模式下, 对CT-18、ST-26、HT-33以及CT-18、HT-26、ST-26、HT-33等不同温度组合进行了代谢物分析。结果显示, 在正离子模式下, CT-18 VS ST-26产生了732种代谢物的变化; CT-18 VS HT-33有539种代谢物的变化; ST-26 VS HT-33产生了496种代谢物的变化。在负离子模式下, CT-18 VS ST-26有274种代谢物的变化, 166种减少; CT-18 VS HT-26产生了263种代谢物的变化; ST-26 VS HT-33产生了174种代谢物的变化。这些结果揭示了不同贻贝组合之间的代谢物变化情况(表 1)。因此, 该方法和结果是可靠的, 双离子模式下, 各实验组与对照组之间具有显著差异的代谢物数量如火山图所示(图 3a, 3b)。
| 状态 | 组别 | 差异代谢物总数/个 | 上调差异代谢物/个 | 下调差异代谢物/个 |
| CT-18 VS ST-26 | 732 | 342 | 390 | |
| pos | CT-18 VS HT-33 | 593 | 349 | 244 |
| ST-26 VS HT-33 | 496 | 237 | 259 | |
| CT-18 VS ST-26 | 496 | 108 | 166 | |
| neg | CT-18 VS HT-33 | 263 | 128 | 135 |
| ST-26 VS HT-33 | 174 | 88 | 86 |
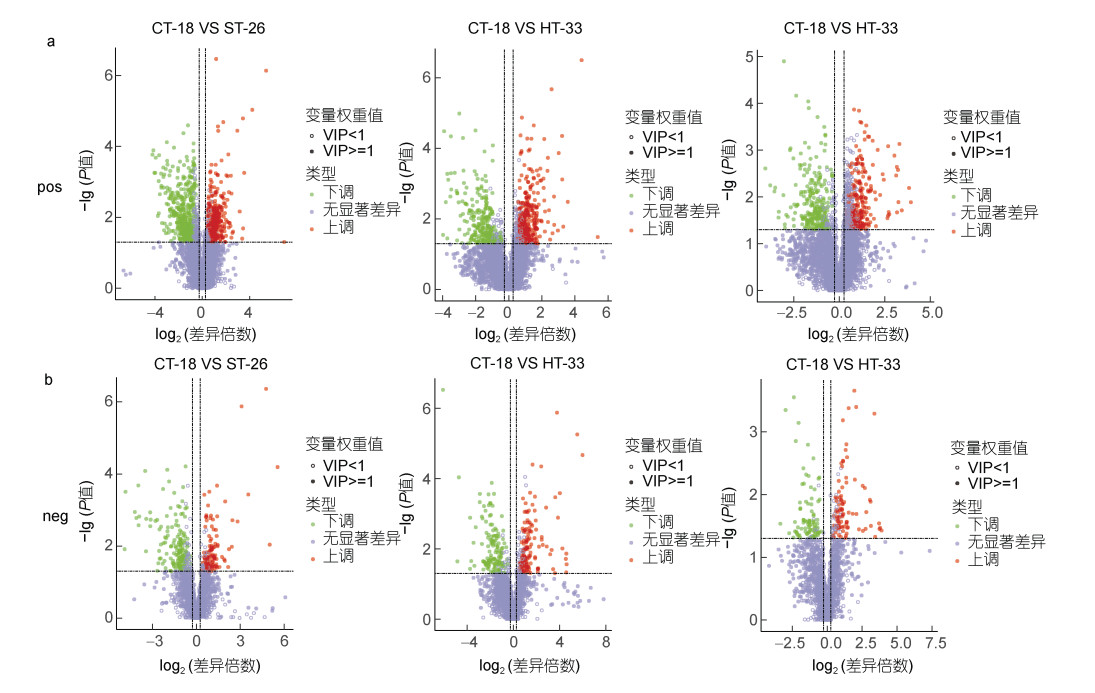 |
| 图 3 热胁迫处理后, 实验组和对照组厚壳贻贝消化腺差异代谢物火山图 Fig. 3 Volcano plot of differential metabolites in digestive glands of M. coruscus in the experimental and control groups after heat stress treatment 注: a. 正离子检测和鉴定的火山图; b. 负离子检测和鉴定的火山图。在火山图中, 每个数据点代表相应的代谢物种类, 而数据点的大小则反映了基于OPLS-DA模型计算得出的代谢物变量权重值(VIP)。根据颜色编码, 红色数据点表示具有显著上调表达的代谢物(P < 0.05), 绿色数据点表示具有显著下调表达的代谢物(P < 0.05), 而灰色数据点则代表在统计上无显著差异的代谢物(P > 0.05) |
在双离子模式下, 我们对获得的差异显著的代谢物进行了层次聚类分析, 如图 4a和图 4b所示。研究结果显示, 在对照组和实验组之间存在着代谢物含量方面的显著差异。高温胁迫处理组与对照组相比, 高温胁迫实验组聚类关联性良好。
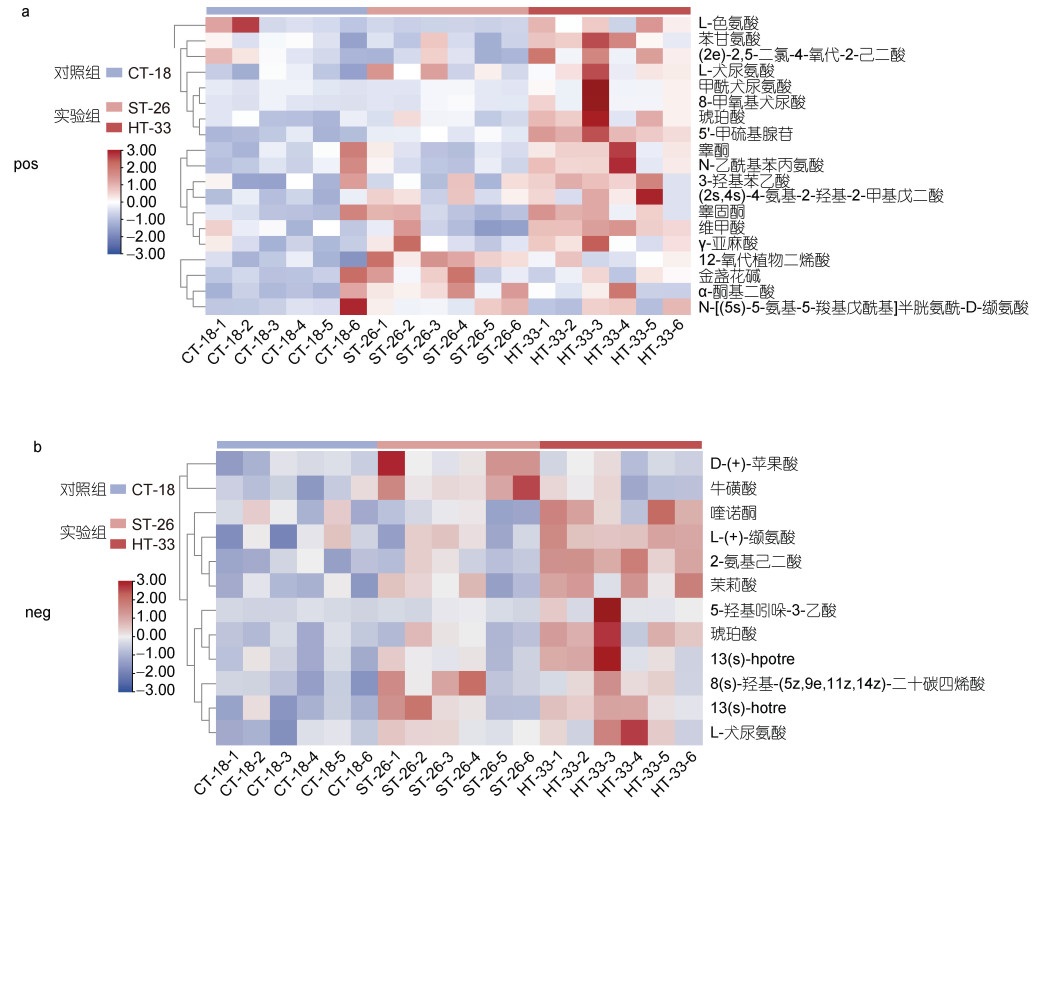 |
| 图 4 经热胁迫处理后, 厚壳贻贝消化腺的差异代谢物层次聚类热图 Fig. 4 The heat map of hierarchical clustering analysis of significantly different metabolites in outer coat membrane of M. coruscus after heat stress treatment 注: a. 正离子模式图; b. 负离子模式图; CT-18表示对照组, ST-26和HT-33表示实验组; 蓝色代表下调, 红色代表上调, 颜色表尺显示代谢物差异 |
KEGG富集分析用于探索差异代谢物的潜在代谢途径。在正离子模式下, 共发现73条信号通路, 其中有12条显著(P < 0.05)。具体来说, CT-18对比ST-26显示出鞘脂类代谢和视黄醇新陈代谢, CT-18对比HT-33中有酪氨酸、亚油酸和丙氨酸新陈代谢的变化, ST-26对比HT-33中有多个代谢通路发生变化(图 5a)。在负离子模式下, 共发现71条信号通路, 其中有17条显著(P < 0.05)。具体来看, CT-18对比ST-26表现出牛磺酸和次牛磺酸代谢、神经活性配体-受体相互作用、不饱和脂肪酸的生物合成的显著变化; CT-18对比HT-26中, 酪氨酸、色氨酸和苯丙氨酸代谢有显著差异; ST-26对比HT-33中则有咖啡因代谢等代谢通路的显著差异(图 5b)。
 |
| 图 5 经热胁迫处理后, 厚壳贻贝消化腺差异代谢物的代谢通路富集分析气泡图 Fig. 5 The bubble plot of metabolic pathway enrichment analysis of differential metabolites in digestive gland of M. coruscus after heat stress treatment 注: a. 正离子模式图, b. 负离子模式图。图中, X轴表示分组, Y轴表示显著富集的差异代谢通路; 每个圆点的大小表示该代谢通路中差异代谢物的数量, 圆点的颜色程度代表着该代谢通路的P值大小 |
在全球变暖的情况下, 不断上升的温度可能构成热应激, 进而导致生物机体做出不同的反应(Paraskevopoulou et al, 2018)。对于水生动物来说, 调节代谢水平是适应温度变化的重要机制之一。这是因为代谢水平的调节能够影响细胞产生能量和生成关键代谢物, 从而帮助维持身体内部环境的稳定状态(Liang et al, 2021)。潮间带软体动物适应温度升高的机制在水生生物研究中越来越受到关注, 其对水温的适应范围十分有限, 超过一定水温限度会对其生理功能造成紊乱, 也会导致贝类的生长代谢速率和免疫功能被抑制, 影响其生存能力和地理分布(Weigel et al, 2016)。而东海潮间带的海表温度每年变化在8~27 ℃之间(鞠霞等, 2013), 本研究在前期通过查阅相关文献资料和做与温度有关的预实验, 实验结果显示20~26 ℃比较适合厚壳贻贝生存。18 ℃是在厚壳贻贝被带进实验室时的海表温度, 因此, 18 ℃作为对照组温度。之所以选择26 ℃, 是因为其代表了厚壳贻贝在该地区夏季可能经历的最高温度。最后, 33 ℃则是该地区可能经历的极端温度(Liao et al, 2019)。
基于代谢组学研究结果发现, 在对照组和实验组之间存在着代谢物含量方面的显著差异, 这意味着不同温度对厚壳贻贝消化腺中的代谢产物具有明显的调控作用。具体来说, 经过层次聚类分析, 我们观察到代谢物在样本之间的聚类模式呈现出明确的趋势, 揭示了它们在不同条件下的表达变化。尤其值得注意的是, 与对照组相比, 高温胁迫实验组的代谢物差异聚类表现出良好的关联性, 这表明高温胁迫处理对厚壳贻贝消化腺的代谢网络产生了显著影响, 并导致了一系列代谢物水平上的变化。
KEGG富集在以下代谢通路中, 例如在ST-26 VS HT-33中发现“苯丙氨酸、酪氨酸和色氨酸生物合成(map00400)”, CT-18 VS ST-26中发现“鞘脂类代谢(map00600)”, CT-18 VS HT-33中发现“酪氨酸代谢(map00350)”。基于前期所研究转录组与代谢组学联合分析(Wang et al, 2023), 发现色氨酸代谢通路代谢物和差异基因上调明显, 这些基因参与的通路也包括能量代谢, 而TCA循环作为生物机体重要的能量代谢组成成分, 其代谢产物的高表达可能说明了热应激使厚壳贻贝消化腺具有比较强的能量代谢水平。
色氨酸是生物体的必需氨基酸, 它的功能具有多样性, 主要参与蛋白质的合成。其代谢功能具有复杂性, 能直接或间接参与多种代谢通路反应(Chen et al, 2019; Agostini et al, 2020)。厚壳贻贝的消化腺是色氨酸代谢的主要器官, 消化腺的细胞组织破损导致L-色氨酸代谢物和犬尿氨酸产物的表达量发生改变, 也可能通过色氨酸代谢调节紊乱的免疫反应, 保护消化腺组织细胞免受损伤。这种氨基酸是合成神经递质、神经调节因子5-羟色胺、褪黑激素、狗嘌呤以及相关化合物如狗嘌呤酸、喹啉酸或烟酸的前体。因此, 它在脊椎动物体内从免疫系统到神经内分泌的调节过程中都发挥着关键作用(Machado et al, 2022)。在水产养殖中, 色氨酸的作用得到了广泛的研究, 特别是在调节鱼类的行为、应激反应、抗氧化和免疫系统方面(Hoseini et al, 2019; Herrera et al, 2020)。脂质是水不溶性分子, 其中磷酸甘油酯、鞘脂和固醇是构建细胞膜的主要成分(Yang et al, 2018)。更重要的是, 脂质在能量稳态和细胞内信号转导中发挥着关键作用(Bian et al, 2021), 细胞脂质代谢与细胞凋亡密切相关(Zhang et al, 2022)。
在ST (26 ℃)组和HT (33 ℃)组中, 除其他与脂质相关的代谢过程外, 分别检测到甘油磷脂代谢和鞘脂代谢的变化。CDP-胆碱是一种热保护剂, 能对抗高温对蛋白质稳定性的影响(Chen et al, 2021)。磷脂酰胆碱和磷脂酰乙醇胺是细胞膜的重要组成部分, 受高温损伤(Nguyen et al, 2020), 而CDP-胆碱途径是合成磷脂酰胆碱的主要途径(Hörl et al, 2011)。CDP-胆碱含量的减少无疑削弱了磷脂酰胆碱(PC)的合成, 从而影响了细胞膜的稳定性。被认为是耐高温的物种之一的塔结节滨螺(Echinolittorina malaccana), 在遭受极端高温时通过增加热保护性渗透物和上调甘油磷脂代谢来适应极端高温(Chen et al, 2021), 并且珍珠贝(Pinctada maxima)的耐热性不及塔结节滨螺, 即使中等强度的高温热浪对珍珠贝也会产生显著的负面影响(Liu et al, 2023)。鞘脂是真核细胞膜的主要组成部分, 对稳定脂质双层的结构很重要。3-去氢鞘脂碱是鞘脂和鞘脂激酶1-磷酸酶的前体, 它们在细胞生长和死亡的调控中起着重要作用(León et al, 2021; Tian et al, 2022)。在不同细胞类型中, 鞘脂酰胺促进细胞死亡, 但鞘脂醇1-磷酸酶调节信号通路, 刺激细胞生长并抑制程序性细胞死亡。鞘脂酰胺和鞘脂醇1-磷酸酶之间的平衡称为鞘脂醇1-磷酸酶鞘脂醇1-磷酸酶平衡器, 并在细胞生长和死亡中保持长期平衡(Laychock et al, 2003)。3-去氢鞘脂碱的减少不能确定鞘脂酰胺鞘脂醇1-磷酸酶平衡器的平衡是否被破坏, 但我们从结果中可知, 高温胁迫对厚壳贻贝鞘脂代谢的合成、细胞生长能力和死亡调节机制产生了重大的影响。
4 结论通过厚壳贻贝热应激前后消化腺代谢组学分析, 两种离子模式下, 鉴定得到了1 821个和711个差异表达代谢物, 通过对其进行KEGG注释及富集分析, 最终确定了包括色氨酸(Tryptophol)、L-色氨酸(L-tryptophan)、L-犬尿氨酸(L-kynurenine)、8-甲氧基犬尿酸(8-methoxykynurenic acid)、5'-甲基硫腺苷(5'-methylthioadenosine)、次牛磺酸(Hypotaurine)、5-羟基吲哚-3-乙酸(5-hydroxyindole-3-acetic acid)、2-氨基己二酸(2-aminoadipic acid)和L-缬氨酸(L-(+)-valine)等差异表达的标志代谢物, 并且还显著地富集到厚壳贻贝消化腺主要通过调节色氨酸代谢、酪氨酸代谢、鞘脂代谢、代谢通路和苯丙氨酸代谢等代谢信号通路。这些研究结果提示, 热应激对厚壳贻贝的能量代谢和免疫机能产生不利影响, 影响厚壳贻贝消化腺脂肪代谢吸收从而导致消化腺功能受损。本研究在代谢水平上揭示了厚壳贻贝消化腺对热应激的适应机制, 并强调了相关差异基因和代谢物的作用, 为后续针对特定代谢通路的厚壳贻贝耐高温靶向调控研究提供了理论基础。
刘硕博, 唐祖蓉, 申望, 等, 2019. 基于F型mtDNA D-Loop的厚壳贻贝(Mytilus coruscus)群体遗传多样性研究[J]. 海洋与湖沼, 50(2): 355-364. |
江天棋, 张扬, 姜亚洲, 等, 2020. 高温胁迫对厚壳贻贝摄食、代谢和相关酶活性的影响[J]. 生态学杂志, 39(9): 3048-3056. |
杨东敏, 张艳丽, 丁鉴锋, 等, 2017. 高温、低盐对菲律宾蛤仔免疫能力的影响[J]. 大连海洋大学学报, 32(3): 302-309. |
张元, 朱战豪, 姚高友, 等, 2022. 温度和盐度对扇贝"渤海红"稚贝存活和生长的互作效应[J]. 水产科学, 41(1): 1-10. |
范孝俊, 王莹, 蔡吕萍, 等, 2023. 海水酸化对厚壳贻贝(Mytilus coruscus)外套膜代谢组的急性影响[J]. 海洋与湖沼, 54(3): 921-933. |
姜高伟, 李琪, 徐成勋, 等, 2021. 温度对长牡蛎和葡萄牙牡蛎及其杂交稚贝生长和存活的影响[J]. 中国水产科学, 28(1): 29-36. |
姚翠鸾, SOMERO G N, 2015. 海洋暖化对海洋生物的影响[J]. 科学通报, 60(9): 805-816. |
袁文斌, 李长保, 焦海峰, 等, 2017. 基于CO1基因的渔山列岛厚壳贻贝遗传资源评估[J]. 海洋科学, 41(11): 107-112. DOI:10.11759/hykx20170727001 |
常抗美, 吴剑锋, 2007. 厚壳贻贝人工繁殖技术的研究[J]. 南方水产, 3(3): 26-30. DOI:10.3969/j.issn.2095-0780.2007.03.005 |
鞠霞, 熊学军, 2013. 渤、黄、东海水温季节变化特征分析[J]. 海洋科学进展, 31(1): 55-68. DOI:10.3969/j.issn.1671-6647.2013.01.007 |
AGOSTINI A, YUCHUN D, LI B, et al, 2020. Sex-specific hippocampal metabolic signatures at the onset of systemic inflammation with lipopolysaccharide in the APPswe/ PS1dE9 mouse model of Alzheimer's disease[J]. Brain, Behavior, and Immunity, 83: 87-111. DOI:10.1016/j.bbi.2019.09.019 |
ALFONSO S, GESTO M, SADOUL B, 2021. Temperature increase and its effects on fish stress physiology in the context of global warming[J]. Journal of Fish Biology, 98(6): 1496-1508. DOI:10.1111/jfb.14599 |
BIAN X L, LIU R, MENG Y, et al, 2021. Lipid metabolism and cancer[J]. The Journal of Experimental Medicine, 218(1): e20201606. DOI:10.1084/jem.20201606 |
CHEN C H, HO Y C, HO H H, et al, 2019. Tryptophan metabolite 5-methoxytryptophan ameliorates arterial denudation-induced intimal hyperplasia via opposing effects on vascular endothelial and smooth muscle cells[J]. Aging (Albany NY), 11(19): 8604-8622. |
CHEN Y Q, WANG J, LIAO M L, et al, 2021. Temperature adaptations of the thermophilic snail Echinolittorina malaccana: insights from metabolomic analysis[J]. Journal of Experimental Biology, 224(6): jeb238659. DOI:10.1242/jeb.238659 |
COSTA R, ALDRIDGE D C, MOGGRIDGE G D, 2008. Seasonal variation of zebra mussel susceptibility to molluscicidal agents[J]. Journal of Applied Ecology, 45(6): 1712-1721. DOI:10.1111/j.1365-2664.2008.01555.x |
COURANT F, ANTIGNAC J P, DERVILLY-PINEL G, et al, 2014. Basics of mass spectrometry based metabolomics[J]. Proteomics, 14(21/22): 2369-2388. |
DUMAS T, BONNEFILLE B, GOMEZ E, et al, 2020. Metabolomics approach reveals disruption of metabolic pathways in the marine bivalve Mytilus galloprovincialis exposed to a WWTP effluent extract[J]. Science of the Total Environment, 712: 136551. DOI:10.1016/j.scitotenv.2020.136551 |
GÖTZE S, BOCK C, EYMANN C, et al, 2020. Single and combined effects of the "Deadly trio" hypoxia, hypercapnia and warming on the cellular metabolism of the great scallop Pecten maximus[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 243/244: 110438. DOI:10.1016/j.cbpb.2020.110438 |
GUI Y, KASPAR H F, ZAMORA L N, et al, 2016. Capture efficiency of artificial food particles of post-settlement juveniles of the Greenshell™ mussel, Perna canaliculus[J]. Aquaculture, 464: 1-7. DOI:10.1016/j.aquaculture.2016.06.011 |
GUO K, RUAN G L, FAN W H, et al, 2020. Immune response to acute heat stress in the intestine of the red swamp crayfish, Procambarus clarkii[J]. Fish & Shellfish Immunology, 100: 146-151. |
HERRERA M, FERNℑNDEZ-ALACID L, SANAHUJA I, et al, 2020. Physiological and metabolic effects of a tryptophan-enriched diet to face up chronic stress in meagre (Argyrosomus regius)[J]. Aquaculture, 522: 735102. DOI:10.1016/j.aquaculture.2020.735102 |
HOSEINI S M, P⊃REZ-JIM⊃NEZ A, COSTAS B, et al, 2019. Physiological roles of tryptophan in teleosts: current knowledge and perspectives for future studies[J]. Reviews in Aquaculture, 11(1): 3-24. DOI:10.1111/raq.12223 |
HÖRL G, WAGNER A, COLE L K, et al, 2011. Sequential synthesis and methylation of phosphatidylethanolamine promote lipid droplet biosynthesis and stability in tissue culture and in vivo[J]. Journal of Biological Chemistry, 286(19): 17338-17350. DOI:10.1074/jbc.M111.234534 |
JACOX M G, ALEXANDER M A, BOGRAD S J, et al, 2020. Thermal displacement by marine heatwaves[J]. Nature, 584(7819): 82-86. DOI:10.1038/s41586-020-2534-z |
JANSEN J M, PRONKER A E, KUBE S, et al, 2007. Geographic and seasonal patterns and limits on the adaptive response to temperature of European Mytilus spp. and Macoma balthica populations[J]. Oecologia, 154(1): 23-34. DOI:10.1007/s00442-007-0808-x |
LANKADURAI B P, NAGATO E G, SIMPSON M J, 2013. Environmental metabolomics: An emerging approach to study organism responses to environmental stressors[J]. Environmental Reviews, 21(3): 180-205. DOI:10.1139/er-2013-0011 |
LAYCHOCK S G, TIAN Y R, SESSANNA S M, 2003. Endothelial differentiation gene receptors in pancreatic islets and INS-1 cells[J]. Diabetes, 52(8): 1986-1993. DOI:10.2337/diabetes.52.8.1986 |
LEÓN Y, MAGARIÑOS M, VARELA-NIETO I, 2021. Ceramide kinase inhibition blocks IGF-1-mediated survival of otic neurosensory progenitors by impairing AKT phosphorylation[J]. Frontiers in Cell and Developmental Biology, 9: 678760. DOI:10.3389/fcell.2021.678760 |
LIANG Q J, DONG W N, OU M F, et al, 2021. miR-151 affects low-temperature tolerance of Penaeus vannamei by modulating autophagy under low-temperature stress[J]. Frontiers in Cell and Developmental Biology, 9: 595108. DOI:10.3389/fcell.2021.595108 |
LIAO M L, SOMERO G N, DONG Y W, 2019. Comparing mutagenesis and simulations as tools for identifying functionally important sequence changes for protein thermal adaptation[J]. Proceedings of the National Academy of Sciences of the United States of America, 116(2): 679-688. |
LIU X L, PENG Y L, XU Y, et al, 2023. Responses of digestive metabolism to marine heatwaves in pearl oysters[J]. Marine Pollution Bulletin, 186: 114395. DOI:10.1016/j.marpolbul.2022.114395 |
MACHADO M, PEIXOTO D, SANTOS P, et al, 2022. Tryptophan modulatory role in European Seabass (Dicentrarchus labrax) immune response to acute inflammation under stressful conditions[J]. International Journal of Molecular Sciences, 23(20): 12475. DOI:10.3390/ijms232012475 |
MAULVAULT A L, SANTOS L H M L M, PAULA J R, et al, 2018. Differential behavioural responses to venlafaxine exposure route, warming and acidification in juvenile fish (Argyrosomus regius)[J]. Science of the Total Environment, 634: 1136-1147. DOI:10.1016/j.scitotenv.2018.04.015 |
NGUYEN T P L, NGUYEN V T A, DO T T T, et al, 2020. Fatty acid composition, phospholipid molecules, and bioactivities of lipids of the Mud Crab Scylla paramamosain[J]. Journal of Chemistry, 2020: 8651453. |
PARASKEVOPOULOU S, TIEDEMANN R, WEITHOFF G, 2018. Differential response to heat stress among evolutionary lineages of an aquatic invertebrate species complex[J]. Biology Letters, 14(11): 20180498. DOI:10.1098/rsbl.2018.0498 |
SERRA-COMPTE A, ÁLVAREZ-MUÑOZ D, SOLÉ M, et al, 2019. Comprehensive study of sulfamethoxazole effects in marine mussels: Bioconcentration, enzymatic activities and metabolomics[J]. Environmental Research, 173: 12-22. DOI:10.1016/j.envres.2019.03.021 |
SMITH K E, BURROWS M T, HOBDAY A J, et al, 2023. Biological impacts of marine heatwaves[J]. Annual Review of Marine Science, 15: 119-145. DOI:10.1146/annurev-marine-032122-121437 |
SOKOLOVA I M, FREDERICH M, BAGWE R, et al, 2012. Energy homeostasis as an integrative tool for assessing limits of environmental stress tolerance in aquatic invertebrates[J]. Marine Environmental Research, 79: 1-15. DOI:10.1016/j.marenvres.2012.04.003 |
TIAN J, TIAN L, CHEN M, et al, 2022. Low Temperature Affects Fatty Acids Profiling and Key Synthesis Genes Expression Patterns in Zanthoxylum bungeanum Maxim[J]. International Journal of Molecular Sciences, 23(4): 2319. DOI:10.3390/ijms23042319 |
VAN DE POL M, JENOUVRIER S, CORNELISSEN J H C, et al, 2017. Behavioural, ecological and evolutionary responses to extreme climatic events: challenges and directions[J]. Philosophical Transactions of the Royal Society B, Biological Sciences, 372(1723): 20160134. DOI:10.1098/rstb.2016.0134 |
VASSEUR D A, DELONG J P, GILBERT B, et al, 2014. Increased temperature variation poses a greater risk to species than climate warming[J]. Proceedings of the Royal Society B, Biological Sciences, 281(1779): 20132612. DOI:10.1098/rspb.2013.2612 |
WANG Y X, LIN S R, XU L Z, et al, 2023. Comparative transcriptomic analysis revealed changes in multiple signaling pathways involved in protein degradation in the digestive gland of Mytilus coruscus during high-temperatures[J]. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 46: 101060. DOI:10.1016/j.cbd.2023.101060 |
WEIGEL B L, ERWIN P M, 2016. Intraspecific variation in microbial symbiont communities of the sun sponge, Hymeniacidon heliophila, from intertidal and subtidal habitats[J]. Applied and Environmental Microbiology, 82(2): 650-658. DOI:10.1128/AEM.02980-15 |
YANG C Y, HAO R J, DU X D, et al, 2019. Response to different dietary carbohydrate and protein levels of pearl oysters (Pinctada fucata martensii) as revealed by GC-TOF/MS-based metabolomics[J]. Science of The Total Environment, 650: 2614-2623. DOI:10.1016/j.scitotenv.2018.10.023 |
YANG Y B, LEE M, FAIRN G D, 2018. Phospholipid subcellular localization and dynamics[J]. Journal of Biological Chemistry, 293(17): 6230-6240. DOI:10.1074/jbc.R117.000582 |
ZHANG Y, LIU C H, LIU J H, et al, 2022. Multi-omics reveals response mechanism of liver metabolism of hybrid sturgeon under ship noise stress[J]. Science of The Total Environment, 851: 158348. DOI:10.1016/j.scitotenv.2022.158348 |
ZHANG W Y, STOREY K B, DONG Y W, 2020. Adaptations to the mudflat: Insights from physiological and transcriptional responses to thermal stress in a burrowing bivalve Sinonovacula constricta[J]. Science of The Total Environment, 710: 136280. DOI:10.1016/j.scitotenv.2019.136280 |
ZHANG Z Q, ZHOU C, FAN K P, et al, 2021. Metabolomics analysis of the effects of temperature on the growth and development of juvenile European seabass (Dicentrarchus labrax)[J]. Science of The Total Environment, 769: 145155. DOI:10.1016/j.scitotenv.2021.145155 |
ZHAO S, ZHAO J, BU D, et al, 2014. Metabolomics analysis reveals large effect of roughage types on rumen microbial metabolic profile in dairy cows[J]. Letters in Applied Microbiology, 59(1): 79-85. DOI:10.1111/lam.12247 |
ZIPPAY M L, HELMUTH B, 2012. Effects of temperature change on mussel, Mytilus[J]. Integrative Zoology, 7(3): 312-327. DOI:10.1111/j.1749-4877.2012.00310.x |
 2024, Vol. 55
2024, Vol. 55


