中国海洋湖沼学会主办。
文章信息
- 杨阳, 宁超, 王亚军. 2023.
- YANG Yang, NING Chao, WANG Ya-Jun. 2023.
- 银鲳(Pampus argenteus)胰岛素基因的分子鉴定及其与卵黄原蛋白基因的关联表达
- MOLECULAR IDENTIFICATION OF INSULIN GENE AND ITS ASSOCIATIVE EXPRESSION WITH VITGELLOGENIN GENE IN PAMPUS ARGENTEUS
- 海洋与湖沼, 54(2): 550-558
- Oceanologia et Limnologia Sinica, 54(2): 550-558.
- http://dx.doi.org/10.11693/hyhz20220500117
文章历史
-
收稿日期:2022-05-03
收修改稿日期:2022-07-26
2. 浙江省海水增养殖重点实验室 浙江舟山 316021;
3. 宁波大学海洋学院 浙江宁波 315832
2. Key Laboratory of Mariculture and Enhancement of Zhejiang Province, Zhoushan 316021, China;
3. School of Marine Science, Ningbo University, Ningbo 315832, China
胰岛素(insulin, Ins)是动物体内最重要的内分泌激素, 能调控动物的生长、发育和代谢等各个方面, 具有广泛的生物学功能(鲁程瑶等, 2018; 罗智等, 2018)。Ins结构保守, 由两个多肽组成, 保守的A链和B链, 中间由二硫键组成(Caruso et al, 2011; Irwin, 2019)。哺乳动物中, Ins仅由一个ins基因编码合成, 是唯一降低血糖的激素, 由胰岛β细胞合成和分泌, 通过与胰岛素受体(insulin receptor, IR)特异性结合激活信号转导, 从而调控糖、脂肪和蛋白质代谢(罗智等, 2018; Irwin, 2019)。胰岛素基因广泛存在于哺乳动物和鱼类中, 同源基因胰岛素样多肽(insulin-like peptides, ILPs)也广泛存在无脊椎动物中包括埃及伊蚊中发现了8个ILPs (Brown et al, 2008)和大多数鱼类具有多个ins基因等(Irwin, 2004, 2019)。近年来, 越来越多的研究还发现, Ins的作用与低等到高等生物的生殖密切有关, 调控了动物的繁殖等活动(Caruso et al, 2011; 谢鹏飞等, 2018; 彭竹清等, 2019)。
卵黄合成, 又称卵黄发生, 是卵生动物卵巢发育过程中最为重要的一环。卵子中的卵黄蛋白(yolk protein, YP)含有大量营养物质, 包括蛋白质、脂肪和维生素等, 可为早期胚胎发生和发育提供所需的营养和功能性物质(Reading et al, 2011; 周阳等, 2017)。卵黄蛋白的前体是卵黄原蛋白(vitellogenin, Vtg), Vtg的合成受基因表达调控, 鱼类中主要在肝胰脏合成, 节肢动物中主要在脂肪体合成, 后经血液循环运送至卵母细胞表面, 经细胞膜上受体介导的内吞作用而被吸收入细胞内, 储存在卵黄颗粒中(周阳等, 2017; Sullivan et al, 2018)。无脊椎动物如昆虫和甲壳动物中, 研究证实ins信号对卵巢发育, 尤其是卵黄合成具有重要的调控作用(Richard et al, 2005; Parthasarathy et al, 2011; Sheng et al, 2011), 但在脊椎动物鱼类中关于ins信号对卵巢发育的研究还未见报道。果蝇中, 胰岛素蛋白基因突变会导致雌性不育, 卵母细胞停留在卵黄发生前阶段, 卵子不能成熟(Richard et al, 2005)。研究发现胰岛素能够通过促进保幼激素(juvenile hormone, JH)和蜕皮激素合成, 促进卵黄合成(Brown et al, 2008; Sheng et al, 2011)。另一方面, 近期研究还发现胰岛素能直接调控卵黄发生, 在动物卵巢发育中发挥重要作用(Richard et al, 2005; Huang et al, 2017)。鱼类作为一类卵生动物, 卵巢发育中也需要合成大量卵黄原蛋白, 在卵子发生及胚胎发育过程中发挥重要作用。同时, 越来越多研究发现大多数硬骨鱼在卵巢发育中可见卵黄合成受阻, 卵母细胞发育停止并退化的现象(González-Kother et al, 2020; 强俊等, 2021)。然而目前, 有关调控鱼类卵黄合成的研究还较少, 尤其关于胰岛素与卵黄合成关联的研究还未见报道。
银鲳(Pampus argenteus)属硬骨鱼纲(Osteichthyes), 鲈形目(Pereiformes), 鲳亚目(Stromaeoidei), 鲳科(Stromateidae), 鲳属(Pampus), 是一种重要的海洋经济鱼类, 主要分布于中国、日本等亚洲海域, 科威特、伊拉克海域的阿拉伯湾及印度孟加拉湾等印度洋和西太平洋(James et al, 2008; Gu et al, 2021)。银鲳因其味道鲜美, 营养丰富且组成合理, 深受人们喜爱, 具有开阔的市场前景。作为一种极具前景的水产养殖物种, 近年来银鲳在人工养殖及繁育方面已有突破, 但银鲳在繁殖时期的受精卵质量与数量低下, 是制约银鲳规模化养殖的主要原因之一(施兆鸿等, 2009)。早期研究发现银鲳卵巢发育过程中还存在大量卵泡闭锁现象(王腾飞等, 2017)。鉴于胰岛素在卵黄合成中的重要作用, 本研究从肝脏转录组中获得了银鲳insulin (ins)、insulin-like (ins-like)和insulin-2 (ins-2)基因的cDNA序列, 拟分析分子特征、进化关系及组织分布, 解析其和vtg基因在卵巢发育过程中在肝脏和卵巢组织中的表达变化。研究结果不仅丰富鱼类胰岛素基因的研究, 也为探讨卵黄合成的调控机制提供基础。
1 材料与方法 1.1 实验样品不同性腺发育时期的银鲳(2019年2~5月), 采自浙江象山港湾水产苗种养殖基地。所采样品均为1龄, 体重为(44.05±10.34) g。饲养温度20~25 ℃, 盐度24±0.8, 溶解氧(7.35±0.05) mg/L, 光照周期为光照14 h, 黑暗10 h, 每天定时投喂6次人工配合饵料。共采样5次, 每次约30尾。通过MS-222麻醉后进行快速地解剖。根据性腺形态学判断雌雄, 其中每尾雌鱼的1/2卵巢组织固定于波恩试剂中, 24 h后置换为70%乙醇, 再24 h后更换一次70%乙醇, 并长期保存, 另1/2卵巢组织保存于–80 ℃冰箱备用。此外, 解剖脑、心脏、肾脏、脾脏、鳃、鳍、胃、肠、皮肤、肌肉、精巢、肝脏组织也保存于–80 ℃冰箱备用。
1.2 胰岛素基因cDNA序列获得及序列分析从银鲳肝脏转录组测序结果中获得3个ins、ins-2和ins-like的cDNA序列, 利用Primer5.0设计引物。按照总RNA提取试剂盒(Fastagen, RNAfast200试剂盒)操作方法提取肝脏组织总RNA, 用反转录试剂盒(TaKaRa, EasyScript® All-in-One First-Strand cDNA Synthesis试剂盒)将RNA反转录成总cDNA。利用特异性引物进行PCR扩增, 获得3个胰岛素基因的cDNA序列, 经TA克隆后送有康公司测序验证。3个胰岛素家族基因的开放阅读框(ORF)采用NCBI ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找; 运用软件DNAMAN8.0将cDNA序列翻译成氨基酸序列; 使用生物序列分析中心(http://www.cbs.dtu.dk/services/SignalP)的SignalIP 4.1鉴定潜在的信号肽及信号肽切割位点; 使用SMART (http://smart.embl-heidelberg.de/)进行氨基酸结构域分析; 通过MUSCLE (https://www.ebi.ac.uk/Tools/msa/muscle/)进行氨基酸多重序列比对分析; 使用LALIGN (http://www.ch.embnet.org/software/LALIGN-form.html)计算同源基因的相似性(similar)和同一性(identity)百分比; 使用MEGA-X软件, 在最佳拟合模型下构建系统发育NJ树, 重复1 000次, 并可视化。
1.3 组织切片学观察波恩试剂固定后长期保存于70%乙醇的性腺组织, 逐步更换80%、90%、95%、100%乙醇, 再经二甲苯透明石蜡浸泡后包埋于石蜡中, 以5~8 μm厚度切片, 用苏木精-伊红染色, 最后经光学显微镜观察和拍照。
1.4 RNA提取和反转录按照总RNA提取试剂盒(Fastagen, RNAfast200试剂盒)操作方法提取卵巢、脑、心脏、肾脏、脾脏、腮、鳍、胃、肠、皮肤、肌肉、精巢、肝脏组织总RNA, 用反转录试剂盒(TaKaRa, EasyScript® All-in-One First-Strand cDNA Synthesis试剂盒)将RNA反转录成cDNA, 并储存于–20 ℃备用。
1.5 采用qRT-PCR检测银鲳胰岛素基因(ins, ins-2和ins-like)和卵黄原蛋白基因(vtgAa, vtgAb和vtgB)表达采用qRT-PCR对卵巢、脑、心脏、肾脏、脾脏、鳃、鳍、胃、肠、皮肤、肌肉、精巢、肝脏组织中3个胰岛素基因包括ins、ins-2和ins-like的表达量进行检测分析, 同时采用qRT-PCR对5个不同发育时期的卵巢和肝脏组织中胰岛素基因(ins, ins-2和ins-like)和卵黄蛋白基因(vtgAa, vtgAb和vtgB)进行检测分析。18S和β-actin作为内参基因, 所有基因引物以Premier 5.0设计且引物序列信息如表 1所示。按照SYBR PreMix Ex Taq试剂盒说明书要求在Quantagene q225荧光定量PCR仪上进行qRT-PCR实验, 每个样品重复3次。
| 引物名称 | 引物序列 |
| ins-F | 5′-CGAGTGAGACCGGCAATGGA-3′ |
| ins-R | 5′-CTCCACGATGCCTCGCTTCA-3′ |
| ins-2-F | 5′-AGAGCCAAACAGGAGCAGCA-3′ |
| ins-2-R | 5′-ATGGCAGCACTGCTCAACGA-3′ |
| ins-like-F | 5′-CCCACGGAAGACACCGACTC-3′ |
| ins-like-R | 5′-GATGCTGCAGGGCCTGTGA-3′ |
| vtgAa-F | 5′-GCCAGGACACCAAGTGCTAC-3′ |
| vtgAa-R | 5′-ATGAGCTTCTGCGCTTTCCC-3′ |
| vtgAb-F | 5′-GCGTGTGGCCAGATTTGAGA-3′ |
| vtgAb-R | 5′-CAGCAGAGCTTGAGCAGCTT-3′ |
| vtgC-F | 5′-AAAGCCTTCGCCATGAGTGG-3′ |
| vtgC-R | 5′-TGCTTCGGGCGTGTAGTAGA-3′ |
| 18S-F | 5′-GGTTTTCTCTCTGAACTGGGG-3′ |
| 18S-R | 5′-CCTCCGACTTTCGTTCTTGAT-3′ |
| β-actin-F | 5′-ACCCAGATCATGTTCGAGACC-3′ |
| β-actin-R | 5′-ATGAGGTAGTCTGTGAGGTCG-3′ |
根据2–ΔΔCt法计算各个基因mRNA的相对表达量, 所有结果以平均值±标准误表示(n=3), 数据分析采用单因素方差分析(One-way ANOVA), 然后进行t检验, 显著性用P < 0.05和P < 0.01表示。
2 实验结果 2.1 胰岛素基因(ins, ins-2和ins-like) cDNA序列分析银鲳ins基因cDNA全长473 bp (GenBank登录号: BankIt2574894), 其中包括一个长度为318 bp的ORF, 编码105个氨基酸, 预测蛋白分子量大小为11.86 kDa; ins-2基因cDNA全长351 bp (GenBank登录号: BankIt2574894), 编码116个氨基酸, 预测蛋白分子量大小为12.95 kDa; ins-like基因cDNA全长336 bp (GenBank登录号: BankIt2574894), 编码111个氨基酸, 预测蛋白分子量大小为12.58 kDa。蛋白结构域分析结果表明, 银鲳ins、ins-2和ins-like基因氨基酸序列均由位于N端的信号肽(signal peptide)和2个属于胰岛素多肽A链和B链组成的IIGF (胰岛素/胰岛素样生长因子/松弛素家族)构成(图 1), 属于胰岛素家族成员。
 |
| 图 1 银鲳与部分鱼类的胰岛素基因多重比对 Fig. 1 Multiple alignment of insulin amino acid sequences of silver pomfret and other fish 注: signal peptide: 信号肽结构; B-chain: B链, A-chain: A链; IIGF: 胰岛素/胰岛素样生长因子/松弛素家族; 蓝色阴影: 完全相同的氨基酸, 粉色阴影: 部分相同的氨基酸。Pampus argenteus: 银鲳; Danio rerio: 斑马鱼; Salmo salar: 大西洋鲑; Paralichthys olivaceus: 牙鲆; Oryzias latipes: 青鳉; Salvelinus alpinus: 北极红点鲑 |
多序列分析结果表明, 银鲳ins、ins-2和ins-like氨基酸序列之间的同一性(identity)为48%~56%, 相似性(similar)为70%~77%。根据部分哺乳类和鱼类ins、ins-2和ins-like以及无脊椎动物ILPs的氨基酸全序列构建系统进化树, 结果显示银鲳Ins-like与三湖慈鲷(Pundamilia nyererei)同源性最高, 同一性为84.7%, 相似性为96.4%, 聚类分析显示无脊椎动物Ins-like和哺乳类Ins均单独为一簇, 鱼类Ins和Ins-2成一簇以及鱼类Ins-like单独成一簇(图 2)。
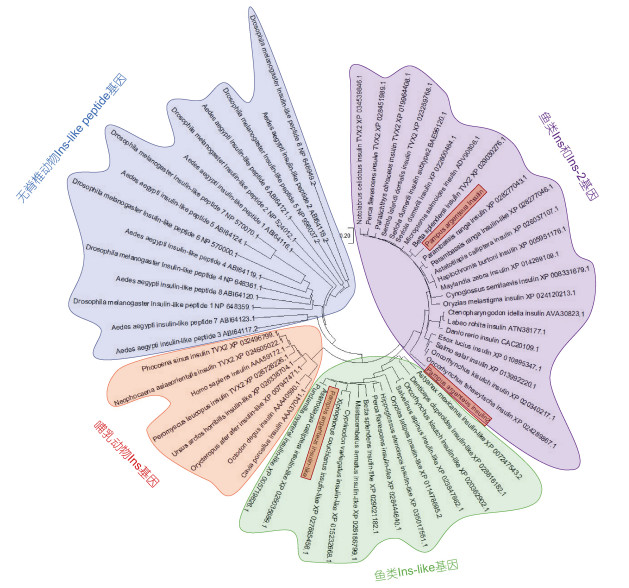 |
| 图 2 银鲳和其他动物胰岛素全长氨基酸序列构建的系统进化树 Fig. 2 Phylogenetic tree of the full-length amino acid sequences of silver pomfret and other animals insulin genes 注: Pampus argenteus: 银鲳; Danio rerio: 斑马鱼; Micropterus salmoides: 大口黑鲈; Haplochromis burtoni: 伯氏妊丽鱼; Esox lucius: 白斑狗鱼; Oncorhynchus kisutch: 银大麻哈鱼; Parambassis ranga: 印度玻璃鱼; Astatotilapia calliptera: 快乐东方鲷; Cynoglossus semilaevis: 半滑舌鳎; Maylandia zebra: 斑马拟丽鱼; Oncorhynchus tshawytscha: 大鳞大麻哈鱼; Oryzias melastigma: 海水青鳉; Ctenopharyngodon idella: 草鱼; Labeo rohita: 露斯塔野鲮; Seriola dumerili: 高体鰤; Salmo salar: 大西洋鲑; Perca flavescens: 黄鲈; Seriola lalandi dorsalis: 黄条鰤; Betta splendens: 暹罗斗鱼; Paralichthys olivaceus: 牙鲆; Notolabrus celidotus: 新西兰背唇隆头鱼; Peromyscus leucopus: 白足鼠; Neophocaena siaeorientalis: 长江江豚; Phocoena sinus: 加湾鼠海豚; Octodon degus: 灌丛八齿鼠; Homo sapiens: 智人; Cavia porcellus: 豚鼠; Xiphophorus couchianus: 库舍剑尾鱼; Mastacembelus armatus: 大刺鳅; Oryzias latipes: 青鳉; Salvelinus alpinus: 北极红点鲑; Astyanax mexicanus: 墨西哥丽脂鲤; Denticeps clupeoides: 齿鲱; Pundamilia nyererei: 三湖慈鲷; Cyprinodon variegatus: 北美鱂; Hippoglossus stenolepis: 狭鳞庸鲽; Orycteropus afer: 土豚; Ursus arctos horribilis: 灰熊; Drosophila melanogaster: 黑腹果蝇; Aedes aegypti: 埃及伊蚊 |
组织学观察卵巢组织, 将卵巢划分为五个时期: 从Ⅱ期到Ⅵ期。Ⅱ期卵巢, 可见大量核仁核周和初级卵母细胞(图 3a)。核仁核周卵母细胞的细胞核明显, 同时具有一个大的核仁。初级卵母细胞大的核仁消失, 多个小的核仁出现。Ⅲ期卵巢, 可见大量卵黄发生前卵母细胞, 细胞由椭圆型转变呈多边型, 多个小的核仁排列在细胞核膜上, 细胞质中出现泡状小体, 卵母细胞表面的放射带和两层滤泡细胞层清晰可见(图 3b)。Ⅳ期卵巢, 可见大量卵黄发生中卵母细胞, 1~2层的黄红色卵黄颗粒开始出现在卵母细胞细胞膜周围, 细胞核周围出现一团致密深色颗粒(图 3c)。Ⅴ期卵巢, 可见大量卵黄发生后卵母细胞, 细胞直径500~800 μm。卵黄颗粒填充细胞质大部分, 细胞核体积减小, 放射带明显加粗(图 3d)。Ⅵ期卵巢, 可见大量为成熟卵细胞。卵细胞体积达到最大阶段, 直径为800~1 300 μm左右。卵母细胞细胞质充斥大量卵黄颗粒, 在制作切片中甚至有卵黄颗粒掉落(图 3e)。
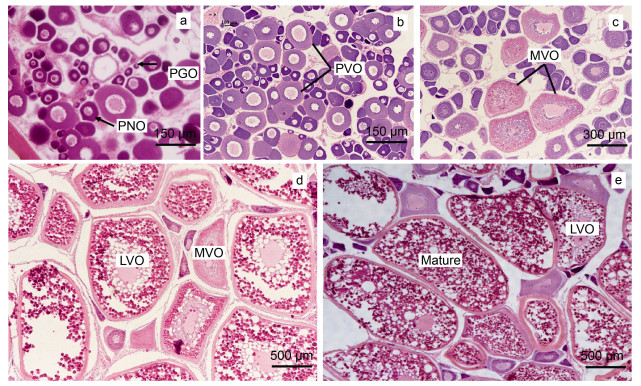 |
| 图 3 不同时期银鲳卵巢的组织学 Fig. 3 Histology of ovary of silver pomfret at different developmental stages 注: a. Ι期卵巢; b. Ⅱ期卵巢; c. Ⅲ期卵巢; d. Ⅳ期卵巢; e. Ⅴ期卵巢。PGO: 初级生长卵母细胞(primary growth oocyte); PNO: 核仁核周卵母细胞(perinucleolar oocyte); PVO: 卵黄发生前卵母细胞(previtellogenic oocyte); MVO: 卵黄发生中卵母细胞(midvitellogenic oocyte); LVO: 卵黄发生后卵母细胞(late vitellogenic oocytes); Mature: 成熟卵母细胞 |
用qRT-PCR检测了ins、ins-2和ins-like基因不同组织中的相对表达水平, 包括肝、脑、心、脾、肾、鳃、卵巢、精巢、胃、肠、肌肉、鳍和皮肤。如图 4所示, ins、ins-2和ins-like基因在各个组织中均有表达, 其中ins基因显著高表达在脾中, 在其他各组织中表达量相近, ins-like和ins-2基因显著高表达在肝和脾中, 在其他各组织中表达量相对较低。
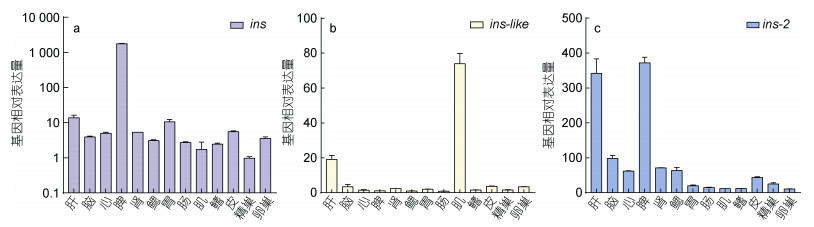 |
| 图 4 3个胰岛素基因在银鲳各组织中表达量 Fig. 4 The expression levels of three insulin genes in various tissues of silver pomfret |
在根据组织观察划分的卵巢不同发育时期, 采用qRT-PCR测定肝脏和卵巢组织中ins、ins-2、ins-like、vtgAa、vtgAb和vtgB基因的mRNA相对量。结果显示, 3个胰岛素基因和3个卵黄蛋白原基因在肝脏和卵巢中的表达趋势一致, 从Ⅱ期至Ⅳ期肝脏和卵巢中逐渐升高, 并在Ⅳ期达到最高值, 从Ⅳ期至Ⅵ期表达量显著下降(图 5)。在不同时期肝脏中, 胰岛素基因中ins-2和ins-like基因表达量最高, ins基因表达量最低, 卵黄原蛋白基因中vtgAb基因表达量最高, vtgAa和vtgB基因表达量较低, 在不同卵巢时期中, 胰岛素基因中ins和ins-2基因表达量最高, ins-like基因表达量最低, 卵黄原蛋白基因中vtgB基因表达量最高, vtgAa和vtgAb基因表达量较低。
 |
| 图 5 胰岛素和卵黄原蛋白基因和在不同发育时期的肝脏和卵巢中表达量 Fig. 5 The expression levels of insulin and vitellogenin genes in liver and ovary at different developmental stages 注: *表示P < 0.05, 两组数据间具有显著性差异; **表示P < 0.01, 两组数据间具有极显著性差异 |
胰岛素是被广泛研究的肽激素, 调控动物生长、发育、代谢、繁殖及免疫等多项生命活动(Boucher et al, 2014)。本文从转录组测序数据中获得了银鲳ins、ins-2和ins-like cDNA序列, 分别为318 bp、351 bp和409 bp, 编码氨基酸长度分别为105 aa、116 aa和111 aa。序列分析显示银鲳ins、ins-2和ins-like氨基酸序列具有胰岛素基因的典型特征, 与其他鱼类的同源基因类似, 包含NH-2端分泌信号肽(signal peptide)和由B链、不保守的C链和A链组成的IIGF。哺乳动物中Ins仅由一个ins基因编码合成, 由胰腺细胞生成, 是调节血糖水平的关键因子, 反应于高血糖水平, 导致肝脏和脂肪等组织吸收葡萄糖, 从而储备能量(White et al, 1994; Boucher et al, 2014)。但相比于哺乳动物, 有关鱼类胰岛素的研究较少。目前, 大约有30多种鱼类的胰岛素基因被发现(罗智等, 2018)。不同鱼类胰岛素的氨基酸序列相对保守(罗智等, 2018), 然而大多数鱼类, 如斑马鱼和虹鳟等中发现存在2个胰岛素基因ins和ins-2 (Irwin, 2004; Caruso et al, 2011), 且分布在不同染色体, 斑马鱼ins位于5号染色体, ins-2位于14号染色体。最近的基因组数据分析发现辐鳍亚纲的鱼类胰岛素基因具有3个重复基因, 但大多数硬骨鱼类中缺失第3个基因(Irwin, 2019)。鱼类中多个胰岛素基因的产生被认为是由于鱼类特有的(第三次)基因组大复制事件。基因复制的经典理论认为大多数基因复制之后, 只有其中一个基因保留其祖先的功能, 其他复制基因演变为假基因, 不具备功能, 或者发生突变, 转变为具新功能的基因(Taylor et al, 2004)。另外一个新的理论认为, 复制基因可能会保留祖先基因功能的一部分, 同时其他复制基因也会行使祖先基因的一部分功能, 它们的作用相互补充(Force et al, 2000; Irwin, 2004)。因此, 鱼类中不同类型胰岛素基因的表达及功能需要进一步研究。
3.2 银鲳胰岛素基因(ins, ins-2和ins-like)的组织表达分析各组织表达特征分析表明, 银鲳胰岛素3个重复基因ins、ins-2和ins-like在健康银鲳组织中广泛表达, 但是不同组织的3个基因表达水平不相同。银鲳3个胰岛素基因在肝胰脏组织中均具有较高的表达水平, 这与哺乳动物中胰岛素主要在胰腺组织中生成一致, 暗示胰岛素基因在鱼类中可能也具有相似的调控系统与功能。斑马鱼中研究也证实外源胰岛素能促进鱼体内血糖转运, 维持血糖平衡, 但鱼类胰岛素合成不足, 分泌相对延迟(鲁程瑶等, 2018)。银鲳ins和ins-2在脾脏组织中具有较高的表达水平, 同时ins-like在肌肉组织中具有较高的表达水平。已有研究证实大部分鱼类的胰岛素合成在肝脏、肌肉和生殖腺(Caruso et al, 2011; 罗智等, 2018)。而不同组织的表达特征暗示3个胰岛素基因在功能上可能存在差异。同时, 血清胰岛素具有波动性, 与鱼类季节性繁殖改变具有相关性增长趋势(Caruso et al, 2011), 这也暗示胰岛素基因参与调控了鱼类繁殖等生殖活性。
3.3 银鲳不同时期卵巢和肝脏中胰岛素基因和卵黄原蛋白基因的表达分析鱼类作为一类卵生动物, 卵子的形成需要卵黄合成, 又称为卵黄发生, 这是卵巢发育过程中最为重要的一环。对昆虫的研究证实, ILPs在卵巢发育中具有重要作用, 直接参与调控卵黄发生和卵母细胞发育(Brown et al, 2008; Sheng et al, 2011; 张龙辉等, 2014)。其他卵生动物, 如甲壳动物青蟹中也发现外源胰岛素能够刺激肝胰脏中卵黄原蛋白基因的表达(Huang et al, 2017)。然而, 目前有关鱼类中胰岛素基因与卵黄原蛋白基因间关联的研究还未见报道。先前研究发现银鲳及多种鱼类具有3类卵黄蛋白原基因vtgAa、vtgAb和vtgB (Yilmaz et al, 2016; Xue et al, 2018)。因此, 本研究对不同发育阶段的银鲳肝脏和卵巢组织中3个胰岛素基因和3个卵黄原蛋白基因的表达量进行了分析。结果显示, 银鲳胰岛素基因和卵黄原蛋白基因在肝脏和卵巢中的表达趋势一致, 从Ⅱ期至Ⅳ期肝脏和卵巢中逐渐升高, 并在Ⅳ期达到最高值, 从Ⅳ期至Ⅵ期表达量显著下降。这一结果与卵巢组织切片结果相符合, 卵母细胞积累卵黄蛋白从Ⅲ期至Ⅴ期。同时在其他鱼类研究发现, 卵黄蛋白原主要在肝脏中表达, 少量表达在卵巢组织中, 较高的表达量集中在卵黄发生过程的肝脏和卵巢组织中(Sullivan et al, 2018; Xue et al, 2018)。肝脏和卵巢中胰岛素基因与卵黄原蛋白基因相一致的表达趋势, 我们推测鱼类胰岛素可能调控着卵黄蛋白的生成, 两者关系密切, 但是否如同昆虫中研究一致, 鱼类胰岛素与卵黄蛋白合成之间存在确切因果关系, 仍需要进一步研究确认在3个胰岛素基因中, 在不同时期肝脏, ins-2和ins-like基因表达量最高, ins基因表达量最低, 而在不同时期卵巢, ins和ins-2基因表达量最高, ins-like基因表达量最低。肝脏和卵巢组织中胰岛素基因的不同表达水平暗示3个胰岛素基因可能在卵黄发生中发挥作用大小有所差异, 但具体基因的功能需要进一步研究。
4 结论本研究鉴定了银鲳3个胰岛素insulin (ins)、insulin-like (ins-like)和insulin-2 (ins-2)基因的cDNA序列, 序列分析揭示这3个基因的氨基酸序列具有胰岛素基因的典型特征。银鲳胰岛素家族3个基因ins、ins-2和ins-like在各个组织中广泛表达, 但是不同组织的3个基因表达水平不相同。同时, 在不同发育阶段的银鲳肝脏和卵巢组织中3个胰岛素基因和3个卵黄蛋白原基因的表达趋势一致, 从Ⅱ期至Ⅳ期肝脏和卵巢中逐渐升高, 并在Ⅳ期达到最高值, 从Ⅳ期至Ⅵ期表达量显著下降。研究结果首次推测, 鱼类胰岛素可能也参与调控卵黄蛋白的生成, 两者密切相关, 为深入探究鱼类胰岛素的功能及作用机制提供了新思路。
王腾飞, 张鼎元, 郭春阳, 等, 2017. 养殖银鲳性腺发育规律和性类固醇激素变化. 水产学报, 41(2): 198-211 |
张龙辉, 王国栋, 2014. 无脊椎动物胰岛素样蛋白(Insulin-like/related peptides)研究进展——以昆虫为例. 生物技术通报, (10): 33-42 |
罗智, 卓梅琴, 2018. 鱼类胰岛素、胰岛素受体和胰岛素受体底物的生物学特性及其对营养物质代谢的调控. 水产学报, 42(1): 149-158 |
周阳, 侯聪聪, 竺俊全, 2017. 硬骨鱼类卵黄原蛋白及其在卵子发生中的作用. 中国细胞生物学学报, 39(5): 649-658 |
施兆鸿, 彭士明, 孙鹏, 等, 2009. 我国鲳属鱼类养殖的发展潜力及前景展望. 现代渔业信息, 24(10): 3-4, 8 DOI:10.3969/j.issn.1004-8340.2009.10.001 |
彭竹清, 郝友进, 2019. 胰岛素信号调控昆虫滞育的研究进展. 上海交通大学学报(农业科学版), 37(6): 201-206 DOI:10.3969/J.ISSN.1671-9964.2019.06.031 |
鲁程瑶, 张震, 丁倩雯, 等, 2018. 外源性胰岛素对斑马鱼血糖及其转运的影响. 生物技术进展, 8(5): 426-434 |
谢鹏飞, 李正辉, 黄茜, 等, 2018. 昆虫胰岛素生理功能的研究进展. 环境昆虫学报, 40(4): 834-839 |
强俊, 马俊蕾, 曹哲明, 等, 2021. 鱼类卵子发育与卵泡闭锁的研究进展. 中国水产科学, 28(2): 239-252 |
BOUCHER J, KLEINRIDDERS A, KAHN C R, 2014. Insulin receptor signaling in normal and insulin-resistant states. Cold Spring Harbor Perspectives in Biology, 6(1): a009191 DOI:10.1101/cshperspect.a009191 |
BROWN M R, CLARK K D, GULIA M, et al, 2008. An insulin-like peptide regulates egg maturation and metabolism in the mosquito Aedes aegypti. Proceedings of the National Academy of Sciences of the United States of America, 105(15): 5716-5721 |
CARUSO M A, SHERIDAN M A, 2011. New insights into the signaling system and function of insulin in fish. General and Comparative Endocrinology, 173(2): 227-247 |
GONZÁLEZ-KOTHER P, OLIVA M E, TANGUY A, et al, 2020. A review of the potential genes implicated in follicular atresia in teleost fish. Marine Genomics, 50: 100704 |
GU W W, YANG Y, NING C, et al, 2021. Identification and characteristics of insulin-like growth factor system in the brain, liver, and gonad during development of a seasonal breeding teleost, Pampus argenteus. General and Comparative Endocrinology, 300: 113645 |
HUANG X S, FENG B Y, HUANG H Y, et al, 2017. In vitro stimulation of vitellogenin expression by insulin in the mud crab, Scylla paramamosain, mediated through PI3K/Akt/ TOR pathway. General and Comparative Endocrinology, 250: 175-180 |
IRWIN D M, 2004. A second insulin gene in fish genomes. General and Comparative Endocrinology, 135(1): 150-158 |
IRWIN D M, 2019. Duplication and diversification of insulin genes in ray-finned fish. Zoological Research, 40(3): 185-197 |
JAMES C M, ALMATAR S M, 2008. Potential of silver pomfret (Pampus argenteus) as a new candidate species for aquaculture[EB/OL]. Marine Finfish Aquaculture Network. https://www.researchgate.net/profile/Charles_James8/publication/242257281_Potential_of_silver_pomfret_Pampus_argenteus_as_a_new_candidate_species_for_aquaculture/links/55b8838b08ae092e96589457/Potential-of-silver-pomfret-Pampus-argenteus-as-a-new-candidate-species-foraquaculture.pdf.
|
LYNCH M, FORCE A, 2000. The probability of duplicate gene preservation by subfunctionalization. Genetics, 154(1): 459-473 |
PARTHASARATHY R, PALLI S R, 2011. Molecular analysis of nutritional and hormonal regulation of female reproduction in the red flour beetle, Tribolium castaneum. Insect Biochemistry and Molecular Biology, 41(5): 294-305 |
READING B J, SULLIVAN C V, SCHILLING J, 2011. Vitellogenesis in fishes[M] // READING B J, SULLIVAN C V. Encyclopedia of Fish Physiology. New York: Plenum Press: 635-646.
|
RICHARD D S, RYBCZYNSKI R, WILSON T G, et al, 2005. Insulin signaling is necessary for vitellogenesis in Drosophila melanogaster independent of the roles of juvenile hormone and ecdysteroids: female sterility of the chico1 insulin signaling mutation is autonomous to the ovary. Journal of Insect Physiology, 51(4): 455-464 |
SHENG Z T, XU J J, BAI H, et al, 2011. Juvenile hormone regulates vitellogenin gene expression through insulin-like peptide signaling pathway in the red flour beetle, Tribolium castaneum. Journal of Biological Chemistry, 286(49): 41924-41936 |
SULLIVAN C V, YILMAZ O, 2018. Vitellogenesis and yolk proteins, fish. Encyclopedia of Reproduction, 6: 266-277 |
TAYLOR J S, RAES J, 2004. Duplication and divergence: the evolution of new genes and old ideas. Annual Review of Genetics, 38: 615-643 |
WHITE M F, KAHN C R, 1994. The insulin signaling system. Journal of Biological Chemistry, 269(1): 1-4 |
XUE R, WANG X Y, XU S H, et al, 2018. Expression profile and localization of vitellogenin mRNA and protein during ovarian development in turbot (Scophthalmus maximus). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 226: 53-63 |
YILMAZ O, PRAT F, IBÁÑEZ A J, et al, 2016. Multiple vitellogenins and product yolk proteins in European sea bass (Dicentrarchus labrax): molecular characterization, quantification in plasma, liver and ovary, and maturational proteolysis. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 194/195: 71-86 |
 2023, Vol. 54
2023, Vol. 54

