中国海洋湖沼学会主办。
文章信息
- 蔺诗颖, 赵亮, 刘璐璐, 冯建龙. 2023.
- LIN Shi-Ying, ZHAO Liang, LIU Lu-Lu, FENG Jian-Long. 2023.
- 基于CMIP6气候变化情景下南极小须鲸(Balaenoptera bonaerensis)在宇航员海栖息地变化分析
- HABITAT CHANGES OF ANTARCTIC MINKE WHALE (BALAENOPTERA BONAERENSIS) IN THE COSMONAUT SEA UNDER CMIP6 CLIMATE CHANGE SCENARIOS
- 海洋与湖沼, 54(2): 387-398
- Oceanologia et Limnologia Sinica, 54(2): 387-398.
- http://dx.doi.org/10.11693/hyhz20220600163
文章历史
-
收稿日期:2022-06-20
收修改稿日期:2022-07-30
南极小须鲸(Balaenoptera bonaerensis)又称南极须鲸、南方小须鲸, 隶属于哺乳动物纲(Mammalia)鲸目(Cetacea)须鲸科(Balaenopteridae)须鲸属(Balaenoptera), 雌性平均体长9.0 m, 雄性平均体长8.5 m, 背部呈深灰色, 腹部为白色(Kato et al, 2000)。南极小须鲸分布在南半球海域, 多数在南半球夏季接近南极, 冬季向北迁移, 少数整年在南极生活(Ishikawa et al, 2022)。南极小须鲸主要以南极磷虾(Euphausia superba)为食, 冰磷虾(Euphausia crystallorophias)和南极银鱼(Pleuragramma antarcticum)也是它的食物(Bushuev, 1986; Ichii et al, 1991; Ishikawa et al, 2022)。南极小须鲸是南大洋生态系统的重要组成部分, 在物质循环、维护生态系统稳定等方面有重要作用(Parry, 1981; Apollonio, 2002; Springer et al, 2003; Roman et al, 2010, 2014)。
南极小须鲸的分布与环境密切相关。Herr等(2019)发现海冰密集度、距冰缘的距离与南极小须鲸的分布相关。南极小须鲸在海冰边缘和中等海冰密集度处分布多, 在无冰水域很少。温度是鲸等大型哺乳动物选择栖息地的重要依据(Davis, 2019; Adamczak et al, 2020; Heide-Jørgensen et al, 2020), 温度升高已经导致一些鲸繁殖率下降(Cartwright et al, 2019)。在过去几十年南极区域海洋温度升高已经对海洋环境造成了显著影响(Etourneau et al, 2019)。温度升高会影响海冰的分布及其季节变化、影响浮游植物生长、改变南极磷虾栖息地和生物量(Martinson et al, 2008; Stammerjohn et al, 2008)。南极小须鲸的主要食物来源是南极磷虾, 它的分布和海冰密切相关(Friedlaender et al, 2014; Herr et al, 2019)。因此, 海冰、海温的变化均会对南极小须鲸产生重要影响。已有研究表明, 近年来南极小须鲸的生物量已经从2013年国际捕鲸协会统计的720 000下降到了500 000, 下降了31% (Risch et al, 2019)。目前对南极小须鲸的研究主要集中在觅食和迁移上, 对南极小须鲸栖息地分布以及其对气候变化的响应缺少认识。宇航员海位于东南极洲的恩德比地西部, 是南大洋研究最少的区域之一(Hunt et al, 2007)。气候变化情景下南极小须鲸在宇航员海栖息地变化分析研究对南极小须鲸保护策略提供科学基础, 同时也为认识气候变化对南极生态系统的影响提供参考。
物种分布模型(species distribution model, SDM), 是一种基于生态位理论, 根据已知分布数据和各种环境数据评估给定物种的分布的模型(Byeon et al, 2018)。SDM在物种潜在栖息地预测、生物热点区域评估和濒危物种保护等方面应用广泛(Franklin et al, 2010)。最大熵(maximum entropy, MaxEnt)模型结合了机器学习和最大熵原理, 在物种分布数据较少时仍具有较好的预测结果, 是目前预测全球海洋物种栖息地时空变化的最常用的模型(Ahmed et al, 2015; Feng et al, 2022)。近年来, SDM越来越多地运用于预测气候变化下物种分布的潜在变化(Lezama-Ochoa et al, 2016; Hu et al, 2022)。Hu等(2022)运用MaxEnt模型预测了中国近海21种鱼在2050年的时空分布, 发现在气候变化背景下, 到2050年, 20种鱼的栖息地会向北迁移。本研究将运用MaxEnt模型和第六次国际耦合模式比较计划(Coupled Model Intercomparison Project in its sixth phase, CMIP6)的数据来分析气候变化下南极小须鲸在宇航员海栖息地的时空变化。主要研究目标为: (1) 确定影响南极小须鲸栖息地分布的主要环境因素; (2) 预测未来南极小须鲸的适宜栖息地分布情况; (3) 评估未来不同情景下气候变化对南极小须鲸栖息地的潜在影响。
1 材料与方法 1.1 数据来源 1.1.1 物种分布数据南极小须鲸的数据主要来源于中国南极第36和第37次科学考察以及世界数据中心地球科学与环境数据发布网PANGAEA (https://www.pangaea.de/)上的1993~2014年的数据, 原始分辨率为0.25°×0.25°, 重采样到0.1°×0.1°分辨率下, 每个网格只记一个数。由于数据均为调查观测数据, 几乎所有的数据采集在南半球夏半年, 也就是11月至次年3月。研究区域的范围纬度上为60°~70°S, 经度上为30°~65°E, 空间分辨率设定为0.1° × 0.1°。为了避免模型过度拟合, 随机删除两个点位间的距离小于0.1°的其中一个, 最终得到60个南极小须鲸在宇航员海分布点数据来构建MaxEnt模型(图 1)。
 |
| 图 1 南极小须鲸样本点分布图 Fig. 1 Distribution of Antarctic minke whale sampling points |
本研究中当前环境因子来自全球海洋再分析模拟(Global Ocean Reanalysis and Simulations Version2.4, GLORYS2V4) (http://www.mercator-ocean.fr)和欧洲中期天气预报中心(European Centre for Medium-Range Weather Forecasts, ECMWF)的第五代再分析数据(the 5th major atmospheric reanalysis produced by ECMWF, ERA5) (https://cds.climate.copernicus.eu/cdsapp#!/dataset/reanalysis-era5-single-levels?tab=overview)。分别计算其平均值、最大值和最小值作为环境因子。为了避免环境因子间的强相关性导致模型准确性降低, 运用SPSS (statistical product service solutions)软件对所有因子进行相关性分析, 剔除相关性较高(相关系数 > 0.8)的变量, 最终保留了16个环境因子(表 1)。所有环境因子为月均数据, 并统一到相同坐标系相同范围的0.1° × 0.1°分辨率。
| 环境因子 | 环境因子描述 | 单位 |
| chl | 叶绿素平均值(mean total chlorophyll) | mg/m3 |
| chlmin | 叶绿素最小值(min total chlorophyll) | mg/m3 |
| Fe | 溶解铁平均值(mean dissolved Iron) | mmol/m3 |
| ice | 海冰密集度平均值(mean sea ice concentration) | |
| mlpmax | 混合层深度最大值(max density ocean mixed layer thickness) | m |
| mlpmin | 混合层深度最小值(min density ocean mixed layer thickness) | m |
| mslmax | 海平面气压最大值(max sea level pressure) | Pa |
| Si | 溶解硅平均值(mean dissolved Silicate) | mmol/m3 |
| slhfmax | 表面潜热辐射最大值(max surface latent heat flux) | J/m2 |
| sshf | 表面感热辐射平均值(mean surface sensible heat flux) | J/m2 |
| sshfmin | 表面感热辐射最小值(min surface sensible heat flux) | J/m2 |
| ssrdmax | 表面向下辐射最大值(max surface solar radiation downwards) | J/m2 |
| ssrdmin | 表面向下辐射最小值(min surface solar radiation downwards) | J/m2 |
| tem | 温度平均值(mean temperature) | K |
| velocity | 北向速度平均值(mean northward velocity) | m/s |
| depth | 深度(depth) | m |
未来情景下环境变量采用CMIP6提供的MPI-ESM1-2-HR在historical情景以及排放路径为共享社会经济路径(SSP1-2.6、SSP2-4.5和SSP5-8.5)数据。Historical情景取的是1993~2014年中每年的1月、2月、3月、11月和12月的各环境因子值。未来变化情景中SSP1-2.6为低排放情景, 2100年辐射强迫稳定在2.6 W/m2; SSP2-4.5为中等排放情景, 2100年辐射强迫稳定在4.5 W/m2; SSP5-8.5为高排放情景, 2100年辐射强迫稳定在8.5 W/m2 (Riahi et al, 2017)。未来气候预测选择年21世纪中期(2029~2050年)和21世纪末期(2079~2100年)。本研究把CMIP6下1993~2014年的变量分别和2029~2050年与2079~2100年变量的差异分别叠加到GLORYS2V4和ERA5提供的当前环境变量上, 作为未来环境21世纪中期和末期的环境因子。
1.2 模型设置与评价标准本研究采用MaxEnt (3.4.1)软件来模拟南极小须鲸在宇航员海的潜在栖息地分布(Phillips et al, 2017)。将预处理好的分布数据和环境因子导入MaxEnt模型, 选取25%的分布数据作为测试集, 剩余的75%作为训练集, 设置10次重复, 其他参数为默认值, 其平均结果为最终结果。MaxEnt模型采用受试者工作曲线(receiver operating characteristic curve, ROC)来衡量模型的模拟精度, ROC曲线与横坐标取曲线下的面积值(area under ROC curve, AUC)反映模型的精确性。AUC的取值范围是0~1, 当0.5≤AUC < 0.6时, 表示预测失败; 当0.6≤AUC < 0.7时, 表示预测结果较差; 当0.7≤AUC < 0.8时, 表示预测结果一般; 当0.8≤ AUC < 0.9时, 表示预测结果好; 当0.9≤AUC≤1时, 表示预测结果非常好(Phillips et al, 2006; Nachtsheim et al, 2017)。MaxEnt模型的输出结果是一张发生概率(P)为0~1的适生程度图。对输出结果进行重分类: 不适生(P < 0.2)、低度适生(0.2≤P < 0.4)、中度适生(0.4≤P < 0.6)、高度适生(0.6≤P≤1)(Boitani et al, 2002; Elith et al, 2011)。
1.3 栖息地变化南极小须鲸新增和丢失的适生区域用来分析和比较不同时期和不同情景下栖息地的变化。新增区域为MaxEnt模型输出的值从小于0.2 (不适生)改变为大于或等于0.2 (包括低度适生、中度适生和高度适生)的区域; 丢失的区域为MaxEnt模型输出的值从大于或等于0.2 (包括低度适生、中度适生和高度适生)改变为小于0.2 (不适生)的区域; 不变的区域为概率值保持在0.2和1之间(包括低度适生、中度适生和高度适生)的区域或概率值保持在0.2以下(不适生)的区域。为了分析不同时期和不同情景下环境变化的情况, 在宇航员海南极小须鲸的主要适生区内对环境因子进行评估。选取对模型贡献最大的两个因子来分析环境变化对适生区变化的影响。
2 结果与分析 2.1 当前分布与环境贡献在当前气候情景下, 南极小须鲸栖息地预测模型的AUC平均值为0.916, 表明本研究中MaxEnt模型预测结果非常好。模型预测结果具有较高的可信度。南极小须鲸在宇航员海的栖息地主要分布在东部(图 2), 高度适生区分布在54°E以东, 纬度上分布较广, 存在于61°~67°S; 中度适生区主要分布在高度适生区的周围, 中部也存在一个中度适生区; 低度适生区分布在中度适生区的周围。低度适生区面积为143.13 × 103 km2, 占宇航员海总面积的9.65%, 中度适生区的面积为92.05 × 103 km2, 占总面积的6.21%, 高度适生区的面积为206.98 × 103 km2, 占总面积的13.96%。
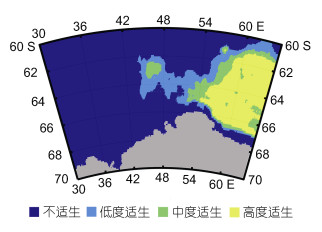 |
| 图 2 南极小须鲸在宇航员海的潜在分布 Fig. 2 The potential distribution of Antarctic minke whale in the Cosmonaut Sea |
根据MaxEnt模型输出的贡献率和刀切法分析结果(图 3), 对南极小须鲸栖息地模型贡献最大的三个环境因子分别是深度(depth)、海冰密集度(ice)和混合层深度最小值(minmlp), 贡献率分别为33.2%、15.7%和11.6%。仅使用单一环境因子时, 影响最大的环境因子为depth, 其次是ice。总体来看, depth、ice和minmlp是主要影响因子。
 |
| 图 3 各环境贡献率(a)和刀切法检验结果(b) Fig. 3 Contribution percentage of each environmental variable (a) and the results of jackknife test (b) |
由潜在适生程度对主要环境变量的响应曲线可以看出(图 4), 南极小须鲸的适生程度随着深度的加深而先增加后减小, 最大适生程度在−4 200 m处, 最佳适生程度的范围(P≥0.6)为−2 780~−4 631 m; 南极小须鲸的适生程度随着海冰密集度的增加而先增加后减小, 最大适生程度在0.409处, 最佳适生程度的范围为0.46以下; 南极小须鲸的适生程度随着混合层深度最小值的增加而先增加后减小, 最大适生程度在14 m处, 最佳适生程度的范围为13.2~16.5 m。
 |
| 图 4 主要环境因子响应曲线 Fig. 4 Curves of response to major environmental variables |
在气候变化情景下, 南极小须鲸的栖息地发生了显著的变化(图 5)。到21世纪中期, 在SSP1-2.6情景下, 高度适生区主要分布在东部和东北部, 中部也存在一定范围高度适生区, 东南部的适生区以中度适生区为主; 在SSP2-4.5情景下, 东部的适生区从南北向中间缩小, 适生区类型也以高度适生为主, 中部的高度适生区范围相较于SSP1-2.6情景下呈现增大趋势; 在SSP5-8.5情景下, 东部的高适生区范围变小, 中适生区和低度适生范围增加。到21世纪末期, 在SSP1-2.6情景下, 主要适生区仍存在于东部, 高度适生区向南收缩, 适生区类型以低度适生为主; 在SSP2-4.5情景下, 东部存在零星的高度适生区, 低度适生和中度适生成为主要类型; 在SSP5-8.5情景下, 南部有低度适生区和中度适生区, 东部的适生区以低度适生区为主, 高度适生区完全消失, 西部出现了低度适生区和中度适生区。总体来看, 在三种气候变化情景下, 高适生区范围随时间增加均呈减少的趋势(表 2), SSP1-2.6情景下减少得较少, SSP5-8.5情景下减少得最多。在SSP5-8.5情景下, 到21世纪末期高度适生区完全消失。
 |
| 图 5 21世纪中期(a, b, c)和21世纪末期(d, e, f)不同气候情景下南极小须鲸栖息地的分布 Fig. 5 Spatial distribution of suitable areas of Antarctic minke whale under three SSP scenarios in the mid 21st century (a, b, c) and late 21st century (d, e, f) |
| 情景 | 时间 | 面积/(×103 km2) |
| 当前 | 206.98 | |
| SSP1-2.6 | 21世纪中期 | 199.12 |
| 21世纪末期 | 139.89 | |
| SSP2-4.5 | 21世纪中期 | 153.36 |
| 21世纪末期 | 5.65 | |
| SSP5-8.5 | 21世纪中期 | 119.99 |
| 21世纪末期 | 0.00 |
南极小须鲸的栖息地在21世纪中期和末期的潜在变化如图 6所示。到21世纪中期, 在SSP1-2.6情景下, 新增的适生面积(117.90 × 103 km2)远多于损失的适生面积(45.40 × 103 km2)。新增的适生区分布在原适生区的周围, 主要为中度适生区和低度适生区。丢失的适生区主要分布在中部, 主要为低度适生区。在SSP2-4.5情景下, 丢失的面积(112.41 × 103 km2)是新增面积(60.69 × 103 km2)的1.85倍。新增的适生区分布在中部原有适生区的周围, 主要为中度适生区。丢失的适生区分布在东部原有的适生区的南边和北边, 主要为高度适生区和低度适生区。在SSP5-8.5情景下, 新增的面积(82.73 × 103 km2)多于丢失的面积(44.29 × 103 km2), 新增的适生区主要位于宇航员海的西部和原有适生区的南部, 主要为低度适生区。丢失的适生区主要分布在原有适生区的北边缘, 主要为高度适生区。
 |
| 图 6 三种SSP情景下南极小须鲸潜在栖息地分布的变化 Fig. 6 Changes in the potential geographical distribution of Antarctic minke whale under three SSP scenarios 注: a~c是从当前到21世纪中期; d~f是从21世纪中期到21世纪末期 |
到21世纪末期, 相较于21世纪中期来说, 在SSP1-2.6情景下, 丢失的面积(178.19 × 103 km2)是新增面积(60.11 × 103 km2)的2.96倍。新增的适生区主要分布在西侧, 主要为低度适生区和中度适生区。丢失的适生区主要分布在原有适生区的北部, 主要为高度适生区。在SSP2.-4.5情景下, 丢失的面积(178.01 × 103 km2)是新增面积(87.53 × 103 km2)的2.03倍。新增的适生区主要位于东南部, 主要为低度适生区和中度适生区。丢失的适生区主要分布在中部, 主要为高度适生区和中度适生区。在SSP5-8.5情景下, 丢失的面积(281.09 × 103 km2)是新增面积(97.41 × 103 km2)的2.89倍。新增的适生区主要分布在西南部, 主要为低度适生区和中度适生区。丢失的适生区主要分布在原有适生区的中部和北部, 主要为中度适生区和高度适生区。
南极小须鲸的栖息地类型从当前到21世纪中期和从21世纪中期到末期的变化如图 7和图 8所示。从当前到21世纪中期, 在SSP1-2.6情景下, 丢失的高度适生区主要变成了中度适生区, 也有相当一部分中度适生区变成了高度适生区; 在SSP2-4.5情景下, 丢失的高度适生区多于SSP1-2.6情景下的, 主要变成了中度适生区和低度适生区, 中度适生区主要变成了高度适生区和低度适生区; 在SSP5-8.5情景下, 丢失的高度适生区面积大于保留下来的, 丢失的高度适生区大部分变成了中度适生区。从21世纪中期到末期, 在SSP1-2.6情景下, 大部分高度适生区保留下来, 丢失的主要变成了中度适生区和低度适生区, 中度适生区大部分变成了低度适生区; 在SSP2-4.5情景下, 高度适生区大部分变成了中度适生区、低度适生区和不适生区; 在SSP5-8.5情景下, 高度适生区完全消失, 中度适生区主要变成了低度适生区和不适生区。排放等级越高, 越多的高度适生区变成更低等的适生区。
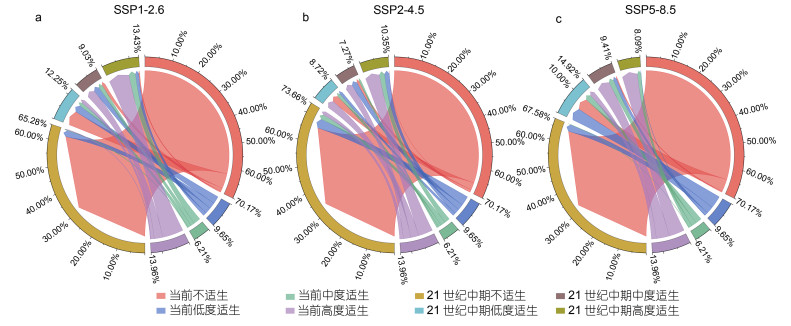 |
| 图 7 从当前到21世纪中期, 三种情景下不同类型适生区域的变化 Fig. 7 Changes in different types of suitable areas under three SSP scenarios from the present to the mid 21st century 注: 百分比的含义是某一类的适生区面积占总面积的比例 |
 |
| 图 8 从21世纪中期到末期, 三种情景下不同类型适生区域的变化 Fig. 8 Changes in different types of suitable areas under three SSP scenarios from the mid 21st century to the last 21st century 注: 百分比的含义是某一类的适生区面积占总面积的比例 |
总体来看, 在21世纪中期和末期南极小须鲸的栖息地主要分布在东部。从当前到21世纪中期再到末期, 南极小须鲸的适生面积持续减小, 并且从21世纪中期到末期的栖息地减少的速率快于从当前到21世纪中期的减小的速率。从不同情景来看, SSP1-2.6情景下南极小须鲸的适生面积减少最少, SSP5-8.5情景下, 适生面积减少最多, 高排放情景对南极小须鲸生存不利。
2.4 环境变化对栖息地演变的影响本研究对模型贡献最大的环境因子是深度, 由于深度作为地形参考在未来基本没有变化, 为了更好地分析南极小须鲸的栖息地的分布与环境因子的关系, 选取对模型贡献第二大的海冰密集度和贡献第三大的混合层深度最小值分析环境变化对适生区变化的影响(图 9)。分析区域选取南极小须鲸栖息地的主要分布区域(60°~70°S, 54°~60°E)。在所有情景下, 混合层深度最小值随时间增大, 海冰密集度随时间减小(表 3)。在SSP1-2.6情景下, 21世纪中期和末期的混合层深度最小值的平均值和海冰密集度的平均值都处于最优范围内。南极小须鲸的栖息地分布在最优环境内的比例略低于当前的分布比例。在SSP2-4.5情景下, 21世纪中期和末期的海冰密集度的平均值超出了最优范围, 南极小须鲸的栖息地分布在最优环境内的比例相比于当前的分布比例大幅减小。在SSP5-8.5情景下, 21世纪中期和末期的海冰密集度大幅减小, 减小后的平均值在最优范围之外。到21世纪末期南极小须鲸的最优适生环境完全消失。因此, 海冰密集度的减小是南极小须鲸栖息地丢失的主要原因。总的来说, 低排放情景对南极小须鲸未来的栖息地的影响较小, 中等排放情景和高排放情景对南极小须鲸未来的栖息地存在威胁。
 |
| 图 9 在不同情景和不同时期下南极小须鲸分布区主要影响因子变化 Fig. 9 Changes in key factors in the distribution area Antarctic minke whales under three SSP scenarios and periods 注: 包围的区域是高度适生区在主要影响因子上的分布 |
| 情景 | 时间 | 混合层深度最小值的最优范围/m | 混合层深度最小值的平均值/m | 海冰密集度的最优范围 | 海冰密集度的平均值 | 栖息地在最优环境内的比例/% |
| 当前 | 13.00~20.00 | 15.21 | 0.40~0.59 | 0.52 | 10.83 | |
| SSP126 | 21世纪中期 | 12.35~19.26 | 15.48 | 0.33~0.55 | 0.49 | 8.50 |
| 21世纪末期 | 13.73~17.98 | 15.97 | 0.33~0.52 | 0.47 | 7.26 | |
| SSP245 | 21世纪中期 | 13.78~18.52 | 15.78 | 0.33~0.46 | 0.48 | 5.74 |
| 21世纪末期 | 15.73~17.72 | 16.60 | 0.34~0.40 | 0.44 | 0.29 | |
| SSP585 | 21世纪中期 | 12.98~17.83 | 15.77 | 0.31~0.43 | 0.47 | 6.03 |
| 21世纪末期 | - | 16.68 | - | 0.42 | - | |
| 注: “-”表示没有值 | ||||||
物种的栖息地分布是认识和研究该物种的必要信息之一。对鲸的潜在栖息地分布及气候变化对其影响的分析, 有助于有效地管理和保护鲸以及整个海洋生态系统(Kanaji et al, 2015)。本研究运用MaxEnt模型对宇航员海的南极小须鲸的潜在栖息地进行了预测, 验证结果表明模型预测结果非常好。根据MaxEnt模型输出的结果发现深度、海冰密集度和混合层深度最小值是影响栖息地分布的主要因素, 累积贡献为60.5%。南极小须鲸属于大型哺乳动物, 其栖息地对水深有一定的要求(Lee et al, 2017), 水深是重要的影响因子。在未来虽然有平均海平面的变化但相对于水深来说可以忽略, 因此, 本研究不考虑水深变化对南极小须鲸栖息地变化的影响。
在全球变暖背景下, 南极海冰大范围退缩, 这种变化会使磷虾、企鹅和鲸等诸多与海冰息息相关的生物的栖息地减少(Massom et al, 2010; Steinberg et al, 2015)。南极小须鲸经常在有海冰的海域被发现, 栖息地与海冰分布密切相关(Ainley et al, 2007; Scheidat et al, 2011; Williams et al, 2014)。首先, 南极小须鲸的觅食空间与浮冰出现的位置高度相关(Lee et al, 2017), 这种高度相关性可能与南极小须鲸的食物组成有关。南极小须鲸主要以南极磷虾为食, 漂浮的海冰下附着的大量的冰藻是南极磷虾越冬的食物, 浮冰周围南极磷虾的丰度大(Ainley, 2003; Atkinson et al, 2006; Ishikawa et al, 2022), 南极小须鲸还会吃冰磷虾和南极银鱼, 这些生物也大量出现在海冰边缘(Ichii et al, 1998), 所以浮冰海域是南极小须鲸理想的觅食地。其次, 南极小须鲸的体型较小, 这使得它们可以在狭窄的浮冰间隙进行捕食, 同时也避免与像座头鲸(Megaptera novaeangliae)这种大型鲸竞争食物(Thiele et al, 2000; Ainley, 2003)。最后, 南极小须鲸喜欢有海冰的栖息地也与躲避捕食者有关, 在海冰覆盖的区域可以躲避虎鲸的追杀(Pitman et al, 2003)。
混合层是海洋上层各项物理性质均一的水体。混合层内有相对充足的光照和丰富的营养盐如硝酸盐、磷酸盐等微量元素, 有利于光合作用, 促进浮游植物的生长, 为整个海洋提供初级生产力(Sverdrup, 1953; Ohlmann et al, 1996)。因此, 依赖浮游植物生存的南极磷虾在混合层内充分生长, 次级生产力大大升高, 并引来鲸等顶级捕食者(Orsi et al, 1995)。混合层深度的变化, 会影响浮游生物的产生, 从而影响整个海洋食物网(Polovina et al, 1995)。虽然更深的混合层可能通过提供更深层的营养物质来增加浮游植物的产量, 但是随着深度的增加光照强度会变弱, 会影响浮游植物的光合作用, 混合层深度与初级生产力呈非线性的关系(Vernet et al, 2008; Schofield et al, 2018)。Vernet等(2008)发现初级生产与夏季混合层深度的关系有空间差异性, 在陆架中部较高的初级生产力与浅的夏季混合层深度相关, 在近岸海域初级生产力与较深的夏季混合层相关。宇航员海的北部受南极绕极流(Antarctic circumpolar current, ACC)的影响(Bibik et al, 1988)。ACC内主要是绕极深层水(circumpolar deep water, CDW), CDW始于低纬度地区, 向南流动, 最终在南极附近上升流入混合层中(Sievers et al, 1984; De Baar et al, 1995; Orsi et al, 1995)。宇航员海的混合层里是高热、高盐和高营养的CDW, 因此, 初级生产力高, 南极磷虾丰度大, 南极小须鲸资源丰富。全球变暖背景下, 虽然宇航员海混合层深度变浅, 但南极小须鲸的最佳适生程度的范围仍在减小后的混合层深度最小值内, 对栖息地变化没有明显的影响。
3.2 栖息地减少全球变暖背景下, 海温升高、海冰覆盖下降等这些环境变化都给海洋哺乳动物带来了不利影响, 其中栖息地的变化是最直观的影响(Simmonds et al, 2007; Chambault et al, 2018; Derville et al, 2019; Albouy et al, 2020)。Derville等(2019)调查了座头鲸在大洋洲的繁殖栖息地对气候变化的适应性, 预测表明, 到21世纪末, 现有的许多繁殖地将变得不适合座头鲸, 而在大洋洲南部出现了适合座头鲸的栖息地。在北极, 白喙海豚(Lagenorhynchus albirostris)也被观测到栖息地范围缩小, 并且数量明显下降(Macleod et al, 2005)。白喙海豚通常生活在欧洲西北部200 m以浅的冷水中, 它们通过寻找新的栖息地来应对气候变化可能会受到限制, 因为再往北缺乏合适的陆架水域, 因此, 气候变暖可能会对白喙海豚产生严重影响(Elliott et al, 2007)。我们的研究结果表明, 在未来南极小须鲸在宇航员海的栖息地范围会缩小。甚至在高排放情景下, 到本世纪末, 南极小须鲸在宇航员海的高度适生的栖息地完全消失。这与前人的大型哺乳动物在未来的栖息地的变化的观点相符。同时我们也发现在宇航员海西部区域由于海冰密集度减小到最佳适生范围内, 出现了低度适生区和中度适生区。我们的研究目前只探究了南极小须鲸的栖息地未来在宇航员海的分布情况, 它们是否会迁移到南半球的其他海域, 是下一步的研究方向。
4 结论本研究运用MaxEnt模型, 研究了在不同气候情景下宇航员海南极小须鲸到21世纪中期和末期潜在栖息地分布和变化。南极小须鲸主要分布在宇航员海的东部, 影响南极小须鲸栖息地分布的主要环境因子是深度、海冰密集度和混合层深度最小值。在21世纪中期和末期, 南极小须鲸的栖息地仍分布在宇航员海的东部, 但是栖息地的范围会缩小。在不同情景下, 到21世纪中期失去的栖息地主要分布在原有栖息地的北部, 从21世纪中期到末期失去的栖息地面积远大于前一个时期, 失去的栖息地主要分布在21世纪中期存在的栖息地的北部和中部。宇航员海的海冰密集度在未来会随时间逐渐减小, 这是造成栖息地减少的主要原因。从时间上看, 后半个世纪南极小须鲸的栖息地减少的速率快于前半个世纪; 从不同排放情景看, 高排放情景下南极小须鲸的栖息地减少的速率快于低排放情景。到本世纪末, 中排放情景和高排放情景下的宇航员海已不适合南极小须鲸生存。
ADAMCZAK S K, MCLELLAN W A, READ A J, et al, 2021. The impact of temperature at depth on estimates of thermal habitat for short-finned pilot whales. Marine Mammal Science, 37(1): 193-206 DOI:10.1111/mms.12737 |
AHMED S E, MCINERNY G, O'HARA K, et al, 2015. Scientists and software–surveying the species distribution modelling community. Diversity and Distributions, 21(3): 258-267 DOI:10.1111/ddi.12305 |
AINLEY D G, DUGGER K M, TONIOLO V, et al, 2007. Cetacean occurrence patterns in the Amundsen and southern Bellingshausen Sea sector, Southern Ocean. Marine Mammal Science, 23(2): 287-305 DOI:10.1111/j.1748-7692.2007.00109.x |
AINLEY D G, TYNAN C T, STIRLING I, 2003. Sea ice: a critical habitat for polar marine mammals and birds [M] // THOMAS D, DIECKMANN G. Sea Ice: An Introduction to its Physics, Chemistry, Biology, and Geology. Oxford: Blackwell Science: 240-266.
|
ALBOUY C, DELATTRE V, DONATI G, et al, 2020. Global vulnerability of marine mammals to global warming. Scientific Reports, 10(1): 548 DOI:10.1038/s41598-019-57280-3 |
APOLLONIO S, 2002. Hierarchical Perspectives on Marine Complexities: Searching for Systems in the Gulf of Maine. New York: Columbia University Press, 121-132
|
ATKINSON A, SHREEVE R S, HIRST A G, et al, 2006. Natural growth rates in Antarctic krill (Euphausia superba): Ⅱ. Predictive models based on food, temperature, body length, sex, and maturity stage. Limnology and Oceanography, 51(2): 973-987 DOI:10.4319/lo.2006.51.2.0973 |
BIBIK V A, MASLENNIKOV V V, PELEVIN A S, et al, 1988. The current system and the distribution of waters of different modifications in the Cooperation and Cosmonaut Seas [M] // MAKAROV R R. Interdisciplinary investigations of pelagic ecosystem in the Commonwealth and Cosmonaut Seas. Moscow, Russia: VNIRO Press: 16-43.
|
BOITANI L, CORSI F, FALCUCCI A, et al, 2002. Rete ecologica nazionale. Un approccio alla conservazione dei vertebrati italiani [R]. Relazione finale Ministero dell'ambiente e della tutela del territorio [National Ecological Network. An approach to the conservation of Italian vertebrates. Final report of the Ministry of the Environment and of the Territory: 1–114.
|
BUSHUEV S G, 1986. Feeding of minke whales, Balaenoptera acutorostrata, in the Antarctic [R]. Report of the International Whaling Commission, 36: 241-245.
|
BYEON D H, JUNG S, LEE W H, 2018. Review of CLIMEX and MaxEnt for studying species distribution in South Korea. Journal of Asia-Pacific Biodiversity, 11(3): 325-333 DOI:10.1016/j.japb.2018.06.002 |
CARTWRIGHT R, VENEMA A, HERNANDEZ V, et al, 2019. Fluctuating reproductive rates in Hawaii's humpback whales, Megaptera novaeangliae, reflect recent climate anomalies in the North Pacific. Royal Society Open Science, 6(3): 181463 DOI:10.1098/rsos.181463 |
CHAMBAULT P, ALBERTSEN C M, PATTERSON T A, et al, 2018. Sea surface temperature predicts the movements of an Arctic cetacean: the bowhead whale. Scientific Reports, 8(1): 9658 DOI:10.1038/s41598-018-27966-1 |
DAVIS L, 2019. Effects of sea surface temperature on the distribution of short-finned pilot whales (Globicephala macrorhynchus) in the Western North Atlantic Ocean [D]. Durham: Duke University.
|
DE BAAR H J W, DE JONG J T M, BAKKER D C E, et al, 1995. Importance of iron for plankton blooms and carbon dioxide drawdown in the Southern Ocean. Nature, 373(6513): 412-415 DOI:10.1038/373412a0 |
DERVILLE S, TORRES L G, ALBERTSON R, et al, 2019. Whales in warming water: Assessing breeding habitat diversity and adaptability in Oceania's changing climate. Global Change Biology, 25(4): 1466-1481 DOI:10.1111/gcb.14563 |
ELITH J, PHILLIPS S J, HASTIE T, et al, 2011. A statistical explanation of MaxEnt for ecologists. Diversity and Distributions, 17(1): 43-57 DOI:10.1111/j.1472-4642.2010.00725.x |
ELLIOTT W, SIMMONDS M, 2007. Whales in Hot Water? The Impact of a Changing Climate on Whales, Dolphins and Porpoises: a Call For Action. Gland Switzerland: World Wildlife Fund International
|
ETOURNEAU J, SGUBIN G, CROSTA X, et al, 2019. Ocean temperature impact on ice shelf extent in the eastern Antarctic Peninsula. Nature Communications, 10(1): 304 DOI:10.1038/s41467-018-08195-6 |
FENG J L, LIU L L, LIU Q L, et al, 2022. The potential distribution of adult Antarctic krill in the Amundsen Sea. Journal of Oceanology and Limnology, 40(4): 1566-1577 DOI:10.1007/s00343-021-1181-z |
FRANKLIN J, MILLER J A, 2010. Mapping Species Distributions: Spatial Inference and Prediction. Cambridge: Cambridge University Press
|
FRIEDLAENDER A S, GOLDBOGEN J A, NOWACEK D P, et al, 2014. Feeding rates and under-ice foraging strategies of the smallest lunge filter feeder, the Antarctic minke whale (Balaenoptera bonaerensis). Journal of Experimental Biology, 217(16): 2851-2854 DOI:10.1242/jeb.106682 |
HEIDE-JøRGENSEN M P, BLACKWELL S B, WILLIAMS T M, et al, 2020. Some like it cold: Temperature-dependent habitat selection by narwhals. Ecology and Evolution, 10(15): 8073-8090 DOI:10.1002/ece3.6464 |
HERR H, KELLY N, DORSCHEL B, et al, 2019. Aerial surveys for Antarctic minke whales (Balaenoptera bonaerensis) reveal sea ice dependent distribution patterns. Ecology and Evolution, 9(10): 5664-5682 DOI:10.1002/ece3.5149 |
HU W J, DU J G, SU S K, et al, 2022. Effects of climate change in the seas of China: Predicted changes in the distribution of fish species and diversity. Ecological Indicators, 134: 108489 DOI:10.1016/j.ecolind.2021.108489 |
HUNT B P V, PAKHOMOV E A, TROTSENKO B G, 2007. The macrozooplankton of the Cosmonaut Sea, east Antarctica (30°E–60°E), 1987–1990. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 54(7): 1042-1069 DOI:10.1016/j.dsr.2007.04.002 |
ICHII T, KATO H, 1991. Food and daily food consumption of southern minke whales in the Antarctic. Polar Biology, 11(7): 479-487 |
ICHII T, SHINOHARA N, FUJISE Y, et al, 1998. Interannual changes in body fat condition index of minke whales in the Antarctic. Marine Ecology Progress Series, 175: 1-12 DOI:10.3354/meps175001 |
ISHIKAWA H, OTSUKI M, TAMURA T, et al, 2022. Foraging ecology of mature male Antarctic minke whales (Balaenoptera bonaerensis) revealed by stable isotope analysis of baleen plates. Polar Science, 31: 100785 DOI:10.1016/j.polar.2021.100785 |
KANAJI Y, OKAZAKI M, KISHIRO T, et al, 2015. Estimation of habitat suitability for the southern form of the short-finned pilot whale (Globicephala macrorhynchus) in the North Pacific. Fisheries Oceanography, 24(1): 14-25 DOI:10.1111/fog.12074 |
KATO H, FUJISE Y, 2000. Dwarf minke whales: morphology, growth and life history with some analyses on morphometric variation among the different forms and regions [C]. Paper SC/52/OS3 presented to the IWC Scientifc Committee, June 2000, in Adelaide, Australia.
|
LEE J F, FRIEDLAENDER A S, OLIVER M J, et al, 2017. Behavior of satellite-tracked Antarctic minke whales (Balaenoptera bonaerensis) in relation to environmental factors around the western Antarctic Peninsula. Animal Biotelemetry, 5(1): 23 DOI:10.1186/s40317-017-0138-7 |
LEZAMA-OCHOA N, MURUA H, CHUST G, et al, 2016. Present and future potential habitat distribution of Carcharhinus falciformis and Canthidermis maculata by-catch species in the tropical tuna purse-seine fishery under climate change. Frontiers in Marine Science, 3: 34 |
MACLEOD C D, BANNON S M, PIERCE G J, et al, 2005. Climate change and the cetacean community of north-west Scotland. Biological Conservation, 124(4): 477-483 DOI:10.1016/j.biocon.2005.02.004 |
MARTINSON D G, STAMMERJOHN S E, IANNUZZI R A, et al, 2008. Western Antarctic Peninsula physical oceanography and spatio–temporal variability. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 55(18/19): 1964-1987 |
MASSOM R A, STAMMERJOHN S E, 2010. Antarctic sea ice change and variability–physical and ecological implications. Polar Science, 4(2): 149-186 DOI:10.1016/j.polar.2010.05.001 |
NACHTSHEIM D A, JEROSCH K, HAGEN W, et al, 2017. Habitat modelling of crabeater seals (Lobodon carcinophaga) in the Weddell Sea using the multivariate approach Maxent. Polar Biology, 40(5): 961-976 DOI:10.1007/s00300-016-2020-0 |
OHLMANN J C, SIEGEL D A, GAUTIER C, 1996. Ocean mixed layer radiant heating and solar penetration: a global analysis. Journal of Climate, 9(10): 2265-2280 DOI:10.1175/1520-0442(1996)009<2265:OMLRHA>2.0.CO;2 |
ORSI A H, WHITWORTH III T, NOWLIN JR W D, 1995. On the meridional extent and fronts of the Antarctic Circumpolar Current. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 42(5): 641-673 DOI:10.1016/0967-0637(95)00021-W |
PARRY G D, 1981. The meanings of r- and K-selection. Oecologia, 48(2): 260-264 DOI:10.1007/BF00347974 |
PHILLIPS S J, ANDERSON R P, DUDÍK M, et al, 2017. Opening the black box: an open-source release of Maxent. Ecography, 40(7): 887-893 DOI:10.1111/ecog.03049 |
PHILLIPS S J, ANDERSON R P, SCHAPIRE R E, 2006. Maximum entropy modeling of species geographic distributions. Ecological Modelling, 190(3/4): 231-259 |
PITMAN R L, ENSOR P, 2003. Three forms of killer whales (Orcinus orca) in Antarctic waters. Journal of Cetacean Research and Management, 5(2): 131-139 |
POLOVINA J J, MITCHUM G T, EVANS G T, 1995. Decadal and basin-scale variation in mixed layer depth and the impact on biological production in the Central and North Pacific, 1960-88. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 42(10): 1701-1716 DOI:10.1016/0967-0637(95)00075-H |
RIAHI K, VAN VUUREN D P, KRIEGLER E, et al, 2017. The shared socioeconomic pathways and their energy, land use, and greenhouse gas emissions implications: an overview. Global Environmental Change, 42: 153-168 DOI:10.1016/j.gloenvcha.2016.05.009 |
RISCH D, NORRIS T, CURNOCK M, et al, 2019. Common and Antarctic minke whales: conservation status and future research directions. Frontiers in Marine Science, 6: 247 DOI:10.3389/fmars.2019.00247 |
ROMAN J, ESTES J A, MORISSETTE L, et al, 2014. Whales as marine ecosystem engineers. Frontiers in Ecology and the Environment, 12(7): 377-385 DOI:10.1890/130220 |
ROMAN J, MCCARTHY J J, 2010. The whale pump: marine mammals enhance primary productivity in a coastal basin. PLoS One, 5(10): e13255 DOI:10.1371/journal.pone.0013255 |
SCHEIDAT M, FRIEDLAENDER A, KOCK K H, et al, 2011. Cetacean surveys in the Southern Ocean using icebreaker-supported helicopters. Polar Biology, 34(10): 1513-1522 DOI:10.1007/s00300-011-1010-5 |
SCHOFIELD O, BROWN M, KOHUT J, et al, 2018. Changes in the upper ocean mixed layer and phytoplankton productivity along the West Antarctic Peninsula. Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences, 376(2122): 20170173 DOI:10.1098/rsta.2017.0173 |
SIEVERS H A, NOWLIN JR W D, 1984. The stratification and water masses at Drake Passage. Journal of Geophysical Research: Oceans, 89(C6): 10489-10514 DOI:10.1029/JC089iC06p10489 |
SIMMONDS M P, ISAAC S J, 2007. The impacts of climate change on marine mammals: early signs of significant problems. Oryx, 41(1): 19-26 DOI:10.1017/S0030605307001524 |
SPRINGER A M, ESTES J A, VAN VLIET G B, et al, 2003. Sequential megafaunal collapse in the North Pacific Ocean: an ongoing legacy of industrial whaling?. Proceedings of the National Academy of Sciences of the United States of America, 100(21): 12223-12228 DOI:10.1073/pnas.1635156100 |
STAMMERJOHN S E, MARTINSON D G, SMITH R C, et al, 2008. Sea ice in the western Antarctic Peninsula region: Spatio-temporal variability from ecological and climate change perspectives. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 55(18/19): 2041-2058 |
STEINBERG D K, RUCK K E, GLEIBER M R, et al, 2015. Long-term (1993–2013) changes in macrozooplankton off the Western Antarctic Peninsula. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 101: 54-70 DOI:10.1016/j.dsr.2015.02.009 |
SVERDRUP H U, 1953. On conditions for the vernal blooming of phytoplankton. ICES Journal of Marine Science, 18(3): 287-295 DOI:10.1093/icesjms/18.3.287 |
THIELE D, CHESTER E T, GILL P C, 2000. Cetacean distribution off Eastern Antarctica (80–150°E) during the Austral summer of 1995/1996. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 47(12/13): 2543-2572 |
VERNET M, MARTINSON D, IANNUZZI R, et al, 2008. Primary production within the sea-ice zone west of the Antarctic Peninsula: I—Sea ice, summer mixed layer, and irradiance. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 55(18/19): 2068-2085 |
WILLIAMS R, GRAND J, HOOKER S K, et al, 2014. Prioritizing global marine mammal habitats using density maps in place of range maps. Ecography, 37(3): 212-220 DOI:10.1111/j.1600-0587.2013.00479.x |
 2023, Vol. 54
2023, Vol. 54


