中国海洋湖沼学会主办。
文章信息
- 范云庭, 郑江, 薄军, 江兴龙, 刘慧敏, 黄将远. 2023.
- FAN Yun-Ting, ZHENG Jiang, BO Jun, JIANG Xing-Long, LIU Hui-Min, HUANG Jiang-Yuan. 2023.
- 基于核酸适配体的差减荧光法检测鳗弧菌(Vibrio anguillarum)
- DETECTION OF VIBRIO ANGUILLARUM BY DIFFERENTIAL FLUORESCENCE METHOD USING APTAMER
- 海洋与湖沼, 54(1): 296-302
- Oceanologia et Limnologia Sinica, 54(1): 296-302.
- http://dx.doi.org/10.11693/hyhz20220600172
文章历史
-
收稿日期:2022-06-28
收修改稿日期:2022-08-08
2. 鳗鲡现代产业技术教育部工程研究中心 福建厦门 361021;
3. 自然资源部海洋第三研究所 福建厦门 361005
2. Engineering Research Center of the Modern Technology for Eel Industry, Ministry of Education, Xiamen 361021, China;
3. Third Institute of Oceanography, Ministry of Natural Resources, Xiamen 361005, China
鳗弧菌(Vibrio anguillarum)隶属于弧菌科、弧菌属, 生物学形态为短杆状、两端钝圆、弯曲呈弧形, 是一种致病性较高的革兰氏阴性菌(Hickey et al, 2018)。鳗弧菌可以感染多种鱼类、虾类和贝类, 对水产养殖和食品安全都有巨大的危害(王金龙等, 2020)。对鳗弧菌进行快速的检测, 是其病害防治的前提和基础。目前, 针对鳗弧菌等弧菌的检测方法主要有微生物培养法(Da-Silva et al, 2018), 以基因为靶点的分子生物学法(孙晶晶等, 2015; Luo et al, 2018; Kim et al, 2019), 以及以抗体为基础的免疫检测法(吴斌等, 2016; Zhang et al, 2016; Yonekita et al, 2020; 王晓瑞等, 2021; 吴美娇等, 2021)。微生物培养法耗时较长, 检测限通常在103或104 CFU/mL左右, 灵敏度不高, 难以定量。分子生物学法在区分同源性较高的弧菌时效果不够理想(Sawabe et al, 2007; Wei et al, 2014)。而抗体等免疫检测法则受抗体蛋白的制备、稳定性等因素影响较大, 实际应用中常常受到不同程度的限制。因此, 寻找和开发更为理想的针对鳗弧菌的检测技术变得尤为重要。
核酸适配体(Aptamer)是通过SELEX技术(Systematic Evolution of Ligands by Exponential enrichment)筛选出的一类寡核苷酸分子(赵丽萍等, 2020)。它对靶目标有较高的亲和特异性, 具有分子量小、易修饰、组织渗透率高和靶目标范围广等诸多优点(Muhammad et al, 2021), 在金属离子、小分子、蛋白质、细菌和细胞等靶目标的检测分析中都得到广泛应用(刘若冰等, 2020; 曲瑶等, 2020; 孙淼等, 2020; 赵晨等, 2020; 杜彩溢等, 2021; Yu et al, 2021)。因此, 筛选鳗弧菌的核酸适配体, 并将其应用于鳗弧菌的检测, 将有望获得较好的检测效果。
本文利用前期获得的对鳗弧菌有较好亲和特异性的核酸适配体(郑江等, 2022), 建立了可定量检测鳗弧菌的技术——“差减荧光法”。该方法利用鳗弧菌特异性地结合溶液中带有荧光标记的核酸适配体, 使溶液的荧光值下降, 而且该荧光下降幅度与鳗弧菌浓度成正比, 因此通过检测溶液中荧光强度的变化就可以实现对鳗弧菌的定量检测。文中进一步研究了该方法的特异性和定量检测效果, 并通过加标回收法对海水和鱼体组织进行了检测验证。相关研究对于鳗弧菌的病害防治以及核酸适配体的应用开发都具有重要意义。
1 材料与方法 1.1 材料 1.1.1 核酸适配体核酸适配体为先前筛选并验证的鳗弧菌核酸适配体H5 (郑江等, 2022), 序列为5′-TCAGTCGCTTCGCCGTCTCCTTCTCCCTCTTGTGCTCCCTCTTGTGCAGCCT GAGCACAAGAGGGA GACCCCAGAGGG-3′, 在其5′端标记FAM荧光基团, 核酸适配体的合成及荧光基团的标记均由生工生物工程(上海)股份有限公司完成。
1.1.2 人工海水和养殖鳗鲡速溶海水晶溶解于超纯水中, 并用盐度计标定, 配制出人工海水, 速溶海水晶购买自济南衍德生物科技有限公司。欧洲鳗鲡(Anguilla anguilla)由集美大学龙舟池水产试验场提供。
1.1.3 实验用菌和培养基鳗弧菌(Vibrio anguillarum)、溶藻弧菌(Vibrio alginolyticus)、哈维氏弧菌(Vibrio harveyi)、迟钝爱德华氏菌(Edwardsiella tarda)、大肠杆菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa)、变形假单胞菌(P. plecoglossicida)和嗜水气单胞菌(Aeromonas hydrophila)均由集美大学病原微生物实验室提供。胰蛋白胨大豆肉汤培养基(TSB培养基), 用于鳗弧菌、溶藻弧菌、哈维氏弧菌、迟钝爱德华氏菌和嗜水气单胞菌的培养; LB培养基(Luria-Bertani培养基), 用于大肠杆菌、铜绿假单胞菌和变形假单胞菌的培养。
1.1.4 结合缓冲液20×结合缓冲液: NaCl 5.844 g、KCl 3.725 g、Tris-HCl 6.06 g、MgCl2·6H2O 2.033 g, 超纯水定容至100 mL, 调pH至7.4。使用时用超纯水稀释为2×和1×结合缓冲液。
1.2 特异性研究 1.2.1 荧光显微镜的定性观察将浓度为300 nmol/L的标记了荧光基团的核酸适配体置于金属浴95 ℃加热5 min, 冰浴10 min。用2×结合缓冲液将6种细菌(迟钝爱德华氏菌、溶藻弧菌、嗜水气单胞菌、哈维氏弧菌、大肠杆菌和鳗弧菌)分别稀释至108 CFU/mL。然后取上述菌的悬液各100 μL与100 μL的核酸适配体结合, 作为实验组; 另取100 μL 2×结合缓冲液代替核酸适配体, 与100 μL菌液结合, 作为对照组。实验组和对照组一同在常温25 ℃下、100 r/min摇床孵育30 min, 随后6 000 r/min离心5 min, 弃上清, 1×结合缓冲液洗涤菌沉淀3次, 洗去未结合的核酸适配体, 再用100 μL 1×结合缓冲液悬浮菌沉淀。玻片用无菌超纯水和酒精冲洗后烘干, 取1~3 μL菌悬液样品, 沿着一条斜线进行涂片, 再用酒精灯烘干固定, 冷却后, 用番红染色液染色1~3 min, 再用无菌超纯水洗掉染色液。晾干后置于荧光显微镜下观察, 并在亮度为71%, 伽马值为0.65, 荧光强度为2档的条件下分别拍摄明场和荧光场下的图片。
1.2.2 差减荧光法检测将浓度为100 nmol/L的核酸适配体置于金属浴95 ℃加热5 min, 冰浴10 min, 后续核酸适配体使用前都依此法处理。用2×结合缓冲液将8种细菌(溶藻弧菌、哈维氏弧菌、铜绿假单胞菌、变形假单胞菌、嗜水气单胞菌、迟钝爱德华氏菌、大肠杆菌和鳗弧菌)分别稀释至105 CFU/mL。然后取上述菌的悬液各300 μL与100 μL的核酸适配体结合, 作为实验组; 另取300 μL的2×结合缓冲液代替菌悬液, 与100 μL的核酸适配体结合, 作为对照组。实验组和对照组都各3个平行。实验组和对照组一同在常温25 ℃下、200 r/min摇床孵育1 h, 随后6 000 r/min离心取上清液用Qubit3.0荧光定量仪测定实验组和对照组的荧光强度, 则细菌结合的荧光值=对照组平均荧光值-实验组平均荧光值。
1.3 定量研究及其工作曲线将鳗弧菌用2×结合缓冲液分别稀释至浓度为1、10、102、103、104、105、106、107和108 CFU/mL, 然后取100 μL 100 nmol/L的核酸适配体分别与300 μL上述各浓度的鳗弧菌悬液结合, 作为实验组; 对照组与特异性研究中的相同, 实验组和对照组也都各3个平行。之后按照1.2.2的差减荧光法进行检测, 得到鳗弧菌结合的荧光值, 然后以鳗弧菌浓度的常用对数为横坐标, 以其结合的荧光值为纵坐标, 作图并进行线性拟合, 可得到相应的工作曲线及其拟合方程。
1.4 海水样品的检测为了研究该方法对海水样品中鳗弧菌的检测效果, 选用不同盐度的海水样品进行加标回收实验。先配制盐度为20、30、35和40的人工海水样品, 然后分别取浓度为2×102和2×103 CFU/mL的菌悬液各2 mL与2 mL上述不同盐度的海水样品混合配制成加标样品, 此时加标样品中鳗弧菌的浓度分别为102和103 CFU/mL。随后取100 μL 100 nmol/L的核酸适配体与300 μL加标样品混合, 作为实验组; 另外, 将150 μL的不同浓度海水样品和150 μL的2×结合缓冲液混合代替菌悬液, 与100 μL 100 nmol/L的核酸适配体混合, 作为对照组。实验组和对照组都各3个平行。后续按照1.2.2的差减荧光法进行检测, 得到每个加标样品中鳗弧菌结合的荧光值, 然后根据工作曲线及其回归方程, 可计算出相应的回收量, 相应的回收率=回收量/加入量×100%。
1.5 鱼体组织样品的检测为了研究该方法对鱼体不同组织中鳗弧菌的检测效果, 选用不同的鱼体组织进行加标回收实验。将鳗鲡的腮、胃、肾、表皮和肌肉等组织器官取出并剪碎, 称取0.5 g, 加入5 mL的2×结合缓冲液浸泡1 h, 然后离心取上清制成组织悬液(李改娟等, 2013)。再取浓度分别为2×102和2×103 CFU/mL鳗弧菌悬液各2 mL, 与2 mL组织悬液样品混合配制成加标样品, 此时加标样品中鳗弧菌浓度分别为102和103 CFU/mL。随后取100 μL 100 nmol/L核酸适配体与300 μL加标样品混合, 作为实验组; 另取150 μL的组织悬液和150 μL的2×结合缓冲液混合代替加标样品, 与100 μL 100 nmol/L的核酸适配体混合, 作为对照组。实验组和对照组都各3个平行。后续按照1.2.2的差减荧光法进行检测, 得到每个加标样品中鳗弧菌结合的荧光值。回收量和回收率的计算按1.4的方法进行计算。
1.6 统计分析利用EXCEL软件中的t-检验函数对实验数据进行组间差异分析, P < 0.05为差异显著, P < 0.01为差异极显著。
2 结果与分析 2.1 差减荧光法的检测原理检测原理如图 1所示, 标记了荧光基团的核酸适配体为识别分子, 鳗弧菌为被检测的靶目标。空白对照组中, 含有荧光基团的核酸适配体溶液与缓冲液混合, 由于体系中无鳗弧菌等样品, 离心后无菌沉淀, 核酸适配体也几乎没有损失, 溶液中的荧光强度基本没有变化。而在实验组中, 检测体系中存在鳗弧菌, 由于鳗弧菌与其核酸适配体有较好的亲和特异性, 鳗弧菌会与核酸适配体结合, 离心去掉菌沉淀后, 与鳗弧菌结合的含有荧光基团的核酸适配体也随之被去除, 此时上清溶液中的荧光强度就会降低。用空白对照的荧光值减去实验组的荧光值, 得到的差值就是鳗弧菌所结合的适配体的荧光值。而且鳗弧菌含量越高, 能结合的核酸适配体也就越多, 这个荧光差值就越大。因此, 通过分析空白对照组和实验组中上清液的荧光差值可以实现对鳗弧菌的检测。
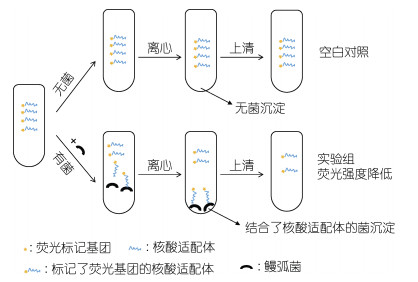 |
| 图 1 基于核酸适配体的差减荧光法检测鳗弧菌的示意图 Fig. 1 Schematic diagram of detection of V. anguillarum using aptamer in differential fluorescence methods |
采用荧光显微镜法对鳗弧菌和其他5种菌(迟钝爱德华氏菌、溶藻弧菌、嗜水气单胞菌、哈维氏弧菌和大肠杆菌)进行了定性检测, 结果如图 2所示。可以看到, 这些细菌本身均无明显的荧光, 但鳗弧菌与带有荧光基团的核酸适配体结合后, 鳗弧菌呈现出较为明显的荧光, 而其他菌均没有呈现出明显的荧光。说明该核酸适配体对鳗弧菌有较好的识别能力, 可用于鳗弧菌的识别检测。
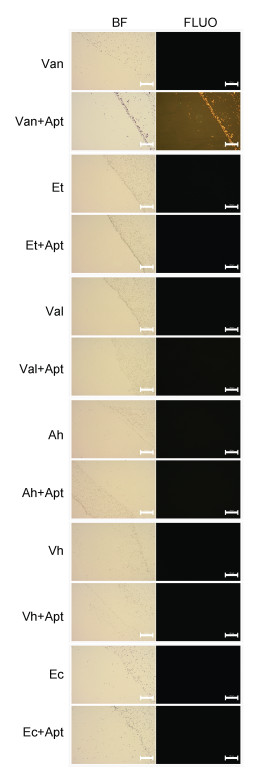 |
| 图 2 放大200倍的荧光显微镜观察图 Fig. 2 Images of fluorescence microscopy at 200 magnification 注: BF: 明场; FLUO: 荧光场; Van: 鳗弧菌; Van+Apt: 与核酸适配体混合后的鳗弧菌; Et: 迟钝爱德华氏菌; Et+Apt: 与核酸适配体混合后的迟钝爱德华氏菌; Val: 溶藻弧菌; Val+Apt: 与核酸适配体混合后的溶藻弧菌; Ah: 嗜水气单胞菌; Ah+Apt: 与核酸适配体混合后的嗜水气单胞菌; Vh: 哈维氏弧菌; Vh+Apt: 与核酸适配体混合后的哈维氏弧菌; Ec: 大肠杆菌; Ec+Apt: 与核酸适配体混合后的大肠杆菌。比例尺=100 μm |
通过荧光显微镜定性观察, 确定了相应核酸适配体的识别效果。在此基础上, 采用差减荧光法对浓度均为105 CFU/mL的鳗弧菌和其他7种菌(溶藻弧菌、哈维氏弧菌、铜绿假单胞菌、变形假单胞菌、嗜水气单胞菌、迟钝爱德华氏菌和大肠杆菌)进行了检测, 结果如图 3所示。可以看到, 鳗弧菌结合的荧光值要显著高于其他菌(P < 0.01), 是其他菌荧光值的4~11倍, 说明鳗弧菌能特异性结合溶液中含有荧光的核酸适配体, 从而导致溶液中荧光强度的大幅降低。由此可知, 基于该核酸适配体的差减荧光法可特异性识别鳗弧菌。
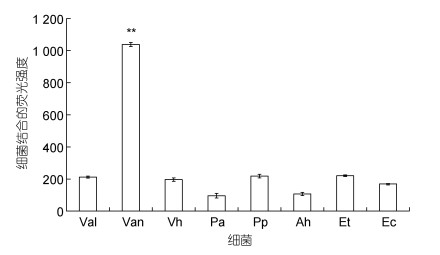 |
| 图 3 对鳗弧菌检测的特异性 Fig. 3 Specificity of detection of V. anguillarum 注: Val: 溶藻弧菌; Van: 鳗弧菌; Vh: 哈维氏弧菌; Pa: 铜绿假单胞菌; Pp: 变形假单胞菌; Ah: 嗜水气单胞菌; Et: 迟钝爱德华氏菌; Ec: 大肠杆菌 |
鳗弧菌与核酸适配体结合后, 随着鳗弧菌浓度的增大, 鳗弧菌结合的荧光强度也逐渐增大, 且鳗弧菌浓度的常用对数与其结合的荧光值呈现出良好的线性关系, 线性拟合系数达到0.990 2 (如图 4), 说明该方法在实验范围内有较好的线性, 可用于鳗弧菌的定量检测。不过鳗弧菌在浓度1和10 CFU/mL下的荧光强度均接近0, 与空白差异不显著(P > 0.05), 检出有难度, 因此较为可靠和准确的检测限应为102 CFU/mL, 相应鳗弧菌的定量检测范围为102~108 CFU/mL。
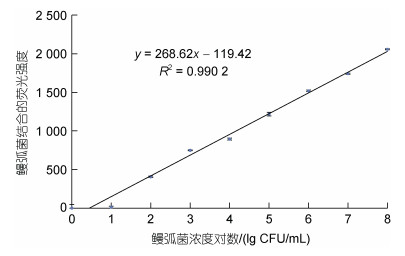 |
| 图 4 鳗弧菌检测的工作曲线及其线性拟合曲线 Fig. 4 Working curve and linear fitting curve for the detection of V. anguillarum |
采用差减荧光法对不同盐度的海水和盐度为0的淡水中菌的含量进行了加标检测, 并按照标准曲线计算相应的含量和回收率, 结果如表 1所示。可以看到, 不同盐度的样品, 添加量是100 CFU/mL时的加标回收率为80.13%~109.69%, 添加量是1 000 CFU/mL时的加标回收率为67.84%~121.33%, 这个回收率符合2020年的《中华人民共和国药典》中对微生物计数的要求(国家药典委员会, 2020)。同时, 该方法对海水样品检测的相对标准偏差均小于12%, 符合检测体系标准(孔德莉等, 2021)。由此可知, 该检测方法准确可靠, 可用于海水样品中鳗弧菌的检测。
| 海水盐度 | 添加量/(CFU/mL) | 检测结果(荧光强度) | 相对标准偏差/% | 回收率/% |
| 0 | 100 | 409.05±24.08 | 5.89 | 99.03 |
| 1000 | 725.26±16.97 | 2.34 | 121.33 | |
| 20 | 100 | 398.91±32.64 | 8.18 | 92.19 |
| 1000 | 704.81±14.97 | 2.12 | 103.00 | |
| 30 | 100 | 382.46±24.34 | 6.36 | 80.13 |
| 1000 | 716.64±28.59 | 3.99 | 114.53 | |
| 35 | 100 | 422.69±20.22 | 4.78 | 109.69 |
| 1000 | 685.96±27.58 | 4.02 | 89.64 | |
| 40 | 100 | 422.84±6.17 | 1.46 | 109.20 |
| 1000 | 652.73±6.72 | 1.03 | 67.84 |
采用差减荧光法对鱼体器官进行检测, 按照标准曲线计算得到相应的含量和回收率, 结果如表 2所示。可以看到, 不同组织器官的样品, 添加量是100 CFU/mL时对应的加标回收率为83.27%~105.86%, 添加量是1 000 CFU/mL时对应的加标回收率为71.13%~94.09%, 该加标回收率也符合《中华人民共和国药典》中对微生物计数的要求(国家药典委员会, 2020)。同时, 该方法对鱼体组织样品检测的相对标准偏差均小于12%, 符合检测体系标准(孔德莉等, 2021)。因此, 该检测方法对鱼体组织样品中的鳗弧菌也有较好检测效果, 可用于水产品或食品中鳗弧菌的检测。
| 鱼体组织器官 | 添加量/(CFU/mL) | 检测结果(荧光强度) | 相对标准偏差/% | 回收率/% |
| 腮 | 100 | 403.08±11.77 | 2.92 | 93.53 |
| 1 000 | 691.68±30.18 | 4.36 | 94.09 | |
| 胃 | 100 | 387.59±24.81 | 6.40 | 83.27 |
| 1 000 | 675.39±26.64 | 3.94 | 82.37 | |
| 肾 | 100 | 404.58±18.65 | 4.61 | 95.08 |
| 1 000 | 685.81±14.29 | 2.08 | 88.53 | |
| 表皮 | 100 | 417.07±27.47 | 6.59 | 105.86 |
| 1 000 | 684.86±22.29 | 3.25 | 88.41 | |
| 肌肉 | 100 | 395.53±22.22 | 5.62 | 88.73 |
| 1 000 | 658.48±10.92 | 1.66 | 71.13 |
核酸适配体主要是通过其形成的特定三维结构, 如茎、环、发夹、假结、三链体或四链体等, 依靠氢键、范德华力、静电作用等相互作用, 与靶标形成稳定复合物, 从而实现对靶标的识别和结合(Patel et al, 2000)。它具有亲和特异性高、分子量小、易修饰、靶分子范围广等多种优点(Muhammad et al, 2021), 在分子识别等检测领域展现出巨大的应用潜力。本文采用的鳗弧菌核酸适配体H5, 则是一种能够进入鳗弧菌内部的核酸适配体, 前期的研究表明, 该核酸适配体很可能是先与鳗弧菌表面位点结合, 再通过胞吞作用进入菌体内部的(郑江等, 2022)。因此鳗弧菌能够特异性的结合吞噬这个带有荧光基团的核酸适配体, 从而使溶液中的荧光强度下降, 本文则首次利用这种能进入菌体内的核酸适配体, 建立了差减荧光法, 实现了对鳗弧菌的定量检测。
有关鳗弧菌的检测方法主要有传统的微生物培养法、以基因为靶点的分子生物学方法和抗体为基础的免疫学方法。市售的检测试剂盒主要采用的是微生物培养法, 该方法检测时间较长(Da-Silva et al, 2018; 汤学敏等, 2019), 灵敏度不高, 对弧菌的检测限一般在103~104 CFU/mL左右, 无法实现定量检测。比较而言, 分子生物学的检测方法灵敏度较高。孙晶晶等(2015)报道了以鳗弧菌的vah4和rtxA这两个毒力基因为靶点的双重PCR检测法, 其对鳗弧菌的检测限为2.4×103 CFU/mL, 定量范围为2.4×103~2.4×108 CFU/mL, 而以溶血素毒力基因vah4为靶点的LAMP检测法, 其检测限可达2.4×101 CFU/mL, 定量范围为2.4×101~2.4×108 CFU/mL; Luo等(2018)报道了以鳗弧菌的flaA基因为靶点的多重PCR检测法, 其检测限可达2.7×104 CFU/mL, 定量范围为2.7×104~2.7×107 CFU/mL。在鳗弧菌的免疫学检测方面, 吴斌等(2016)建立了鳗弧菌的胶体金免疫层析快速检测方法, 其检测限为6.3×104 CFU/mL, 定量范围为6.3×104~ 6.3×108 CFU/mL; Zhang等(2016)建立了鳗弧菌的量子点标记免疫分析法, 其检测限为103 CFU/mL, 定量范围为103~108 CFU/mL。本文建立的基于核酸适配体的差减荧光法, 对鳗弧菌的检测限为102 CFU/mL, 定量范围为102~108 CFU/mL, 在检测限和定量范围上都居于较优的水平, 并能对海水样品、鱼体组织样品进行较好的检测, 体现出了较好的抗干扰性和应用前景。
4 结论利用核酸适配体和鳗弧菌之间较好的亲和特异性, 建立的一种基于核酸适配体的差减荧光法, 可定量检测鳗弧菌, 该方法可特异性的识别鳗弧菌, 在102~108 CFU/mL范围内呈现出较好的线性关系, 最低检测限为102 CFU/mL, 在海水样品和鱼体组织样品的检测中, 均呈现了较好的检测效果。
王金龙, 冯艳微, 李赞, 等, 2020. 鳗弧菌和副溶血弧菌对短蛸感染的病理学研究. 山东大学学报(理学版), 55(9): 102-110 |
王晓瑞, 邱红玲, 王寿利, 等, 2021. 抗副溶血弧菌OMPK单克隆抗体的制备及其ELISA双抗体夹心检测方法建立. 食品科学, 42(4): 319-325 |
孔德莉, 罗思, 彭瑞晨, 等, 2021. 基于无标记金纳米簇的新型荧光生物传感器在赭曲霉毒素A快速检测中的应用. 食品科学, 42(4): 263-270 |
曲瑶, 张亚旗, 肖光, 等, 2020. 基于核酸碱基猝灭荧光团的核酸适配体传感器检测赭曲霉毒素A. 分析化学, 48(10): 1409-1415 |
刘若冰, 郝怡环, 杨茜, 等, 2020. 基于核酸适配体的AccuBlue荧光法检测动物食品中的恩诺沙星. 食品科学, 41(24): 310-315 |
汤学敏, 林文燕, 鄢庆枇, 等, 2019. 基于核酸适配体的PCR法检测溶藻弧菌及其灭活菌. 中国水产科学, 26(2): 391-396 |
孙晶晶, 高晓建, 张晓君, 等, 2015. 病原性鳗弧菌(Vibrio anguillarum)双重PCR与LAMP检测方法的建立. 渔业科学进展, 36(6): 49-55 |
孙淼, 杨歌, 赵毅, 等, 2020. 乳腺癌生物标志物钙网蛋白的核酸适配体筛选及血清检测和乳腺癌细胞识别. 分析化学, 48(5): 642-649 |
杜彩溢, 杨川宇, 刘文慧, 等, 2021. 核酸适配体传感器在四环素类抗生素检测中的应用. 食品安全质量检测学报, 12(2): 439-446 |
李改娟, 刘艳辉, 郭军, 等, 2013. 超高效液相色谱法测定鱼体组织中培氟沙星的含量. 水产学杂志, 26(2): 26-28 |
吴美娇, 吴有雪, 刘程, 等, 2021. 基于组合胶体金纳米颗粒的免疫层析试纸条快速可视化检测海产品中副溶血性弧菌. 工业微生物, 51(2): 1-9 |
吴斌, 樊海平, 王雪妹, 等, 2016. 鳗弧菌单克隆抗体-胶体金检测方法的建立. 福建农业学报, 31(11): 1145-1150 |
国家药典委员会, 2020. 中华人民共和国药典: 2020年版四部[S]. 北京: 中国医药科技出版社.
|
郑江, 刘慧敏, 黄力行, 等, 2022. 鳗弧菌(Vibrio anguillarum)核酸适配体的筛选及其结合蛋白的分离鉴定. 生物化学与生物物理进展, 49(1): 250-261 |
赵丽萍, 杨歌, 张小敏, 等, 2020. 蛋白质的核酸适配体筛选及应用的研究进展. 分析化学, 48(5): 560-572 |
赵晨, 洪诚毅, 林郑忠, 等, 2020. 基于核酸适配体及胶体金可视化检测水中孔雀石绿. 光谱学与光谱分析, 40(3): 831-836 |
DA-SILVA E, BAUDART J, BARTHELMEBS L, 2018. Biosensing platforms for Vibrio bacteria detection based on whole cell and nucleic acid analysis: a review. Talanta, 190: 410-422 |
HERMANN T, PATEL D J, 2000. Adaptive recognition by nucleic acid aptamers. Science, 287(5454): 820-825 |
HICKEY M E, LEE J L, 2018. A comprehensive review of Vibrio (Listonella) anguillarum: ecology, pathology and prevention. Reviews in Aquaculture, 10(3): 585-610 |
KIM K I, WON K M, LEE E S, et al, 2019. Detection of Vibrio and ten Vibrio species in cage-cultured fish by multiplex polymerase chain reaction using house-keeping genes. Aquaculture, 506: 417-423 |
LUO K, YUAN H W, ZHANG W Q, et al, 2018. Two rapid methods to identify three species of pathogenic Vibrio in Penaeus vannamei. Israeli Journal of Aquaculture-Bamidgeh, 70: 1458 |
MUHAMMAD M, HUANG Q, 2021. A review of aptamer-based SERS biosensors: Design strategies and applications. Talanta, 227: 122188 |
SAWABE T, KITA-TSUKAMOTO K, THOMPSON F L, 2007. Inferring the evolutionary history of vibrios by means of multilocus sequence analysis. Journal of Bacteriology, 189(21): 7932-7936 |
WEI S, ZHAO H, XIAN Y Y, et al, 2014. Multiplex PCR assays for the detection of Vibrio alginolyticus, Vibrio parahaemolyticus, Vibrio vulnificus, and Vibrio cholerae with an internal amplification control. Diagnostic Microbiology and Infectious Disease, 79(2): 115-118 |
YONEKITA T, MORISHITA N, ARAKAWA E, et al, 2020. Development of a monoclonal antibody for specific detection of Vibrio parahaemolyticus and analysis of its antigen. Journal of Microbiological Methods, 173: 105919 |
YU Q, LIU M Z, WEI S N, et al, 2021. Research progress and prospects for the use of aptamers in aquaculture biosecurity. Aquaculture, 534: 736257 |
ZHANG Y, XIAO J F, WANG Q Y, et al, 2016. A modified quantum dot-based dot blot assay for rapid detection of fish pathogen Vibrio anguillarum. Journal of Microbiology and Biotechnology, 26(8): 1457-1463 |
 2023, Vol. 54
2023, Vol. 54


