中国海洋湖沼学会主办。
文章信息
- 仉佳文, 唐君玮, 张远帆, 魏敏, 张国范, 吴富村. 2022.
- ZHANG Jia-Wen, TANG Jun-Wei, ZHANG Yuan-Fan, WEI Min, ZHANG Guo-Fan, WU Fu-Cun. 2022.
- 皱纹盘鲍(Haliotis discus hannai)不同群体贝壳形态和相对生长变异研究
- SHELL MORPHOLOGY AND RELATIVE GROWTH VARIABILITY OF PACIFIC ABALONE HALIOTIS DISCUS HANNAI IN COASTAL CHINA
- 海洋与湖沼, 53(6): 1539-1547
- Oceanologia et Limnologia Sinica, 53(6): 1539-1547.
- http://dx.doi.org/10.11693/hyhz20220300050
文章历史
-
收稿日期:2022-03-07
收修改稿日期:2022-05-05
2. 中国科学院海洋研究所实验海洋生物学重点实验室 山东青岛 266071;
3. 长岛海洋经济促进中心 山东烟台 265800
2. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Changdao Marine Economy Promotion Center, Yantai 265800, China
皱纹盘鲍(Haliotis discus hannai Ino)自然分布于亚洲东部海域, 包括我国辽东半岛和山东半岛海区, 以及日本北部和朝鲜半岛部分海区(吕端华, 1978)。在我国, 皱纹盘鲍是重要的渔业资源, 20世纪50年代捕捞量一度达100 t以上, 而由于酷捕滥采和缺乏有效的渔业管理, 我国皱纹盘鲍资源遭到了严重破坏(张昭, 1979), 海珍品产量逐年下降至近枯竭。随着我国皱纹盘鲍人工繁育技术的突破(陈木等, 1977; 刘永峰等, 1984), 以人工苗种底播为主要方式开始了皱纹盘鲍资源修复工作。在20世纪80年代后期至 90年代, 山东、辽宁等海区的底播鲍的采捕量得以显著提升(刘永峰等, 1994; 吴富村等, 2020)。之后杂交技术开始在我国皱纹盘鲍人工养殖产业成功应用, 逐渐推动福建成为苗种繁育和养殖产业中心, 然而南繁苗种因较难以适应黄渤海海区环境, 其在我国北方海区难以越冬, 底播鲍的采捕产量显著下降, 在北方部分海区甚至已放弃开展皱纹盘鲍的底播增养殖工作。近年来, 随着我国生态环境保护政策的制定与落实, 皱纹盘鲍栖息海区如山东长岛等生态环境保护力度逐年加强, 相关海区皱纹盘鲍资源密度虽仍然较低, 但也呈逐步恢复态势。皱纹盘鲍不同地理群体也是我国重要的种质资源来源, 我国已设立包括大连圆岛、烟台钦隍岛等7处皱纹盘鲍水产种质资源保护区。近几年随着我国关于加强农业种质资源保护与利用、开展全国农业种质资源普查的政策推动, 皱纹盘鲍不同地理群体的种质鉴定和评价工作也得到重视。
长期以来, 人们已经认识到鲍等海洋底栖动物地理种群间差异, 以及这种差异对应对过度捕捞和局部资源枯竭等资源管理的重要性(Begg et al, 1999), 并引入和识别管理单位(mangement units, MU)的概念, 管理单位可定义为应单独管理和监测的独立的地理种群(Martien et al, 2003)。而如何区分地理种群或种群组成则成为管理单位成功开发和应用的基础(Defeo et al, 2005)。识别鲍种群结构的最常用方法是分析假设种群之间的遗传差异如基于单基因、微卫星、SNP等分子标记的种群遗传分析方法(Sandoval-Castillo et al, 2018; Mares-Mayagoitia et al, 2021; Nam et al, 2021), 此类研究通常显示出比预期更大的尺度差异(Stephens et al, 2006; Sandoval-Castillo et al, 2018), 如毗邻海区小空间尺度(~10 km)可能因环境剧烈差异而造成形态变化、种群隔离, 而分子遗传学中单基因分析无法全面反映种群遗传分化程度, 不能区分种间杂交个体和纯种个体(Liu et al, 2021), 种群基因组学则刚兴起, 往往缺乏相关研究且成本较高。我国不同海区的皱纹盘鲍群体是否可以以独立的地理种群作为管理单位, 一直以来缺乏相关数据支持。海水贝类由于贝壳形态的可塑性, 壳形态测量及变异研究在物种鉴定和种群分化中得到了广泛的应用。形态学标记作为最直接的遗传标记, 在鲍科动物中也广泛的应用于鲍种间的分类和判别分析(陈世杰, 1995), 如吴玉云(2001)利用鲍壳长、壳宽、壳高间的比率数值参数可基本将我国自然分布的7种鲍科动物进行分类; 张仪方(2019)利用线性测量法分别研究不同鲍种及杂交种的形态差异, 结果显示不同种间鲍的形态差异存在明显区别, 可以通过形态差异区分开。除此之外, 同时张仪方(2019)对皱纹盘鲍6个养殖群体采用形态学聚类等分析得出仅靠形态差异很难区分开所有的养殖群体的结论。而利用鲍形态学及相关测量参数间的相对生长来开展我国不同海区自然群体的变异和判别分析则未见报道。
本研究通过采集和比较我国不同海区皱纹盘鲍样本, 利用贝壳外部形态特征和样本重量的测量, 对皱纹盘鲍不同群体的形态和相对生长变异进行了研究。所获得的数据对进一步了解地理群体的可塑性具有重要意义, 同时对判别种群来源提供参考。
1 材料与方法 1.1 样本采集在我国黄渤海自然海区位于大连的圆岛(YD)、老偏岛(LPD)、獐子岛大蚝岛(ZZD), 烟台长岛的大钦(DQ)、南隍城(NHC), 青岛的灵山岛(LS)以及荣成成山(XXK) 7个地点随机收集了700余只皱纹盘鲍个体(图1)。为防采样季节对数据分析的影响, 所有样本均来自2020年及2021年7月份皱纹盘鲍资源调查时采集样本, 潜水于2~6 m深的潮下带海区采集。资源调查时, 根据所属岛屿或海区管理单位历史记录, 尽量选择未采用皱纹盘鲍人工繁育苗种开展底播放流的海区, 或至少10年内未曾开展相关底播工作的海区作为采样点。样本收集后, 根据壳顶颜色判别是否为人工苗种底播的个体(Gallardo et al, 2003; Marchais et al, 2017), 如有绿壳色或者在距壳顶2~5 cm外壳处有显著生长壳纹, 则该个体不作为样本分析。最终本研究共对自然海区采集的452个皱纹盘鲍样本进行形态学测量, 每个地点取样的样本数在31~153不等。
 |
| 图 1 本研究沿海皱纹盘鲍采样点分布图 Fig. 1 Distribution of sampling sites for the Pacific abalone along coast of China in this study 注: 图中圆点示采样点, 按维度由北往南分别为獐子岛(ZZD)、老偏岛(LPD)、圆岛(YD)、南隍城岛(NHC)、大钦岛(DQ)、成山(XXK)和灵山岛(LS) |
每个样本采样后立即记录每个个体的形态特征: 外壳的最大壳长(SL, 单位: mm)、壳宽(SW, 单位: mm)、壳高(SH, 单位: mm)、总湿重(TWW, 单位: g); 取回实验室解剖所有样本, 称量记录软体部重(SPW, 单位: g)以及干壳重(SHELLW, 单位: g)。长度测量使用数字卡尺(精度为0.01 mm), 重量测量使用电动数字天平(精度为0.001 g), 其中干壳重SHELLW的测定为解剖后取鲍壳暴晒72 h后称量。
周长、面积、弯曲度的识别和测量: 将晒干后的鲍壳样本通过数字相机(Cannon EOS 5D4, 100微镜头)拍摄以每个鲍壳样本的图像, 样本拍摄记录镜头与样本距离、焦距等参数以保持一致; 然后通过软件ImageJ (美国国立卫生研究院)计算壳口轮廓的周长(CIRC, 单位: mm)和面积(AREA, 单位: mm2); 通过Matlab软件计算壳口边缘的粗糙度(CURV), 该指标定义为: (1-凸包周长与周长之比)×100, 其中凸包(convex hull)是一个图形学分析中用于描述边缘粗糙/光滑的参数, 可以用MATLAB软件来实现相关计算。
1.3 相对生长通过回归分析, 建立了所有种群和每个种群的壳形态特征(壳长SL, 壳宽SW, 壳高SH分别与总湿重TWW、软体部重SPW和干壳重SHELLW)之间的异速生长关系。对各参数的自然对数变换数据采用线性最小二乘法估计相关参数a和b。
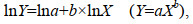 (1)
(1)式中, 参数b通常用作生长比率与等距的偏差的指标(Rizhinashvili, 2008), 采用Student’s t 检验以确定异速生长的类型, 及在每组异速生长关系中, 以整合所有种群拟合得到的b值为期望, 分别以各个群体内所有个体为样本进行Student’s t检验。
1.4 数据处理用所有记录的形态测量值计算出17个性状比率指标(SPW/TWW、SHELLW/TWW、SHELLW/SPW、SW/SL、SH/SL、SL/CURV、SW/CURV、SH/CURV、SL/SUM、SW/SUM、SH/SUM、TWW/DSUM、SPW/DSUM、SHELLW/DSUM、SL/CIRC、SW/CIRC、SLSW/AREA), 尽管两两测量性状间可获得更多的比率指标, 本研究的17个比率指标的选取主要依据其生物学意义, 如SW/SL、SL/CIRC、SW/CIRC、SLSW/(100×CIRC)分别为样本壳宽与壳长、壳长与壳口周长、壳宽与壳口周长、壳长壳宽乘积与壳口周长的比值, 可以用来表示壳型偏长或偏宽的形态; SL/SUM、SW/SUM、SH/SUM与TWW/DSUM、SPW/DSUM、SHELLW/DSUM比率指标主要参考Kobayashi等(1996)文献, 分别表示皱纹盘鲍壳长SL、壳宽SW、壳高SH与这三个测量指标(SL、SW和SH)之和的比率, 以及全湿重TWW、软体部重SPW、干壳重SHELLW与这三个测量指标(SL、SW和SH)之积的比率。
基于(协)方差分析(ANCOVA)对这17个比率变量进行群体间变异显著性比较; 进而在比率变量差异显著下, 对17个比率变量采用聚类分析(CLUSTER)和非度量多维尺度(NMDS)开展群体间多元统计分析。本研究中因样本采集难度的原因, 样本规格(以壳长SL反映)在种群内、种群间均差异较大。为了减少样本规格的影响, 形态学数据按照Reist(1986), 对种群间每个样本壳长(SL)进行常用对数(lg)转换并作为协变量进行ANCOVA分析(Sokal et al, 1981)。用9个测量指标变量进行种群的线性判别分析(LDA), 同样为了减少样本尺寸的影响, 对每个测量指标变量(x)使用lg(x)转换后进行LDA分析。
2 结果 2.1 种群的描述各海区采集的皱纹盘鲍样本的测量指标变量的均值和标准偏差如表1所示, 群体间及群体内均有很大的变异性。个体总平均壳长为85.17 mm, 种群的平均壳高度差异较大。本次调查记录的最大样本位于大连獐子岛(ZZD), 壳长SL为120.25 mm, 最小的在老偏岛(LPD), 高度为2.15 mm。我们发现, 大于100 mm的样本主要来自獐子岛(ZZD, 44.14%)、大钦岛(23.42%)。另一方面, 发现所有群体在所测量指标中均存在重要的异质性, 且纬度靠北的大个群体变异系数更大, 如老偏岛和獐子岛变异系数分别为24.18%和21.12%。
| 种群 | N | 测量指标 | ||||||||
| SL/mm | SW/mm | SH/mm | TWW/g | SPW/g | SHELLW/g | CIRC/mm | AREA/mm2 | CURV | ||
| ZZD | 153 | 88.43±18.68 | 59.7±12.55 | 18.2±4.28 | 84.95±37.35 | 61.43±28.47 | 19.6±8.53 | 210.41±52.31 | 5 725.21±2636.93 | 19.15±1.20 |
| LPD | 46 | 44.7±10.81 | 30.18±6.95 | 9.91±2.97 | 14.40±26.78 | 9.89±21.11 | 3.72±6.00 | 117.48±41.16 | 1 645.09±2208.76 | 22.45±1.13 |
| YD | 24 | 96.04±17.3 | 64.65±11.61 | 20.08±4.03 | 109.36±35.66 | 78.57±27.28 | 28.46±8.08 | 339.65±49.89 | 6 688.92±2556.97 | 28.42±1.20 |
| NHC | 50 | 89.71±14.38 | 61.74±9.54 | 20.81±3.53 | 95.14±31.72 | 65.89±24.49 | 22.78±7.18 | 243.42±45.04 | 6 108.01±2390.44 | 23.65±0.97 |
| DQ | 75 | 96.27±7.49 | 65.84±4.5 | 20.53±2.57 | 112.65±23.7 | 82.05±19.09 | 26.67±5.24 | 223.88±37.19 | 7 093.40±2085.75 | 17.51±1.11 |
| XXK | 31 | 61.78±15.74 | 42.77±10.6 | 13.17±3.79 | 40.17±33.73 | 28.66±25.94 | 9.37±7.64 | 234.73±47.12 | 5 343.32±2472.63 | 26.20±1.20 |
| LS | 73 | 95.67±12.66 | 63.99±8.29 | 22.16±3.25 | 112.29±29.38 | 82.07±22.89 | 25.00±6.64 | 256.45±42.61 | 6 648.17±2297.25 | 24.13±0.78 |
| 总体 | 452 | 85.17±19.72 | 57.73±13.29 | 18.42±4.46 | 86.13±38.94 | 62.09±29.59 | 20.15±8.91 | 222.81±53.8 | 5 753.38±2702.60 | 21.49±1.60 |
本研究测定了所有种群样本称量指标变量(TWW、SPW和SHELLW)与壳生长变量(SL、SW和SH)之间的异速生长关系。整合所有种群异速生长线性方程和相关系数如图2所示。Student’s t检验结果表明, 所有三种异速生长类型(等速生长和正向、负向异速生长)均可在群体内观察到。因此, 为了更好地解释数据, 我们将种群的异速生长类型分为如下组: I组显示负向异速生长(negative allometry); II组显示等速生长(isometry); III组显示正向异速生长(positive allometry)。
 |
| 图 2 皱纹盘鲍所有采样点样本贝壳形态测量指标和重量相关指标的异速生长关系 Fig. 2 Allometric relationships between shell morphometric and body weight characters of all samples 注: a. TWW-SL; b. TWW-SW; c. TWW-SH; d. SPW-SL; e. SPW-SW; f. SPW-SH; g. SHELLW-SL; h. SHELLW-SW; i. SHELLW-SH |
回归分析表明, 所采集皱纹盘鲍样本的全湿重TWW和3个壳形态指标(SL、SW和SH)之间存在显著的线性相关关系(P<0.01)。在全湿重TWW和壳长SL关系方面, 在合并群体的决定系数为0.954 (P<0.01, 图2a), 种群间的决定系数为0.553 (DQ)~0.987 (XXK)。b值在2.07~2.933之间波动。在全湿重TWW和壳长SL关系方面, I组由DQ和LS种群组成, II组由LPD、YD和ZZD种群组成, III组由NHC和XXK组成。在全湿重TWW和壳宽SW关系方面, 在合并群体的决定系数为0.947 (P<0.01, 图2a), 种群间的决定系数为0.557 (DQ)~0.991 (XXK)。b值在2.18~3.05之间波动。经Student’s t检验, I组、II组、III分组与上述全湿重TWW和壳长SL关系结论相同。然而, 由全湿重TWW和壳高SH关系拟合b值经Student’s t检验, III组由LPD和XXK组成, 其余群体均为I组。
2.2.2 软体部重SPW与壳形态指标(SL、SW和SH)关系回归分析表明, 所采集皱纹盘鲍样本的软体部重SPW和3个壳形态指标(SL、SW和SH)之间存在显著的线性相关关系(P<0.01)。在软体部重SPW和壳长SL关系方面, 在合并群体的决定系数为0.933 (P<0.01, 图2d), 种群间的决定系数为0.475 (DQ)~0.989 (XXK)。b值在2.44~3.07之间波动。在软体部重SPW和壳长SL关系方面, I组由LS、ZZD、YD和DQ种群组成, II组由LPD种群组成, III组由NHC、XXK组成。在全湿重TWW和壳宽SW关系方面, 与TWW和SL关系类似, 经Student’s t检验, I组、II组、III分组与上述全湿重TWW和壳长SL关系结论相同。然而, 由全湿重TWW和壳高SH关系拟合b值经经Student’s t检验, III组由LPD和XXK组成, 其余群体均为I组。
2.2.3 干壳重SHELLW与壳形态指标(SL、SW和SH)关系回归分析表明, 所采集皱纹盘鲍样本的干壳重SHELLW和3个壳形态指标(SL、SW和SH)之间存在显著的线性相关关系(P<0.01)。在干壳重SHELLW和壳长SL关系方面, 在合并群体的决定系数为0.964 (P<0.01, 图2g), 种群间的决定系数为0.546 (LS)~0.987 (LPD)。b值在1.95~2.94之间波动。在软体部重SPW和壳长SL关系方面, I组由LS、NHC、YD和DQ种群组成, II组由LPD、ZZD种群组成, III组由XXK组成。在干壳重SHELLW和壳宽SW关系方面, 与TWW和SL关系类似, 经Student’s t检验, I组、II组、III分组与上述全湿重TWW和壳长SL关系结论相同。然而, 由干壳重SHELLW和壳高SH关系拟合b值经经Student’s t检验, III组由LPD和XXK组成, 其余群体均为I组。
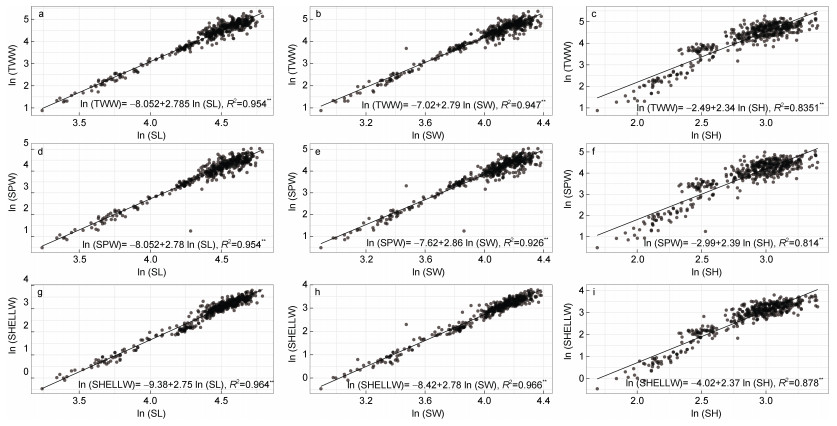
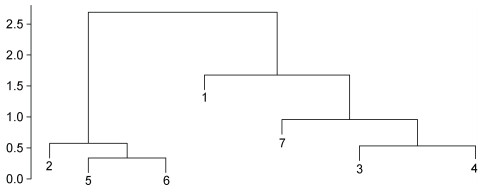
2.3 壳特征的比较分析各海区采集的皱纹盘鲍样本的测量指标间17个比率变量的均值和标准偏差如表2所示, 与测量指标变量相似, 比率变量在群体间及群体内均有很大的变异性。采用不同的分类或判别方法研究了所采样点皱纹盘鲍贝壳形态特征的变异性。测量指标比率变量的协方差分析表明, 除SHELLW/SPW变量外其他变量表示的壳形态间有显著差异(P<0.05), 这一结果揭示了各群体之间存在重要的表型变异。通过测量指标间比率变量的马氏距离(Mahalanobis distance, D2)对种群进行了区分, 结果显示不同地点的种群的壳形态存在显著差异, 聚类分析CLUSTER可以分为2个不同的生物地理群体(图3): 由XXK、NHC和LPD所采集的群体组成的一组, 以及由剩余的ZZD、YD、DQ和LS组成的另一组。对基于比率多变量的NMDS分析基本证实了马氏距离聚类的结果, 从图4可以大体看出XXK、NHC和LPD集中于坐标轴的右中位置。基于Fisher判别法, 建立了线性判别标准化典型判别函数系数矩阵, 同时基于该系数矩阵构建线性判别函数图(图5), 未能很好地区分各个群样本, 其中仅62.6%的原始分组观察值已正确地分类到各群体内, 针对分析中的各样本观察值进行交叉验证。在交叉验证中, 每一个观察值都会依据从该观察值之外的所有观察值衍生的函数进行分类, 结果显示仅58.0%的交叉验证已分组观察值已正确地分类。
| 种群 | N | 比率变量 | |||||||||||||||
| SPW/TWW | SHELLW/TWW | SHELLW/SPW | SW/SL | SH/SL | SL/CURV | SW/CURV | SH/CURV | ||||||||||
| ZZD | 153 | 0.72(0.08) | 0.23(0.05) | 0.34(0.20) | 0.67(0.02) | 0.20(0.03) | 4.76(0.76) | 3.21(0.52) | 0.97(0.20) | ||||||||
| LPD | 46 | 0.68(0.04) | 0.26(0.03) | 0.39(0.06) | 0.68(0.04) | 0.22(0.02) | 2.02(0.57) | 1.37(0.35) | 0.45(0.12) | ||||||||
| YD | 22 | 0.72(0.04) | 0.27(0.04) | 0.37(0.06) | 0.67(0.02) | 0.21(0.02) | 3.73(1.37) | 2.51(0.91) | 0.78(0.29) | ||||||||
| NHC | 50 | 0.69(0.04) | 0.24(0.03) | 0.36(0.06) | 0.70(0.06) | 0.23(0.03) | 3.92(0.71) | 2.70(0.48) | 0.91(0.17) | ||||||||
| DQ | 75 | 0.73(0.04) | 0.25(0.07) | 0.34(0.11) | 0.69(0.04) | 0.21(0.03) | 5.51(0.49) | 3.77(0.30) | 1.18(0.16) | ||||||||
| XXK | 31 | 0.71(0.04) | 0.26(0.20) | 0.37(0.25) | 0.69(0.02) | 0.21(0.02) | 2.46(0.96) | 1.70(0.67) | 0.52(0.20) | ||||||||
| LS | 73 | 0.73(0.04) | 0.22(0.03) | 0.31(0.05) | 0.67(0.03) | 0.23(0.02) | 4.26(1.12) | 2.85(0.73) | 0.98(0.25) | ||||||||
| 种群 | 比率变量 | ||||||||||||||||
| SL/SUM | SW/SUM | SH/SUM | TWW/DSUM | SPW/DSUM | SHELLW/DSUM | SL/CIRC | SW/CIRC | SLSW/(100×CIRC) | |||||||||
| ZZD | 0.53(0.01) | 0.36(0.01) | 0.11(0.01) | 0.88(0.22) | 0.63(0.18) | 0.20(0.03) | 0.42(0.05) | 0.29(0.04) | 0.26(0.06) | ||||||||
| LPD | 0.53(0.02) | 0.36(0.01) | 0.12(0.01) | 0.92(0.12) | 0.62(0.09) | 0.24(0.03) | 0.38(0.03) | 0.26(0.03) | 0.12(0.03) | ||||||||
| YD | 0.53(0.01) | 0.36(0.01) | 0.11(0.01) | 0.87(0.16) | 0.63(0.11) | 0.23(0.06) | 0.31(0.09) | 0.21(0.06) | 0.20(0.07) | ||||||||
| NHC | 0.52(0.02) | 0.36(0.02) | 0.12(0.01) | 0.81(0.11) | 0.56(0.09) | 0.20(0.03) | 0.37(0.03) | 0.26(0.02) | 0.23(0.03) | ||||||||
| DQ | 0.53(0.02) | 0.36(0.01) | 0.11(0.01) | 0.89(0.23) | 0.65(0.18) | 0.21(0.03) | 0.44(0.09) | 0.30(0.06) | 0.29(0.07) | ||||||||
| XXK | 0.53(0.01) | 0.36(0.01) | 0.11(0.01) | 0.91(0.09) | 0.64(0.06) | 0.24(0.16) | 0.27(0.09) | 0.19(0.06) | 0.13(0.08) | ||||||||
| LS | 0.53(0.01) | 0.35(0.01) | 0.12(0.01) | 0.83(0.12) | 0.61(0.09) | 0.18(0.02) | 0.38(0.05) | 0.25(0.03) | 0.24(0.03) | ||||||||
 |
| 图 3 皱纹盘鲍各采样点群体基于测量指标间比率变量马氏距离的聚类分析 Fig. 3 The Mahalanobis-distance-based cluster analysis for ratio variates from morphological and weight related characters of Pacific abalone populations 注: 1. DQ; 2. LPD; 3. LS; 4. NHC; 5. XXK; 6. YD; 7. ZZD |
 |
| 图 4 皱纹盘鲍所有采样点样本非度量多维尺度分析 Fig. 4 Multidimensional scaling plots of weight ratios of Pacific abalone samples at all sample sites |
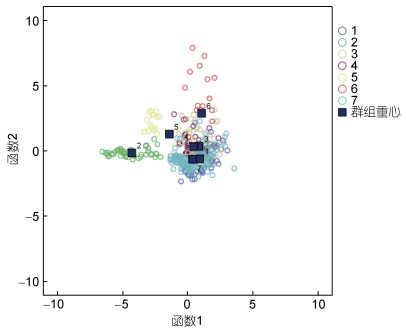 |
| 图 5 皱纹盘鲍所有样本基于群体的线性判别分析 Fig. 5 Population-based linear discriminant analysis of all samples of Pacific abalone 注: 1. DQ; 2. LPD; 3. LS; 4. NHC; 5. XXK; 6. YD; 7. ZZD |
形态测量分析在鲍物种鉴定中应用较广(Geiger et al, 2012)。在我国, 因鲍种间杂交的产业化应用, 形态测量分析也在鲍纯种和杂交种区分中有报道, 相关研究结果表明该分析方法具有重要应用价值(吴玉云, 2001; 张仪方, 2019)。与上述研究的样本来源不同, 本研究样本来自我国沿海7个自然海区采样点的皱纹盘鲍, 分别从贝壳形态变化和相对生长情况进行了调查和测定分析, 从结果看虽然未能完全将所有样本按采样区分开, 但大致能分为2个组, 且该结果能分别从各多元统计方法的结果中相互印证。
有关鲍的生长研究多集中于绝对生长的研究, 如Day等(1992)综述分析了18种经济鲍种不同的生长曲线方程。贻贝、珠母贝等双壳贝类以及海水鱼类中, 异速生长方面的研究较多(Gardner, 1996; Nurul Amin et al, 2004; Bellaaj-Zouari et al, 2012), 其中体重和体长的异速生长系数由线性回归方程的指数b表示; 在鱼类和贝类研究表明当b值接近3时, 表示等速生长, 而与b=3显示显著不同的值表示异速生长(Nurul Amin et al, 2008; Najmudeen, 2015)。在鲍科动物中, 不同性状间的异速生长报道相对较少。在本研究中, 我国皱纹盘鲍不同自然海区采样点所有样本体重相关的测量指标(TWW、SPW和SHELLW)与壳形态(SL、SW和SH)间的线性回归方程指数b大多在2.34~2.89之间。为比较群体间相关指标异速生长的变异, 本研究以整合所有群体样本的b值作为理论值, 通过Student’s t检验发现正向异速生长(positive allometry)的群体集中在LPD、NHC和XXK, 一般认为关于总重和壳长的相对增长反映了生态因素对贝类生长的影响, 即环境条件有利于物种的生长和发展(Bellaaj-Zouari et al, 2012), 本研究结果也反映了三个海区的环境条件有利于皱纹盘鲍生长, 比如据有关海藻调查报告显示山东南隍城岛(NHC)大型海藻丰度是国内最高的海区, 不仅调查点大型海藻平均生物量达18 000 g/m2, 且从海藻组成上以皱纹盘鲍喜食的裙带菜、海带为主(章守宇等, 2020); 而大连老偏岛LPD和荣成XXK是最近两年新发现皱纹盘鲍自然繁殖幼鲍和成体的海区, 由于皱纹盘鲍自然海区繁殖生态条件苛刻, 如孵化后幼体需舔食珊瑚礁微藻(crustose coralline algae, CAA), 稚幼鲍摄食分布较浅的藻类(turf algae)以及成体需大型海藻床(Takami et al, 2018), 皱纹盘鲍在自然海区繁殖个体的发现也一定程度证明这两个海区生态的改良。同时, 本研究尝试以各采样点群体样本TWW、SPW、SHELLW与SL、SW、SH间的9个线性回归方程系数组成的矩阵进行聚类和判别分析, 但可能由于各系数相差较小、变异度较低, 未能区分本研究中皱纹盘鲍各采样点地理群体。
形态比率变量的ANCOVA分析表明, 本研究各采样点皱纹盘鲍种群间形态具有重要的异质性。在采样中本着随机采样原则, 各群体均由皱纹盘鲍大型成年和幼年个体组成的, 这表明皱纹盘鲍在这些采样点中已经找到了一个适合生长和繁殖的环境。我们的研究结果进一步证明了皱纹盘鲍自然群体中表现出壳形态变异, 这与Kobayashi等(1996)的研究结果一致。皱纹盘鲍种群的壳形态和异速生长的变异可能是由于当地条件和环境因素的差异, 特别是波浪作用、温度、海水酸化影响了软体组织的生长和发育, 这在其他腹足纲贝类报道较多(Boulding et al, 1999; Solas et al, 2013; Carro et al, 2019)。它也可能与种群密度和食物资源的可获得性有关。事实上, 许多调查已经得出结论, 因为对食物的竞争, 低密度种群的增长比高密度种群的增长更快, 可能更为重要的是越来越多的报道中受全球变暖的影响, 皱纹盘鲍的生长和繁殖受海胆种群的扩张而影响更大(Strain et al, 2013; Rogers-Bennett et al, 2019)。
本研究结果表明皱纹盘鲍各采样点样本的形态特征区分与其地理分布不相吻合。本研究中利用形态比率变量(17个)的马氏距离对各采样点皱纹盘鲍群体进行聚类分析, 马氏距离可以克服变量之间的相关性干扰, 并且消除各变量量纲的影响, 结果显示大连的老偏岛(LPD)、圆岛(YD)以及荣成(XXK)聚为一组, 剩余4个群体聚为另一组, 而且基于标准化后的测量变量(9个)的线性判别分析(LDA)也印证了这一结果, LDA分析采用Fisher判别法, 该方法的优点是与主成分分析有关, 而对各变量的分布、方差等都无限制。同时, 非度量多维尺度NMDS分析虽然不能将所有个体完全区分, 但LPD、XXK和YD群体基本上可单独区分, 剩余群体的样本则混为一组。造成这一结果的原因, 根据相关单位的生产记录, LPD、YD和XXK虽曾大规模底播皱纹盘鲍人工苗种, 但后一组的青岛LS、大连ZZD、烟台NHC、DQ作为20世纪90年代皱纹盘鲍底播鲍的主产区, 其底播鲍的数量还是面积都远远高于前者。虽然本研究可以确定采样皱纹盘鲍样本均为各采样点的自然繁殖的个体, 但这些样本的亲本遗传来源不确定(未经人工繁育的野生个体繁育而来, 或底播人工苗种繁育而来)可能显著影响了采样样本的形态变异。贝类由于个体繁殖力强, 人工苗种往往来源于几个雄性亲本, 再加上海区间底播投苗来源不清晰, 这可能造成虽然地理相隔很远(如LS和ZZD地理距离远), 但形态比率变量仍聚类为一组。这也可能是LDA未能将所有个体完全清晰按采样点分开的原因(成功率仅62.6%)。
样本质量和测量方法的准确性是采用形态特征区分皱纹盘鲍群体的关键。无论在本研究的采样过程还是样本处理、测定中采用了严格的质量控制。比如为防止季节对样本测量指标的影响, 特别是重量相关指标的影响, 本研究均采用夏季7月份采样的样本; 采样地点的选择是至少近10年未由人工苗种底播的海区, 并且采样后严格观察是否有因海流等迁徙过来的人工底播鲍, 本实验中所有采样点虽有700余个标本采集, 但实际分析中仅有452个样本进入数据分析。在实验中测量时发现皱纹盘鲍壳高和粗糙度的测量会受到测量人和拍照获取壳轮廓影响很大, 实验中壳高SH的测定采用同一测量人多次测量(n>5)取平均的方法, 而为获取鲍壳外缘轮廓的凸包值, 实验采用同一天暗室光源拍照获取所有贝类轮廓的方式进行。此外, 在数据分析中, 为减少样本规格差异对结果的影响, 本研究采用数据对数转化, 并以对数转化后的壳长作为协变量来进行比率变量的协方差分析。尽管如此, 样本间规格差异大、样本量较小, 以及人工苗种的混杂或者遗传影响可能是本研究缺陷, 未来研究需加强该方面工作。
4 结论研究以我国沿海采集的7个皱纹盘鲍群体作为研究材料, 分析了群体内和群体间贝壳形态和体重相对生长的变异。协方差分析揭示形态特征变量(比率指标)在群体间存在显著变异; 非度量多维尺度分析和马氏距离将皱纹盘鲍群体分为2个组; 异速生长研究揭示了壳形态特征与皱纹盘鲍群体中异速生长差异之间的高度线性相关性, 异速生长程度呈现一定的群体区别; 然而线性判别分析未能较好地将各种群样本分类。该研究初步表明皱纹盘鲍表现出与我国沿海环境和/或生态条件差异相关的表型可塑性, 然而也可能受到人工底播影响造成的遗传影响。本研究将对于皱纹盘鲍渔业资源管理如管理单位的界定, 以及为今后全面评价不同地理群体的遗传变异等提供参考。
吕端华, 1978. 中国近海鲍科的研究[M]//中国科学院海洋研究所. 海洋科学集刊. 北京: 科学出版社: 89-100.
|
刘永峰, 刘永襄, 高绪生, 2020. 稚鲍人工配合饵料的初步研究. 水产科学, (2): 14-19 |
吴玉云, 2001. 我国主要经济鲍的形态计量学及随机扩增引物的DNA多态性研究[D]. 广州: 中山大学.
|
吴富村, 阙华勇, 张国范, 2020. 我国皱纹盘鲍底播增养殖历史、现状及未来发展趋势. 海洋科学, 44(8): 56-68 |
张仪方, 2019. 鲍的种间及群体间形态差异和遗传多样性研究[D]. 厦门: 厦门大学.
|
张昭, 1982. 在全国海珍品增养殖座谈会开始时的讲话[M]//国家水产总局养殖公司. 全国海珍品增养殖座谈会材料汇编. 国家水产总局养殖公司: 1-6.
|
陈木, 卢豪魁, 陈世杰, 等, 1977. 皱纹盘鲍人工育苗的初步研究. 动物学报, 23(1): 35-46 |
陈世杰, 1995. 鲍的形态类别及种名辑录. 福建水产, 1(2): 71-75, 82 |
章守宇, 王凯, 李训猛, 2020. 中国沿海潮下带重点藻场调查报告. 北京: 中国农业出版社
|
BEGG G A, WALDMAN J R, 1999. An holistic approach to fish stock identification. Fisheries Research, 43(1/2/3): 35-44 |
BELLAAJ-ZOUARI A, DKHILI S, GHARSALLI R, et al, 2012. Shell morphology and relative growth variability of the invasive pearl oyster Pinctada radiata in coastal Tunisia. Journal of the Marine Biological Association of the United Kingdom, 92(3): 553-563 DOI:10.1017/S0025315411001925 |
BOULDING E G, HOLST M, PILON V, 1999. Changes in selection on gastropod shell size and thickness with wave-exposure on Northeastern Pacific shores. Journal of Experimental Marine Biology and Ecology, 232(2): 217-239 DOI:10.1016/S0022-0981(98)00117-8 |
CARRO B, QUINTELA M, RUIZ J M, et al, 2019. Wave exposure as a driver of isolation by environment in the marine gastropod Nucella lapillus. Hydrobiologia, 839(1): 51-69 DOI:10.1007/s10750-019-03993-5 |
DAY R W, FLEMING A, 1992. The determinants and measurement of abalone growth [M]//SHEPHERD S A, TEGNER M J, GUZMAN DEL PRÓO S A. Abalone of the World: Biology, Fisheries and Culture. Oxford, Britain: Blackwell: 141-168.
|
DEFEO O, CASTILLA J C, 2005. More than one bag for the world fishery crisis and keys for co-management successes in selected artisanal Latin American shellfisheries. Reviews in Fish Biology and Fisheries, 15(3): 265-283 DOI:10.1007/s11160-005-4865-0 |
GALLARDO W G, BAUTISTA-TERUEL M N, FERMIN A C, et al, 2003. Shell marking by artificial feeding of the tropical abalone Haliotis asinina Linne juveniles for sea ranching and stock enhancement. Aquaculture Research, 34(10): 839-842 DOI:10.1046/j.1365-2109.2003.00890.x |
GARDNER J P A, 1996. The Mytilus edulis species complex in southwest England: effects of hybridization and introgression upon interlocus associations and morphometric variation. Marine Biology, 125(2): 385-399 DOI:10.1007/BF00346319 |
GEIGER D L, OWEN B, 2012. Abalone: Worldwide Haliotidae. Hackenheim: Conchbooks
|
KOBAYASHI M, FUJIO Y, 1996. Genetic study on shell shape and growth-related traits in the Pacific abalone Haliotis discus hannai. Tohoku Journal of Agricultural Research, 46(3/4): 141-147 |
LIU S, XUE Q G, XU H Q, et al, 2021. Identification of main oyster species and comparison of their genetic diversity in Zhejiang coast, south of Yangtze River estuary. Frontiers in Marine Science, 8: 662515 |
MARCHAIS V, JOLIVET A, HERVÉ S, et al, 2017. New tool to elucidate the diet of the ormer Haliotis tuberculata (L. ): digital shell color analysis. Marine Biology, 164(4): 71 |
MARES-MAYAGOITIA J A, DE-ANDA-MONTAÑEZ J A, PEREZ-ENRIQUEZ R, et al, 2021. Neutral and adaptive population structure of pink abalone (Haliotis corrugata): fishery management implications. ICES Journal of Marine Science, 78(5): 1909-1919 |
MARTIEN K K, TAYLOR B L, 2003. Limitations of hypothesistesting in defining management units for continuously distributed species. Journal of Cetacean Research and Management, 5(3): 213-218 |
NAJMUDEEN T M, 2015. Biometric relationships of the Indian abalone Haliotis varia Linnaeus 1758 from Mandapam waters of Gulf of Mannar, south-east coast of India. Indian Journal of Fisheries, 62(3): 146-150 |
NAM B H, KIM H, SEOL D, et al, 2021. Genotyping-by-Sequencing of the regional Pacific abalone (Haliotis discus) genomes reveals population structures and patterns of gene flow. PLoS One, 16(4): e0247815 |
NURUL AMIN S M, ARSHAD A, ZAINAL A, et al, 2008. First distribution records of Acetes intermedius (Decapoda: Sergestidae) from the coastal waters of Bintulu, Sarawak: population structure, length-weight and length-length relationship. Journal of Sustainability Science and Management, 3(1): 74-83 |
NURUL AMIN S M, ZAFAR M, 2004. Studies on age, growth and virtual population analysis of Coilia dussumieri from the neritic water of Bangladesh. Journal of Biological Sciences, 4(3): 342-344 |
REIST J D, 1986. An empirical evaluation of coefficients used in residual and allometric adjustment of size covariation. Canadian Journal of Zoology, 64(6): 1363-1368 |
RIZHINASHVILI A L, 2008. On the relationships between absolute and allometric shell growth in unionid mussels (Bivalvia, Unionidae) from European Russia. Inland Water Biology, 1(3): 241-247 |
ROGERS-BENNETT L, CATTON C A, 2019. Marine heat wave and multiple stressors tip bull kelp forest to sea urchin barrens. Scientific Reports, 9(1): 15050 |
SANDOVAL-CASTILLO J, ROBINSON N A, HART A M, et al, 2018. Seascape genomics reveals adaptive divergence in a connected and commercially important mollusc, the greenlip abalone (Haliotis laevigata), along a longitudinal environmental gradient. Molecular Ecology, 27(7): 1603-1620 |
SOKAL R R, ROHLF F J, 1981. Biometry. 2nd ed. New York, NY: W. H. Freeman and Company, 859
|
SOLAS M R, SEPÚLVEDA R D, BRANTE A, 2013. Genetic variation of the shell morphology in Acanthina monodon (Gastropoda) in habitats with different wave exposure conditions. Aquatic Biology, 18(3): 253-260 |
STEPHENS S A, BROEKHUIZEN N, MACDIARMID A B, et al, 2006. Modelling transport of larval New Zealand abalone (Haliotis iris) along an open coast. Marine and Freshwater Research, 57(5): 519-532 |
STRAIN E M A, JOHNSON C R, THOMSON R J, 2013. Effects of a range-expanding sea urchin on behaviour of commercially fished abalone. PLoS One, 8(9): e73477 |
TAKAMI H, KAWAMURA T, 2018. Ontogenetic habitat shift in abalone Haliotis discus hannai: a review. Fisheries Science, 84(2): 189-200 |
 2022, Vol. 53
2022, Vol. 53


