中国海洋湖沼学会主办。
文章信息
- 朱雅婷, 张明清, 吴妤莘, 赵会宏, 张海发, 舒琥. 2022.
- ZHU Ya-Ting, ZHANG Ming-Qing, WU Yu-Xin, ZHAO Hui-Hong, ZHANG Hai-Fa, SHU Hu. 2022.
- 赤点石斑鱼(Epinephelus akaara)精子超微结构及环境因子对精子活力的影响
- ULTRASTRUCTURE OF SPERMATOZOA AND EFFECTS OF ENVIRONMENTAL FACTORS ON SPERMATOZOA MOTILITY OF GROUPER EPINEPHELUS AKAARA
- 海洋与湖沼, 53(6): 1523-1530
- Oceanologia et Limnologia Sinica, 53(6): 1523-1530.
- http://dx.doi.org/10.11693/hyhz20220300079
文章历史
-
收稿日期:2022-03-31
收修改稿日期:2022-05-07
2. 华南农业大学海洋学院 广东广州 510642;
3. 广东省海洋渔业试验中心 广东惠州 516081
2. College of Marine Sciences, South China Agricultural University, Guangzhou 510642, China;
3. Guangdong Marine Fishery Experiment Center, Huizhou 516081, China
赤点石斑鱼(Epinephelus akaara)隶属鲈形目、鲈亚目、鮨科, 分布于北太平洋西部, 我国产于南海和东海南部。作为我国重要的经济鱼类, 其具有病害少、肉质鲜美、营养丰富等特点, 深受消费者的喜爱。由于过度捕捞, 自2003年以来, 赤点石斑鱼已被国际自然保护联盟(International Union for Conservation of Nature)列为濒危物种(Ahn et al, 2018)。为满足广大消费者需求, 大规模人工繁育赤点石斑鱼显得尤为重要。赤点石斑鱼是一种雌雄同体且雌性先熟的海洋鱼类。在自然条件下, 大多数个体在2~3龄时成熟为雌性, 然后在5~6龄时反转为雄性(He et al, 2011)。在正常养殖条件下, 雌鱼会在养殖初期占据亲鱼的主导地位, 这不可避免地导致成熟雄鱼稀缺(He et al, 2011)和精液质量差(Mylonas et al, 2017)等问题, 严重影响繁育和生产, 使赤点石斑鱼的人工养殖受到极大的限制(Lee et al, 2020)。因此, 对其精子生物学开展相关研究很有必要。
鱼类大多数为体外受精, 配子的质量及受精时的环境会影响鱼类的受精效果。精子质量可以被定义为精子利用其游动能力达到卵母细胞并使其受精的能力(Fauvel et al, 2010)。据报道, 精子的超微结构可被视为判断精子质量的标准之一(Kestemont et al, 2015)。同时, 受精环境也会极大影响精子活力, 相关研究表明, 鱼类精子活力与多种环境因素有关。Alavi等(2005)发现激活介质的温度和pH会影响精子的运动时间、受精能力和速度。Griffin等(1998)研究发现, 当盐度高于或低于最适盐度16时, 太平洋鲱鱼(Clupea pallasi)游动精子的数量逐步减少。Mylonas等(2003, 2017)阐述了激素和季节变化对精子活力的影响。由此可见, 鱼类精子活力与温度、pH、盐度、离子浓度、激素及季节变化等因素有关, 这是鱼类精子生理与环境相适应的结果(潘德博等, 2002; 刘鉴毅等, 2014; 郑学斌等, 2018)。因此, 研究不同的环境因子对赤点石斑鱼精子活力的影响, 对提高精子受精率、增强人工繁育及增殖能力具有重要意义。目前, 赤点石斑鱼尚未见相关方面的报道。
本文对赤点石斑鱼精子超微结构进行了观察分析, 探讨了环境因子(温度、盐度、pH及不同离子浓度等)对其精子活力的影响, 并探究其相关影响机制, 旨在为赤点石斑鱼规模化人工繁育提供基础资料和指导。
1 材料与方法 1.1 亲鱼来源实验用赤点石斑鱼(Epinephelus akaara)采自广东省大亚湾海洋渔业试验中心养殖网箱, 选用繁殖季节健康且发育良好的雄性亲鱼10尾(全长35.2~ 41.0 cm, 体质量770~1 060 g)。
1.2 精子采集与观察 1.2.1 精子采集用洁净的干毛巾擦干鱼体生殖孔及周围的水分, 沿腹鳍向臀鳍方向挤压腹部, 挤出精巢内的精液, 用灭菌的滴管吸取精液, 放入取样管中并立即进行精子活力观察。采集的精液为乳白色, 干净且无尿液、粪便及体表水分污染。
1.2.2 超薄切片标本的制备取收集的精液加入等量2.5%的戊二醛溶液(pH 7.4), 双层纱布过滤, 制成精子悬液, 3 500 r/min离心5 min, 去上清液, 加适量2.5%的戊二醛溶液(pH 7.4)于4 ℃固定。然后, 样品经磷酸缓冲液(pH 7.4)冲洗、1%的锇酸后固定, 各级乙醇脱水, Epon812树脂包埋, 切片后使用醋酸铀和柠檬酸铅染色, 在TECNAI 12透射电镜观察、测量并拍照。
1.2.3 扫描电镜标本的制备精子样品用2.5%的戊二醛和1%的锇酸双重固定, 各级乙醇脱水, 入丙酮、醋酸异戊酯, 临界点干燥仪干燥, 镀金后, 使用FEI-XL30环境扫描电子显微镜观察、测量并拍照。
1.3 精子活力观察将天然海水过滤后灭菌, 使用海水晶(盐通, 江苏)和ddH2O调节过滤海水的盐度, 设置10、15、20、25、30、33、40共7个盐度梯度, 其中大亚湾海区天然海水盐度为33。用0.1 mol/L的NaOH和HCl溶液调节过滤海水的pH值, 设置6.5、7、7.5、8.1、8.5、9、9.5共7个pH梯度, 天然海水pH值为8.5。取适量过滤海水于烧杯中, 置于恒温箱中, 设置4个温度梯度(23、27、31、34 ℃)。使用去离子水配制不同浓度的NaCl、KCl、EDTANa2、CaCl2、MgCl2溶液, 本研究所用NaCl、KCl、EDTANa2、CaCl2、MgCl2均为分析纯。
精子活力观察方法参照文献(赵会宏等, 2003)并加以改进, 观察具体方法如下: 在凹面载玻片上滴加适量的无菌过滤海水, 然后用微量进样器取等量的精液与载玻片上的海水混匀, 同时计时。观察精子活力的方法和指标为: (1) 快速运动时间, 精子自激活开始到约90%原处颠动前的激烈运动; (2) 寿命, 精子自激活开始到约90%停止颠动。每个处理重复3次, 结果取平均值。
1.4 数据处理所有数据处理均使用统计软件SPSS 26.0进行, 所有数据均以“平均数±标准差”表示。
2 结果 2.1 赤点石斑鱼精子的超微结构 2.1.1 扫描电镜下精子的形态在扫描电镜下, 赤点石斑鱼精子由头部、颈部(中段)和尾部(鞭毛)三部分组成。可清晰观察到精子头部呈圆形, 表面光滑, 无顶体, 头长1.65~2.02 μm, 直径约为(1.8±0.095) μm, 颈部(中段)宽(0.94±0.35) μm, 长为(0.73±0.26) μm, 尾部(鞭毛)自头部后端的正中部向后伸出, 细且长, 约为(30.16±2.49) μm (图1: 10~12)。
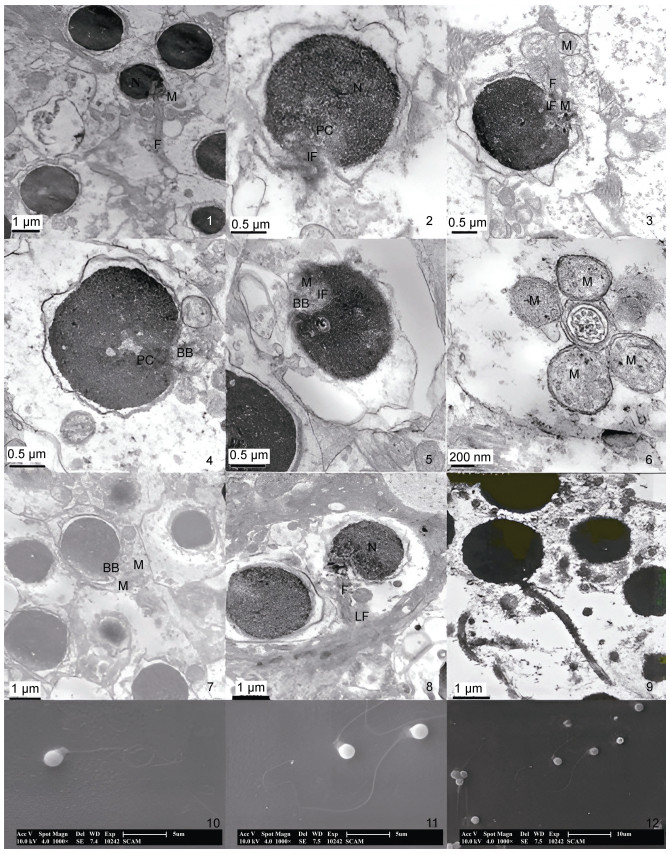 |
| 图 1 赤点石斑鱼精子的超微结构 Fig. 1 The ultrastructure images of E. akaara spermatozoon 注: 1. 精子纵切, 示头部和尾部; 2. 精子头部横切, 示细胞核、近端中心粒、植入窝; 3. 精子头部横切, 示近端中心粒、植入窝、线粒体; 4. 精子头部横切, 示近端中心粒、基体; 5. 精子头部横切, 示近端中心粒、基体、线粒体; 6. 精子尾部横切, 示轴丝的“9+2”结构; 7. 精子头部横切, 示基体、线粒体; 8~9. 精子纵切, 示头部、尾部及侧鳍; 10~12. 扫描电镜下赤点石斑鱼精子外形。A: 轴丝; BB: 基体; H: 头部; F: 鞭毛; IF: 植入窝; LF: 侧鳍; M: 线粒体; MP: 中段; N: 细胞核; PC: 近端中心粒 |
透射电镜下, 赤点石斑鱼精子头部在不同切面呈圆形或卵圆形, 直径为1.65~2.05 μm, 头部几乎全部由细胞核组成, 细胞质相对较少(图1: 1~3)。细胞核圆形, 核膜双层, 核质由电子染色深的颗粒组成, 呈现出较大的电子密度。精子头部有质膜, 细胞质包裹在核外周, 有波浪形的皱褶, 头部未见顶体或类似顶体的结构(图1: 2, 3, 9)。袖套位于核后端、呈筒状, 围绕轴丝形成的空腔称为袖套腔; 袖套两侧不对称, 分布着大小、数量不等的线粒体和囊泡(图1: 4~7)。线粒体排列也不对称, 袖套的纵、横切面均可见到2~4个线粒体。头部细胞核后端有一较浅的凹痕称为植入窝(图1: 2, 3)。
尾部细长。起始部分位于袖套腔中(图1: 1, 8), 大部分伸出袖套腔外。尾部的核心结构为轴丝。尾部起始端由细胞质、线粒体和轴丝前段构成。中心粒复合体包括近端中心粒和基体两部分, 位于植入窝内(图1: 4)。由基体与轴丝相连发出“9+2”微管结构(图1: 6), 即9组外周二联微管及1对中央微管对。整个尾部的结构一致, 无主段末段之分。
2.2 赤点石斑鱼精子活力观察 2.2.1 温度对精子活力的影响水温对赤点石斑鱼的精子活力影响见图2。精子活力从23 ℃开始缓慢升高, 到27.5 ℃升至最高值, 此时精子的快速运动时间和寿命分别为27 min和37 min, 之后开始下降。精子的快速运动时间在23~27.5 ℃变化不大, 在27.5 ℃达到最高值后快速下降。精子活力在23~31 ℃范围内较好。
 |
| 图 2 赤点石斑鱼精子活力与水温的关系 Fig. 2 The impact of water temperature on the motility duration and lifetime of E. akaara spermatozoa |
由图3所示, 盐度为10 时精子无活力, 之后随着盐度升高精子活力快速上升, 在盐度为15时达最高值, 此时精子的快速运动时间和寿命分别为43 min和50 min。之后, 伴随盐度升高, 精子活力开始下降, 但在盐度为30时又开始升高, 并于盐度为33时达到一新的峰值, 此时精子的快速运动时间和寿命分别为20 min和35 min。随后, 精子活力伴随盐度的升高而下降, 在盐度为35以后快速下降。
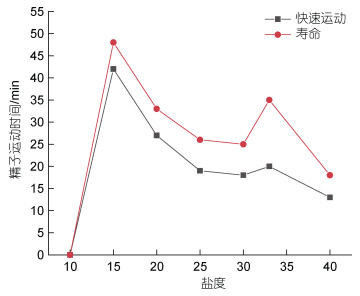 |
| 图 3 盐度与赤点石斑鱼精子活力的关系 Fig. 3 The impact of water salinity on the motility duration and lifespan of E. akaara spermatozoa |
由图4可见, 在不同的pH值下赤点石斑鱼精子的快速运动时间和寿命的变化不大; 从pH 8.1开始, 该鱼精子运动的寿命逐渐延长, 到pH 9时精子的寿命达到最高值33 min, 此后精子寿命迅速下降; 而精子的快速运动时间则在pH 8.1时就达到最高值26 min, 此后便缓慢下降。
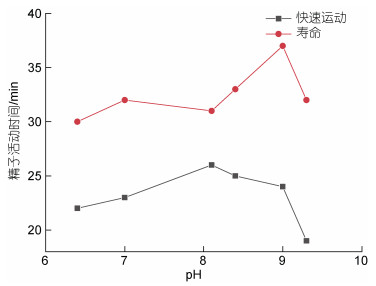 |
| 图 4 pH值与赤点石斑鱼精子活力的关系 Fig. 4 The impact of water pH value on the motility duration and lifespan of E. akaara spermatozoa |
由表1可知, 赤点石斑鱼精子在400~700 mmol/L的NaCl溶液和400~600 mmol/L KCl溶液中均具有较好的活动能力, 在EDTANa2溶液中精子呈抑制状态, 在500 mmol/L的CaCl2溶液中精子活动能力亦佳。在MgCl2溶液中, 精子活力表现不佳。
| NaCl /(mmol/L) |
运动精子/% | KCl /(mmol/L) |
运动精子/% | EDTANa2 /(mmol/L) |
运动精子/% | CaCl2 /mmol/L |
运动精子/% | MgCl2 /(mmol/L) |
运动精子/% |
| 100 | 0 | 100 | 0 | 100 | 0 | 100 | 0 | 100 | 0 |
| 200 | 0 | 200 | 0 | 200 | 0 | 200 | 0 | 200 | 0 |
| 300 | 40 | 300 | 20 | 300 | 0 | 300 | 20 | 300 | 10 |
| 400 | 90 | 400 | 90 | 400 | 0 | 400 | 40 | 400 | 20 |
| 500 | 100 | 500 | 95 | 500 | 0 | 500 | 80 | 500 | 60 |
| 600 | 95 | 600 | 95 | 600 | 0 | 600 | 50 | 600 | 40 |
| 700 | 90 | 700 | 60 | 700 | 0 | 700 | 10 | 700 | 30 |
| 800 | 30 | 800 | 40 | 800 | 0 | 800 | 5 | 800 | 10 |
| 900 | 0 | 900 | 10 | 900 | 0 | 900 | 0 | 900 | 5 |
| 1 000 | 0 | 1 000 | 5 | 1 000 | 0 | 1 000 | 0 | 1 000 | 0 |
赤点石斑鱼精子头部浓缩的细胞核具有较高的电子密度, 非常致密, 细胞核中核质部分高度凝聚, 没有空隙(即核泡)存在(图1: 1, 2), 其他一些鱼类精子头部的细胞核中亦有相似之处(魏刚等, 1995; 胡谋等, 2014)。此外, 赤点石斑鱼精子的核膜紧贴于质膜, 与鲤鱼(Cyprinus carpio)、草鱼(Ctenopharyngodon idellus)、七带石斑鱼(E. septemfasciatus) (廖光勇等, 2011)、兴国红鲤(C. carpio var. singguoensis) (林光华等, 1998)类似, 但与某些硬骨鱼类的精子不同。管汀鹭等(1990)发现金鱼(Carassius auratus auratus)精子核膜与质膜之间有液泡存在, Liu等(2015)在大西洋牙鲆(Paralichthys dentatus)中也有类似报道。此外, 在斜带石斑鱼(E. coioides) (赵会宏等, 2003)、日本鳗鲡(Anguilla japonica) (张涛等, 2010)中观察到精子核膜与质膜存在较大间隙的现象。林光华等(1998)对革胡子鲇(Clarias gariepinus)精细胞进行研究发现, 其头部核后端具有较为丰富的细胞质。但硬骨鱼精子头部核膜与质膜间空间的大小及所含细胞质的多少对精子活力究竟有何影响, 对受精过程有何生理意义, 目前尚不清楚, 需进一步研究。
3.2 赤点石斑鱼精子近端中心粒赤点石斑鱼精子植入窝不在核正中, 而是偏向一侧, 中心粒复合体不在细胞核的主轴上, 也偏向核的一侧, 近端中心粒和基体不呈常见的“T”字形排列, 而是有一定的角度, 与鲫鱼(C. auratus)相似。通常硬骨鱼精子的植入窝多位于细胞核后端, 但也有位于核的一侧。如鲤鱼精子的植入窝就位于核的一侧(尤永隆等, 1996), 同赤点石斑鱼精子类似。但鲤鱼的近端中心粒和基体垂直, 呈“T”字形排列。而赤点石斑鱼精子的近端中心粒和基体的排列形式与鲫鱼、红鳍东方鲀(Takifugu rubripes) (张筱兰等, 1999)类似, 与大黄鱼(Larimichthys crocea) (尤永隆等, 1997)不同, 它的中心粒复合体的走向与细胞核长轴平行。Madhavi等(2015)也曾指出: 中心粒复合体的相对位置具有种间特异性, 从平行状态到垂直状态均有出现, 差异较大。
3.3 赤点石斑鱼精子尾部结构赤点石斑鱼精子尾部轴丝为典型的“9+2”结构(图1: 6), 与真鲷(Pagrus major) (Liu et al, 2007)、大西洋牙鲆(Liu et al, 2015)、鞍带石斑鱼(E. lanceolatus)、云纹石斑鱼(E. moara)、鲤鱼、长吻鮠(Leiocassis longirostris)等鱼类相同。此外, 赤点石斑鱼精子尾部的轴丝起始段无中央微管对结构, 这与大黄鱼、红鳍东方鲀相似; 轴丝具有极少量的外周囊泡, 轴丝之外无其他明显结构, 缺少某些硬骨鱼会出现的结构, 如白梭吻鲈(Sander lucioperca)精子尾部的侧鳍(lateral fin) (křišťan et al, 2014)、大黄鱼精子尾部的篓状结构(basket-like structure)等。
3.4 赤点石斑鱼精子活力 3.4.1 温度、盐度和pH值对赤点石斑鱼精子活力的影响Lahnsteiner等(2012)发现精子的供能酶和鞭毛运动与温度密切相关, 过低和过高的温度都会影响精子的活力。研究表明温度与精子快速运动时间的关系是一个开口向下的二次曲线函数关系(Van Deurs et al, 1973)。本研究中, 在23~34 ℃范围内, 赤点石斑鱼精子的活力先逐步升高, 到临界温度时再下降, 说明其精子活力的适宜温度范围是23~31 ℃, 最适温度为27.5 ℃, 这与繁殖季节的最适水温范围(24~28 ℃)相符合。
盐度对鱼类精子的影响主要与渗透压和离子浓度的变化相关联。研究表明, 鱼类精浆的适宜渗透压为656.8~838 kPa。因鱼类大多数为体外受精, 精子在性腺或精液中通常不运动(Cosson et al, 2008), 而是在释放到水生环境中后开始运动, 由性腺和水生环境之间的物理(渗透压)或化学(离子组成、pH)差异触发(Byrne et al, 2015)。涉及精子活动激活的机制在物种之间差异很大(Herrera et al, 2021)。例如, 在海洋硬骨鱼类中, 精子活力因暴露于高盐受精环境相关的高渗溶液而被激活(Tiersch et al, 2012)。相比之下, 在淡水鱼类中, 精子活力因暴露于淡水受精环境相关的低渗溶液而被激活(Alavi et al, 2006)。从鱼类精子的适盐性与环境盐度的关系来看, 精子所需的适盐范围与该物种繁殖季节的盐度密切相关。从本试验结果来看, 赤点石斑鱼精子的适宜盐度范围较广, 在15~35之间, 能很好地适应大亚湾海区赤点石斑亲鱼产卵阶段的盐度(28~34.8)。由于赤点石斑鱼的卵属于浮性卵, 即正常盐度的海水能够起到筛选卵子的作用, 而精子活力也只是在这一较窄范围内活力最高, 这也反映了它对环境的适应。此外, 赤点石斑鱼精子对pH值的变化适应性较强, 这与大多数海水鱼类相似(区又君等, 2011)。
3.4.2 离子浓度对赤点石斑鱼精子活力的影响离子浓度是影响精子活力的重要因素。鱼类精浆中一般富含K+、Na+、Ca2+和Mg2+等, 因此精子激活的直接动力被认为源于精浆与海水中这些离子含量的差异(严安生等, 1993)。适宜的Na+、K+浓度, 是保持鱼类精子活力的重要条件。Na+对鱼类精子活力的影响已被许多研究所证实。萨罗罗非鱼(Sarotherodon melanotheron)在NaCl浓度为30时精子快速运动时间最长(罗明坤等, 2014); 鲤、团头鲂(Megalobrama amblycephala)在5的NaCl溶液中快速运动及寿命最长(严安生等, 1993); 宽体沙鳅(Sinibotia reevesae)精子活力在4时达到最高(王永明等, 2016); 点带石斑鱼(Epinephelus malabaricus)在15的NaCl溶液中寿命最长(王小刚等, 2013)。在本试验中, 赤点石斑鱼精子在400~700 mmol/L的NaCl溶液中, 活动精子可达90%以上。NaCl浓度在200 mmol/L以下及900 mmol/L以上不能激活赤点石斑鱼精子。
赤点石斑鱼精子在400~600 mmol/L的KCl溶液中活动能力较佳, 变化趋势与精子在NaCl溶液中相似。萨罗罗非鱼在K+浓度为0.5%时精子活力最强, 寿命也最长。宽体沙鳅在0.4%的KCl时精子活力最强, 存活时间也最长。此外, Morisawa等(1983)发现, K+的存在增加了鲤科鱼类精子的游动速度。Lahnsteiner(2014)也发现, 0.25 mmol/L浓度的K+使河鲈(Perca fluviatilis)精子的游动速度增加。但同时, Billard等(1987)与Cosson等(1989)发现20~40 mmol/L的K+浓度完全抑制了虹鳟鱼精子的活力。Dumorné等(2018)报道K+对鲑鱼精子的运动性具有抑制作用。严安生等(1993)对鲤、团头鲂等鲤科鱼类的研究表明, K+对精子的影响表现与Na+相似, 并且相同渗透压的K+具有延长精子寿命的作用。本研究也可得出类似的结果, K+对赤点石斑鱼精子活力的影响与Na+类似, 但同样在800~1 000 mmol/L的高离子浓度下, 精子在K+环境中的活动能力强于Na+。
Ca2+、Mg2+离子是精浆中的重要组成成分, 但它们对精子的作用与Na+、K+离子不同。Morisawa等(1983)发现, 0~16 mmol/L的Ca2+或Mg2+溶液不影响大马哈鱼精子的运动时间。赤点石斑鱼精子仅在500 mmol/L的CaCl2溶液中精子活力较佳, 高于或低于此浓度, 精子活力明显下降, 产生较强的抑制作用。在MgCl2溶液中, 精子活力均受到抑制。可能是由于外源性的Ca2+、Mg2+离子引起精子内部的渗透压或内环境发生变化从而导致活力下降, 该结果与金属离子对中华倒刺鲃(Spinibarbus sinensis) (张春霖等, 1999)及中华鲟精子的研究结果一致。
EDTANa2为二价金属离子的螯合剂, 它们对赤点石斑鱼精子的抑制作用可能是由于其螯合了Ca2+、Mg2+引起的, 这与鳗鲡(Anguilla japonica)、牙鲆(P. olivaceus) (王宏田等, 1999)的研究结果一致。
4 结论赤点石斑鱼成熟精子的结构特点是细胞核圆形或卵圆形, 核内染色质致密, 核膜紧贴于质膜, 没有核泡(核空隙)。精子植入窝和中心粒复合体偏向核的一侧, 尾部细长, 横切面为典型的“9+2”微管结构。精子的最适温度范围与繁殖季节的最适水温范围符合, 适宜盐度范围较广, 对pH值的变化适应性较强, 符合海水鱼类的特性。精子在NaCl、KCl、CaCl2溶液中活动能力较强, 在MgCl2溶液和EDTANa2溶液中呈抑制状态。
王小刚, 骆剑, 尹绍武, 等, 2013. 点带石斑鱼的精子活力及超低温冷冻前后精子超微结构的比较. 海洋科学, 37(2): 70-75 |
王永明, 陈瑜, 胡雨, 等, 2016. 宽体沙鳅精子超微结构及 Na+、K+、Ca2+对其精子活力的影响. 四川动物, 35(1): 38-43 |
王宏田, 张培军, 1999. 环境因子对牙鲆精子运动能力的影响. 海洋与湖沼, 30(3): 233-237 DOI:10.3321/j.issn:0029-814X.1999.03.001 |
区又君, 廖光勇, 陈超, 等, 2011. 七带石斑鱼精子活力及其与环境的关系. 海洋环境科学, 30(4): 516-519 DOI:10.3969/j.issn.1007-6336.2011.04.014 |
尤永隆, 林丹军, 1996. 鲤鱼精子超微结构的研究. 动物学研究, 17(4): 377-383 |
尤永隆, 林丹军, 1997. 大黄鱼精子的超微结构. 动物学报, 43(2): 119-126 DOI:10.3321/j.issn:0001-7302.1997.02.002 |
刘鉴毅, 黄晓荣, 章龙珍, 等, 2014. 盐度、温度和pH对2种篮子鱼精子活性的影响. 海洋渔业, 36(6): 523-528 DOI:10.3969/j.issn.1004-2490.2014.06.007 |
严安生, 王其和, 李诗模, 1993. 渗透压和钾对鲤、团头鲂精子活力的影响. 淡水渔业, 23(3): 19-21 |
张春霖, 李英文, 邹奇志, 等, 1999. 金属离子及低温对中华倒刺鲃精子活力的影响. 西南农业大学学报, 21(3): 274-278 |
张涛, 柳凌, 张洁明, 等, 2010. 日本鳗鲡精卵的超微结构以及受精过程观察. 水生生物学报, 34(4): 769-778 |
张筱兰, 姜明, 姚斐, 等, 1999. 红鳍东方鲀精子形态的研究. 青岛海洋学报, 29(2): 255-259 |
林光华, 林琼, 胡成钰, 等, 1998. 草鱼、兴国红鲤和革胡子鲇精子超微结构的比较研究. 南昌大学学报(理科版), 22(3): 283-287 |
罗明坤, 赵岩, JEERAWAT T, 等, 2014. pH、盐度及K+、Ca2+和葡萄糖对萨罗罗非鱼精子活力的影响. 南方农业学报, 45(11): 2076-2080 |
郑学斌, 张清科, 朱咏梅, 等, 2018. 几种环境因子对马口鱼精子活力的影响. 生物学杂志, 35(6): 74-78 |
赵会宏, 刘晓春, 林浩然, 等, 2003. 斜带石斑鱼精子超微结构及盐度、温度、pH对精子活力及寿命的影响. 中国水产科学, 10(4): 286-290 |
胡谋, 苗亮, 李明云, 等, 2014. 黄姑鱼(Nibea albiflora)与大黄鱼(Pseudosciaena crocea)精子超微结构的观察与比较. 生物学杂志, 31(2): 1-4 |
管汀鹭, 黄丹青, 黄国屏, 1990. 金鱼精巢的细胞构造与精子的发生和形成. 水生生物学报, 14(3): 233-238 |
廖光勇, 区又君, 李加儿, 等, 2011. 七带石斑鱼精子的超微结构. 上海海洋大学学报, 20(1): 71-75 |
潘德博, 谢骏, 王广军, 2002. 环境因子对日本鳗鲡精子活力影响的研究. 水产科技情报, 29(5): 198-200 |
魏刚, 戴大临, 陈怀辉, 等, 1995. 长吻鮠精子超微结构的观察. 四川动物, 14(2): 56-57 |
AHN J Y, PARK J Y, LIM H K, 2018. Effects of different diluents, cryoprotective agents, and freezing rates on sperm cryopreservation in Epinephelus akaara. Cryobiology, 83: 60-64 |
ALAVI S M H, COSSON J, 2005. Sperm motility in fishes. I. Effects of temperature and pH: a review. Cell Biology International, 29(2): 101-110 |
ALAVI S M H, COSSON J, 2006. Sperm motility in fishes. (II) Effects of ions and osmolality: a review. Cell Biology International, 30(1): 1-14 |
BILLARD R, COSSON M P, CHRISTEN R, 1987. Some recent data on the biology on trout spermatozoa[C]//Proceedings of the Third International Symposium on Reproductive Physiology of Fish. St John’s, Newfoundland: 187-190.
|
BYRNE P G, DUNNE C, MUNN A J, et al, 2015. Environmental osmolality influences sperm motility activation in an anuran amphibian. Journal of Evolutionary Biology, 28(3): 521-534 |
COSSON M P, BILLARD R, LETELLIER L, 1989. Rise of internal Ca2+ accompanies the initiation of trout sperm motility. Cell Motility and the Cytoskeleton, 14(3): 424-434 |
COSSON J, GROISON A L, SUQUET M, et al, 2008. Studying sperm motility in marine fish: an overview on the state of the art. Journal of Applied Ichthyology, 24(4): 460-486 |
DUMORNÉ K, FIGUEROA E, COSSON J, et al, 2018. Protein phosphorylation and ions effects on salmonid sperm motility activation. Reviews in Aquaculture, 10(3): 727-737 |
FAUVEL C, SUQUET M, COSSON J, 2010. Evaluation of fish sperm quality. Journal of Applied Ichthyology, 26(5): 636-643 |
GRIFFIN F J, PILLAI M C, VINES C A, et al, 1998. Effects of salinity on sperm motility, fertilization, and development in the Pacific herring, Clupea pallasi. The Biological Bulletin, 194(1): 25-35 |
HE Q T, LU G, CHE K, et al, 2011. Sperm cryopreservation of the endangered red spotted grouper, Epinephelus akaara, with a special emphasis on membrane lipids. Aquaculture, 318(1/2): 185-190 |
HERRERA F, BONDARENKO O, BORYSHPOLETS S, 2021. Osmoregulation in fish sperm. Fish Physiology and Biochemistry, 47(3): 785-795 |
KESTEMONT P, DABROWSKI K, SUMMERFELT R C, et al, 2015. Biology and Culture of Percid Fishes: Principles and Practices. Dordrecht: Springer, 163-191
|
KŘIŠŤAN J, HATEF A, ALAVI S M H, et al, 2014. Sperm morphology, ultrastructure, and motility in pikeperch Sander lucioperca (Percidae, Teleostei) associated with various activation media. Czech Journal of Animal Science, 59(1): 1-10 |
LAHNSTEINER F, 2014. The effect of K+, Ca2+, and Mg2+ on sperm motility in the perch, Perca fluviatilis. Fish Physiology and Biochemistry, 40(2): 469-480 |
LAHNSTEINER F, MANSOUR N, 2012. The effect of temperature on sperm motility and enzymatic activity in brown trout Salmo trutta, burbot Lota lota and grayling Thymallus thymallus. Journal of Fish Biology, 81(1): 197-209 |
LEE C H, HUR S W, KIM B H, et al, 2020. Induced maturation and fertilized egg production of the red-spotted grouper, Epinephelus akaara, using adaptive physiology of photoperiod and water temperature. Aquaculture Research, 51(5): 2084-2090 |
LIU Q H, LI J, ZHANG S C, et al, 2007. Flow cytometry and ultrastructure of cryopreserved red seabream (Pagrus major) sperm. Theriogenology, 67(6): 1168-1174 |
LIU Q H, MA D Y, XU S H, et al, 2015. Summer flounder (Paralichthys dentatus) sperm cryopreservation and application in interspecific hybridization with olive flounder (P olivaceus). Theriogenology, 83(4): 703-710 |
MADHAVI M, KAILASAM M, MOHANLAL D L, 2015. Ultrastructure of sperm of the Spotted scat (Scatophagus argus, Linnaeus, 1766) observed by scanning and transmission electron microscopy. Animal Reproduction Science, 153: 69-75 |
MORISAWA M, SUZUKI K, SHIMIZU H, et al, 1983. Effects of osmolality and potassium on motility of spermatozoa from freshwater cyprinid fishes. Journal of Experimental Biology, 107(1): 95-103 |
MYLONAS C C, DUNCAN N J, ASTURIANO J F, 2017. Hormonal manipulations for the enhancement of sperm production in cultured fish and evaluation of sperm quality. Aquaculture, 472: 21-44 |
MYLONAS C C, PAPADAKI M, DIVANACH P, 2003. Seasonal changes in sperm production and quality in the red porgy Pagrus pagrus (L. ). Aquaculture Research, 34(13): 1161-1170 |
TIERSCH T R, YANG H P, 2012. Environmental salinity-induced shifts in sperm motility activation in Fundulus grandis. Aquaculture, 324-325: 145-150 |
VAN DEURS B, LASTEIN U, 1973. Ultrastructure of the spermatozoa of the teleost Pantodon buchholzi Peters, with particular reference to the midpiece. Journal of Ultrastructure Research, 42(5/6): 517-533 |
 2022, Vol. 53
2022, Vol. 53


