中国海洋湖沼学会主办。
文章信息
- 吕晓阳, 黄骞, 李蒙, 刘炜鑫, 李才文. 2022.
- LYU Xiao-Yang, HUANG Qian, LI Meng, LIU Wei-Xin, LI Cai-Wen. 2022.
- 海洋寄生甲藻血卵涡鞭虫生活史及温度对其发展的影响
- LIFE CYCLE OF MARINE PARASITIC DINOFLAGELLATE HEMATODINIUM PEREZI AND EFFECT OF TEMPERATURE ON GROWTH
- 海洋与湖沼, 53(6): 1430-1440
- Oceanologia et Limnologia Sinica, 53(6): 1430-1440.
- http://dx.doi.org/10.11693/hyhz20220200042
文章历史
-
收稿日期:2022-02-28
收修改稿日期:2022-03-18
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 山东青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 山东青岛 266071
2. Marine Ecology and Environmental Science Laboratory, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
血卵涡鞭虫(Hematodinium spp.)是一类感染海水甲壳类的致病性寄生甲藻(parasitic dinoflagellates), 目前在世界范围内感染40多种蟹、虾类, 包括多种重要野生(如美国兰蟹、蛛雪蟹和挪威龙虾)及养殖经济物种(如三疣梭子蟹和拟穴青蟹)(Stentiford et al, 2005; Li et al, 2021a)。该寄生甲藻主要寄生在甲壳动物宿主的血淋巴和血腔内, 在体内大量增殖, 引起宿主重要器官、组织(如心脏、肝胰腺和鳃等)发生功能紊乱甚至丧失, 最终导致宿主死亡(Stentiford et al, 2005; Wheeler et al, 2007; 王金凤等, 2015)。近年来, 我国浙江舟山、广东汕头、山东半岛、河北和天津等沿海主要经济蟹类养殖区均报道发现了血卵涡鞭虫的分布存在, 其感染宿主包括三疣梭子蟹(Portunus trituberculatus)、拟穴青蟹(Scylla paramamosain)、脊尾白对虾(Exopalaemon carinicauda)和斑节对虾(Penaeus monodon)(许文军等, 2007a, 2007b, 2010; Li et al, 2008, 2021a; 李才文等, 2014; Wang et al, 2017; 王印庚等, 2017)。自2013年首次被报道发现以来, 山东沿海三疣梭子蟹养殖池塘中血卵涡鞭虫流行病频繁暴发, 给当地养殖户造成了严重的经济损失(Li et al, 2013; Wang et al, 2017)。最近研究发现, 山东沿海混合养殖池塘周边的野生天津厚蟹(Helice tientsinensis)是血卵涡鞭虫的重要轮转宿主和潜在病原来源, 在混合养殖系统中的血卵涡鞭虫传播扩散过程中发挥重要作用(Huang et al, 2019, 2021; Li et al, 2021b)。
血卵涡鞭虫的生活史比较复杂。基于体外连续培养体系, 目前仅对分离自挪威龙虾(Nephrops norvegicus)和美国兰蟹(Callinectes sapidus)的两个血卵涡鞭虫株系开展了较为完整的生活史研究(Appleton et al, 1998; Li et al, 2011)。结果表明, 这两个株系具有大致相似的生活史, 均经历了丝状滋养体、蛛网状滋养体、蛛网状孢子体、团块状聚合体、孢子母细胞、孢子前细胞和孢子等生活史阶段。感染我国近海三疣梭子蟹、天津厚蟹的血卵涡鞭虫与感染美国兰蟹及欧洲港口蟹(Liocarcinus depurator)的血卵涡鞭虫株系遗传进化关系相近, 属于典型种Hematodinium perezi的不同基因型(肖洁等, 2015; Huang et al, 2019)。团队研究人员通过建立体外培养, 前期也发现了分离自三疣梭子蟹的血卵涡鞭虫株系的多个典型生活史阶段(Wang et al, 2017), 但是仍缺乏对于我国近海血卵涡鞭虫株系完整生活史的系统研究。开展对分离于不同宿主的血卵涡鞭虫株系的生活史研究, 有助于了解该寄生甲藻的复杂生活史, 明确其传播扩散过程中的关键生活史阶段, 并进一步揭示血卵涡鞭虫的流行病学特征。
血卵涡鞭虫在野生和养殖甲壳类宿主群体中的流行感染具有季节性特征, 在挪威龙虾中的感染高峰期为冬春季(Field et al, 1992, 1998; Stentiford et al, 2001), 在美国兰蟹中的感染高峰期为秋季和次年春季(Messick et al, 2000; Sheppard et al, 2003), 在白氏雪蟹(Chionoecetes bairdi)和三疣梭子蟹中的感染高峰期为夏季(Meyers et al, 1990; Eaton et al, 1991; Love et al, 1993; Wang et al, 2017)。Huang等(2021)发现环境水体温度与血卵涡鞭虫宿主感染率呈显著正相关关系, 当水温高于25 ℃时宿主感染率明显较高。体外培养实验结果表明, 温度可显著影响血卵涡鞭虫的细胞生长发育, 感染挪威龙虾的血卵涡鞭虫株系在8~15 ℃的体外培养条件下能够进行正常生长发育(Appleton et al, 1998), 而感染美国兰蟹的血卵涡鞭虫株系在低于15 ℃的体外培养条件下生长、增殖缓慢甚至停滞, 无法完成生活史(Li et al, 2011)。此外, 美国兰蟹体内血卵涡鞭虫形成、释放孢子的最适温度为25 ℃ (Huchin-Mian et al, 2018)。以上研究结果表明, 温度与血卵涡鞭虫的生活史密切相关, 可能是影响血卵涡鞭虫流行病发生的重要环境因子。
本文通过血涂片法、H & E染色法(hematoxylin- eosin staining, 苏木精-伊红染色法)和体外培养方法系统研究了从我国沿海天津厚蟹中分离的血卵涡鞭虫株系的生活史, 详细描述了血卵涡鞭虫在感染宿主体内(血淋巴、组织)和体外培养体系中的各生活史阶段的细胞形态, 并进一步探究了温度对血卵涡鞭虫生活史发展的影响, 以进一步丰富和完善我们对于海洋寄生甲藻血卵涡鞭虫的科学认知, 为经济甲壳动物渔业生产中血卵涡鞭虫流行病的有效防控提供理论依据。
1 材料与方法 1.1 实验天津厚蟹及病原采集实验用天津厚蟹采集自山东省青岛市黄岛区琅琊水产养殖基地。在养殖池塘周边渠道中布置网笼诱捕天津厚蟹, 后置于塑料箱中, 常温条件下运到中国科学院海洋研究所。随后, 对采集的天津厚蟹进行血淋巴检测确认其血卵涡鞭虫感染情况(方法见1.2)。筛选后的血卵涡鞭虫感染个体与健康个体分别置于独立循环水系统中, 室温条件下[(20±2) ℃]饲养, 定期投喂适量蛤蜊肉并清理残饵以保持水质。
1.2 血卵涡鞭虫感染检测血淋巴检测: 参照Stentiford等(2005)的血涂片法对天津厚蟹中血卵涡鞭虫的感染程度和生活史阶段进行检测。具体步骤如下: 75%酒精对天津厚蟹第五腹肢基部擦拭消毒, 采用1 mL无菌注射器于其关节膜处抽取约200 μL血淋巴, 将1~2滴血淋巴(剩余血淋巴置于100%乙醇中保存, 用于血卵涡鞭虫感染的后续PCR确认分析)滴于载玻片上并与等体积的中性红溶液(重量体积比0.04%, 过滤海水)混合, 在显微镜(Olympus BX53)下进行观察并拍照。根据200×显微镜视野下观察到的血卵涡鞭虫数量(分别为 < 10, 10~100, > 100), 将每个个体的血卵涡鞭虫感染程度分为轻度、中度和重度感染(Wang et al, 2017)。无明显感染(血涂片中未观察到血卵涡鞭虫)的血淋巴样本归为未感染; 对多次镜检无明显感染的个体进行PCR检测确认(Huang et al, 2021), 仅通过PCR检测呈阳性的感染归为轻度感染, PCR检测呈阴性的感染归为未感染。
组织病理检测: 采集经过血淋巴检测确定感染的天津厚蟹肝胰腺、心脏、鳃和步足肌等组织样品, 在波恩氏液中固定48 h后转移到70%酒精中长期保存或进行下一步处理; 参照Wheeler等(2007)的方法, 通过石蜡切片技术处理固定组织样品, 并用苏木精、伊红(H & E)染色, 切片经脱水封片后于显微镜(Olympus BX53)下观察天津厚蟹组织内的血卵涡鞭虫形态并拍照记录。
1.3 宿主体内血卵涡鞭虫生活史选取重度感染的天津厚蟹作为病原供体, 75%酒精擦拭其第五附肢基部关节膜处, 采用1 mL无菌注射器抽取血淋巴液, 使用血球计数板对血淋巴中血卵涡鞭虫进行计数。随后选取30只规格一致(甲宽23~28 mm)、活性好的健康天津厚蟹, 每只个体从第五附肢基部关节膜处注射20 μL前述感染天津厚蟹的血淋巴液(约2×105个虫体细胞)。将注射后的天津厚蟹个体单独装入带孔透明塑料盒(10.5 cm×10.5 cm× 4.0 cm)中, 饲养于装有30 L过滤海水的充氧塑料水箱中[温度(20±2) ℃, 盐度30±1], 每周投喂蛤蜊肉2次。自注射感染开始, 每隔5~6天对30只感染天津厚蟹进行随机抽样检测(初始样本量为5), 进行血淋巴检测以确定宿主感染程度及宿主体内血卵涡鞭虫的生活史阶段, 并进行组织病理样品采集和处理(见1.2)。
1.4 体外培养条件下血卵涡鞭虫生活史参照分离自三疣梭子蟹中血卵涡鞭虫株系的体外培养方法(Wang et al, 2017), 分离纯化天津厚蟹中的血卵涡鞭虫进行体外培养。培养液组分包括三疣梭子蟹血清、胎牛血清和Nephrops saline缓冲液(Appleton et al, 1998)(体积比为1︰2︰17), 且每100 mL培养液中加入1 mL青链霉素混合液(规格: 100 μg/mL), 采用0.2 μm针头滤器除菌备用。从重度感染的天津厚蟹第五附肢基部的关节膜处抽取适量血淋巴液(约0.5~1.0 mL), 加入到含有10 mL培养液、底面积为25 cm2的无菌细胞培养瓶中, 室温黑暗条件下静置20 min, 然后将悬浮液小心地转移到一个新无菌培养瓶中, 室温黑暗条件再静置20 min (可重复悬浮液转移、静置操作数次, 直至去除宿主血细胞及其他杂质), 分离纯化血卵涡鞭虫细胞。将分离纯化获得的血卵涡鞭虫悬浮液2 mL加入10 mL培养液中, 形成终体积为12 mL的体外培养体系, 放置在培养箱中于25 ℃黑暗条件下进行培养。定期(每隔5~7天)更换50%体积的培养液, 定期(每隔1~2天)采用倒置显微镜(Olympus IX71)观察血卵涡鞭虫的生活史阶段, 并拍照记录。
1.5 温度对宿主体内血卵涡鞭虫生活史的影响通过前述血淋巴注射感染方法(见1.3)人工注射感染90只健康天津厚蟹, 分配到10、15、20、25、30 ℃实验组, 其中10 ℃实验组10只天津厚蟹、其余实验组各20只天津厚蟹, 分别饲养于装有30 L过滤海水的充氧塑料水箱(盐度30±1)。为避免实验动物对温度突变的应激反应, 各水箱自室温20 ℃开始每隔3 h缓慢调升或调降2 ℃至相应实验设定温度, 实验期间每周投喂两次蛤蜊肉、去除残饵并及时换水保持水质清洁。在注射感染第10、第15、第20天分别对5个实验组注射感染天津厚蟹进行随机抽样检测(n=5), 进行血淋巴检测评估宿主感染程度并确定血卵涡鞭虫生活史阶段(见1.2), 记录各实验组天津厚蟹存活个数, 并根据各实验组存活个体数确定实验过程中后续取样检测的时间点及样本量。
1.6 温度对体外培养条件下血卵涡鞭虫生活史的影响从重度感染的天津厚蟹中分离纯化获得血卵涡鞭虫, 参考前述血卵涡鞭虫体外培养方法(见1.4)建立体外培养。分别在5个温度梯度下(10、15、20、25和30 ℃, 每个温度梯度设置3个实验重复)进行体外培养实验, 实验培养体系均为12 mL、起始浓度均为104 cells/mL。培养瓶置于不同设定温度的培养箱中黑暗条件下培养, 定期更换培养液、观察生活史阶段并拍照记录。
2 结果 2.1 血卵涡鞭虫在宿主体内的生活史及其形态学特征在不同时间点对注射感染天津厚蟹的血淋巴进行了血卵涡鞭虫感染程度及生活史阶段的取样检测(表 1)。在注射感染天津厚蟹的血淋巴中发现了血卵涡鞭虫的多种生活史阶段, 包括丝状滋养体、类变形虫滋养体、团块状聚合体、孢子母细胞、孢子前细胞和孢子等。特别是丝状滋养体(图 1a), 又称蠕虫状滋养体, 存在于轻度感染的宿主血淋巴中, 在常规显微镜观察中往往不易被发现。丝状滋养体一般呈蠕虫状, 个体大小差异大[(41.6±11.5) μm, n=25], 能够在宿主血淋巴中进行蠕动、弯曲和伸展运动。血卵涡鞭虫大多数生活史阶段细胞内的溶酶体能够主动吸收中性红而被染成亮红色, 便于显微观察和鉴定。
| 感染时间/天 | 感染程度 | 生活史阶段 | 样本量/只 |
| 5 | +(5/5) | 丝状滋养体*、类变形虫滋养体 | 5 |
| 10 | ++(5/5) | 类变形虫滋养体*、丝状滋养体 | 5 |
| 16 | ++(4/5)+++(1/5) | 类变形虫滋养体、团块状聚合体 | 5 |
| 21 | ++(1/5)+++(4/5) | 类变形虫滋养体、团块状聚合体 | 5 |
| 26 | +++(9/9) | 类变形虫滋养体、团块状聚合体(5/9); 孢子母细胞(3/9); 孢子前细胞、孢子(1/9) | 9 |
| 28 | +++(6/6) | 类变形虫滋养体、团块状聚合体(1/6); 孢子母细胞(2/6); 孢子前细胞、孢子(3/6) | 6 |
| 注: *: 表示主要生活史阶段; +: 轻度感染; ++: 中度感染; +++: 重度感染 | |||
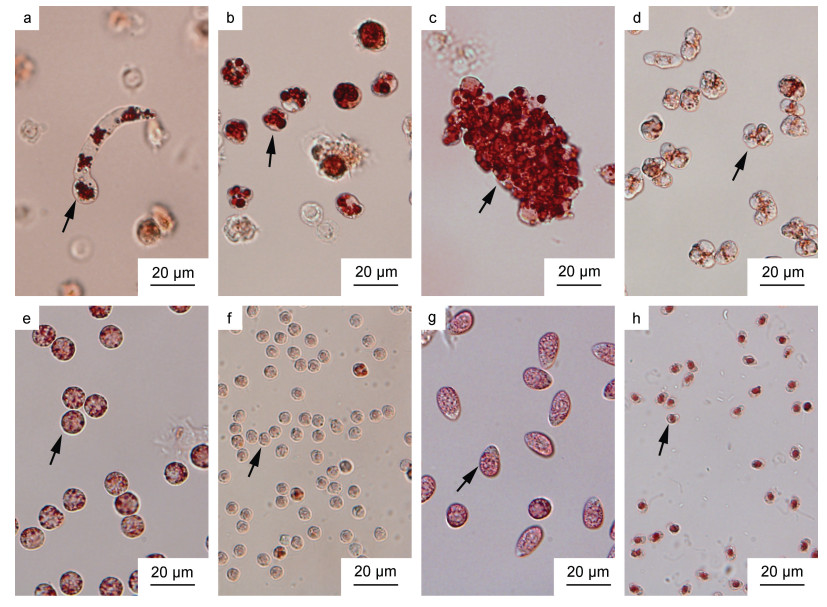 |
| 图 1 天津厚蟹血淋巴中血卵涡鞭虫各生活史阶段 Fig. 1 Life stages of H. perezi found in haemolymph of mudflat crabs H. tientsinensis 注: a. 丝状滋养体(箭头); b. 类变形虫滋养体(箭头); c. 团块状聚合体(箭头); d. 孢子母细胞(箭头); e. 大孢子前细胞(箭头); f. 小孢子前细胞(箭头); g. 大孢子(箭头); h. 小孢子(箭头)。血淋巴显微观察样品经0.04%中性红染色, 血卵涡鞭虫细胞内溶酶体主动吸收中性红被染成亮红色。 |
在感染前期(5~10天), 宿主血淋巴中存在少量的血卵涡鞭虫丝状滋养体与类变形虫滋养体(图 1b), 仍存在大量血细胞。在感染中期(10~25天), 宿主血淋巴中血卵涡鞭虫细胞数量显著增加, 主要形态包括类变形虫滋养体和团块状聚合体(图 1c), 以及少量丝状滋养体。在感染后期(≥26天), 宿主血淋巴中充斥大量血卵涡鞭虫细胞, 仅存在少量的血细胞; 部分宿主血淋巴中血卵涡鞭虫以类变形虫滋养体形式大量存在, 而部分宿主血淋巴中血卵涡鞭虫以大量孢子母细胞(图 1d)、孢子前细胞(图 1e, 1f)及游动孢子(图 1g, 1h)形式存在; 且宿主陆续死亡。感染后期, 部分濒死宿主释放孢子(局部密度可达109 cells/mL)。
组织病理学检测结果显示, 宿主的心脏、肝胰腺和鳃等组织中均存在血卵涡鞭虫感染, 并且发现了血卵涡鞭虫的多个生活史阶段, 包括丝状滋养体、类变形虫滋养体、蛛网状滋养体、团块状聚合体、孢子母细胞、孢子前细胞和孢子等。丝状滋养体(图 2a)零星发现于轻度感染宿主的组织中, 类变形虫滋养体(图 2b)、蛛网状滋养体(图 2c)和团块状聚合体(图 2d)常见于中度、重度感染宿主的组织中, 而孢子母细胞(图 2e)、孢子前细胞(图 2f, 2g)和孢子(图 2h, 2i)出现在重度感染宿主的组织中。
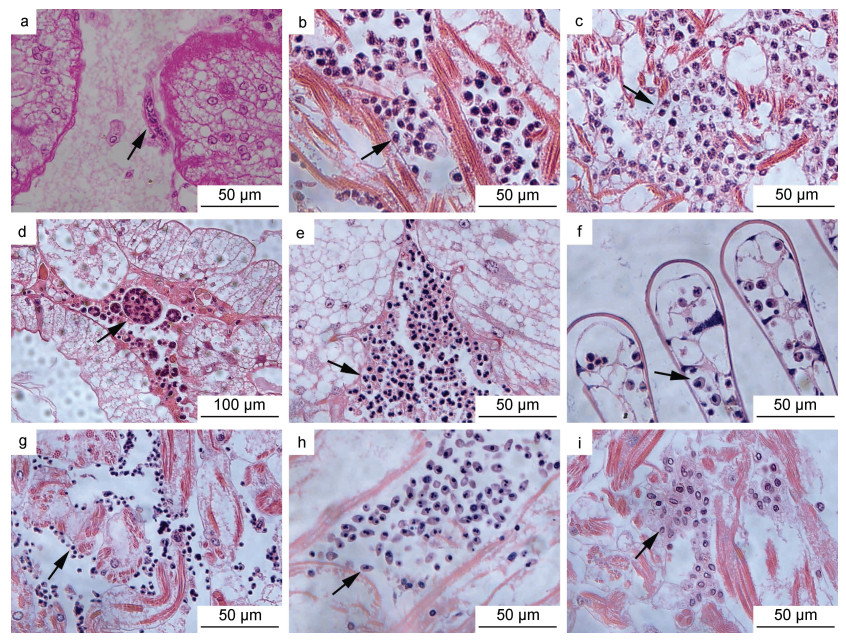 |
| 图 2 天津厚蟹组织中血卵涡鞭虫各生活史阶段 Fig. 2 Life stages of H. perezi found in tissues of mudflat crabs H. tientsinensis 注: a. 肝胰腺中的丝状滋养体(箭头); b. 心脏中的类变形虫滋养体(箭头); c. 心脏中的蛛网状滋养体(箭头); d. 肝胰腺中的团块状聚合体(箭头); e. 肝胰腺中的孢子母细胞(箭头); f. 鳃丝中的大孢子前细胞(箭头); g. 心脏中的小孢子前细胞(箭头); h. 心脏中的大孢子(箭头); i. 心脏中的小孢子(箭头) |
从我国沿海野生天津厚蟹体内分离获得不同生活史阶段的血卵涡鞭虫细胞, 成功建立了由类变形虫滋养体开始的体外连续培养体系。在以类变形虫滋养体为培养起点的体外培养过程中, 血卵涡鞭虫先后经历了类变形虫滋养体、蛛网状滋养体、团块状聚合体、孢子母细胞、孢子前细胞、孢子等生活史阶段。
类变形虫滋养体(图 3a)呈不规则的球形, 大小不等, 直径约为8~16 μm [(12.2±1.5) μm, n=25]; 类变形虫滋养体在宿主血淋巴或体外培养中几乎没有运动, 常规显微观察时其形态大小与血细胞相近, 但是类变形虫滋养体内部的溶酶体结构能够主动吸收中性红变成亮红色, 而宿主血细胞几乎不能吸收中性红, 因此可根据是否含有染成亮红色的溶酶体结构来区分这两种细胞。培养初期, 类变形虫滋养体会逐渐贴壁, 黏附在培养瓶底部, 随后形成伪足分支, 虫体之间通过伪足相互连接, 形成合胞体网络即早期的蛛网状滋养体(图 3b)。随着伪足不断生长发育, 相互接触的蛛网状滋养体彼此结合, 形成成熟庞大的蛛网状滋养体。
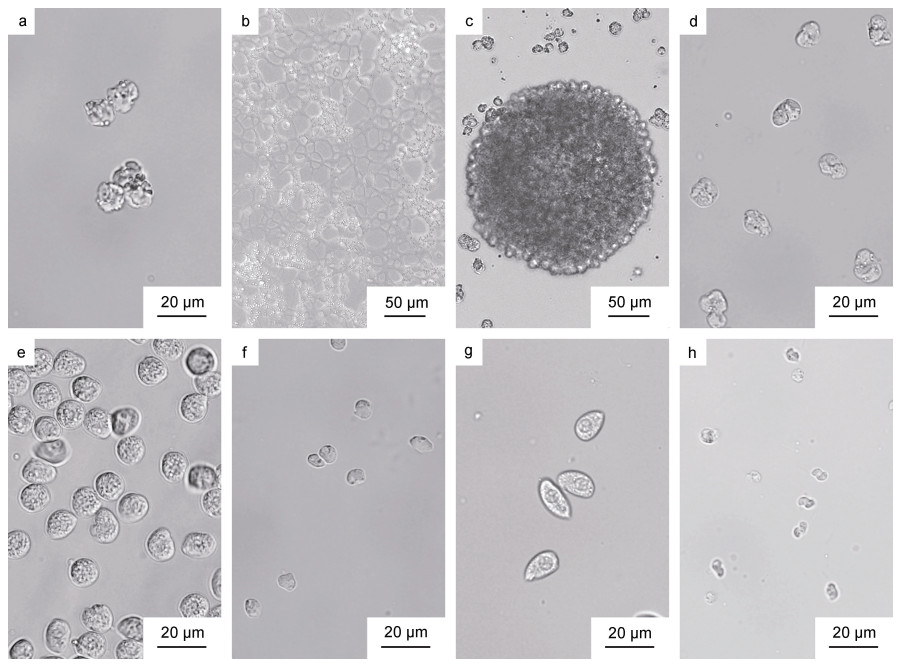 |
| 图 3 分离自天津厚蟹的血卵涡鞭虫株系的体外培养各生活史阶段 Fig. 3 In vitro life stages of H. perezi isolated from mudflat crabs H. tientsinensis 注: a. 类变形虫滋养体; b. 蛛网状滋养体; c. 团块状聚合体; d. 孢子母细胞; e. 大孢子前细胞; f. 小孢子前细胞; g. 大孢子; h. 小孢子 |
蛛网状滋养体后期阶段, 蛛网状滋养体逐渐从培养瓶底部脱落, 伪足结构逐渐消失, 虫体细胞间互相黏附形成大小不等的团块状聚合体(图 3c)(团块状聚合体的大小由聚合的细胞数量决定), 之后团块状聚合体中的虫体细胞逐渐分散, 形成分散的、单独的类变形虫滋养体细胞。实验发现将团块状聚合体或团块状聚合体分散后的类变形虫滋养体转移到新鲜培养液中, 能够重新开始形成蛛网状滋养体。
在蛛网状滋养体后期还有一条发展路径, 蛛网状滋养体从培养瓶底部脱落, 形成孢子母细胞(图 3d)。孢子母细胞呈不规则球形, 其直径约为11~15 μm [(13.2±1.1) μm, n=25], 对于中性红染液的吸收能力较弱, 不易被染色。孢子母细胞或形成聚集体, 或以单个细胞的形式在培养液中分布, 随后进一步发展形成孢子前细胞。大孢子前细胞(图 3e)呈球形, 直径约为10~13 μm [(11.9±0.5) μm, n=25], 其大小形态与类变形虫状滋养体相似, 但是类变形虫状滋养的溶酶体结构能够迅速吸收中性红染液而被染成亮红色, 而孢子前细胞对于中性红染液吸收能力不强, 染色较弱。小孢子前细胞(图 3f)形状呈球形, 直径约为6~8 μm [(6.5±0.5) μm, n=25]。
孢子前细胞进一步发展形成具有游动能力的孢子。在体外培养实验中观察到大孢子(图 3g)和小孢子(图 3h)两种类型, 来源于单个宿主的血卵涡鞭虫在体外培养中只能发展成为一种类型的孢子。大孢子的大小约为15~19 μm [(16.6±1.1) μm, n=25], 呈椭球形; 小孢子的大小约为6~9 μm [(7.5±0.5) μm, n=25], 呈螺旋形。鞭毛发育后, 两种类型的孢子都能够在培养液中游动, 大孢子游动缓慢、活动范围较小, 小孢子游动能力强、能够在培养液中快速移动。孢子形成后一段时间后逐渐停止运动, 部分孢子的形态由椭球形或螺旋形变为球形, 之后孢子增殖发育停滞并逐渐死亡。
2.3 温度对宿主体内血卵涡鞭虫生活史的影响温度能够影响血卵涡鞭虫在宿主内的增殖。在注射感染后第10、第15和第20天(图 4)对各组注射感染天津厚蟹进行随机抽样镜检(n=5), 在10 ℃下未发现感染; 在15、20和25 ℃下, 温度越高, 宿主感染程度越重; 在30 ℃下未发现感染。在15、20和25 ℃下, 温度越高, 宿主死亡越快, 20、25 ℃下注射感染天津厚蟹分别在第31和第28天全部死亡, 而在15 ℃下注射感染天津厚蟹在第33天开始死亡, 至第91天才全部死亡, 在15 ℃下注射感染天津厚蟹平均存活时间明显长于20以及25 ℃组(图 5)。在注射感染后第30天分别对10和30 ℃实验组剩余存活及实验期间死亡的天津厚蟹进行血涂片镜检和PCR检测, 均未发现血卵涡鞭虫感染。
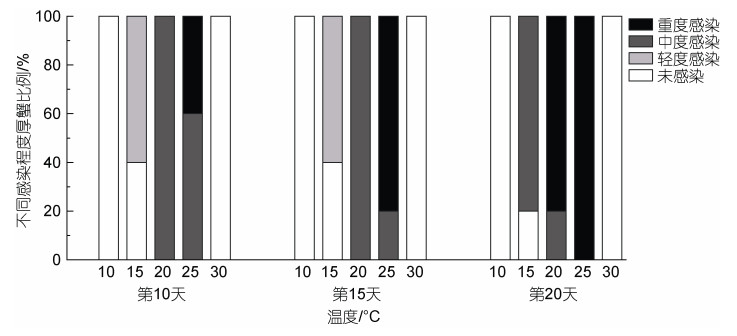 |
| 图 4 不同温度下注射感染天津厚蟹体内的血卵涡鞭虫感染程度变化 Fig. 4 Intensity of H. perezi in experimentally infected mudflat crabs H. tientsinensis at different temperatures |
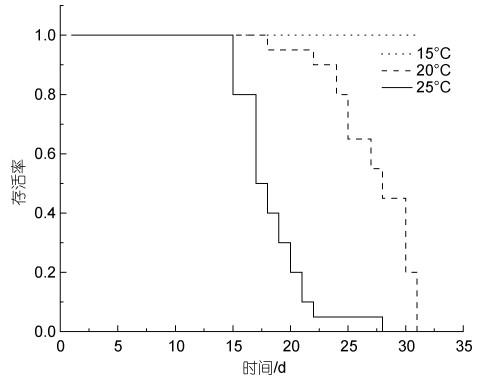 |
| 图 5 不同温度下注射感染天津厚蟹的存活情况 Fig. 5 Survival curves for mudflat crabs H. tientsinensis experimentally infected with H. perezi at different temperatures |
温度也显著影响了血卵涡鞭虫在宿主体内的生活史发展。丝状滋养体是宿主感染血卵涡鞭虫早期的常见生活史阶段, 类变形虫滋养体是宿主感染血卵涡鞭虫中、后期的常见生活史阶段; 实验第10天, 15 ℃实验组中40%的天津厚蟹血淋巴中发现丝状滋养体, 40%的天津厚蟹血淋巴中未发现感染, 20%的天津厚蟹血淋巴中发现类变形虫滋养体, 20 ℃实验组中20%的天津厚蟹血淋巴中发现丝状滋养体, 80%的天津厚蟹血淋巴中发现类变形虫滋养体, 而25 ℃实验组中所有抽检天津厚蟹均发现了类变形虫滋养体, 而未检测出丝状滋养体(图 6)。孢子母细胞是宿主感染血卵涡鞭虫后期的常见生活史阶段; 在15 ℃实验组中, 在第37天第一次在天津厚蟹血淋巴中检测到孢子母细胞, 而在20和25 ℃实验组中天津厚蟹血淋巴中孢子母细胞的第一次检出时间分别为第20天和第15天(图 6)。此外, 在15 ℃实验组中, 有55% (11/20)的天津厚蟹释放孢子到环境水体中, 完成产孢过程, 平均周期大约59.7天(n=11); 在20 ℃实验组中, 有30% (6/20)的天津厚蟹释放孢子, 完成产孢过程, 平均周期大约27.2天(n=6); 在25 ℃实验组中, 始终没有发现注射感染的天津厚蟹释放孢子。
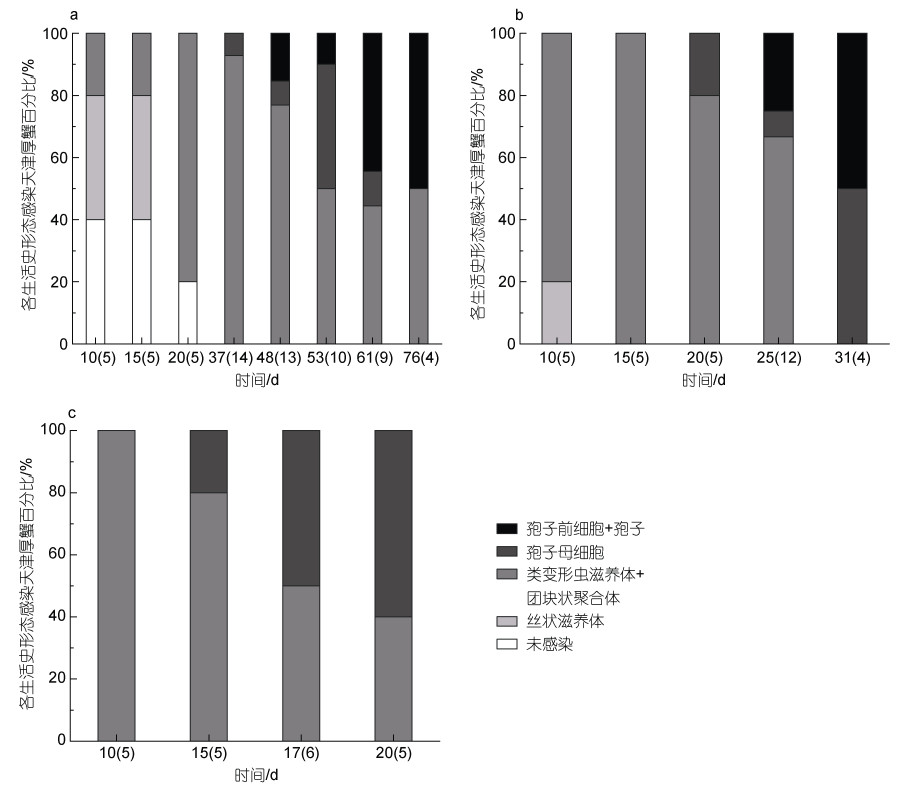 |
| 图 6 不同温度下注射感染天津厚蟹体内血卵涡鞭虫的主要生活史阶段变化 Fig. 6 Life stages of H. perezi in experimentally infected mudflat crabs H. tientsinensis at 15, 20 and 25 ℃ 注: a. 15 ℃; b. 20 ℃; c. 25 ℃; 括号内为每次检查样本数 |
温度影响体外培养血卵涡鞭虫的生活史发展。在以类变形虫滋养体为起点的体外培养中, 在10 ℃下培养3天后, 大量类变形虫滋养体细胞死亡。在15、20和25 ℃培养条件下, 类变形虫滋养体均能发展为蛛网状滋养体、团块状聚合体, 并重新分散成单独的类变形虫滋养体; 血卵涡鞭虫细胞在15 ℃培养条件下生长发展明显慢于20、25 ℃培养, 在20、25 ℃培养条件下第1天时已经开始形成蛛网状滋养体, 而15 ℃培养到第3天时才开始形成蛛网状滋养体。30 ℃培养条件下, 类变形虫滋养体细胞没有发展变化, 在第10天细胞死亡。
以大孢子前细胞为起点的体外培养与以类变形虫滋养体为起点的体外培养类似, 10 ℃下培养的大量大孢子前细胞到第5天时死亡, 30 ℃下培养的细胞到第7天细胞开始死亡。在20、25 ℃培养条件下, 第6天发现形成大孢子, 15 ℃培养中第8天出现大孢子。
3 讨论本研究首次建立了分离自我国野生天津厚蟹的寄生甲藻血卵涡鞭虫株系的体外连续培养, 确定了该寄生甲藻体外培养经历的主要生活史阶段, 包括类变形虫滋养体、蛛网状滋养体、团块状聚合体、孢子母细胞、孢子前细胞、孢子等阶段。本研究所观察的血卵涡鞭虫体外培养生活史与分离自挪威龙虾(Appleton et al, 1998)、美国兰蟹(Li et al, 2011)的血卵涡鞭虫体外培养生活史基本一致, 但在体外培养过程中未观察到丝状滋养体、丝状滋养体集合体、蛛网状孢子体和裂殖体等生活史阶段。本研究中孢子经过一段时间后便停止发育, 这一实验结果与分离自蛛雪蟹(Chionoecetes opilio)的血卵涡鞭虫体外培养观察结果一致, 其电镜分析结果表明体外培养的孢子已经衰老, 不具备进一步发育的能力(Gaudet et al, 2015)。上述血卵涡鞭虫株系体外培养的温度范围不同(Appleton et al, 1998; Li et al, 2011; Gaudet et al, 2015), 且在分类和系统发育分析中属于血卵涡鞭虫属的不同种, 或属于同一种的不同基因型(Small, 2012; 肖洁等, 2015; Huang et al, 2019), 可能是造成生活史差异的原因。此外, 体外培养后期蛛网状滋养体能够发育成团块状聚合体或孢子母细胞, 但是其决定机制尚有待进一步研究。
本研究通过注射感染实验和连续取样检测, 研究了宿主血淋巴及主要组织器官内血卵涡鞭虫各生活史阶段的细胞形态, 刻画了血卵涡鞭虫在宿主体内发展和增殖的完整过程。血卵涡鞭虫在宿主感染前期以丝状滋养体和类变形虫滋养体形式存在, 在感染中期增殖形成大量类变形虫滋养体, 并在宿主主要组织器官内形成蛛网状滋养体, 虫体聚合形成团块状聚合体, 虫体数量逐渐增多, 感染程度逐渐加重。在感染后期, 滋养体逐渐发展成孢子母细胞、孢子前细胞, 并进一步转化出孢子, 最终大量孢子从宿主体内释放到水体中。这一结果与感染美国兰蟹(Li et al, 2011)和三疣梭子蟹(王金凤等, 2015)的血卵涡鞭虫在宿主体内的生活史一致。蛛网状滋养体被认为是血卵涡鞭虫在体外培养过程中无性繁殖的主要阶段(Li et al, 2011), 蛛网状滋养体后期形成的团块状聚合体能够重新形成类变形虫滋养体, 加入新的培养中能够重新形成蛛网状滋养体, 这一过程解释了血卵涡鞭虫在宿主体内的快速增殖。
由于宿主栖息温度范围不同, 不同株系的血卵涡鞭虫对温度表现出不同的适应性。在体外培养中分离自挪威龙虾的血卵涡鞭虫生长发育的适宜温度范围为8~15 ℃ (Appleton et al, 1998), 分离自美国兰蟹的血卵涡鞭虫在低于15 ℃条件下生长缓慢甚至停滞, 并且在23 ℃下的生长状况优于15 ℃ (Li et al, 2011), 分离自蛛雪蟹的血卵涡鞭虫在体外培养中能够在0 ℃条件下正常生长增殖(Gaudet et al, 2015)。而在本研究中, 分离自天津厚蟹的血卵涡鞭虫在体外培养中15~25 ℃条件下能够正常生长, 但是在15 ℃条件下生长缓慢, 而且在10和30 ℃下血卵涡鞭虫不能正常生长发育。此外, 温度也会影响血卵涡鞭虫在宿主体内的细胞生长发育和增殖, 在15~25 ℃范围内, 温度越高, 其细胞生长发育及细胞增殖速度越快; 在10 ℃和30 ℃条件下, 血卵涡鞭虫不能在宿主体内正常寄生增殖。在15 ℃和20 ℃条件下, 天津厚蟹在感染第10天和15天时, 其感染程度无显著性差异, 该结果反映了在以上温度条件下, 血卵涡鞭虫在感染早期的宿主体内处于缓慢增殖和细胞累积时期; 而在第15天和20天时, 宿主体内的血卵涡鞭虫增殖积累到一定数量, 增殖速度加快, 宿主感染程度产生显著性差异, 该结果表明实验感染第15~20天是血卵涡鞭虫在以上温度条件下在宿主体内的关键快速增殖时期。尽管在25 ℃下血卵涡鞭虫能够在宿主体内迅速增殖发育, 但由于死亡过快, 实验中没有宿主完成孢子的形成与释放。与此类似, Shields等(2000)推断急性感染的美国兰蟹死亡迅速, 血卵涡鞭虫生活史不能完成, 不会产生和释放孢子。
本研究观察到大孢子和小孢子两种孢子类型; 与以往研究结果相同, 来源于同一个宿主的血卵涡鞭虫, 以及分离自同一个宿主的血卵涡鞭虫建立的体外培养中只产生一种类型的孢子(Appleton et al, 1998; Li et al, 2011; Gaudet et al, 2015)。此外, 来源于同一个宿主的血卵涡鞭虫在宿主体内以及体外培养中能够大致同步发育成孢子。但决定大、小孢子的形成机制(即产生大孢子或者小孢子)及大、小孢子的生物学功能尚不明确。通过孢子进行水体传播被认为是血卵涡鞭虫进行宿主间传播扩散的有效途径(Shields, 1994; Stentiford et al, 2005), 且近年来多项研究通过哨兵实验和宿主共居实验验证了水体传播的有效性(Huchin-Mian et al, 2017; Shields et al, 2017; Huang et al, 2021)。此外, 一些研究者认为孢子可能是在宿主蜕皮或者受到物理损伤期间侵入宿主体内(Meyers et al, 1990; Eaton et al, 1991; Stentiford et al, 2001; Shields et al, 2007), 但Huchin-Mian等(2017)研究认为血卵涡鞭虫感染与宿主蜕皮无关。然而, 迄今尚没有孢子直接通过水体浸浴成功感染蟹类宿主的相关报道, 孢子在易感宿主间传播过程中的作用以及血卵涡鞭虫侵入宿主的途径等都有待展开进一步的调查研究。
4 结论本研究系统研究了分离自我国沿海天津厚蟹的血卵涡鞭虫株系的生活史, 详细描述了血卵涡鞭虫在宿主体内及体外培养体系中的各生活史阶段的细胞形态; 并进一步发现温度可显著影响血卵涡鞭虫的细胞生长发育及增殖过程, 在一定温度范围内(15~25 ℃), 随着温度升高会促进血卵涡鞭虫的细胞生长发育和增殖速度, 而在低温(10 ℃)和高温(30 ℃)条件下不利于血卵涡鞭虫对宿主的寄生感染, 且发现15和20 ℃条件下可形成、释放游动孢子。以上研究成果进一步丰富和完善了寄生甲藻血卵涡鞭虫的生活史研究, 并为今后有效防控血卵涡鞭虫流行病提供重要理论依据。
王印庚, 杨洋, 张正, 等, 2017. 津冀地区养殖三疣梭子蟹大量死亡的病原和病理分析. 中国水产科学, 24(3): 596-605 |
王金凤, 李才文, 李蒙, 等, 2015. 血卵涡鞭虫感染三疣梭子蟹的病原形态学及组织病理学变化. 海洋与湖沼, 46(4): 748-757 |
许文军, 施慧, 徐汉祥, 等, 2007b. 养殖梭子蟹血卵涡鞭虫感染的初步研究. 水生生物学报, 31(5): 637-642 |
许文军, 绳秀珍, 徐汉祥, 等, 2007a. 血卵涡鞭虫在养殖锯缘青蟹中的寄生. 中国海洋大学学报, 37(6): 916-920 |
许文军, 谢建军, 施慧, 等, 2010. 池塘养殖脊尾白虾(Exopalaemon carinicauda)感染血卵涡鞭虫的研究. 海洋与湖沼, 41(3): 396-402 |
李才文, 许文军, 2014. 海水甲壳类寄生性病原血卵涡鞭虫(Hematodinium spp.)研究进展. 海洋与湖沼, 45(1): 1-10 |
肖洁, 张学雷, 刘瑞娟, 等, 2015. 中国沿海寄生性病原血卵涡鞭虫(Hematodinium sp.)的遗传多样性研究. 海洋与湖沼, 46(3): 481-488 |
APPLETON P L, VICKERMAN K, 1998. In vitro cultivation and developmental cycle in culture of a parasitic dinoflagellate (Hematodinium sp.) associated with mortality of the Norway lobster (Nephrops norvegicus) in British waters. Parasitology, 116(2): 115-130 DOI:10.1017/S0031182097002096 |
EATON W D, LOVE D C, BOTELHO C, et al, 1991. Preliminary results on the seasonality and life cycle of the parasitic dinoflagellate causing bitter crab disease in Alaskan Tanner crabs (Chionoecetes bairdi). Journal of Invertebrate Pathology, 57(3): 426-434 DOI:10.1016/0022-2011(91)90147-I |
FIELD R H, CHAPMAN C J, TAYLOR A C, et al, 1992. Infection of the Norway lobster Nephrops norvegicus by a Hematodinium-like species of dinoflagellate on the west coast of Scotland. Diseases of Aquatic Organisms, 13: 1-15 DOI:10.3354/dao013001 |
FIELD R H, HILLS J M, ATKINSON R J A, et al, 1998. Distribution and seasonal prevalence of Hematodinium sp. infection of the Norway lobster (Nephrops norvegicus) around the west coast of Scotland. ICES Journal of Marine Science, 55(5): 846-858 DOI:10.1006/jmsc.1998.0357 |
GAUDET P H, CAWTHORN R J, BUOTE M A, et al, 2015. In vitro cultivation of Hematodinium sp. isolated from Atlantic snow crab, Chionoecetes opilio: partial characterization of late developmental stages. Parasitology, 142(4): 598-611 DOI:10.1017/S0031182014001656 |
HUANG Q, LI M, WANG F, et al, 2019. The parasitic dinoflagellate Hematodinium perezi infecting mudflat crabs, Helice tientsinensis, in polyculture system in China. Journal of Invertebrate Pathology, 166: 107229 DOI:10.1016/j.jip.2019.107229 |
HUANG Q, LI M, WANG F, et al, 2021. Transmission pattern of the parasitic dinoflagellate Hematodinium perezi in polyculture ponds of coastal China. Aquaculture, 538: 736549 DOI:10.1016/j.aquaculture.2021.736549 |
HUCHIN-MIAN J P, SMALL H J, SHIELDS J D, 2017. Patterns in the natural transmission of the parasitic dinoflagellate Hematodinium perezi in American blue crabs, Callinectes sapidus from a highly endemic area. Marine Biology, 164(7): 153 DOI:10.1007/s00227-017-3185-y |
HUCHIN-MIAN J P, SMALL H J, SHIELDS J D, 2018. The influence of temperature and salinity on mortality of recently recruited blue crabs, Callinectes sapidus, naturally infected with Hematodinium perezi (Dinoflagellata). Journal of Invertebrate Pathology, 152: 8-16 DOI:10.1016/j.jip.2018.01.003 |
LI M, HUANG Q, LV X Y, et al, 2021b. The parasitic dinoflagellate Hematodinium infects multiple crustaceans in the polyculture systems of Shandong Province, China. Journal of Invertebrate Pathology, 178: 107523 DOI:10.1016/j.jip.2020.107523 |
LI C W, LI M, HUANG Q, 2021a. The parasitic dinoflagellate Hematodinium infects marine crustaceans. Marine Life Science & Technology, 3(3): 313-325 |
LI C W, MILLER T L, SMALL H J, et al, 2011. In vitro culture and developmental cycle of the parasitic dinoflagellate Hematodinium sp. from the blue crab Callinectes sapidus. Parasitology, 138(14): 1924-1934 DOI:10.1017/S0031182011001405 |
LI C W, SONG S Q, LIU Y, et al, 2013. Hematodinium infections in cultured Chinese swimming crab, Portunus trituberculatus, in northern China. Aquaculture, 396-399: 59-65 DOI:10.1016/j.aquaculture.2013.02.022 |
LI Y Y, XIA X A, WU Q Y, et al, 2008. Infection with Hematodinium sp. in mud crabs Scylla serrata cultured in low salinity water in southern China. Diseases of Aquatic Organisms, 82(2): 145-150 |
LOVE D C, RICE S D, MOLES D A, et al, 1993. Seasonal prevalence and intensity of Bitter crab dinoflagellate infection and host mortality in Alaska Tanner crabs Chionoecetes bairdi from Auke Bay, Alaska, USA. Diseases of Aquatic Organisms, 15: 1-7 DOI:10.3354/dao015001 |
MESSICK G A, SHIELDS J D, 2000. Epizootiology of the parasitic dinoflagellate Hematodinium sp. in the American blue crab Callinectes sapidus. Diseases of Aquatic Organisms, 43(2): 139-152 |
MEYERS T R, BOTELHO C, KOENEMAN T M, et al, 1990. Distribution of bitter crab dinoflagellate syndrome in southeast Alaskan tanner crabs Chionoecetes bairdi. Diseases of Aquatic Organisms, 9: 37-43 DOI:10.3354/dao009037 |
SHEPPARD M, WALKER A, FRISCHER M E, et al, 2003. Histopathology and prevalence of the parasitic dinoflagellate, Hematodinium sp, in crabs (Callinectes sapidus, Callinectes similis, Neopanope sayi, Libinia emarginata, Menippe mercenaria) from a Georgia estuary. Journal of Shellfish Research, 22(3): 873-880 |
SHIELDS J D, 1994. The parasitic dinoflagellates of marine crustaceans. Annual Review of Fish Diseases, 4: 241-271 DOI:10.1016/0959-8030(94)90031-0 |
SHIELDS J D, HUCHIN-MIAN J P, O'LEARY P A, et al, 2017. New insight into the transmission dynamics of the crustacean pathogen Hematodinium perezi (Dinoflagellata) using a novel sentinel methodology. Marine Ecology Progress Series, 573: 73-84 DOI:10.3354/meps12175 |
SHIELDS J D, SQUYARS C M, 2000. Mortality and hematology of blue crabs, Callinectes sapidus, experimentally infected with the parasitic dinoflagellate Hematodinium perezi. Fishery Bulletin, 98(1): 139-152 |
SHIELDS J D, TAYLOR D M, O'KEEFE P G, et al, 2007. Epidemiological determinants in outbreaks of bitter crab disease (Hematodinium sp.) in snow crabs Chionoecetes opilio from Conception Bay, Newfoundland, Canada. Diseases of Aquatic Organisms, 77(1): 61-72 |
SMALL H J, 2012. Advances in our understanding of the global diversity and distribution of Hematodinium spp. – Significant pathogens of commercially exploited crustaceans. Journal of Invertebrate Pathology, 110(2): 234-246 |
STENTIFORD G D, NEIL D M, ATKINSON R J A, 2001. The relationship of Hematodinium infection prevalence in a Scottish Nephrops norvegicus population to season, moulting and sex. ICES Journal of Marine Science, 58(4): 814-823 |
STENTIFORD G D, SHIELDS J D, 2005. A review of the parasitic dinoflagellates Hematodinium species and Hematodinium-like infections in marine crustaceans. Diseases of Aquatic Organisms, 66(1): 47-70 |
WANG J F, LI M, XIAO J, et al, 2017. Hematodinium spp. infections in wild and cultured populations of marine crustaceans along the coast of China. Diseases of Aquatic Organisms, 124(3): 181-191 |
WHEELER K, SHIELDS J D, TAYLOR D M, 2007. Pathology of Hematodinium infections in snow crabs (Chionoecetes opilio) from Newfoundland, Canada. Journal of Invertebrate Pathology, 95(2): 93-100 |
 2022, Vol. 53
2022, Vol. 53


