中国海洋湖沼学会主办。
文章信息
- 李苏恒, 董逸, 赵苑, 孙晓霞, 张光涛, 赵丽, 张武昌, 肖天. 2022.
- LI Su-Heng, DONG Yi, ZHAO Yuan, SUN Xiao-Xia, ZHANG Guang-Tao, ZHAO Li, ZHANG Wu-Chang, XIAO Tian. 2022.
- 獐子岛海域和胶州湾表层微微型浮游植物丰度和生物量的季节变化比较
- COMPARISON IN SEASONAL VARIATION OF SURFACE PICOPHYTOPLANKTON ABUNDANCE AND BIOMASS IN THE ZHANGZI ISLAND AREA AND THE JIAOZHOU BAY
- 海洋与湖沼, 53(6): 1405-1414
- Oceanologia et Limnologia Sinica, 53(6): 1405-1414.
- http://dx.doi.org/10.11693/hyhz20220300058
文章历史
-
收稿日期:2022-03-10
收修改稿日期:2022-05-16
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 山东青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 山东青岛 266071;
5. 中国科学院海洋研究所 山东胶州湾海洋生态系统国家野外科学观测研究站 山东青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. Jiaozhou Bay Marine Ecosystem Research Station, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China
海洋微微型浮游植物(picophytoplankton)细胞粒径介于0.22~2 µm之间, 是迄今为止发现的最小的光合自养浮游生物, 主要包括蓝细菌中的原绿球藻(Prochlorococcus, PRO)和聚球藻(Synechococcus, SYN), 以及微微型真核浮游植物(Picoeukaryotes, PEUK)。SYN最适生长温度为17~25 °C, 决定了它在热带、亚热带和温带海域丰度较高, 较强的温度适应能力使其在70°N 到 69°S 水体都可以生存(Li et al, 1983; Joint et al, 1986)。PRO对温度敏感, 尤其是低温对其影响明显, 其生长海区被限制在南北纬40°之间。在我国东海、南海、黄海东南部检测到了PRO, 渤海尚未发现(焦念志等, 2002)。PEUK分布广泛, 因其种类丰富, 包含多种耐低温的藻类, 从赤道到极地海区都可以检测到(Marie et al, 2006; Worden, 2006)。微微型浮游植物对初级生产力和浮游植物生物量的贡献显著, 被认为是世界上大多海区浮游植物群落中的重要组分(Olson et al, 1990)。微微型浮游植物具有粒径小、比表面积大, 种类丰富, 数量多等特点(Campbell et al, 1994), 因而决定了它是海洋生态系统物质循环和能量流动的重要推动者, 对维持海洋生态系统的稳定起着重要的作用。
獐子岛海域位于黄海北部(38º42'~39º12'N, 122º24'~ 123º6'E)外长山群岛的最南端, 拥有全国最大的虾夷扇贝养殖基地。胶州湾位于黄海南部(35º8'~36º18'N, 120º04'~120º23'E), 是典型的半封闭海湾, 有数十条河流流入, 是我国北方重要的港口、养殖及经济贸易区域。
獐子岛海域和胶州湾同属于温带海域, 受大陆气候和黄海暖流等因素的影响, 海水理化环境有明显的季节变化(俞建銮等, 1993), 两海区都受到人类活动的影响。对獐子岛海域微微型浮游植物的研究相对较少(Zhao et al, 2018), 胶州湾的研究相对较多(肖天等, 1995; 赵三军等, 2005; 杨琳等, 2012), 但已有研究主要集中在单个海区, 并未系统对比过海区间存在的差异。本文对比了北黄海和南黄海典型海区微微型浮游植物的分布及环境影响因素, 旨在全面了解受不同理化因素及人类活动影响海区的微微型浮游植物丰度及季节变化情况, 为黄海的生态环境评估提供基础数据。
1 材料与方法 1.1 调查站位及样品采集2009年7月至2010年6月搭乘大连獐子岛渔业集团有限公司“辽长渔科研19号”对獐子岛海域进行逐月调查采样(因天气原因, 2010年1月和5月未采样), 共设13个观测站。其中A6、B6、C6站位于非养殖海区, 最大水深约55 m, 其他站均位于养殖海区, 水深小于50 m。2010年1~12月搭乘“创新号”考察船对胶州湾常规站位进行逐月调查采样, 共设12个观测站, 除D5站最大水深约36 m外, 其余站位水深在1~26 m不等, 采样站位如图1所示。獐子岛海域和胶州湾季节按如下进行划分: 春季3~5月, 夏季6~8月, 秋季9~11月, 冬季12~2月。季节取值为3个月的平均值。使用Niskin采水器采集海水样品, 取4 mL海水置于5 mL离心管中, 加入10%多聚甲醛固定, 终浓度为1%, 样品4 °C避光保存, 带回实验室后液氮速冻, 然后转移至−80 °C冰箱保存(Marie et al, 2001), 为便于比较, 本文獐子岛海域和胶州湾均选取表层海水样品进行分析。
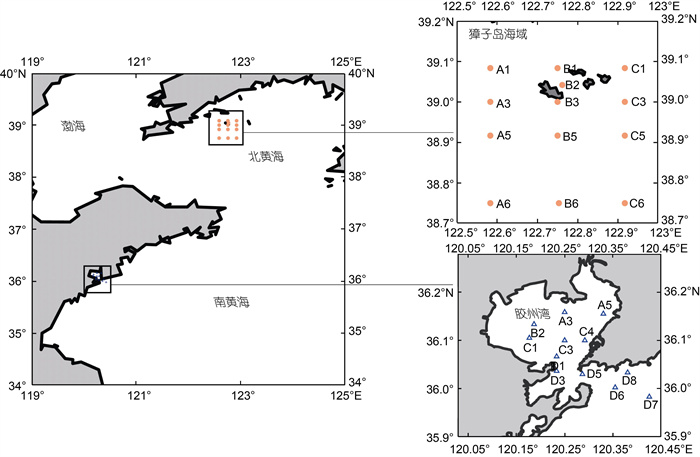 |
| 图 1 獐子岛海域和胶州湾采样站位 Fig. 1 Sampling stations in the Zhangzi Island Area and Jiaozhou Bay |
将样品从−80 °C冰箱中取出, 室温避光融化, 利用流式细胞仪(BD FACSVantage SE, Becton Dickinson, USA)检测到聚球藻(Synechococcus, SYN)和微微型真核浮游植物(Picoeukaryotes, PEUK), 未发现原绿球藻(Prochlorococcus, PRO), 故本文提到的微微型浮游植物包括SYN和PEUK。取2 mL海水样品, 加入2 µm绿色荧光微球(Polysciences)作标准内参, 上机检测3 min。SYN和PEUK自身含有荧光, 可直接进行检测。通过前向散射光(FSC)和侧向散射光(SSC)的双参数散点图FSC-SSC、橙色荧光(FL2)和红色荧光(FL3)的双参数散点图FL2-FL3可以检测并区分SYN和PEUK(Zhao et al, 2016)。
1.3 理化因子的测定獐子岛海域的温度和盐度由船载CTD(AAQ 1183-1F)测定, 叶绿素a浓度按海洋调查规范(GB12763.6-91)(国家技术监督局, 1991)规定的萃取法, 用Turner Designs Model 7200 荧光光度计进行测定。营养盐(

胶州湾的温度、盐度、叶绿素a浓度和营养盐浓度数据均由胶州湾生态站提供。温度和盐度由船载CTD (SEB19-CTD)测定, 叶绿素a浓度采用Turner II荧光光度计测定(于莹等, 2011), 营养盐的测定仪器和方法与獐子岛海域一致。
1.4 丰度和生物量计算用CellQuest软件(Version 3.3, Becton Dickinson)收集和分析流式细胞仪数据, 获得SYN和PEUK丰度。微微型浮游植物生物量由丰度乘以碳转换系数(SYN和PEUK碳转换系数分别为250 fg C/cell和1 500 fg C/cell)获得 (Zubkov et al, 1998)。浮游植物生物量通过叶绿素a浓度转换获得, 转换系数为50 (Krempin et al, 1981)。
1.5 数据处理与统计分析采用克鲁斯卡尔-沃利斯检验(Kruskal-Wallis)方法, 分别检验獐子岛海域和胶州湾的理化环境因子、微微型浮游植物丰度和生物量在季节之间的差异显著性。采用曼惠特尼U检验(Mann-Whitney U Test) 的方法检验獐子岛海域和胶州湾理化环境因子、微微型浮游植物丰度和生物量在海区之间的差异显著性。采用斯皮尔曼相关性(Spearman correlation)方法分析各个海区环境因子和微微型浮游植物丰度之间的相关关系。所有数据进行分析前均经过log(x+1)转换。
利用Origin Pro 2015绘制微微型浮游植物丰度和生物量的季节变化图。用SPSS 23.0软件进行数据的克鲁斯卡尔-沃利斯检验、曼惠特尼U检验和斯皮尔曼相关性分析。
2 结果 2.1 温盐、叶绿素a、营养盐及砂壳纤毛虫丰度季节分布及海区间差异比较獐子岛海域和胶州湾均表现出相似的温带季节变化特征, 即夏秋季节温度高, 冬春季节温度低, 二者全年温度变化范围分别在2.55~23.53 °C和1.85~ 26.40 °C之间, 獐子岛海域表层温度略低于胶州湾(图2a, 表1)。獐子岛海域和胶州湾的盐度高值均出现在冬春季, 低值出现在夏秋季, 盐度变化范围分别是30.54~32.27和28.52~31.69, 全年大部分时间獐子岛海域表层盐度略高于胶州湾(图2b, 表1)。獐子岛海域和胶州湾叶绿素a浓度高值均出现在夏季, 低值均出现在冬季(图2c, 表1)。獐子岛海域DIN和PO43-浓度高值均出现在冬季, 低值分别出现在春季和夏季; 胶州湾DIN和PO43-浓度高值分别出现在秋季和春季, 低值均出现在夏季(图2d, 2e, 表1)。两海区营养盐浓度均无明显的季节分布特征。獐子岛海域砂壳纤毛虫丰度春夏季高于秋冬季; 胶州湾砂壳纤毛虫丰度冬春季高于夏秋季(图2f, 表1)。
 |
| 图 2 獐子岛海域和胶州湾理化因子和相关生物因子月份比较 Fig. 2 Seasonal comparison of environmental parameters and related biological factors in Zhangzi Island Area and Jiaozhou Bay 注: a: 温度; b: 盐度; c: 叶绿素a浓度; d: 溶解无机氮(DIN)浓度; e: 磷酸盐(PO43-)浓度; f: 砂壳纤毛虫丰度 |
| 项目 | 海域 | 春 | 夏 | 秋 | 冬 | 全年平均 |
| 温度/(°C) | 獐子岛海域 | 3.88±0.57 | 19.91±1.41 | 16.61±0.24 | 5.23±1.04 | 12.73±0.92 |
| 胶州湾 | 8.82±1.27 | 22.78±1.05 | 20.83±1.20 | 4.26±1.05 | 14.21±1.24 | |
| 盐度 | 獐子岛海域 | 32.10±0.19 | 30.88±0.47 | 31.62±0.09 | 32.17±0.14 | 31.53±0.26 |
| 胶州湾 | 31.55±0.22 | 31.01±0.33 | 29.98±0.87 | 31.41±0.34 | 30.97±0.50 | |
| 叶绿素a浓度 /(μg/L) |
獐子岛海域 | 0.36±0.25 | 0.83±0.73 | 0.60±0.33 | 0.26±0.11 | 0.67±0.48 |
| 胶州湾 | 0.45±0.66 | 1.06±0.92 | 0.73±0.52 | 0.44±0.28 | 0.69±0.70 | |
| DIN浓度 /(μmol/L) |
獐子岛海域 | 1.32±0.67 | 2.88±1.39 | 4.89±1.17 | 7.26±1.24 | 4.05±1.15 |
| 胶州湾 | 12.65±8.31 | 6.44±5.19 | 14.05±14.98 | 10.27±11.5 | 10.85±9.99 | |
| PO43-浓度 /(μmol/L) |
獐子岛海域 | 0.21±0.05 | 0.19±0.04 | 0.49±0.06 | 0.59±0.10 | 0.37±0.08 |
| 胶州湾 | 0.38±0.31 | 0.17±0.09 | 0.25±0.14 | 0.32±0.14 | 0.26±0.22 | |
| 砂壳纤毛虫丰度/(ind./L) | 獐子岛海域 | 281.26±191.20 | 442.56±423.82 | 26.94±16.04 | 84.69±40.40 | 214.92±429.80 |
| 胶州湾 | 99.57±23.37 | 18.23±32.3 | 12.51±6.37 | 100.51±63.78 | 82.7±118.96 |
曼惠特尼U检验分析结果表征了獐子岛海域和胶州湾主要环境因子之间的差异情况: 獐子岛海域盐度、PO43-浓度和砂壳纤毛虫丰度均显著高于胶州湾(P<0.01, 表1); 獐子岛海域DIN浓度显著低于胶州湾(P<0.01, 表1); 獐子岛海域与胶州湾两海区之间的温度、叶绿素a浓度均无显著性差异(P>0.05, 表1)。
2.2 微微型浮游植物丰度季节分布及海区间差异比较獐子岛海域SYN丰度范围在0.05×103~120×103 cells/mL之间, 平均值为(11.82±7.35) ×103 cells/mL (n=130)(图3a, 表2)。SYN丰度在秋季最高, 且显著高于其他季节(Kruskal-Wallis, P<0.01, 表2)。季节趋势总体表现为秋季>夏季>冬季>春季(图3b)。胶州湾SYN丰度范围在0.02×103~61.8×103 cells/mL之间, 平均值为(4.08±2.39)×103 cells/mL (n=142) (图3a, 表2)。SYN丰度在夏季最高, 丰度在夏秋季显著高于冬春季(Kruskal-Wallis, P<0.01, 表2)。季节趋势总体表现为夏季>秋季>冬季>春季(图3b)。
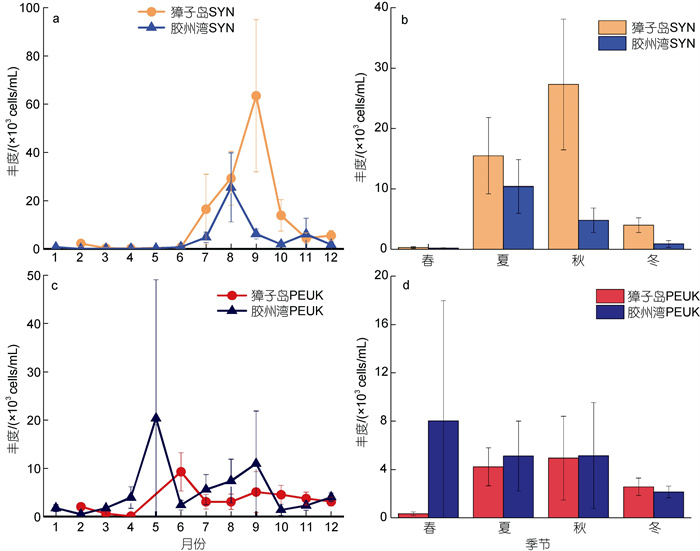 |
| 图 3 獐子岛海域和胶州湾微微型浮游植物丰度的月份和季节变化 Fig. 3 Monthly and seasonal variation in picophytoplankton abundance in Zhangzi Island Area and Jiaozhou Bay 注: a: 聚球藻月变化; b: 聚球藻季节变化; c: 微微型真核浮游植物月变化; d: 微微型真核浮游植物季节变化; SYN: 聚球藻; PEUK: 微微型真核浮游植物 |
| 项目 | 海域 | 春 | 夏 | 秋 | 冬 | 全年平均 |
| SYN丰度/ (×103 cells/mL) |
獐子岛海域 | 0.28±0.15 | 15.5±6.6 | 27.28±11.26 | 3.98±1.28 | 11.82±7.35 |
| 胶州湾 | 0.16±0.07 | 10.4±4.7 | 4.78±2.14 | 0.87±0.56 | 4.08±2.39 | |
| PEUK丰度/ (×103 cells/mL) |
獐子岛海域 | 0.34±0.1 | 5.13±1.6 | 4.44±1.72 | 2.13±0.31 | 3.33±1.68 |
| 胶州湾 | 8.7±9.2 | 5.10±2.3 | 4.872±4.03 | 2.56±0.45 | 5.1±4.43 | |
| SYN生物量/ (μg C/L) |
獐子岛海域 | 0.07±0.06 | 3.44±2.02 | 5.71±3.79 | 0.98±0.41 | 2.95±1.84 |
| 胶州湾 | 0.04±0.03 | 2.59±1.4 | 1.22±0.8 | 0.23±0.15 | 1.02±0.6 | |
| PEUK生物量/ (μg C/L) |
獐子岛海域 | 0.51±0.23 | 6.33±2.36 | 7.41±5.19 | 3.84±1.08 | 4.99±2.53 |
| 胶州湾 | 12.02±14.93 | 7.66±4.33 | 7.72±6.57 | 3.2±0.73 | 7.65±6.64 | |
| PICO生物量 / (µg C/L) |
獐子岛海域 | 0.58±0.24 | 9.77±4.15 | 13.11±8.26 | 4.82±1.33 | 7.95±4.03 |
| 胶州湾 | 12.06±14.93 | 10.2±5.37 | 8.94±6.53 | 0.78±1.41 | 8.67±6.9 | |
| 注: SYN: 聚球藻; PEUK: 微微型真核浮游植物; PICO: 微微型浮游植物 | ||||||
獐子岛海域PEUK丰度范围在0.01×103~ 18.76×103 cells/mL之间, 平均值为(3.33±1.68) ×103 cells/mL(n=130) (图3c, 表2)。PEUK丰度在秋季最高, 且夏秋季显著高于冬春季(Kruskal-Wallis, P<0.01, 表2)。季节趋势总体表现为秋季>夏季>冬季>春季(图3d)。胶州湾PEUK丰度范围在0.25×103~95.57×103 cells/mL之间, 平均值为(5.1±4.43)×103 cells/mL (n=142) (图3c, 表2)。PEUK丰度在春季最高, 冬季最低(Kruskal-Wallis, P<0.01, 表2)。季节趋势总体表现为春季>秋季>夏季>冬季(图3d)。
通过对两海区进行比较发现, 獐子岛海域与胶州湾SYN丰度存在显著性差异(Mann-Whitney U Test, P<0.01), 獐子岛海域SYN丰度显著高于胶州湾(表2); 两海区PEUK丰度不存在显著性差异(Mann-Whitney U Test, P>0.05, 表2)。
比较微微型浮游植物丰度组成发现, 两海区微微型浮游植物丰度组成存在差异, 其中獐子岛海域除春季外, 以SYN为主; 而胶州湾除夏季外, 以PEUK为主(图4)。
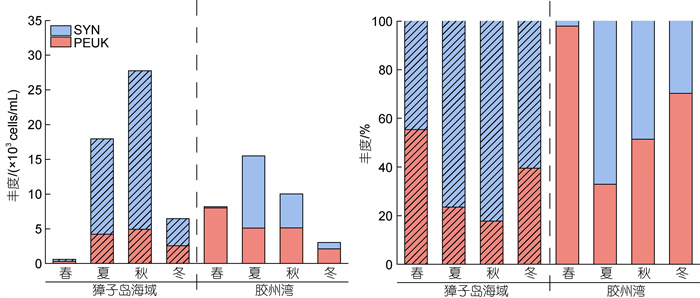 |
| 图 4 獐子岛海域和胶州湾微微型浮游植物丰度组成季节变化 Fig. 4 Seasonal variation in composition of picophytoplankton abundance in Zhangzi Island Area and Jiaozhou Bay |
獐子岛海域SYN和PEUK的生物量季节变化均为夏秋季>冬春季, 微微型浮游植物生物量变化范围在0.16~22.87 µg C/L之间, 最高值出现在秋季 (图5a), SYN和PEUK平均生物量百分比分别为43.52%和56.48%, PEUK略微占优势, 其余季节PEUK也占明显优势(图5b)。
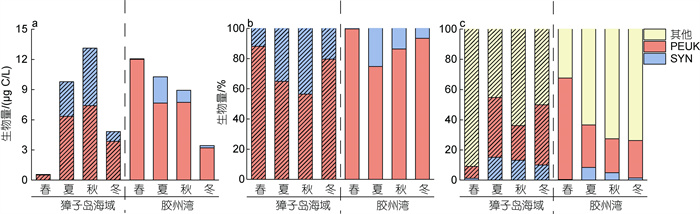 |
| 图 5 獐子岛海域和胶州湾微微型浮游植物生物量组成季节变化比较 Fig. 5 Seasonal variation in composition of picophytoplankton biomass in Zhangzi Island Area and Jiaozhou Bay 注: a, b: 微微型浮游植物生物量组成季节变化; c: 微微型浮游植物对浮游植物生物量贡献季节变化; SYN: 聚球藻; PEUK: 微微型真核浮游植物; 其他: 除微微型浮游植物外的其他浮游植物 |
胶州湾SYN的生物量季节变化为夏季>秋季>冬季>春季, PEUK生物量季节变化与SYN不同, 表现为春季>秋季>夏季>冬季。微微型浮游植物生物量变化范围在0.72~30.61 µg C/L 之间, 最高值出现在春季(图5a), SYN和PEUK平均生物量百分比分别为0.34%和99.66%, PEUK占明显优势。其余季节PEUK也表现出明显优势。由此可见, 獐子岛海域和胶州湾PEUK对微微型浮游植物生物量的贡献大于SYN, 胶州湾SYN对微微型浮游植物生物量的贡献远小于獐子岛海域(图5b)。
獐子岛海域微微型浮游植物年平均生物量为(7.95±4.03) µg C/L, 胶州湾微微型浮游植物年平均生物量为(8.67±6.9) µg C/L (表2)。通过对比獐子岛海域与胶州湾微微型浮游植物生物量发现, 两海区间微微型浮游植物生物量不存在显著性差异(Mann-Whitney U Test, P>0.05, 表2)。
比较獐子岛海域和胶州湾微微型浮游植物对浮游植物总生物量的贡献发现, 獐子岛海域微微型浮游植物年平均贡献为39.01%, 其中夏季贡献最大, 超过54%, 春季贡献最小, 不超过10%; 胶州湾微微型浮游植物年平均贡献为39.44%, 其中春季贡献最大, 超过67%, 冬季贡献最小, 为26.15% (图5c)。
2.4 微微型浮游植物丰度与环境因子和其他生物因子的关系相关性分析结果表明, 獐子岛海域SYN丰度与温度极显著正相关, 与DIN和PO43-浓度显著正相关, 与盐度和砂壳纤毛虫丰度极显著负相关; PEUK丰度与温度极显著正相关, 与DIN浓度显著正相关, 与盐度极显著负相关, 与砂壳纤毛虫丰度显著负相关(表3)。
| 海区 | 因变量 | T | S | DIN浓度 | PO43-浓度 | 砂壳纤毛虫 |
| 獐子岛海域 | SYN | 0.686** | −0.340** | 0.177* | 0.188* | −0.278** |
| PEUK | 0.439** | −.469** | 0.189* | −0.252** | ||
| 胶州湾 | SYN | 0.765** | −0.569** | −0.172* | ||
| PEUK | 0.449** | |||||
| 注: SYN: 聚球藻; PEUK: 微微型真核浮游植物; T: 温度; S: 盐度; DIN: 溶解无机氮; PO43-: 磷酸盐; *, **表示相关性明显 | ||||||
胶州湾SYN丰度与温度极显著正相关, 与盐度和砂壳纤毛虫丰度显著负相关; PEUK丰度与温度极显著正相关(表3)。
3 讨论 3.1 獐子岛海域和胶州湾环境因子的季节变化和海区差异獐子岛海域和胶州湾的环境因子具有明显的季节变化特征。獐子岛海域位于北黄海, 夏秋季节温度高, 冬春季节温度低。受降雨和冲淡水输入的影响, 夏季盐度明显降低。獐子岛海域属于离岸养殖海区, 营养盐受陆源影响较小, 营养盐的补充主要来自于鸭绿江冲淡水、黄海冷水团和黄海暖流(Yin et al, 2013)。然而赵倩等(2012)对北黄海西部调查发现该海区溶解无机营养盐(DIN和PO43-)浓度的季节变化主要与北黄海冷水团中颗粒物的积累与分解有关, 黄海暖流和鸭绿江冲淡水的影响较小。本文中的獐子岛海域位于北黄海西部, 溶解无机营养盐也具有相同的季节变化趋势, 即春季<夏季<秋季<冬季。胶州湾位于暖温带季风气候区, 夏季受副热带高压控制, 温暖潮湿, 降水充沛, 冬季常有冷空气来袭(展鹏, 2012), 夏秋季节温度高于冬春季节。胶州湾附近有数十条河流输入, 在降水充沛的夏季, 河流径流带来大量淡水导致盐度明显降低, 但本文中盐度的低值出现在9月, 可能与该月份的降雨量有关。以往的研究表明胶州湾营养盐的季节变化并无明显的规律性, 可能与胶州湾面积小, 受人类活动影响有关(沈志良, 1995)。本文中胶州湾DIN和PO43-浓度在夏季最低, 其他季节较高。
獐子岛海域和胶州湾的环境因子在海区之间具有差异。獐子岛海域年平均温度低于胶州湾, 可能与獐子岛海域纬度较高有关。獐子岛海域的盐度高于胶州湾, 而DIN浓度和春季的PO43-浓度低于胶州湾, 可能与胶州湾附近数十条淡水河流输入带来大量营养盐有关, 因此胶州湾盐度较低, 营养盐浓度偏高。此外, 有研究表明密集的贝类养殖活动会加速营养盐的消耗(梁艺, 2019), 獐子岛海域大规模贝类养殖活动造成的营养盐消耗可能是獐子岛海域营养盐浓度低于胶州湾的另一个原因。秋冬季节獐子岛海域磷酸盐浓度高于胶州湾, 很有可能与黄海冷水团消退后, 底层携带的高浓度磷酸盐对表层的补充有关(臧璐, 2009)。
3.2 獐子岛海域和胶州湾微微型浮游植物丰度季节变化本文獐子岛海域和胶州湾SYN丰度的季节变化与两海区的温度季节变化趋势一致, 均表现为夏秋季节高于冬春季节, 与以往胶州湾(赵三军等, 2005; 杨琳等, 2012)、桑沟湾(Zhao et al, 2016; 赵燕楚等, 2018; 李凤雪等, 2020)、辽东湾(于旭光, 2017)、日本近岸沿海(Shimada et al, 1995; Katano et al, 2005; Kamiyama et al, 2009)、西班牙比斯开湾(Calvo-Díaz et al, 2006)等温带沿海区域SYN的季节变化趋势基本一致。相关性分析结果显示SYN丰度与温度呈极显著正相关关系(獐子岛海域: R=0.686, P<0.01; 胶州湾: R=0.765, P<0.01)(表3)。已有研究表明, 温度的升高会刺激SYN的细胞分裂速率, 因此SYN生长速率随温度升高而加快。温度还影响着细胞酶活性, 生物新陈代谢能力与酶活性相关, 在一定温度范围内, 细胞酶活性与温度呈正比, 较高的海水温度能加快生物的新陈代谢能力, 从而对SYN的丰度产生较大影响(Agawin et al, 1998; Bec et al, 2005; Fu et al, 2007)。相关性分析也显示了SYN丰度与盐度之间呈极显著负相关关系(獐子岛海域: R=−0.340, P<0.01; 胶州湾: R=−0.569, P<0.01)(表3), 獐子岛SYN与DIN和PO43-浓度以及砂壳纤毛虫丰度之间均具有显著相关关系, 但上述环境因子与SYN丰度的季节变化并不完全一致。推测两海区SYN丰度的季节变化受温度影响更大, 獐子岛海域和胶州湾的水体环境虽然存在差异, 但两海区都位于黄海, 温度具有相似的季节变化特征, 所以两海区的SYN丰度具有相似的季节变化特征。
獐子岛海域和胶州湾PEUK丰度的季节变化趋势不完全一致。獐子岛海域PEUK丰度季节变化趋势为秋季>夏季>冬季>春季, 与SYN丰度的季节变化趋于一致。而胶州湾PEUK丰度季节变化趋势为春季>秋季>夏季>冬季。相关性分析结果显示, 温度和PEUK之间均存在极显著的正相关关系(獐子岛海域: R=0.439, P<0.01; 胶州湾: R=0.449, P<0.01) (表3)。獐子岛海域PEUK丰度的季节变化趋势与温度的季节变化趋势一致, 相关性结果显示营养盐浓度和砂壳纤毛虫丰度与PEUK丰度之间也存在相关关系, 但对PEUK丰度的季节变化影响可能较小, 因此推测温度是影响獐子岛海域PEUK丰度季节变化的主要因素。胶州湾PEUK丰度的季节变化相对较复杂, 春季最高, 夏秋季节次之, 冬季最低。相关性结果表明温度与PEUK丰度之间呈极显著的正相关关系, 可以解释夏秋季节丰度高于冬季。春季的丰度高值可能与其他的环境因素相关。尽管相关性分析中没有体现出除温度外其他因素的影响, 但是已有研究证明, 添加硝酸盐和磷酸盐, 能够刺激PEUK的生长(Katano et al, 2005)。胶州湾的营养盐数据也显示在春季PO43-浓度最高, DIN浓度也保持着较高水平, 因此胶州湾PEUK丰度在春季的高值可能与高浓度的营养盐有关。
3.3 獐子岛海域和胶州湾微微型浮游植物丰度海区差异比较两个海区微微型浮游植物的丰度组成发现, 在獐子岛海域除春季外, 以SYN为主; 而在胶州湾除夏季外, 以PEUK为主(图4)。对比两海区的SYN和PEUK丰度, 獐子岛海域SYN丰度高于胶州湾, 而PEUK丰度无显著性差异。理论上来讲, 獐子岛海域温度低于胶州湾, SYN丰度也应该更低, 然而比较发现, 獐子岛海域SYN丰度更高, 尤其在7~9月的高温季节, 獐子岛海域SYN丰度明显高于胶州湾, 推测可能是除温度外的其他因素导致了SYN丰度在两海区间的丰度差异。比较两个海区的营养盐发现, 胶州湾营养盐浓度通常高于獐子岛海域(图2d, 2e, 表1)。已有研究证明, SYN由于细胞体积小, 单位比表面积大, 在寡营养环境中能有效利用低浓度的营养盐维持生长, 因此更具有竞争优势(Agawin et al, 2000)。胶州湾高浓度的营养盐更有利于促进较大浮游植物的生长, 由于存在竞争关系, 可能在一定程度上抑制了SYN的生长, 因此PEUK成为胶州湾微微型浮游植物的主要成分。SYN在獐子岛海域相对较低的营养盐浓度下更具竞争力, 从而成为微微型浮游植物的主要成分。
3.4 獐子岛海域和胶州湾微微型浮游植物生物量对浮游植物生物量的贡献尽管獐子岛海域和胶州湾微微型浮游植物丰度组成存在差异, 獐子岛海域以SYN为主, 胶州湾以PEUK为主, 但PEUK均是两海区微微型浮游植物生物量的主要贡献者。獐子岛海域微微型浮游植物生物量年平均贡献为39.01%±25.3%, 其中夏季贡献最大, 超过54%, 春季贡献最小; 胶州湾微微型浮游植物生物量年平均贡献为39.44%±35.57%, 其中春季贡献最大, 超过67%, 冬季贡献最小。本研究中两海区微微型浮游植物生物量的年平均贡献与西班牙比开斯湾和地中海沿岸的泻湖中的数值相符(Bec et al, 2005, Calvo-Díaz et al, 2006)。西班牙比开斯湾在夏季贡献最大, 约为30%; 地中海沿岸泻湖在冬季贡献最大, 超过40%。不同海区微微型浮游植物对浮游植物贡献的高值出现的季节不一致, 可能与不同海区间的环境因素有关。在寡营养大洋海域, 微微型浮游植物是浮游植物生物量和初级生产力的主要贡献者, 对浮游植物总生物量的贡献占绝对优势, 在热带海域的贡献超过80% (Li et al, 1983), 亚热带海域约为60%~80% (Platt et al, 1983), 而在近海沿岸区, 微微型浮游植物的贡献通常不超过30% (Modigh et al, 1996)。例如, 在河北沿岸, 微微型浮游植物对浮游植物总生物量贡献为1.84%~8.91%, 年平均贡献为5.32%, 最大值和最小值分别出现在春季和秋季(李洪波等, 2012)。在桑沟湾养殖区, 春、夏和秋季PEUK对浮游植物总生物量的贡献在21.46%~27.74%之间, 冬季降至6.39%; SYN贡献很小, 秋季贡献为6.82%, 其他季节不超过1.5% (Zhao et al, 2016)。本文中獐子岛海域微微型浮游植物生物量在夏季的贡献超过54%, 胶州湾微微型浮游植物生物量在春季的贡献超过67%, 由此可见微微型浮游植物在獐子岛海域和胶州湾生态系统中的重要性。
致谢 本研究中獐子岛海域海上调查得到了大连獐子岛渔业集团有限公司“辽长渔科研19号”全体工作人员的支持, 样品采集工作由徐剑虹老师和于莹博士共同完成; 胶州湾海上调查和样品采集得到了中国科学院山东胶州湾海洋生态系统野外科学观测研究站各位老师、同学和“创新号”考察船全体工作人员的支持, 谨致谢忱。
于旭光, 2017. 辽东湾微微型浮游生物的丰度及季节变化. 海洋开发与管理, 34(7): 67-74 DOI:10.3969/j.issn.1005-9857.2017.07.011 |
于莹, 张武昌, 赵楠, 等, 2011. 胶州湾浮游纤毛虫丰度和生物量的周年变化. 海洋与湖沼, 42(5): 690-701 |
李凤雪, 杜美荣, 高亚平, 等, 2020. 桑沟湾养殖水域微微型浮游生物的时空分布特征及环境影响因素. 水产学报, 44(7): 1100-1111 |
李洪波, 刘述锡, 林凤翱, 等, 2012. 河北沿岸微微型浮游植物的分布特征. 海洋科学, 36(7): 49-55 |
杨琳, 汪岷, 刘冠群, 等, 2012. 胶州湾微微型浮游植物丰度及其与环境因子的相关性分析. 海洋与湖沼, 43(5): 967-975 |
肖天, 焦念志, 王荣, 1995. 胶州湾蓝细菌、异养细菌的数量分布特点[M] // 董金海. 胶州湾生态学研究. 北京: 科学出版社: 118-124.
|
沈志良, 1995. 胶州湾营养盐的动态变化[M] // 董金海. 胶州湾生态学研究. 北京: 科学出版社: 47-52.
|
国家海洋局, 1991. 海洋调查规范 第6部分: 海洋生物调查[S]. 北京: 中国标准出版社: 5.
|
赵三军, 肖天, 李洪波, 等, 2005. 胶州湾聚球菌(Synechococcus spp. )蓝细菌的分布及其对初级生产力的贡献. 海洋与湖沼, 36(6): 534-540 |
赵倩, 臧路, 张传松, 等, 2012. 北黄海西部海区营养盐季节变化及其影响因素探讨. 海洋科学进展, 30(1): 69-76 DOI:10.3969/j.issn.1671-6647.2012.01.009 |
赵燕楚, 赵丽, 张武昌, 等, 2018. 桑沟湾微微型浮游生物丰度和生物量分布的季节变化. 海洋科学, 42(5): 145-154 |
俞建銮, 李瑞香, 1993. 渤海、黄海浮游植物生态的研究. 黄渤海海洋, 11(3): 52-59 |
展鹏, 2012. 胶州湾三维水动力及生态动力学数值模拟[D]. 青岛: 中国海洋大学: 7-8.
|
梁艺, 2019. 獐子岛海域贝类养殖与营养盐限制的关系研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所): 11-26.
|
焦念志, 杨燕辉, 2002. 中国海原绿球藻研究. 科学通报, 47(7): 485-491 DOI:10.3321/j.issn:0023-074X.2002.07.002 |
臧璐, 2009. 北黄海生源要素的季节特征及冷水团对其影响的研究[D]. 青岛: 中国海洋大学: 78-85.
|
AGAWIN N S R, DUARTE C M, AGUSTI S, 1998. Growth and abundance of Synechococcus sp. in a Mediterranean Bay: seasonality and relationship with temperature. Marine Ecology Progress Series, 170: 45-53 DOI:10.3354/meps170045 |
AGAWIN N S R, DUARTE C M, AGUSTÍ S, 2000. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production. Limnology and Oceanography, 45(3): 591-600 DOI:10.4319/lo.2000.45.3.0591 |
BEC B, HUSSEINI-RATREMA J, COLLOS Y, et al, 2005. Phytoplankton seasonal dynamics in a Mediterranean coastal lagoon: emphasis on the picoeukaryote community. Journal of Plankton Research, 27(9): 881-894 DOI:10.1093/plankt/fbi061 |
CALVO-DÍAZ A, MORÁN X A G, 2006. Seasonal dynamics of picoplankton in shelf waters of the southern Bay of Biscay. Aquatic Microbial Ecology, 42(2): 159-174 |
CAMPBELL L, NOLLA H A, VAULOT D, 1994. The importance of Prochlorococcus to community structure in the central North Pacific Ocean. Limnology and Oceanography, 39(4): 954-961 DOI:10.4319/lo.1994.39.4.0954 |
FU F X, WARNER M E, ZHANG Y H, et al, 2007. Effects of Increased temperature and CO2 on photosynthesis, growth, and elemental ratios in marine Synechococcus and Prochlorococcus (cyanobacteria). Journal of Phycology, 43(3): 485-496 DOI:10.1111/j.1529-8817.2007.00355.x |
JOINT I R, OWENS N J P, POMROY A J, 1986. Seasonal production of photosynthetic picoplankton in the Celtic Sea. Marine Ecology Progress Series, 28(3): 251-258 |
KAMIYAMA T, YAMAUCHI H, IWAI T, et al, 2009. Seasonal variations in abundance and biomass of picoplankton in an oyster-farming area of northern Japan. Plankton and Benthos Research, 4(2): 62-71 DOI:10.3800/pbr.4.62 |
KATANO T, KANEDA A, TAKEOKA H, et al, 2005. Seasonal changes in the abundance and composition of picophytoplankton in relation to the occurence of Kyucho and bottom in trusion in Uchiumi Bay, Japan. Marine Ecology Progress Series, 298: 59-67 DOI:10.3354/meps298059 |
KREMPIN D W, SULLIVAN C W, 1981. The seasonal abundance, vertical distribution, and relative microbial biomass of chroococcoid cyanobacteria at a station in southern California coastal waters. Canadian Journal of Microbiology, 27(12): 1341-1344 DOI:10.1139/m81-205 |
LI W K W, RAO D V S, HARRISON W G, et al, 1983. Autotrophic picoplankton in the tropical ocean. Science, 219(4582): 292-295 DOI:10.1126/science.219.4582.292 |
MARIE D, SIMON N, GUILLOU L, et al, 2001. DNA/RNA analysis of phytoplankton by flow cytometry. Current Protocols in Cytometry DOI:10.1002/0471142956.cy1112s11 |
MARIE D, ZHU F, BALAGUÉ V, et al, 2006. Eukaryotic picoplankton communities of the Mediterranean Sea in summer assessed by molecular approaches (DGGE, TTGE, QPCR). FEMS Microbiology Ecology, 55(3): 403-415 DOI:10.1111/j.1574-6941.2005.00058.x |
MODIGH M, SAGGIOMO V, D'ALCALÀ M R, 1996. Conservative features of picoplankton in a Mediterranean eutrophic area, the Bay of Naples. Journal of Plankton Research, 18(1): 87-95 DOI:10.1093/plankt/18.1.87 |
OLSON R J, CHISHOLM S W, ZETTLER E R, et al, 1990. Spatial and temporal distributions of prochlorophyte picoplankton in the North Atlantic Ocean. Deep Sea Research Part A. Oceanographic Research Papers, 37(6): 1033-1051 |
PLATT T, RAO D V S, IRWIN B, 1983. Photosynthesis of picoplankton in the oligotrophic ocean. Nature, 301(5902): 702-704 DOI:10.1038/301702a0 |
SHIMADA A, NISHIJIMA M, MARUYAMA T, 1995. Seasonal appearance of Prochlorococcus in Suruga Bay, Japan in 1992–1993. Journal of Oceanography, 51(3): 289-300 DOI:10.1007/BF02285167 |
WORDEN A Z, 2006. Picoeukaryote diversity in coastal waters of the Pacific Ocean. Aquatic Microbial Ecology, 43(2): 165-175 |
YIN J H, ZHAO Z X, ZHANG G T, et al, 2013. Tempo-spatial variation of nutrient and chlorophyll-α concentrations from summer to winter in the Zhangzi Island Area (Northern Yellow Sea). Journal of Ocean University of China, 12(3): 373-384 DOI:10.1007/s11802-013-2101-4 |
ZHAO L, ZHAO Y C, DONG Y, et al, 2018. Influence of the northern Yellow Sea Cold Water Mass on picoplankton distribution around the Zhangzi Island, northern Yellow Sea. Acta Oceanologica Sinica, 37(5): 96-106 DOI:10.1007/s13131-018-1149-9 |
ZHAO L, ZHAO Y, XU J H, et al, 2016. Distribution and seasonal variation of picoplankton in Sanggou Bay, China. Aquaculture Environment Interactions, 8: 261-271 DOI:10.3354/aei00168 |
ZUBKOV M V, SLEIGH M A, TARRAN G A, et al, 1998. Picoplanktonic community structure on an Atlantic transect from 50ºN to 50ºS. Deep Sea Research Part I:Oceanographic Research Papers, 45(8): 1339-1355 DOI:10.1016/S0967-0637(98)00015-6 |
 2022, Vol. 53
2022, Vol. 53


