中国海洋湖沼学会主办。
文章信息
- 王圣, 赵亮, 张海彦, 李菲. 2022.
- WANG Sheng, ZHAO Liang, ZHANG Hai-Yan, LI Fei. 2022.
- 黄海绿潮生消过程及其主导因素
- GREEN TIDE IN THE YELLOW SEA FROM GENERATION TO EXTINCTION AND THE CNTROLING FACTOR
- 海洋与湖沼, 53(6): 1338-1348
- Oceanologia et Limnologia Sinica, 53(6): 1338-1348.
- http://dx.doi.org/10.11693/hyhz20220200032
文章历史
-
收稿日期:2022-02-19
收修改稿日期:2022-03-14
2. 天津科技大学海洋与环境学院 天津 300457;
3. 天津大学海洋科学与技术学院 天津 300072
2. College of Marine and Environmental Sciences, Tianjin University of Science and Technology, Tianjin 300457, China;
3. School of Marine Science and Technology, Tianjin University, Tianjin 300072, China
绿潮是一种在世界沿岸海域中普遍发生的大型海洋绿藻极速增殖的现象, 近年来成为一种世界范围内的海洋生态灾害, 主要发生在水体富营养严重的河口、泻湖、人类活动密集的海岸等区域(王广策等, 2020; 张海波等, 2020)。据研究, 绿潮主要是由石莼属(Ulva)、浒苔属(Enteromorpha)、刚毛藻属(Cladophora)、硬毛藻属(Chaetomorpha)等大型藻类脱离其固着基后迅速增殖所造成的藻类灾害。绿潮的暴发时间为每年的春夏之交, 暴发时间一般会持续2~3个月, 并于秋季前完全消亡(刘湘庆, 2014)。我国黄海绿潮暴发主要是由浒苔引起的, 自2008年至今, 黄海已连续13 a暴发了不同规模的绿潮灾害, 因此, 探究绿潮的生消过程对认识和预防绿潮有重要的作用。
从世界范围来说, 绿潮在包括英国、法国、美国、日本、韩国、中国等10多个国家的沿海地区均有发生(唐启升等, 2010), Taylor等(2001)在实验室内研究了光照、温度、氮营养盐对绿潮生长的影响, Nelson等(2003)研究了美国华盛顿州沿海水域绿潮的空间及季节分布, Aurousseau (2001)和Cugier等(2005)在法国绿潮灾害严重的Brest湾, 建立了三维生物地球化学模式, 模拟了该海域的漂浮绿潮的生消过程。Ruiz (1999)指出绿潮的生消过程受到了生物活动以及化学过程的影响, 同时绿潮的暴发会导致生态系统层面的变化。Merceron等(2007)指出法国Brittany湾绿潮藻类的生长受到光照强度、温度和盐度的影响。
我国学者们同样做了大量关于绿潮生消过程的研究。吴洪喜等(2000)在实验中发现浒苔适应环境能力较强, 是一种广温广盐性的海藻, 具有很强的环境适应能力。衣立等(2010)利用卫星遥感数据, 结合普林斯顿海洋模型(Princeton ocean model, POM)分析了绿潮暴发期间的水文条件以及浒苔定向漂移的原因。张海波等(2020)根据卫星监测数据及绿潮前后水文要素及氮营养盐等数据, 对绿潮生消规律进行了分析, 结果发现在不同阶段绿潮受氮营养盐影响不同。丁月旻(2014)探究了绿潮发生过程中浒苔成分的变化, 同时探究了浒苔生消过程中生源要素的转化以及浒苔腐烂对环境的影响。白雨等(2019)分析了温度、光照、降水在绿潮生消过程中的影响, 结论表明降水是影响绿潮生长规模的重要因素, 较高的温度是导致绿潮消亡的主要原因。李雪娜等(2016)研究了海表面温度与浒苔生消之间的关系, 认为浒苔暴发的适宜温度范围为23~26 ℃。冯立娜等(2020)通过实验探讨了浒苔绿潮消亡过程中的营养盐释放规律以及浒苔绿潮聚积腐烂对海水水质的影响, 结果表明浒苔分解以有机态及颗粒态营养盐为主。目前关于浒苔生消过程的研究已有很多, 但大多都是基于单个影响因子或实验室条件下进行的研究。
本文基于考虑了温度、光照、营养盐的物理—生态耦合绿潮模型(LTRANS-GT), 对黄海浒苔的生消过程进行模拟, 探究了温度、光照、营养盐等影响因子在黄海绿潮生消过程不同阶段中的作用。
1 生态模型建立与配置 1.1 绿潮生态模型及参数设置黄海绿潮生态动力学模型主要分为两个部分, 分别是漂移模块以及生态模块(图 1)。漂移模块采用了拉格朗日粒子追踪方法, 基于LTRANS模型, 以海表面风场和表层流场数据作为驱动来计算绿潮的漂移轨迹。生态模块中考虑了海表面温度、光照强度、营养盐等环境因子, 建立了浒苔生长死亡的生态方程。进一步将生态模块与LTRANS模型耦合, 建立了物理—生态耦合的绿潮模型(LTRANS-GT), 来计算绿潮分布及生消过程。
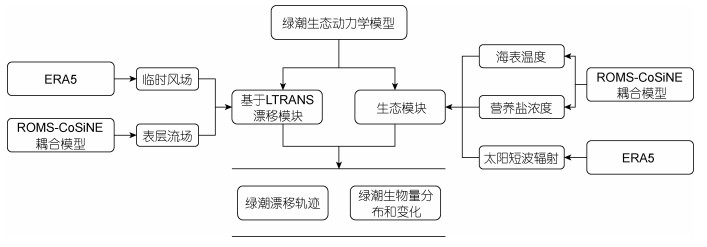 |
| 图 1 黄海绿潮生态动力学模型概念图 Fig. 1 The model of ecological dynamics of green tide in Yellow Sea 注: ERA5: ECMWF reanalysis v5; LTRANS: Larval TRANSport Lagrangian model; ROMS-CoSiNE: regional ocean modelling system-carbon, silicate and nitrogen ecosystem |
漂移模块考虑了海表面风以及海流下用的水平方向的物理运动过程。何恩业等(2021)指出, 浒苔漂移过程中会受到重力、浮力、波浪和湍流等作用, 这导致海流赋予浒苔的速度会有所下降, 在模型中我们将表层海流赋予浒苔的速度设定为表层海流速度的0.9倍; 衣立等(2010)研究发现海表面风会赋予浒苔一部分速度, 同时在海表面风的作用下浒苔的运动方向会偏向盛行风右侧约5°~40°, 在模型中我们将风速赋予浒苔的速度设定为风速的0.01倍, 而由于科氏力造成的影响, 模型中设定浒苔的运动方向会偏向盛行风右侧20°。生态模块考虑了浒苔的生长及死亡, 其中模型中设定浒苔的生长受到了光照强度、温度、营养盐的控制, 而死亡仅受到了温度的影响。在模型中我们将绿潮生物量的变化通过下面的公式来进行表达:
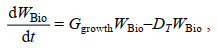 (1)
(1)其中, WBio表示浒苔湿重, 单位是g, Ggrowth表示浒苔日生长率, 单位为d–1, DT表示浒苔受温度影响的日死亡率, 单位为d–1。
温度、光照和营养盐对浒苔的生长起到了关键作用, 浒苔生长率的公式可以表达为
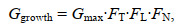 (2)
(2)其中, Ggrowth为浒苔生长率, Gmax为浒苔最大生长率, FT、FL、FN分别为温度、光照强度、营养盐对浒苔生长速率的限制因子。
参考了Moisan等(2002)建立的浮游植物动态生长-温度模型, 改进了水温对浒苔生长率的影响公式
 (3)
(3)其中, T1、T2分别是最适温度的上下限, θ1和θ2为生长率温度调节系数。
海藻的光合作用速率在一定范围内会随着光照强度的增大而增加, 但超出了一定限度后反而会受到抑制(吴洪喜等, 2000), 在模型中, 光照对绿潮的影响参考Steele (1962)的公式:
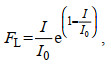 (4)
(4)其中, I0表示最适合浒苔生长的光照强度。
浒苔的快速生长与较高的营养盐浓度有着密切的关系, 本模型主要考虑了N营养盐及P营养盐对于浒苔生长的影响, 参考Monod方程式我们给出浒苔生长受N营养盐及P营养盐的影响公式:
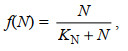 (5)
(5)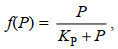 (6)
(6)其中, f(N)表示N营养盐对浒苔生长的影响, f(P)表示P营养盐对浒苔生长的影响, KN为NO3-营养盐的半饱和常数, N为海水中NO3-的浓度, 单位是μmol/L。KP为PO43-营养盐的半饱和常数, P为海水中PO43-的浓度, 单位是μmol/L。
庞秋婷等(2013)指出, 在合适的磷酸盐浓度下高浓度的硝酸盐更能够促进浒苔的生长, 在模型中, 我们设定当外界磷酸盐浓度大于0.7μmol/L时, 我们只考虑硝酸盐对于浒苔生长的影响, 由此我们给出营养盐对浒苔生长的影响公式:
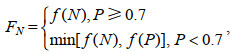 (7)
(7)其中, min[f(N), f(P)]表示取f(N)和f(P)中较小的值。
模型中我们假设浒苔的死亡仅受到温度的影响, 参照Eppley (1972)的研究结果我们设定浒苔死亡率公式
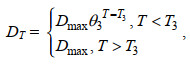 (8)
(8)其中, DT为浒苔受温度影响的日死亡率; Dmax为日最大死亡率; θ3为死亡率系数; T3为最大死亡率临界温度。
上述模型中设计的变量如表 1所示。
| 参数 | 定义 | 参数值 | 单位 |
| θ1 | 生长率系数 | 1.15 | — |
| θ2 | 生长率系数 | 1.8 | — |
| θ3 | 死亡率系数 | 1.1 | — |
| T1 | 浒苔最适温度的上限 | 15 | ℃ |
| T2 | 浒苔最适温度的下限 | 20 | ℃ |
| T3 | 浒苔死亡率临界温度 | 25 | ℃ |
| I0 | 浒苔生长最适光照强度 | 5 500 | Lx |
| KN | NO3-的半饱和常数 | 8.39 | μmol/L |
| KP | PO43-的半饱和常数 | 0.904 | μmol/L |
| Gmax | 浒苔最大生长率 | 0.45 | d–1 |
| Dmax | 浒苔每日最大死亡率 | 0.1 | d–1 |
模型模拟的海域范围是118°~128°E, 32°~38°N, 模型模拟时间为2008~2017年。模型每24 h输出一次结果, 结果包含浒苔粒子的经纬度、浒苔粒子的重量、浒苔粒子所在位置的环境(光照、温度、营养盐浓度)等。
用于模型输入的表层流场、海表温度和海表面营养盐分布的数据, 来自ROMS-CoSiNE (regional ocean modelling system-carbon, silicate and nitrogen ecosystem)模型计算结果(钱思萌, 2018), 模型覆盖了渤黄海及部分东海区域(117.01°~131.66°E, 29.04°~ 42.09°N)。数据垂向分层30层, 空间分辨率为1/24°, 时间分辨率为1 h, 数据时间范围是从2008~2017年。钱思萌(2018)、罗辰奕等(2019)对模型的物理场(环流、温度、盐度)和生态场(营养盐、叶绿素、溶解氧)的时空分布特征进行了验证。用于模型输入的海面风场数据及光照强度数据来源于欧洲中期天气预报中心(European Centre for Medium-Range Weather Forecasting, ECMWF)的ERA5数据(Hersbach et al, 2018), 其空间分辨率为1/4°, 时间分辨率为1 h, 所用到的数据时间范围为2008~2017年, 我们截取了渤黄海及部分东海区域(117°~131.75°E, 29°~42°N), 并插值到模型的计算网格上。
模型的初始场设置包括了粒子的初始位置、初始重量以及初始时间, 在模型中一次性释放粒子4 000个, 本文利用郭伟(2017)、白雨等(2019)处理过的绿潮遥感信息, 对2008~2017年卫星图像中首次发现绿潮的时间与区域进行统计, 确定了输入粒子的初始位置, 刘湘庆(2014)在2012年绿潮暴发过程中测得的数据表明, 浒苔发展初期浒苔密为0.45 g/m2, 结合绿潮首次发现时的分布面积, 反算得到每年绿潮初始生物量(湿重)的大小。将遥感首次发现绿潮的时间确定为模型的起算时间, 模型结束的日期为遥感影像最后一次观测到有绿潮存在的日期。
得到模拟结果后, 我们将模拟结果与绿潮遥感信息进行了对比验证, 如图 2所示。整体上来看, 该模型对绿潮漂移路径、转向时间等方面的模拟结果与卫星遥感有较好的一致性, 基本可以刻画绿潮的分布特征。
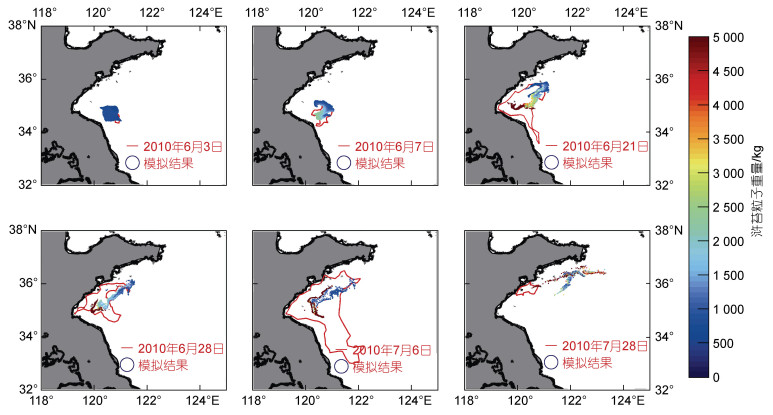 |
| 图 2 模型结果验证图 Fig. 2 Validation of the model results |
根据模型模拟的2008~2017年结果, 给出了黄海绿潮的生长消亡特征, 并分阶段讨论了温度、光照、营养盐在绿潮不同生长阶段所起到的作用。
2.1 黄海绿潮生长消亡特征模型模拟的整个绿潮生消过程持续62~94 d, 其中2010及2017年绿潮生消过程持续时间较短, 约60 d; 2008、2012、2014年持续时间较长, 均在80 d以上; 其余年份均在70~80 d。过去的10 a间, 绿潮的生物量也存在着明显的年际差异, 如图 3所示, 黄海绿潮生物量高值年份为2013、2015、2016年, 这些年份最大生物量均超过50万t, 同时生物量极大值出现在2013年, 当年最大生物量高达56万t。绿潮生物量低值年份为2009、2010、2017年, 这些年份最大生物量均不足5万t, 同时生物量极小值出现在2017年, 当年的最大生物量仅为2.5万t。其余年份最大生物量约10~36万t。
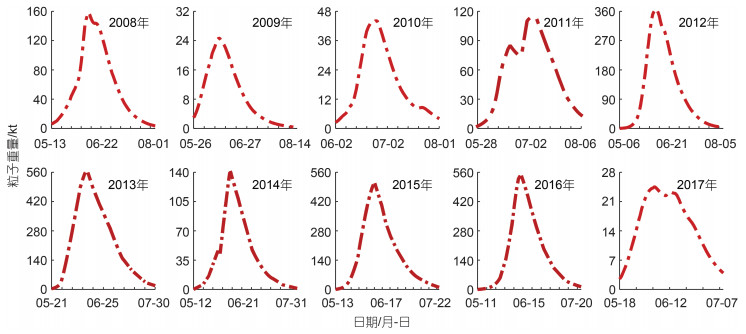 |
| 图 3 绿潮模拟生物量 Fig. 3 Simulated green tide biomass |
虽然绿潮规模存在年际间差异, 但其季节规律较为类似, 除去2009~2011这三年绿潮从6月初左右开始暴发, 其余年份暴发时间均在5月中旬前后, 随后绿潮规模迅速扩大, 并于随后的20~38 d达到当年的生物量峰值, 统计显示达到当年的生物量峰值平均需要29 d, 标准差为5 d, 说明每年绿潮在暴发后的约一个月生物量达到峰值。白雨等(2019)根据遥感数据分析也得出绿潮覆盖面积约在30~40 d达到当年峰值。之后绿潮于7月份快速消亡, 至8月份基本消失。
浒苔生物量不同年份间季节变化存在明显差异, 很多学者通过遥感影像得出绿潮分布面积呈现单峰值分布的结论, 但模拟显示生物量变化形式并不单一。总体来说生物量季节变化可以分为以2011年和2017年为代表的双峰值形式, 以及其他年份所表现出的单峰值形式, 以2011年为例, 绿潮生物量于6月18日达到全年次高值, 之后生物量逐渐降低, 直到6月26日达到近期最低值, 随后又逐渐升高直到7月4日达到全年生物量最高值。这一生物量分布特征也同样出现在何恩业等(2021)的2019年绿潮模拟结果中。
2.2 黄海绿潮生长阶段主要控制因素根据绿潮生物量的季节变化特征, 我们将绿潮开始暴发至到达最大生物量定义为绿潮的生长阶段, 将之后的时间定义为绿潮的消亡阶段。在模型中浒苔的生长和消亡过程受温度、光照、营养盐的控制, 为了进一步了解绿潮在生长阶段的受控因素, 我们对2008~2017年连续10 a的数据进行了统计分析, 结果如表 2所示。
| 年份 | 太阳短波辐射 /(W/m2) |
温度 /℃ |
氮营养盐浓度 /(μmol/L) |
磷营养盐浓度 /(μmol/L) |
| 2008 | 265.26 | 16.93 | 18.51 | 0.23 |
| 2009 | 319.43 | 19.86 | 26.68 | 0.51 |
| 2010 | 284.78 | 19.12 | 24.12 | 0.32 |
| 2011 | 272.50 | 20.58 | 29.67 | 0.72 |
| 2012 | 292.63 | 18.63 | 26.73 | 0.71 |
| 2013 | 269.65 | 18.92 | 29.83 | 0.66 |
| 2014 | 279.03 | 18.35 | 28.02 | 0.62 |
| 2015 | 264.57 | 18.31 | 28.26 | 0.49 |
| 2016 | 237.34 | 18.53 | 35.32 | 0.76 |
| 2017 | 313.86 | 18.81 | 22.28 | 0.28 |
从表 2中可以看出, 在绿潮覆盖区域太阳短波辐射最低为237.34 W/m2, 最高为319.43 W/m2, 平均约为279.91 W/m2, 主要集中在260~290 W/m2的范围内。吴洪喜等(2000)研究表明浒苔的最适光强为5 000~6 000 Lx, 马汶菲等(2022)研究发现浒苔在光强144 μmol/(m2·s)条件下适合释放孢子, 崔琳琳等(2014)研究表明, 在绿潮聚集前期短波辐射能量在200 W/m2左右, 光照条件有利于绿潮繁殖。而在模型中设定220 W/m2为浒苔生长的最适光照强度, 根据表中统计代入到生长公式中可以得知光照对浒苔生长的影响系数在0.89~0.98范围内, 表明在生长阶段光照为浒苔生长提供了必要的条件, 但不是生长阶段的限制性因素。
而绿潮覆盖区在生长阶段的海表面温度普遍处于16~21 ℃, 其中最低温度为16.93 ℃, 最高温度为20.58 ℃, 平均为18.81 ℃。Taylor等(2001)研究表明浒苔的最高生长速率出现在15~20 ℃, 吴洪喜等(2000)研究表明浒苔的最适温度范围为15~25 ℃。在模型中设定15~20 ℃为浒苔生长的最适温度, 同时在模型中此温度下浒苔的日死亡率均小于8%, 因此从表中统计数据可以得出结果, 在生长阶段温度同样为浒苔生长提供了必要的条件, 但并不是主要控制因素, 这与衣立等(2010)发现海表面温度对浒苔暴发的影响不显著的结论一致。同时模型在绿潮覆盖区域的光照强度数据与温度数据与白雨等(2019)的遥感结果非常接近, 这也间接证明了模型模拟效果较为理想。
而在生长阶段绿潮覆盖区的营养盐浓度年际间波动较大, 氮营养盐浓度处于18~36 μmol/L范围内, 其中最低为18.51 μmol/L, 最高为35.32 μmol/L, 平均为26.94 μmol/L, 磷营养盐浓度处于0.2~0.8 μmol/L范围内, 其中最低为0.23 μmol/L, 最高为0.76 μmol/L, 平均为0.53 μmol/L。代入模型中可以得知浒苔生长阶段营养盐对浒苔生长的影响系数在0.22~0.62范围内。张海波等(2020)研究表明, 在绿潮快速增殖阶段, 丰富的氮营养盐是绿潮快速繁殖生长的物质基础。庞秋婷等(2013)研究认为在磷酸盐含量适中时, 高浓度的硝酸盐更能促进浒苔的生长, 同时充足、连续的营养盐补充是绿潮暴发的物质基础。因此本文认为在合适的温度、光照条件下, 营养盐浓度可能是浒苔生长阶段的主导因素。
为了验证营养盐浓度是其生长阶段的主导因素这一认识, 本文设计了一组敏感性实验, 在保持其他模型参数及输入条件不变的情况下, 模型中不考虑营养盐水平浒苔生长的影响, 即设定FN=1, 通过对比实验前后浒苔的生消过程是否产生大的变化, 判断营养盐浓度是否是浒苔生长阶段的主导因素。得到结果如图 4所示。
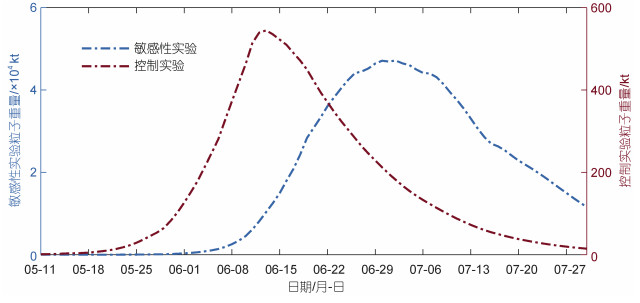 |
| 图 4 2016年敏感性实验生物量对比图 Fig. 4 Comparison in sensitivity of experiment on biomass in 2016 |
以2016年为例, 我们可以看到相较于正常状态下的生物量曲线, 浒苔的生消时间在不考虑营养盐影响的情况下得到了极大的延长, 同时最大生物量也有明显的变化。2016年在考虑营养盐与不考虑营养盐情况下, 生长阶段所需时间分别为34 d以及53 d, 敏感性试验相较于控制实验, 生长阶段所需时间增加了19 d; 该年最大生物量分别为56万t以及4 715万t, 敏感性试验相较于控制实验, 最大生物量增加了近100倍。从结果可以看出, 营养盐浓度影响生长阶段的持续时间及最大生物量, 印证了在合适的温度、光照条件下, 营养盐浓度是浒苔生长阶段的主要控制因素这一观点。
浒苔生物量受其所在海域光照、温度、营养盐等环境因素的影响, 而造成浒苔所在海域环境因素差异的来源有两个, 一个是浒苔不同年份分布区域不同所带来的, 另一个是不同年份环境因素存在年际差异, 以2009年和2010年为例讨论这两种来源的作用。
浒苔漂移受海表面风场及表层流场的影响, 流场及风场数据显示, 2008~2017年这10 a间黄海表层流场及风场存在显著的年际间差异。风、海流等动力因素不会直接影响浒苔的生物量, 但是会通过影响浒苔的漂移路径及分布区域, 间接使不同年份间浒苔所在海域的温度、光照、营养盐产生差异, 从而造成浒苔生物量的差异。浒苔暴发一般集中于5月中旬, 同时在6月经历一个快速增长期, 图 5给出了2009年与2010年6月表层平均流场及海表面平均风场的对比, 从图 5中可以看出, 2009年黄海海域6月表层平均流速及海表面平均风速大小均高于2010年, 同时流向及风向也存在显著差异, 2009年青岛外海的流向与2010年均呈现与岸大致平行的特征, 但2009年的流向更加偏东。2009年青岛外海的风向为北向, 而2010年的风向为西北向。表层流场与海表面风场的年际差异共同造成了浒苔分布区域的不同。与此同时, 每年浒苔暴发的时间与初始位置存在差别, 也会使得浒苔分布存在差异。
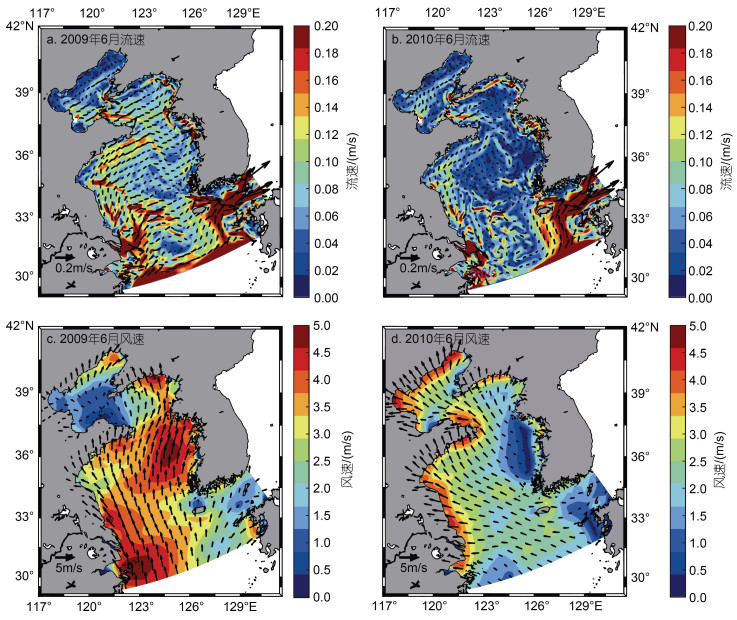 |
| 图 5 2009年与2010年表层流场及海表面风场对比图 Fig. 5 Comparison of surface current field and sea surface wind field between 2009 and 2010 |
不同年份浒苔所在区域环境因素存在差异, 与浒苔分布区域的不同有着直接的关系, 但不排除环境因素空间分布存在年际间差异的影响, 图 6给出了2009与2010年6月海表面温度数据及表层营养盐浓度数据的对比, 同时标注了浒苔6月所处的位置轮廓。从图 6中可以看出, 黄海海域6月温度大小及结构存在差异, 但差异较小; N、P营养盐浓度大小及结构均无明显差异, 营养盐空间分布差异较为明显, 呈现出近岸高, 外海低的特点, 这与李伯志(2018)的统计与分析结果类似, 潘俊等(2018)也指出黄海中南部海域营养盐分布并不均匀, 同时从图 6中可以直观看出浒苔所在区域营养盐浓度存在显著差异。因此, 表层流场与海表面风场的年际差异共同造成了浒苔分布区域的不同, 使得浒苔所在区域环境因素存在差异, 从而对浒苔的生长造成影响。
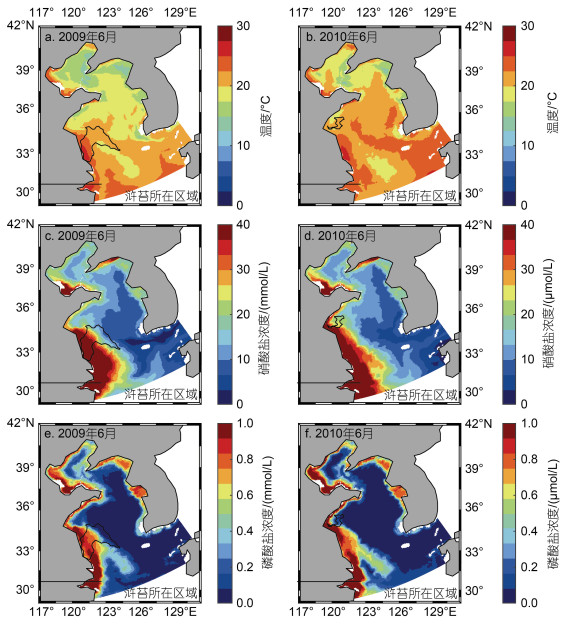 |
| 图 6 2009(a, b, c)年与2010(b, d, f)年温度与营养盐浓度对比图 Fig. 6 Comparison in temperature and nutrient concentration between 2009(a, b, c) and 2010(b, d, f) |
在大多数年份, 绿潮的季节变化较为相似, 生物量均呈现单峰值形式, 但在少部分年份, 由于短期极端天气过程, 如台风、强对流天气等, 导致温度、光照、营养盐等环境因素急剧变化, 从而导致绿潮的季节变化特征与其他年份有所差异。以2011年为例, 2011年第五号强热带风暴“米雷”于6月22日在菲律宾以东海面形成, 24号加强为强热带风暴, 并沿中国东部沿海北移, 26号下午到达山东半岛以东海域, 并于26号晚上于山东荣成登陆, 在台风经过黄海的这段时间内, 绿潮覆盖区域太阳短波辐射最低为72.84 W/m2, 最高为150.77 W/m2, 平均约为110.12 W/m2, 上文统计了正常天气下太阳短波辐射约为主要集中在260~290 W/m2的范围内, 相比之下台风过境造成了太阳短波辐射的大幅度下降, 将台风期间的光照强度数据代入到生长公式中可以得知光照对浒苔生长的影响系数在0.6~0.8范围内, 有明显的下降。而在此期间绿潮覆盖区域温度下降约0.5 ℃, 氮营养盐浓度增加约1.6 μmol/L, 磷营养盐浓度增加约0.17 μmol/L, 代入到生长公式中可以算得温度与营养盐浓度的影响系数与台风过境前无明显差异, 因此我们推断短期极端天气现象而导致的光照强度骤降是生物量季节变化出现双峰特征的主要原因。
2.3 黄海绿潮消亡阶段主要控制因素本文同样对浒苔消亡阶段区域的温度、光照、营养盐数据进行了统计分析, 结果如表 3所示。在浒苔消亡阶段, 附近海域的太阳短波辐射最低为238.26 W/m2, 最高为295.35 W/m2, 平均约为274.74 W/m2, 主要集中在260~290 W/m2的范围内。相较于生长阶段, 太阳短波辐射无明显变化, 因此光照不是浒苔消亡阶段的限制性因素。
| 年份 | 太阳短波辐射 /(W/m2) |
温度 /℃ |
氮营养盐浓度 /(μmol/L) |
磷营养盐浓度 /(μmol/L) |
| 2008 | 265.68 | 23.32 | 12.42 | 0.03 |
| 2009 | 270.31 | 23.14 | 13.98 | 0.12 |
| 2010 | 284.58 | 24.26 | 15.59 | 0.07 |
| 2011 | 238.26 | 23.14 | 15.62 | 0.14 |
| 2012 | 295.35 | 23.56 | 13.11 | 0.04 |
| 2013 | 274.79 | 23.35 | 15.26 | 0.12 |
| 2014 | 280.57 | 23.63 | 14.07 | 0.04 |
| 2015 | 259.60 | 22.79 | 15.31 | 0.05 |
| 2016 | 291.53 | 23.46 | 18.38 | 0.14 |
| 2017 | 286.68 | 23.38 | 15.73 | 0.05 |
而在消亡阶段绿潮覆盖区的营养盐浓度年际间波动不大, 氮磷营养盐均处于较低水平, 氮营养盐浓度处于12~19 μmol/L范围内, 其中最低为12.42 μmol/L, 最高为18.38 μmol/L, 平均为14.95 μmol/L, 磷营养盐浓度处于0.03~0.1 μmol/L范围内, 其中最低为0.03 μmol/L, 最高为0.14 μmol/L, 平均为0.08 μmol/L。许多学者进行了有关浒苔对氮、磷营养盐的实验, 实验结果均表明在其他条件不变的情况下, 较低的营养盐浓度会限制浒苔的生长(邵魁双等, 2011; 庞秋婷等, 2013)。代入模型中可知浒苔消衰阶段营养盐对浒苔生长的影响系数在0.03~0.14范围内, 而从图 4中的敏感性实验结果我们可以看出, 在不考虑营养盐的情况下, 浒苔消亡的趋势并没有停止, 说明在消亡阶段营养盐浓度不是唯一的主导因素。
消亡阶段绿潮覆盖区附近海域温度处于22~25 ℃之间, 最低为22.56 ℃, 最高为24.26 ℃, 平均约为23.41 ℃, 相较于发展阶段的平均温度18.81 ℃有着很明显的升高, 同时在消亡阶段末期浒苔附近海域海表面平均温度均超过了26 ℃, 根据统计代入到生长公式中可以得知在消亡阶段温度对浒苔生长的影响系数在0.55~0.68范围内, 对浒苔死亡的影响系数在0.8~0.9范围内, 相比较而言, 浒苔生长阶段温度对浒苔生长的影响系数为1, 对浒苔死亡的影响系数普遍在0.5~0.6, 说明温度的升高不仅降低了浒苔的生长率, 同时也增加了浒苔的死亡率。从图 7中不同阶段绿潮附近海域海表面温度变化, 可以直观得看出不同阶段的温度差异, 说明较高的温度是浒苔的消亡的主导因素。辛蕾等(2018)根据遥感数据得出结论, 当表层水温高于25 ℃时, 绿潮覆盖面积开始下降。孟晓智等(2018)通过实验室测定, 发现温度高于25 ℃会明显抑制浒苔生长。因此温度同样是浒苔消亡阶段的主导因素。
 |
| 图 7 不同年份绿潮附近海域温度对比图 Fig. 7 Sea temperature in the areas near green tide in different years |
综上所述, 在浒苔消亡阶段, 光照对于浒苔的消亡无显著影响, 海表面风场及表层流场的差异造成浒苔分布区域不同, 带来的海表面温度及营养盐浓度的差异共同影响了浒苔的消亡。这与其他学者的认识类似, 杨静等(2017)表示因海水温度上升、营养盐含量降低以及其他环境因子的改变, 促使绿潮逐渐消亡。冯立娜等(2020)表明在高温和乏营养盐的条件下, 浒苔会很快进入腐烂分解阶段。
3 结论本文在LTRANS输运模型的基础上, 增加了包含温度、光照、营养盐等环境因子的生态模块, 构建了黄海浒苔生态动力学模型(LTRANS-GT), 并选用卫星遥感绿潮数据进行验证, 最终模拟了2008~2017年黄海浒苔从暴发到消亡的全过程, 探究了海表面温度、光照、营养盐、海表面风及海流在浒苔生消过程的不同阶段所起到的作用。
结果表明绿潮规模存在年际间差异, 但其季节规律较为类似, 每年于5月中旬前后暴发, 随后绿潮规模迅速扩大, 在暴发后的约一个月生物量达到峰值, 之后绿潮于7月份快速消亡, 至8月份基本消失。
生长阶段浒苔周围海域的温度及光照处于适宜浒苔生长范围内, 在模型中对浒苔的生长起不到显著作用, 而营养盐浓度年际间波动较大。海表面风场及表层流场的差异造成浒苔分布区域不同, 带来的营养盐浓度的差异是绿潮生长阶段年际差异的主导因素。
消亡阶段浒苔所在海域光照与生长阶段相比无明显差异, 因此光照对浒苔的消亡无显著作用; 温度相较于生长阶段有着很明显的升高, 同时在消亡阶段末期浒苔附近海域海表面平均温度均超过了26 ℃, 温度的升高使得浒苔的生长率降低、死亡率升高; 此时氮磷营养盐也处于较低水平, 限制了浒苔的生长。因此浒苔附近海域温度的大幅升高及营养盐浓度的下降共同影响了浒苔的消亡。
绿潮暴发受多种环境因素的控制, 而生态动力学模型在定量化描述黄海绿潮输运及生消过程方面有着很强的优势。虽然模型仍存在一些不足, 如使用的数据分辨率不够高, 浒苔的生长和死亡过程的参数化方法还存在不确定性, 但模型的建立和应用, 可以为黄海绿潮的灾害评估和应对措施的制定提供支撑。
丁月旻. 2014. 黄海浒苔绿潮中生源要素的迁移转化及对生态环境的影响[D]. 青岛: 中国科学院研究生院(海洋研究所).
|
马汶菲, 李景玉, 2022. 从藻类生理生态学角度解析绿潮爆发的内在机制. 应用生态学报, 33(5): 1420-1428 DOI:10.13287/j.1001-9332.202205.028 |
王广策, 王辉, 高山, 等, 2020. 绿潮生物学机制研究. 海洋与湖沼, 51(4): 789-808 |
白雨, 赵亮, 刘境舟, 2019. 生态因子在黄海绿潮生消过程中的作用. 海洋学报, 41(8): 97-105 DOI:10.3969/j.issn.0253-4193.2019.08.011 |
冯立娜, 张海波, 孙雨嫣, 等, 2020. 浒苔绿潮消亡腐败过程中的营养盐释放及其对近海环境的影响. 海洋学报, 42(8): 59-68 DOI:10.3969/j.issn.0253-4193.2020.08.007 |
刘湘庆. 2014. 黄海绿潮形成过程中漂浮绿藻及微观繁殖体时空分布研究[D]. 青岛: 国家海洋局第一海洋研究所.
|
衣立, 张苏平, 殷玉齐, 2010. 2009年黄海绿潮浒苔爆发与漂移的水文气象环境. 中国海洋大学学报(自然科学版), 40(10): 15-23 DOI:10.16441/j.cnki.hdxb.2010.10.003 |
李伯志. 2018. 中国近海营养盐季节和年际变化特征分析[D]. 天津: 天津科技大学.
|
李雪娜, 韩震, 刘贤博, 等, 2016. 浒苔和马尾藻的生消与海表面温度的相互影响研究. 海洋湖沼通报, (5): 125-130 DOI:10.13984/j.cnki.cn37-1141.2016.05.018 |
杨静, 张思, 刘桂梅, 2017. 基于卫星遥感监测的2011-2016年黄海绿潮变化特征分析. 海洋预报, 34(3): 56-61 |
吴洪喜, 徐爱光, 吴美宁, 2000. 浒苔实验生态的初步研究. 浙江海洋学院学报(自然科学版), 19(3): 230-234 DOI:10.3969/j.issn.1008-830X.2000.03.007 |
何恩业, 季轩梁, 高姗, 等, 2021. 黄海浒苔漂移输运和生长消亡过程的数值模拟与预测应用. 海洋与湖沼, 52(1): 39-50 |
辛蕾, 丁一, 王宁, 等, 2018. 基于遥感的黄海绿潮覆盖面积受表层温盐的影响分析. 广西科学院学报, 34(3): 210-215 DOI:10.13657/j.cnki.gxkxyxb.20180710.001 |
张海波, 王爽, 尹航, 等, 2020. 2018年南黄海浒苔绿潮发展规律及氮组分的作用探究. 海洋学报, 42(8): 40-49 DOI:10.3969/j.issn.0253-4193.2020.08.005 |
邵魁双, 巩宁, 李珂, 等, 2011. 缘管浒苔和羽藻氮、磷营养生理学研究. 海洋学报, 33(3): 131-139 |
罗辰奕, 聂红涛, 张海彦, 2019. 渤、黄海生态环境模拟的参数敏感度空间差异分析. 海洋学报, 41(8): 85-96 DOI:10.3969/j.issn.0253-4193.2019.08.010 |
庞秋婷, 李凤, 刘湘庆, 等, 2013. 围隔实验中浒苔在不同营养盐条件下的生长比较. 环境科学, 34(9): 3398-3404 DOI:10.13227/j.hjkx.2013.09.020 |
孟晓智, 苏贵森, 卓品利, 等, 2018. 温度和光照强度对浒苔生长和光合生理特性的影响. 生物学杂志, 35(4): 49-52, 57 DOI:10.3969/j.issn.2095-1736.2018.04.049 |
钱思萌. 2018. 渤海中部低氧现象的数值模拟研究[D]. 天津: 天津大学.
|
郭伟. 2017. 黄海绿潮年际变化特征及灾害分析[D]. 天津: 天津科技大学.
|
唐启升, 张晓雯, 叶乃好, 等, 2010. 绿潮研究现状与问题. 中国科学基金, 24(1): 5-9 DOI:10.16262/j.cnki.1000-8217.2010.01.006 |
崔琳琳, 胡松, 杨红, 等, 2014. 绿潮早期聚集期间天气过程分析. 海洋环境科学, 33(6): 941-946 DOI:10.13634/j.cnki.mes.2014.06.021 |
潘俊, 于非, 魏传杰, 等, 2018. 南黄海绿潮暴发与硝酸盐及水文环境因子的关系. 海洋与湖沼, 49(5): 1031-1037 |
AUROUSSEAU P, 2001. Le flux d'azote et de phosphore provenant des bassins versants de la rade de Brest. Oceanis, 27(1): 137-161 |
CUGIER P, MÉNESGUEN A, GUILLAUD J F, 2005. Three-dimensional (3D) ecological modelling of the Bay of Seine (English Channel, France). Journal of Sea Research, 54(1): 104-124 DOI:10.1016/j.seares.2005.02.009 |
EPPLEY R W, 1972. Temperature and phytoplankton growth in the sea. Fishery Bulletin, 70(4): 1063-1085 |
HERSBACH H, BELL B, BERRISFORD P, et al. 2018. ERA5 hourly data on pressure levels from 1979 to present[M]. ECMWF ERA Report Series 27.
|
MERCERON M, ANTOINE V, AUBY I, et al, 2007. In situ growth potential of the subtidal part of green tide forming Ulva spp. stocks. Science of the Total Environment, 384(1/2/3): 293-305 |
MOISAN J R, MOISAN T A, ABBOTT M R, 2002. Modelling the effect of temperature on the maximum growth rates of phytoplankton populations. Ecological Modelling, 153(3): 197-215 DOI:10.1016/S0304-3800(02)00008-X |
NELSON T A, NELSON A V, TJOELKER M, 2003. Seasonal and spatial patterns of "Green Tides" (Ulvoid Algal Blooms) and related water quality parameters in the coastal waters of Washington State, USA. Botanica Marina, 46(3): 263-275 |
RUIZ J M, 1999. Bivalves, tributyltin and green tides: Ecosystem-level impact?. Marine Ecology, 20(1): 1-9 DOI:10.1046/j.1439-0485.1999.00061.x |
STEELE J H, 1962. Environmental control of photosynthesis in the sea. Limnology and Oceanography, 7(2): 137-150 DOI:10.4319/lo.1962.7.2.0137 |
TAYLOR R, FLETCHER R L, RAVEN J A, 2001. Preliminary studies on the growth of selected 'Green Tide' algae in laboratory culture: Effects of irradiance, temperature, salinity and nutrients on growth rate. Botanica Marina, 44(4): 327-336 |
 2022, Vol. 53
2022, Vol. 53


