中国海洋湖沼学会主办。
文章信息
- 雷宁, 郝贵杰, 黄爱霞, 王雨辰, 林锋, 沈小明, 朱俊杰. 2022.
- LEI Ning, HAO Gui-Jie, HUANG Ai-Xia, WANG Yu-Chen, LIN Feng, SHEN Xiao-Ming, ZHU Jun-Jie. 2022.
- 大口黑鲈(Micropterus salmoides)致病性维氏气单胞菌的分离鉴定及其特性分析
- ISOLATION AND IDENTIFICATION OF PATHOGENIC AEROMONAS VERONII IN MICROPTERUS SALMOIDES
- 海洋与湖沼, 53(5): 1180-1188
- Oceanologia et Limnologia Sinica, 53(5): 1180-1188.
- http://dx.doi.org/10.11693/hyhz20220200045
文章历史
-
收稿日期:2022-02-28
收修改稿日期:2022-04-07
2. 农业农村部淡水渔业健康养殖重点实验室 浙江省鱼类健康与营养重点实验室 浙江省淡水水产研究所 浙江湖州 313001;
3. 德清昊源水产种业有限公司 浙江湖州 313200
2. Key Laboratory of Healthy Freshwater Aquaculture, Ministry of Agriculture and Rural Affairs, Key Laboratory of Fish Health and Nutrition of Zhejiang Province, Institute of Freshwater Fisheries, Huzhou 313001, China;
3. Deqing Haoyuan Aquatic Seed Industry Co., Ltd., Huzhou 313200, China
大口黑鲈(Micropterus salmoides)俗称加州鲈, 隶属于鲈形目(Perciformes)、鲈亚目(Porcoidei)、太阳鱼科(Cehtrachidae)、黑鲈属(Micropterus), 是广温性淡水鱼类, 肉质鲜嫩、营养丰富、养殖周期短、生长速度快, 是国内重要经济性淡水养殖品种之一。据统计, 中国大口黑鲈产量占据全球总产量99.8% (Hussein et al, 2020), 至2019年, 资料显示我国大口黑鲈年产量近50×104 t。全国已有20多个省市养殖生产淡水鲈, 养殖面积超过1.33×104 hm2 (张红燕等, 2019)。国内大口黑鲈最大产区是华南的广东地区, 约占全国60%, 华东的浙江、江苏地区产量约占全国30% (陈莉莉, 2018)。随着养殖规模的不断扩大, 区域生产不平衡、价格波动大、种质资源退化及病害等因素, 严重影响了大口黑鲈养殖业的健康发展(Hussein et al, 2020)。细菌、病毒和寄生虫等是诱发大口黑鲈病害的重要原因, 其中细菌性疾病以柱状黄杆菌病、气单胞菌病、诺卡氏菌病为主, 病毒性疾病以病毒性溃疡病、脾肾坏死病和弹状病毒病为主, 寄生虫病以车轮虫、斜管虫、指环虫、累枝虫、锚头鳋等病原为主(国家特色淡水鱼产业技术体系, 2021)。而细菌性疾病是鱼类病害中占比极高, 具有传染性较强、覆盖区域广、流行时间长的特点, 由于新毒株增加快, 导致控制难度大, 其造成的经济损失约占据全部疾病所造成总体经济损失的半数以上(王玉堂等, 2013)。在淡水鱼类细菌性疾病中, 属细菌性败血病造成的损失最为严重, 其病原体涵括了温和气单胞菌、嗜水气单胞菌以及维氏气单胞菌(蔺凌云等, 2018)。
维氏气单胞菌(Aeromonas veronii)隶属弧菌科、气单胞菌属, 属于革兰氏阴性菌, 可感染无脊椎动物、水生脊椎动物以及包括人类在内的哺乳动物(Lazado et al, 2018)。维氏气单胞菌对大口黑鲈、草鱼(Ctenopharyngodon idellus) (高彩霞等, 2018)、框镜鲤(Cyprinus carpio) (胡天野等, 2012)、黄颡鱼(Pelteobagrus fulvidraco) (朱成科等, 2017)、怀头鲶(Silurus soldatovi) (陆梦莹等, 2017)、蓝曼龙鱼(Trichogaster trichopterus) (陈亨利等, 2016)、齐口裂腹鱼(Sclizothorax prenanti) (刘港彪等, 2012)、泥鳅(Misgurnus anguillicaudatus) (徐先栋等, 2018)、胭脂鱼(Myxocyprinus asiaticus) (黄文明等, 2013)、鳙鱼(Aristichthys nobilis) (朱若林等, 2017)、中华鲟(Acipenser sinensis) (田甜等, 2017)、鲫鱼(Carassius auratus) (王利等, 2013)和罗非鱼(Tilapia) (黎炯等, 2011)等鱼类都具有一定致病性。维氏气单胞菌广泛存在于自然界中, 且有着较强的适应性, 是引起淡水鱼败血症和溃疡综合征的重要病原菌(Li et al, 2020)。水产品作为蛋白质等营养物质的重要来源之一。水产品若被维氏气单胞菌污染, 人们食用后可能会诱发败血症及胃肠炎等疾病, 免疫力低下者甚至会发生死亡(邓龙君, 2021)。因此, 本研究对发病大口黑鲈病原菌进行分离鉴定, 通过形态学观察、生理生化特性分析、16S rDNA序列鉴定、药敏试验及毒力基因检测对分离菌株的生物学特性进行分析, 以期为大口黑鲈维氏气单胞菌病的诊断和有效防治提供参考。
1 材料与方法 1.1 试验材料患病大口黑鲈[(10±1.5) cm]采自浙江省湖州市某养殖场。健康大口黑鲈[(7.00±0.65) g, (7.9±0.42) cm]购自湖州湖旺水产种业有限公司, 在50 L养殖桶内暂养7 d后用于感染试验。
胰蛋白胨大豆肉汤(TSB)和胰蛋白胨大豆琼脂(TSA)培养基均购于青岛海博生物科技有限公司, 细菌生化微量鉴定管和药敏试纸购自杭州滨和微生物试剂有限公司, 革兰氏染色试剂盒购自索莱宝公司, 细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司, OneTaq Quick-Load® 2×预混液购自NEB公司, 所用引物均由上海生工生物工程有限公司合成。
1.2 细菌分离患病大口黑鲈体表经消毒后, 无菌环境下解剖检查鱼体, 用接种针从内脏组织各部位取样, 分别在TSA培养基上划线培养, 28 ℃恒温培养12 h; 观察菌落形态, 根据菌落特征的不同, 挑取优势菌株在TSB培养基中培养, 分离纯化得到的菌株命名为LB2101。
1.3 细菌形态学观察根据革兰氏染色试剂盒操作说明对该分离菌进行染色。先挑取单菌落涂片固定, 滴加草酸铵结晶紫染色液初染1 min, 水洗; 滴加碘液媒染1 min, 水洗; 用95%酒精脱色约45 s, 水洗, 吸干水分; 最后滴加蕃红复染1 min, 水洗, 自然晾干; 在100倍油镜下观察细菌形态以及染色特征, 并拍照保存。
将分离菌株接种于TSB培养基中, 振荡培养过夜, 低速离心收集菌体, PBS洗涤后灭菌水重悬备用。将处理后的菌液与适量2%锇酸小心混匀, 后把铜网覆盖于混合溶液上, 静置5 min左右; 滴加适量负染液磷钨酸溶液于封口膜上, 处理好的铜网转移至负染液磷钨酸上静置2 min左右, 吸去铜网上多余染液, 自然晾干, 透射电子显微镜下观察并拍照保存。
1.4 生理生化特性分析参照《常见细菌系统鉴定手册》(东秀珠等, 2001)中细菌鉴定方法, 并采用细菌微量生化鉴定管对待测菌株各项生化指标进行测定, 每项检测指标均重复3次并设置对照。将分离菌株LB2101接种TSA培养基, 28 ℃培养至长出单菌落。挑取新鲜单菌落分别接种于22种细菌微量生化鉴定管中, 28 ℃培养24 h或48 h, 后根据测定结果分析该菌株的生理生化特性。
1.5 分子生物学鉴定根据细菌基因组DNA提取试剂盒方法提取该分离菌株的DNA。采用细菌通用引物进行16S rRNA基因序列的扩增, 正向引物为27F: 5′-AGAGTTTGATCCTGGCTCAG-3′, 反向引物为1492R: 5′-TACGGTTACCTTGTTACGAC-3′, 扩增片段大小约1 470 bp。扩增反应体系(50 μL): DNA模板2 μL, 正向和反向引物各1 μL, OneTaq Quick-Load® 2×预混液25 μL, RNase-Free Water补至50 μL。PCR扩增条件: 95 ℃预变性4 min; 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1 min, 35个循环后72 ℃延伸10 min。PCR产物进行1% 凝胶电泳检测。将扩增产物送至生工生物工程(上海)有限公司进行测序, 根据核苷酸测序结果, 利用NCBI中Blast检索系统进行同源序列比对, 利用MEGA 6.0软件构建基于细菌16S rRNA基因的系统进化树, 采用邻接法(Neighbor joining method)建树方法进行菌株LB2101的系统发育树分析。
1.6 药敏试验利用K-B纸片琼脂扩散法进行药敏实验, 28 ℃培养24 h后测定抑菌圈直径, 测定3次取平均值, 根据杭州滨和微生物试剂有限公司提供的标准进行细菌敏感性判定。检测的抗生素包含头孢曲松、氯霉素、氟苯尼考、新霉素、恩诺沙星、强力霉素、阿米卡星、复方新诺明、四环素、诺氟沙星、乙酰螺旋霉素、羧苄西林、青霉素、头孢噻吩、多粘菌素、痢特灵、庆大霉素、链霉素、利福平、阿齐霉素、环丙沙星、左氟沙星等22种。
1.7 毒力基因检测根据已发表文献合成气溶素基因aer、细胞毒性肠毒素基因act、脂肪酶基因lip、胆固醇酰基转移酶基因gcat、脱氧核糖核酸酶基因exu、鞭毛蛋白结构基因fla及外膜蛋白OMPA I等毒力相关基因的特异性引物(见表 1), 以病原菌DNA为模板进行PCR检测。扩增反应体系(25 μL): DNA模板1 μL, 正向和反向引物各0.5 μL, OneTaq Quick-Load® 2×预混液12.5 μL, RNase-Free Water补至25 μL。PCR扩增条件: 95 ℃预变性5 min; 95 ℃变性30 s, 退火温度30 s, 72 ℃延伸1 min, 35个循环后72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳进行分析。
| 基因 | 引物序列(5′~3′) | 产物大小/bp | 退火温度Tm/℃ | 参考文献 |
| aer-F | CCTATGGCCTGAGCGAGAAG | 431 | 63 | (Nawaz et al, 2010) |
| aer-R | CCAGTTCCAGTCCCACCACT | |||
| gcaT-F | CTCCTGGAATCCCAAGTATCAG | 237 | 65 | (Nawaz et al, 2010) |
| gcaT-R | GGCAGGTTGAACAGCAGTATCT | |||
| act-F | AGAAGGTGACCACCACCAAGAACA | 232 | 65 | (Nawaz et al, 2010) |
| act-R | AACTGACATCGGCCTTGAACTC | |||
| lip-F | ATCTTCTCCGACTGGTTCGG | 382 | 63 | (Nawaz et al, 2010) |
| lip-R | CCGTGCCAGGACTGGGTCTT | |||
| fla-F | GCGGAATTCATGGGCCTTTATATCA | 915 | 58 | (王惠, 2014) |
| fla-R | ACGAAGCTTTTAGCCTTGCAACAGT | |||
| OMPA I-F | GACGATATCATGATGAAAATGGCTCT | 1 026 | 58 | (张海月等, 2016) |
| OMPA I-R | GCGAAGCTTTTACTTCTGAACTTCTTG | |||
| exu-F | GGACATGCACAACCTCTTCC | 323 | 55 | (边宇等, 2013) |
| exu-R | GATTGGTATTGCCTTGCAAG |
将分离菌株接种于TSB培养基中, 28 ℃振荡培养12h, 低速离心收集菌体, 用生理盐水将菌液浓度分别调节至1.4×105、1.4×106、1.4×107、1.4×108和1.4×109 CFU/mL。健康大口黑鲈随机分为6组, 每组30尾, 试验组分别腹腔注射不同浓度菌液, 注射剂量为100 μL/尾, 对照组注射等量生理盐水。试验期间水温控制在28~30 ℃。感染后每隔24 h观察大口黑鲈的临床表现并统计死亡情况, 连续监测7d。从发病症状明显的大口黑鲈肝脏等组织中分离病原菌, 进行分离培养及鉴定, 以确定是否是该分离菌株导致大口黑鲈死亡。
2 结果与分析 2.1 细菌形态学观察根据观察结果, LB2101菌落具有菌落呈圆形、表面光滑不透明、微隆起、呈现淡黄色。根据细菌革兰氏染色结果(图 1a), 显示该菌染色后呈红色, 呈杆状, 初步判定为革兰氏阴性菌。经透射电镜观察发现该菌体无侧鞭毛, 极端着生单鞭毛(图 1b)。
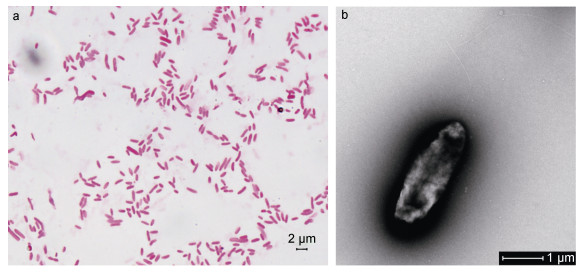 |
| 图 1 分离菌株的革兰氏染色(a)形态及电镜照片(b) Fig. 1 The Gram-staining micrograph (a) and transmission electron micrograph (b) of the isolated strain |
分离菌株LB2101对精氨酸脱羧酶、葡萄糖产气、葡萄糖、蛋白胨水、苯丙氨酸、明胶、甘露醇和蔗糖等呈阳性; 而对赖氨酸脱羧酶、鸟氨酸脱羧酶、氨基酸对照、葡磷胨水、葡萄糖酸盐、侧金盏花醇、山梨醇、棉子糖、木糖、水杨素、尿素、枸橼酸盐、硫化氢和半固体琼脂等呈阴性反应(见表 2)。结合细菌生化鉴定结果并根据文献(东秀珠等, 2001)的鉴定方法, 发现分离菌株LB2101与维氏气单胞菌的生理生化特性基本一致。
| 试验项目 | 结果 | 试验项目 | 结果 | |
| 鸟氨酸脱羧酶 | – | 侧金盏花醇 | – | |
| 赖氨酸脱羧酶 | – | 甘露醇 | + | |
| 精氨酸脱羧酶 | + | 山梨醇 | – | |
| 氨基酸对照 | – | 棉子糖 | – | |
| 葡萄糖 | + | 蔗糖 | + | |
| 葡萄糖产气 | + | 木糖 | – | |
| 葡磷胨水 | – | 水杨素 | – | |
| 葡萄糖酸盐 | – | 尿素 | – | |
| 蛋白胨水 | + | 硫化氢 | – | |
| 苯丙氨酸 | + | 枸橼酸盐 | – | |
| 明胶 | + | 半固体琼脂 | – | |
| 注: +表示阳性, –表示阴性 | ||||
利用引物27F和1492R进行PCR扩增, 其1%琼脂糖凝胶电泳结果(如图 2)所示, 产物大小约1 470 bp。将该分离菌的核酸序列在NCBI库上进行比对, 比对结果表明该菌株与维氏气单胞菌HC050630A-1 (EF669480.1)同源性较高, 两者同源性达99.24%; 该菌株16S rRNA序列构建系统发育树的结果(见图 3), 显示LB2101与维氏气单胞菌HC050630A-1聚为一个分支。综合菌株LB2101的表型、生理生化特征及16S rRNA测序及系统发育树分析结果, 可以判定菌株LB2101属于维氏气单胞菌(Aeromonas veronii)。
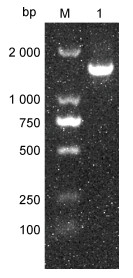 |
| 图 2 菌株LB2101 16S rRNA PCR电泳结果 Fig. 2 PCR amplification of the 16S rRNA gene of LB2101 注: M: DL2000 DNA Marker; 1: LB2101 |
 |
| 图 3 菌株LB2101 16S rRNA基因序列系统发育树 Fig. 3 The phylogenetic tree based on the 16S rRNA gene sequences |
利用纸片扩散法进行药敏实验。结果显示, 该分离菌株LB2101对头孢曲松、氯霉素、氟苯尼考、强力霉素、四环素、多粘菌素、复方新诺明、左氟沙星等8种抗生素高度敏感, 对新霉素、恩诺沙星、庆大霉素、链霉素、阿齐霉素、环丙沙星等6种抗生素中度敏感; 对阿米卡星、诺氟沙星、乙酰螺旋霉素、羧苄西林、青霉素、头孢噻吩、痢特灵、利福平等8种抗生素具有耐药性。
| 抗菌药物 | 抑菌圈大小平均值/mm(药物敏感性) | 抗菌药物 | 抑菌圈大小平均值/mm(药物敏感性) |
| 头孢曲松 | 33(S) | 羧苄西林 | 0(R) |
| 氯霉素 | 25(S) | 青霉素 | 0(R) |
| 氟苯尼考 | 26(S) | 头孢噻吩 | 0(R) |
| 新霉素 | 14(I) | 左氟沙星 | 25(S) |
| 恩诺沙星 | 18(I) | 多粘菌素 | 13(S) |
| 强力霉素 | 20(S) | 痢特灵 | 14(R) |
| 阿米卡星 | 12(R) | 庆大霉素 | 11(I) |
| 复方新诺明 | 17(S) | 链霉素 | 12(I) |
| 四环素 | 22(S) | 利福平 | 16(R) |
| 诺氟沙星 | 11(R) | 阿齐霉素 | 16(I) |
| 乙酰螺旋霉素 | 8(R) | 环丙沙星 | 20(I) |
| 注: S表示高度敏感, I表示中度敏感, R表示耐药 | |||
根据琼脂糖凝胶电泳检测结果(图 4), 检测表明菌株LB2101含有气溶素基因aer、细胞毒性肠毒素基因act、脂肪酶基因lip、胆固醇酰基转移酶基因gcat、鞭毛蛋白结构基因fla和外膜蛋白OMPA I基因, 但不具有脱氧核糖核酸酶基因exu。
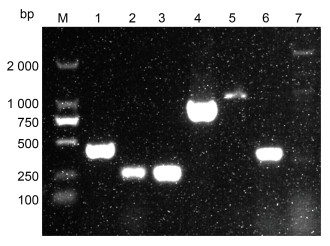 |
| 图 4 分离菌株毒力基因检测 Fig. 4 Virulence genes of the isolated strain detected by PCR 注: M: DL2000 DNA Marker; 1: aer; 2: gcaT; 3: act; 4: fla; 5: OMPA I; 6: lip; 7: exu |
根据人工回归感染试验结果, 试验期间对照组大口黑鲈未见异常, 试验组出现不同程度死亡情况(详见表 4)。大口黑鲈在感染后第2天开始出现死亡, 1.4×108 CFU/mL浓度组48h内死亡率达到100%; 1.4×106 CFU/mL浓度组第3天开始出现死亡, 死亡率为50%; 而低浓度组1.4×104 CFU/mL在第5天出现发病症状, 但该浓度组却并未发生大量死亡。感染后发病的大口黑鲈出现游泳不正常、鳞片脱落、肛门红肿、腹部膨大等临床表现(图 5), 解剖发现腹腔有积液、肝脏肿大出血, 与自然发病大口黑鲈的症状相似, 且从发病鱼体中可再次分离到该菌, 这充分表明LB2101分离株对大口黑鲈具有较强的致病性。
| 分组 | 浓度/(CFU/mL) | 试验鱼数量/尾 | 累计死亡量/尾 | 累计死亡率/% |
| A | 1.4×108 | 30 | 30 | 100 |
| B | 1.4×107 | 30 | 25 | 83.3 |
| C | 1.4×106 | 30 | 15 | 50 |
| D | 1.4×105 | 30 | 6 | 20 |
| E | 1.4×104 | 30 | 1 | 3.3 |
| 对照组 | PBS | 30 | 0 | 0 |
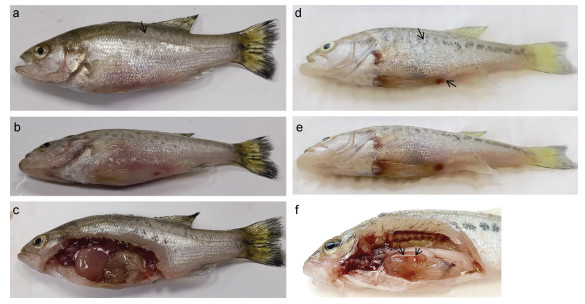 |
| 图 5 患病大口黑鲈的症状 Fig. 5 Pathological syndromes of M. salmoides 注: a、b和c为自然患病, d、e和f为人工感染。a: 鳞片脱落; b: 腹部膨大, 肛门红肿; c: 腹腔积液; d、e: 鳞片脱落, 肛门红肿; f: 肝脏有出血点 |
细菌性病原菌的鉴定方法有多种, 包括了血清分型、形态学观察、生理生化鉴定、遗传学分析等方法(宋路萍等, 2020)。其中, 16S rRNA基因检测被许多学者认为是细菌鉴定的有效方法(Kita-Tsukamoto et al, 1993)。16S rDNA序列同时包含了高度保守序列和高度可变序列, 可用于研究各类生物间的遗传进化关系(宋路萍等, 2020)。孟令缘等(2021)利用16S rDNA序列测定方法对18株金黄色葡萄球菌进行鉴定, 结果表明可将其中15株菌鉴定到种水平。16S rDNA序列分析法可将菌株鉴定到种水平, 表明其鉴定结果准确可靠。本研究结合利用形态观察、生理生化测定及16S rRNA分子鉴定法, 对从大口黑鲈肝脏中分离出的菌株LB2101进行鉴定。本研究通过革兰氏染色发现该分离菌LB2101是革兰氏阴性菌, 呈杆状, 具极端单鞭毛; 生理生化结果可初步判定LB2101为维氏气单胞菌; 利用16S rRNA分子鉴定法进一步证实菌株LB2101是维氏气单胞菌(Aeromonas veronii)。
3.2 维氏气单胞菌的毒力与致病性分析维氏气单胞菌可以感染大口黑鲈(杨超等, 2021)、草鱼(高彩霞等, 2018)、鳙鱼(朱若林等, 2017)、蓝曼龙鱼(陈亨利等, 2016)、鲫鱼(王利等, 2013)、罗非鱼(黎炯等, 2011)和胭脂鱼(黄文明等, 2013)等多种水生鱼类, 感染后临床症状存在一定差异, 但大致都出现鳞片脱落、肛门红肿及腹部有积液等临床表现。该菌属的致病性由多重因素决定, 涉及水生态环境以及毒力因子的分泌表达等。已知维氏气单胞菌具有多种毒力因子, 如气溶素、肠毒素、外膜蛋白、鞭毛、溶血素、细胞外蛋白酶、脂多糖和S层等(宋明芳等, 2018)。气溶素通过与糖基磷脂酰肌醇(GPI)锚定蛋白相结合, 与宿主细胞发生相互作用在质膜上形成一个通道, 从而引发小离子的渗透、激活G蛋白和某些细胞类型的凋亡(Abrami et al, 2003)。而细胞毒性肠毒素, 作为维氏气单胞菌重要毒力因子之一, 它具有使肠道绒毛和小肠隐窝退化的作用, 可刺激肠道促进其分泌作用从而导致小肠上皮细胞广泛性损失(熊广泽等, 2021)。外膜蛋白则是革兰氏阴性菌的重要结构特征, 它能够促进细菌黏附作用和增强致病性(宋明芳等, 2018)。有研究表明lamB基因缺失可导致维氏气单胞菌的毒力和粘附力显著降低, 而lamB基因编码蛋白属于外膜蛋白(Yang et al, 2019), 这间接说明外膜蛋白与维氏气单胞菌的毒力或致病性密切相关。此外, 鞭毛在气单胞菌侵染鱼类细胞系的过程中也起着关键作用, 它的存在可作为菌株具有致病性的特征之一, 可增强病原细菌与真核细胞表面间的相互作用(Merino et al, 1997; Gavín et al, 2003)。
其中, 气溶素(aer)是维氏气单胞菌感染鱼类过程中最重要、最丰富的毒力因子之一(Foysal et al, 2019)。Li等(2020)从多种鱼类体中分离出87株维氏气单胞菌, 毒力基因检测结果表明气溶素(aer)检出率为88.51%。气溶素的存在可作为判定菌株是否具有毒力的标志(赵武义, 2018)。本研究检测了维氏气单胞菌7种毒力相关基因, 结果表明该分离菌株LB2101同时含有气溶素(aer)、细胞毒性肠毒素(act)、脂肪酶(lip)、胆固醇酰基转移酶(gcat)、鞭毛(fla)和外膜蛋白(OMPs)等多种致病性毒力因子, 但不具有脱氧核糖核酸酶(exu)毒力基因。综合人工回归感染试验结果, 病鱼出现鳞片脱落、肛门红肿及腹腔积液等明显症状, 充分表明本分离菌株具有显著的致病性。
3.3 维氏气单胞菌的药敏性分析不同养殖环境中分离出的维氏气单胞菌, 其对抗生素的耐药性会存在一定差异。如邓龙君和杨超等分别从四川和佛山某养殖场分离得到维氏气单胞菌, 药敏试验结果表明两菌株对氟苯尼考和大观霉素都敏感, 均对复方新诺明和阿莫西林产生耐药性, 但在四环素、卡那霉素和多西环素上存在不同耐药性(邓龙君, 2021; 杨超等, 2021)。而本研究发现该分离菌株LB2101对氟苯尼考、四环素、复方新诺明、新霉素、多粘菌素B和强力霉素等敏感, 对青霉素、乙酰螺旋霉素、羧苄西林和利福平等具有耐药性, 这与邓龙君(2021)和杨超等(2021)的试验结果都有差异, 说明了不同菌株间存在药物敏感性差异。造成菌株间耐药性差异的原因, 这可能是与养殖地区和抗生素种类等因素相关, 不同养殖地区其抗菌药物的使用类型、用药剂量和用药方式往往不同, 可能会形成不同的药物环境或养殖环境。有研究证明, 病原细菌耐药性与苗种来源、养殖水平和模式、菌株来源、分离年份及各地用药习惯有关(胡大胜, 2010; 丁正峰等, 2011; 邓玉婷等, 2019)。
3.4 大口黑鲈维氏气单胞菌病的防治技术鉴于维氏气单胞菌其致病机理尚未清楚, 在养殖生产中主要以预防为主, 这其中防治的有效防治手段包括疫苗和免疫增强剂。水产上针对维氏气单胞菌的疫苗已有研究, 如灭活疫苗(任燕等, 2019)、减毒疫苗(徐一轲等, 2019)、菌影疫苗(徐展等, 2014)、菌蜕疫苗(闫兵兵等, 2017)等。研究表明五味子、鸡血藤、苦谏树皮、丹参、乌梅、苏木、五倍子、丁香、艾叶、石榴皮和地榆等中草药, 对于维氏气单胞菌有较好的抑制作用, 可用于预防维氏气单胞菌感染(马秀慧等, 2018; 朱成科等, 2018; 王宝屯等, 2021)。此外, 还可以通过调节鱼体自身免疫力进行防控, 现已发现在饲料中添加益生菌(如干酪乳杆菌、屎肠球菌)和免疫调节剂(如百泰A、酵母细胞壁、牛磺酸)等可显著增强鱼体自身的非特异性免疫力, 有效提高抗维氏气单胞菌感染的能力(郁欢欢等, 2014; 张海朋等, 2017; 鞠安琪等, 2018)。除此之外, 部分抗生素对维氏气单胞菌也有着较强的抑菌效果。但抗生素滥用会导致水产养殖对象产生耐药性, 而且抗生素残留会引发水产品质量安全问题, 间接性危害人类健康, 目前很多抗生素已经列入禁用或限用范畴。因此, 在实际生产中对于维氏气单胞菌的防治, 需要根据国家渔业用药标准合理用药, 以选用适宜的中草药、益生菌等为宜, 实现绿色养殖, 做到减量用药。
4 结论本实验从患病大口黑鲈肝脏组织中分离到1株病原菌, 通过形态学观察、生理生化特性分析、16S rRNA序列和特定毒力基因分析对其进行鉴定, 并通过人工回归感染试验和药敏试验分析其致病性和耐药性, 结果表明分离获得的维氏气单胞菌是一种导致鲈鱼发病的条件性致病菌。研究结果揭示了维氏气单胞菌菌株的部分生物学特性, 有利于丰富该菌属的基础数据, 为鲈鱼养殖过程中的病害防控提供了有效的参考依据。
丁正峰, 薛晖, 王晓丰, 等, 2011. 江苏主要水产病原菌耐药谱系监测. 江苏农业科学, 39(2): 344-347 DOI:10.3969/j.issn.1002-1302.2011.02.122 |
马秀慧, 姜海波, 罗学评, 等, 2018. 中草药对罗非鱼源维氏气单胞菌体外抑菌效果研究. 黑龙江畜牧兽医, (16): 174-176, 179 |
王玉堂, 陈昌福, 吕永辉, 2013. 水产养殖动物致病菌耐药性检测数据实际作用. 中国水产, (10): 57-61 DOI:10.3969/j.issn.1002-6681.2013.10.029 |
王利, 魏勇, 2013. 鲫鱼维氏气单胞菌的分离鉴定及耐药表型检测. 黑龙江畜牧兽医, (3): 101-103 |
王宝屯, 颜远义, 毛灿, 等, 2021. 82种中草药及其复方对花鲈源维氏气单胞菌的体外抑菌效果. 华南师范大学学报(自然科学版), 53(3): 64-72 |
王惠, 2014. 不同动物源性维氏气单胞菌的生物特性及四种毒力基因比较研究[D]. 长春: 吉林农业大学: 19-23.
|
邓玉婷, 谭爱萍, 张瑞泉, 等, 2019. 广东主要水产养殖地区气单胞菌耐药状况的调查分析. 南方农业学报, 50(11): 2375-2383 DOI:10.3969/j.issn.2095-1191.2019.11.01 |
邓龙君, 2021. 大口黑鲈维氏气单胞菌的分离鉴定及其感染的病理损伤. 河南农业科学, 50(1): 164-171 |
东秀珠, 蔡妙英, 2001. 常见细菌系统鉴定手册. 北京: 科学出版社, 106-120
|
田甜, 张建明, 杜合军, 2017. 中华鲟源维氏气单胞菌的分离鉴定及其药敏特性. 安徽农业大学学报, 44(6): 1011-1017 |
边宇, 钱宏伟, 孟庆峰, 等, 2013. 维氏气单胞菌RCR快速检测方法的建立及初步应用. 中国兽药杂志, 47(1): 1-3 |
朱成科, 王建, 周燕, 等, 2018. 150种中草药体外抑杀维氏气单胞菌的药效研究. 淡水渔业, 48(1): 80-85, 96 DOI:10.3969/j.issn.1000-6907.2018.01.013 |
朱成科, 刘桂嘉, 张争世, 等, 2017. 黄颡鱼源维氏气单胞菌Aha和gyrB基因双重PCR检测方法的建立. 中国预防兽医学报, 39(10): 810-814 |
朱若林, 马腾, 陈露, 等, 2017. 鳙鱼维氏气单胞菌的分离鉴定及其毒力基因检测. 安徽农业大学学报, 44(2): 229-233 |
任燕, 时云朵, 曾伟伟, 等, 2019. 维氏气单胞菌灭活疫苗对草鱼免疫相关基因表达的影响及其保护效果. 中国生物制品学杂志, 32(7): 726-731 |
刘港彪, 王利, 王吉坤, 等, 2012. 齐口裂腹鱼维氏气单胞菌16S rDNA序列分析. 水生态学杂志, 33(1): 92-96 |
闫兵兵, 姜娜, 罗琳, 等, 2017. 维氏气单胞菌菌蜕疫苗免疫后鲤免疫应答与hepcidin基因表达特征. 微生物学通报, 44(6): 1395-1404 |
杨超, 董浚键, 刘志刚, 等, 2021. 大口黑鲈源维氏气单胞菌的分离鉴定. 南方水产科学, 17(3): 54-61 |
宋明芳, 张冬星, 张海鹏, 等, 2018. 维氏气单胞菌毒力因子的研究进展. 中国兽医科学, 48(8): 1038-1042 |
宋路萍, 杨振苹, 王斌, 等, 2020. 基于16S rDNA快速鉴定细菌的PCR测序方法的建立及其进化关系分析. 中国医药科学, 10(17): 86-91 DOI:10.3969/j.issn.2095-0616.2020.17.022 |
张红燕, 袁永明, 贺艳辉, 等, 2019. 中国淡水鲈养殖生产现状分析. 湖南农业科学, (4): 112-114 |
张海月, 康元环, 陈龙, 等, 2016. 不同动物源性维氏气单胞菌OMPAⅠ基因的克隆及比较研究. 中国兽医科学, 46(5): 607-610 |
张海朋, 谷巍, 鞠安琪, 等, 2017. 饲料中添加干酪乳杆菌对鲤鱼非特异性免疫力和抗病力的影响. 中国兽医杂志, 53(7): 85-88 |
陆梦莹, 胡秀彩, 吕爱军, 等, 2017. 鲶源维氏气单胞菌的分离鉴定及药敏特性. 大连海洋大学学报, 32(5): 563-567 |
陈亨利, 莫金龙, 康元环, 等, 2016. 蓝曼龙鱼致病性维氏气单胞菌的分离鉴定与系统进化分析. 中国兽医杂志, 52(6): 115-118 |
陈莉莉, 2018. 加州鲈饲料市场最全调查, 一文看懂如今产业现状、痛点和契机. 当代水产, 43(2): 80-81, 83 DOI:10.3969/j.issn.1674-9049.2018.02.027 |
郁欢欢, 薛敏, 韩芳, 等, 2014. 几种免疫调节剂对花鲈生长性能、免疫力以及细菌感染后存活率影响的比较研究. 动物营养学报, 26(8): 2386-2396 DOI:10.3969/j.issn.1006-267x.2014.08.046 |
国家特色淡水鱼产业技术体系, 2021. 中国淡水鲈产业发展报告. 中国水产, (3): 40-48 DOI:10.3969/j.issn.2095-1833.2021.03.006 |
孟令缘, 牛沁雅, 廉鲁昕, 等, 2021. 基于16S rDNA序列、MALDI-TOF-MS和VITEK的沙门氏菌和金黄色葡萄球菌的鉴定. 中国食品学报, 21(10): 197-205 |
赵武义, 2018. 加州鲈源维氏气单胞菌的鉴定与分析[D]. 成都: 四川农业大学: 4-5.
|
胡大胜, 2010. 广西水产养殖主要细菌病的监测与耐药性调查. 中国科技成果, (13): 49-51 DOI:10.3772/j.issn.1009-5659.2010.13.018 |
胡天野, 吴同垒, 孟庆峰, 等, 2012. 框镜鲤维氏气单胞菌的生物学特性. 中国兽医杂志, 48(8): 18-21 DOI:10.3969/j.issn.0529-6005.2012.08.006 |
徐一轲, 孙愉宸, 盛强龙, 等, 2019. 维氏气单胞菌的smpB、tmRNA及hfq敲除菌株减毒活疫苗筛选. 山东农业大学学报(自然科学版), 50(2): 186-190 DOI:10.3969/j.issn.1000-2324.2019.02.002 |
徐先栋, 李燕华, 王海华, 等, 2018. 台湾泥鳅幼鱼红点病病原的分离鉴定及药敏分析. 水产科学, 37(4): 522-526 |
徐展, 孟庆峰, 王伟利, 等, 2014. 维氏气单胞菌菌影疫苗的构建及其溶菌动力学研究. 中国预防兽医学报, 36(12): 982-984 DOI:10.3969/j.issn.1008-0589.2014.12.16 |
高彩霞, 任燕, 王庆, 等, 2018. 草鱼源致病性维氏气单胞菌的分离鉴定及药物敏感性分析. 安徽农业大学学报, 45(3): 409-415 |
黄文明, 王利, 冀国桢, 等, 2013. 胭脂鱼维氏气单胞菌和中间气单胞菌的鉴定及药物敏感性. 水产科学, 32(4): 210-214 DOI:10.3969/j.issn.1003-1111.2013.04.006 |
蔺凌云, 潘晓艺, 袁雪梅, 等, 2018. 淡水鱼虾细菌病诊断与防控技术研究进展. 中国动物检疫, 35(6): 83-88 DOI:10.3969/j.issn.1005-944X.2018.06.023 |
熊广泽, 张焱, 2021. 鱼源维氏气单胞菌的研究进展. 陕西农业科学, 67(9): 76-80 DOI:10.3969/j.issn.0488-5368.2021.09.020 |
黎炯, 叶星, 卢迈新, 等, 2011. 罗非鱼维氏气单胞菌的分离鉴定和药敏试验. 水生态学杂志, 32(3): 132-136 |
鞠安琪, 谷巍, 张海朋, 等, 2018. 屎肠球菌对鲤鱼非特异性免疫酶活性和抗病力的影响. 中国兽医科学, 48(2): 228-233 |
ABRAMI L, FIVAZ M, GLAUSER P E, et al, 2003. Sensitivity of polarized epithelial cells to the pore-forming toxin aerolysin. Infection and Immunity, 71(2): 739-746 DOI:10.1128/IAI.71.2.739-746.2003 |
FOYSAL J, MOMTAZ F, ALI H, et al, 2019. Molecular characterization and interactome analysis of aerolysin (aer) gene from fish pathogen Aeromonas veronii: The pathogenicity inferred from sequence divergence and linked to histidine kinase (cheA). Journal of Fish Diseases, 42(4): 465-475 DOI:10.1111/jfd.12954 |
GAVÍN R, MERINO S, ALTARRIBA M, et al, 2003. Lateral flagella are required for increased cell adherence, invasion and biofilm formation by Aeromonas spp. FEMS Microbiology Letter, 224(1): 77-83 DOI:10.1016/S0378-1097(03)00418-X |
HUSSEIN G H G, CHEN M, QI P P, et al, 2020. Aquaculture industry development, annual price analysis and out-of-season spawning in largemouth bass Micropterus salmoides. Aquaculture, 519: 734901 DOI:10.1016/j.aquaculture.2019.734901 |
KITA-TSUKAMOTO K, OYAIZU H, NANBA K, et al, 1993. Phylogenetic relationships of marine bacteria, mainly members of the family Vibrionaceae, determined on the basis of 16S rRNA sequences. International Journal of Systematic and Evolutionary Microbiology, 43(1): 8-19 |
LAZADO C C, ZILBERG D, 2018. Pathogenic characteristics of Aeromonas veronii isolated from the liver of a diseased guppy (Poecilia reticulata). Letters in Applied Microbiology, 67(5): 476-483 DOI:10.1111/lam.13057 |
LI T, RAZA S H A, YANG B T, et al, 2020. Aeromonas veronii infection in commercial freshwater fish: a potential threat to public health. Animals (Basel), 10(4): 608 |
MERINO S, RUBIRES X, AGUILAR A, et al, 1997. The role of flagella and motility in the adherence and invasion to fish cell lines by Aeromonas hydrophila serogroup O: 34 strains. FEMS Microbiology Letters, 151(2): 213-217 DOI:10.1111/j.1574-6968.1997.tb12572.x |
NAWAZ M, KHAN S A, KHAN A A, et al, 2010. Detection and characterization of virulence genes and integrons in Aeromonas veronii isolated from catfish. Food Microbiology, 27(3): 327-331 DOI:10.1016/j.fm.2009.11.007 |
YANG B T, ZHANG D X, WU T L, et al, 2019. Maltoporin (LamB protein) contributes to the virulence and adhesion of Aeromonas veronii TH0426. Journal of Fish Diseases, 42(3): 379-389 DOI:10.1111/jfd.12941 |
 2022, Vol. 53
2022, Vol. 53


