中国海洋湖沼学会主办。
文章信息
- 王靖文, 杨国梁, 孔杰, 夏正龙, 隋娟, 唐琼英, 罗坤, 代平, 孟宪红, 陈丽梅, 栾生. 2022.
- WANG Jing-Wen, YANG Guo-Liang, KONG Jie, XIA Zheng-Long, SUI Juan, TANG Qiong-Ying, LUO Kun, DAI Ping, MENG Xian-Hong, CHEN Li-Mei, LUAN Sheng. 2022.
- 罗氏沼虾(Macrobrachium rosenbergii)雌雄虾不同形态阈值性状的遗传变异分析
- AN ANALYSIS ON GENETIC VARIATION OF THRESHOLD TRAITS OF FEMALE AND MALE MORPHOTYPES IN MACROBRACHIUM ROSENBERGII
- 海洋与湖沼, 53(3): 710-717
- Oceanologia et Limnologia Sinica, 53(3): 710-717.
- http://dx.doi.org/10.11693/hyhz20211100289
文章历史
-
收稿日期:2021-11-23
收修改稿日期:2021-12-21
2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东青岛 266071;
3. 湖州师范学院 浙江湖州 313000;
4. 江苏数丰水产种业有限公司 江苏高邮 225600
2. Key Laboratory for Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao); Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Huzhou University, Huzhou 313000, China;
4. Jiangsu Shufeng Prawn Breeding Co. Ltd., Gaoyou 225600, China
罗氏沼虾(Macrobrachium rosenbergii)隶属甲壳纲(Crustacea)、十足目(Decapoda)、长臂虾科(Palaemonidae)、沼虾属(Macrobrachium)。根据它们在群体中的相对大小、第二步足的颜色及其与体长的比例等特征, 雄虾可以分为四种形态: 小雄虾(small male, SM), 橙色螯(orange-clawed male, OC)、蓝色螯(blue-clawed male, BC)和老蓝色螯(old blue-clawed male, OBC)雄虾(Wortham et al, 2014)。根据繁殖状态, 雌虾可以分为: 性腺未发育(immature female, IF)、性腺成熟(mature ovary female, MOF)、抱卵(berried female, BF)和已产卵(spawned female, SF)四种形态。不同形态的雄虾体重差异显著(Ranjeet et al, 2002), 其中SM是雄虾生长发育的起始阶段, OC为快速生长时期(Cohen et al, 1981); BC是雄虾形态变化的最终阶段, 体型大, 生长速度变慢; OBC雄虾色深蓝、外壳坚硬、头胸甲和第二步足发达, 其第二步足长多为体长的1.5倍以上(唐琼英等, 2019), 从外型看起来更为老气, 被养殖户俗称为“老头虾”。BC雄虾处于统治地位, 会抑制SM和OC雄虾的生长速度和形态转变。只有当OC个体的体型和争斗能力不弱于其附近最大的BC个体时, OC雄虾才有机会转变为BC雄虾(Kuris et al, 1987)。未性成熟的IF雌虾的体重小于性成熟的MOF、BF和SF雌虾, 但达到性成熟状态后, 后三种形态雌虾生长速度变慢(Ra’anan et al, 1991)。
养殖群体中不同形态雌雄虾所占比例会影响养殖产量和经济效益。如果群体中BC雄虾比例过高, 一方面BC个体间争斗会降低养殖存活率, 另一方面BC个体会抑制SM和OC个体的生长, 导致群体生长速度变慢, 降低养殖产量(Aflalo et al, 2014)。在养殖收获期前如果雌虾BF和SF形态个体的比例过高, 也会导致群体的生长速度变慢, 影响产量。
当前, 关于罗氏沼虾雌雄虾不同形态个体所占比例的遗传参数估计研究较少。Dinh等(2014)对罗氏沼虾核心育种群体5个世代21 459尾雌雄个体不同形态阈值性状的方差组分和遗传参数进行了估计。但是该群体的养殖测试密度非常低(2尾/m2), 个体的收获规格较大(BC雄虾收获体重均值为81.2 g), 与我国常规土塘养殖模式和市场规格存在较大差异(杨雁等, 2019)。已有研究表明, 养殖密度对罗氏沼虾雄虾不同形态及社会等级结构的影响较大(徐晔等, 2021)。因此在不同养殖模式下获得的形态阈值性状的遗传参数, 可能会存在较大差异。本文评估了土塘养殖模式下罗氏沼虾不同形态雌雄虾占比的选择潜力, 以及改良性状后对罗氏沼虾生长速率的影响, 以期为进一步改良罗氏沼虾的产量性状提供关键的遗传参数支撑。
1 材料与方法 1.1 实验对象实验群体来自位于江苏省高邮市的江苏数丰水产种业有限公司。奠基群体包括两个商业群体和两个野生群体(Liu et al, 2020)。2019年, 将来自三个扩繁群体的9个雄虾和7个雌虾引入核心群体, 并在G3代产生了21个新的家系。扩繁群体为G0~G2世代高选择指数家系的后代。本实验使用有形态记录的G3~G4两代群体的信息。
1.2 家系的交配和生产使用基于系谱信息的最佳线性无偏预测方法(best linear unbiased prediction based on pedigree, pBLUP) (G0~G2世代)、单步基因组BLUP方法(single step genomic BLUP, ssGBLUP) (Meuwissen et al, 2001) (G3世代)结合个体动物模型预测每个世代个体体重的估计育种值(estimated breeding value, EBV)。使用pBLUP (G0~G2)或ssGBLUP (G3)方法结合父母本阈值(连接函数PROBIT) 模型预测家系存活性状的EBV。综合体重和存活性状的育种值, 计算个体的综合选择指数, 挑选高选择指数个体作为候选配种亲本。优先挑选外形健康、爪长且粗的OC形态雄虾个体, 以及卵巢呈橙色且占头胸甲面积较大的雌虾个体作为亲本。挑选出的个体单独养殖至性成熟。
利用最佳遗传贡献理论(optimum contribution selection, OCS), 平衡近交水平和遗传进展, 将来自不同家系的1尾雄虾和3~5尾雌虾饲养在3 m2的混凝土水池中交配。将受精后的雌虾转移到单独的120 L桶中, 饲养15~18 d, 直到卵开始孵化。每个家系随机抽取5 000尾幼体, 移至120 L的育苗桶中。
1.3 幼体中间培育与家系和个体标记当每个家系80%以上幼体变态为仔虾时, 开始淡化直至全部幼体变为仔虾。每个家系计数600尾仔虾移入3 m2的暂养池内进行中间培育。当家系内最小个体的体长超过2.5 cm时, 在仔虾的第5、6腹节处选取4个部位中的2个位置注射可视嵌入性胶条(visible implant elastomer, VIE), 每个家系用不同的颜色组合进行标记。
1.4 生长与个体形态测试使用P10 (2 133 m2)和P11 (2 000 m2)两个土塘对G3和G4代个体进行共同饲养测试。每个世代每个家系挑选100尾以上标记过VIE的仔虾, 并平均分配到每个池塘。放养密度在2代间的变化范围为12.5~14.39尾/m2。各世代的家系生产和管理如表 1所示。G3和G4分别混养测试110 d和89 d后, 共收获40 935尾个体。收获时记录每只虾的体重、性别、VIE代码、池塘ID和收获日期。根据第二步足的颜色和长度将雄虾分为SM、OC、BC和OBC四种形态。根据第二步足的个数(0、1或2), 进一步将雄虾分为M0C、M1C和M2C三种类型。雌虾按其繁殖状态IF、MOF、BF和SF四种形态。
| 世代 | 家系生产同步性 | 家系暂养期天数 | 家系测试池a | 放苗密度/(尾/m2) | 养成期信息 | 收获时养殖密度/(尾/m2) | 存活率/% | ||||
| 开始日期(月.日) | 结束日期(月.日) | 天数/d | 放苗日期(月.日) | 收获日期(月.日) | 天数/d | ||||||
| 2019 | 03.27 | 04.20 | 24 | 48~65 | P10b | 14.39 | 06.26 | 10.14 | 110 | 9.60 | 66.7 |
| P11 | 10.65 | 7.99 | 75.0 | ||||||||
| 2020 | 03.26 | 04.22 | 27 | 49~70 | P11 | 12.50 | 06.28 | 09.25 | 89 | 6.80 | 70.9 |
| 注: a P10: 2 133 m2; P11: 2 000 m2; b在该池养殖的群体包括21 150尾VIE标记个体和9 540尾未标记个体 | |||||||||||
本研究收集了国内罗氏沼虾核心育种群体2个世代40 935尾雌雄个体在较高养殖密度(10.65~14.39尾/m2)下个体形态的记录。对于雄虾, 设置是否为OC形态和BC形态两个阈值性状进行分析。如当雄虾形态为OC时, 将该性状记为1, 否则记为0。由于SM和OBC形态雄虾所占比例较小(1.0%~2.5%), 难以准确地估计其遗传参数, 文中未做分析。雌虾设置为IF、BF和SF等3个阈值性状, 估计其遗传参数。由于MOF雌虾所占比例较小(3.4%~12.1%), 难以准确地估计其遗传参数, 本文中未做分析。
利用R包psych计算不同世代雌、雄罗氏沼虾收获体重性状的描述性统计参数, 包括个体数量、平均值、最大值、最小值、标准差和变异系数等。使用ggplot2包在家系水平上绘制各世代雌雄虾不同形态个体所占比例的箱形图。
利用ASReml 4.2软件的平均信息约束最大似然(AIREML)方法, 结合父母本阈值性状模型估计罗氏沼虾不同形态阈值性状的遗传参数。育种分析模型如下:
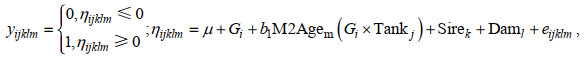 (1)
(1)式中, yijklm表示第m尾虾的形态(是=1; 否=0)(i表示包含世代的固定效应, j表示包含测试池效应, k和l表示包含第k个父本和第l个母本的加性遗传效应; 潜在变量和随机残差下同); ηijklm为yijklm的潜在变量, 假设其符合累积标准正态分布; μ表示总体均值; Gi表示第i个世代的固定效应; M2Agem表示嵌套在世代和测试池互作中的第m尾虾日龄的线性协变量; Sirek和Daml表示第k个父本和第l个母本的加性遗传效应, Sire和Dam~(0, Aσsd2) (σsd2=σs2=σd2), σsd2为父本σs2和母本σd2加性遗传方差的均值, A为加性遗传相关矩阵; eijklm表示第m尾虾的随机残差, e~(0, Iσe2), 其中σe2是残差方差, I是单位矩阵。当评估单个世代不同形态的遗传参数时, 从模型中剔除Gi效应。
形态相关阈值性状在潜在变量尺度上的遗传力(hu2):
 (2)
(2)形态相关阈值性状经过转换后在观测值尺度上的遗传力(hp2):
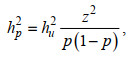 (3)
(3)式中, p是某一形态在全部个体中的比例, z是正态分布的最高点的纵坐标(Robertson et al, 1949)。
使用两性状阈值-动物模型估计雌雄虾不同形态阈值性状与其收获体重的遗传相关, 其中收获体重的线性模型如下:
 (4)
(4)式中, yijklm表示第l尾虾的收获体重; μ表示总体均值; Gi表示第i个世代的固定效应; SexSpecj表示第j个性别的固定效应(雄虾: M0C, M1C和M2C); Tankk表示第k个测试池的固定效应; Gi×Tankk表示第i个世代和第k个测试池的交互效应; M2Agel表示嵌套在世代和测试池互作固定效应中的第l尾虾日龄的线性协变量, b1为回归系数; al表示第l尾虾的加性遗传效应, 假设该效应符合正态分布, a~(0, Aσa2), 其中σa2是加性遗传方差, A为加性遗传相关矩阵; cm是第m个全同胞家系的随机效应; eijklm表示第l尾虾的随机残差, e~(0, Iσe2), 其中σe2是残差方差, I是单位矩阵。当评估单个世代不同形态阈值性状与收获体重的遗传相关时, 从模型中剔除Gi效应。
1.6 遗传力和相关评估的显著性检验Z-score用来检验遗传力及遗传相关估计值与0之间是否存在显著差异(王明珠等, 2017)。其公式为:
 (5)
(5)式中, xi是不同形态阈值性状的遗传力或遗传相关估计值, σi是相应的遗传力或遗传相关的标准误。如果Z≥1.96, 遗传力或遗传相关估计值与0存在显著差异; 如果Z≥2.58, 遗传力或遗传相关估计值与0存在极显著差异。
2 结果 2.1 描述性统计罗氏沼虾各世代不同形态雌雄虾的个体数及比例、收获体重的描述性统计参数见表 2 (雄虾)和表 3 (雌虾)。G3和G4世代不同形态的雄虾所占比例分别为: 1.7% vs 4.5% (SM)、56.1% vs 72.7% (OC)、39.7% vs 21.7% (BC)、2.5% vs 1.0% (OBC)。G3世代OC雄虾的比例明显低于G4世代, BC雄虾的比例高于G4世代。G3和G4世代不同形态的雌虾所占比例分别为: 19.3% vs 29.9% (IF)、3.4% vs 12.1% (MOF)、31.3% vs 25.9% (BF)、46.1% vs 32.1% (SF)。G3世代IF雌虾的比例明显低于G4世代, BF和SF雌虾的比例高于G4世代。G3和G4世代雄虾的体重均值分别为(46.32±14.28) g、(39.73±15.49) g; 雌虾的体重均值分别为(31.17±6.19) g、(29.10±7.13) g。此外, 值得注意的是G3世代OC雄虾的平均体重比BC雄虾高8.71%, 与之相反, G4世代OC雄虾的平均体重比BC雄虾低1.69%; G3世代IF雌虾的平均体重比BF雌虾低15.06%, G4世代IF雌虾的平均体重比BF雌虾低26.89%。雌雄虾不同形态个体的体重差异幅度在两代间有较大差异, 间接表明, 雌雄虾性成熟后生长速度明显变慢。
| 世代 | 形态 | 数量 | 比例/% | 收获体重 | ||||
| 平均值/g | 最小值/g | 最大值/g | 标准差/g | 变异系数/% | ||||
| G3 | SM | 222 | 1.67 | 10.95 | 3.70 | 24.50 | 3.38 | 30.87 |
| OC | 7 442 | 56.12 | 48.66 | 6.80 | 116.30 | 13.62 | 27.99 | |
| BC | 5 263 | 39.69 | 44.75 | 10.80 | 132.00 | 13.38 | 29.90 | |
| OBC | 333 | 2.51 | 42.35 | 16.00 | 79.40 | 11.18 | 26.40 | |
| All | 13 260 | — | 46.32 | 3.70 | 132.00 | 14.28 | 30.83 | |
| G4 | SM | 275 | 4.54 | 10.82 | 4.40 | 71.30 | 6.29 | 58.13 |
| OC | 4 410 | 72.74 | 40.83 | 7.10 | 107.60 | 14.19 | 34.75 | |
| BC | 1 315 | 21.69 | 41.53 | 8.90 | 97.70 | 14.96 | 36.02 | |
| OBC | 63 | 1.04 | 51.40 | 25.50 | 92.10 | 15.17 | 29.51 | |
| All | 6 063 | — | 39.73 | 4.40 | 107.60 | 15.49 | 38.99 | |
| 注: SM为小型雄虾; OC为橙色螯雄虾; BC为蓝色螯雄虾; OBC为老蓝色螯雄虾 | ||||||||
| 世代 | 形态 | 数量 | 比例/% | 收获体重 | ||||
| 平均值/g | 最小值/g | 最大值/g | 标准差/g | 变异系数/% | ||||
| G3 | IF | 2 901 | 19.25 | 28.18 | 6.00 | 68.80 | 6.69 | 23.74 |
| MOF | 512 | 3.40 | 31.69 | 12.40 | 57.20 | 5.68 | 17.92 | |
| BF | 4 711 | 31.26 | 33.20 | 10.00 | 62.10 | 5.85 | 17.62 | |
| SF | 6 945 | 46.09 | 31.01 | 9.40 | 77.60 | 5.68 | 18.32 | |
| All | 15 069 | — | 31.17 | 6.00 | 77.60 | 6.19 | 19.86 | |
| G4 | IF | 1 959 | 29.94 | 24.20 | 4.30 | 51.00 | 6.24 | 25.79 |
| MOF | 789 | 12.06 | 27.81 | 12.00 | 52.30 | 5.46 | 19.63 | |
| BF | 1 697 | 25.94 | 33.10 | 10.00 | 61.00 | 6.47 | 19.55 | |
| SF | 2 098 | 32.06 | 30.94 | 12.70 | 57.90 | 6.13 | 19.81 | |
| All | 6 543 | — | 29.10 | 4.30 | 61.00 | 7.13 | 24.50 | |
| 注: IF为性腺未发育雌虾; MOF为性腺成熟雌虾; BF为抱卵雌虾; SF为已产幼体雌虾 | ||||||||
雌雄虾不同形态个体在家系水平上的比例见图 1。在G3世代不同家系中, OC雄虾占比最大为83.3%, 最小为16.5%, 而在G3世代不同家系中, IF雌虾占比最大为83.3%, 最小为16.5%。雌雄虾不同形态个体在家系中占比有明显差异。
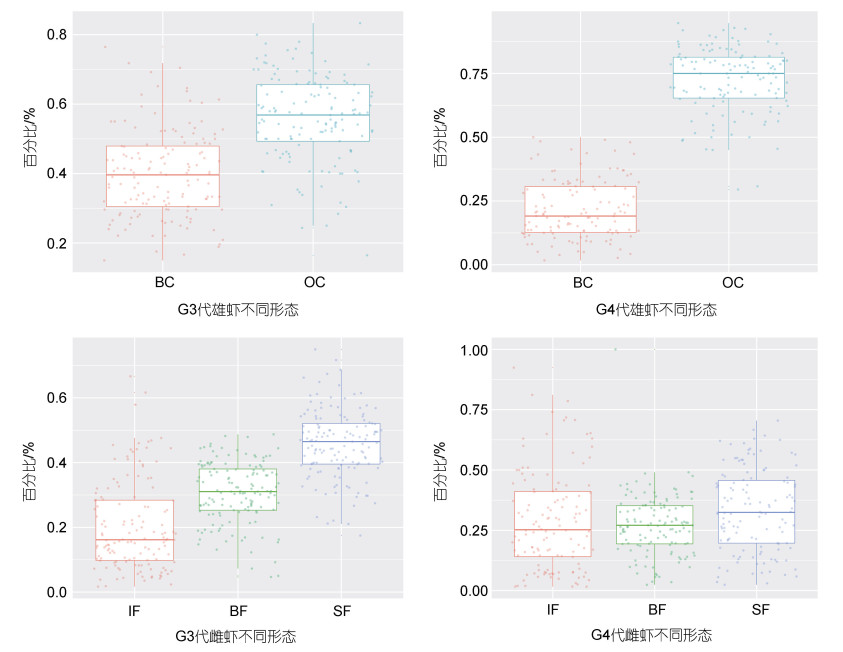 |
| 图 1 罗氏沼虾不同家系多种形态雌雄虾占比的箱形图 Fig. 1 Box plot of the proportion of female and male morphotypes in different families of M. rosenbergii 注: OC为橙色螯雄虾; BC为蓝色螯雄虾; IF为性腺未发育雌虾; BF为抱卵雌虾; SF为已产幼体雌虾 |
罗氏沼虾雄、雌虾不同形态阈值性状的方差组分、遗传力及其与收获体重的遗传相关见表 4和表 5。雄虾OC、BC两个阈值性状的遗传力估计值范围分别为(0.10±0.01)~(0.12±0.02)、(0.08±0.02)~(0.10±0.02), 属于低遗传力水平。雄虾OC、BC阈值性状与收获体重的遗传相关估计值范围分别为(0.01±0.15)~ (0.23±0.20)、(0.11±0.14)~(0.43±0.20); 雌虾IF、BF、SF三个阈值性状的遗传力估计值范围分别为(0.13±0.02)~(0.22±0.03)、(0.05±0.01)~(0.13±0.02)、(0.04±0.01)~(0.07±0.01)。雌虾IF、BF和SF阈值性状与收获体重的遗传相关估计值范围分别为–(0.61±0.09)~–(0.12±0.11)、(0.15±0.11)~(0.51±0.10)、–(0.18±0.12)~(0.53±0.14)。大部分性状在G4世代的遗传参数估计值高于G3世代, 跨世代遗传参数估计值在G3和G4世代相应值之间。
| 形态 | 世代 | 4σa2 | σa2 | σp2 | hu2 | hp2 | rg |
| OC | G3 | 0.17±0.03 | 1.00 | 1.08±0.01 | 0.16±0.02** | 0.10±0.01** | 0.01±0.15 |
| G4 | 0.23±0.05 | 1.00 | 1.12±0.02 | 0.21±0.04** | 0.12±0.02** | 0.23±0.20 | |
| Across | 0.22±0.03 | 1.00 | 1.11±0.01 | 0.20±0.02** | 0.12±0.01** | 0.17±0.15 | |
| BC | G3 | 0.18±0.03 | 1.00 | 1.09±0.01 | 0.17±0.02** | 0.10±0.02** | 0.11±0.14 |
| G4 | 0.17±0.04 | 1.00 | 1.09±0.02 | 0.16±0.03** | 0.08±0.02** | 0.43±0.20* | |
| Across | 0.19±0.03 | 1.00 | 1.10±0.01 | 0.17±0.02** | 0.10±0.01** | 0.26±0.14 | |
| 注: OC为橙色螯雄虾; BC为蓝色螯雄虾; 4σa2为加性遗传方差; σa2为残差方差; σp2为表型方差; hu2为潜在变量尺度上的遗传力; hp2为观测值尺度上的遗传力; rg为遗传相关; **表示差异极显著(P < 0.01); *表示差异显著(P < 0.05) | |||||||
| 形态 | 世代 | 4σa2 | σa2 | σp2 | hu2 | hp2 | rg |
| IF | G3 | 0.32±0.05 | 1.00 | 1.16±0.02 | 0.27±0.04** | 0.13±0.02** | −0.12±0.11 |
| G4 | 0.48±0.08 | 1.00 | 1.24±0.04 | 0.39±0.05** | 0.22±0.03** | −0.61±0.09** | |
| Across | 0.45±0.05 | 1.00 | 1.23±0.03 | 0.37±0.04** | 0.19±0.02** | −0.46±0.08** | |
| BF | G3 | 0.09±0.02 | 1.00 | 1.04±0.01 | 0.09±0.02** | 0.05±0.01** | 0.15±0.11 |
| G4 | 0.26±0.05 | 1.00 | 1.13±0.02 | 0.23±0.04** | 0.13±0.02** | 0.51±0.10** | |
| Across | 0.16±0.02 | 1.00 | 1.08±0.01 | 0.15±0.02** | 0.08±0.01** | 0.41±0.09** | |
| SF | G3 | 0.07±0.01 | 1.00 | 1.03±0.01 | 0.06±0.01** | 0.04±0.01** | −0.18±0.12 |
| G4 | 0.12±0.03 | 1.00 | 1.06±0.01 | 0.11±0.03** | 0.07±0.01** | 0.53±0.14** | |
| Across | 0.09±0.02 | 1.00 | 1.04±0.01 | 0.08±0.01** | 0.05±0.01** | 0.24±0.11* | |
| 注: IF为性腺未发育雌虾; BF为抱卵雌虾; SF为已产幼体雌虾; 4σa2为加性遗传方差; σa2为残差方差; σp2为表型方差; hu2为潜在变量尺度上的遗传力; hp2为观测值尺度上的遗传力; rg为遗传相关; **表示差异极显著(P < 0.01); *表示差异显著(P < 0.05) | |||||||
本研究结果表明OC (BC)雄虾的比例在两世代间存在显著差异。推测原因有三点: 一是生长测试周期和养殖密度不同造成差异, G3代生长测试周期较长, 有更多的OC雄虾转变为BC个体, 造成群体中OC个体的比例降低; 二是每个世代对OC个体的优先选择留种会产生遗传增益, 进而增加G4代OC个体的比例, 第三是随着密度的增加, 部分雄虾可能会在较小的规格下提前转变为BC形态, 这在以往的研究中得到证实(Wenner, 1985)。
罗氏沼虾雄虾OC、BC形态阈值性状的遗传力估计值较为接近, 分别为0.10~0.12和0.08~0.10, 低于越南育种群体的遗传力估计值(0.10~0.21) (Dinh et al, 2014)。推测可能是因为两个养殖群体测试密度差异较大所致(10.65~14.39尾/m2 vs 2尾/m2)。雌虾BF阈值性状的遗传力估计值(0.05~0.13)高于SF的估计值(0.04~0.07), 与越南育种群体的估计结果(0.06~0.10)较一致。此外本研究首次获得了雌虾IF阈值性状的遗传力(0.13~0.22), 表现为中低等遗传力水平。阈值性状的遗传力估计值多表现为中低水平, 如Medrado等(2021)分析表明, 多种养殖虾类存活性状的遗传均值为(0.15±0.003)。上述结果表明, 改良罗氏沼虾育种群体中雌雄虾不同形态的比例具有数量遗传学基础。较大的估计值范围, 可能是受不同世代群体的遗传结构、测试模式等因素影响。
在本研究中, 雌虾不同形态阈值性状与收获体重的遗传相关估计值在两个世代间存在较大差异。如, G3和G4世代雌虾IF形态阈值性状与收获体重的遗传相关分别为–0.12±0.11和–0.61±0.09。雌虾从IF转变为MOF、BF和SF后均达到性成熟状态, 生长速度变慢可能是导致世代间遗传相关估计值存在差异的主要原因之一。由于G3世代混养测试周期长于G4世代(110 d vs 89 d), 导致G3代MOF、BF和SF性成熟雌虾的比例高于G4世代(80.75% vs 70.06%)。由于性成熟雌虾的生长速度变慢, 导致G3世代未性成熟个体(IF)和性成熟个体(MOF、BF和SF)间的体重差异幅度要小于G4世代相应值, 这是G3世代雌虾不同形态阈值性状与收获体重的遗传相关绝对值低于G4世代相应估计值的主要原因。研究资料表明, 雄虾可能存在着“跨级”生长模式(Karplus, 2005), 从而导致不同形态阈值性状与收获体重遗传相关估计值在两个世代间存在差异。由于G3世代混养测试周期更长, OC雄虾要转变为BC雄虾, 其生长规格和争斗能力必须要不弱于甚至强于已存在的BC雄虾, 便导致G3世代存在体重大于BC个体的“跨级生长”OC个体。与G3世代相比, G4世代观测值受到社会等级结构等非加性遗传效应的影响更小, 因此获得的BC形态阈值性状与收获体重的遗传相关估计值更大[(0.11±0.14) vs (0.43±0.20)], 标准误更小, 估计值更为精确。此外, 本文获得的雄虾OC、BC形态阈值性状与收获体重的遗传相关估计值[(0.01±0.15)~ (0.43±0.20)]低于越南育种群体相关性状的估计值[(0.25±0.14)~(0.70±0.10)] (Dinh et al, 2014), 推测可能是因为两个群体在数据结构(2个世代vs 5个世代)、测试密度(10.65~14.39尾/m2 vs 2尾/m2)、混养周期(89~110 d vs 182~196 d)、收获规格(OC: 40.83~48.66 g vs 60.2 g)等因素的差异所致。
4 结论本文在较高密度的土塘养殖模式下, 首次利用父母本育种分析模型和阈值统计模型估计了罗氏沼虾核心育种群体雌雄虾5个形态阈值性状的遗传参数, 其中遗传力为中低水平, 表明存在可利用的加性遗传方差。雄虾OC、BC型阈值性状与收获体重间存在中低度遗传相关, 表明利用一个核心育种群体, 可同时实现增加OC型雄虾比例和提高生长速度两个育种目标。部分世代雌虾形态阈值性状与收获体重间为中度遗传相关, 表明如增加雌虾群体中未性成熟IF个体的比例, 会降低雌虾群体的生长速度, 因此难以同时改良这两个性状。
王明珠, 2017. 中国对虾生长和耐低温性状的遗传参数评估[D]. 上海: 上海海洋大学: 15-18.
|
杨雁, 王雪龙, 朱丽艳, 2019. 罗氏沼虾土池高密度养殖试验. 渔业致富指南, (2): 61-63 |
徐晔, 杨国梁, 夏正龙, 等, 2021. 罗氏沼虾雄性个体异质生长研究进展. 水产学杂志, 34(4): 93-98 DOI:10.3969/j.issn.1005-3832.2021.04.014 |
唐琼英, 夏正龙, 蔡缪荧, 等, 2019. 罗氏沼虾养殖群体表型性状间的相关性及类群差异分析. 中国水产科学, 26(6): 1075-1085 |
AFLALO E D, DANDU R S N, VERGHESE J T, et al, 2014. Neo-females production and all-male progeny of a cross between two Indian strains of prawn (Macrobrachium rosenbergii): Population structure and growth performance under different harvest strategies. Aquaculture, 428/429: 7-15 DOI:10.1016/j.aquaculture.2014.02.021 |
COHEN D, RAANAN Z, BRODY T, 1981. Population profile development and morphotypic differentiation in the giant freshwater prawn Macrobrachium rosenbergii (de Man). Journal of the World Mariculture Society, 12(2): 231-243 |
DINH H, NGUYEN N H, 2014. Genetic inheritance of female and male morphotypes in giant freshwater prawn Macrobrachium rosenbergii. PLoS One, 9(2): e90142 DOI:10.1371/journal.pone.0090142 |
KARPLUS I, 2005. Social control of growth in Macrobrachium rosenbergii (De Man): a review and prospects for future research. Aquaculture Research, 36(3): 238-254 DOI:10.1111/j.1365-2109.2005.01239.x |
KURIS A M, RA'ANAN Z, SAGI A, et al, 1987. Morphotypic differentiation of male malaysian giant prawns, Macrobrachium rosenbergii . Journal of Crustacean Biology, 7(2): 219-237 DOI:10.2307/1548603 |
LIU J Y, YANG G L, KONG J, et al, 2020. Using single-step genomic best linear unbiased prediction to improve the efficiency of genetic evaluation on body weight in Macrobrachium rosenbergii. Aquaculture, 528: 735577 DOI:10.1016/j.aquaculture.2020.735577 |
MEDRADO B D, PEDROSA V B, PINTO L F B, 2021. Meta-analysis of genetic parameters for economic traits in sheep. Livestock Science, 247: 104477 DOI:10.1016/j.livsci.2021.104477 |
MEUWISSEN T H E, HAYES B J, GODDARD M E, 2001. Prediction of total genetic value using genome-wide dense marker maps. Genetics, 157(4): 1819-1829 DOI:10.1093/genetics/157.4.1819 |
RA'ANAN Z, SAGI A, WAX Y, et al, 1991. Growth, size rank, and maturation of the freshwater prawn, Macrobrachium rosenbergii: analysis of marked prawns in an experimental population. The Biological Bulletin, 181(3): 379-386 DOI:10.2307/1542358 |
RANJEET K, KURUP B M, 2002. Heterogeneous individual growth of Macrobrachium rosenbergii male morphotypes. Naga, 25(2): 13-18 |
ROBERTSON A, LERNER I M, 1949. The heritability of all-or-none traits: viability of poultry. Genetics, 34(4): 395-411 DOI:10.1093/genetics/34.4.395 |
WENNER A M, 1985. Factors in Adult Growth. Rotterdam, Netherlands: A.A. Balkema, 277-312
|
WORTHAM J L, VANMAURIK L N, PRICE W W, 2014. Setal morphology of the grooming appendages of Macrobrachium rosenbergii (Crustacea: Decapoda: Caridea: Palaemonidae) and review of decapod setal classification. Journal of Morphology, 275(6): 634-649 DOI:10.1002/jmor.20244 |
 2022, Vol. 53
2022, Vol. 53


