中国海洋湖沼学会主办。
文章信息
- 刘岩, 李志恩, 袁一鸣, 张真, 钱鹏宇, 叶欢, 刘松怡, 王泽, 韩姣姣, 周君, 苏秀榕. 2022.
- LIU Yan, LI Zhi-En, YUAN Yi-Ming, ZHANG Zhen, QIAN Peng-Yu, YE Huan, LIU Song-Yi, WANG Ze, HAN Jiao-Jiao, ZHOU Jun, SU Xiu-Rong. 2022.
- 基于高通量测序的象山港水域细菌多样性的研究
- STUDY ON BACTERIAL DIVERSITY IN THE XIANGSHAN HARBOR USING HIGH THROUGHPUT SEQUENCING
- 海洋与湖沼, 53(3): 645-653
- Oceanologia et Limnologia Sinica, 53(3): 645-653.
- http://dx.doi.org/10.11693/hyhz20211000252
文章历史
-
收稿日期:2021-10-22
收修改稿日期:2021-12-19
2. 国家海洋局东海环境监测中心 上海 201206;
3. 浙江正合谷生物科技有限公司 浙江宁波 315048
2. East China Sea Environmental Monitoring Center of State Oceanic Administration, Shanghai 201206, China;
3. Zhejiang Zhenghegu Biotechnology Co., Ltd., Ningbo 315048, China
象山港位于浙江省宁波市东南部沿海, 是一个由东北向西南深入内陆的狭长型半封闭型海湾, 港内地形复杂, 水产资源丰富, 是重要的以海水养殖区和海洋牧场示范区为主的多功能水域, 也是著名的避风良港, 其地处29°24′~29°46′N和121°25′~122°00′E的范围内。由于象山港海域深浅宽窄不一, 是浙江省最重要的海水增养殖基地, 也是重要的渔业资源保护区(江志兵等, 2013)。近年来由于陆源污染(童晨等, 2018)和水产养殖污染(Han et al, 2013; 吴燕妮等, 2017)等人为活动的干扰, 给原本就较为脆弱的海湾生态系统造成巨大压力, 生态环境问题日益突出。我国非常重视资源的保护, 更关注海洋的生态环境。海水中微生物种类较多, 是自然界最重要的分解者, 对维持生态平衡和物质循环有着重要作用。有些微生物可以有效降解水内的有毒物质; 有些致病微生物能够控制它们的寄主的数量, 甚至影响寄主的进化方向; 有些微生物之间存在着某种相互作用, 对维持水内生态环境的稳定性意义重大。为了掌握象山港细菌的多样性, 本文利用高通量测序技术研究象山港早春低温海水环境中的微生物多样性, 以期为海洋环境保护、水产养殖病害的防护奠定基础。
1 材料与方法 1.1 样品采集于2021年3月(春季)对象山港中部海域(121°43′06″E, 29°34′44″N) (G04)、象山港西沪港海域(121°47′20″E, 29°31′40″N) (G06)、象山港中部海域(121°35′52″E, 29°31′00″N) (G08)、象山港铁港口海域(121°30′43″E, 29°30′21″N) (G09)、象山港西沪港口海域(121°45′42″E, 29°32′38″N) (G11); 象山港黄墩港海域(121°31′37″E, 29°26′45″N) (G12)的6个取样点的0.5 m深海水进行取样检测。
1.2 样品的处理和测序采集的水样带回实验室后, 取1 L的水样经0.22 μm的无菌纤维素滤膜真空抽滤, 滤膜取出放置于15 mL的无菌离心管中, 并将样品送至杭州联川生物技术股份有限公司进行16S rRNA高通量测序。选择CTAB法对微生物组样本进行微生物组总DNA的提取, 并通过琼脂糖凝胶电泳检测DNA质量, 紫外分光光度计进行DNA定量。PCR扩增产物通过2%琼脂糖凝胶电泳进行检测, AMPure XT beads试剂盒回收产物。对纯化后的PCR产物使用Agilent 2100生物分析仪(Agilent, 美国)和Illumina (Kapa Biosciences, Woburn, MA, 美国)的文库定量试剂盒进行评估。将合格的文库梯度稀释后(Index序列不可重复), 根据所需测序量按相应比例混合, 并经NaOH变性为单链利用NovaSeq 6000测序仪进行2×250 bp的双端测序。
1.3 可培养细菌的鉴定将6个取样点的海水进行10×稀释后分别涂布于海水牛肉膏、海水大豆蛋白培养基、2216E和TCBS固体培养基上28 ℃培养。待12~16 h菌落长出后按照形态、大小和颜色进行平板划线分离纯化。
分别挑取纯化后细菌单菌落的DNA作为模板, 利用16S rRNA通用引物27F (5′-AGAGTTTGATC CTGGCTCAG-3′)和1492R (5′-TACGGTTACCTTGT TACGACTT-3′)进行PCR扩增后产物送到上海生工测序。
2 结果与分析 2.1 测序结果利用高通量测序共获得836属和2 166种细菌, 它们隶属33个门、91个纲、186个目和352个科。通过去重复获得高精度单碱基代表序列, 然后使用ASVs (amplicon sequence variants)构建OTU (operational taxonomic units), 获得最终的feature特征表以及特征序列, 并进行多样性分析、物种分类注释和差异分析等。根据不同的相似度、feature ID进行分析。花瓣图可清晰地看出各取样点之间物种丰富度的差异, G04、G06、G08、G09、G11和G12特有的菌种分别有1 089、880、1 113、513、447和628个, 共有的菌种有213个; 其中G08、G04和G06细菌丰富度较高(图 1)。
 |
| 图 1 象山港细菌种类差异分析 Fig. 1 Analysis on the difference of bacterial species in Xiangshan harbor 注: G04: 象山港中部海域; G06: 象山港西沪港海域; G08: 象山港中部海域; G09: 象山港铁港口海域; G11: 象山港西沪港口海域; G12: 象山港黄墩港海域。下同 |
图 2的桑基图用来展示数据的“流动”变化, 分支的宽度表示流量的大小。图中展示了不同样本(左侧)对应的门水平(中间)和属水平(右侧)的菌群相对丰度, 直观展示菌群多样性研究中最为关注的两个层级的物种注释信息、对应关系以及所占比例。从图中可以看出象山港海域中的优势菌群包括弧菌属(Vibrio)、大西洋美女神菌属(Amphritea)和假交替单胞菌属(Pseudoalteromonas), 其中假交替单胞菌属在变形菌门中丰度最高, 其次是弧菌属; 而假交替单胞菌属在G09中丰度最高, 在G04中丰度最低; 弧菌属和大西洋美女神菌属主要来自G04 (图 2)。
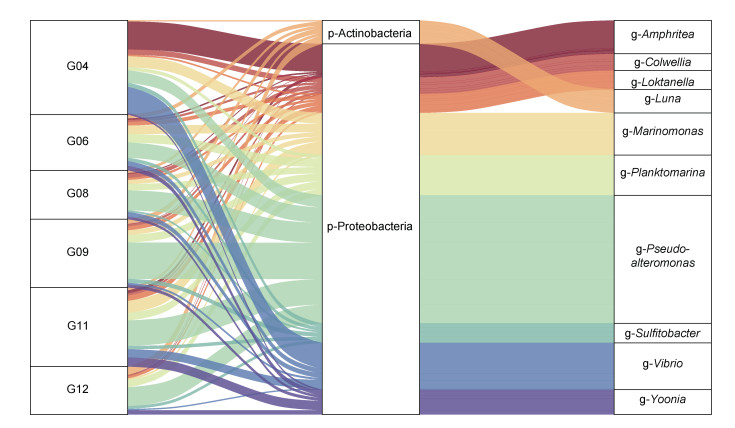 |
| 图 2 象山港海域细菌种属水平差异分析 Fig. 2 Analysis of bacterial species and genera in the sea area of Xiangshan harbor |
玉玦图通过角度来表示每个玦环数值的大小, 角度是决定性因素。通过分析玉玦图可以清晰地看到各个海域中的门、纲、目、科、属和种水平的丰度情况。根据每个水平所占的角度大小分析得知, G09、G11和G12在各水平的丰度水平相近, G04、G06和G08之间的丰度差距也不明显; 经两两相比得知G08的物种丰度最高, G11的物种丰度较低, 并且这种差异主要体现在种属水平上(图 3)。
 |
| 图 3 象山港海域细菌各分类水平丰度分析 Fig. 3 Analysis on the richness of bacteria at different classification levels in the sea area of Xiangshan harbor |
将纲水平相对丰度最高的13个群落数据根据分类单元的丰度分布或样本间的相似程度加以聚类, 并对分类单元和样本分别排序。其中γ-变形菌纲(Gammaproteobacteria)和α-变形菌纲(Alphaproteobacteria)在各海域中丰度较高; 随着纬度的上升, 海域中γ-变形菌纲(Gammaproteobacteria)流动性增高, 其中在G04取样点中高达72.76%, 在G12为29.11%, 最低(图 4)。
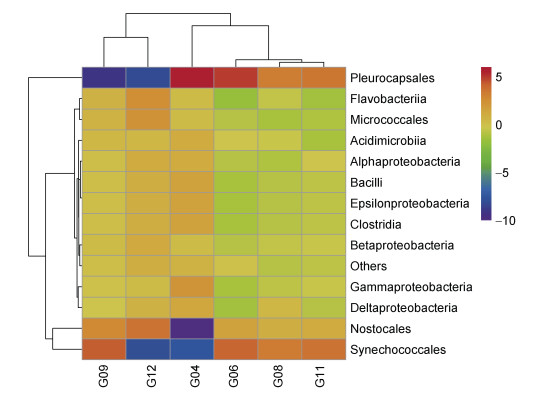 |
| 图 4 象山港海域纲水平上细菌群落结构组成分析 Fig. 4 Analysis on the composition of bacterial community at levels of class in the sea area of Xiangshan harbor |
为进一步准确了解象山港海域细菌群落结构组成, 并揭晓不同取样点的差异, 我们分别根据分类学的门、纲、目、科、属和种水平绘制累计柱状图, 分析各取样点细菌群落结构特点。
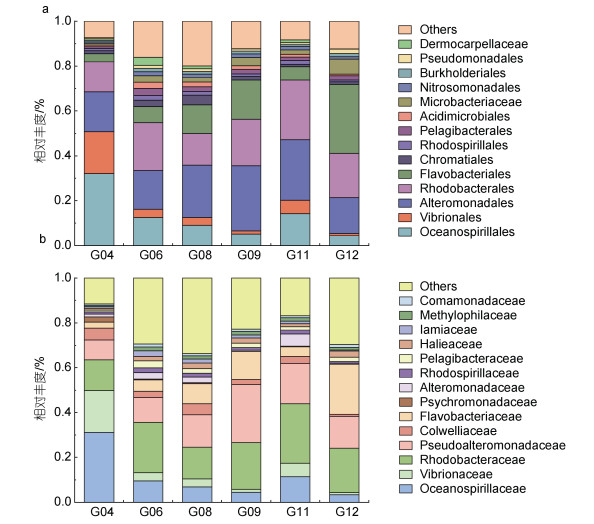
累计柱状图显示变形菌门在G04、G06、G08、G09、G11和G12中的丰度最高, 分别为91.45%、76.18%、73.94%、71.33%、86.76%和57.00%; 其次是拟杆菌门, 所占比例为3.74%、7.59%、13.92%、18.05%、6.01%、31.41%; 再次是放线菌门。与其他海域不同的是, 在G06中蓝藻门丰度高于放线菌门丰度(图 5a)。
 |
| 图 5 象山港海域门水平(a)和纲水平(b)细菌群落结构组成分析 Fig. 5 Analysis on the composition of bacterial community at levels of phylum (a) and class (b) in the sea area of Xiangshan harbor |
在纲水平上, 6个取样点细菌种类中γ-变形菌纲的丰度都比其他纲所占比例高, 其中最高的是在G04 (72.96%), 最低在G12 (29.11%); 其次是α变形菌纲, 最高在G11 (30.65%)。与其他6个取样点不同的是, 在G12中黄杆菌的丰度最高(30.74%); 此外分析发现, 虽然在G04中弧菌丰度最高, 但是黄杆菌纲(Flavobacteriia)丰度最低; 在G12中黄杆菌丰度最高且弧菌丰度最低, 并且弧菌和黄杆菌之间的丰度变化关系在G08、G09和G11中均有所体现(图 5b)。
在目水平上, 海洋螺菌目(Oceanospirillales)和弧菌目(Vibrionales)在G04中所占比最高(32.30%和18.72%), 在G12中占比最低(4.39%和1.01%); 交替单胞菌目(Alteromonadales)在G09中所占比为29.08%, 远高于G12中交替单胞菌目的占比(16.00%); 除G12中黄杆菌目占比30.74%高于红细菌目(Rhodobacterales) 19.76%外, 其他6个取样点的红细菌目占比都高于黄杆菌目; 与其他取样点不同的是G04的优势菌群为海洋螺旋菌目、弧菌目、交替单胞菌目和红细菌目, 而其他取样点的黄杆菌目丰度均高于弧菌目(图 6a)。
 |
| 图 6 象山港海域目水平(a)和科水平(b)细菌群落结构组成分析 Fig. 6 Analysis on the composition of bacterial community at levels of order (a) and family (b) in the sea area of Xiangshan harbor |
科水平上, 在6个取样点中海洋螺菌科(Oceanospirillaceae)、弧菌科(Vibrionaceae)、红细菌科(Rhodobacteraceae)、假交替单胞菌科(Pseudoalteromonadaceae)和黄杆菌科(Flavobacteriaceae)占比较多, 其中在G04中海洋螺菌科和弧菌科丰度最高, 占比分别为31.19%和18.72%, 而黄杆菌科丰度较低, 为2.72%; 在G12中黄杆菌科丰度最高, 而弧菌丰度相对较低, 分别为22.32%和1.01%; 红细菌科在G11和G06中占比最高, 分别是25.74%和20.42%; 从图中我们了解到G08和G12中的假单胞菌科丰度接近, 分别为14.46%和14.20% (图 6b)。
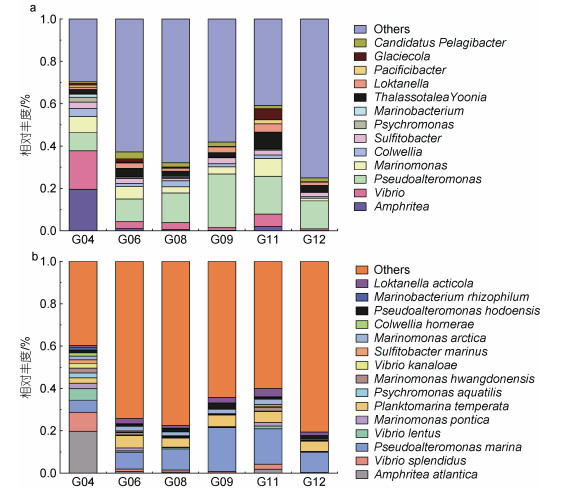
在属水平上, 以6个取样点中丰度占比前13的细菌属整合成累计柱状图进行对比分析发现, 在G04中大西洋美女神菌属和弧菌属占比最高, 分别为19.57%和18.19%, 假交替单胞菌属占比(8.60%)明显低于其他取样点, 这可能与假交替单胞菌和弧菌之间的拮抗作用有关(杨行等, 2019); 在其他5个取样点中丰度最高的是假交替单胞菌属, 在G09的占比高达25.38%; 此外我们还发现各个取样点中均分布着一定数量的海单胞菌属(Marinomonas), G11中8.25%, 占比最多, G12中1.27%, 占比最少(图 7a)。
 |
| 图 7 象山港海域属水平(a)和种水平(b)细菌群落结构组成分析 Fig. 7 Analysis on the composition of bacterial community at levels of genera (a) and species (b) in the sea area of Xiangshan harbor |
在种水平上, 共发现了2 166种细菌, 其中丰度最高的是在G04中的大西洋美女神菌(Amphritea atlantica)和G09中的海假交替单胞菌(Pseudoalteromonas marina), 所占比例分别为19.76%和20.62%。在G04中优势菌包括大西洋美女神菌、灿烂弧菌(Vibrio splendidus) (8.98%)和海假交替单胞菌(5.74%), 除G04以外的各取样点中优势菌群均为海假交替单胞菌(图 7b)。
2.5 细菌群落相似性分析通过PCA分析可得, 样品的空间距离越接近, 表示样品的物种组成结构越相似。PCA图展现出G04与其他5个取样点的微生物组成结构相似性较小, 差异性较大, 其中G11和G06、G08和G09聚集在一起, 距离较近, 说明G11和G06、G08和G09取样点的细菌群落相似性较大, 而G12与这4个水域距离较远, 细菌差异性较大; 造成这种差异的可能原因是G11和G06, G08和G09分别处于纬度相邻的地方, 生活环境和菌群间的互相影响; 而G04与其他取样点的距离较远, 所处的环境和温度有差异, 导致细菌群落的结构组成也会有所不同(图 8)。
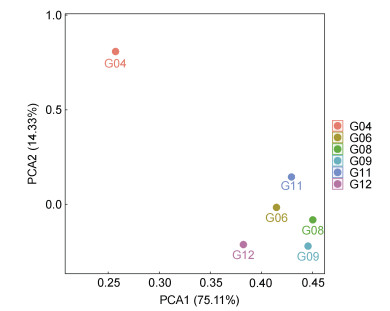 |
| 图 8 象山港海域的菌群PCA分析 Fig. 8 PCA analysis of microbiome in the sea area of Xiangshan harbor |
基于细菌分离培养法, 通过对形态特征、生理生化反应等的分析比较, 对分离纯化出9种细菌, 经16S rRNA测序结果分析, 6个取样点的可培养优势细菌是溶藻弧菌(V. alginolyticus)、副溶血弧菌(V. parahaemolyticus)、灿烂弧菌(V. splendidus)、卡诺弧菌(V. kanaloae)、巨型弧菌(V. gigantis)、粗糙弧菌(V. crassostreae)、海假交替单胞菌(Pseudoaltermonas marina)、罗氏发光杆菌(Photobacterium rosenbergii)和鲁氏发光杆菌(P. lutimaris), 其中弧菌大多来自G04取样点, 海假交替单胞菌主要来源于G09。这与高通量测序结果一致。
3 讨论目前研究的象山港水域生物种类主要为海洋浮游动植物及底栖动物, 对象山港水域微生物多样性及群落分布的研究很少, 对早春低水温环境下的细菌种类研究更少。高通量测序能有效描述微生物的群落特征, 对水样的合理利用有着重要的参考价值。前期研究结果显示象山海域优势细菌类群为α-变形杆菌纲(39.45%)、γ-变形杆菌纲(47.48%)和拟杆菌门(7.76%) (胡常巨等, 2015)。本研究发现变形菌门和蓝藻菌门是象山港水域3月份的两个优势类群。其次是放线菌门和厚壁菌门, 这与前人研究结果一致(李秋芬等, 2013)。这些菌均属于海洋沉积环境中常见的微生物(黄莹等, 2020)。6个不同水域取样点的微生物种类都很多, 但因为所处地理位置及其周围环境的不同, 也导致不同水域的优势类群和多样性有所差别。其中G08、G04和G06细菌多样性较高, 分别是1 113、1 089和880种, 并且这3个取样点所处位置经度都较高; 由于采集时间和水样采集深度相同, 因此菌群的多样性可能与其经纬度及靠岸距离有关。本研究结果表明, 靠近岸边的水域细菌丰富度降低, 这与Wang等(2016)得出的污水及重金属排放会对细菌群落造成一定影响的结果一致。
通过玉玦图分析, 我们以丰度相似度为指标, 6个取样点可分为两组, G09、G11和G12为第一组, G04、G06和G08为第二组, 并且第二组的细菌丰富度均高于第一组; G08的物种丰富度最高, G11与G08相比丰富度显著降低, 多样性减少; 随后对这几个取样点的地理位置进行分析, 找到造成这种丰富度变化的可能原因是G08所处位置远离岸边, 处于四周环海的位置, 菌群丰富度受到人为影响小, 群落结构较复杂; 而其他取样点丰富度差距小的可能原因是所处位置相近, 周围水生环境相近, 这与白洁等(2009)所得出的地域差异导致微生物群落结构和多样性显著不同的结果相一致。
本研究结果显示, α-变形菌纲和γ-变形菌纲(弧菌科)在各海域中丰度较高, 这与之前虞嘉玥等(2021)的研究结果一致; 其中γ-变形菌纲在G04中最高, 在G12中最低; 其次是α-变形菌纲。我们发现, 在维度较高的地方, γ-变形菌纲的流动性也在增强, 据文献报道, γ-变形菌类群广泛存在于是循环水健康养殖池及一些鱼类的皮肤、腮、肠道中(Roeselers et al, 2011), 且丰度越高越有利于养殖动物的健康生长(Hu et al, 2007; Schreier et al, 2010)。此外我们研究发现在海域中大多数的弧菌属都来源于纬度最高的G04, 而弧菌属多数属于与鱼病有关的病原菌或条件致病菌, 因此推测是随着纬度的上升, 海域中γ-变形菌纲流动性在增高, 其他致病细菌丰度也在增加; 之后我们在对各取样点细菌群落组成结构分析中, 得到在G09中假交替单胞菌的丰度最高、弧菌丰度较低的结果; 在G04中弧菌丰度最高, 假交替单胞菌最低, 这与杨行等(2019)研究得出的假交替单胞菌对弧菌的抑制作用有关结果一致。
α-变形菌纲中主要是红细菌, 红细菌科在经度较高的G11和G06中占比最高, 同时G11和G06中拟杆菌门和放线菌门的丰度在下降, 这些红细菌能够通过光合作用进行生长代谢, 涉及CO2和氮的固定的菌较多。在海洋生态系统的碳、氮循环中发挥重要作用(白洁等, 2009), 因此我们推测, 在G11和G06的海水光照充足, 利于红细菌进行光合作用, 所以红细菌丰度变高; 同时也有研究表明变形菌门在土壤中的C、N和S循环中起着关键作用(Wang et al, 2020), 而α-变形菌的相对丰度随水体中总磷浓度增加而增加, 拟杆菌门的相对丰度随磷酸盐的浓度升高而增加(沈燕等, 2010)。拟杆菌门、放线菌门和γ-变形菌纲的丰度对水质变化敏感, 可用于指示和评价海水养殖污染的生态效应(Xiong et al, 2014)。因此推测在G04、G11和G06取样点周围水环境污染相对严重一些, 可能由于其靠近海岸, 而人类活动是引起水体细菌群落结构变化的主要原因之一(虞嘉玥等, 2021)。
通过对细菌种水平的分析, 我们发现大西洋美女神菌丰度在G04取样点中较高, 其次是在G11中; 该属在结构组成上与海螺菌科的海螺菌属非常接近, 是一种典型的海洋细菌, 对钠盐有专性需求, 并且是一类有机物降解菌(Gärtner et al, 2008)。大西洋美女神菌在除G04和G11以外的其他取样点中分布很少, 同时G04和G11所处位置的纬度高于其他取样点, 且G04略高于G11; 结合对PCA图的分析发现, G04的细菌组成与其他取样点的细菌组成差异较大, 因此推测造成这种分布现象的可能原因是G04的纬度、钠盐含量和有机物含量明显高于其他5个取样点。柱状黄杆菌(Flavobacterium columnare)属于黄杆菌科、黄杆菌属, 广泛存在于淡水、海水、土壤和植物中, 在世界范围内的水体环境和土壤中均有分布, 可导致被感染鱼类出现烂鳃、体表溃疡等症状(张玉蕾等, 2016)。在G12中黄杆菌科丰度较高但弧菌丰度很低, 在G04中弧菌丰度较高, 但是黄杆菌丰度较低; 推测可能在经纬度都相对比较低的海域, 黄杆菌数量也随之增多; 并且分析对比其他取样点弧菌和黄杆菌的丰度变化情况推测, 黄杆菌和弧菌之间可能存在某种相互作用, 初步推测两者之间可能存在拮抗作用。若要在该范围水域进行养殖, 需先对黄杆菌数量进行处理, 否则可能会导致鱼类死亡。
4 结论综上所述, 利用高通量测序对象山港海域6个不同水域细菌的群落结构和多样性进行分析比较, 发现变形菌门和蓝细菌门是象山港水域3月份的两个优势类群, 其次是放线菌门和厚壁菌门。推测在经纬度都相对比较低的海域黄杆菌数量增多, 黄杆菌和弧菌之间可能存在某种相互作用。后续可根据这一发现对细菌间的相互抑制作用进行深入研究; 并且本研究同时也进一步证明弧菌属和假交替单胞菌属之间的相互抑制作用, 可为象山港生物防治和水环境保护等提供参考。今后应考虑季节和人为因素, 有助于更深入了解不同生境下象山港细菌结构的变化规律。
白洁, 李海艳, 赵阳国, 2009. 黄海北部不同站位海洋细菌群落分布特征. 微生物学报, 49(3): 343-350 DOI:10.3321/j.issn:0001-6209.2009.03.010 |
江志兵, 朱旭宇, 高瑜, 等, 2013. 象山港春季网采浮游植物的分布特征及其影响因素. 生态学报, 33(11): 3340-3350 |
李秋芬, 有小娟, 张艳, 等, 2013. 象山港中部养殖区细菌群落结构的特征及其在生境修复过程中的变化. 中国水产科学, 20(6): 1234-1246 |
杨行, 章翔, 龙昊, 等, 2019. 假交替单胞菌对哈维氏弧菌拮抗作用初探. 水产科学, 38(6): 833-838 |
吴燕妮, 李冬玲, 叶林安, 等, 2017. 象山港海域水质与沉积物主要污染因子及污染源分析. 海洋环境科学, 36(3): 328-335 |
沈燕, 高光, 汤祥明, 等, 2010. 用FISH技术检测太湖梅梁湾水体中细菌优势种群在冬夏两季的变化. 湖泊科学, 22(1): 57-62 |
张玉蕾, 赵丽娟, 周伟东, 等, 2016. 黄颡鱼源柱状黄杆菌的分离鉴定及其对翘嘴鳜的致病性. 华中农业大学学报, 35(2): 83-89 |
胡常巨, 熊金波, 陈和平, 等, 2015. 象山港网箱养殖区与非养殖区的细菌群落分布. 生态学报, 35(24): 8053-8061 |
黄莹, 秦纹静, 戴红, 等, 2020. 马里亚纳海沟不同深度水样微生物分离与多样性分析. 微生物学通报, 47(9): 2720-2731 |
童晨, 李加林, 黄日鹏, 等, 2018. 陆源污染生态损害评估及其补偿标准研究——以象山港为例. 海洋通报, 37(6): 685-694 |
虞嘉玥, 姜亚洲, 孙鹏, 等, 2021. 象山港海域不同生境细菌群落结构与多样性. 生态学杂志, 40(9): 2842-2849 |
GÄRTNER A, WIESE J, IMHOFF J F, 2008. Amphritea atlantica gen. nov., sp. nov., a gammaproteobacterium from the Logatchev hydrothermal vent field. International Journal of Systematic and Evolutionary Microbiology, 58(1): 34-39 DOI:10.1099/ijs.0.65234-0 |
HAN Q X, WANG Y Q, ZHANG Y, et al, 2013. Effects of intensive scallop mariculture on macrobenthic assemblages in Sishili Bay, the northern Yellow Sea of China. Hydrobiologia, 718(1): 1-15 DOI:10.1007/s10750-013-1590-x |
HU Z Y, LI Y, 2007. Pseudidiomarina sediminum sp. nov., a marine bacterium isolated from coastal sediments of Luoyuan Bay in China. International Journal of Systematic and Evolutionary Microbiology, 57(11): 2572-2577 DOI:10.1099/ijs.0.65199-0 |
ROESELERS G, MITTGE E K, STEPHENS W Z, et al, 2011. Evidence for a core gut microbiota in the zebrafish. The ISME Journal, 5(10): 1595-1608 DOI:10.1038/ismej.2011.38 |
SCHREIER H J, MIRZOYAN N, SAITO K, 2010. Microbial diversity of biological filters in recirculating aquaculture systems. Current Opinion in Biotechnology, 21(3): 318-325 DOI:10.1016/j.copbio.2010.03.011 |
WANG P, CHEN B, YUAN R, et al, 2016. Characteristics of aquatic bacterial community and the influencing factors in an urban river. Science of the Total Environment, 569/570: 382-389 DOI:10.1016/j.scitotenv.2016.06.130 |
WANG Y Z, XU X M, LIU T M, et al, 2020. Analysis of bacterial and fungal communities in continuous-cropping ramie (Boehmeria nivea L. Gaud) fields in different areas in China. Scientific Reports, 10(1): 3264 DOI:10.1038/s41598-020-58608-0 |
XIONG J B, YE X S, WANG K, et al, 2014. Biogeography of the sediment bacterial community responds to a nitrogen pollution gradient in the East China Sea. Applied and Environmental Microbiology, 80(6): 1919-1925 DOI:10.1128/AEM.03731-13 |
 2022, Vol. 53
2022, Vol. 53


