中国海洋湖沼学会主办。
文章信息
- 张佳谊, 杨蕾, 陈一, 王爱民, 战欣. 2022.
- ZHANG Jia-Yi, YANG Lei, CHEN Yi, WANG Ai-Min, ZHAN Xin. 2022.
- 企鹅珍珠贝矿化基因表达模式和贝壳超微结构对珍珠质层颜色影响的研究
- EFFECT OF GENE EXPRESSIONS AND SHELL ULTRASTRUCTURE ON THE COLOR OF NACREOUS LAYER IN PTERIA PENGUIN
- 海洋与湖沼, 53(1): 113-119
- Oceanologia et Limnologia Sinica, 53(1): 113-119.
- http://dx.doi.org/10.11693/hyhz20210600146
文章历史
-
收稿日期:2021-06-24
收修改稿日期:2021-08-18
2. 海南大学海洋学院 海南海口 570228
2. College of Marine Science, Hainan University, Haikou 570228, China
企鹅珍珠贝(Pteria penguin)是一种广泛分布于热带和亚热带海区的海洋双壳贝类, 在我国广东、海南等省主要用于生产附壳珍珠。贝壳是由外套膜分泌形成的, 贝壳的珍珠质层是具有彩虹光泽的内部生物矿物层, 与大珠母贝(Pinctada maxima)和马氏珠母贝(Pinctada fucata)相同, 企鹅珍珠贝贝壳珍珠质层内表面也呈现明显的颜色分区, 在靠近贝壳外缘的珍珠质层(以下称生长区)呈现绿色、古铜色等混合颜色, 而在贝壳内表面中心区域(以下称中心区)呈白色(蒙钊美, 1996; 陈明强等, 2020)。企鹅珍珠贝等育珠母贝在进行珍珠培育时, 将贝的外套膜远端膜区(分泌生长区珍珠质层的外套膜)切成小片, 插入育珠母贝体内, 进行珍珠培育。研究发现, 小片培育的珍珠与小片所在贝的贝壳生长区颜色相同, 此贝壳生长区珍珠质层颜色的形成原因一直受到广泛关注。目前关于珍珠质层颜色的理论主要有金属元素致色假说(杨明月等, 2004; 姜琦等, 2019)、类胡萝卜素致色假说(Urmos et al, 1991; 闻海波等, 2012; 李西雷等, 2018)、有机质大分子致色假说(孔蓓等, 2002; 张妮等, 2004; 李耿等, 2007; 李雪英等, 2007; 严俊等, 2011, 2013)等, 但是目前尚无定论。
企鹅珍珠贝中心区曾经是其生长区, 即中心区在由生长区变为中心区的过程中, 其颜色也逐渐由彩色变为白色。因此, 研究生长区和中心区不同颜色形成的机理, 不仅可以研究贝壳珍珠质层颜色变化的机理, 同时也可以为珍珠质层颜色形成机理的研究提供理论参考。企鹅珍珠贝的贝壳分为三层, 由文石板片构成的珍珠质层位于贝壳内侧, 由方解石构成的棱柱层位于贝壳的中间, 贝壳表面为角质层(Kinoshita et al, 2011)。矿化基因在外套膜表达, 调节外套膜的蛋白质分泌活动, 外套膜分泌的蛋白质形成生物矿物框架并调节碳酸钙的成核和生长(Sarashina et al, 2006; Marin et al, 2007), 调控无定形碳酸钙转化为文石或方解石(Weiss et al, 2002; Addadi et al, 2003; Gehrke et al, 2005), 进而形成珍珠质层和棱柱层。珍珠质层和棱柱层中存在多种基质蛋白, 比如MSI60、N16家族, nacrein等, 基质蛋白最主要的功能是诱导并调控碳酸钙晶体的晶体形状与类型(Marin et al, 2007; Marin, 2012), 甚至可以调控贝壳形成的整个生物矿化过程(Miyamoto et al, 1996; Kong et al, 2009)。因此生物矿化基因可以通过调控基质蛋白影响碳酸钙晶体的结构与方向, 从而使珍珠质层呈现出各种颜色(刘晓丽, 2015)。一般情况下, 外套膜的边缘膜区形成棱柱层, 远端膜区和中央膜区分别形成贝壳珍珠质层的生长区和中心区。贝壳的内部珍珠质层由多边形文石板片组成, 文石板片通过薄的有机夹层附着在片状结构上, 形成“砖浆”的微结构。在贝壳的形成期间, 角质层先形成贝壳的外表面, 随后形成棱柱层, 最后珍珠质层在棱柱层上面形成(Crenshaw, 1972; Kawaguchi et al, 1993)。
前人研究认为由于企鹅珍珠贝贝壳生长区和中心区文石板片厚度不同, 导致珍珠质层呈现颜色差异, 由此我们推测: 由于贝壳中心区曾经是生长区, 因此, 其靠近棱柱层位置的文石板片厚度应与生长区文石板片厚度相似、与靠近贝壳内表面的文石板片厚度应呈显著差异, 而分泌中心区和生长区的外套膜中央膜区和远端膜区中矿化基因的表达模式也应呈显著差异。因此, 我们检测9个矿化基因在企鹅珍珠贝外套膜两个区域的表达模式及贝壳两个区域表面的超微结构和贝壳纵断面4个位置文石板片厚度的差异, 进而研究贝壳中心区和生长区颜色形成的机理。
1 材料与方法 1.1 实验材料实验用企鹅珍珠贝采集自海南海昌虾苗繁育基地, 按照Elisabeth Strack的划分标准, 采集6个企鹅珍珠贝的外套膜远端膜区和中央膜区, -20 ℃保存于RNA贮存液(Takara, 大连)中, 同时将其贝壳用清水冲刷数次, 除去表面污垢, 去除内部组织后, 用去离子水冲洗数次, 室温下自然晾干, 用于贝壳结构观察。
1.2 总RNA提取及cDNA合成采用TRIzol试剂(ThermoFisher Scientific, USA), 根据说明书进行6个个体外套膜远端膜区和中央膜区总RNA的提取, 利用1%琼脂糖凝胶电泳法检测其完整性, 用微量分光光度计(NanoDrop 2000, Thermo Scientific, USA)检测其浓度和质量。以提取的总RNA为模板, 按照PrimeScriptTM RT reagent Kit with gDNA Eraser(Takara, 大连)说明书进行逆转录, 得到cDNA。
1.3 组织荧光定量分析检测反转录后的cDNA产物浓度, 并稀释至100 ng/μL, 选取9个矿化基因特异性引物(表 1), 由铂尚生物技术公司合成。以Li等(2017)在实验中所用的β-actin基因为内参基因, 使用QuantStudioTM 6 Flex Real-Time PCR扩增仪按照TB Green ® Premix Ex Taq TM (Takara, 大连)的使用说明进行实时荧光定量PCR扩增反应, 反应体系为20 μL, TB Green Premix Ex Taq 10 μL, 上下游引物各0.4 μL (10 μmol/L), cDNA模板1 μL, ddH2O 8.2 μL, 反应程序为95 ℃预变性30 s; 95 ℃变性5 s, 52 ℃退火30 s, 循环40次; 融解曲线反应程序为95 ℃ 15 s, 60℃ 1 min, 95 ℃ 15 s。以β-actin基因为内参, 以外套膜远端膜区为对照, 运用公式2-ΔΔCt计算各基因的相对表达量, 公式中ΔΔCt=(Ct目的基因 - Ct内参基因)中央膜区- (Ct目的基因 - Ct内参基因)远端膜区。运用Excel进行T检验, 对实验数据进行统计学分析, P < 0.05表示差异显著, 用Excel软件作图。
| 基因 | 引物名称 | 引物序列(5′~3′) |
| Chitin synthase | Chitin-F | CTGAGCCCGGATCTTGTAGG |
| Chitin-R | TCTTGTCACGGTGGGAGTTG | |
| Chitinase | Chitinase-F | ACTGGGATGATCCACTACAA |
| Chitinase-R | GTAATCAGAGCCTGGACCTA | |
| Nacrein | Nacrein-F | AGAAACCTGCACATTCATCG |
| Nacrein-R | CTGGCAACCTCAAGAAATACAC | |
| Shematrin-1 | Shematrin-1-F | TCATCAACTCAAACTTACAGGGTC |
| Shematrin-1-R | CGATAGGTCCAGTTCCCAAG | |
| MSI60-related gene | MSI60-F | CAAGTCTCCTCCCGAAGAAC |
| MSI60-R | AGCATCAGCTAGGGCTCAAC | |
| Mantle gene 3 | Mantle3-F | GAGGCTGTTTCGCTCGTTGGTT |
| Mantle3-R | CGTCACTGGTGTAAGGGTTCCC | |
| Aspein | Aspein-F | CAAGCTCATTTGTGGTTTTATC |
| Aspein-R | TGTCGTCACTCATTTCGGTATC | |
| N16 | N16-F | TGCATCTCAGTTTAATTTTACG |
| N16-R | TTATTGCTCTCGGTTGTCTCTT | |
| Tyr | Tyr-F | GTTTGGTAATGGCAGAGGGTC |
| Tyr-R | TCGATAAAGGTATGGTGGAACC | |
| β-actin | β-actin-F | CGGTACCACCATGTTCTCAG |
| β-actin-R | GACCGGATTCATCGTATTCC |
企鹅珍珠贝珍珠质层光学照片如图 1所示, 贝壳经机械破碎, 取颜色各异的生长区与中心区碎片若干, 贝壳碎片纵截面如图 1右下角插图所示, 上方黑色层为棱柱层, 下方白色层为珍珠质层, A、B表示电镜观察位置, A为靠近棱柱层的文石层, B为靠近珍珠质层内表面的文石层。生长区的观察区域为G-A、G-B, 中心区的观察区域为C-A、C-B, 每个贝壳碎片分别观察生长区和中心区的内表面及纵断面的上述四个区域。制作完成的贝壳碎片样品置于去离子水中超声清洗8 min, 室温下自然晾干, 对贝壳珍珠质层表面及纵断面进行镀金处理, 采用场发射扫描电子显微镜进行观察, 仪器型号为Thermoscientific Verios G4 UC, 加速电压10-20kV。
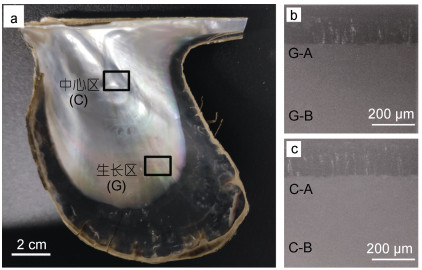 |
| 图 1 (a) 企鹅珍珠贝贝壳内表面珍珠质层光学照片; (b) 生长区纵断面; (c) 中心区纵断面 Fig. 1 (a) Optical photos of the nacreous layer of Pteria Penguin; (b) Longitudinal section of growth area; (c) Longitudinal section of central area 注: G和C分别表示生长区和中心区; A和B表示电镜观察位置 |
采用Image J软件测量贝壳G-A、G-B、C-A、C-B四个区域文石板片的厚度(图 1), 数据以平均值±标准差表示, 用Excel软件进行T检验, P < 0.05表示差异显著。
2 实验结果 2.1 矿化基因在外套膜不同区域的表达模式荧光定量PCR结果显示, 除N16外, 其他8个矿化基因在企鹅珍珠贝外套膜远端膜区和中央膜区的表达量均具有显著差异, 其中Nacrein和MSI60-related gene在中央膜区的表达量显著高于远端膜区, 而Chitin synthase、Chitinase、Shematrin-1、Mantle gene 3、Aspein、Tyr在中央膜区的表达量显著低于远端膜区(图 2)。
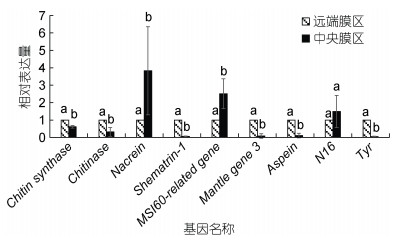 |
| 图 2 9个生物矿化基因表达模式 Fig. 2 Nine biomineralized genes expression patterns 注: 柱上不同字母表示各组织间的表达量存在显著差异(P < 0.05) |
图 3为企鹅珍珠贝贝壳生长区与中心区内表面的扫描电镜图, 可见生长区内表面成熟文石板片较多, 形状较规则, 呈近似六边形, 边缘平整, 且排列整齐, 局部放大可见文石板片的堆叠以及未成形的文石板片晶体; 中心区内表面成熟文石板片较少, 边缘模糊。
 |
| 图 3 珍珠质层内表面扫描电镜图 Fig. 3 The scanning electron microscope images of the shell nacreous layer 注: a: 生长区; b: 中心区 |
采用ImageJ软件测量珍珠质层纵断面中文石板片的厚度(图 4), 结果表明, 贝壳4个区域的文石板片平均厚度之间存在显著性差异, C-A > G-A > G-B > C-B (P < 0.05)(表 2)。其中, 中心区靠近棱柱层的C-A区文石板片厚度最大, 为(0.50±0.13) μm。而且, 不论是中心区还是生长区, 靠近棱柱层(A位置)的文石板片厚度均显著大于B位置(P < 0.05)。
 |
| 图 4 内壳珍珠质层纵断面不同区域扫描电镜图 Fig. 4 The scanning electron microscope images of longitudinal section of the shell nacreous layer 注: a: G-A区; b: C-A区; c: G-B区; d: C-B区 |
| 区域 | 生长区(G区) | 中心区(C区) |
| A | 0.43 ± 0.08 | 0.51 ± 0.11 |
| B | 0.34 ± 0.06 | 0.31 ± 0.06 |
9个检测的矿化基因中, 8个基因的表达模式在企鹅珍珠贝外套膜中央区域和远端膜区存在显著差异(P < 0.05)。其中2个基因Nacrein和MSI60在外套膜中央膜区的表达量显著高于远端膜区, Miyamoto等(1996)在1996年发现Nacrein在外套膜中央膜区表达水平较高, 而在与棱柱层形成有关的外褶中几乎不表达; 在2005年发现Nacrein在马氏珠母贝的外套膜上皮细胞中表达量较高, 通过抑制CaCO3的沉淀, 在贝壳和外套膜之间的膜外空间的钙化中发挥负调控作用, 在钙质棱柱层和文石珍珠质层的形成中都起着重要作用(Miyamoto et al, 2005)。MSI60是参与贝壳珍珠质层形成的蛋白之一, Takeuchi等(2006)在2005年发现其在马氏珠母贝外套膜的中央膜区表达量较高。另外5个基因包括Chitin synthase、Chitinase、Shematrin-1、Mantle gene 3、Aspein、Tyr在外套膜中央膜区的表达量显著低于远端膜区, 几丁质是β-(1-4)连接的N-乙酰葡萄糖胺的线性聚合物, 是仅次于纤维素的第二丰富的天然高分子多糖, 是软体动物贝壳和珍珠质层形成的关键成分; Chitin synthase在外套膜上皮细胞中表达, 是几丁质合成过程中的关键酶, 而Chitinase则是最大的几丁质水解酶类之一, 能将几丁质分解成N-乙酰葡糖胺。Levi-Kalisman等(2001)利用冷冻透射显微镜研究Atrina serrata的珍珠质层结构时发现, 文石层间的片层主要是由高度有序排列的β-几丁质纤维组成; 另外Zhan等(2020)在2020年发现在企鹅珍珠贝珍珠质层的生长区与中心区, Na、Mg、P、B、Li、Mo几种元素的分布水平具有显著性差异, 他们认为这与两个区域的颜色差异有关; 因此我们推测Chitin synthase和Chitinase通过调控几丁质的合成与分解来调控珍珠质层中有机基质的形成, 而不同区域的有机基质又与不同种类的元素相结合, 从而导致企鹅珍珠贝内部珍珠质层生长区与中心区的颜色变化。Yano等(2006)在2006年发现Shematrin-1只在马氏珠母贝的外套膜中表达, 特别是在外套膜的远端膜区, 许多shematrins在外套膜边缘合成, 并分泌到外壳的棱柱层, 在一定程度上决定了贝壳的韧性。Mantle gene 3是一种碱性蛋白, Wang等(2011)在2011年发现其在马氏珠母贝外套膜的远端膜区特异性表达, 并能促进碳酸钙晶体在体外的形成, 在贝壳生物矿化中起着重要作用。Aspein是一种酸性壳基质蛋白, 2012年, Isowa等(2012)发现其在棱柱层中方解石的沉淀过程中起重要作用, 仅在外套膜的远端膜区表达, 并在近缘物种大珠母贝、企鹅珍珠贝中发现了其同源物。Tyr在远端膜区的表达水平较高, Yu等(2018)发现其在企鹅珍珠贝黑色素合成和珍珠质层颜色形成中起着关键作用。本文的荧光定量结果与马氏珠母贝和大珠母贝等的研究结果基本一致。因此我们推测上述矿化基因的表达差异从分子水平上导致了生长区与中心区颜色的差异。
由扫描电镜图得知, 企鹅珍珠贝贝壳的超微结构与大珠母贝、马氏珠母贝类似, 具有典型的文石板片和有机基质通过周期性堆叠形成的层状结构。由于受到扫描电子显微镜视域的影响, 同一区域文石板片厚度较均一。通过分析表 2中文石板片平均厚度可知, 无论是在生长区还是中心区, 靠近棱柱层的文石板片平均厚度显著大于靠近内表面的文石板片平均厚度; 生长区靠近棱柱层的文石板片平均厚度小于中心区, 但靠近内表面的文石板片平均厚度却大于中心区。首先, 这表明在生长区和中心区, 沿棱柱层至贝壳内表面的方向, 文石板片呈现逐渐变薄的趋势; 而且, 中心区靠近棱柱层的文石板片应为此区过去作为生长区时形成的, 但是中心区靠近棱柱层的文石板片厚度显著大于生长区靠近棱柱层和靠近内表面的文石板片厚度, 说明文石板片厚度很可能与贝壳珍珠质层颜色无关, 这与Zhang等(2016)的研究结果存在差异, 我们认为文石板片厚度与贝壳珍珠质层分泌的早晚有关, 在检测的四个区域中, 分泌的越早, 文石板片厚度越大。
4 结论本研究测定9个矿化基因在企鹅珍珠贝外套膜远端膜区和中央膜区的表达水平, 其中8个矿化基因在上述两个区域的表达量具有显著差异(P < 0.05), 因此矿化基因的表达差异可能从分子水平导致贝壳珍珠质层内表面生长区与中心区颜色的差异。生长区和中心区表面的超微结构和纵断面文石板片厚度均存在显著差异(P < 0.05), 但该差异与生长区和中心区的颜色差异并无显著联系, 我们认为贝壳珍珠质层分泌的早晚影响文石板片的厚度。
孔蓓, 邹进福, 陈积光, 等. 2002. 海水养殖珍珠表层微形貌的结构研究-以广西防城养殖珍珠为例. 矿产与地质, 16(6): 342-345 DOI:10.3969/j.issn.1001-5663.2002.06.005 |
刘晓丽, 2015. 马氏珠母贝外套膜不同区域差异矿化基因的克隆及功能研究[D]. 湛江: 广东海洋大学: 3-4.
|
李西雷, 李卿青, 朱庭耀, 等. 2018. 添加类胡萝卜素对三角帆蚌总类胡萝卜素含量及贝壳珍珠质颜色的影响. 上海海洋大学学报, 27(4): 477-486 |
张妮, 郭继春, 张学云, 等. 2004. 珍珠表面微形貌的AFM和SEM研究. 岩石矿物学杂志, 23(4): 370-374 DOI:10.3969/j.issn.1000-6524.2004.04.012 |
杨明月, 郭守国, 史凌云, 等. 2004. 淡水养殖珍珠的化学成分与呈色机理研究. 宝石和宝石学杂志, 6(2): 10-13 DOI:10.3969/j.issn.1008-214X.2004.02.004 |
陈明强, 魏海军, 李有宁, 等. 2020. 企鹅珍珠贝F3选育系的珍珠层颜色及生长性状的比较分析. 南方农业学报, 51(3): 659-668 DOI:10.3969/j.issn.2095-1191.2020.03.024 |
严俊, 张刚生. 2011. 褶纹冠蚌贝壳结构特征及其珍珠层呈色机制研究. 安庆师范学院学报(自然科学版), 17(3): 83-85 DOI:10.3969/j.issn.1007-4260.2011.03.023 |
严俊, 胡仙超, 王巨安, 等. 2013. 不同颜色的淡水养殖珍珠呈色机理研究. 岩矿测试, 32(2): 263-268 DOI:10.3969/j.issn.0254-5357.2013.02.014 |
李耿, 林瓴, 沙拿利, 等. 2007. 淡水养殖珍珠的光泽、颜色与有机质关系初探. 桂林工学院学报, 27(4): 569-571 DOI:10.3969/j.issn.1674-9057.2007.04.025 |
李雪英, 王海增, 孙省利, 等. 2007. 不同颜色珍珠的傅里叶变换红外光谱和石墨炉原子吸收光谱分析. 宝石和宝石学杂志, 9(1): 15-18 DOI:10.3969/j.issn.1008-214X.2007.01.005 |
闻海波, 聂志娟, 曹哲明, 等. 2012. 不同颜色珍珠层的三角帆蚌组织中类胡萝卜素含量的分析. 大连海洋大学学报, 27(3): 265-268 DOI:10.3969/j.issn.1000-9957.2012.03.015 |
姜琦, 白志毅, 孙朝虎. 2019. 三角帆蚌所育不同颜色珍珠及其相关组织金属元素种类和含量差异分析. 上海海洋大学学报, 28(6): 882-889 |
蒙钊美, 李有宁, 邢孔武. 1996. 珍珠养殖理论与技术. 北京: 科学出版社, 39-40
|
ADDADI L, RAZ S, WEINER S, 2003. Taking advantage of disorder: amorphous calcium carbonate and its roles in biomineralization. Advanced Materials, 15(12): 959-970 DOI:10.1002/adma.200300381 |
CRENSHAW M A, 1972. The inorganic composition of molluscan extrapallial fluid. The Biological bulletin, 143(03): 506-512 DOI:10.2307/1540180 |
GEHRKE N, NASSIF N, PINNA N et al, 2005. Retrosynthesis of nacre via amorphous precursor particles. Chemistry of Materials, 17(26): 6514-6516 DOI:10.1021/cm052150k |
ISOWA Y, SARASHINA I, SETIAMARGA D H E et al, 2012. A comparative study of the shell matrix protein aspein in pterioid bivalves. Journal of Molecular Evolution, 75(1/2): 11-18 |
KAWAGUCHI T, WATABE N, 1993. The organic matrices of the shell of the American oyster Crassostrea virginica Gmelin. Journal of Experimental Marine Biology and Ecology, 170(1): 11-28 DOI:10.1016/0022-0981(93)90126-9 |
KINOSHITA S, WANG N, INOUE H et al, 2011. Deep sequencing of ESTs from nacreous and prismatic layer producing tissues and a screen for novel shell formation-Related genes in the pearl oyster. PLoS One, 6(6): e21238 DOI:10.1371/journal.pone.0021238 |
KONG Y W, JING G, YAN Z G et al, 2009. Cloning and characterization of Prisilkin-39, a novel matrix protein serving a dual role in the prismatic layer formation from the oyster Pinctada fucata. Journal of Biological Chemistry, 284(16): 10841-10854 DOI:10.1074/jbc.M808357200 |
LEVI-KALISMAN Y, FALINI G, ADDADI L et al, 2001. Structure of the Nacreous Organic Matrix of a Bivalve Mollusk Shell Examined in the Hydrated State Using Cryo-TEM. Journal of Structural Biology, 135(1): 8-17 DOI:10.1006/jsbi.2001.4372 |
LI H M, LIU B S, HUANG G J et al, 2017. Characterization of transcriptome and identification of biomineralization genes in winged pearl oyster (Pteria penguin) mantle tissue. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 21: 67-76 DOI:10.1016/j.cbd.2016.12.002 |
MARIN F, 2012. The formation and mineralization of mollusk shell. Front Biosci, 4(3): 1099-1125 |
MARIN F, LUQUET G, MARIE B et al, 2007. Molluscan Shell Proteins: Primary Structure, Origin, and Evolution. Current Topics in Developmental Biology, 80: 209-276 |
MIYAMOTO H, MIYASHITA T, OKUSHIMAT M et al, 1996. A carbonic anhydrase from the nacreous layer in oyster pearls. Proceedings of the National Academy of Sciences of the United States of America, 93(18): 9657-9660 DOI:10.1073/pnas.93.18.9657 |
MIYAMOTO H, MIYOSHI F, KOHNO J, 2005. The carbonic anhydrase domain protein nacrein is expressed in the epithelial cells of the mantle and acts as a negative regulator in calcification in the mollusc Pinctada fucata. Zoological Science, 22(3): 311-315 DOI:10.2108/zsj.22.311 |
SARASHINA I, ENDO K, 2006. Skeletal matrix proteins of invertebrate animals: comparative analysis of their amino acid sequences. Paleontological Research, 10(4): 311-336 DOI:10.2517/prpsj.10.311 |
TAKEUCHI T, ENDO K, 2006. Biphasic and dually coordinated expression of the genes encoding major shell matrix proteins in the pearl oyster Pinctada fucata. Marine Biotechnology, 8(1): 52-61 DOI:10.1007/s10126-005-5037-x |
URMOS J, SHARMA S K, MACKENZIE F T, 1991. Characterization of some biogenic carbonates with Raman spectroscopy. American Mineralogist, 76(3/4): 641-646 |
WANG X Y, LIU S F, XIE L P et al, 2011. Pinctada fucata mantle gene 3 (PFMG3) promotes differentiation in mouse osteoblasts (MC3T3-E1). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 158(2): 173-180 DOI:10.1016/j.cbpb.2010.11.004 |
WEISS I M, TUROSS N, ADDADI L et al, 2002. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology, 293(5): 478-491 DOI:10.1002/jez.90004 |
YANO M, NAGAI K, MORIMOTO K et al, 2006. Shematrin: a family of glycine-rich structural proteins in the shell of the pearl oyster Pinctada fucata. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 144(2): 254-262 DOI:10.1016/j.cbpb.2006.03.004 |
YU F F, PAN Z N, QU B L et al, 2018. Identification of a tyrosinase gene and its functional analysis in melanin synthesis of Pteria penguin. Gene, 656: 1-8 DOI:10.1016/j.gene.2018.02.060 |
ZHAN X, WEI H J, JIE Y et al, 2020. Variation of element concentration in nacreous marginal area and central area of Pteria penguin shell. Journal of Shellfish Research, 39(3): 679-682 |
ZHANG W G, ZHANG G S, 2016. Dynamic structural color from the one-dimensional photonic structure in the nacre of Pteria Penguin. Optik, 127(18): 7162-7166 DOI:10.1016/j.ijleo.2016.05.060 |
 2022, Vol. 53
2022, Vol. 53


