中国海洋湖沼学会主办。
文章信息
- 叶文琪, 刘诚刚, 蔡昱明, 翟红昌, 乐凤凤, 王斌, 寿鹿, 陈全震, 杜萍. 2022.
- YE Wen-Qi, LIU Cheng-Gang, CAI Yu-Ming, ZHAI Hong-Chang, LE Feng-Feng, WANG Bin, SHOU Lu, CHEN Quan-Zhen, DU Ping. 2022.
- 黄东海浮游生物群落呼吸率对碳平衡的重要性
- THE IMPORTANCE OF PLANKTON COMMUNITY RESPIRATION RATE TO CARBON FLUX BALANCE IN THE YELLOW AND EAST CHINA SEA
- 海洋与湖沼, 53(1): 84-95
- Oceanologia et Limnologia Sinica, 53(1): 84-95.
- http://dx.doi.org/10.11693/hyhz20210600139
文章历史
-
收稿日期:2021-06-18
收修改稿日期:2021-08-08
工业革命以来, 人类活动产生的大量CO2导致温室效应加剧, 促使全球气候变暖。海洋作为重要的碳汇, 每年吸收约2.5 pg人为排放CO2, 占全球排放的30%左右, 对控制气候变化至关重要(Khatiwala et al, 2009; García-Martín et al, 2019)。海洋对CO2的固定主要通过生物碳泵介导: 浮游植物和光合细菌通过光合作用吸收CO2形成颗粒有机碳(POC); 同时海洋生物通过呼吸作用分解POC, 两个过程差额的POC沉降到深海即为生物泵(Sigman et al, 2000)。
尽管陆架仅覆盖全球海表面积的8%, 但其在全球碳循环中扮演着重要的角色(Sverdrup et al, 1942)。由于具有较高的初级生产力, 以及接受大量陆源有机碳, 陆架海区被认为是潜在的有机碳汇(Walsh et al, 1981; Moran et al, 1991; Walsh, 1991)。然而, 地质资料显示, 陆架沉积物中并没有发现较高的有机碳含量(de Haas et al, 2002)。Borges (2005)研究揭露了沿岸和陆架区域很可能是净异养状态, 或表现为大气CO2的源, 尤其是在低生产力区域。这说明海洋生物的呼吸作用能够很大程度影响海洋有机碳代谢平衡, 在碳循环中起着重要作用。海洋浮游生物群落呼吸率(plankton community respiration, PCR)是指浮游动物、植物和浮游细菌等浮游生物组成的群落在单位时间内完成的呼吸作用所消耗的有机碳量, 表征群落代谢水平及其对有机物质的消耗能力(Calbet et al, 2004)。PCR结合总初级生产力(gross primary production, GPP), 可描述和评价生物群落在海洋吸收或释放大气CO2中的作用(Ducklow et al, 2013)。当生态系统的生产量高于消耗量时, 表现为净自养状态; 而当消耗量高于生产量时, 表现为净异养状态。
生态系统的自养或异养状态(基于有机碳)与海区CO2的碳源汇性质有关。Smith等(1993)对1961~1991年间西北大西洋的沿岸陆架区域的净生态系统生产力的研究进行统计得到, 沿岸西北大西洋陆架生态系统总体呈现为异养状态, 且为大气CO2的源; Gattuso等(1998)在东北大西洋的沿岸陆架区域的多航次(主要包括LOISE、ELOISE)研究结果显示, 东北大西洋沿岸等陆架生态系统为净自养状态, 且为大气CO2的汇。但由于海气CO2通量是由海气界面CO2压力梯度驱动的, 受多种环境因素影响, 生态系统营养状态并不能与海气CO2通量完全对应, 例如上升流海域是净自养状态, 但却是大气CO2的源, 这是由于上升流中海洋CO2分压高于平均大气CO2分压(Gattuso et al, 1998)。
黄东陆架海作为世界上最典型的陆架海之一, 其碳平衡对全球碳通量有重要意义。黄东海是世界最大陆架之一, 同时受到黑潮、长江冲淡水、江苏沿岸流、浙闽沿岸流和台湾暖流等水团影响(Chen et al, 1999; Wang et al, 2000), 具有多变的季节和空间碳源/汇格局。黄东海海气CO2通量的研究认为, 黄海总体表现为碳汇, 吸收CO2约1.15 Tg C/a, 东海春、夏、冬季为碳汇, 秋季为碳源, 吸收CO2约6.92~23.30 Tg C/a (焦念志等, 2018; 宋金明等, 2018); 空间上, 夏、冬季表层海水CO2分压(pCO2)西高东低, 春、秋季空间变化剧烈(曲宝晓等, 2013)。但黄东海海气CO2源汇性质及通量存在明显的季节变化, 且易受到人类活动的影响。如夏季东海海水受到较强的物理扰动时, 仍然可能成为CO2源; 又如近海富营养化加剧、三峡工程的运行可能导致东海冬季碳汇量减少、秋季碳源汇格局转变。黄东海海气CO2源汇性质及通量与营养状态的关系还不明确, 宋金明等(2018)认为碳源汇性质的季节和水层间变化受生物活动影响较大。Chen等(2003, 2006)分别于1998年11月和2003年6、8月对东海陆架海域浮游生物群落呼吸率进行调查研究, 结果表明东海陆架生态系统表现为净异养状态。但目前关于一年四季黄东海区域的群落呼吸作用及其营养状态变化尚有待进一步研究。
为了解黄东海陆架营养状态的季节性变化, 阐明生物活动与大气CO2源汇性质的关系, 以揭示其碳平衡, 本研究对四季南黄海及东海北部不同水层的PCR进行测定, 并分析其分布与环境因子(温度、盐度、溶氧、营养盐、叶绿素a和细菌丰度)之间的相关关系, 以确定其分布特征以及区域内PCR的主要贡献者。此外, 通过比较生物碳的生产量和消耗量, 以说明黄东海陆架生态系统中生物活动对区域内有机碳平衡的作用。
1 材料和方法 1.1 研究区域与采样站位分别于2011年3月17日至4月7日(春季)、2011年7月6日至2011年7月24日(夏季)、2011年10月17日至11月5日(秋季)、2011年12月20日至2012年1月11日(冬季)搭载“东方红2号”调查船进行了海上采样, PCR采样站位覆盖南黄海、东海北部及浙江近岸(121.35°~127.00°E, 27.50°~36.34°N), 各季节略有差异(图 1): 春季27个站位, 其中6个站位测定初级生产力; 夏季26个站位, 3个站位测定初级生产力; 秋季20个站位, 3个站位测定初级生产力; 冬季19个站位。初级生产力的各季节测定站位详见表 3。
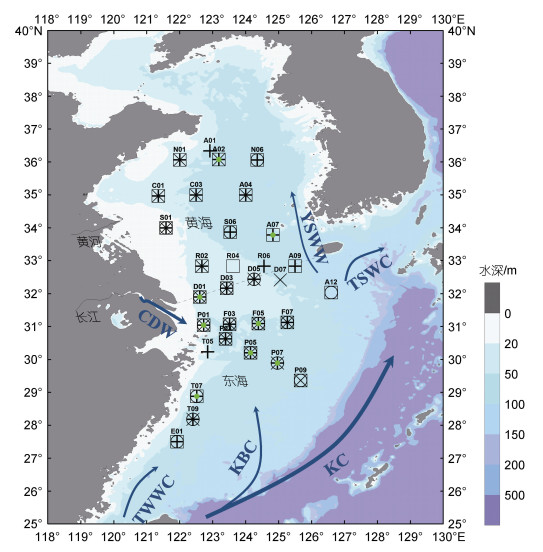 |
| 图 1 2011年四季浮游生物群落呼吸率采样站位图 Fig. 1 The sampling stations for Plankton Community Respiration rate in four seasons in 2011 注: “+”代表春季, “□”代表夏季, “×”代表秋季, “○”代表冬季, 绿色点代表初级生产力测定站位。CDW表示长江冲淡水, KBC表示黑潮分支, KC表示黑潮, TSWC表示对马暖流, TWWC表示台湾暖流, YSWW表示黄海暖流。虚线表示黄海和东海的分界线 |
每个站位分别采集表层(距海面2 m)、中层(南黄海为30 m层, 东海为10 m)和底层(距海底2 m)共三层水样进行浮游生物群落呼吸率培养实验。每个水样用250 mL的生物需氧测定瓶(biological oxygen demand, BOD)采集4瓶, 采样按照溶解氧(dissolved oxygen, DO)采集要求进行: 将乳胶管的一端接上玻璃管, 另一端套在采水器的出水口, 放出少量水样洗涤水样瓶两次。将玻璃管插到水样瓶底部, 慢慢注入水样, 并使玻璃管口始终处于水面下, 待水样装满并溢出水样瓶体积的1/2时, 将玻璃管慢慢抽出, 瓶内不出现气泡。2瓶水样立即测定溶解氧浓度, 均值作为“培养前DO浓度”; 另外2瓶水样置于对应水层环境温度黑暗培养24 h。其中表层水样置于甲板循环水水槽中培养, 中层水和底层水分别置于实验室控温培养箱中培养。培养结束后, 取出水样测定溶解氧浓度, 均值作为“培养后DO浓度”。溶解氧浓度使用YSI 5000台式溶解氧检测仪(美国维赛)测定, 测定结果经滴定法结果校正后用于分析。浮游生物群落呼吸率[μmol O2/(L·d)]计算公式为:
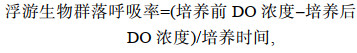 (1)
(1)应用呼吸熵(respiration quotient, RQ)为1, 将呼吸率由氧O2转换为碳的单位mg C/(m3·d)(Hopkinson, 1985)。
1.2.2 初级生产力使用透明度盘测定海水的透明度, 确定采样的光学深度。按光学深度, 在光强为表层的100%、50%、30%、10%、5%和1%的深度上采水样。在弱光下, 将水样经孔径为200 μm的筛绢过滤, 分装至提前用体积分数2%的稀盐酸浸泡24 h的培养瓶中, 每层样品包括两个白瓶和一个黑瓶, 第一层和第四层样品分装一个准确体积的零时间培养瓶, 取相同体积37~370 kBq的14C工作溶液加至每个培养瓶, 培养24 h。用微量洗液器从每一零时间培养瓶中吸取一定体积水样两份, 分别移入2个闪烁瓶中, 加20 mL闪烁液, 混匀, 用于放射性活性测定。将已加有14C的培养瓶, 放入各自相应的培养箱内, 再放入透明的培养箱内, 记下开始培养时间, 用流动的表层海水保持培养期间的温度恒定。培养开始后, 立即过滤两个零时间样品, 所得载有浮游植物的滤膜, 放入闪烁瓶中, 存放于-20 ℃低温冰箱中。样品培养后用孔径为0.65 μm的纤维素酯微孔滤膜进行过滤, 将滤膜放入闪烁瓶中, 存放于-20 ℃低温冰箱中。在实验室通风橱中, 加入1 mL 0.1 mol/L的盐酸, 15 min后加盖。向闪烁瓶中加入10 mL闪烁液, 在振荡器上振荡20 min后, 把闪烁液置于液体闪烁计数仪(AccuFLEX LSC-8000, HITACHI, 日本)内, 使样品暗适应12 h后测定。
1.2.3 浮游细菌丰度用预先经稀盐酸浸泡并冲洗烘干的PEB瓶, 采集3.6 mL水样, 加入终浓度10%的多聚甲醛固定后, 于液氮中保存带回实验室。测定前先于室温下解冻, 取0.5 mL水样用SYBRGreen-1进行染色后, 使用流式细胞仪(BDFACSCalibur, BD公司, 美国)测定细菌总数。
1.2.4 环境因子深度、温度、盐度数据均由“东方红2号”调查船配备的Seabird 911 PlusCTD获得。营养盐(活性硅酸盐SiO3-Si、活性磷酸盐PO4-P、硝酸盐NO3-N、亚硝酸盐NO2-N、铵盐NH4-N)的测定方法为: 分别采集表层、10 m、30 m、底层水样100 mL, 用孔径为0.45 μm的醋酸纤维滤膜过滤, 滤液在4 ℃临时保存, 48 h内在船上实验室用Skalar san++型营养盐自动分析仪测得。溶解无机氮(dissolved inorganic nitrogen, DIN)为硝酸盐、亚硝酸盐、铵盐浓度之和。
叶绿素a浓度的测定: 分别采集表层、10 m、30 m、底层水样, 用0.7 μm孔径的GF/F玻璃纤维滤膜进行过滤, 过滤体积为50~100 mL。过滤后的滤膜置于15 mL Falcon离心管中, 存放于-20 ℃低温冰箱。回实验室后, 向离心管中加入10 mL体积分数为90%的丙酮, 摇荡, 置于低温冰箱内, 提取12~24 h。取出样品后, 置于黑暗处使样品恢复室温, 用唐纳荧光计(10-AU型, TURNER公司, 美国)测定叶绿素a和脱镁叶绿素浓度。
1.3 数据分析采用非参数检验(Kruskal-Wallis test, K-W检验)方法分析营养盐的季节差异以及浮游生物群落呼吸率的季节、层次和区域间差异。利用Spearman相关系数分析浮游生物群落呼吸率与环境因子(温度、盐度、营养盐浓度、溶氧浓度、叶绿素a浓度、细菌丰度)的相关性, 并利用线性回归分析各环境因子与浮游生物群落呼吸率的线性相关性, 以上分析均通过SPSS20.0软件完成。
生态系统的营养状态用总初级生产力(GPP)与总群落呼吸率(PCR)的比值描述, 即GPP/PCR值(Odum, 1956)。PP/CR小于1, 认为海区生态系统表现为异养; PP/CR大于1, 认为海区生态系统表现为自养。
2 结果 2.1 浮游生物群落呼吸率时空分布特征研究区域PCR的变化范围为1.61~834.84 mg C/(m3·d), 均值为(184.53±154.21) mg C/(m3·d)。季节和水层间差异显著, 且季节间差异(R=0.220, P=0.001)比水层间(R=0.120, P=0.001)差异更显著。两两季节间PCR差异均显著(P < 0.01), 夏季最高[(266.63±172.28) mg C/(m3·d)], 其次为秋季[(206.60±175.77) mg C/(m3·d)], 再次为春季[(142.74±107.06) mg C/(m3·d)], 冬季最低[(94.68±74.21) mg C/(m3·d)]。两两水层间PCR也具有显著差异(R=0.120, P=0.001), 中层最高[(212.46±178.27) mg C/(m3·d)], 其次为表层[(195.68±162.47) mg C/(m3·d)], 底层最低[(150.19±115.37) mg C/(m3·d)]。
PCR具有一定的水平分布变化, 且各季节的空间变化特征不同(图 2)。将研究站位分为黄海南部和东海北部两个区域, 两个区域间PCR均值仅在夏季(P=0.018)和冬季(P=0.025)的底层水存在显著差异(表 1)。春季表层PCR在长江口区域和南黄海北部较高; 中层在长江口区域较高; 底层分布较均匀, 南黄海区域略高于东海北部。夏季表层和中层PCR的高值主要分布在长江口区域和浙江近岸区域, 并沿长江口离岸方向呈现递减趋势; 底层南黄海区域高于东海北部, 且差异显著(P < 0.5)。秋季各层PCR在南黄海北部沿岸和东海离岸区均较高, 在不同水层之间的分布相似。冬季因天气和海况原因, 南黄海区域的有效数据较少, 仅N06站位较高; 东海北部在D01站位和P断面的离岸侧较高。
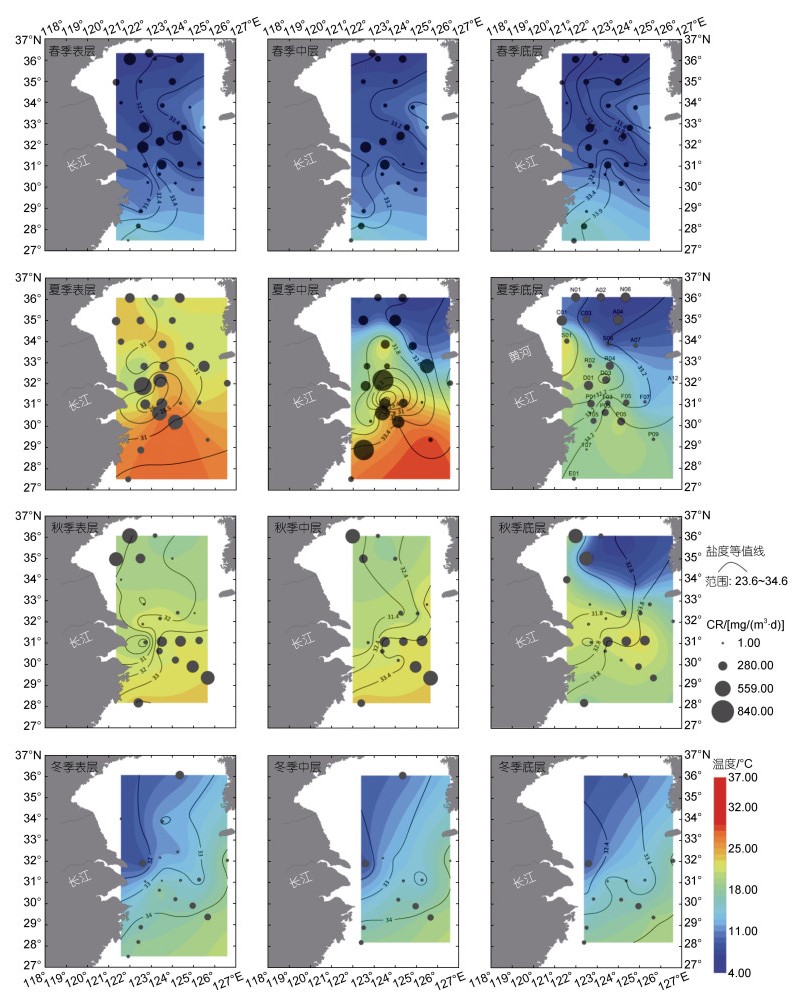 |
| 图 2 2011年四季各层次PCR分布图 Fig. 2 Distribution of Plankton Community Respiratory rate at different layers in four seasons of 2011 注: 圆饼图表示浮游生物群落呼吸率分布, 等值线图表示盐度分布, 彩虹等值线图表示温度分布 |
| 季节 | 层位 | 南黄海 | 东海北部 | 总区域 |
| 春季 | 表层 | 182.27±129.87 | 144.59±130.67 | 161.34±129.21 |
| 中层 | 152.17±55.40 | 141.00±122.02 | 145.06±101.34 | |
| 底层 | 151.76±82.42 | 106.77±78.25 | 126.77±81.79 | |
| 夏季 | 表层 | 258.11±51.63 | 304.72±214.13 | 284.21±162.80 |
| 中层 | 268.00±78.23 | 336.09±260.24 | 312.41±214.81 | |
| 底层 | 230.27±99.73* | 148.81±99.31* | 184.65±105.78 | |
| 秋季 | 表层 | 225.83±249.04 | 221.18±166.77 | 222.81±192.76 |
| 中层 | 254.53±212.92 | 218.67±176.20 | 227.63±179.14 | |
| 底层 | 238.83±234.15 | 149.64±119.94 | 175.13±159.63 | |
| 冬季 | 表层 | 112.47±142.39 | 80.74±68.50 | 86.03±79.99 |
| 中层 | 236.47Δ | 100.12±76.06 | 112.52±83.05 | |
| 底层 | 112.94Δ | 89.33±60.88 | 91.30±58.44 | |
| 注: *表示显著性P < 0.05; Δ表示冬季南黄海中、底层仅有一个站位的有效数据。 | ||||
研究区域夏季、秋季平均温度最高[分别为(19.11±6.68) ℃、(20.10±3.24) ℃], 其次为冬季[(14.61±3.33) ℃], 春季温度最低[(9.34±2.61) ℃]。春季温度垂直分布较均匀, 南黄海东侧和研究区域南侧温度较高。夏季温度垂直分布差异较大, 表层普遍高温, 但长江近岸口温度较低; 中底层南黄海东北侧表现为明显低温。秋季表中层温度垂直分布较均匀, 但南黄海底层东北侧表现为明显低温。冬季, 温度垂直分布较均匀, 整体呈现出东南向西北递减的趋势(图 2)。
研究区域四季各水层盐度总范围为23.6~34.6, 四季的空间分布较相似(图 2), 均表现为长江口较低, 东海北部东南侧、南黄海东侧较高。其中夏季表层盐度最低, 尤其是长江口。
DIN季节分布差异显著(P=0.00), 在春季[(10.72±4.04) μmol/L]最高, 其次为夏季[(9.10±8.59) μmol/L], 秋季[(7.14±4.43) μmol/L]与冬季[(7.38±4.14) μmol/L]最低。PO4-P的季节差异不显著, 在秋季[(0.69±0.49) μmol/L]最高, 其次为夏季[(0.52±0.45) μmol/L]、冬季[(0.51±0.25) μmol/L]、春季[(0.50±0.24) μmol/L]。SiO3-Si的季节分布差异显著(P=0.00), 在春季[(15.81±6.21) μmol/L]最高, 其次为冬季[(11.82±4.21) μmol/L]、秋季[(11.39±7.47) μmol/L], 夏季[(10.89±8.44) μmol/L]最低。在空间分布上, 春季, DIN在长江口近岸较高, 黄海及东海远岸处较低; PO4-P在东海北部西北侧及南黄海东侧较高, 而在浙江近岸及南黄海西侧较低; SiO3-Si在东海北部及南黄海东侧较高, 南黄海西侧较低。夏季, DIN及SiO3-Si在长江口近岸较高; PO4-P在东海北部西北侧较高。秋季, DIN、PO4-P及SiO3-Si在东海北部较高。冬季, DIN在东海北部中北侧及南黄海北部较高; PO4-P在东海北部及南黄海西侧较高; SiO3-Si在东海北部较高。
对东海北部和南黄海四季各层平均叶绿素a进行统计(图 3a)。总体而言, 春季各层次叶绿素a均较高, 夏、秋季表、中层较高, 但底层较低, 冬季普遍较低, 东海北部高于南黄海。对不同区域而言, 南黄海的叶绿素a在春季最高, 尤其是春季底层, 冬季最低, 尤其是冬季底层; 东海北部除冬季底层高于表、中层外, 其余季节表、中层均高于底层。
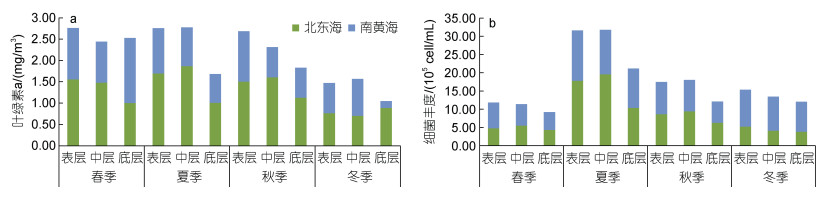 |
| 图 3 南黄海、东海北部四季各层平均叶绿素a (a)、平均细菌丰度(b)的比较 Fig. 3 Comparison of mean chlorophyll a (a) and mean bacterial abundance (b) in four seasons in the Southern Yellow Sea and the Northern East China Sea |
对东海北部和南黄海四季各层平均细菌丰度进行统计(图 3b)。夏季平均细菌丰度最高, 秋季与冬季稍高于春季。四季底层中浮游细菌丰度相较于其他水层均较低。东海北部与南黄海浮游细菌丰度在春、夏、秋季分布较均匀, 但在冬季南黄海浮游细菌丰度高于东海北部。
2.2.2 PCR与环境因素的相关性分析Spearman相关性分析结果显示(表 2), 整体上, 研究区域PCR与细菌丰度、叶绿素a、温度呈极显著正相关, 与硅酸盐、盐度呈极显著负相关。其中, 与细菌丰度相关性最高, 其次是硅酸盐、盐度、叶绿素a和温度, 再次是磷酸盐。
| 季节 | 水层 | 细菌丰度 | 叶绿素a | 温度 | 盐度 | 溶解氧 | 无机氮 | 磷酸盐 | 硅酸盐 |
| 四季全水层 | 0.371** | 0.199** | 0.172** | -0.244** | -0.057 | -0.045 | -0.138* | -0.259** | |
| 春季 | 全水层 | 0.252* | 0.000 | -0.385** | -0.259* | 0.348** | -0.017 | -0.034 | -0.093 |
| 表层 | 0.266 | 0.075 | -0.590** | -0.396* | 0.496** | 0.056 | -0.084 | -0.111 | |
| 中层 | 0.381 | -0.160 | -0.386 | -0.360 | 0.366 | 0.011 | -0.038 | -0.212 | |
| 底层 | 0.336 | 0.048 | -0.284 | -0.198 | 0.269 | -0.167 | -0.001 | -0.117 | |
| 夏季 | 全水层 | 0.331** | 0.484** | 0.220 | -0.372** | 0.461** | 0.058 | 0.016 | -0.208 |
| 表层 | 0.212 | 0.431* | 0.078 | -0.473* | -0.015 | 0.381 | 0.655** | 0.195 | |
| 中层 | 0.469* | 0.546* | 0.012 | 0.097 | 0.374 | 0.091 | 0.147 | -0.140 | |
| 底层 | -0.119 | 0.206 | -0.266 | -0.537** | 0.211 | 0.019 | 0.258 | -0.208 | |
| 秋季 | 全水层 | 0.228 | 0.259 | 0.168 | 0.131 | 0.076 | -0.213 | -0.266* | -0.366** |
| 表层 | 0.242 | 0.393 | 0.277 | 0.221 | -0.094 | -0.272 | -0.191 | -0.376 | |
| 中层 | -0.081 | 0.324 | 0.195 | 0.186 | 0.060 | -0.031 | -0.098 | -0.260 | |
| 底层 | 0.330 | 0.031 | -0.032 | 0.057 | 0.009 | -0.255 | -0.328 | -0.355 | |
| 冬季 | 全水层 | -0.094 | -0.249 | 0.068 | 0.081 | -0.137 | 0.160 | -0.333* | 0.009 |
| 表层 | 0.065 | -0.110 | 0.215 | 0.196 | -0.257 | 0.046 | -0.433 | -0.141 | |
| 中层 | -0.314 | -0.393 | -0.132 | -0.173 | 0.096 | 0.241 | -0.265 | 0.068 | |
| 底层 | 0.112 | -0.371 | 0.021 | 0.049 | -0.329 | 0.273 | -0.168 | 0.140 | |
| 注: **表示显著性P < 0.01; *表示显著性P < 0.05。 | |||||||||
PCR与叶绿素a浓度(chl a)和细菌丰度(BA)的线性回归分析模型得到PCR=57.070+11.367×BA+ 25.688×chl a (F=44.297, P < 0.001), 表明在南黄海和东海北部区域, 大部分PCR是由浮游植物和浮游细菌贡献。
春季, 研究区域PCR空间变化与溶解氧呈极显著正相关(P=0.004), 与温度(P=0.001)呈极显著负相关, 也与细菌丰度显著正相关、与盐度显著负相关。其中, 春季表层PCR的水平变化与溶解氧呈极显著正相关(P=0.008), 而与温度呈极显著负相关(P=0.001), 与盐度显著负相关(表 2)。
夏季, 研究区域PCR空间变化与细菌丰度(P=0.009)、叶绿素a (P=0.000)、溶解氧(P=0.000)呈极显著正相关, 与盐度呈极显著负相关(P=0.003)。其中, 夏季表层PCR的水平变化与磷酸盐(P=0.002)呈极显著正相关, 与叶绿素a呈显著正相关, 与盐度呈显著负相关; 中层与细菌丰度和叶绿素a呈显著正相关; 底层则与盐度(P=0.007)呈极显著负相关。
秋季, 黄东海PCR与硅酸盐(P=0.006)呈极显著负相关, 也与磷酸盐呈显著负相关。
冬季, 研究区域PCR与磷酸盐呈显著负相关。
秋冬季节, 研究区域PCR在各水层的水平分布与上述环境因子的相关性不显著。
2.3 南黄海及东海北部生态系统群落呼吸率与初级生产力的相对关系选取初级生产力与浮游生物群落呼吸率数据均有效的站位, 计算水柱净浮游生物群落呼吸率[ICR, mg C/(m2·d)]和真光层深度的水柱初级生产力[IPP, mg C/(m2·d)] (表 3)。所有站位的水柱群落呼吸率ICR均高于水柱初级生产力IPP, 即所有站位IPP/ICR均小于1, 表明研究海区水柱呈异养状态。
| 季节 | 站位 | ED | ICR | IPP | IPP/ICP | PP | LCR | |
| 表层 | 中层 | |||||||
| 春季 | A02 | 27.0 | 7123.76 | 507.08 | 0.07 | 18.78 | 60.37 | 167.48 |
| A07* | 10.0 | 7312.65 | 250.74 | 0.03 | 25.07 | 23.37 | 93.48 | |
| D01 | 5.0 | 8802.45 | 210.92 | 0.02 | 42.18 | 407.01 | 387.54 | |
| P01* | 1.5 | 1926.99 | 111.05 | 0.06 | 74.03 | 124.64 | 13.63 | |
| P07 | 13.0 | 2991.27 | 399.44 | 0.13 | 30.73 | 53.11 | 82.85 | |
| T07* | 14.0 | 3653.41 | 3474.69 | 0.95 | 248.19 | 89.58 | 95.43 | |
| 夏季 | A02 | 29.8 | 17510.20 | 1897.22 | 0.11 | 63.67 | 197.67 | 224.37 |
| D01 | 9.5 | 10759.53 | 1801.12 | 0.17 | 189.59 | 699.46 | 345.97 | |
| F05* | 28.4 | 10040.81 | 2121.74 | 0.21 | 74.71 | 50.57 | 289.95 | |
| 秋季 | A02* | 21.9 | 4611.16 | 3011.41 | 0.65 | 88.83 | 50.46 | 67.86 |
| P01 | 2.7 | 7255.31 | 328.74 | 0.05 | 15.01 | 110.62 | 93.75 | |
| P07* | 23.2 | 1063.93 | 152.93 | 0.14 | 56.64 | 78.75 | 46.61 | |
| 注: 表中ED为真光层深度(m); ICR为表层到底层的水柱净浮游生物群落呼吸率[mg C/(m2·d)], IPP为真光层的水柱初级生产力[mg C/(m2·d)]; PP为真光层初级生产力均值[mg C/(m3·d)]; LCR为表层或中层(A2和A7站位为30 m层; 其他站位为10 m层)的浮游生物群落呼吸率[mg C/(m3·d)]。加粗表示PP > LCR, *表示PP > LCR的站位 | ||||||||
但比较真光层初级生产力均值[PP, mg C/(m3·d)]与真光层的群落呼吸率[LCR, mg C/(m3·d)], 以下季节某些站位和水层PP/LCR > 1: 春季A07站位表层, P01站位中层, T07站位表、中层; 夏季F05站位上层; 秋季A02站位表、中层, P07站位中层(表 3); 表明这些季节站位的水层生态系统为净自养状态, 而其他水层为净异养状态。在空间上, 表现出南黄海东部A07站位春季表层呈净自养状态; 南黄海北部A02站位秋季表、中层呈净自养状态; 长江口区P01站位春季中层呈净自养状态; 长江口远岸区F05站位夏季表层、P07站位秋季中层呈现净自养状态, 浙江近岸T07站位在春季表中层呈现净自养状态。
3 讨论 3.1 黄东海陆架生态系统具有较高的浮游生物群落呼吸率全球陆架海区域面积虽然不及全球海洋表面积的8% (Sverdrup et al, 1942), 但却是全球生产力最高的区域之一(Liu et al, 2000), 这个区域的碳通量对全球而言不可忽视。世界典型海域如西北大西洋沿岸、东欧沿岸等, 其浮游生物群落呼吸率均已受到广泛关注(表 4)。与其他沿岸海域相比, 南黄海和东海北部PCR较高, 根据分析, 其他多数海区温度、叶绿素a比本海区低、盐度比本海区高, 这种现象也符合本研究得到PCR与温度、叶绿素a呈正相关, 而与盐度呈负相关的结果(表 2)。东北大西洋东欧沿岸陆架由于纬度较高, 平均表层温度为10 ℃左右(García-Martín et al, 2019), 远低于本研究区域。东太平洋秘鲁智利沿岸陆架海区具有典型上升流, 平均表层温度较低, 且叶绿素a也低于本研究区域(Daneri et al, 2000)。日本相模湾位于北太平洋沿岸, 其纬度与本研究区域相似, 但其受黑潮暖流影响更大, 盐度较高, 叶绿素a较低(Hashimoto et al, 2006)。西北大西洋与本研究区域位于同一纬度, 且受到与黑潮暖流相似的墨西哥暖流影响, 其四季温度、叶绿素a均与本研究区域较相似(Griffith et al, 1995), 因此与本研究区域PCR相当。
| 研究海域 | 群落呼吸率 | 采样时间 | 文献 |
| 西北大西洋陆架 | 28.80~864.00a | 1985.04~1987.11 | (Griffith et al, 1995) |
| 东欧陆架凯尔特海 | (264.00±43.20)~(1430.40±43.20b) | 2015.04 | (García-Martín et al, 2019) |
| 日本相模湾 | 120.00~3732.00b | 2001.09~2004.6 | (Hashimoto et al, 2006) |
| 东南太平洋陆架 | 0.00~400.80a | 1996.07~1997.07 | (Daneri et al, 2000) |
| 东海 | 5.30~97.20a | 1998.10~1998.11 | (Chen et al, 2003) |
| 27.20~ 412.60 (114±100)a | 2003.06 | (Chen et al, 2006) | |
| 11.90~94.40 (40±23)a | 2003.08 | (Chen et al, 2006) | |
| 东海北部 | 1.95~407.02 (130.55±111.16) a | 2011.03~2011.04 | 本研究 |
| 7.47~834.84 (279.00±219.33)a | 2011.07 | 本研究 | |
| 1.61~549.38 (193.60±153.85)a | 2011.10~2011.11 | 本研究 | |
| 3.60~208.64 (88.75±66.99)a | 2011.12~2012.01 | 本研究 | |
| 南黄海 | 21.70~435.52 (163.31±96.49)a | 2011.03~2011.04 | 本研究 |
| 91.66~407.80 (250.54±78.02)a | 2011.07 | 本研究 | |
| 8.18~582.00 (237.17±221.42)a | 2011.10~2011.11 | 本研究 | |
| 11.25~275.29 (137.37±114.92)a | 2011.12~2012.01 | 本研究 | |
| 注: a代表平均群落呼吸率, 单位为mg C/(m3·d); b代表真光层水柱群落呼吸率, 单位为mg C/(m2·d) | |||
黄海是完全位于陆架上的一个半封闭浅海, 由于其深度较小, 因此对季节交替所施加的作用响应较快。目前对黄海生态系统群落呼吸率的研究尚为空缺。本研究显示, 南黄海区域多数季节和水层的PCR与东海北部研究区域相当。南黄海区夏季底层PCR较东海北部高, 主要与东海北部夏季底层低氧及南黄海夏季冷水团影响有关。本研究得出夏季底层叶绿素a与细菌丰度均较低(图 3), 且PCR与这两者不相关(表 2), 说明在此时PCR的主要贡献者可能是浮游动物。本研究观察到东海北部夏季底层存在低氧现象, 其平均溶解氧含量为4.68 mg/L, 而南黄海夏季底层平均溶解氧含量为7.33 mg/L。低氧抑制了底层大部分需氧浮游生物的生长代谢, 导致东海北部夏季底部较低的PCR。此外, 低温、高盐的南黄海夏季冷水团具有稳定的温盐条件(苏纪兰, 2005), 这为浮游动物提供了躲避夏季高温伤害的环境(孙跃等, 2020)。
东海66%的面积位于陆架上, 受黑潮和长江冲淡水的季节性变化影响, 不同季节有明显的变化特征。相比于往年东海PCR的研究结果, 本研究调查区域得到的PCR较大。Chen等(2003, 2006)在1998年秋季及2003年夏季(6, 8月)东海南部陆架区的PCR结果均低于本研究结果(表 4)。2003年夏季温度与本研究相似, 6月叶绿素a浓度较本研究高, 但8月叶绿素a浓度远低于本研究。Chen等(2003)在研究中提出, 东海南部区域营养盐(尤其是硝酸盐)是限制浮游生物群落呼吸率的因素之一。而本研究东海北部, 离长江口较近, 夏季长江冲淡水范围扩增, 携带大量氮营养盐进入东海陆架区域(苏纪兰, 2005), 硝酸盐含量较高[(11.25±9.79) μmol/L], 未观察到寡营养站位(硝酸盐含量 < 0.3 μmol/L), 因此不受硝酸盐限制, 这也与本研究夏季PCR与无机氮盐显著不相关的结果相符合(表 2)。故本研究中东海北部PCR较高可能主要与硝酸盐浓度较高有关。
3.2 浮游植物与浮游细菌是春夏季表中水层PCR的主要贡献者尽管对于全年全水层而言, 浮游植物和浮游细菌为PCR的主要贡献者, 但具体分析各季节的各水层, 发现各水层PCR与叶绿素a和浮游细菌丰度的相关性却不显著。浮游植物和浮游细菌主要为春、夏季表、中层PCR的贡献者。
在本研究结果中, 仅有夏季表现为PCR与浮游细菌丰度和叶绿素a极显著相关(表 2), 结合表中层较高的浮游细菌丰度及叶绿素a (图 3a, 3b), 说明夏季表中层浮游植物及浮游细菌的呼吸作用贡献了全年大部分的PCR。夏季低盐的长江冲淡水范围的扩展, 大量由冲淡水带来的有机碳和无机氮盐进入黄东海陆架表层区域(苏纪兰, 2005), 大量有机碳为浮游细菌生长繁殖提供底物, 无机氮盐为浮游植物生长代谢提供底物, 大量浮游植物光合作用消耗磷酸盐, 导致磷酸盐成为表层浮游植物生长繁殖的相对限制性因素, 进而成为限制PCR的因素, 这也与本研究发现在夏季表层PCR与磷酸盐呈极显著相关的结果相一致(表 2)。
在春季, 叶绿素a浓度较高, 但研究区域PCR与叶绿素a相关性不显著。这可能是由于春季黄东海区域高发赤潮, 表、中层叶绿素a浓度均较高, 导致PCR空间变化不明显。并且大量的浮游植物死亡下沉, 导致底层具有较高的叶绿素a浓度。春季高发的赤潮, 导致表层水体耗氧较快, 由此溶解氧成为PCR的限制因素, 这与本研究春夏季PCR与溶解氧的极显著相关性结果相符合(表 2)。
在春、夏季底层, PCR的主要贡献者可能是其他浮游生物而不是浮游植物或浮游细菌, 或者可能是所有浮游生物的共同作用。尽管本研究并未统计同步的浮游动物在各季节各水层的丰度, 但除春季外, 底层均具有较低的叶绿素a浓度和细菌丰度(图 3), 推测底层PCR主要是由浮游生物共同作用提供的, 而不是由哪一类群主导。在夏季底层, 南黄海PCR高于东海北部, 且具有显著差异(表 2), 结合已有研究说明浮游动物丰度和生物量在黄南海较东海北部高(孙跃等, 2020), 说明底层浮游动物可能是PCR的主要提供者。
秋冬季节研究区域PCR与叶绿素a浓度和细菌丰度没有明显关系, 在以往的研究中也存在相似的结果。Chen等(2003)在东海的研究显示秋季叶绿素a或初级生产力与PCR之间无相关性。细菌丰度或细菌生产力与PCR之间较低的相关性在其他陆架研究中也有发现(Biddanda et al, 1994)。这显示在秋冬季节, 黄东海陆架区域主要受浮游生物共同影响, 而不受浮游植物或浮游细菌的单一影响, 其中浮游原生动物可能为有机碳的消耗提供了重要作用(Del Giorgio et al, 1997; Chen et al, 2003)。此外, 在秋季观察到, 浮游群落呼吸率与硅酸盐浓度呈现显著负相关。这可能是由于夏季大量浮游植物的光合作用, 耗尽水体中的营养盐, 随着夏末浮游植物大量死亡, 秋季浮游群落呼吸率降低, 而硅酸盐含量在夏季降低而秋季开始回升(李伯志, 2018)。
3.3 黄东海陆架生态系统营养状态与碳平衡之间的相关性目前对海区大气CO2的源汇主要通过海气CO2通量判断。基于对黄东海海气界面CO2通量估计碳通量的研究显示, 黄海在冬季、春季表现为大气CO2的碳汇, 即从大气中吸收CO2, 而在夏季、秋季向大气中释放CO2, 表现为碳源; 而东海在冬、春、夏季节表现为大气CO2的碳汇, 而在秋季表现为大气CO2的碳源, 全年表现为大气CO2的碳汇(宋金明等, 2018)。海气CO2交换在不同季节具有显著的时空变化与复杂的受控因素。本研究从生物学角度, 通过分析浮游生态系统营养状态说明黄东海陆架区域的CO2源汇性质。
以总初级生产力与总群落呼吸率的关系来判断黄东海陆架海域生态系统的营养状态, 结果显示研究海区春、夏、秋季调查站位水柱均表现为净异养状态(表 3), 表明研究区域的原位初级生产力吸收CO2低于浮游生物呼吸产生CO2。这种现象也在过去对东海生态系统营养状态的研究中发现, Chen等(2003, 2006)研究得到, 在夏秋季节东海表现为异养状态, 但海气CO2交换通量显示该海区为碳汇。
南黄海及东海北部总体表现为碳汇而水体为异养状态, 这一现象主要是由于水体的分层作用、再悬浮的沉积有机碳利用以及甲板暗培养法的缺陷三方面导致的。
Chen等(2006)提出, 通过浮游生物呼吸产生的CO2, 以溶解无机碳的方式被固定在次表层中, 并影响了表层中CO2的通量。Chou等(2009)对夏季东海陆架碳化学成分垂直分布的研究也证明了这一观点, 夏季海水分层现象是东海异养水体中维持CO2碳汇的关键因素: 当这种分层现象被打破, 海水混合时, 储存在次表层水体中的溶解CO2也会释放到大气中。
本研究发现, 春、夏季浙江近岸上升流区域(T07站)和夏季长江口远岸区(31°N断面, F05)的上层水呈现自养状态, 但真光层以下呈异养状态, 与长江口区域基于浮标数据获得的结果高度一致(Zhang et al, 2019), 即春、夏季浙江近岸和夏季长江口远岸区的生态系统是大气CO2的碳源或碳汇取决于海区的物理状态: 当风平浪静、水体分层稳定时, 该生态系统为大气CO2的汇; 但当有风过境, 表底层水混合充分时, 该生态系统则可能成为大气CO2的源。
此外, 尽管陆架认为是CO2的碳汇, 且有大量外源输入有机碳, 但研究显示, 陆架的大部分区域并没有积累有机物质(de Haas et al, 2002)。沿岸长江冲淡水将大量有机碳从陆地补充到沿岸和陆架生态系统, 黑潮水携带高浓度的DOC侵入东海陆架, 另外富含有机质的沉积物通过上升流再悬浮进入黄东海陆架区域, 都是外源碳源的重要部分(Chen et al, 1999; Gong et al, 2000)。在东海虽然观察到较高的沉积率, 但沉积物中有机碳的含量不超过预期的1% (Lin et al, 2002), 这表明大部分的有机碳被呼吸消耗或输出。有研究显示, 在陆架的沉积物中, 有40%~85%的有机碳可通过再悬浮, 重新被生物消耗(宋金明等, 2006)。这也部分解释了黄东海区域尽管为碳汇区域但却呈现异养状态。
另外, 基于溶解氧测定的甲板暗培养法是目前获取PCR的唯一实测方法, 但该方法会高估PCR。长期暗培养可能会改变优势微型浮游生物群落昼夜节律; 瓶内培养可能会增加细菌丰度和物质分解速率等(Pomeroy et al, 1994; Sherr et al, 1999; Aranguren-Gassis et al, 2012; Huang et al, 2019)。因此本研究利用培养法评价东黄海海区生态系统营养状态, 可能高估了海区的异养程度。
4 结论本研究对南黄海和东海北部的浮游群落呼吸率进行测定, 得到一年间变化范围为1.61~834.84 mg C/(m3·d), 平均(184.53±154.21) mg C/(m3·d), 其中夏季最高, 冬季最低, 季节之间差异性显著, 不同水层之间的差异也较为显著。此外, 浮游群落呼吸率与叶绿素a浓度和浮游细菌丰度呈显著正相关, 这说明浮游植物和浮游细菌是黄东海陆架生态系统的主要贡献者。本研究得到黄东海陆架总体表现为异养-碳汇区域, 产生这种矛盾现象的原因可能为水体的分层作用、再悬浮的沉积有机碳利用。本研究阐明了黄东海陆架浮游生物呼吸率的时空变化格局, 解析了初级生产和群落呼吸等生物活动对黄东海陆架海区碳源汇格局和碳平衡的贡献。进一步工作可以从浮游动物呼吸率的贡献出发, 探讨不同浮游生物成分对呼吸率的贡献。
致谢 感谢中国海洋大学水文组江文胜、赵亮等老师提供温度、盐度和水深资料; 感谢自然资源部第二海洋研究所化学组提供航次营养盐及溶解氧资料; 感谢中国海洋大学“东方红2号”船长及全体船员在样品采集过程中给予的帮助。
曲宝晓, 宋金明, 袁华茂, 等. 2013. 东海海—气界面二氧化碳通量的季节变化与控制因素研究进展. 地球科学进展, 28(7): 783-793 |
孙跃, 沈阳, 戴铃灵, 等. 2020. 夏冬季黄海浮游动物群落结构及其影响因素. 中国海洋大学学报(自然科学版), 50(7): 82-93 |
苏纪兰, 2005. 中国近海水文[M] //苏纪兰. 中国近海水文. 北京: 海洋出版社: 193-249.
|
李伯志, 2018. 中国近海营养盐季节和年际变化特征分析[D]. 天津: 天津科技大学: 15-19.
|
宋金明, 曲宝晓, 李学刚, 等. 2018. 黄东海的碳源汇: 大气交换、水体溶存与沉积物埋藏. 中国科学: 地球科学, 48(11): 1444-1455 |
宋金明, 徐亚岩, 张英, 等. 2006. 中国海洋生物地球化学过程研究的最新进展. 海洋科学, 30(2): 69-77 DOI:10.3969/j.issn.1000-3096.2006.02.015 |
焦念志, 梁彦韬, 张永雨, 等. 2018. 中国海及邻近区域碳库与通量综合分析. 中国科学: 地球科学, 48(11): 1393-1421 |
ARANGUREN-GASSIS M, TEIRA E, SERRET P et al, 2012. Potential overestimation of bacterial respiration rates in oligotrophic plankton communities. Marine Ecology Progress Series, 453: 1-10 DOI:10.3354/meps09707 |
BIDDANDA B, OPSAHL S, BENNER R, 1994. Plankton respiration and carbon flux through bacterioplankton on the Louisiana shelf. Limnology and Oceanography, 39(6): 1259-1275 DOI:10.4319/lo.1994.39.6.1259 |
BORGES A V, 2005. Do we have enough pieces of the jigsaw to integrate CO2 fluxes in the coastal ocean?. Estuaries, 28(1): 3-27 DOI:10.1007/BF02732750 |
CALBET A, LANDRY M R, 2004. Phytoplankton growth, microzooplankton grazing, and carbon cycling in marine systems. Limnology and Oceanography, 49(1): 51-57 DOI:10.4319/lo.2004.49.1.0051 |
CHEN C C, CHIANG K P, GONG G C et al, 2006. Importance of planktonic community respiration on the carbon balance of the East China Sea in summer. Global Biogeochemical Cycles, 20(4): GB4001 DOI:10.1029/2005GB002647 |
CHEN C C, SHIAH F K, GONG G C et al, 2003. Planktonic community respiration in the East China Sea: importance of microbial consumption of organic carbon. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 50(6/7): 1311-1325 |
CHEN C T A, WANG S L, 1999. Carbon, alkalinity and nutrient budgets on the East China Sea continental shelf. Journal of Geophysical Research: Oceans, 104(C9): 20675-20686 DOI:10.1029/1999JC900055 |
CHOU W C, GONG G C, SHEU D D et al, 2009. Reconciling the paradox that the heterotrophic waters of the East China Sea shelf act as a significant CO2 sink during the summertime: Evidence and implications. Geophysical Research Letters, 36(15): L15607 DOI:10.1029/2009GL038475 |
DANERI G, DELLAROSSA V, QUIñONES R et al, 2000. Primary production and community respiration in the Humboldt Current System off Chile and associated oceanic areas. Marine Ecology Progress Series, 197: 41-49 DOI:10.3354/meps197041 |
DE HAAS H, VAN WEERING T C E, DE STIGTER H, 2002. Organic carbon in shelf seas: sinks or sources, processes and products. Continental Shelf Research, 22(5): 691-717 DOI:10.1016/S0278-4343(01)00093-0 |
DEL GIORGIO P A, COLE J J, CIMBLERIS A, 1997. Respiration rates in bacteria exceed phytoplankton production in unproductive aquatic systems. Nature, 385(6612): 148-151 DOI:10.1038/385148a0 |
DUCKLOW H W, DONEY S C, 2013. What is the metabolic state of the oligotrophic ocean? A debate. Annual Review of Marine Science, 5: 525-533 DOI:10.1146/annurev-marine-121211-172331 |
GARCÍA-MARTÍN E E, DANIELS C J, DAVIDSON K et al, 2019. Plankton community respiration and bacterial metabolism in a North Atlantic Shelf Sea during spring bloom development (April 2015). Progress in Oceanography, 177: 101873 DOI:10.1016/j.pocean.2017.11.002 |
GATTUSO J P, FRANKIGNOULLE M, WOLLAST R, 1998. Carbon and carbonate metabolism in coastal aquatic ecosystems. Annual Review of Ecology and Systematics, 29: 405-434 DOI:10.1146/annurev.ecolsys.29.1.405 |
GONG G C, SHIAH F K, LIU K K et al, 2000. Spatial and temporal variation of chlorophyll a, primary productivity and chemical hydrography in the southern East China Sea. Continental Shelf Research, 20(4/5): 411-436 |
GRIFFITH P C, POMEROY L R, 1995. Seasonal and spatial variations in pelagic community respiration on the southeastern U.S. continental shelf. Continental Shelf Research, 15(7): 815-825 DOI:10.1016/0278-4343(94)00040-T |
HASHIMOTO S, HORIMOTO N, ISHIMARU T et al, 2006. Metabolic balance of gross primary production and community respiration in Sagami Bay, Japan. Marine Ecology Progress Series, 321: 31-40 DOI:10.3354/meps321031 |
HOPKINSON JR C, 1985. Shallow-water benthic and pelagic metabolism: evidence of heterotrophy in the nearshore Georgia Bight. Marine Biology, 87(1): 19-32 DOI:10.1007/BF00397002 |
HUANG Y B, CHEN B Z, HUANG B Q et al, 2019. Potential overestimation of community respiration in the western Pacific boundary ocean: what causes the putative net heterotrophy in oligotrophic systems?. Limnology and Oceanography, 64(5): 2202-2219 DOI:10.1002/lno.11179 |
KHATIWALA S, PRIMEAU F, HALL T, 2009. Reconstruction of the history of anthropogenic CO2 concentrations in the ocean. Nature, 462(7271): 346-349 DOI:10.1038/nature08526 |
LIN S, HSIEH I J, HUANG K M et al, 2002. Influence of the Yangtze River and grain size on the spatial variations of heavy metals and organic carbon in the East China Sea continental shelf sediments. Chemical Geology, 182(2/3/4): 377-394 |
LIU K K, ISEKI K, CHAO S Y, 2000. Continental margin carbon fluxes[M]//HANSON R B, DUCKLOW H W, FIELD J G. The Changing Ocean Carbon Cycle: A Midterm Synthesis of the Joint Global Ocean Flux Study. Canbridge, United Kindom: Cambridge University Press: 187-239.
|
MORAN M A, POMEROY L R, SHEPPARD E S et al, 1991. Distribution of terrestrially derived dissolved organic matter on the southeastern U.S. continental shelf. Limnology and Oceanography, 36(6): 1134-1149 DOI:10.4319/lo.1991.36.6.1134 |
ODUM H T, 1956. Primary production in flowing waters. Limnology and Oceanography, 1(2): 102-117 DOI:10.4319/lo.1956.1.2.0102 |
POMEROY L R, SHELDON J E, SHELDON JR W M, 1994. Changes in bacterial numbers and leucine assimilation during estimations of microbial respiratory rates in seawater by the precision Winkler method. Applied and Environmental Microbiology, 60(1): 328-332 DOI:10.1128/aem.60.1.328-332.1994 |
SHERR E B, SHERR B F, SIGMON C T, 1999. Activity of marine bacteria under incubated and in situ conditions. Aquatic Microbial Ecology, 20(3): 213-223 |
SIGMAN D M, BOYLE E A, 2000. Glacial/interglacial variations in atmospheric carbon dioxide. Nature, 407(6806): 859-869 DOI:10.1038/35038000 |
SMITH S V, HOLLIBAUGH J T, 1993. Coastal metabolism and the oceanic organic carbon balance. Reviews of Geophysics, 31(1): 75-89 DOI:10.1029/92RG02584 |
SVERDRUP H U, JOHNSON M W, FLEMING R H, 1942. The earth and the ocean basins[M]//SVERDRUP H U, JOHNSON M W, FLEMING R H. The Oceans Their Physics, Chemistry, and General Biology. New York, USA: Prentice-Hall: 8-46.
|
WALSH J J, 1991. Importance of continental margins in the marine biogeochemical cycling of carbon and nitrogen. Nature, 350(6313): 53-55 DOI:10.1038/350053a0 |
WALSH J J, ROWE G T, IVERSON R L et al, 1981. Biological export of shelf carbon is a sink of the global CO2 cycle. Nature, 291(5812): 196-201 DOI:10.1038/291196a0 |
WANG S L, CHEN C T A, HONG G H et al, 2000. Carbon dioxide and related parameters in the East China Sea. Continental Shelf Research, 20(4/5): 525-544 |
ZHANG Y F, LI D W, WANG K et al, 2019. Contribution of biological effects to the carbon sources/sinks and the trophic status of the ecosystem in the Changjiang (Yangtze) river estuary plume in summer as indicated by net ecosystem production variations. Water, 11(6): 1264 DOI:10.3390/w11061264 |
 2022, Vol. 53
2022, Vol. 53


