中国海洋湖沼学会主办。
文章信息
- 连晋欣, 臧娜, 林东明, 陈新军. 2021.
- LIAN Jin-Xin, ZANG Na, LIN Dong-Ming, CHEN Xin-Jun. 2021.
- 东太平洋赤道海域茎柔鱼(Dosidicus gigas)的体型月间变化及环境效应
- MONTHLY VARIATION IN BODY SIZE OF DOSIDICUS GIGAS AND ENVIRONMENTAL RESPONSES IN THE EQUATORIAL WATERS OF EASTERN PACIFIC OCEAN
- 海洋与湖沼, 52(4): 1007-1018
- Oceanologia et Limnologia Sinica, 52(4): 1007-1018.
- http://dx.doi.org/10.11693/hyhz20201100322
文章历史
-
收稿日期:2020-11-29
收修改稿日期:2021-02-07
2. 大洋渔业资源可持续开发省部共建教育部重点实验室 上海 201306;
3. 国家远洋渔业工程技术研究中心 上海 201306;
4. 农业农村部大洋渔业开发重点实验室 上海 201306;
5. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266237
2. Key Laboratory of Sustainable Exploitation of Oceanic Fishery Resources, Ministry of Education, Shanghai 201306, China;
3. National Distant-water Fisheries Engineering Research Center, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
5. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
茎柔鱼(Dosidicus gigas)隶属于柔鱼科(Ommastrephidae)、茎柔鱼属(Dosidicus), 广泛分布在东太平洋海域, 栖息水层深度可达1200 m (Jereb et al, 2010)。茎柔鱼为重要的大洋性柔鱼种类, 生长速度快、生命周期短(Nigmatullin et al, 2001; Jereb et al, 2010), 并且因其世代更替快、资源生物量大, 已经成为世界远洋鱿钓渔业的重要捕捞对象, 年产量可达70万t (FAO, 2016; 陈新军, 2019)。在东太平洋海洋生态系统中, 茎柔鱼也起着重要的生态角色作用, 是低营养级生物与高营养级生物之间能量流动的重要链接媒介(Jereb et al, 2010; Rosa et al, 2013)。该种类既是海洋甲壳类、鱼类和头足类的重要捕食者, 也是黄鳍金枪鱼(Thunnus albacares)、剑鱼(Xiphias gladius)和抹香鲸(Physeter macrocephalus)等较高等级海洋捕食者的重要饵料生物(Jereb et al, 2010; Rosa et al, 2013)。
自然种群生物个体的体型既是其生长发育、营养状况、群体补充、自然死亡等的综合表现(Allen et al, 2006; Audzijonyte et al, 2020), 也是其在生态系统中角色作用的重要表征(Sookias et al, 2012; Clements et al, 2017), 对了解自然物种的环境适应性和种群资源的波动变化尤为关键。大洋性柔鱼类的性腺发育滞后于个体生长, 终生一次繁殖, 产卵结束后不久便死去, 理论上其潜在繁殖力和生殖价值决定于体型大小(Laptikhovsky et al, 1993; Hoving et al, 2010; Beasley et al, 2017)。Nigmatullin等(2009)就曾报道了茎柔鱼的潜在繁殖力与其体型密切相关, 胴长710 mm成体的潜在繁殖力是胴长460 mm成体潜在繁殖力的6倍。目前, 国内外学者对茎柔鱼的年龄与生长(Argüelles et al, 2001; Markaida et al, 2004; Chen et al, 2011)、摄食生态(Markaida et al, 2003; Field et al, 2013; Rosas-Luis et al, 2016)、资源量与海洋环境关系(方学燕等, 2014; 汪金涛等, 2014; Ibáñez et al, 2016)等进行了较为广泛的研究, 在肌肉组织能量积累(魏嫣然等, 2018; 韩飞等, 2020)、生殖投入(韩飞等, 2019; Chen et al, 2020)等方面也做了一定的研究报道。同时, 茎柔鱼被认为是对环境波动变化敏感性高的大洋性种类, 在其分布海域范围内形成了体型结构复杂的种群结构(Ibáñez et al, 2007; Keyl et al, 2011)。然而, 茎柔鱼体型生长的月份变化研究则鲜有见诸报道, 并且栖息环境对其体型的影响效应亟需建立数学模型关系。为此, 本研究拟根据2017年2—4月和6—8月在东太平洋赤道公海茎柔鱼资源探捕期间采集的茎柔鱼样本, 结合采样海域海表温、叶绿素a浓度等环境因子分析, 对其体型的月间变化及体型与环境因子关系进行探索研究, 旨在进一步认知该种类资源体型方面的生长特点, 为可持续开发和利用该种群资源提供生物学基础知识。
1 材料与方法 1.1 样本采集和生物学测定茎柔鱼样本来自我国远洋鱿钓渔业作业船的渔获物, 采集时间为2017年2—4月和6—8月, 采集海域为纬度9.33°S—1.35°N、经度84.11°W—118.60°W (图 1)。本研究随机采集了样本3 628尾, 其中雌性2 636尾, 雄性992尾。样本采集后经–30 ℃冷冻保藏运回岸上实验室进行分析。
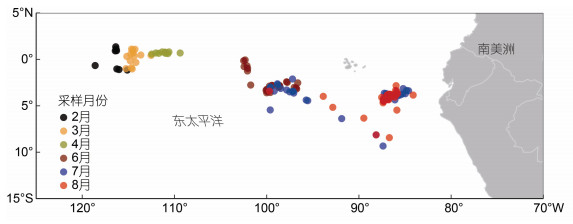 |
| 图 1 东太平洋海域茎柔鱼采样站点 Fig. 1 The sampling stations of D. gigas in the eastern Pacific Ocean |
实验室室温解冻后, 进行体质量(body weight, BW)、胴长(mantle length, ML)等生物学项目测定。其中, 胴长用量鱼板测定, 精确至1 mm; 体质量用电子天平测定, 精确至1 g。
1.2 采样海域的海表温、叶绿素a浓度采样海域的海表温和叶绿素a浓度下载自美国NOAA海洋观测中心ERDDAP数据服务终端(https://oceanwatch.pifsc.noaa.gov/erddap/index.html)。其中, 海表温数据库ID为CRW_sst_v1_0_monthly, 叶绿素a浓度数据库ID为OceanWatch_nasa-viirs_chla_ monthly, 两者的时间精度为月, 空间分辨率为0.05°×0.05°。
2017年, 茎柔鱼样本采集海域的海表温(sea surface temperature, SST)分布和叶绿素a浓度(chlorophyll a concentration, chl a)分布如图 2所示。样本采集站点位于海表温20—27 ℃, 叶绿素a浓度0.17—0.40 mg/m3的海域之间。其中, 2月份采样站点的月平均海表温为(26.11±0.09) ℃, 叶绿素a浓度为(0.20±0.01) mg/m3; 3月份采样站点的月平均海表温为(26.78±0.17) ℃, 叶绿素a浓度为(0.19±0.01) mg/m3; 4月份采样站点的月平均海表温为(27.01±0.19) ℃, 叶绿素a浓度为(0.20±0.01) mg/m3; 6月份采样站点的月平均海表温为(24.77±0.42) ℃, 叶绿素a浓度为(0.21±0.03) mg/m3; 7月份采样站点的月平均海表温为(22.57±1.11) ℃, 叶绿素a浓度为(0.23±0.04) mg/m3; 8月份采样站点的月平均海表温为(20.64±0.52) ℃, 叶绿素a浓度为(0.30±0.04) mg/m3。
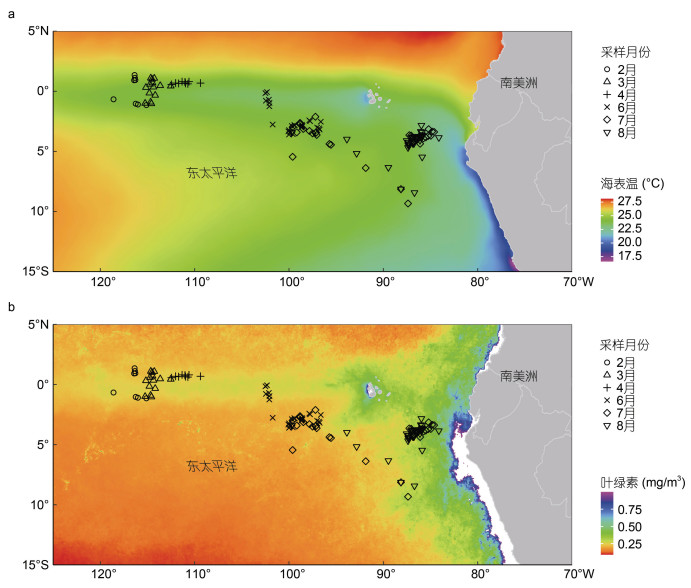 |
| 图 2 东太平洋茎柔鱼样本采集海域2017年的平均海表温(a)和叶绿素a浓度(b)分布 Fig. 2 The average sea surface temperature (a) and chlorophyll a concentration (b) in the eastern Pacific Ocean where D. gigas were sampled in 2017 |
(1) 采用频率分布法分析茎柔鱼的胴长组成, 组间距采用50 mm。计算每个采样月份的平均胴长和平均体质量, 统计分析优势胴长组及其所占比重。
(2) 茎柔鱼生命周期短、生长发育快(Jereb et al, 2010; Rosa et al, 2013), 为了比较茎柔鱼月份的生长特点, 使用幂函数拟合分析不同月份茎柔鱼体质量与胴长的关系。同时, 求取体质量-胴长幂函数关系残差并标准化, 作为表征个体的体征指标(body condition index, CI) (林东明等, 2017; 韩飞等, 2019), 并比较分析茎柔鱼个体月份间的生长质量变化。体质量-胴长(W-L)幂函数关系的计算公式(黄真理等, 1999)为:
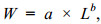 (1)
(1)式中, W为体质量(g), L为胴长(mm), a、b为待估算参数。
(3) 利用广义线性混合效应模型(generalized linear mixed-effects models, GLMM), 拟合胴长与采样海域海表温、叶绿素a浓度和采样站点经度、纬度的关系。为了避免出现过参数化(overparameterization), 模型分析中不考虑解析因子的交互作用。方差扩大因子(variance inflation factor, VIF)检验显示, 采样站点经度与其他参数的共线性显著(雌性, VIF=11.89; 雄性, VIF=8.38), 模型分析中将其剔除。模型中以采样月份作为随机效应变量。模型方程(Zuur et al, 2009)如下:
 (2)
(2)式中, ML为胴长(mm); α0为采样月份对模型截距的随机影响, α1、α2、α3分别为海表温(SST)、叶绿素a浓度(chl a)、纬度(Lat)对胴长的效应, ε为模型误差项。模型拟合时, 胴长取自然对数ln(ML)以降低数据极值的影响(Zuur et al, 2009)。
利用R平台进行数据的处理分析。实验数据以平均值±标准差(mean±SD)表示。t检验分析雌性、雄性个体体质量-胴长关系b值与匀速生长b=3的差异性, 以及不同月份之间b值的差异性。利用单样本Kolmogorov-Smirnoff分析检验体征数据的正态性, 若符合正态分布则利用单因素方差分析(ANOVA)检验分析体征分布的月份差异, 并进行Tukey HSD随后检验; 若不符合正态分布则利用Kruskall-Wallis非参数检验分析体征分布的月份差异性, 利用Games-Howell HSD进行随后的显著性检验。广义线性混合效应模型使用程序包lme4 (Bates et al, 2015)进行拟合分析。数据分析的显著性水平为P < 0.05。
2 结果 2.1 实验样本的个体组成分析显示, 茎柔鱼雌性个体的胴长范围为163—468 mm, 体质量范围为123—3 034 g; 雄性个体的胴长范围为171—475 mm, 体质量范围为145—2 681 g。不同采样月份之间, 雌性、雄性个体的胴长和体质量均存在显著性差异(胴长F=439.26, P < 0.05; 体质量F=487.08, P < 0.05), 并且两者的胴长和体质量均以2月份的个体为最大, 6月、7月和8月的个体较小且三个月份之间的胴长、体质量均没有显著性差异(表 1)。此外, 每个采样月份, 雌性、雄性个体的胴长分布均呈单峰值区间分布(图 3, 4)。
| 月份 | n | 胴长(mm) | 体质量(g) | |||
| 范围 | 平均值±标准差 | 范围 | 平均值±标准差 | |||
| 雌性 | ||||||
| 2月份 | 68 | 326—452 | 397.79±31.78a | 972—2 983 | 1 835.59±498.69a | |
| 3月份 | 169 | 256—455 | 334.57±50.38c | 428—2 764 | 1 124.74±560.41c | |
| 4月份 | 117 | 270—468 | 356.78±49.74b | 570—3 034 | 1 352.97±597.46b | |
| 6月份 | 706 | 163—380 | 261.95±36.21d | 163—1 815 | 549.59±254.84d | |
| 7月份 | 784 | 168—395 | 257.76±34.43d | 123—1 744 | 522.62±243.60d | |
| 8月份 | 792 | 180—375 | 259.40±33.35d | 148—1 507 | 519.20±223.07d | |
| 总计 | 2 636 | 163—468 | 272.31±49.47 | 123—3 034 | 638.15±420.96 | |
| 雄性 | ||||||
| 2月份 | 14 | 352—475 | 402.29±30.69a | 1 191—2 681 | 1 758.29±366.94a | |
| 3月份 | 70 | 268—384 | 324.93±31.65c | 479—1 667 | 923.90±271.55c | |
| 4月份 | 43 | 292—438 | 344.58±35.81b | 633—2 486 | 1 132.40±440.49b | |
| 6月份 | 264 | 195—362 | 259.42±37.39d | 215—1 395 | 519.43±236.53d | |
| 7月份 | 221 | 196—342 | 249.39±34.20d | 202—1 305 | 456.29±213.94d | |
| 8月份 | 380 | 171—376 | 245.23±30.67d | 145—1 337 | 419.22±176.66d | |
| 总计 | 992 | 171—475 | 262.08±46.10 | 145—2 681 | 539.58±325.49 | |
| 注: 平均值±标准差上标示不同字母表示随后检验差异显著(P < 0.05) | ||||||
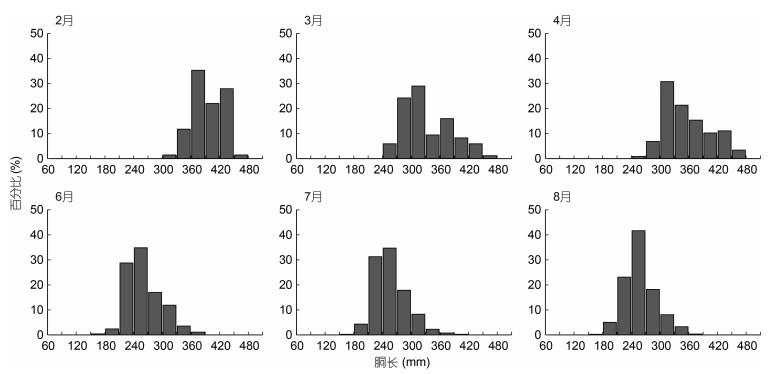 |
| 图 3 茎柔鱼雌性个体胴长的月份分布 Fig. 3 The distribution of mantle length by sampling month for female D. gigas |
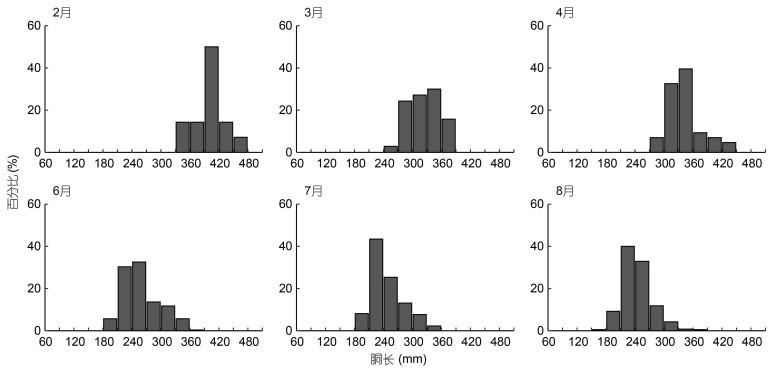 |
| 图 4 茎柔鱼雄性个体胴长的月份分布 Fig. 4 The distribution of mantle length by sampling month for male D. gigas |
茎柔鱼雌性、雄性个体的体质量与胴长的幂函数关系式分别为BW=3.68×10–5 ML2.95和BW=4.45× 10–5 ML2.91 (图 5)。t检验结果显示, 雌性、雄性个体的体质量-胴长幂函数关系b值均与匀速生长假设b=3之间存在显著性差异(雌性, t= –3.46, P < 0.05; 雄性, t= –4.66, P < 0.05)。同时, 每个采样月份茎柔鱼雌性、雄性个体的体质量与胴长均呈显著的幂函数关系, 拟合r2均在0.90以上(表 2)。t检验显示, 2月份雌性个体呈显著的正异速生长(t=2.29, P < 0.05), 6月份雌性个体则呈显著的负异速生长(t= –3.42, P < 0.05), 其他月份的则与匀速生长假设b=3没有显著性差异(表 2)。在雄性个体中, 2月份、6月份和8月份的个体均表现为显著的负异速生长(P < 0.05), 其他月份个体的生长则与匀速生长假设b=3没有显著性差异(P > 0.05) (表 2)。
 |
| 图 5 茎柔鱼雌雄个体体质量与胴长的关系 Fig. 5 The relationship between body weight and mantle length for female and male D. gigas 注: a. 雌性; b. 雄性 |
| 月份 | n | 拟合参数 | 拟合b值与b=3的t检验 | ||||
| a值 | b值 | r2 | t | P | |||
| 雌性 | |||||||
| 2月份 | 68 | 5.45e-06 | 3.28 | 0.92 | 2.29 | 0.025 | |
| 3月份 | 169 | 2.04e-05 | 3.05 | 0.96 | 1.07 | 0.286 | |
| 4月份 | 117 | 3.61e-05 | 2.96 | 0.95 | –0.65 | 0.519 | |
| 6月份 | 706 | 5.38e-05 | 2.89 | 0.92 | –3.42 | 0.001 | |
| 7月份 | 784 | 3.14e-05 | 2.98 | 0.90 | –0.46 | 0.644 | |
| 8月份 | 792 | 3.50e-05 | 2.96 | 0.92 | –1.27 | 0.204 | |
| 总计 | 2 636 | 3.68e-05 | 2.95 | 0.95 | –3.46 | 0.001 | |
| 雄性 | |||||||
| 2月份 | 14 | 5.76e-04 | 2.49 | 0.87 | –1.91 | 0.040 | |
| 3月份 | 70 | 6.71e-05 | 2.89 | 0.92 | –1.62 | 0.110 | |
| 4月份 | 43 | 8.21e-06 | 3.10 | 0.96 | 1.92 | 0.062 | |
| 6月份 | 264 | 5.95e-05 | 2.86 | 0.94 | –3.01 | 0.003 | |
| 7月份 | 221 | 2.12e-05 | 3.05 | 0.95 | 1.02 | 0.311 | |
| 8月份 | 380 | 5.44e-05 | 2.87 | 0.92 | –2.96 | 0.003 | |
| 总计 | 992 | 4.45e-05 | 2.91 | 0.96 | –4.66 | 0.000 | |
不同月份之间, 雌性、雄性个体的体征均存在显著性差异(雌性, F=7.32, P < 0.05; 雄性, F=7.89, P < 0.05)。雌性个体在6—7月份时体征较佳, 在4月份时最差, 3月份的次之(图 6a); 雄性个体的较佳体征也出现在6—7月份, 在3月份时体征最差, 次之为2月份(图 6b)。
 |
| 图 6 茎柔鱼雌性、雄性个体体征的采样月份分布 Fig. 6 Distribution of body condition by sampling months for female and male D. gigas 注: a. 雌性; b. 雄性。各组平均值上标示的不同字母表示随后检验差异显著(P < 0.05) |
广义线性混合效应模型(GLMM)结果显示, 茎柔鱼雌性个体的胴长与海表温、叶绿素a浓度和纬度密切相关(海表温, t=4.59, P < 0.05; 叶绿素a浓度, t=4.21, P < 0.05; 纬度, t=8.51, P < 0.05), 采样月份对个体胴长的效应方差为0.015, 模型的合计方差解析率为54% (R2=0.54) (表 3)。同时, GLMM模型的效应关系图显示, 雌性个体的胴长与海表温、叶绿素a浓度和纬度均呈正相关关系(图 7)。
| 随机效应 | ||||
| 因子 | 效应方差 | |||
| 采样月份 | 0.015 | |||
| 残差 | 0.016 | |||
| 固定效应 | ||||
| 参数 | 估计 | 标准误差 | t | P |
| 截距 | 5.04 | 0.16 | 31.34 | < 2.00×10–16 |
| 海表温 | 0.02 | 0.01 | 4.59 | 4.80×10–6 |
| 叶绿素a浓度 | 0.45 | 0.11 | 4.21 | 2.64×10–5 |
| 纬度 | 0.02 | 0.002 | 8.51 | < 2.00×10–16 |
| 模型统计 | ||||
| R2 | 0.54 | |||
| 注: R2为模型固定效应和随机效应的合计方差解析率 | ||||
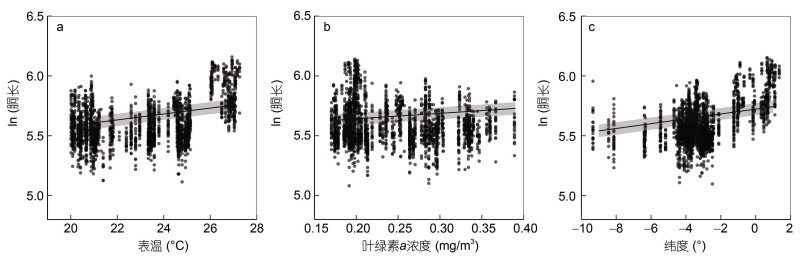 |
| 图 7 茎柔鱼雌性个体胴长与海表温(a)、叶绿素a浓度(b)和纬度(c)的线性混合效应模型关系 Fig. 7 The relationships between mantle length and sea surface temperature (a), chlorophyll-a (b) and latitude (c) for female D. gigas using generalized linear mixed-effects model |
类似于雌性个体, GLMM结果显示茎柔鱼雄性个体的胴长与海表温和纬度密切相关(海表温, t=4.03, P < 0.05; 纬度, t=6.75, P < 0.05), 与叶绿素a浓度的相关性不显著(t=0.11, P=0.91), 采样月份对个体胴长的效应方差为0.013, 模型的合计方差解析率为63% (R2=0.63) (表 4)。GLMM效应关系图显示, 雄性个体的胴长随着海表温上升而增大, 并且在纬度较低时具有较大的体型(图 8)。
| 随机效应 | ||||
| 因子 | 效应方差 | |||
| 采样月份 | 0.013 | |||
| 残差 | 0.015 | |||
| 固定效应 | ||||
| 参数 | 估计 | 标准误差 | t | P |
| 截距 | 4.89 | 0.29 | 21.33 | < 2.00×10–16 |
| 海表温 | 0.03 | 0.01 | 4.28 | 2.00×10–5 |
| 叶绿素a浓度 | 0.04 | 0.16 | 0.26 | 0.79 |
| 纬度 | 0.02 | 0.004 | 6.66 | 4.71×10–11 |
| 模型统计 | ||||
| R2 | 0.63 | |||
| 注: R2为模型固定效应和随机效应的合计方差解析率 | ||||
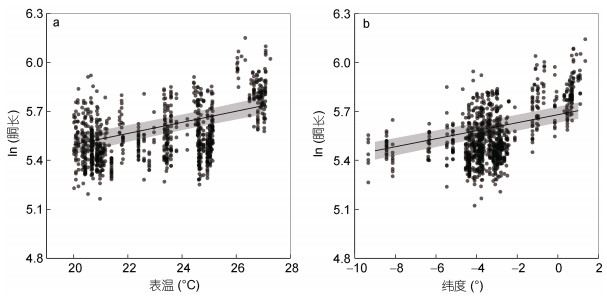 |
| 图 8 茎柔鱼雄性个体胴长与海表温(a)和纬度(b)的线性混合效应模型关系 Fig. 8 The relationships of the mantle length to sea surface temperature (a) and to latitude (b) for male D. gigas using generalized linear mixed-effects model |
大洋性头足类寿命短、生长快、终生一次繁殖产卵, 在其栖息海域范围内进化了全年生长、全年繁殖的生活史特性(Jereb et al, 2010; Rosa et al, 2013; 刘必林等, 2016); 而且, 这些种类的生长发育具有季节特性, 且以体型大小变化为主要表现特征(Nigmatullin et al, 2001)。本研究结果显示, 2017年2—4月和6—8月在东太平洋赤道海域采集的茎柔鱼体型(胴长和体质量)以2月份的个体为最大(P < 0.05), 其他月份呈趋小变化。结果与智利中南部海域(Ibáñez et al, 2007)和秘鲁外海(Keyl et al, 2011)茎柔鱼群体体型大小的季节性变化结果相一致。研究还发现, 采集的样本体型在3月份和4月份之间, 6月份、7月份和8月份之间均没有显著性差异, 且6—8月份样本体型较小。同时, 每个采样月份的样本体型均呈单峰值区间分布。这些结果表明, 随着月份推移东太平洋赤道海域可能存在不同孵化季节的茎柔鱼补充群体, 也一定地佐证了该种类全年生长、全年繁殖的生活史特性(Nigmatullin et al, 2001; Jereb et al, 2010; Rosa et al, 2013)。
水生动物的生长发育具有不均匀性, 表现在体质量、体长的不均匀增长(Economo et al, 2005; Froese, 2006)。一般来说, 体质量-胴长体长(W-L)幂函数关系式W=a×Lb的参数b值可以直观地反映这些生物个体从幼体到成体生长发育的不均匀性: 异速生长→等速生长→异速生长, 并且幼体阶段b值多低于3, 成体时接近或者大于3(黄真理等, 1999)。本实验的茎柔鱼雌性、雄性个体, 不分月份统计时其体质量-胴长幂函数关系的b值均与匀速生长假设b=3存在显著性差异、且均小于3, 说明这些实验样本中的大部分个体处于性腺成熟前的生长发育期。然而, 不同采样月份样本个体的体质量-胴长幂函数关系分析显示, 雌性个体的幂函数关系式b值在2—4月份逐月变小, 并且2月份的b值显著大于匀速生长b=3假设(P < 0.05), 3月和4月份的b则与匀速生长b=3假设一致(P > 0.05)。相反, 雄性个体幂函数关系式b值在2—4月份逐月趋大, 且在4月份时b > 3。这些结果表明, 2—4月份茎柔鱼雌性、雄性个体可能处于不同的生长发育阶段, 即雌性中的大部分个体可能处于成体阶段, 而雄性个体则可能随着月份推移逐渐发育成熟。然而, 大洋性头足类多表现为雄性个体性腺先行发育成熟, 随后先行离开索饵场洄游至产卵场所(Boyle et al, 2005; Rosa et al, 2013)。陈新军等(2012)曾报道, 在东太平洋赤道海域(与本研究2—4月份采样海域相同)12月至翌年4月份采集的茎柔鱼成熟个体中雄性个体数量仅为雌性个1/10, 认为是成熟雄性个体先行离开的原因所致。因此在2—4月份, 茎柔鱼雄性个体体质量-胴长幂函数关系式b值随着月份推移趋大的情况, 也有可能是逐月发育成熟的雄性成体已先行离开采样海域所致。
与2—4月份不同, 雌性茎柔鱼样本的体质量-胴长幂函数关系式b值在6—8月份时均小于3, 雄性个体在6月份和8月份的b值显著小于b=3, 而在7月份的b值符合匀速生长b=3假设。Tafur等(2001)和Rosa等(2013)曾报道, 东太平洋秘鲁近海是茎柔鱼在南半球的重要产卵场和孵化场, 孵化个体会沿着洪堡海流和南赤道流输入赤道水域快速育肥生长。结合6—8月份采集样本体型偏小、采集海域较2—4月份的更加靠近秘鲁近海产卵孵化场等, 可以说明6—8月份茎柔鱼样本中的大部分个体可能正处于生长发育期。此外, 茎柔鱼的生殖投入策略为收入-资本混合型, 在生理性发育期和成熟期将转化部分肌肉存储能量以供给性腺发育所需(韩飞等, 2019; Chen et al, 2020)。理论上, 肌肉组织存储能量的转化将降低个体的体征, 并影响其体质量-胴长的函数关系(黄真理等, 1999; Green, 2001)。本研究的茎柔鱼体征在2—4月份时均为负值, 体征较差; 6—8月份时体征为正值, 体征较佳。该结果可进一步表明2—4月份和6—8月份采集的茎柔鱼个体处于不同的发育时期。
3.2 体型与环境的效应关系大洋性头足类对海洋环境变化的敏感性高, 且具有较高的环境适应性(Jereb et al, 2010)。通常, 水温是影响头足类生长发育的重要环境因子, 决定着个体的生长速率进而影响体型大小(Forsythe, 2004; Boyle et al, 2005)。本研究结果显示, 茎柔鱼雌性、雄性个体的胴长均与采样海域的海表温呈正相关关系, 表明茎柔鱼的体型随着水温升高而趋大, 与Keyl等(2011)的较大体型多出现在水温较为暖和水域的研究结果相近。同时, 本研究海域的月均水温在20—27 ℃之间(图 2a), 处于茎柔鱼生长发育的耐热范围之内(Gilly et al, 2006; Stewart et al, 2013)。Staaf等(2011)和Velázquez等(2013)研究发现, 在适宜的水温条件下茎柔鱼的生长速率随着栖息海域水温升高而显著增大。因而, 茎柔鱼体型随水温趋大的现象可能是在适温范围内较高的水温促进个体生长发育, 随之形成了较大的体型结构。
然而, 茎柔鱼体型与水温的正相关关系似乎与温度-体型法则(temperature-size rule)所阐述的变温动物体型随着温度升高而缩小的论点(Atkinson, 1994)有所相悖。其实不然, 茎柔鱼类似于其他大洋性头足类, 在其较为短暂的生命周期里进行着索饵-产卵洄游习性(Jereb et al, 2010)。在东太平洋海域, 茎柔鱼季节性地进行秘鲁外海→赤道海域的索饵育肥洄游, 并在赤道海域附近发育成熟, 随后进行赤道海域→秘鲁外海的繁殖产卵洄游(Rosa et al, 2013)。茎柔鱼雌性、雄性个体体型随采样海域纬度显著增大的结果(图 7c, 图 8b), 也一定程度地佐证了茎柔鱼在赤道海域附近发育成熟的情况。因而在赤道海域, 同一年份采集的样本中来自于水温较高水域的茎柔鱼个体也将具有较大的体型结构, 而温度-体型法则在此应用可能存在一定的局限性。此外, 最近Audzijonyte等(2020)研究发现在全球气候变暖下, 澳大利亚近海的珊瑚礁鱼类近55%左右的体型趋小型化, 而余下的则体型趋大, 表明海洋生物体型因水温升高的变化趋势可能存在属种特殊性。东太平洋赤道海域处于热带太平洋次表层异常(subsurface ocean temperature anomaly, SOTA)与厄尔尼诺与南方涛动(El Niño-Southern Oscillation, ENSO)循环系统作用下, 导致海域表面温度变化波动较为频繁(陈永利等, 2020)。因此, 后续需要加强同海域、多年份的较长时期的实验观察, 以验证温度-体型法则在茎柔鱼生长发育上的应用。
东太平洋赤道海域因丰富的上升流系统形成了高营养盐、低溶解氧水域环境, 然而叶绿素a浓度处于较低水平(Fiedler et al, 2006)。本研究采样海域的叶绿素a浓度在0.17—0.40 mg/m3之间(图 2b), 处于茎柔鱼适宜且集中分布时的叶绿素a浓度范围之内(0.06—0.50 mg/m3) (方学燕等, 2014)。然而, 本研究的茎柔鱼体型与采样海域的叶绿素a浓度关系具有雌雄差异性, 雌性个体体型随着叶绿素a浓度增加而趋大, 而雄性个体体型则与叶绿素a浓度没有显著的效应关系。这可能与茎柔鱼雌性和雄性个体的生长发育特性不同有关。类似于其他柔鱼类, 茎柔鱼的体型为雌雄二态型, 雌性个体的生长速率、体型均比雄性个体的为大(Argüelles et al, 2001; Markaida et al, 2004; Chen et al, 2011), 并且捕食能力随体型增大而提升(Field et al, 2013; Rosas-Luis et al, 2016)。因此, 在适宜的叶绿素a浓度范围之内, 雌性个体可能更倾向于在叶绿素a浓度较高、生产力较好的区域觅食生长, 以获得更大的体型结构。
4 结论本研究根据2017年2—4月和6—8月在东太平洋赤道公海采集的茎柔鱼样本, 分析茎柔鱼体型生长的月间变化, 并利用广义线性混合模型研究分析体型与环境因子之间关系, 结果表明茎柔鱼体型的月间变化显著, 2—4月份个体体型较大, 体质量、胴长生长接近于匀速生长; 6—8月份个体体型较小, 体质量、胴长生长则为异速生长。茎柔鱼体型与海表温呈显著的正效应关系, 在赤道附近海域体型趋大。此外, 雌性个体体型随着海域叶绿素a浓度增大而趋大。在后续的研究中, 我们还需要通过较长时期的数据采集、实验观察与数据分析等更全面地了解东太平洋茎柔鱼体型的月间变化及其与海域环境因子的效应关系, 为掌握该种类资源的生长发育特性、资源可持续开发提供参考资料。
方学燕, 陈新军, 丁琪. 2014. 基于栖息地指数的智利外海茎柔鱼渔场预报模型优化. 广东海洋大学学报, 34(4): 67-73 DOI:10.3969/j.issn.1673-9159.2014.04.012 |
刘必林, 林静远, 陈新军, 等. 2016. 西北太平洋柔鱼角质颚微结构及其生长纹周期性研究. 海洋与湖沼, 47(4): 821-827 |
汪金涛, 陈新军, 高峰, 等. 2014. 基于环境因子的东南太平洋茎柔鱼资源补充量预报模型研究. 海洋与湖沼, 45(6): 1185-1191 |
陈永利, 官聪, 赵永平, 等. 2020. ENSO相联系的热带太平洋上层海洋异常环流. 海洋与湖沼, 51(5): 967-977 |
陈新军. 2019. 世界头足类资源开发现状及我国远洋鱿钓渔业发展对策. 上海海洋大学学报, 28(3): 321-330 |
陈新军, 李建华, 易倩, 等. 2012. 东太平洋赤道附近海域茎柔鱼(Dosidicus gigas)渔业生物学的初步研究. 海洋与湖沼, 43(6): 1233-1238 |
林东明, 陈新军, 魏嫣然, 等. 2017. 阿根廷滑柔鱼雌性个体肌肉和性腺组织能量积累及其生殖投入. 水产学报, 41(1): 70-80 |
黄真理, 常剑波. 1999. 鱼类体长与体重关系中的分形特征. 水生生物学报, 23(4): 330-336 DOI:10.3321/j.issn:1000-3207.1999.04.006 |
韩飞, 陈新军, 林东明. 2020. 东太平洋赤道海域茎柔鱼组织能量积累及其与海表面环境因子的关系. 中国水产科学, 27(4): 427-437 |
韩飞, 陈新军, 林东明, 等. 2019. 东太平洋赤道海域茎柔鱼体征生长及生殖投入. 水产学报, 43(12): 2511-2522 |
魏嫣然, 陈新军, 林东明, 等. 2018. 秘鲁外海茎柔鱼肌肉组织的能量积累. 中国水产科学, 25(2): 444-454 |
Allen C R, Garmestani A S, Havlicek T D et al, 2006. Patterns in body mass distributions: sifting among alternative hypotheses. Ecol Lett, 9(5): 630-643 DOI:10.1111/j.1461-0248.2006.00902.x |
Argüelles J, Rodhouse P G, Villegas P et al, 2001. Age, growth and population structure of the jumbo flying squid Dosidicus gigas in Peruvian waters. Fish Res, 54(1): 51-61 DOI:10.1016/S0165-7836(01)00380-0 |
Atkinson D, 1994. Temperature and organism size-a biological law for ectotherms?. Adv Ecol Res, 25: 1-58 |
Audzijonyte A, Richards S A, Stuart-Smith R D et al, 2020. Fish body sizes change with temperature but not all species shrink with warming. Nat Ecol Evol, 4(6): 809-814 DOI:10.1038/s41559-020-1171-0 |
Bates D, Mächler M, Bolker B et al, 2015. Fitting Linear Mixed-Effects Models Using lme4. Journal of Statistical Software, 67(1): 1-48 |
Beasley A L, Hall K C, Latella C I et al, 2017. Reproductive characteristics of three small-bodied cuttlefish in subtropical waters. Mar Freshw Res, 69(3): 403-417 |
Boyle P, Rodhouse P, 2005. Cephalopods: Ecology and Fisheries. Oxford: Blackwell Science Ltd, 464
|
Chen X J, Han F, Zhu K et al, 2020. The breeding strategy of female jumbo squid Dosidicus gigas: energy acquisition and allocation. Sci Rep, 10(1): 9639 DOI:10.1038/s41598-020-66703-5 |
Chen X J, Lu H J, Liu B L et al, 2011. Age, growth and population structure of jumbo flying squid, Dosidicus gigas, based on statolith microstructure off the Exclusive Economic Zone of Chilean waters. J Mar Biol Assoc UK, 91(1): 229-235 DOI:10.1017/S0025315410001438 |
Clements C F, Blanchard J L, Nash K L et al, 2017. Body size shifts and early warning signals precede the historic collapse of whale stocks. Nat Ecol Evol, 1(7): 0188 DOI:10.1038/s41559-017-0188 |
Economo E P, Kerkhoff A J, Enquist B J, 2005. Allometric growth, life-history invariants and population energetics. Ecol Lett, 8(4): 353-360 DOI:10.1111/j.1461-0248.2005.00737.x |
FAO, 2016. The state of world fisheries and aquaculture 2016: contributing to food security and nutrition for all. Rome: FAO, 200
|
Fiedler P C, Talley L D, 2006. Hydrography of the eastern tropical Pacific: a review. Prog Oceanogr, 69(2/4): 143-180 |
Field J C, Elliger C, Baltz K et al, 2013. Foraging ecology and movement patterns of jumbo squid (Dosidicus gigas) in the California Current System. Deep Sea Res Ⅱ Top Stud Oceanogr, 95: 37-51 DOI:10.1016/j.dsr2.2012.09.006 |
Forsythe J W, 2004. Accounting for the effect of temperature on squid growth in nature: from hypothesis to practice. Mar Freshw Res, 55(4): 331-339 DOI:10.1071/MF03146 |
Froese R, 2006. Cube law, condition factor and weight-length relationships: history, meta-analysis and recommendations. J Appl Ichthyol, 22(4): 241-253 DOI:10.1111/j.1439-0426.2006.00805.x |
Gilly W F, Markaida U, Baxter C H et al, 2006. Vertical and horizontal migrations by the jumbo squid Dosidicus gigas revealed by electronic tagging. Mar Ecol Prog Ser, 324: 1-17 DOI:10.3354/meps324001 |
Green A J, 2001. Mass/length residuals: measures of body condition or generators of spurious results?. Ecology, 82(5): 1473-1483 DOI:10.1890/0012-9658(2001)082[1473:MLRMOB]2.0.CO;2 |
Hoving H J T, Lipiński M R, Dam L, 2010. The male reproductive strategy of a deep-sea squid: sperm allocation, continuous production, and long-term storage of spermatophores in Histioteuthis miranda. ICES J Mar Sci, 67(7): 1478-1486 DOI:10.1093/icesjms/fsq041 |
Ibáñez C M, Argüelles J, Yamashiro C et al, 2016. Population dynamics of the squids Dosidicus gigas (Oegopsida: Ommastrephidae) and Doryteuthis gahi (Myopsida: Loliginidae) in northern Peru. Fish Res, 173: 151-158 DOI:10.1016/j.fishres.2015.06.014 |
Ibáñez C, Cubillos L A, 2007. Seasonal variation in the length structure and reproductive condition of the jumbo squid Dosidicus gigas (d'Orbigny. 1835) off central-south Chile. Sci Mar, 71(1): 123-128 DOI:10.3989/scimar.2007.71n1123 |
Jereb P, Roper C F E, 2010. Cephalopods of the World: An Annotated and Illustrated Catalogue of Cephalopod Species Known to Date: Volume 2: Myopsid and Oegopsid Squids. Rome: FAO, 605
|
Keyl F, Argüelles J, Tafur R, 2011. Interannual variability in size structure, age, and growth of jumbo squid (Dosidicus gigas) assessed by modal progression analysis. ICES J Mar Sci, 68(3): 507-518 DOI:10.1093/icesjms/fsq167 |
Laptikhovsky V V, Nigmatullin C M, 1993. Egg size, fecundity, and spawning in females of the genus Illex (Cephalopoda: Ommastrephidae). ICES J Mar Sci, 50(4): 393-403 DOI:10.1006/jmsc.1993.1044 |
Markaida U, Quiñónez-Velázquez C, Sosa-Nishizaki O, 2004. Age, growth and maturation of jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) from the Gulf of California, Mexico. Fish Res, 66(1): 31-47 DOI:10.1016/S0165-7836(03)00184-X |
Markaida U, Sosa-Nishizaki O, 2003. Food and feeding habits of jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) from the Gulf of California, Mexico. J Mar Biol Assoc UK, 83(3): 507-522 DOI:10.1017/S0025315403007434h |
Nigmatullin C M, Markaida U, 2009. Oocyte development, fecundity and spawning strategy of large sized jumbo squid Dosidicus gigas (Oegopsida: Ommastrephinae). J Mar Biol Assoc UK, 89(4): 789-801 DOI:10.1017/S0025315408002853 |
Nigmatullin C M, Nesis K N, Arkhipkin A I, 2001. A review of the biology of the jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae). Fish Res, 54(1): 9-19 DOI:10.1016/S0165-7836(01)00371-X |
Rosa R, Yamashiro C, Markaida U et al, 2013. Dosidicus gigas, Humboldt squid. In: Rosa R, Pierce G, O'Dor R K eds. Advances in Squid Biology, Ecology and Fisheries. Part Ⅱ - Oegopsid Squids. New York: Nova Science Publishers, 169-206
|
Rosas-Luis R, Chompoy-Salazar L, 2016. Description of food sources used by jumbo squid Dosidicus gigas (D'Orbigny. 1835) in Ecuadorian waters during 2014. Fish Res, 173: 139-144 DOI:10.1016/j.fishres.2015.08.006 |
Sookias R B, Benson R B J, Butler R J, 2012. Biology, not environment, drives major patterns in maximum tetrapod body size through time. Biol Lett, 8(4): 674-677 DOI:10.1098/rsbl.2012.0060 |
Staaf D J, Zeidberg L D, Gilly W F, 2011. Effects of temperature on embryonic development of the Humboldt squid Dosidicus gigas. Mar Ecol Prog Ser, 441: 165-175 DOI:10.3354/meps09389 |
Stewart J S, Gilly W F, Field J C et al, 2013. Onshore-offshore movement of jumbo squid (Dosidicus gigas) on the continental shelf. Deep Sea Res Ⅱ Top Stud Oceanogr, 95: 193-196 DOI:10.1016/j.dsr2.2012.08.019 |
Tafur R, Villegas P, Rabí M et al, 2001. Dynamics of maturation, seasonality of reproduction and spawning grounds of the jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) in Peruvian waters. Fish Res, 54(1): 33-50 DOI:10.1016/S0165-7836(01)00379-4 |
Velázquez C Q, Herrera A H, Velázquez-Abunader I et al, 2013. Maturation, age, and growth estimation of the jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) in the Central Region of the Gulf of California. J Shellfish Res, 32(2): 351-359 DOI:10.2983/035.032.0214 |
Zuur A F, Ieno E N, Walker N J et al, 2009. Mixed Effects Models and Extensions in Ecology with R. New York: Springer, 574
|
 2021, Vol. 52
2021, Vol. 52


