中国海洋湖沼学会主办。
文章信息
- 康晋伟, 金晶磊, 段丽君, 周燕, 苗亮, 周前进, 陈炯. 2020.
- KANG Jin-Wei, JIN Jing-Lei, DUAN Li-Jun, ZHOU Yan, MIAO Liang, ZHOU Qian-Jin, CHEN Jiong. 2020.
- 香鱼格留虫(Glugea plecoglossi)环介导等温扩增联合横向流动试纸条检测方法的建立
- A LOOP-MEDIATED ISOTHERMAL AMPLIFICATION TECHNIQUE COMBINED WITH A LATERAL FLOW DIPSTICK FOR THE DETECTION OF GLUGEA PLECOGLOSSI
- 海洋与湖沼, 51(6): 1501-1512
- Oceanologia et Limnologia Sinica, 51(6): 1501-1512.
- http://dx.doi.org/10.11693/hyhz20200300076
文章历史
-
收稿日期:2020-03-16
收修改稿日期:2020-04-23
2. 宁波大学海洋学院 宁波 315832;
3. 宁波市海曙区畜牧兽医技术管理服务站 宁波 315153
2. School of Marine Science, Ningbo University, Ningbo 315832, China;
3. Ningbo Haishu District Animal Husbandry and Veterinary Medicine Technical Management Service Station, Ningbo 315153, China
香鱼格留虫(Glugea plecoglossi)是专性寄生于香鱼(Plecoglossus altivelis)体内的一种微孢子虫, 最早由日本学者鉴定并命名。感染该虫后, 香鱼体腔内会形成一种异质孢囊(xenomas), 内含大量的孢子, 孢子释放后, 可引起淋巴细胞、巨噬细胞等单核类细胞的浸润, 造成亚致死感染(sub-lethal infection), 破坏香鱼的体表及外观, 不仅加剧了饲料消耗, 导致鱼类养殖成本大幅度增加, 而且感染后的鱼形体较差, 市场价值缩减。在日本, 该虫是影响香鱼养殖产业的主要原因(Lee et al, 2004)。
香鱼是东亚特有的一种名贵经济鱼类, 日本有“淡水鱼之王”的美誉。在我国北起鸭绿江, 南至广西北仑河的沿海溪流中均有分布, 人工养殖已遍及浙江、福建以及山东等地。规模化、集约化的高密度人工养殖导致香鱼病害急剧增加。近年来, 我们首次从浙江宁海等地养殖的香鱼体内分离到了香鱼格留虫, 进一步调查发现我国的香鱼养殖正面临着严重的香鱼格留虫的感染, 感染率可达30%—40%, 高感染阶段尤其集中在幼鱼的长成期和成鱼的产卵期(Zhou et al, 2018)。鉴于香鱼为一年生洄游型鱼类, 我们推测香鱼的养殖水环境污染或育种亲鱼感染是导致香鱼格留虫高感染率存在的原因。
香鱼格留虫的虫体大小仅有几微米, 香鱼格留虫感染以香鱼组织表面形成肉眼可见的白色异质孢囊为诊断特征。未形成孢囊时, 只能通过组织内分离或组织染色, 进行显微镜镜检来实现针对虫体进行的早期诊断。这需要检测人员具备相当的专业知识背景和操作技能, 不适合于该虫体的快速筛查和及时鉴定。针对核酸的分子检测技术具有检测快速、操作便捷等优点, 基于PCR原理的分子检测技术越来越多地应用于单细胞原虫的分型、鉴定以及诊断, 尤其体现在弓形虫、隐孢子虫、锥虫以及利士曼原虫等与公共卫生、食品安全及人畜共患等密切相关的原虫病原(Liu et al, 2015; Akhoundi et al, 2017; Schijman, 2018; Wang et al, 2018; Thompson et al, 2019)。这些方法在针对病原的实验室诊断方面正发挥着重要作用, 但其存在的仪器价格昂贵、工作环境严格及技术操作专业性要求高等问题, 极大地限制了此类方法在现场快检与基层检测中的应用。
环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)作为一种有别于PCR原理的核酸扩增方法, 在链置换DNA聚合酶的催化下, 恒温条件(如65℃)中, 15—60min即可实现核酸的倍数扩增(109—1010倍)。除其高灵敏度、高特异性等优点之外, 该方法对仪器设备的要求比较低, 一台简单的水浴锅即可完成反应, 被认为是实现微生物病原基层检测的重要方法(Mori et al, 2013, 2020; Notomi et al, 2015; Li et al, 2017; Wong et al, 2018; Deng et al, 2019), 同样适用于原虫病原(Lucchi et al, 2018; Li et al, 2019; Nzelu et al, 2019)。LAMP产物的检测方法有多种, 如浊度仪检测白色浑浊、荧光定量PCR仪检测荧光曲线、核酸电泳分析产物带形, 以及添加荧光染料肉眼观察产物颜色等。其中, 肉眼观察颜色变化, 无需特殊仪器, 是方法能够应用于基层的关键步骤, 但是比较容易出现假阳性。因此, 在无需仪器设备的前提下简便快捷地判读结果是LAMP方法改进的重要方向。在横向流动试纸条(lateral flow dipstick, LFD)上锚定特定荧光素的抗体, 与LAMP产物上标记的荧光素反应, 形成的颜色变化显示在LFD的检测线和质控线上, 完成结果判读, 即为LAMP-LFD方法。该方法只需用不同的荧光素标记的探针与荧光素标记LAMP产物进行杂交, 完全摆脱了对仪器设备的依赖, 同时特异性探针的存在还很大程度上降低了检测的假阳性。该方法目前已成功用于对虾白斑综合征病毒(Jaroenram et al, 2009)、传染性脾肾坏死病毒(Ding et al, 2010)、河流弧菌(杨梦香等, 2017), 以及简单异尖线虫/派氏异尖线虫(乔艳等, 2019)等水产病原微生物的检测。
本研究在香鱼格留虫β微管蛋白基因的保守区, 设计3对特异性引物(其中, 上游内引物由生物素标记), 建立了LAMP方法并优化反应条件; 同时, 设计1条异硫氰酸荧光素标记的探针, 建立了LAMP-LFD技术, 以期为香鱼格留虫的现场快检和基层检测提供一种便捷可靠的方法。
1 材料与方法 1.1 实验样品香鱼格留虫取自鲜活香鱼体内的异质孢囊; 梅氏新贝尼登虫(Neobenedenia melleni)、派氏异尖线虫(Anisakis pegreffii)、内弯宫脂线虫(Hysterothylacium aduncum), 以及鳗弧菌香鱼分离株(V. anguillarum ayu-H080701)均由本实验室鉴定并保存; 刺激隐核虫(Cryptocaryon irritans)由宁波大学尹飞教授馈赠(Yin et al, 2018)、肝肠胞虫(Enterocytozoon hepatopenaei)阳性的虾组织由宁波大学钱冬研究员惠赠(骆云慧等, 2016); 杀香鱼假单胞菌(Pseudomonas plecoglossicida)由集美大学鄢庆枇教授惠赠(Huang et al, 2018)。
1.2 方法 1.2.1 基因组DNA制备解剖新鲜香鱼, 从肝脏或者性腺等器官上摘取白色异质瘤, 使其破裂后获得香鱼格留虫孢子并纯化。将保存的鳗弧菌、杀香鱼假单胞菌从–80℃中取出划线, 挑取单克隆培养扩大到所需浓度。按照基因组DNA提取试剂盒(离心柱型)D3350-01 (Omega Bio-Tek, USA)的说明提取香鱼格留虫、梅氏新贝尼登虫、派氏异尖线虫、内弯宫脂线虫、刺激隐核虫、鳗弧菌、杀香鱼假单胞菌、肝肠胞虫阳性的虾组织样品, 以及香鱼肝组织的基因组DNA。提取的香鱼格留虫基因组DNA经NanoDrop2000测定后, 稀释至70ng/μL备用。
1.2.2 引物设计及质粒标准品制备参考GenBank上已有的香鱼格留虫β-tubulin基因序列, 设计特异性引物Gpl-PF1与Gpl-PR1(表 1), 以香鱼格留虫的基因组DNA为模板, 扩增β-tubulin基因。按照琼脂糖凝胶回收试剂盒的说明(Omega Gel Extraction Kit, USA)回收PCR产物, 将其与pMD19-T Vector载体连接, 构建重组质粒pMD-BT, 转化大肠杆菌DH5α感受态细胞并涂板。挑取单克隆并测序, 鉴定准确后提交NCBI (GenBank登录号: MN811004)。按照质粒提取试剂盒(Omega Plasmid Mini Kit, USA)的说明提取质粒pMD-BT, 经NanoDrop2000测定浓度后, 稀释至1.0ng/μL, 作为pMD-BT质粒标准品备用。
| 引物名称 | 引物类型 | 引物长度 | 引物序列(5′ —3′) | 目的 | 扩增片段长度(bp) |
| Gpl-PF1 | 上游引物 | 25-mer | CACTATATCGGCAACAACCAAAATC | PCR | 981 |
| Gpl-PR1 | 下游引物 | 21-mer | TAGGCTTGAGGGTGGGATATC | PCR | |
| Gpl-F3 | 上游外引物 | 20-mer | GGAAGGTGCTGAACTCATAG | LAMP | — |
| Gpl-B3c | 下游外引物 | 19-mer | TCAGCATTCAACTGACCAG | LAMP | — |
| Gpl-FIP a | (F1c+F2)上游内引物 | 42-mer (Gpl-F1c:24-mer Gpl-F2:18-mer) | ACGGTTCAACCACAGTATCAGATG GGTACTGGTGCTGGAATG | LAMP | — |
| Gpl-BIP | (B1c+B2)下游内引物 | 46-mer (Gpl-B1c:25-mer Gpl-B2:21-mer) | GAGGCACTCTACAATATCTGCTCAA CCGCTCATAACAAGTGATACT | LAMP | — |
| Gpl-LF | 环引物 | 22-mer | ACGAACACATCATCCTATCAGG | LAMP | — |
| Gpl-LB | 环引物 | 20-mer | TGCCTAATCCTGGTTATGCC | LAMP | — |
| Gpl-HP b | 杂交探针 | 19-mer | CTTGTTGAAAATGCTGACG | LFD显色 | — |
| Gpl-PF2 | 上游引物 | 20-mer | GTGGTACTGGTGCTGGAATG | PCR | 90 |
| Glp-PR2 | 下游引物 | 23-mer | GCACAACAGAAAACGAACACATC | PCR | |
| 注: a表示上游内引物Gpl-FIP的5′端用生物素标记; b表示探针Gpl-HP的5′端用异硫氰酸标记 | |||||
以香鱼格留虫β-tubulin基因序列(MN811004)的保守区设计7套引物, 用于LAMP反应。利用LAMP反应的荧光曲线和琼脂糖凝胶电泳等实验结果, 选择1套最优的引物组合, 包括外引物Gpl-F3和Gpl-B3, 内引物Gpl-FIP和Gpl-BIP, 环引物Gpl-LF和Gpl-LB (表 1, 图 1)。在此基础上, 在引物Gpl-F1和Gpl-B1c之间设计1条能够与LAMP产物特异性杂交的探针Gpl-HP (表 1, 图 1); 其中, 内引物Gpl-FIP的5′端由生物素标记, 探针Gpl-HP的5′端进行异硫氰酸荧光素标记。另外, 设计特异性引物Gpl-PF2与Gpl-PR2, 用于PCR方法鉴定香鱼格留虫(表 1)。以上引物与探针均由上海捷瑞生物工程有限公司合成。
 |
| 图 1 香鱼格留虫β-tubulin基因的LAMP-LFD引物及DNA探针设计 Fig. 1 The primers and DNA probe targeting β-tubulin gene of G. plecoglossi used in LAMP-LFD assay 注: LAMP反应的引物和LFD所用探针序列使用下划线或方框表示。其中, Gpl-B1c, Gpl-B2c, Gpl-B3c和Gpl-LFc是引物Gpl-B1, Gpl-B2, Gpl-B3和Gpl-LF的互补序列 |
DNA聚合酶的最佳温度区间为60—65℃, 其中63℃和65℃是研究中最常见使用的。本研究使用65℃作为LAMP的反应温度, 反应时间为60min。参考Ding等(2010)公布的LAMP反应的体系: 10mmol/L KCl, 10mmol/L (NH4)2SO4, 6.5mmol/L MgSO4, 0.1% Triton X-100, 20mmol/L Tris-HCl (pH 8.8), 1.4mmol/L dNTPs, 8U Bst DNA聚合酶大片段(New England Biolabs)和2µL模板, 外引物Gpl-F3和Gpl-B3各0.2µmol/L, 内引物Gpl-FIP和Gpl-BIP各1.6µmol/L, 环引物Gpl-LF和Gpl-LB各0.4µmol/L。另外, 在LAMP反应体系中添加EvaGreen后, 可通过实时的荧光曲线进行LAMP结果判断。同时, LAMP产物也通过1.5%的琼脂糖凝胶电泳和LFD方法来判断。
1.2.4 LFD检测由荧光素标记的引物进行的LAMP反应后, 产物中加入20pmol的异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的探针Gpl-HP, 在相同温度(65℃)下反应, 5min后, 取反应液5µL加入到100µL的LFD buffer (Milenia Biotec GmbH, Germany)中并混匀, 将LFD试纸条的测试端竖直没于混合液中, 静置3—5min, 利用肉眼判断结果。
1.2.5 香鱼格留虫的LAMP-LFD特异性实验为验证LAMP-LFD方法的特异性, 选择水产养殖中的常见病原, 即鳗弧菌、杀香鱼假单胞菌、梅氏新贝尼登虫、刺激隐核虫、派氏异尖线虫及内弯宫脂线虫, 肝肠胞虫阳性的虾组织样品, 以及香鱼肝组织, 提取其基因组DNA并作为模板, 在65℃条件下进行荧光LAMP反应, 时间为60min。LAMP产物与Gpl-HP杂交后, 进LFD试纸条检测。同时, 产物进1.5%的琼脂糖凝胶电泳检测。
1.2.6 香鱼格留虫LAMP-LFD的灵敏度实验将pMD-BT质粒标准品进行10倍梯度稀释, 选择原浓度的1.0×10–2、1.0×10–3、1.0×10–4、1.0×10–5、1.0×10–6及1.0×10–7倍为模板, 各浓度制备三个平行样品, 65℃条件下, 进行荧光LAMP反应60min。产物通过LFD试纸条和1.5%的琼脂糖凝胶电泳检测。同时, 以Gpl-PF2与Gpl-PR2为引物, 检测PCR方法, 作为方法学的比较。PCR反应的体系(25µL)包括: 2.5µL的10×PCR buffer, 0.15µL的rTaq DNA聚合酶(5U/µL) (TaKaRa, 大连), 2µL的dNTPs (2.5mmol/µL), 1µL的Gpl-PF2 (10pmol/µL), 1µL的Gpl-PR2 (10pmol/µL), 2µL的倍比稀释的质粒标准品。反应程序: 94℃预变性3min; 30个循环包括94℃变性30s, 56℃退火30s, 72℃延伸1min; 72℃延伸10min。产物通过1.5%的琼脂糖凝胶电泳检测。
将香鱼格留虫基因组DNA进行倍比稀释, 选择原浓度的1.0×10–2、1.0×10–3、1.0×10–4、1.0×10–5、1.0×10–6、1.0×10–7及1.0×10–8倍为模板, 各浓度制备三个平行样品, 65℃条件下荧光LAMP反应60min。产物通过LFD试纸条和1.5%的琼脂糖凝胶电泳检测。
1.2.7 香鱼格留虫LAMP-LFD的时间优化选择水浴锅作为反应装置, 以灵敏度浓度的香鱼格留虫的基因组DNA为模板, 65℃条件下进行LAMP反应, 反应时间分别设定为20、30、35、40、45、50和60min, 分析LAMP反应的最佳反应时间。产物分别经LFD试纸条和1.5%的琼脂糖凝胶电泳检测。
1.2.8 LAMP-LFD重复性实验分别利用荧光定量PCR仪和水浴锅作为反应设备, 以灵敏度浓度的香鱼格留虫的基因组DNA为模板, 65℃条件下进行LAMP反应, 反应时间设定为1.2.7确定的时间。实验平行进行三次。产物通过LFD试纸条和1.5%的琼脂糖凝胶电泳检测。
1.2.9 香鱼格留虫人工污染香鱼肝组织实验取若干份香鱼的肝脏组织(鉴定无香鱼格留虫感染)100mg加入少量无菌水, 充分匀浆后, 定容至1mL。将香鱼格留虫计数后, 分别取1.0×100、1.0×101、1.0×102、1.0×103、1.0×104个虫体加入到上述肝脏组织悬液中震荡混匀。每个浓度平行制备三个样品。取香鱼格留虫污染的各肝脏组织, 按照基因组DNA提取试剂盒(离心柱型) D3350-01 (Omega Bio-Tek, USA)的说明提取各样品基因组DNA, 溶解于50μL的ddH2O中, 用作PCR和LAMP测试的模板。以健康香鱼的肝脏组织(鉴定无香鱼格留虫感染)匀浆液作为阴性对照。
2 结果 2.1 LAMP引物的筛选以1.0×10–1原浓度(7ng/μL)的香鱼格留虫基因组DNA为模板, 分别使用上述7套引物进行LAMP反应。结果表明, 在荧光LAMP反应条件下, 每套引物都可以获得典型的“S”型荧光曲线(图 2a), 但是曲线特点有明显不同, 阴性对照无明显扩增。在荧光曲线的起峰时间上, 引物组合P4≈P5 < P2 < P3 < P7 < P1 < P6;在荧光强度的峰值上, 引物组合P5 > P4≈P1≈P3 > P7 > P6 > P2;在“S”曲线的线型上, 以P4、P5、P7和P1最为光滑(图 2a)。通过琼脂糖凝胶电泳检测发现, 每套引物的扩增产物均出现典型的梯形条带, 但是带型呈现明显不同(图 2a)。因为荧光曲线的起峰时间与最终的检测时长呈明显相关, 综合考虑下, 我们选择引物组合P4作为下一步实验的引物组合, 用于后续反应。引物组合P4的各引物序列见表 1和图 1。
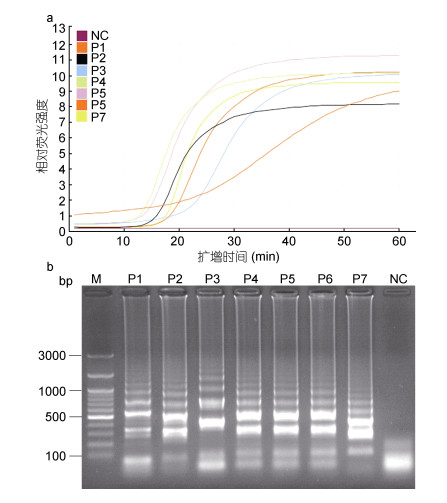 |
| 图 2 LAMP引物的筛选 Fig. 2 Selection of optimal primers for use in the LAMP reaction 注:设计了7套引物, 即P1—P7用于LAMP引物的筛选。a. LAMP反应中的荧光强度; b. LAMP产物琼脂糖凝胶电泳; P1—P7.分别为7套引物; M. GeneRuler 100bp plus DNA Ladder (Fermentas, USA); NC.以不含香鱼格留虫DNA的ddH2O为模板作为阴性对照 |
选择6种常见水产病原, 即梅氏新贝尼登虫、刺激隐核虫、派氏异尖线虫、内弯宫脂线虫、鳗弧菌、杀香鱼假单胞菌, 以及肝肠胞虫阳性的虾组织样品和香鱼肝组织的基因组DNA, 经与香鱼格留虫的基因组DNA相同的方式进行倍比稀释后, 选择1.0×10–2倍原浓度为模板, 进行LAMP反应。结果表明当以0.7ng/µL (1.0×10–2倍原浓度)的香鱼格留虫基因组DNA为模板时, 将探针与LAMP产物杂交后, 在LFD试纸条的检测线上有明显条带, 结果呈阳性(图 3c), 琼脂糖凝胶电泳与荧光曲线也分别显示结果为阳性(图 3a, 3b)。当以上述其它8种水产病原或水产动物组织的DNA为模板时, LFD试纸条的检测线上无明显条带, 结果呈阴性(图 3c), 经琼脂糖凝胶电泳与荧光曲线也分别显示结果为阴性(图 3a, 3b)。
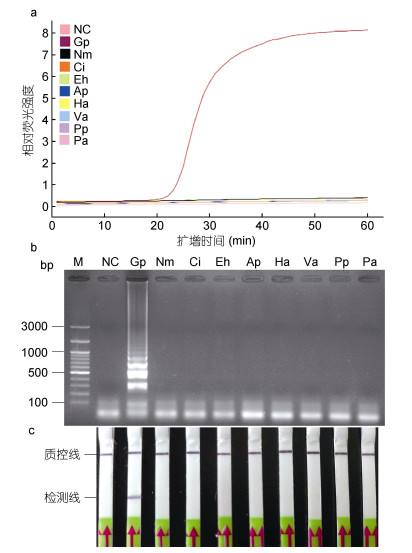 |
| 图 3 LAMP (a, b)和LAMP-LFD (c)的特异性实验结果 Fig. 3 Specificity test of LAMP (a, b) and LAMP-LFD (c) for detection of G. plecoglossi 注: a, b和c:以各受试样本的基因组DNA为模板, 进行有生物素标记的LAMP反应。a. LAMP反应中的荧光强度; b. LAMP产物琼脂糖凝胶电泳; c. LFD检测。M.同上图; NC.同上图。Gp, Nm, Ci, Eh, Ap, Ha, Va, Pp和Pa分别代表以香鱼格留虫, 梅氏新贝尼登虫, 刺激隐核虫, 肝肠胞虫阳性的虾组织、派氏异尖线虫, 内弯宫脂线虫, 鳗弧菌, 杀香鱼假单胞菌和健康香鱼肝组织(不含香鱼格留虫DNA)的基因组DNA为模板 |
使用稀释倍数为1.0×10–2—1.0×10–7的pMD-BT质粒标准品作为模板, 分析LAMP-LFD的灵敏度。结果显示, 当以稀释倍数为1.0×10–6—1.0×10–2的质粒标准品作为模板时, 扩增曲线为典型的“S”型, 结果为阳性(图 4a)。将LAMP产物与Gpl-HP探针孵育后, 利用LFD试纸条检测, LFD的检测线上出现明显条带(图 4c), 与琼脂糖凝胶电泳检测结果一致(图 4b)。当稀释倍数为1.0×10–7时, 扩增曲线在“0”的位置呈线性, 无明显扩增(图 4a), LFD的检测线上无明显条带(图 4c), 利用琼脂糖凝胶电泳检测也呈阴性(图 4b)。因此, LAMP-LFD的检测灵敏度为pMD-BT质粒标准品原浓度的1.0×10–6倍, 即2.0fg/μL。以Gpl-PF2/Gpl-PR2为引物进行的PCR反应, 发现当以稀释倍数为1.0×10–6—1.0×10–2的质粒标准品为模板时, 产物经琼脂糖凝胶电泳均可检测到明显的条带(图 4d), 而当稀释倍数为1.0×10–7时, 无明显条带, 说明以Gpl-PF2/Gpl-PR2为引物的PCR方法的检测灵敏度同样为2.0fg/μL的pMD-BT质粒标准品。
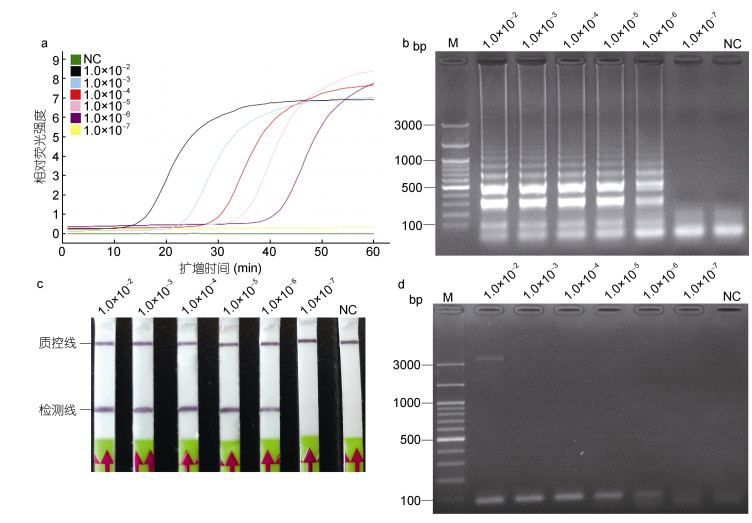 |
| 图 4 以质粒标准品为模板的LAMP-LFD的灵敏度 Fig. 4 Sensitivity of LAMP-LFD to detect plasmid standards 注: a. LAMP反应中的荧光强度; b. LAMP产物琼脂糖凝胶电泳; c. LFD检测; d.常规PCR产物琼脂糖电泳。M.同上图; NC.同上图; 1.0×10–2—1.0×10–7.稀释不同倍数的质粒标准品。LAMP和LAMP-LFD检测到的最低模板稀释倍数为1.0×10–6, 即2.0fg/μL, 常规PCR检测到的最低模板稀释倍数为1.0×10–6, 即2.0fg/μL |
以1.0×10–2—1.0×10–8的香鱼格留虫基因组DNA作为模板, 进行荧光LAMP反应, 并对LAMP产物进行LFD检测。结果表明, 当以稀释倍数为1.0×10–2—1.0×10–4的基因组DNA为模板时, 扩增曲线为典型的S型, 结果为阳性(图 5a)。将LAMP产物与Gpl-HP探针孵育后进行LFD检测, LFD的检测线上出现明显条带(图 5c), 与琼脂糖凝胶电泳检测结果一致(图 5b)。当稀释倍数为1.0×10–5—1.0×10–8时, 扩增曲线在“0”的位置呈线性, 无明显扩增(图 5a), LFD的检测线上无明显条带(图 5c), 利用琼脂糖凝胶电泳检测也呈阴性(图 5b)。因此, LAMP-LFD的检测灵敏度为香鱼格留虫基因组DNA原浓度的1.0×10–4倍, 即14pg/μL。
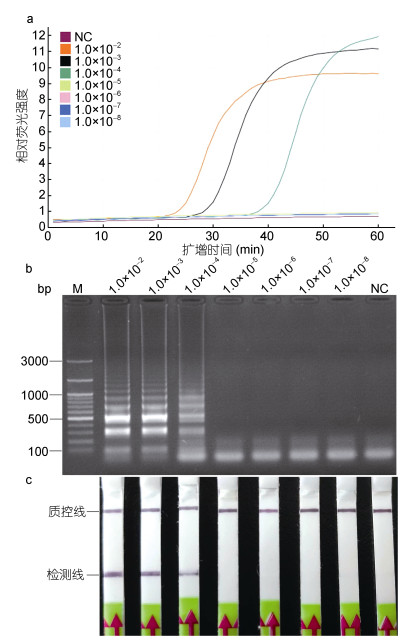 |
| 图 5 以香鱼格留虫基因组DNA为模板的LAMP-LFD的灵敏度 Fig. 5 Sensitivity of LAMP-LFD to detect genomic DNA of G. plecoglossi 注: a. LAMP反应中的荧光强度; b. LAMP产物琼脂糖凝胶电泳; c. LFD检测。M.同上图; NC.同上图; 1.0×10–2—1.0×10–8.稀释不同倍数的香鱼gDNA; LAMP和LAMP-LFD检测到的最低gDNA稀释倍数为1.0×10–4, 即14.0pg/μL |
LAMP-LFD的检测时程与LAMP反应的有效时间呈正相关, 而一定浓度范围内, LAMP反应的有效起峰时间与模板浓度呈正相关(Zhou et al, 2014)。以简易设备水浴锅进行加热, 以灵敏度浓度的香鱼格留虫基因组DNA为模板, 进行LAMP反应, 分析不同反应时间LAMP的产物情况。结果表明:当反应时间设定为20、30和35min时, 利用LFD试纸条和琼脂糖凝胶电泳均未检测到明显条带(图 6a, 6b); 当反应时间增加到40min时, LFD试纸条的检测线位置出现明显条带, 琼脂糖凝胶电泳检测出现典型的梯形条带; 增加反应时间至45min时, LFD试纸条和琼脂糖凝胶电泳上的条带亮度明显大于40min的反应时间; 继续增加反应时间至50和60min时, LFD试纸条和琼脂糖凝胶电泳上的条带亮度与反应时间45min时无明显变化。综上, 为保证结果的可靠性, 选择LAMP的最优反应时间为45min。
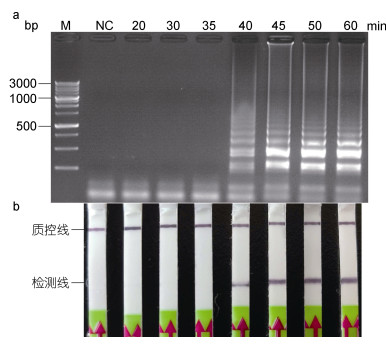 |
| 图 6 LAMP反应最适反应时间的确定 Fig. 6 Time optimization of LAMP assay for detection of Glugea plecoglossi 注: a. LAMP产物琼脂糖凝胶电泳; b. LFD检测。M.同上图; NC.同上图; 1.0×10–4.稀释倍数为1.0×10–4的香鱼格留虫基因组DNA, 即7.0pg/μL |
以原浓度稀释倍数为1.0×10–4的香鱼格留虫的基因组DNA为模板, 65℃条件下进行LAMP反应45min, 分别使用荧光定量PCR仪和水浴锅作为反应装置, 判断LAMP-LFD方法的可重复性。结果表明, 以该灵敏度浓度为模板进行的LAMP反应, 荧光曲线稳定地呈典型的“S”型, 在起峰时间、荧光强度, 曲线的线型等方面都具有很高的吻合度(图 7a); 经LFD试纸条和琼脂糖凝胶电泳的方法检测, 均稳定性地出现明显的条带(图 7b, 7c); 以蒸馏水为模板时, 检测结果呈阴性(图 7a, 7b, 7c), 说明该LAMP-LFD方法在不同的反应装置下均具有良好的可重复性。
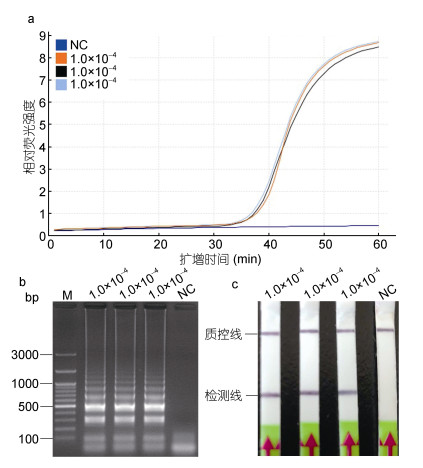 |
| 图 7 LAMP (a, b)和LAMP-LFD (c)的重复性试验 Fig. 7 Reproducibility of LAMP (a, b) and LAMP-LFD (c) of detection for G. plecoglossi 注: a. LAMP; b.琼脂糖电泳; c. LAMP-LFD。M.同上图; NC.同上图; 1.0×10–4.稀释倍数为1.0×10–4的香鱼格留虫基因组DNA, 即14.0pg/μL |
分别用不同数量的香鱼格留虫与香鱼的肝组织悬液充分混匀, 提取混合匀浆液的基因组DNA, 经LAMP-LFD和PCR分别检测。结果表明, 分别使用1.0×104、1.0×103、1.0×102、1.0×101个虫体污染时, 利用LAMP-LFD和PCR方法均能够从污染的肝脏组织中稳定检测到病原; 当仅使用1个香鱼格留虫孢子污染100mg香鱼肝组织时, LAMP-LFD和PCR方法均不能从污染样品中检测到虫体的存在(表 2)。这表明, LAMP-LFD方法的灵敏度为100个虫体/g或0.4个虫体/反应。
| 污染香鱼肝组织所用的香鱼格留虫数量(个) | 未被污染的健康香鱼的肝组织(CFU/mL) | |||||
| 1.0 × 104 | 1.0 × 103 | 1.0 × 102 | 1.0 × 101 | 1.0 × 100 | 0 | |
| LAMP-LFD | + | + | + | + | - | - |
| + | + | + | + | - | - | |
| + | + | + | + | - | - | |
| PCR | + | + | + | + | - | - |
| + | + | + | + | - | - | |
| + | + | + | + | - | - | |
| 注: “+”表示检测结果阳性; “-”表示检测结果阴性 | ||||||
香鱼格留虫是香鱼体内普遍存在的一种寄生原虫, 也可感染虹鳟等其他鱼类。香鱼格留虫感染致死率较低, 多呈隐性状态, 容易被忽视, 导致香鱼群体性品质下降, 引起较大的经济损失。据不完全统计, 2016—2018年香鱼出口创汇逾430万美元, 是我国养殖的淡水鱼种中能够出口的几个鱼种之一, 而目前我国养殖香鱼群体中香鱼格留虫的感染已经比较严重, 实现该病原的快速诊断和准确鉴定, 消除其在养殖环境、亲本香鱼等的污染, 对于维持香鱼的安全高效繁养和高品质具有重要意义。但是, 迄今为止, 还未见应用于香鱼格留虫检测的分子检测技术。因此, 本研究选择香鱼格留虫β微管蛋白基因作为检测靶标, 建立了快速、便捷、低成本的LAMP-LFD技术, 特异性地应用于香鱼格留虫的早期诊断。
灵敏度是衡量分子检测技术优劣的决定性技术指标之一。应用于其他原虫病原的分子检测技术给我们提供了借鉴。用于弓形虫检测的PCR技术最早出现于1989年, 以弓形虫的B1基因为靶标, 能够从细胞裂解产物中检测到单个虫体的DNA (Burg et al, 1989)。运用巢式PCR技术, 选用529bp的重复元件为靶标时, 可检测到640fg的虫体DNA, 以B1基因为靶标, 可检测到5.12fg的虫体DNA (Fallahi et al, 2014a)。同样地, 巢式PCR也被应用于隐孢子虫的实验室诊断。Nikaeen等(2005)以微小隐孢子虫的hsp70基因为靶标, 建立了可特异性检测香鱼格留虫的巢式PCR方法, 能够从自来水样品中检测到单个卵囊的污染。Mero等(2017)针对隐孢子虫、贾地鞭毛虫及溶组织内阿米巴原虫等建立了多重PCR技术, 检测灵敏度为0.1ng/mL的隐孢子虫DNA。Njiru等(2005)以锥虫的核糖体内转录间隔区1(ITS1)为靶标, 建立了用于锥虫检测的PCR技术, 针对不同锥虫的检测灵敏度在10—100pg虫体DNA。Hong等(2017)以动基体大型环状DNA为靶标, 分别建立了特异性检测肌锥虫和路易锥虫的PCR方法, 可检测到0.1ng的锥虫DNA。自LAMP方法公布以来, 很多研究集中于原虫病害LAMP检测技术的开发, 并取得了系列成果。以弓形虫为例, 针对不同类型样品中弓形虫的污染或感染情况, 以及针对不同的检测靶标, 开发了多个LAMP方法(Sotiriadou et al, 2008; Fallahi et al, 2014b; Durand et al, 2020)。Zhang等(2009)以529bp的重复元件为靶标建立了LAMP方法, 最低可检测到1pg/μL的弓形虫DNA; Lin等(2012)和Kong等(2012)分别将最低检测线优化到最低可检测1pg/μL和0.6fg的弓形虫DNA; Qu等(2013)以弓形虫的18S rRNA为靶标建立了RT-LAMP方法, 能够从1g的猪肉中最低可检测到1个速殖子; 而Lalle等(2018)同样以529bp重复元件为靶标, 建立的LAMP方法检测即食沙拉中污染的弓形虫, 每50g即食小莴苣中最低可检测到25个卵囊; Varlet-Marie等(2018)建立了LAMP方法用于贻贝中弓形虫的调查, 每克组织或每毫升血淋巴中最低可检测到5个卵囊。Karanis等(2007)以隐孢子虫60kDa的糖蛋白基因为检测靶标, 建立了LAMP方法, 最低可检测到400fg/μL的虫体DNA或者0.1个隐孢子虫卵囊; Plutzer等(2010)将LAMP方法应用于饮用水中隐孢子虫的筛查, 能够从10L的过滤的饮用水中最低检测到1个卵囊的污染。Njiru等(2008b)以锥虫的重复插入移动元件(RIME)和血清抗性相关基因(SRA)为检测靶标, 建立了2种LAMP方法, 最低检测限为0.001虫体/mL和1个虫体/mL。Thekisoe等(2007)以锥虫的核糖体DNA的5.8S-ITS2区段、18S RNA以及VSG RoTat 1.2序列为靶标, 建立了可用于不同锥虫种的LAMP方法, 均能够检测到1fg的锥虫DNA或0.01个锥虫虫体。Hayashida等(2015)通过优化, 建立了干式LMAP方法, 用于血液样品中锥虫的快速检测, 以RIME、18S rRNA和SRA为检测靶标条件的灵敏度分别为0.01、0.1和1个虫体DNA。在水产养殖领域, Karthikeyan等(2017)以虾肝肠胞虫(EHP)阳性组织样品的DNA为模板, 梯度稀释后, 最低检测灵敏度为阳性组织样品的3—10倍; Sathish等(2018)以虾肝肠胞虫的核糖体小亚基(SSU)为检测靶标, 建立了LAMP方法, 灵敏度为10个拷贝/反应。本研究建立的LAMP-LFD技术能够检测到2.0fg/μL的β微管蛋白所含质粒的DNA, 最低能够检测出14.0pg/μL的虫体基因组DNA, 表现出良好的方法灵敏性。
检测时间是决定快检类技术实用性和推广的重要参考。根据分子靶标与引物设计等条件, LAMP可在15—60min不等的时间内完成反应, 再通过有效的检测手段进行结果判断。Zhang等(2009)以529bp序列为靶标建立的检测弓形虫的LAMP方法, 反应时间为60min, 通过琼脂糖凝胶电泳来判断结果, 整个检测时间超过60min; 同样, Kong等(2012)、Fallahi等(2014b)和Sotiriadou等(2008)分别选择B1基因或529bp序列建立了针对弓形虫的LAMP方法, 优化后的反应时间均为60min, 加上琼脂糖凝胶电泳判断LAMP产物的时间, 检测时程均超过60min。同时, Kong等(2012)和Fallahi等(2014b)通过在LAMP反应产物中添加SYBR Green I染料, 通过颜色变化进行结果判定, 减掉了因制胶和电泳所耗费的时间, 使整个检测时程缩减为60min; Lalle等(2018)优化了Zhang等(2009)的方法, 将LFD试纸条引入到弓形虫LAMP方法的检测, 有效地缩短了检测时程; 有经验者, 甚至可通过肉眼判断有无焦磷酸镁白色浑浊进行结果判定, 也可缩短检测时间(Fallahi et al, 2014b)。在其它原虫病原的检测中; Plutze等(2010)针对隐孢子虫病原建立的LAMP方法, 优化后的反应时间控制在60min, 可凭借上述提及的焦磷酸镁白色浑浊进判定; Ghodrati等(2017)针对利什曼原虫的LAMP方法, 优化后的反应时间同样定在60min; 而Njiru等(2008a)建立的针对锥虫的LAMP方法, 通过使用染料SYTO-9根据扩增曲线实时判断或添加SYBR Green I进行肉眼判定, 优化后的反应时间仅为35min。在水产原虫病原的检测方法中, Sathish等(2018)针对虾肝肠胞虫建立的LAMP方法, 优化后的反应时间为45min。本研究针对香鱼格留虫的LAMP-LFD方法, 优化后的反应时间为45min, 加上5min的探针孵育和5min的LFD试纸条显色, 整个检测时程仅需55min。
4 结论本研究以香鱼格留虫的β微管蛋白基因为分子靶标建立了LAMP-LFD方法, 能够特异检出香鱼格留虫, 对梅氏新贝尼登虫、刺激隐核虫、派氏异尖线虫、内弯宫脂线虫、鳗弧菌、杀香鱼假单胞菌及虾肝肠胞虫等水产养殖中的常见致病微生物及香鱼组织没有交叉反应。该方法的整个检测时程仅需55min, 包括核酸扩增45min、与探针孵育5min, 及LFD检测5min。该方法检测灵敏度高, 最低能够检测到2.0fg/μL的含β微管蛋白的质粒DNA或14.0pg/μL的香鱼格留虫基因组DNA, 能够从感染强度达到100个虫体/克的香鱼肝组织中稳定地检测到虫体。该方法的仪器依赖性很低, 操作便捷, 完全适用于香鱼格留虫的基层检测和现场快检。
乔艳, 周前进, 李孝军, 等. 2019. 环介导等温扩增联合横向流动试纸条检测简单异尖线虫/派氏异尖线虫方法的建立. 海洋与湖沼, 50(2): 324-335 |
杨梦香, 柴方超, 周前进, 等. 2017. 应用LAMP-LFD技术可视化检测河流弧菌(Vibrio fluvialis)的研究. 海洋与湖沼, 48(2): 383-391 |
骆云慧, 石坚, 方磊, 等. 2016. 虾肝肠胞虫TaqMan实时荧光定量PCR检测方法的建立及应用. 中国兽医科学, 46(7): 847-852 |
Akhoundi M, Downing T, Votýpka J et al, 2017. Leishmania infections:molecular targets and diagnosis. Molecular Aspects of Medicine, 57: 1-29 DOI:10.1016/j.mam.2016.11.012 |
Burg J L, Grover C M, Pouletty P et al, 1989. Direct and sensitive detection of a pathogenic protozoan, Toxoplasma gondii, by polymerase chain reaction. Journal of Clinical Microbiology, 27(8): 1787-1792 DOI:10.1128/JCM.27.8.1787-1792.1989 |
Deng M H, Zhong L Y, Kamolnetr O et al, 2019. Detection of helminths by loop-mediated isothermal amplification assay:a review of updated technology and future outlook. Infectious Diseases of Poverty, 8(1): 20 DOI:10.1186/s40249-019-0530-z |
Ding W C, Chen J, Shi Y H et al, 2010. Rapid and sensitive detection of infectious spleen and kidney necrosis virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Archives of Virology, 155(3): 385-389 DOI:10.1007/s00705-010-0593-4 |
Durand L, La Carbona S, Geffard A et al, 2020. Comparative evaluation of loop-mediated isothermal amplification (LAMP) vs qPCR for detection of Toxoplasma gondii oocysts DNA in mussels. Experimental Parasitology, 208: 107809 DOI:10.1016/j.exppara.2019.107809 |
Fallahi S, Kazemi B, Seyyed tabaei S J et al, 2014a. Comparison of the RE and B1 gene for detection of Toxoplasma gondii infection in children with cancer. Parasitology International, 63(1): 37-41 |
Fallahi S, Tabaei S J S, Pournia Y et al, 2014b. Comparison of loop-mediated isothermal amplification (LAMP) and nested-PCR assay targeting the RE and B1 gene for detection of Toxoplasma gondii in blood samples of children with leukaemia. Diagnostic Microbiology and Infectious Disease, 79(3): 347-354 DOI:10.1016/j.diagmicrobio.2014.02.014 |
Ghodrati M, Spotin A, Hazratian T et al, 2017. Diagnostic accuracy of loop-mediated isothermal amplification assay as a field molecular tool for rapid mass screening of old world Leishmania infections in sand flies and in vitro Culture. Iranian Journal of Parasitology, 12(4): 506-515 |
Hayashida K, Kajino K, Hachaambwa L et al, 2015. Direct blood dry LAMP:a rapid, stable, and easy diagnostic tool for Human African Trypanosomiasis. PLoS Neglected Tropical Diseases, 9(3): e0003578 DOI:10.1371/journal.pntd.0003578 |
Hong X K, Zhang X, Fusco O A et al, 2017. PCR-based identification of Trypanosoma lewisi and Trypanosoma musculi using maxicircle kinetoplast DNA. Acta Tropica, 171: 207-212 DOI:10.1016/j.actatropica.2017.04.007 |
Huang L X, Zhao L M, Su Y Q et al, 2018. Genome sequence of Pseudomonas plecoglossicida strain NZBD9. Genome Announcements, 6(4): e01412-17 DOI:10.1128/genomeA.01412-17 |
Jaroenram W, Kiatpathomchai W, Flegel T W, 2009. Rapid and sensitive detection of white spot syndrome virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Molecular and Cellular Probes, 23(2): 65-70 DOI:10.1016/j.mcp.2008.12.003 |
Karanis P, Thekisoe O, Kiouptsi K et al, 2007. Development and preliminary evaluation of a loop-mediated isothermal amplification procedure for sensitive detection of Cryptosporidium oocysts in fecal and water samples. Applied and Environmental Microbiology, 73(17): 5660-5662 DOI:10.1128/AEM.01152-07 |
Karthikeyan K, Sharma A, Mekata T et al, 2017. Rapid and sensitive real-time loop meditated isothermal amplification for the detection of Enterocytozoon hepatopenaei of shrimp. Aquaculture, 481: 119-123 DOI:10.1016/j.aquaculture.2017.08.036 |
Kong Q M, Lu S H, Tong Q B et al, 2012. Loop-mediated isothermal amplification (LAMP):early detection of Toxoplasma gondii infection in mice. Parasites & Vectors, 5(1): 2 |
Lalle M, Possenti A, Dubey J P et al, 2018. Loop-Mediated Isothermal Amplification-Lateral-Flow Dipstick (LAMP-LFD) to detect Toxoplasma gondii oocyst in ready-to-eat salad. Food Microbiology, 70: 137-142 DOI:10.1016/j.fm.2017.10.001 |
Lee S J, Yokoyama H, Ogawa K, 2004. Modes of transmission of Glugea plecoglossi (Microspora) via the skin and digestive tract in an experimental infection model using rainbow trout, Oncorhynchus mykiss (Walbaum). Journal of Fish Diseases, 27(8): 435-444 DOI:10.1111/j.1365-2761.2004.00556.x |
Li Y M, Fan P H, Zhou S S et al, 2017. Loop-mediated isothermal amplification (LAMP):a novel rapid detection platform for pathogens. Microbial Pathogenesis, 107: 54-61 DOI:10.1016/j.micpath.2017.03.016 |
Li S, Liu Y, Wang Y et al, 2019. Lateral flow biosensor combined with loop-mediated isothermal amplification for simple, rapid, sensitive, and reliable detection of Brucella spp. Infection and Drug Resistance, 12: 2343-2353 DOI:10.2147/IDR.S211644 |
Lin Z B, Zhang Y L, Zhang H S et al, 2012. Comparison of loop-mediated isothermal amplification (LAMP) and real-time PCR method targeting a 529-bp repeat element for diagnosis of toxoplasmosis. Veterinary Parasitology, 185(2-4): 296-300 DOI:10.1016/j.vetpar.2011.10.016 |
Liu Q, Wang Z D, Huang S Y et al, 2015. Diagnosis of toxoplasmosis and typing of Toxoplasma gondii. Parasites & Vectors, 8(1): 292 |
Lucchi N W, Ndiaye D, Britton S et al, 2018. Expanding the malaria molecular diagnostic options:opportunities and challenges for loop-mediated isothermal amplification tests for malaria control and elimination. Expert Review of Molecular Diagnostics, 18(2): 195-203 DOI:10.1080/14737159.2018.1431529 |
Mero S, Kirveskari J, Antikainen J et al, 2017. Multiplex PCR detection of Cryptosporidium sp, Giardia lamblia and Entamoeba histolytica directly from dried stool samples from Guinea-Bissauan children with diarrhoea. Infectious Diseases, 49(9): 655-663 DOI:10.1080/23744235.2017.1320728 |
Mori Y, Kanda H, Notomi T, 2013. Loop-mediated isothermal amplification (LAMP):recent progress in research and development. Journal of Infection and Chemotherapy, 19(3): 404-411 DOI:10.1007/s10156-013-0590-0 |
Mori Y, Notomi T, 2020. Loop-mediated isothermal amplification (LAMP):Expansion of its practical application as a tool to achieve universal health coverage. Journal of Infection and Chemotherapy, 26(1): 13-17 DOI:10.1016/j.jiac.2019.07.020 |
Nikaeen M, Mesdaghinia A R, Tehrani M J et al, 2005. A nested-PCR assay for detection of Cryptosporidium parvum oocysts in water samples. Iranian Journal of Public Health, 34(1): 13-18 |
Njiru Z K, Constantine C C, Guya S et al, 2005. The use of ITS1 rDNA PCR in detecting pathogenic African trypanosomes. Parasitology Research, 95(3): 186-192 DOI:10.1007/s00436-004-1267-5 |
Njiru Z K, Mikosza A S J, Armstrong T et al, 2008a. Loop-mediated isothermal amplification (LAMP) method for rapid detection of Trypanosoma brucei rhodesiense. PLoS Neglected Tropical Diseases, 2(2): e147 DOI:10.1371/journal.pntd.0000147 |
Njiru Z K, Mikosza A S J, Matovu E et al, 2008b. African trypanosomiasis:sensitive and rapid detection of the sub-genus Trypanozoon by loop-mediated isothermal amplification (LAMP) of parasite DNA. International Journal for Parasitology, 38(5): 589-599 |
Notomi T, Mori Y, Tomita N et al, 2015. Loop-mediated isothermal amplification (LAMP):principle, features, and future prospects. Journal of Microbiology, 53(1): 1-5 DOI:10.1007/s12275-015-4656-9 |
Nzelu C O, Kato H, Peters N C, 2019. Loop-mediated isothermal amplification (LAMP):An advanced molecular point-of-care technique for the detection of Leishmania infection. PLoS Neglected Tropical Diseases, 13(11): e0007698 DOI:10.1371/journal.pntd.0007698 |
Plutzer J, Törökné A, Karanis P, 2010. Combination of ARAD microfibre filtration and LAMP methodology for simple, rapid and cost-effective detection of human pathogenic Giardia duodenalis and Cryptosporidium spp. in drinking water. Letters in Applied Microbiology, 50(1): 82-88 DOI:10.1111/j.1472-765X.2009.02758.x |
Qu D F, Zhou H Y, Han J Z et al, 2013. Development of reverse transcription loop-mediated isothermal amplification (RT-LAMP) as a diagnostic tool of Toxoplasma gondii in pork. Veterinary Parasitology, 192(1-3): 98-103 DOI:10.1016/j.vetpar.2012.10.010 |
Sathish K T, Navaneeth K A, Joseph S R J et al, 2018. Visual loop-mediated isothermal amplification (LAMP) for the rapid diagnosis of Enterocytozoon hepatopenaei (EHP) infection. Parasitology Research, 117(5): 1485-1493 DOI:10.1007/s00436-018-5828-4 |
Schijman A G, 2018. Molecular diagnosis of Trypanosoma cruzi. Acta Tropica, 184: 59-66 DOI:10.1016/j.actatropica.2018.02.019 |
Sotiriadou I, Karanis P, 2008. Evaluation of loop-mediated isothermal amplification for detection of Toxoplasma gondii in water samples and comparative findings by polymerase chain reaction and immunofluorescence test (IFT). Diagnostic Microbiology and Infectious Disease, 62(4): 357-365 DOI:10.1016/j.diagmicrobio.2008.07.009 |
Thekisoe O M M, Kuboki N, Nambota A et al, 2007. Species-specific loop-mediated isothermal amplification (LAMP) for diagnosis of trypanosomosis. Acta Tropica, 102(3): 182-189 DOI:10.1016/j.actatropica.2007.05.004 |
Thompson R C A, Ash A, 2019. Molecular epidemiology of Giardia and Cryptosporidium infections-What's new?. Infection, Genetics and Evolution, 75: 103951 DOI:10.1016/j.meegid.2019.103951 |
Varlet-Marie E, Sterkers Y, Perrotte M et al, 2018. A new LAMP-based assay for the molecular diagnosis of toxoplasmosis:comparison with a proficient PCR assay. International Journal for Parasitology, 48(6): 457-462 DOI:10.1016/j.ijpara.2017.11.005 |
Wang R J, Li J Q, Chen Y C et al, 2018. Widespread occurrence of Cryptosporidium infections in patients with HIV/AIDS:Epidemiology, clinical feature, diagnosis, and therapy. Acta Tropica, 187: 257-263 DOI:10.1016/j.actatropica.2018.08.018 |
Wong Y P, Othman S, Lau Y L et al, 2018. Loop-mediated isothermal amplification (LAMP):a versatile technique for detection of micro-organisms. Journal of Applied Microbiology, 124(3): 626-643 DOI:10.1111/jam.13647 |
Yin F, Liu W C, Bao P B et al, 2018. Comparison of the susceptibility and resistance of four marine perciform fishes to Cryptocaryon irritans infection. Fish & Shellfish Immunology, 77: 298-303 |
Zhang H S, Thekisoe O M M, Aboge G O et al, 2009. Toxoplasma gondii:sensitive and rapid detection of infection by loop-mediated isothermal amplification (LAMP) method. Experimental Parasitology, 122(1): 47-50 DOI:10.1016/j.exppara.2009.01.012 |
Zhou Q J, Chai F C, Chen J, 2018. First record of Glugea plecoglossi (Takahashi & Egusa. 1977), a microsporidian parasite of ayu (Plecoglossus altivelis altivelis Temminck & Schlegel. 1846) in Mainland China. Journal of Fish Diseases, 41(1): 165-169 DOI:10.1111/jfd.12674 |
Zhou Q J, Wang L, Chen J et al, 2014. Development and evaluation of a real-time fluorogenic loop-mediated isothermal amplification assay integrated on a microfluidic disc chip (on-chip LAMP) for rapid and simultaneous detection of ten pathogenic bacteria in aquatic animals. Journal of Microbiological Methods, 104: 26-35 DOI:10.1016/j.mimet.2014.06.008 |
 2020, Vol. 51
2020, Vol. 51


