中国海洋湖沼学会主办。
文章信息
- 李笑, 曲艺, 张倩倩, 张天宇, 曹瑞文, 赵建民. 2020.
- LI Xiao, QU Yi, ZHANG Qian-Qian, ZHANG Tian-Yu, CAO Rui-Wen, ZHAO Jian-Min. 2020.
- 海水酸化和热应激对日本鼓虾氧化应激和能量代谢的影响
- EFFECTS OF SEAWATER ACIDIFICATION AND THERMAL STERSS ON THE ANTIOXIDANT RESPONSES AND ENERGY METABOLISM OF ALPHEUS JAPONICUS MIERS
- 海洋与湖沼, 51(6): 1412-1421
- Oceanologia et Limnologia Sinica, 51(6): 1412-1421.
- http://dx.doi.org/10.11693/hyhz20200200042
文章历史
-
收稿日期:2020-02-17
收修改稿日期:2020-03-08
2. 中国科学院烟台海岸带研究所 海岸带生物资源高效利用研究与发展中心 烟台 264003;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Research and Development Center for Efficient Utilization of Coastal Bioresources, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-science, Chinese Academy of Sciences, Qingdao 266071, China
工业革命以来, 人类通过化石燃料燃烧、砍伐森林等活动释放了大量CO2进入大气中, 导致大气CO2浓度由280 ppm增至超过410 ppm (Friedlingstein et al, 2019)。其中, 海洋吸收了约29%人为排放的CO2 (Sabine et al, 2004), 导致了海水中CO32-浓度的降低和HCO3-浓度的增加, 同时伴随着海水pH值的降低, 这种现象被称为海洋酸化(ocean acidification)(Feely et al, 2004)。此外, CO2又属于温室气体, 过量排放会引起全球变暖, 进而导致表层海水温度的升高(Hoegh-Guldberg et al, 2012)。据估计, 表层海水pH值较工业革命前下降了约0.1个单位, 海洋表面温度则上升了0.74℃ (Feely et al, 2009)。预计到21世纪末, 表层海水pH将再下降0.3—0.5个pH单位(Caldeira et al, 2003), 而海洋表面温度则将升高1—3℃ (Collins et al, 2013)。在全球气候变化和人类活动的影响下, 近岸海域的生物群落结构及地理分布将不可避免地发生变迁, 进而影响到物种生存以及近海生态系统的健康可持续发展。
生活在近岸海域的海洋生物承受着较强的生存压力, 同时面临着海水酸化和升温等多重环境压力(Cao et al, 2019)。越来越多的证据表明, 海洋酸化对软体动物、甲壳动物、造礁珊瑚、棘皮动物等海洋生物具有负面效应(Talmage et al, 2009; Sinutok et al, 2014; Figueiredo et al, 2016; Mollica et al, 2018), 能够影响生长发育、钙化沉积、酸碱平衡调节和能量代谢等生理过程。此外, 海洋动物多为变温动物, 对温度变化较为敏感, 其存活、发育、繁殖和应激反应等关键生理过程均受到温度变化的显著影响(Yao et al, 2014)。例如, 热应激可导致华丽长臂虾(Palaemon elegans)、短吻海马(Hippocampus guttulatus)和海胆(Heliocidaris erythrogramma)等多种海洋动物的代谢抑制、热休克反应和氧化应激等负面效应(Aurélio et al, 2013; Madeira et al, 2016; Harianto et al, 2018), 同时伴随着机体热调节能力的显著抑制(Brothers et al, 2015)。然而, 相比多因素复合影响, 多数研究主要关注单一环境压力对关键生态类群的影响, 对多重压力下的耦合效应研究仍然非常有限。已有研究发现, 海水酸化和升温刺激能够影响多种海洋生物的生长繁殖、新陈代谢、钙化过程、内分泌调控等生理过程以及行为学特征(Walther et al, 2010; Johnson et al, 2012; Little et al, 2013; Rivest et al, 2014; Pistevos et al, 2015), 而且不同种类以及同种类不同发育阶段的生物表现出明显的敏感性差异(Hendriks et al, 2010; Kroeker et al, 2010)。例如, 海水酸化和升温在抑制白棘三列海胆(Tripneustes gratilla)幼虫生长方面表现出加和效应(Brennand et al, 2010), 而适度的升温刺激则能够减弱海水酸化对长牡蛎(Crassostrea gigas)幼虫生长的负面影响(Parker et al, 2010)。
鼓虾物种丰富、生态多样性高, 常与虾虎鱼、海绵、螠虫动物、珊瑚和海葵等其他生物共生, 是研究宿主类型和栖息地环境关系的理想生态类群(Hurt et al, 2013)。其中, 日本鼓虾(Alpheus japonicus Miers)为我国近海常见种类, 也是我国沿海渔业的常见捕捞对象; 同时, 作为黄渤海渔业资源的重要饵料生物, 其数量波动将影响到生态系统的能量传递途径和食物网的稳定(徐从军等, 2019)。基于此, 本研究以日本鼓虾为研究对象, 开展了为期14天的海水酸化和热应激暴露实验, 以评估单独或复合暴露对鼓虾氧化应激和能量代谢等生理过程的影响, 研究结果可为深入了解多重压力下近海关键生态类群的响应途径提供科学依据。
1 材料和方法 1.1 实验动物采集与暴露实验设置实验用日本鼓虾样品[体长(41.2±5.3)mm, 体重(2.2±0.5)g]采集自山东烟台近岸海域, 样品采集时的海水温度约为18℃, pH约为8.0。样品采集后, 置于新鲜海水中, 立即运至实验室进行为期10天的暂养。暂养期间, 水温控制在(18.0±0.2)℃, pH 8.10±0.03;其间投喂商品化对虾饲料, 每日更换新鲜砂滤海水。
本研究采用2×2双因素实验设计, 包括两个pH水平(pH 8.1和pH 7.6)和两个温度梯度(20.0和23.0℃), 共设置4个处理组。其中, 海水温度和pH的设置以采样海域的实际温度和pH为基础(Zhang et al, 2018), 同时参考了联合国政府间气候变化专门委员会(Intergovernmental Panel on Climate Change, IPCC)预测的2100年海水增温和pH降低幅度(IPCC, 2014)。暴露实验过程中, 通过恒温控制系统以每天0.5℃的幅度逐步调节温度至预设值, 采用气体-CO2流量控制系统调节水体pH值至预设值; 各处理组达到预定条件后稳定5天, 开始为期14天的正式暴露实验。各处理组分别设置三个重复, 每个平行水箱内养殖20只日本鼓虾, 整个实验期间实验动物的死亡率低于5%。
实验期间, 每日采用PB-10型pH计(Sartorius公司, 德国)测定水体pH, 使用前采用符合美国国家标准局标准的pH缓冲溶液校准; 海水盐度和溶解氧(DO)采用YSI® 85型多参数水质分析仪测定; 此外, 每隔两天采集水样, 使用798 MPT Titrino自动电位滴定仪(Metrohm公司, 瑞士)测定水体总碱度(TA)。根据测定的温度、盐度、pH值和TA值, 使用CO2SYS软件计算海水的碳酸盐化学参数, 相关化学参数见表 1。
| 处理组 | pH | 温度(℃) | 盐度 | 总碱度(μmol/kg) | pCO2(μatm) | DIC (μmol/kg) |
| pH 8.1 + 20℃ | 8.17 ± 0.02 | 20.0 ± 0.2 | 31.1 ± 0.3 | 2357.03 ± 14.41 | 433.21 ± 23.71 | 2125.67± 7.14 |
| pH 7.6 + 20℃ | 7.61 ± 0.03 | 20.0 ± 0.2 | 31.2 ± 0.2 | 2353.39 ± 25.14 | 1802.60 ± 35.12 | 2335.33 ± 7.27 |
| pH 8.1 + 23℃ | 8.16 ± 0.01 | 23.0 ± 0.2 | 31.1 ± 0.3 | 2367.53 ± 15.82 | 454.12 ± 21.23 | 2120.28 ± 6.62 |
| pH 7.6 + 23℃ | 7.60 ± 0.02 | 23.0 ± 0.2 | 31.3 ± 0.4 | 2377.29 ± 25.21 | 1917.43 ± 19.11 | 2352.26 ± 5.31 |
暴露实验结束后, 分别采集日本鼓虾的肌肉和消化腺组织, 立即置于液氮中速冻, 随后所有样品置于-80℃超低温冰箱保存, 直至后续生理、生化指标分析。实验过程中, 每个处理组设置6个重复。
1.3 氧化应激指标测定氧化应激指标测定采用南京建成生物工程研究所研制的商品化试剂盒, 方法简述如下: (1)组织匀浆液制备:称取适量肌肉组织, 加入磷酸盐缓冲溶液(0.01mol/L K2HPO4, 0.01mol/L KH2PO4, 0.5mol/L KCl, 1mmol/L EDTA-Na2)中, 制备成10% m/v的组织匀浆液; 10000g, 4℃离心15min收集上清液。(2)氧化应激指标测定:超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(CAT)、谷胱甘肽巯基转移酶(Glutathione S-transferase, GST)活性和还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)含量以及脂质过氧化物(Lipid Peroxidation, LPO)水平的测定参照南京建成生物工程研究所的相关试剂盒说明书, 抗氧化酶SOD、CAT和GST的活力单位为U/mg prot, GSH和GSSG含量以mg/g prot表示, GSH/GSSG比值由GSH和GSSG含量換算; LPO水平以丙二醛(MDA)含量表示, 测定单位为nmol/mg prot; 组织总蛋白浓度采用BCA法测定, 所用试剂盒购自南京建成生物工程研究所, 测定单位为mg/L。
1.4 糖酵解和消化酶指标测定本研究测定的能量代谢相关指标主要包括糖酵解酶[丙酮酸激酶(Pyruvate Kinase, PK)和己糖激酶(HK)]和消化酶[胰蛋白酶(Trypsin, Tryp)和碱性磷酸酶(Alkaline Phosphatase, AKP)], 测定流程简述如下:取适量肝胰腺组织在0.86%生理盐水溶液中匀浆, 制备成10% m/v的组织匀浆液; 在4℃下10000g离心15min, 获得匀浆液上清; 采用南京建成生物工程研究所研制的商品化试剂盒, 分别进行丙酮酸激酶(PK)、己糖激酶(HK)和胰蛋白酶(Tryp)、碱性磷酸酶(AKP)的活性测定。丙酮酸激酶(PK)、己糖激酶(HK)和碱性磷酸酶(AKP)的活性单位为U/g prot, 胰蛋白酶(Tryp)活性单位为U/mg prot, 组织总蛋白浓度测定方法同上。
1.5 能量储备物质含量测定本研究测定的能量储备物质主要包括糖原(Glycogen, GLY)和蛋白质(Protein, PROT)含量, 测定方法简述如下:采集适量肌肉组织, 加入匀浆缓冲液(0.1mol/L Tris-HCl, 15% PVP, 153µmol/L MgSO4和0.2% Triton X-100)中匀浆, 制备成10% m/v的组织匀浆液; 在4℃下以10000g离心15min, 收集匀浆液上清, 用于储能物质含量分析。糖原(GLY)含量测定参照Dubois等(1956)描述的苯酚-硫酸法, 以葡萄糖作为标准物进行糖原含量的定量; 蛋白质(PROT)含量测定以牛血清白蛋白为标准, 根据Biuret方法对PROT含量进行定量(Robinson et al, 1940)。GLY和PROT含量均以mg/g FW(鲜重)表示。
1.6 统计分析所有实验数据均采用平均值±标准偏差来表示, 使用SPSS 22.0统计分析软件对所有数据进行单因素方差分析, 事后检验采用Tukey检验, 显著性水平设定为P < 0.05。通过双因素方差分析评估不同处理组间的差异, 显著性水平设定为P < 0.05。
2 结果 2.1 海水酸化和热应激对日本鼓虾氧化应激的影响海水酸化和热应激对日本鼓虾氧化应激指标的影响如图 1所示。与对照组相比, 酸化和热应激处理组鼓虾的SOD活性均无显著变化(图 1a); 然而, 酸化和热应激复合暴露(pH 7.6 + 23.0℃)导致鼓虾的SOD活性显著低于酸化单独暴露组(pH 7.6)。暴露14天后, 热应激处理组(23.0℃)的CAT活性较对照组水平显著增加1.12倍(P < 0.05, 图 1b), 而酸化单独暴露(pH 7.6)、酸化和热应激复合暴露(pH 7.6 + 23.0℃)对鼓虾的CAT活性均无显著影响。对于GST活性而言, 各处理组间均不存在显著差异(图 1c)。此外, 酸化(pH 7.6)、热应激(23℃)以及酸化和热应激复合暴露组(pH 7.6 + 23℃)的GSH含量和GSH/GSSG比值均较对照组水平显著降低(P < 0.05, 图 1d, 1e); 其中, 酸化和热应激复合暴露组的GSH含量较对照组水平降低66.0%, GSH/GSSG比值降低为对照组水平的20.8%。然而, 热应激(23.0℃)和酸化升温复合暴露(pH 7.6 + 23℃)导致LPO水平较对照组分别增加47.2%和51.4%(P < 0.05, 图 1f)。ANOVA结果分析表明, 海水酸化和热应激对日本鼓虾的CAT活性、GSH含量和GSH/GSSG比值均具有交互作用(表 2)。
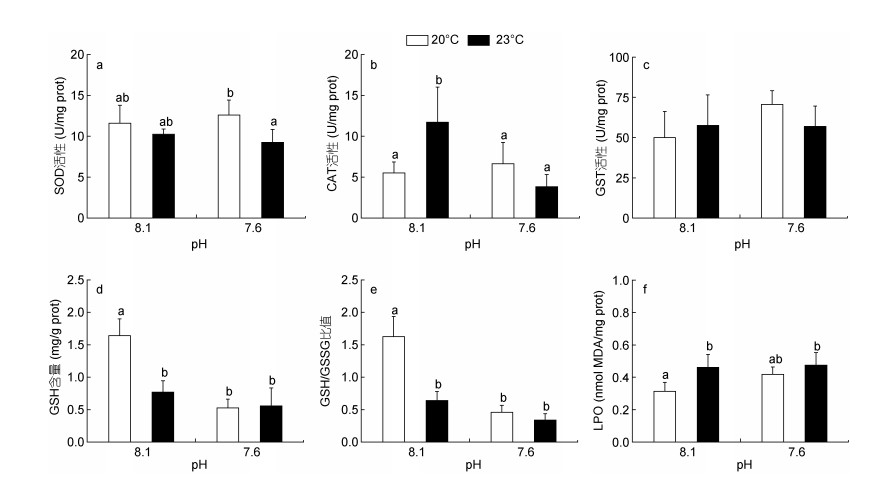 |
| 图 1 海水酸化和热应激对日本鼓虾氧化应激指标的影响 Fig. 1 Antioxidant enzyme activities and LPO levels in A. japonicus exposed to increased seawater acidification and thermal stress 注: a:超氧化物歧化酶(SOD); b:过氧化氢酶(CAT); c:谷胱甘肽巯基转移酶(GST); d:还原型谷胱甘肽(GSH); e:还原型谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG); f:脂质过氧化水平(LPO)。竖线代表平均值±标准差(n = 6), 标有不同字母的处理组间存在显著性差异(P < 0.05)。 |
| 因子/交互 | ||||
| pH | 温度 | pH ×温度 | ||
| 氧化应激 | SOD | F (1, 20) = 0 P = 0.988 |
F (1, 20) = 11.995 P = 0.002 |
F (1, 20) = 2.187 P = 0.155 |
| CAT | F (1, 16) = 7.785 P = 0.013 |
F (1, 16) = 1.910 P =0.186 |
F (1, 16) = 13.841 P = 0.002 |
|
| GST | F (1, 20) = 2.773 P = 0.111 |
F (1, 20) = 0.245 P = 0.626 |
F (1, 20) = 3.243 P = 0.087 |
|
| GSH | F (1, 16) = 45.517 P < 0.0001 |
F (1, 16) = 18.107 P = 0.001 |
F (1, 16) = 20.948 P < 0.0001 |
|
| GSH/GSSG | F (1, 12) = 62.912 P < 0.0001 |
F (1, 12) = 35.693 P < 0.0001 |
F (1, 12) = 21.846 P = 0.001 |
|
| MDA | F (1, 17) = 4.319 P = 0.053 |
F (1, 17) = 13.110 P = 0.002 |
F (1, 17) = 2.600 P = 0.125 |
|
| 糖酵解酶 | PK | F (1, 20) = 3.246 P = 0.087 |
F (1, 20) = 42.499 P < 0.0001 |
F (1, 20) = 12.488 P = 0.002 |
| HK | F (1, 16) = 7.370 P = 0.015 |
F (1, 16) = 14.874 P = 0.001 |
F (1, 16) = 2.991 P = 0.103 |
|
| 消化酶 | Tryp | F (1, 20) = 3.681 P = 0.069 |
F (1, 20) = 5.169 P = 0.034 |
F (1, 20) = 1.966 P = 0.176 |
| AKP | F (1, 16) = 0.017 P = 0.899 |
F (1, 16) = 29.815 P < 0.0001 |
F (1, 16) = 3.500 P = 0.080 |
|
| 能量储备 | PROT | F (1, 20) = 15.282 P = 0.001 |
F (1, 20) = 37.496 P < 0.0001 |
F (1, 20) = 20.348 P < 0.0001 |
| GLY | F (1, 24) = 2.311 P = 0.141 |
F (1, 24) = 0.134 P = 0.717 |
F (1, 24) = 1.683 P = 0.207 |
|
| 注:表中加粗字体表示具有显著作用。 | ||||
海水酸化和热应激对鼓虾肝胰腺组织中糖酵解酶的影响如图 2所示。暴露14天后, 海水酸化处理组(pH 7.6)的PK活性显著高于其他处理组, 而酸化和热应激复合暴露(pH 7.6 + 23.0℃)则导致鼓虾PK活性较对照组降低了21.2% (P < 0.05, 图 2a)。此外, 海水酸化和热应激单独处理对HK活性无显著影响, 而酸化海水和热应激复合暴露组(pH 7.6 + 23.0℃)的HK活性较对照组水平显著增加了83.6% (P < 0.05, 图 2b)。ANOVA分析结果表明, 海水酸化和热应激对日本鼓虾的PK活性具有显著的交互作用(表 2)。
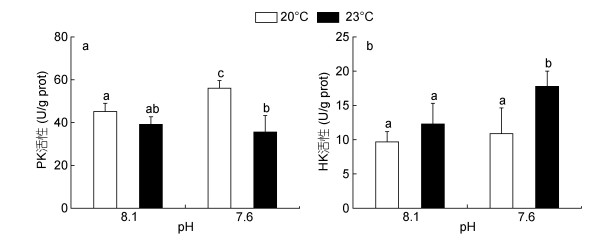 |
| 图 2 海水酸化和热应激对日本鼓虾糖酵解酶活性的影响 Fig. 2 Glycolytic enzyme activities in A. japonicus exposed to increased seawater acidification and thermal stress 注: a:丙酮酸激酶(PK); b:己糖激酶(HK)。竖线代表平均值±标准差(n = 6), 标有不同字母的处理组间存在显著性差异(P < 0.05)。 |
海水酸化和热应激对鼓虾肝胰腺组织中消化酶活性的影响如图 3所示。海水酸化和热应激单独暴露14天后, 胰蛋白酶Tryp活性较对照组水平无显著变化, 而酸化和热应激复合暴露组(pH 7.6 + 23.0℃)的胰蛋白酶Tryp活性则较对照组水平升高了36.5% (P < 0.05, 图 3a)。此外, 无论酸化暴露与否, 热应激(23.0℃)处理能够显著抑制鼓虾肝胰腺的AKP活性(图 3b)。
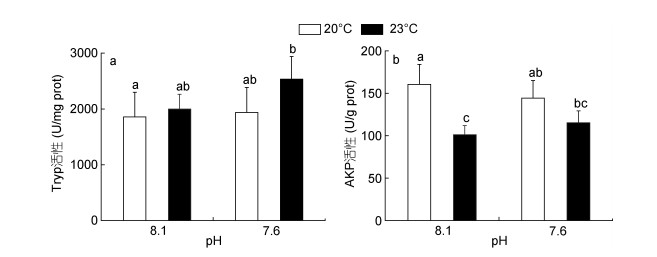 |
| 图 3 海水酸化和热应激对日本鼓虾消化酶活性的影响 Fig. 3 Digestive enzyme activities in A. japonicus exposed to increased seawater acidification and thermal stress 注: a:胰蛋白酶(Tryp); b:碱性磷酸酶(AKP)。竖线代表平均值±标准差(n = 6), 标有不同字母的处理组间存在显著性差异(P < 0.05)。 |
海水酸化和热应激暴露14天后, 日本鼓虾肌肉组织中的储能物质含量如图 4所示。其中, 海水酸化和热应激单独处理组的蛋白质含量较对照组无显著变化, 而海水酸化和热应激复合暴露(pH 7.6 + 23.0℃)可导致鼓虾肌肉组织中的蛋白质含量显著低于其他三个处理组(P < 0.05, 图 4a)。对糖原含量而言, 虽然海水酸化和/或热应激处理组较对照组水平有所降低, 但均与对照组含量无显著差异(图 4b)。分析发现, 在单独酸化(pH 7.6)条件下, 鼓虾体内两种储能物质(糖原和蛋白质)的含量均无显著变化, 表明在短期酸化处理下鼓虾尚能维持其能量稳态。双因素方差分析结果表明, 海水酸化和热应激对日本鼓虾肌肉组织中的蛋白质含量具有显著的交互作用(表 2)。
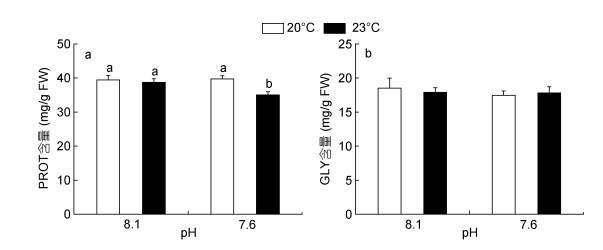 |
| 图 4 海水酸化和热应激对日本鼓虾储能物质含量的影响 Fig. 4 Contents of energy reserves in A.japonicus exposed to increased seawater acidification an thermal stress 注: a:蛋白质(PROT); b:糖原(GLY)。竖线代表平均值±标准差(n = 6), 标有不同字母的处理组间存在显著性差异(P < 0.05)。 |
越来越多的证据表明, 海洋酸化和暖化将不可避免地造成海洋生物多样性的下降, 导致生物群落结构及地理分布的变迁, 进而影响整个生态系统的结构、功能、服务与产出(Campbell et al, 2016)。目前, 有关海洋酸化和暖化对软体动物、珊瑚等海洋生物的影响已有较多报道, 但在甲壳类生物中的研究相对较少。已有研究发现, 甲壳类动物对海洋环境变化的适应能力较弱, 为面临较高风险的生态类群(Whiteley et al, 2011)。本文以兼具生态和经济价值的近海常见种——日本鼓虾为研究对象, 探讨了海水酸化和升温对其氧化应激和能量代谢等生理过程的影响, 以期能够为准确评估多重环境压力下近海关键生态类群的适应潜力提供理论依据。
3.1 氧化应激活性氧(ROS)是生物体正常有氧代谢过程的副产物(Halliwell et al, 1986), 保持ROS的动态平衡是机体维持正常生理功能的关键。当生物体受到外界环境干扰时, 会导致机体的ROS平衡失调, 从而造成机体的氧化损伤(Hassoun et al, 1996; Almazan et al, 2000)。在长期进化过程中, 生物体形成了一整套抗氧化防御机制, 主要包括SOD、CAT、GST、GPx等酶抗氧化系统和多种小分子抗氧化物质。其中, SOD是机体清除氧自由基的关键酶类, 能够催化超氧化物转化为H2O2, 而CAT则可将H2O2进一步转化为H2O; GST可以催化谷胱甘肽与亲脂性化合物结合, 在机体防御氧化应激中也发挥着重要作用(Matozzo et al, 2013)。
已有研究表明, 包括海水酸化、热应激和污染物暴露在内的多种环境压力, 均能够增加海洋无脊椎动物体内的ROS含量(Zhang et al, 2012; Siddiqui et al, 2015), 造成机体的氧化损伤。例如, 海水酸化和/或热应激可导致虾夷扇贝(Patinopecten yessoensis)、鸡帘蛤(Chamelea gallina)和紫贻贝(Mytilus galloprovincialis)体内ROS的过量产生, 从而对机体健康状态产生负面影响(Matozzo et al, 2013; Liao et al, 2019)。在本研究中, 短期海水酸化处理(pH 7.6)对日本鼓虾的SOD和CAT活性均无显著影响, 热应激(23.0℃)则能够显著诱导CAT活性, 推测SOD和CAT活性变化的不同步性与该两种酶的受影响模式存在差异密切相关(秦洁芳等, 2011)。此外, 热应激单独暴露以及海水酸化和热应激复合暴露均能够导致机体LPO水平的显著升高和GSH含量、GSH/GSSG的显著降低。LPO作为细胞和组织氧化损伤的重要指标, 常被用来表征生物膜氧化损伤的程度; GSH是一种重要的抗氧化剂, 可作为底物与GPx和GST共同抵御过氧化损害, 其含量是衡量机体抗氧化能力的重要因素。本研究中LPO水平的显著升高和GSH含量、GSH/GSSG比值的显著降低, 表明热应激以及海水酸化和热应激复合暴露均能够诱导较为严重的脂质过氧化, 导致机体产生氧化应激现象。类似的现象在其他多种物种中已有报道, 如热应激可导致南极扇贝(Adamussium colbecki)消化腺中GSH含量降低(Benedetti et al, 2016), 海水酸化和卡马西平复合暴露则能够导致浅沟蛤(Scrobicularia plana)体内GSH/GSSG比值的降低和LPO水平的升高(Freitas et al, 2016)。
3.2 能量代谢与储备能量代谢标志物对于评估环境压力下的机体能量状态具有重要的指示意义(Dong et al, 2016)。Freitas等(2017)研究发现, 海水酸化暴露可导致紫贻贝(M. galloprovincialis)体内的蛋白质含量被显著抑制, 而酸化和灿烂弧菌复合暴露也能够导致长牡蛎(C. gigas)体内蛋白质含量的显著降低(Cao et al, 2018)。在本研究中, 单独酸化、热应激处理对鼓虾体内的蛋白质和糖原含量无显著影响, 而海水酸化和热应激复合暴露则能够显著抑制鼓虾体内的蛋白质含量, 提示复合暴露对机体能量物质储备的影响较单一暴露组更加强烈。蛋白质含量降低的原因可能是由于氨基酸被动员进入三羧酸循环为机体提供能量, 抑或氨基酸被用于合成其他抵抗环境应激的物质。
PK和HK作为糖酵解过程重要的变构调节酶, 其活力变化能够反映机体对糖酵解过程的调控水平。例如, 热应激可降低紫贻贝(M. galloprovincialis)外套膜的PK活性(Anestis et al, 2007)。在本研究中, 海水酸化导致鼓虾肝胰腺组织的PK活性显著升高, 表明机体通过增强糖酵解过程以维持其酸碱稳态及其他应激反应所需的能量; 然而, 在热应激以及酸化和热应激复合暴露条件下, 鼓虾肝胰腺PK活性受到显著抑制, 这可能是由于热应激导致了线粒体呼吸速率增加, 加速了ROS的形成(钱佳慧等, 2015), 进而导致PK活性的降低。此外, 在酸化和热应激复合暴露条件下, 肝胰腺HK活性受到显著诱导, 较对照组水平增加了83.6%, 表明鼓虾体内糖原消耗的增加, 用于满足机体耗氧代谢的需求, 这与本研究中热应激条件下糖原含量降低的趋势相吻合。类似的现象在金头鲷(Sparus aurata)中也有报道, 单独酸化以及酸化和热应激复合暴露均可导致机体糖酵解过程的增强和糖原含量的降低(Araújo et al, 2018)。总体而言, 热应激对日本鼓虾糖酵解酶类活性的影响强于酸化, 这可能是由于温度升高导致机体代谢速率的加快, 从而诱导了能量代谢相关酶类活性的显著变化。
消化酶活性变化也是生物体能量代谢调节的途径之一(Hochachka et al, 2002), 被认为是评估机体受环境胁迫导致的生物学损伤和生理状态改变的可靠指标(Zambonino Infante et al, 2008)。Rosa等研究发现, 适度升温刺激可导致清洁虾(Lysmata seticaudata)肝胰腺中胰蛋白酶活性的显著升高(Rosa et al, 2014)。在本研究中, 酸化和热应激复合暴露导致日本鼓虾胰蛋白酶活性显著升高, 提示机体可能通过增强蛋白质消化能力以维持自身能量的稳态。此外, 热应激处理能够显著抑制鼓虾AKP活性, 这被认为与AKP酶活性的温度依赖性密切相关。与海水酸化暴露相比, 热应激对日本鼓虾肝胰腺中消化酶活性的影响更加显著, 提示热应激对日本鼓虾消化能力的影响程度高于海水酸化。
4 结论本文以日本鼓虾为研究对象, 探讨了海水酸化和热应激对其氧化应激和能量代谢等生理过程的影响, 主要结论如下:短期海水酸化、热应激以及海水酸化和热应激复合暴露处理均可导致日本鼓虾出现不同程度的氧化应激现象, 且复合暴露组的LPO水平和GSH/GSSG比值较单独暴露组变化更加显著; 同时, 海水酸化、热应激以及海水酸化和热应激复合暴露能够影响鼓虾的糖酵解过程和能量储备, 且表现为热应激的影响程度高于海水酸化。
秦洁芳, 陈海刚, 蔡文贵, 等. 2011. 邻苯二甲酸二丁酯对翡翠贻贝抗氧化酶及脂质过氧化水平的影响. 应用生态学报, 22(7): 1878-1884 |
钱佳慧, 栗志民, 申玉春, 等. 2015. 温度和盐度对华贵栉孔扇贝抗氧化酶活性的联合效应研究. 南方水产科学, 11(6): 49-57 |
徐从军, 徐宾铎, 张崇良, 等. 2019. 基于SURF指数识别海州湾食物网的关键饵料生物. 生态学报, 39(24): 9373-9378 |
Almazan G, Liu H N, Khorchid A et al, 2000. Exposure of developing oligodendrocytes to cadmium causes HSP72 induction, free radical generation, reduction in glutathione levels, and cell death. Free Radical Biology and Medicine, 29(9): 858-869 DOI:10.1016/S0891-5849(00)00384-1 |
Anestis A, Lazou A, Pörtner H O et al, 2007. Behavioral, metabolic, and molecular stress responses of marine bivalve Mytilus galloprovincialis during long-term acclimation at increasing ambient temperature. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 293(2): R911-R921 DOI:10.1152/ajpregu.00124.2007 |
Araújo J E, Madeira D, Vitorino R et al, 2018. Negative synergistic impacts of ocean warming and acidification on the survival and proteome of the commercial sea bream, Sparus aurata. Journal of Sea Research, 139: 50-61 DOI:10.1016/j.seares.2018.06.011 |
Aurélio M, Faleiro F, Lopes V M et al, 2013. Physiological and behavioral responses of temperate seahorses (Hippocampus guttulatus) to environmental warming. Marine Biology, 160(10): 2663-2670 DOI:10.1007/s00227-013-2259-8 |
Benedetti M, Lanzoni I, Nardi A et al, 2016. Oxidative responsiveness to multiple stressors in the key Antarctic species, Adamussium colbecki:interactions between temperature, acidification and cadmium exposure. Marine Environmental Research, 121: 20-30 DOI:10.1016/j.marenvres.2016.03.011 |
Brennand H S, Soars N, Dworjanyn S A et al, 2010. Impact of ocean warming and ocean acidification on larval development and calcification in the sea urchin Tripneustes gratilla. PLoS One, 5(6): e11372 DOI:10.1371/journal.pone.0011372 |
Brothers C J, McClintock J B, 2015. The effects of climate-induced elevated seawater temperature on the covering behavior, righting response, and Aristotle's lantern reflex of the sea urchin Lytechinus variegatus. Journal of Experimental Marine Biology and Ecology, 467: 33-38 DOI:10.1016/j.jembe.2015.02.019 |
Caldeira K, Wickett M E, 2003. Oceanography:anthropogenic carbon and ocean pH. Nature, 425(6956): 365 DOI:10.1038/425365a |
Campbell L M, Gray N J, Fairbanks L et al, 2016. Global oceans governance:New and emerging issues. Annual Review of Environment and Resources, 41: 517-543 DOI:10.1146/annurev-environ-102014-021121 |
Cao R W, Liu Y L, Wang Q et al, 2018. Seawater acidification reduced the resistance of Crassostrea gigas to Vibrio splendidus challenge:an energy metabolism perspective. Frontiers in Physiology, 9: 880 DOI:10.3389/fphys.2018.00880 |
Cao R W, Zhang T Y, Li X et al, 2019. Seawater acidification increases copper toxicity:A multi-biomarker approach with a key marine invertebrate, the Pacific oyster Crassostrea gigas. Aquatic Toxicology, 210: 167-178 DOI:10.1016/j.aquatox.2019.03.002 |
Collins M, Knutti R, Arblaster J et al, 2013. Long-term climate change: projections, commitments and irreversibility. In: Stocker T F, Qin D, Plattner G K et al eds. Climate Change 2013: The Physical Science Basis Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. New York, USA: Cambridge University Press, 1029-1136
|
Dong Y W, Zhang S, 2016. Ecological relevance of energy metabolism:transcriptional responses in energy sensing and expenditure to thermal and osmotic stresses in an intertidal limpet. Functional Ecology, 30(9): 1539-1548 DOI:10.1111/1365-2435.12625 |
Dubois M, Gilles K A, Hamilton J K et al, 1956. Colorimetric method for determination of sugars and related substances. Analytical Chemistry, 28: 350-356 DOI:10.1021/ac60111a017 |
Feely R A, Doney S C, Cooley S R, 2009. Ocean acidification:Present conditions and future changes in a high-CO2 world. Oceanography, 22(4): 36-47 DOI:10.5670/oceanog.2009.95 |
Feely R A, Sabine C L, Lee K et al, 2004. Impact of anthropogenic CO2 on the CaCO3 system in the oceans. Science, 305(5682): 362-366 DOI:10.1126/science.1097329 |
Figueiredo D A L, Branco P C, dos Santos D A et al, 2016. Ocean acidification affects parameters of immune response and extracellular pH in tropical sea urchins Lytechinus variegatus and Echinometra luccunter. Aquatic Toxicology, 180: 84-94 DOI:10.1016/j.aquatox.2016.09.010 |
Freitas R, Almeida Â, Calisto V et al, 2016. The impacts of pharmaceutical drugs under ocean acidification:new data on single and combined long-term effects of carbamazepine on Scrobicularia plana. Science of the Total Environment, 541: 977-985 DOI:10.1016/j.scitotenv.2015.09.138 |
Freitas R, De Marchi L, Bastos M et al, 2017. Effects of seawater acidification and salinity alterations on metabolic, osmoregulation and oxidative stress markers in Mytilus galloprovincialis. Ecological Indicators, 79: 54-62 DOI:10.1016/j.ecolind.2017.04.003 |
Friedlingstein P, Jones M W, O'Sullivan M et al, 2019. Global carbon budget 2019. Earth System Science Data, 11(4): 1783-1838 DOI:10.5194/essd-11-1783-2019 |
Halliwell B, Gutteridge J M C, 1986. Oxygen free radicals and iron in relation to biology and medicine:some problems and concepts. Archives of Biochemistry and Biophysics, 246(2): 501-514 DOI:10.1016/0003-9861(86)90305-X |
Harianto J, Nguyen H D, Holmes S P et al, 2018. The effect of warming on mortality, metabolic rate, heat-shock protein response and gonad growth in thermally acclimated sea urchins (Heliocidaris erythrogramma). Marine Biology, 165(6): 96 DOI:10.1007/s00227-018-3353-8 |
Hassoun E A, Stohs S J, 1996. Cadmium-induced production of superoxide anion and nitric oxide, DNA single strand breaks and lactate dehydrogenase leakage in J774A.1 cell cultures. Toxicology, 112(3): 219-226 DOI:10.1016/0300-483X(96)03404-X |
Hendriks I E, Duarte C M, Álvarez M, 2010. Vulnerability of marine biodiversity to ocean acidification:a meta-analysis. Estuarine, Coastal and Shelf Science, 86(2): 157-164 DOI:10.1016/j.ecss.2009.11.022 |
Hochachka P W, Somero G N, 2002. Biochemical Adaptation:Mechanism and Process in Physiological Evolution. Oxford, UK: Oxford University Press
|
Hoegh-Guldberg O, Bruno J F, 2012. The impact of climate change on the world's marine ecosystems. Science, 328(5985): 1523-1528 |
Hurt C, Silliman K, Anker A et al, 2013. Ecological speciation in anemone-associated snapping shrimps (Alpheus armatus species complex). Molecular Ecology, 22(17): 4532-4548 DOI:10.1111/mec.12398 |
IPCC, 2014. Climate Change 2014:Synthesis Report. Contribution of Working Group I, II and III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University Press
|
Johnson M D, Carpenter R C, 2012. Ocean acidification and warming decrease calcification in the crustose coralline alga Hydrolithon onkodes and increase susceptibility to grazing. Journal of Experimental Marine Biology and Ecology, 434-435: 94-101 DOI:10.1016/j.jembe.2012.08.005 |
Kroeker K J, Kordas R L, Crim R N et al, 2010. Meta-analysis reveals negative yet variable effects of ocean acidification on marine organisms. Ecology Letters, 13(11): 1419-1434 DOI:10.1111/j.1461-0248.2010.01518.x |
Liao H, Yang Z J, Dou Z et al, 2019. Impact of ocean acidification on the energy metabolism and antioxidant responses of the yesso scallop (Patinopecten yessoensis). Frontiers in Physiology, 9: 1967 DOI:10.3389/fphys.2018.01967 |
Little A G, Kunisue T, Kannan K et al, 2013. Thyroid hormone actions are temperature-specific and regulate thermal acclimation in zebrafish (Danio rerio). BMC Biology, 11(1): 26 DOI:10.1186/1741-7007-11-26 |
Madeira D, Mendonça V, Vinagre C et al, 2016. Is the stress response affected by season? Clues from an in situ study with a key intertidal shrimp. Marine Biology, 163(2): 41 DOI:10.1007/s00227-015-2803-9 |
Matozzo V, Chinellato A, Munari M et al, 2013. Can the combination of decreased pH and increased temperature values induce oxidative stress in the clam Chamelea gallina and the mussel Mytilus galloprovincialis?. Marine Pollution Bulletin, 72(1): 34-40 DOI:10.1016/j.marpolbul.2013.05.004 |
Mollica N R, Guo W F, Cohen A L et al, 2018. Ocean acidification affects coral growth by reducing skeletal density. Proceedings of the National Academy of Sciences of the United States of America, 115(8): 1754-1759 DOI:10.1073/pnas.1712806115 |
Parker L M, Ross P M, O'Connor W A, 2010. Comparing the effect of elevated pCO2 and temperature on the fertilization and early development of two species of oysters. Marine Biology, 157(11): 2435-2452 DOI:10.1007/s00227-010-1508-3 |
Pistevos J C A, Nagelkerken I, Rossi T et al, 2015. Ocean acidification and global warming impair shark hunting behaviour and growth. Scientific Reports, 5: 16293 DOI:10.1038/srep16293 |
Rivest E B, Hofmann G E, 2014. Responses of the metabolism of the larvae of Pocillopora damicornis to ocean acidification and warming. PLoS One, 9(4): e96172 DOI:10.1371/journal.pone.0096172 |
Robinson H W, Hogden C G, 1940. The biuret reaction in the determination of serum proteins. 1. A study of the conditions necessary for the production of a stable color which bears a quantitative relationship to the protein concentration. Journal of Biological Chemistry, 135: 707-725 |
Rosa R, Lopes A R, Pimentel M et al, 2014. Ocean cleaning stations under a changing climate:biological responses of tropical and temperate fish-cleaner shrimp to global warming. Global Change Biology, 20(10): 3068-3079 DOI:10.1111/gcb.12621 |
Sabine C L, Feely R A, Gruber N et al, 2004. The oceanic sink for anthropogenic CO2. Science, 305(5682): 367-371 DOI:10.1126/science.1097403 |
Siddiqui S, Bielmyer-Fraser G K, 2015. Responses of the sea anemone, Exaiptasia pallida, to ocean acidification conditions and copper exposure. Aquatic Toxicology, 167: 228-239 DOI:10.1016/j.aquatox.2015.08.012 |
Sinutok S, Hill R, Kühl M et al, 2014. Ocean acidification and warming alter photosynthesis and calcification of the symbiont-bearing foraminifera Marginopora vertebralis. Marine Biology, 161(9): 2143-2154 DOI:10.1007/s00227-014-2494-7 |
Talmage S C, Gobler C J, 2009. The effects of elevated carbon dioxide concentrations on the metamorphosis, size, and survival of larval hard clams (Mercenaria mercenaria), bay scallops (Argopecten irradians), and Eastern oysters (Crassostrea virginica). Limnology and Oceanography, 54(6): 2072-2080 DOI:10.4319/lo.2009.54.6.2072 |
Walther K, Anger K, Pörtner H O, 2010. Effects of ocean acidification and warming on the larval development of the spider crab Hyas araneus from different latitudes (54° vs. 79°N). Marine Ecology Progress Series, 417: 159-170 DOI:10.3354/meps08807 |
Whiteley N M, 2011. Physiological and ecological responses of crustaceans to ocean acidification. Marine Ecology Progress Series, 430: 257-271 DOI:10.3354/meps09185 |
Yao C L, Somero G N, 2014. The impact of ocean warming on marine organisms. Chinese Science Bulletin, 59(5-6): 468-479 DOI:10.1007/s11434-014-0113-0 |
Zambonino Infante J L, Gisbert E, Sarasquete C et al, 2008. Ontogeny and physiology of the digestive system of marine fish larvae. In: Cyrino J E P, Bureau D P, Kapoor B G eds. Feeding and Digestive Functions in Fishes. Boca Raton: CRC Press, 281-348
|
Zhang Y, Gao X L, Guo W D et al, 2018. Origin and dynamics of dissolved organic matter in a mariculture area suffering from summertime hypoxia and acidification. Frontiers in Marine Science, 5: 325 DOI:10.3389/fmars.2018.00325 |
Zhang D J, Li S J, Wang G Z et al, 2012. Biochemical responses of the copepod Centropages tenuiremis to CO2-driven acidified seawater. Water Science and Technology, 65(1): 30-37 DOI:10.2166/wst.2011.821 |
 2020, Vol. 51
2020, Vol. 51


