中国海洋湖沼学会主办。
文章信息
- 钟兆山, 王敏晓, 孙园园, 王孝程, 陈浩, 孙妍, 李梦娜, 李超伦. 2020.
- ZHONG Zhao-Shan, WANG Min-Xiao, SUN Yuan-Yuan, WANG Xiao-Cheng, CHEN Hao, SUN Yan, LI Meng-Na, LI Chao-Lun. 2020.
- 平端深海偏顶蛤(Gigantidas platifrons)实验室蓄养过程鳃部含菌上皮细胞超微结构动态变化研究
- ULTRASTRUCTURE OF BACTERIOCYTES IN GILLS OF GIGANTIDAS PLATIFRONS IN LONG-TERM CULTIVATION
- 海洋与湖沼, 51(4): 952-959
- Oceanologia et Limnologia Sinica, 51(4): 952-959.
- http://dx.doi.org/10.11693/hyhz20200100016
文章历史
-
收稿日期:2020-01-14
收修改稿日期:2020-03-01
2. 中国科学院研究所 海洋生态与环境科学重点实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071;
5. 中国科学院海洋研究所 实验海洋生物学重点实验室 青岛 266071;
6. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
7. 国家海洋环境监测中心 大连 116023
2. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. CAS Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
6. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
7. National Marine Environmental Monitoring Center, Dalian 116023, China
深海偏顶蛤(深海贻贝)隶属于深海偏顶蛤亚科(双壳纲:贻贝科), 是全球深海冷泉、热液和沉木等化能生态系统系统中最典型的大型无脊椎动物(Turner et al, 1984; Smith, 1985; Jones et al, 2005)。在深海无光、低温的环境中, 可以滤食的颗粒有机质相对匮乏; 深海偏顶蛤与化能合成细菌建立了紧密的共生关系, 高效利用化能细菌化学能合成的有机物, 共生的建立成为深海偏顶蛤适应深海化能生态系统的关键特征(Cavanaugh et al, 1992; Fisher et al, 1993; Fujiwara et al, 2000)。这些共生菌分布于深海偏顶蛤鳃上皮细胞中, 特化成膨大的含菌细胞, 可以通过氧化水体中的甲烷、硫化氢、氢气等还原性物质产生能量固定水体中的碳源(Fiala-Médioni et al, 1986; Southward, 2008)。此外, 共生菌还参与深海偏顶蛤硫化氢、重金属等胁迫的应答, 因此深海共生近年来广为关注, 成为深海领域研究的热点(Company et al, 2004; Wang et al, 2017; Zheng et al, 2017; Zhou et al, 2020)。
营养互利是深海偏顶蛤共生关系建立的重要纽带, 然而对于深海偏顶蛤如何获取共生菌合成的有机碳, 目前尚无定论。目前主要有两个假说: “牧场假说”, 即宿主通过细胞内消化共生菌, 获取所需物质能量; “奶牛假说”, 即共生菌分泌有机物供给宿主生长(Nelson et al, 1995; Barry et al, 2002; Kádár et al, 2008)。深海偏顶蛤共生菌被包裹在鳃上皮细胞中的囊泡中, 而溶酶体可以与这些囊泡结合, 在消化酶的作用下被降解成小分子, 在牧场假说的细胞内消化中发挥重要作用。此外, 溶酶体还参与调控共生菌的平衡, 状态良好的共生菌可以抑制带菌囊泡与初级溶酶体的融合, 而衰老状态的共生菌则无法抑制融合过程而被消化, 因此溶酶体决定共生菌的归宿(Trench, 1971)。溶酶体在共生调控的重要作用已经在刺胞动物-虫黄藻(Hohman et al, 1982), 蚜虫-布赫纳氏菌(Nishikori et al, 2009), 头足类-弧菌(Castillo et al, 2015), 阿米巴虫和共生菌(Kim et al, 1994)等多类群的共生体系中得到证实。在深海偏顶蛤中, 溶酶体在宿主-共生菌互作和营养获取的重要作用得到了比较转录组、荧光原位杂交和电镜观测证据的支持, 但Kádár等(2008)基于酶细胞化学和电镜研究结果, 提出深海偏顶蛤中的共生菌消失是自溶的结果, 而非被溶酶体消化, 深海偏顶蛤鳃内共生菌主要通过分泌大分子有机物为宿主提供能量, 因此溶酶体在共生互作中的作用有待开展深入研究。
平端深海偏顶蛤(Gigantidas platifrons)在化能生态系统中分布广泛且生物量巨大, 据调查发现, 从北到南广泛分布于日本相模湾冷泉区, 冲绳海槽热液区以及我国南海的台西南冷泉区(Sun et al, 2017b; Xu et al, 2018)。平端深海偏顶蛤生存于远离真光层的深海化能生态系统中, 成体分布深度超过1100m, 鳃部明显膨大, 其鳃上皮细胞发现大量内共生的甲烷氧化菌, 形成独特的含菌细胞(Barry et al, 2002)。含菌细胞中众多的甲烷氧化菌通过氧化冷泉渗漏口释放出的甲烷气体, 产生有机物, 供给平端深海偏顶蛤生长。鉴于其巨大的数量和重要的生态功能, 该物种是我国深海生物特殊生命过程研究的模式物种, 开展了基因组、转录组、基因功能等不同层次的研究工作, 成功建立平端深海偏顶蛤常压培养方法, 培养时间长达388d。在培养过程中, 共生菌由于还原性底物的不足而逐渐减少(Sun et al, 2017a), 为研究共生菌变化过程中的深海偏顶蛤响应提供了基础。本研究聚焦平端深海偏顶蛤含菌细胞中溶酶体与内共生甲烷氧化菌的动态变化, 选择了不同蓄养时间(0d, 30d, 90d)的平端深海偏顶蛤鳃丝进行电镜观察, 通过其鳃部含菌细胞超微结构变化, 推测含菌细胞中溶酶体与共生菌的动态变化关系, 以期进一步揭示溶酶体在鳃丝共生菌调控中的作用。
1 材料与方法 1.1 样品采集平端深海偏顶蛤Gigantidas platifrons采样工作依托2017年9月的冷泉调查航次开展, 采集站位位于中国台湾西南海域的活跃冷泉区(119°17′08.043″E; 22°06′55.569″N), 采样深度1120m, 环境水温3.35℃, 盐度34.54(图 1a)。样品使用ROV搭载的保温生物箱带到甲板后, 少量样品迅速解剖固定, 其余样品培养于预冷海水的循环水培养系统中(图 1b, c), 循环水系统控制温度(3.5±0.5)℃、盐度34.5±0.5, 待蓄养30d和90d(图 1e, f)后分别取10只生存状态良好的平端深海偏顶蛤进行解剖, 获取其鳃组织。鳃丝低温保存于电镜固定液(2%多聚甲醛, 2.5%戊二醛)中, 24h后更换固定液。
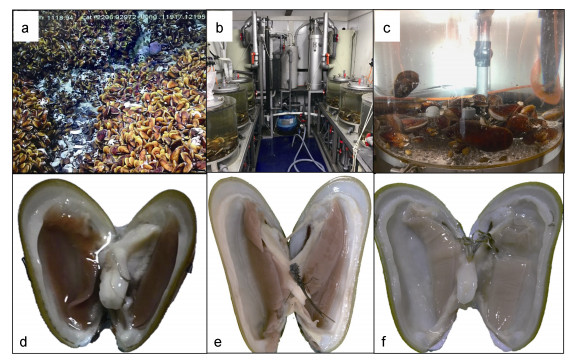 |
|
图 1 原位和常压水族培养后深海偏顶蛤鳃丝状态 Fig. 1 Gills of G. platifrons on board (0d) and reared in the atmosphere-pressured aquarium for 30 and 90 days 注: a.平端深海偏顶蛤原位生存环境; b, c.实验室循环水蓄养系统; d.平端深海偏顶蛤原位样品蓄养0d; e.平端深海偏顶蛤蓄养30d; f.平端深海偏顶蛤蓄养90d |
将不同蓄养阶段(0—90d)的鳃丝从固定液中取出, 用无菌海水漂洗2次, 每次10min, 将漂洗后的样品用1.0%锇酸固定1h, 固定后的样品再用超纯水漂洗2次, 随后将样品进行梯度酒精(30%, 50%, 70%, 95%, 100%)脱水, 每次10min, 脱水后的样品再经100%丙酮脱水3次, 每次10min, 然后将样品放入100%丙酮和树脂Epon812的混合溶液中, 丙酮、树脂混合液比例分别为(3︰1, 2︰1, 1︰1), 最后用纯树脂Epon812进行样品包埋。对包埋块进行切片(EM UC7, 莱卡, 奥地利), 染色(3%醋酸铀和2%柠檬酸铅), 使用透射电子显微镜(HT7700, 日立, 日本)观察鳃上皮细胞超微结构。
1.2.2 扫描电镜观察0d, 30d与90d的平端深海偏顶蛤鳃丝样品的固定液清洗、锇酸固定以及脱水过程与1.2.1透射电镜观察中描述相同, 将脱水后的样品用CO2临界点干燥仪(EM CPD 300, 莱卡, 奥地利)干燥, 镀膜仪(Sputter/Carbon Thread, EM ACE200, 莱卡, 奥地利)喷金, 使用扫描电子显微镜(S-3400N, 日立, 日本)观察鳃丝表面形态, 含菌细胞的大小。
2 结果 2.1 蓄养0d鳃丝超微结构观察蓄养开始时鳃丝扫描电镜结果显示平端深海偏顶蛤鳃上表皮(图 2a)主要包括两类细胞:含有纤毛的间细胞(图 2c中IC细胞), 只有微绒毛无纤毛的含菌细胞(图 2c中Bc细胞)。两片鳃丝通过纤毛盘连接(图 2a中CD所示为纤毛盘位置), 透射电镜照片显示含菌细胞(~24μm×12μm)呈杯状(图 2b), 含菌细胞内有高密度的杆状和球状的细菌结构(图 2b, ~2.13μm×0.89μm), 细菌被细胞膜包裹形成囊泡, 每个囊泡中细菌的数量不等, 从1个到多个均有发现。细菌内部含有堆叠的、层次分明的脊状膜结构, 符合I型甲烷氧化菌的特征。在细菌内部可以观察到高电子密度的黑色颗粒, 推测为碳源和能源的储备物——聚羟基丁酸样包涵体(图 2d)。甲烷氧化菌主要分布在含菌细胞的外侧, 最接近间细胞(图 2a的IC细胞)鳃丝纤毛摆动形成水流的位置。溶酶体多处于消化状态, 在含菌细胞中呈现螺旋的圈层结构(图 2b中Ly), 隐约可见未完全消化的甲烷氧化菌膜结构, 主要分布在靠近细胞依附生长的基底膜(图 2b中BM)周围, 含菌细胞的细胞核(图 2b中Nu)也常分布于靠近基底膜一侧。图 2d中展示了溶酶体对共生菌消化的不同阶段, 灰色箭头指示未消化甲烷氧化菌的初级溶酶体状态, 黑色箭头展示的溶酶体消化不完全, 残存的细菌膜结构明显; 白色箭头中的溶酶体消化程度更高, 细菌的结构已经消失, 此外基底膜附近存在大量的脂滴(Lp)。
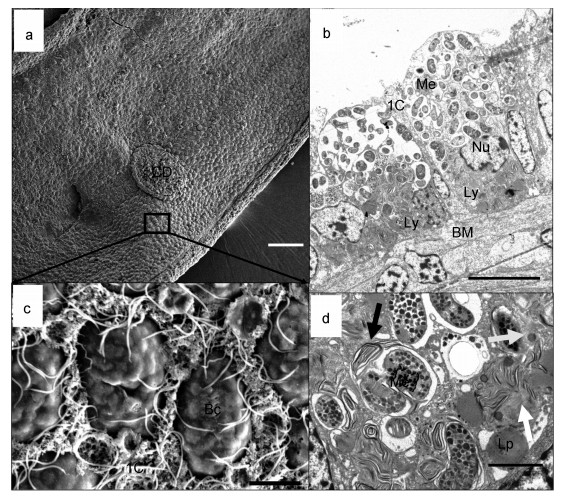 |
| 图 2 原位(0d)深海偏顶蛤鳃丝状态 Fig. 2 Gills of in-situ G. platifrons on board (0d) 注: a.平端深海偏顶蛤鳃扫描电镜观察; b.平端深海偏顶蛤鳃透射电镜观察; c.扫描电镜下鳃表面含菌细胞和间细胞形态; d.含菌细胞中溶酶体对甲烷氧化菌的分解(比例尺a=100 μm, b=10 μm, c=5 μm, d=1 μm)。Bc:含菌细胞; BM:基底膜; CD:纤毛盘; IC:间细胞; Lp:脂滴; Ly:溶酶体; Me:甲烷氧化菌; Nu:细胞核; 白色箭头:溶酶体分解甲烷氧化菌后期状态; 灰色箭头:指示未消化甲烷氧化菌的初级溶酶体状态; 黑色箭头:溶酶体初步包裹甲烷氧化菌开始分解 |
培养30d后, 平端深海偏顶蛤鳃丝上皮细胞结构完整性下降, 含菌细胞明显出现破碎(图 3a中白色箭头指示破碎的含菌细胞), 共生菌数量减少, 但在破碎的含菌细胞中可以看到结构完整的椭球状甲烷氧化菌。蓄养30d后的鳃样品中, 含菌细胞内部甲烷氧化菌数量与0d样品相比密度明显下降(图 3b), 含菌细胞中溶酶体(Ly)相对比例增大, 溶酶体小泡增多, 由基底膜附近分布到细胞的顶部(图 3c), 且处于消化后期的次级溶酶体比例增高, 显示细胞内甲烷氧化菌在溶酶体的作用下大量消化, 同时, 细胞中还有大量电子密度较弱的圆球状脂滴(Lp)出现。
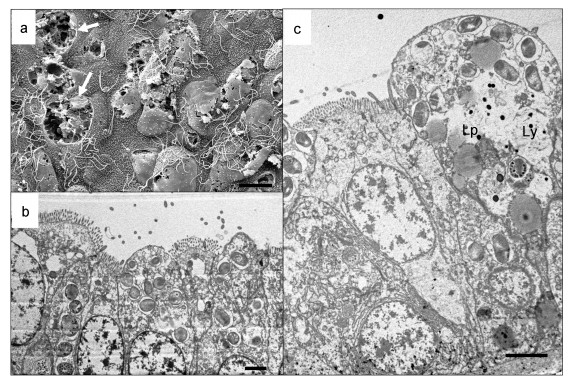 |
| 图 3 平端深海偏顶蛤蓄养30d鳃部含菌细胞的形态 Fig. 3 The ultrastructures of bacteriocytes in the gills of G. platifrons reared in the aquarium systems for 30 days 注: a.蓄养30d后鳃丝扫描电镜观察; b.蓄养30d后鳃丝透射电镜观察; c.蓄养30d后含菌细胞局部观察(比例尺a=10 μm, b=5 μm, c=5 μm)。Lp:脂滴; Ly:溶酶体; 白色箭头:破碎的含菌细胞 |
蓄养90d后, 平端深海偏顶蛤鳃丝含菌细胞明显减少, 与0d扫描电镜对比, 上皮细胞明显空瘪, 在鳃表面形成细胞脱落后的坑洞(图 4a), 鳃丝变细。在透射电镜的照片中观察到含菌细胞中几乎不存在甲烷氧化菌(图 4b, c)。在蓄养90d的鳃部含菌细胞中无明显的细胞器结构, 溶酶体分解后残留的膜状结构减少, 细胞内依然存在脂滴(图 4b, c中Lp)。
 |
| 图 4 平端深海偏顶蛤蓄养90d鳃部含菌细胞的形态 Fig. 4 The ultrastructures of bacteriocytes in the gills of G. platifrons reared in the aquarium systems for 90 days 注: a.蓄养90d后鳃丝扫描电镜观察; b.蓄养90d后鳃丝透射电镜观察; c.蓄养90d后含菌细胞局部观察(比例尺a=5 μm, b=5 μm, c=5 μm)。Lp:脂滴; Ly:溶酶体; 白色箭头:破碎的含菌细胞; 黑色箭头:指示含菌细胞中的脂滴 |
许多深海生物可以适应海底到海面巨大压力变化, 在实验室常压条件下长期培养甚至繁殖(Colaço et al, 2006, 2011; Bettencourt et al, 2008; Arellano et al, 2009)。本研究采用常压循环水蓄养平端深海偏顶蛤, 虽然平端深海偏顶蛤共生菌开始出现丢失, 但是在其鳃部还广泛分布大量含菌细胞, 而蓄养90d样品中内共生菌在透射电镜下难以检出, 这种随蓄养时间增长内共生菌含量减少的变化趋势与前人研究结果相同。分布在大西洋中脊热液区的深海偏顶蛤Bathymodiolus azoricus鳃部含菌细胞中同时含有硫氧化菌和甲烷氧化菌两种内共生细菌, 在非原位含有硫化物和甲烷气体的系统中蓄养六个月后依然可以检测出硫氧化菌, 但是甲烷氧化菌已经消失, 而在更长的培养中两种共生菌均消失(Colaço et al, 2011)。Sun等(2017a)在常压环境下对平端深海偏顶蛤进行蓄养, 分为充甲烷组与不充甲烷组, 发现两组样品中, 甲烷氧化菌含量随蓄养时间的增加, 均出现减少, 但是不充甲烷组的样品, 甲烷氧化菌减少的幅度更大。因此, 深海偏顶蛤所有的培养试验中共生菌的丢失是不可逆的, 还原性底物的添加只能延缓共生菌的丢失, 因此培养过程中共生菌的丢失除了代谢缺失造成共生菌的增殖减缓, 还涉及宿主的主动调控。共生关系的维持需要宿主、共生菌内部及其之间形成稳态, 压力变化造成的胁迫无疑会打破二者间的免疫平衡, 发生类似于珊瑚白化的共生菌丢失(Dunn et al, 2007)。已有研究表明, 减压培养过程中会诱导深海偏顶蛤含菌细胞产生活性氧自由基(ROS), 而ROS产生伴随含菌细胞溶酶体清除的示例在蚜虫中已有报道(Simonet et al, 2018)。此外压力变化诱导的共生菌凋亡也是不可逆共生菌丢失的主要因之一(Duperron et al, 2016)。本研究中0d的样品中存在低电子密度的小空泡, 类似的空泡在蚜虫带菌细胞的消亡早起也有报道(Simonet et al, 2018);同时, 培养30d后可以发现溶酶体的比例和消化程度显著升高, 提示共生菌的消失与溶酶体活动直接相关。
3.2 溶酶体在维持含菌细胞稳态中的作用溶酶体是一种膜结合的细胞器, 膜内包含肽酶、核酸酶、脂肪酸酶等多种酶, 使细胞能够分解它所吞噬的各种生物分子。溶酶体的水解酶在酸性环境才能达到最佳活性, 为了维持溶酶体内酸性环境需要利用ATP水解的能量激活质子泵,持续将质子泵入溶酶体中。初级溶酶体的大小从0.1 μm到1.2 μm不等, 在本研究中刚刚经历压力变化的0d样品中存在大量类似大小的囊泡(图 2d中黑色小球), 结合后期(30d)广泛增生的次级溶酶体, 上述囊泡可能是初级溶酶体。传统观念认为溶酶体只是细胞的垃圾处理站, 但现在越来越多的证据表明溶酶体有更广泛的功能(Settembre et al, 2013), 特别在共生互作中发挥重要作用(Hohman et al, 1982; Nishikori et al, 2009)。本研究发现, 蓄养0d样品中次级溶酶体分布在鳃上皮含菌细胞的基底膜附近, 而共生菌则分布在该细胞靠近水面的外侧, 这种共生菌和溶酶体的极化分布在深海偏顶蛤鳃上皮细胞中普遍存在(Barry et al, 2002; Kádár et al, 2005)。共生菌合成的有机物透过基底膜通过鳃丝间的管腔通过血窦进行输运(Geier et al, 2019), 因此溶酶体靠近基底膜有利于分解得到的小分子作为养分供给深海偏顶蛤生长。同时, 溶酶体靠近基底膜也可以为活跃的共生菌留出最佳的生态位。共生菌化能合成有机物需要氧气、还原性底物的供给, 而上述物质通过自由渗透进入上皮细胞, 形成从表至里的环境梯度, 而共生菌所在囊泡分布于外侧有利于提高化能合成速率。含菌细胞的极化并非随机生成的, 而是在细胞骨架的调控下实现的(Goldberg, 2001; Fiala-Médioni et al, 2002)。
而在30d样品中, 含菌细胞内的溶酶体范围扩大, 已经不仅限于分布在基底膜附近。结果表明在宿主受到胁迫或者共生菌状态不佳时, 为了避免共生菌自溶释放的酶或者ROS等有害产物危害宿主细胞(Dunn et al, 2007), 宿主通过溶酶体清除这些共生菌维持细胞和共生体系的稳态。在90d的样品中, 共生菌由于营养匮乏和宿主调控消失殆尽, 鳃部的颜色较0d和30d样品相比明显变浅, 这种鳃部颜色的变化同时也表明平端深海偏顶蛤的营养获取不足(Kádár et al, 2005)。相对于前期样品, 后期鳃上皮细胞中初级溶酶体和消化程度较低, 次级溶酶体的比例大幅度降低, 仅剩下分解后期的溶酶体和脂滴, 结果间接支持溶酶体形成与共生菌的密度相关, 而根据Yu等(2018)的研究结果, 溶酶体相关基因在含菌细胞的表达的确随共生菌的减少而降低。
综上, 研究结果支持, 在深海偏顶蛤与化能自养细菌形成的共生体系中, 溶酶体可能通过控制含菌细胞内共生菌的数量, 使宿主处于共生体系的主导地位, 另外溶酶体系统可以及时清除含菌细胞中已经死亡的内共生菌, 保证含菌细胞内部共生菌的质量, 也可以在机体能量匮乏时直接分解消化含菌细胞内部的共生菌产生可供深海偏顶蛤细胞吸收的物质, 维持机体生存(Kádár et al, 2008)。在冷泉环境中平端深海偏顶蛤利用内共生的甲烷氧化菌氧化甲烷产生的能量供给其正常生理活动, 虽然保留滤食系统, 但机体通过滤食获取的能量极少(王孝程, 2018)。因此在常压长期蓄养的过程中, 平端深海偏顶蛤鳃部共生菌含量的减少, 直接影响平端深海偏顶蛤的能量供给水平, 而为保持机体基本的营养来源, 只有大量通过溶酶体分解含菌细胞内共生菌来提供营养物质, 这也是溶酶体在营养匮乏条件下维持生命稳态, 主动从共生体系获取能量的展示。
4 结论我们通过长期常压蓄养观察到平端深海偏顶蛤鳃上皮含菌细胞中共生菌数量减少, 溶酶体含量降低。根据现有结果推测, 由于宿主营养匮乏和胁迫响应条件下, 溶酶体可能主动对含菌细胞中的甲烷氧化菌进行分解消化, 过程中伴随着溶酶体含量先逐渐增多, 甲烷氧化菌逐渐减少, 当分解消化甲烷氧化菌之后, 溶酶体随之在细胞内消失, 使细胞呈现空泡化的现象。这种能量缺乏条件下含菌细胞中溶酶体与共生菌的动态变化, 可能是平端深海偏顶蛤在共生互作中的通过溶酶体主导消化和调控共生菌的直观体现。
王孝程, 2018.深海化能生态系统大型生物营养来源分析及对重金属的富集作用.青岛: 中国科学院大学(中国科学院海洋研究所)博士学位论文, 28-34
|
Arellano S M, Young C M, 2009. Spawning, development, and the duration of larval life in a deep-sea cold-seep mussel. Biological Bulletin, 216(2): 149-162 |
Barry J P, Buck K R, Kochevar R K et al, 2002. Methane-based symbiosis in a mussel, Bathymodiolus platifrons, from cold seeps in Sagami Bay, Japan. Invertebrate Biology, 121(1): 47-54 |
Bettencourt R, Dando P, Rosa D et al, 2008. Changes of gill and hemocyte-related bio-indicators during long term maintenance of the vent mussel Bathymodiolus azoricus held in aquaria at atmospheric pressure. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 150(1): 1-7 |
Castillo M G, Salazar K A, Joffe N R, 2015. The immune response of cephalopods from head to foot. Fish & Shellfish Immunology, 46(1): 145-160 |
Cavanaugh C M, Wirsen C O, Jannasch H W, 1992. Evidence for methylotrophic symbionts in a hydrothermal vent mussel (Bivalvia:Mytilidae) from the Mid-Atlantic Ridge. Applied and Environmental Microbiology, 58(12): 3799-3803 DOI:10.1128/AEM.58.12.3799-3803.1992 |
Colaço A, Bettencourt R, Costa V et al, 2011. LabHorta:a controlled aquarium system for monitoring physiological characteristics of the hydrothermal vent mussel Bathymodiolus azoricus. ICES Journal of Marine Science, 68(2): 349-356 DOI:10.1093/icesjms/fsq120 |
Colaço A, Martins I, Laranjo M et al, 2006. Annual spawning of the hydrothermal vent mussel, Bathymodiolus azoricus, under controlled aquarium, conditions at atmospheric pressure. Journal of Experimental Marine Biology and Ecology, 333(2): 166-171 DOI:10.1016/j.jembe.2005.12.005 |
Company R, Serafim A, Bebianno M J et al, 2004. Effect of cadmium, copper and mercury on antioxidant enzyme activities and lipid peroxidation in the gills of the hydrothermal vent mussel Bathymodiolus azoricus. Marine Environmental Research, 58(2-5): 377-381 DOI:10.1016/j.marenvres.2004.03.083 |
Dunn S R, Schnitzler C E, Weis V M, 2007. Apoptosis and autophagy as mechanisms of dinoflagellate symbiont release during cnidarian bleaching:every which way you lose. Proceedings of the Royal Society B:Biological sciences, 274(1629): 3079-3085 DOI:10.1098/rspb.2007.0711 |
Duperron S, Quiles A, Szafranski K M et al, 2016. Estimating symbiont abundances and gill surface areas in specimens of the hydrothermal vent mussel Bathymodiolus puteoserpentis maintained in pressure vessels. Frontiers in Marine Science, 3: 16 |
Fiala-Médioni A, McKiness Z, Dando P et al, 2002. Ultrastructural, biochemical, and immunological characterization of two populations of the mytilid mussel Bathymodiolus azoricus from the mid-Atlantic ridge:evidence for a dual symbiosis. Marine Biology, 141(6): 1035-1043 DOI:10.1007/s00227-002-0903-9 |
Fiala-Médioni A, Métivier C, Herry A et al, 1986. Ultrastructure of the gill of the hydrothermal-vent mytilid Bathymodiolus sp. Marine Biology, 92(1): 65-72 |
Fisher C R, Brooks J M, Vodenichar J S et al, 1993. The co-occurrence of methanotrophic and chemoautotrophic sulfur-oxidizing bacterial symbionts in a deep-sea mussel. Marine Ecology, 14(4): 277-289 |
Fujiwara Y, Takai K, Uematsu K et al, 2000. Phylogenetic characterization of endosymbionts in three hydrothermal vent mussels:influence on host distributions. Marine Ecology Progress Series, 208: 147-155 |
Geier B K, Sogin E, Michellod D et al, 2019. Spatial metabolomics of in situ, host-microbe interactions. bioRxiv: 555045
|
Goldberg M B, 2001. Actin-based motility of intracellular microbial pathogens. Microbiology and Molecular Biology Reviews, 65(4): 595-626 |
Hohman T C, McNeil P L, Muscatine L, 1982. Phagosome-lysosome fusion inhibited by algal symbionts of Hydra viridis. Journal of Cell Biology, 94(1): 56-63 DOI:10.1083/jcb.94.1.56 |
Jones W J, Won Y J, Maas P A Y et al, 2005. Evolution of habitat use by deep-sea mussels. Marine Biology, 148(4): 841-851 |
Kádár E, Bettencourt R, Costa V et al, 2005. Experimentally induced endosymbiont loss and re-acquirement in the hydrothermal vent bivalve Bathymodiolus azoricus. Journal of Experimental Marine Biology and Ecology, 318(1): 99-110 DOI:10.1016/j.jembe.2004.12.025 |
Kádár E, Davis S A, Lobo-da-Cunha A, 2008. Cytoenzymatic investigation of intracellular digestion in the symbiont-bearing hydrothermal bivalve Bathymodiolus azoricus. Marine biology, 153(5): 995-1004 DOI:10.1007/s00227-007-0872-0 |
Kim K J, Na Y E, Jeon K W, 1994. Bacterial endosymbiont- derived lipopolysaccharides and a protein on symbiosome membranes in newly infected amoebae and their roles in lysosome-symbiosome fusion. Infection and Immunity, 62(1): 65-71 DOI:10.1128/IAI.62.1.65-71.1994 |
Nelson D C, Hagen K D, Edwards D B, 1995. The gill symbiont of the hydrothermal vent mussel Bathymodiolus thermophilus is a psychrophilic, chemoautotrophic, sulfur bacterium. Marine Biology, 121(3): 487-495 |
Nishikori K, Morioka K, Kubo T et al, 2009. Age- and morph-dependent activation of the lysosomal system and Buchnera degradation in aphid endosymbiosis. Journal of Insect Physiology, 55(4): 351-357 DOI:10.1016/j.jinsphys.2009.01.001 |
Settembre C, Fraldi A, Medina D L et al, 2013. Signals from the lysosome:a control centre for cellular clearance and energy metabolism. Nature Reviews Molecular Cell Biology, 14(5): 283-296 |
Simonet P, Gaget K, Balmand S et al, 2018. Bacteriocyte cell death in the pea aphid/Buchnera symbiotic system. Proceedings of the National Academy of Sciences of the United States of America, 115(8): E1819-E1828 DOI:10.1073/pnas.1720237115 |
Smith K L, 1985. Deep-sea hydrothermal vent mussels:nutritional state and distribution at the Galapagos Rift. Ecology, 66(3): 1067-1080 |
Southward E C, 2008. The morphology of bacterial symbioses in the gills of mussels of the genera Adipicola and Idas (Bivalvia:Mytilidae). Journal of Shellfish Research, 27(1): 139-146 DOI:10.2983/0730-8000(2008)27[139:TMOBSI]2.0.CO;2 |
Sun Y, Wang M X, Li L L et al, 2017a. Molecular identification of methane monooxygenase and quantitative analysis of methanotrophic endosymbionts under laboratory maintenance in Bathymodiolus platifrons from the South China Sea. Peer J, 5: e3565
|
Sun J, Zhang Y, Xu T et al, 2017b. Adaptation to deep-sea chemosynthetic environments as revealed by mussel genomes. Nature Ecology & Evolution, 1(5): 121Trench R K, 1971. The physiology and biochemistry of zooxanthellae symbiotic with marine coelenterates I. The assimilation of photosynthetic products of zooxanthellae by two marine coelenterates. Proceedings of the Royal Society B: Biological Sciences, 177(1047): 225-235
|
Turner R D, Lutz R, 1984. Growth and distribution of mollusks at deep-sea vents and seeps. Oceanus, 27(3): 55-62 |
Wang X C, Li C L, Zhou L, 2017. Metal concentrations in the mussel Bathymodiolus platifrons from a cold seep in the South China Sea. Deep Sea Research Part I:Oceanographic Research Papers, 129: 80-88 DOI:10.1016/j.dsr.2017.10.004 |
Xu T, Sun J, Watanabe H K et al, 2018. Population genetic structure of the deep-sea mussel Bathymodiolus platifrons (Bivalvia:Mytilidae) in the Northwest Pacific. Evolutionary Applications, 11(10): 1915-1930 DOI:10.1111/eva.12696 |
Yu J J, Wang M X, Liu B Z et al, 2018. Gill symbionts of the cold-seep mussel Bathymodiolus platifrons:Composition, environmental dependency and immune control. Fish & Shellfish Immunology, 86: 246-252 |
Zheng P, Wang M X, Li C L et al, 2017. Insights into deep-sea adaptations and host-symbiont interactions:A comparative transcriptome study on Bathymodiolus mussels and their coastal relatives. Molecular Ecology, 26(19): 5133-5148 DOI:10.1111/mec.14160 |
Zhou L, Cao L, Wang X C et al, 2020. Metal adaptation strategies of deep-sea Bathymodiolus mussels from a cold seep and three hydrothermal vents in the West Pacific. Science of the Total Environment, 707: 136046 DOI:10.1016/j.scitotenv.2019.136046 |
 2020, Vol. 51
2020, Vol. 51


