中国海洋湖沼学会主办。
文章信息
- 陶振铖, 王延清, 金鑫, 李超伦. 2020.
- TAO Zhen-Cheng, WANG Yan-Qing, JIN Xin, LI Chao-Lun. 2020.
- 2014年冬季西太平洋雅浦海山与大洋海域大型浮游动物群落比较研究
- COMPARATIVE STUDIES OF MACROZOOPLANKTON COMMUNITIES IN THE WESTERN PACIFIC OCEAN AND YAP SEAMOUNT AREA IN WINTER 2014
- 海洋与湖沼, 51(4): 919-930
- Oceanologia et Limnologia Sinica, 51(4): 919-930.
- http://dx.doi.org/10.11693/hyhz20200100025
文章历史
-
收稿日期:2020-01-19
收修改稿日期:2020-04-15
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院海洋研究所 工程技术部 青岛 266071;
4. 中国科学院海洋研究所 深海极端环境与生命研究中心 青岛 266071;
5. 中国科学院海洋大科学研究中心 青岛 266071;
6. 中国科学院大学 北京 100049
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Engineering Technology Department, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
4. Center of Deep Sea Research, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
6. University of Chinese Academy of Sciences, Beijing 100049, China
作为海洋学研究的重点海域, 西太平洋海域被认为是全球海洋生物种源中心, 许多海洋生物类群的最高物种多样性都出现于该海域(林茂等, 2011), 并且该海域的浮游动物丰度、分布、群落结构等与海流、温度、溶解氧等环境因子都密切相关(Tittensor et al, 2010;代鲁平等, 2014;李学刚等, 2017)。海山一般是指深海大洋中位于水面以下且高度大于1000m的隆起地形(Menard, 1964; Epp et al, 1989; Rogers, 2018)。全球大洋中分布着超过15万座海山, 海山被认为是“地球上人类最不了解的生物栖息地”之一, 作为深海大洋中独特的生境, 海山有着特定的地理学特征和水文条件, 影响着周边栖息的海洋生物, 也使其成为海洋生物多样性研究的热点地区(Yesson et al, 2011;汪品先, 2013; Rogers, 2018)。
浮游动物是海洋中生物量最大的生物类群, 在海洋食物链中处于承上启下的中枢地位, 它们摄食浮游植物, 自身又是鱼类等高级摄食者的饵料, 它们还是海洋生物泵的主要组成部分, 在海洋食物网和全球生物地球化学循环中起着至关重要的关键作用(Beaugrand et al, 2003, 2010; Ware et al, 2005; Behrenfeld et al, 2006; Turner, 2015)。浮游动物群落结构、种群组成和数量的变化, 反映着整个生态系统的动态, 尤其是浮游动物的关键种和功能群又起着控制生态系统全局的作用(Sun et al, 2010)。根据个体大小一般将浮游动物划分为微型、小型、中型、大型和巨型五类(Dussart, 1965;郑重等, 1984; Harris, 2000)。Ware等(2005)认为大型浮游动物是许多幼鱼和成年经济鱼类的重要食物。Sun等(2010)将黄海生态系统中的浮游动物分为6个功能群, 其中大型磷虾类等大型甲壳类浮游动物是浮游动物的主要贡献者, 可占到总生物量的73%。关于大型浮游动物的生态作用和地位, 早期研究主要集中在数量多且体格强壮的大型桡足类等甲壳类动物, 而对体形更大的磷虾类、端足类等则研究相对较少。近些年, 关于海山区大型底栖生物和生源要素方面的研究取得了较多进展(Yesson et al, 2011; Stocks et al, 2012;张均龙等, 2013), 但针对海山区浮游生物方面的研究尚少(张武昌等, 2014)。本文的研究对象是体长超过2mm的大型浮游动物, 主要包括磷虾类、端足类、十足类、被囊类、多毛类、头足类、小型水母和仔稚鱼等, 通过分析2014年冬季大型浮游动物在西太平洋雅浦海山区和大洋海域的物种组成、丰度和分布, 比较两个海域浮游动物群落的差异, 进而分析海山对浮游动物群落的影响, 以期为系统研究西太平洋海洋生态系统提供支持。
1 材料与方法 1.1 调查时间、海域及站位设置2014年12月3日—2015年1月7日, 搭乘“科学”号海洋科学综合考察船从山东青岛出发对西太平洋雅浦海山区进行了综合调查。在位于热带西太平洋暖池区, 邻近雅浦岛弧和海沟的Y3海山设计两条走向分别为西北—东南和东北—西南的调查断面, 共计15个调查站位, 其中Y3-0站水深最浅(295m), 位于海山山顶位置, 是两条断面的交汇站位; 返程途中设计一条从西太平洋暖池区到黑潮源区的横跨北赤道流区的大洋生态大断面, 共计进行了9个定点站位的综合调查, 具体调查海域及调查站位见图 1。
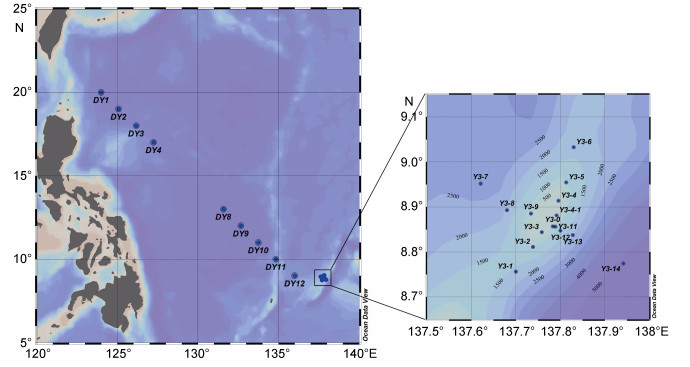 |
| 图 1 西太平洋Y3海山区与大洋海域调查站位图 Fig. 1 Sampling stations in the western Pacific Ocean and seamount Y3 area |
调查站位的温度、盐度和叶绿素荧光等环境参数的测定获取, 以及不同水层海水的采集均由CTD(SBE-911 plus, SEA-BIRD ELECTRONICS INC., USA)现场完成。用于测定叶绿素a浓度的海水水样采自表层、30、75、100、150和200m。水样采集后, 将2000mL水样过滤到Whatman GF/F滤膜(0.70μm)上, 然后立即保存在–20℃冰箱内。叶绿素的测定先经90%丙酮溶液在≤4℃条件下萃取24h, 然后用Turner Designs荧光计测定叶绿素a浓度(Parsons et al, 1984;张文静等, 2016)。根据Satapoomin等(2004)的方法, 将各水层的叶绿素a浓度进行梯形积分, 得出每个站位的叶绿素a浓度。
浮游动物样品的采集和室内处理均根据《GB/T12763.6-2007海洋调查规范》完成。采样期间, 船舶排放等非自然因素影响轻微, 不影响样品和数据的可靠性。考察过程中无特殊垃圾物质产生, 具有较高的安全性和环保性。调查中采集大型浮游动物的网具为标准浮游动物大网(网口直径80cm, 网目孔径0.50mm)。取样时由水深200m垂直拖曳至表层, 浮游动物网口悬挂数字流量计(HYDROBIOS, GERMANY)以测量采样滤水体积。样品用5%的中性甲醛溶液(最终浓度)固定保存。将同步采集的另一个标准浮游动物大网样品一次性通过2000、1000和500μm分样筛, 进行分级过滤, 然后将每个粒级的浮游动物分别过滤到已称重的Whatman GF/C(直径47mm, 孔径2μm)滤膜上, 滤膜放入离心管内, 保存于–20℃冰箱内。由于恶劣天气等现场调查中不可预见的原因, 海山区Y3-5站的分级生物量未能完成。整个调查航次结束后, 回到实验室内, 甲醛固定样品在体视显微镜(Nikon SMZ745, JAPAN)下进行全样鉴定和计数; 浮游动物分级生物量样品置于通风干燥箱, 在60℃下通风干燥48h以上至恒重, 然后称量计算每个粒级浮游动物的干重生物量。本研究所涉及的浮游动物丰度单位为ind/m3, 生物量单位为mg/m3。
1.3 数据统计分析对调查海域的大型浮游动物群落结构的香农-威纳多样性指数(Shannon-wiener index, H′)、Pielou均匀度指数(Evenness index, J′)、各物种/类群的优势度指数(Y)和Sørensen相似性系数(Coefficient of similarity, Sc)进行计算分析。多样性指数利用公式H′=–SUM(Pi×ln(Pi))计算, 均匀度指数利用公式J′ = H′/ln(S)计算, 优势度指数利用公式Y=ni/N×fi计算, 群落相似度系数利用公式Sc=2C/(A+B)×100%计算(Sørensen, 1948)。上述公式中的ni为第i种在所有站位出现的丰度, N为所有站位出现的总丰度, fi为第i种在所有站位出现的频率, S为调查海域采集到的所有物种总数, A为海山区物种数, B为大洋海域物种数, C为两个海域共有物种数, Pi=ni/N。当Y > 0.02时, 将该物种/类群作为该海域的优势种/类群(徐兆礼等, 1989)。
调查海域的温度、盐度、叶绿素a浓度和浮游动物分布图均采用Ocean Data View软件完成。利用IBM SPSS Statistics 20和PAST软件对浮游动物丰度与环境因子(温度、盐度和叶绿素a浓度)进行Pearson相关性分析和主成分分析(Principal Component Analysis, PCA)。
2 结果 2.1 海山区和大洋海域的环境参数分布特征2014年冬季, 西太平洋雅浦Y3海山区和大洋海域0—200m水层的表层温度、200m层温度、表层盐度、200m层盐度、平均温度、平均盐度和叶绿素a浓度的水平分布情况见图 2。调查海域的温度、盐度及叶绿素a浓度的垂直分布情况见张文静等(2016)。
 |
| 图 2 2014年冬季西太平洋Y3海山区与大洋海域温度(℃)、盐度和叶绿素a浓度(mg/m3)的水平分布 Fig. 2 Horizontal distribution of seawater temperature (℃), salinity and chlorophyll a concentration (mg/m3) of the western Pacific Ocean and seamount Y3 area in winter 2014 注: a:表层温度(海山); b: 200m层温度(海山); c:平均温度(海山); d:表层盐度(海山); e: 200m层盐度(海山); f:平均盐度(海山); g:表层温度(大洋); h: 200m层温度(大洋); i:平均温度(大洋); j:表层盐度(大洋); k: 200m层盐度(大洋); l:平均盐度(大洋); m:叶绿素a浓度(海山); n:叶绿素a浓度(大洋) |
海山区调查海域的表层温度范围为28.95—29.27℃, 200m层温度为11.32—13.50℃, 表层盐度和200m层盐度范围分别为33.70—33.99和34.46—34.58。受海山地形影响, 海山区的海水表层温度和200m层温度均呈现山顶高、周边低的趋势; 而海水表层盐度和200m层盐度的分布趋势则不尽相同, 表层盐度从海山西北侧向东南侧逐渐升高趋势, 200m层盐度的分布则是南高北低。整个海山区调查海域0—200m的平均温度和平均盐度均是在海山西南部海域较低。海山区0—200m整个水柱的叶绿素a浓度呈现海山东西两侧高, 山顶和南北两侧低的分布趋势, 叶绿素a浓度范围为0.032—0.086mg/m3, 最高值出现在海山区最西面的Y3-7站, 整个海山区的平均叶绿素a浓度为0.054mg/m3。大洋调查海域的表层温度为24.54—29.14℃, 呈现南高北低的趋势, 200m层温度、表层盐度和200m层盐度的分布趋势与表层温度正好相反, 总体上均呈南低北高的趋势, 范围分别为12.86—20.62℃、33.81—34.83和34.43—34.92, 且表层盐度的变化幅度要大于200m层盐度。大洋海域靠近海山区的站位150m以下有明显的底层冷水入侵现象, 但是, 从每个大洋站位0—200m水柱的平均温度和平均盐度图可以看出, 平均温度和平均盐度的高值都出现在大洋调查断面的中间站位海域。大洋调查海域的叶绿素a浓度范围为0.031—0.070mg/m3, 叶绿素a最高值出现在DY10站, 整个大洋调查断面的平均叶绿素a浓度为0.048mg/m3。
比较两个海域的温度、盐度和叶绿素a浓度可以发现, 海山区的叶绿素a浓度要略高于大洋海域, 然而, 两个海域的海水温度和盐度差异较大。虽然, 海山区的表层水温要高于大洋调查海域, 但是, 受海山区地形和雅浦海沟深层低温高盐水的影响, 海山区200m层水温和平均温度均低于大洋海域, 而200m层盐度则要高于大洋海域。
2.2 海山区和大洋海域大型浮游动物群落物种组成2014年冬季, 利用标准浮游动物大网在西太平洋雅浦Y3海山区和大洋海域采集到磷虾类、端足类、十足类、被囊类、多毛类、头足类、小型水母和仔稚鱼等大型浮游动物共计25种/类群(表 1), 其中磷虾类9种/类, 占种类组成的36.0%, 端足类7种, 占种类组成的28.0%, 十足类2种。海山区和大洋区均采集到19个物种/类群, 两个海域的共有物种/类群共计13个, 分别是磷虾的各期幼体、尖额磷虾、弯臂磷虾、手磷虾、蛮𧊕、路𧊕、莹虾、樱虾、被囊类、仔稚鱼和小型水母等。两个海域的大型浮游动物群落物种组成存在差异, 群落相似度系数为68.4%。海山区的大型浮游动物优势种/类群依次为磷虾早期幼体、磷虾中期幼体(F1—F3)、磷虾后期幼体(F4—未成体)、尖额磷虾和蛮𧊕, 优势度分别是0.266、0.212、0.212、0.025和0.023;大洋海域的大型浮游动物优势种/类群依次为磷虾后期幼体、手磷虾、蛮𧊕、尖额磷虾和莹虾, 优势度分别是0.411、0.077、0.067、0.064和0.056。海山区大型浮游动物的物种多样性指数和均匀度指数分别是为1.934和0.657, 大洋海域的物种多样性指数和均匀度指数都高于海山区, 分别为2.032和0.690。
| 物种/类群的中文名 | 物种/类群的拉丁名/英文名 | 海山区 | 大洋海域 |
| 磷虾类 | |||
| 尖额磷虾 | Euphausia diomedeae | + + | + + |
| 弯臂磷虾 | Nematobrachion flexipes | + | + |
| 线脚磷虾 | Nematoscelis sp. | - | + |
| 手磷虾 | Stylocheiron sp. | + | + + |
| 有刺樱磷虾 | Thysanopoda aequalis | + | - |
| 三刺樱磷虾 | Thysanopoda tricuspidata | + | - |
| 磷虾早期幼体 | Euphausiid early lavae | + + | + |
| 磷虾中期幼体(F1—F3) | Euphausiid furcila 1—3 | + + | + |
| 磷虾后期幼体(F4—未成体) | Euphausiid furcila 4—6 and juvenile | + + | + + |
| 端足类 | |||
| 窄头𧊕 | Leptocotis sp. | + | - |
| 蛮𧊕 | Lestrigonus spp. | + + | + + |
| 慎𧊕 | Paraphronima spp. | - | + |
| 岷岛司氏𧊕 | Streetsia mindanaonis | - | + |
| 法𧊕 | Themisto sp. | - | + |
| 路𧊕 | Vibilia sp. | + | + |
| 钩虾 | Gammaridea | - | + |
| 十足类 | |||
| 莹虾 | Lucifer spp. | + | + + |
| 樱虾 | Sergestes sp. | + | + |
| 其他类群及幼虫 | |||
| 阿利玛幼虫 | Alima larva | - | + |
| 短尾类幼虫 | Brachyura larva | + | - |
| 多毛类 | Polychaeta | + | - |
| 被囊类 | Tunicate | + | + |
| 头足类 | Cephalopoda | + | - |
| 仔稚鱼 | Fish lava | + | + |
| 小型水母 | Small jellyfish | + | + |
| 注: -:未采集到该物种/类群; +:采集到该物种, 但不是优势种/类群; + +:采集到该物种, 且为优势种/类群 | |||
2014年冬季, 在西太平洋雅浦Y3海山区采集到的大型浮游动物的平均丰度为0.65ind/m3, 最大丰度(1.64ind/m3)出现在海山最北面的Y3-6站; 大型浮游动物在大洋海域的平均丰度为0.61ind/m3, 最大丰度(1.28ind/m3)出现在DY断面最南端的DY12站(图 3)。海山区五个优势物种/类群的丰度总和占到海山区总丰度的86.6%, 大洋海域五个优势物种/类群的丰度总和占到大洋海域总丰度的78.1%。
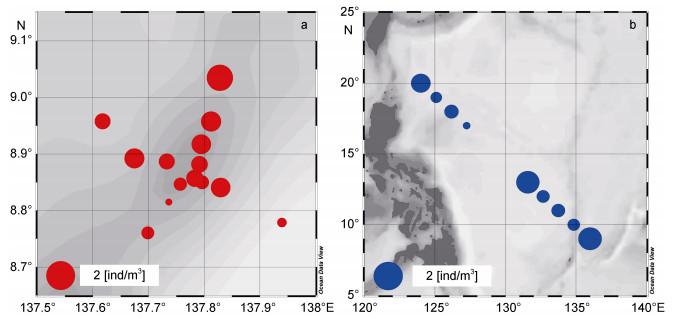 |
| 图 3 西太平洋Y3海山区(a)和大洋海域(b)大型浮游动物总丰度(ind/m3)的水平分布 Fig. 3 Horizontal distribution of macrozooplankton abundances (ind/m3) in the western Pacific Ocean and seamount Y3 area |
在分级生物量方面, 雅浦Y3海山区14个站位的浮游动物大网平均生物量为0.86mg/m3, 最大生物量(1.92mg/m3)出现在海山区最西面的Y3-7站; 其中体长在2mm以上的大型浮游动物生物量平均值为0.28mg/m3, 最大值(0.57mg/m3)同样出现在Y3-7站。在整个海山区所有调查站位中, 大型浮游动物生物量在浮游动物总生物量中的平均占比为34.25%。在西太平洋大洋海域的9个站位中, 浮游动物大网平均生物量为1.10mg/m3, 最大生物量(2.61mg/m3)出现在DY3站; 其中体长在2mm以上的大型浮游动物生物量平均值为0.52mg/m3, 最大值(1.76mg/m3)同样出现在DY3站; 大洋海域大型浮游动物生物量在浮游动物总生物量中的平均占比为42.53%(图 4)。
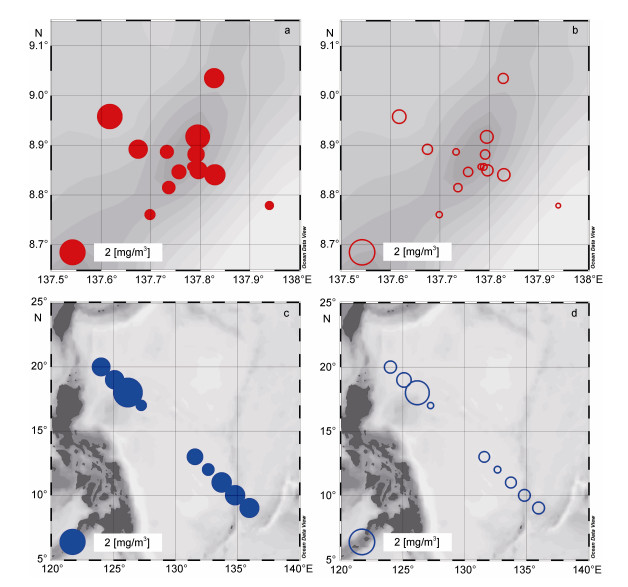 |
| 图 4 西太平洋Y3海山区和大洋海域浮游动物生物量(mg/m3)的水平分布 Fig. 4 Horizontal distribution of zooplankton biomass (mg/m3) in the western Pacific Ocean and seamount Y3 area 注: a:大网浮游动物总生物量(海山); b:大型浮游动物生物量(海山); c:大网浮游动物总生物量(大洋); d:大型浮游动物生物量(大洋) |
虽然, 雅浦Y3海山区的大型浮游动物群落在丰度和生物量都要高于西太平洋大洋海域, 但是, 大洋海域的大型浮游动物生物多样性指数、均匀度指数和生物量占比都要高于海山区。
2.4 海山区和大洋海域大型浮游动物主要优势种/类群的丰度和分布海山区和大洋海域的大型浮游动物优势种/类群不尽相同, 两个海域共有的优势物种/类群是磷虾后期幼体、尖额磷虾和蛮𧊕。海山区和大洋海域主要大型浮游动物优势种的丰度和分布情况见图 5。
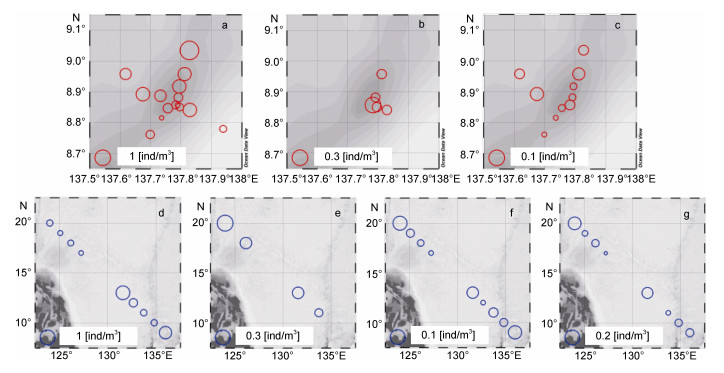 |
| 图 5 西太平洋Y3海山区和大洋海域大型浮游动物主要优势种/类群丰度(ind/m3)的水平分布 Fig. 5 Horizontal distribution of dominant macrozooplankton species/groups abundances (ind/m3) in the western Pacific Ocean and seamount Y3 area 注: a:磷虾幼体总和(海山); b:尖额磷虾(海山); c:蛮𧊕(海山); d:磷虾后期幼体(大洋); e:尖额磷虾(大洋); f:蛮𧊕(大洋); g:手磷虾(大洋) |
磷虾后期幼体作为两个海域共有的优势类群, 在海山区的平均丰度和最大丰度分别为0.16和0.68ind/m3, 主要分布在海山区的山顶及北侧海域; 在大洋海域, 磷虾后期幼体的平均丰度和最大丰度分别为0.25和0.85ind/m3, 高丰度磷虾后期幼体主要分布在南部海域及邻近海山区海域。尖额磷虾作为海山区的主要磷虾优势种主要分布在海山区的东侧水深小于1800m的Y3-0、Y3-4-1、Y3-5、Y3-12和Y3-13等五个站位, 最大丰度(0.30ind/m3)出现在山顶的Y3-0站。在大洋海域, 尖额磷虾分布较为分散, 只在DY1、DY3、DY8和DY10等四个站位采集到, 最大丰度为0.34ind/m3, 出现在大洋调查海域最北面距离陆地最近的DY1站。蛮𧊕在海山区的分布情况则跟尖额磷虾形成了互补, 主要分布在海山山顶及其西侧海域, 东侧海域未采集到, 其在海山区的平均丰度和最大丰度分别为0.02和0.07ind/m3, 最大丰度出现在海山西侧的Y3-8站(水深2174m)。在大洋海域的9个站位中均采集到蛮𧊕, 平均丰度和最大丰度分别为0.04和0.09ind/m3, 最大丰度的分布情况跟尖额磷虾类似, 同样出现在DY1站。手磷虾是大洋海域的第二优势种, 也是大洋区独有的优势种, 除DY9站外, 其他8个站都有采集到, 平均丰度为0.05ind/m3, 最大丰度为0.15ind/m3, 也出现在DY1站。
2.5 海山区和大洋海域大型浮游动物分布与环境因子的关系通过对大型浮游动物丰度与环境因子(温度、盐度和叶绿素a浓度)的相关性分析可以看出, 2014年冬季雅浦Y3海山区的大型浮游动物总丰度仅与200m层盐度存在显著的负相关关系(P < 0.05, n=15), 与表层温度、表层盐度、200m层温度和叶绿素a浓度等环境因子均不存在显著的相关关系; 磷虾各期幼体的总丰度亦与200m层盐度存在显著的负相关关系(P < 0.05, n=15);蛮𧊕的丰度与表层盐度和200m层盐度均呈极显著的负相关关系(P < 0.01, n=15)。在大洋海域各参数的相关性分析方面, 只发现大型浮游动物总丰度与平均温度存在极显著的负相关关系(P < 0.01, n=9)。
鉴于海山区主要优势种/类群丰度总和在大型浮游动物中占比超过了80%, 将海山区大型浮游动物群落五个优势种/类群的丰度及主要环境因子进行主成分分析(图 6a)。结果表明, 前4个主成分的初始特征值的累积方差占到12个成分(磷虾早期幼体、中期幼体、后期幼体、尖额磷虾、蛮𧊕、表层温度、200m层温度、表层盐度、200m层盐度、平均温度、平均盐度和叶绿素a浓度)解释的总方差的75.5%。在第一主成分矩阵中, 200m层盐度的主成分载荷(绝对值)最高(–0.891), 尖额磷虾的主成分载荷(绝对值)最低(–0.121), 其他成分的载荷分别是表层盐度为–0.839、表层温度为0.633、平均温度为–0.413、平均盐度为0.350、200m层温度为–0.167、叶绿素a浓度为–0.258, 第二、三和四主成分矩阵中主成分载荷(绝对值)最高的依次为平均盐度(0.745)、200m层温度(0.906)和表层温度(–0.580)。此外, 海山区的表层温度与表层盐度呈极显著的负相关关系(P < 0.01, n=15), 表层盐度与200m层盐度呈极显著的正相关关系(P < 0.01, n=15)。
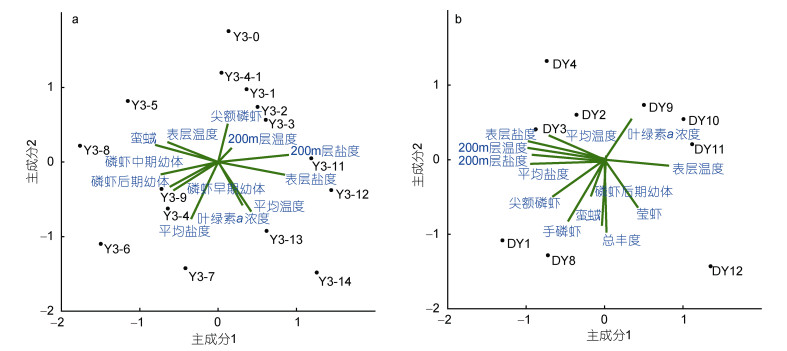 |
| 图 6 西太平洋Y3海山区(a)和大洋海域(b)大型浮游动物优势种/类群丰度及主要环境因子的主成分分析图 Fig. 6 PCA scatter diagrams of macrozooplankton species/groups abundances and environmental factors in the western Pacific Ocean and seamount Y3 area |
大洋海域的主成分分析结果表明, 前3个主成分的初始特征值的累积方差占到12个成分(磷虾后期幼体、手磷虾、蛮𧊕、尖额磷虾、莹虾、表层温度、200m层温度、表层盐度、200m层盐度、平均温度、平均盐度和叶绿素a浓度)解释的总方差的86.5%。在第一主成分矩阵中, 200m层温度的主成分载荷(绝对值)最高(0.965), 蛮𧊕的主成分载荷(绝对值)最低(0.044), 表层盐度、平均盐度、200m层盐度、表层温度、平均温度和叶绿素a浓度的载荷分别为0.962、0.936、0.911、–0.809、0.698和–0.341(图 6b)。大洋海域的平均温度与平均盐度呈显著的正相关关系(P < 0.05, n=9), 表层温度与200m层温度、表层盐度、200m层盐度都呈极显著的负相关关系(P < 0.01, n=9)。
3 讨论 3.1 两个海域大型浮游动物群落生物多样性对比鉴于海山的特殊地形、水文特征和特有的“泰勒柱”现象造就了“海山效应”, 使其具有较高的生物量、生物多样性和物种独特性(Kvile et al, 2014)。海山还被认为是研究物理和生物过程相互作用造成物种隔离、分化和扩散的天然实验室(Shank, 2010)。虽然, 从2005年以来, 国际海洋生物普查计划针对全球海山已获得了大量新发现和研究成果, 但是到目前为止已被详细调查研究过的海山数量仍然不足300个, 且其中只有7座海山的浮游动物被详尽调查研究过(Stocks et al, 2012;张武昌等; 2014)。Denda等(2014)通过调查研究发现, 东北大西洋的两座海山的浮游动物生物量存在较大差异, 他们认为造成这种差异的主要原因是控制生产力状况的大规模水文特征, 而不是海山效应。通过本研究发现, 2014年冬季西太平洋雅浦Y3海山区和大洋海域大型浮游动物群落的物种相似度为68.4%, 且海山区的大型浮游动物丰度要高于大洋海域, 但是, 海山区的大型浮游动物的生物多样性指数和物种均匀度指数却都低于大洋海域(表 2), 在大型浮游动物群落组成结构方面, 并没有发现显著的“海山效应”。两个海域的多样性与丰度比较结果相反的现象主要是由两方面造成的, 首先是浮游动物群落组成结构的差异, 其次, 可能与两个调查海域范围的差异有关, 毕竟海山区调查海域相对于大洋海域要小很多。
尽管海山区的叶绿素a浓度没有明显高于大洋海域(张文静等, 2016), 但是, 由于Y3海山区的营养盐等生源要素要高于大洋调查海域(马骏等, 2020), 较高的营养盐能够促进初级生产, 进而提高微型和小型浮游动物的丰度和生物量, 故而在优势种方面, 磷虾类的早期和中期幼体在海山区成为优势类群, 而在大洋海域却只有磷虾类后期幼体成为优势类群(表 2)。这也就造就了海山区浮游动物群落中的中小型浮游动物占比要高于大洋海域, 因而, 海山区大型浮游动物在浮游动物群落生物量中的占比要低于大洋海域。
| 雅浦Y3海山区 | 大洋海域 | |
| 最大丰度(ind/m3) | 1.64 | 1.28 |
| 平均丰度(ind/m3) | 0.65 | 0.61 |
| 最大生物量(mg/m3) | 0.57 | 1.76 |
| 平均生物量(mg/m3) | 0.28 | 0.52 |
| 占总生物量的百分比 | 34.25% | 42.53% |
| 物种数 | 19 | 19 |
| 多样性 | 1.934 | 2.032 |
| 均匀度 | 0.657 | 0.690 |
| 优势种/类群 | 磷虾早期幼体、磷虾中期幼体、磷虾后期幼体、尖额磷虾和蛮𧊕 | 磷虾后期幼体、手磷虾、蛮𧊕、尖额磷虾和莹虾 |
| 注:加粗字体表示两个海域的共有优势种/类群 | ||
经典观点认为, 海山周围的上升流和泰勒柱会将底层的营养物质带到上层海域, 从而提高表层的初级生产力, 进而促进浮游生物和高营养级生物的丰度和生物量。例如, Papiol等(2019)通过对加那利群岛东部三个海山区浮游动物的调查研究发现, 浮游动物总生物量和主要类群的最高值都出现在水深小于200m的海山山顶海域, 他们认为升高的叶绿素和溶解氧浓度增强了浮游动物的聚集。但是, 也有大量研究发现, 海山海域浮游动物的数量明显减少(Dower et al, 1996; Martin et al, 2009), 这种现象大多被认为是由于浮游动物的昼夜迁移行为受到海山地形影响, 而被海山海域的捕食者摄食造成的。同样地, 这种捕食效应可能会改变浮游动物的群落组成, 但往往不会显著降低其丰度或生物量(Haury et al, 2000; Genin et al, 2007)。Denda等(2011)对地中海的Rhodes海盆和Anaximenes海山的浮游动物物种组成、生物量、丰度和稳定同位素特征进行了研究分析, 研究发现两个海域的浮游动物的生物量和丰度都较低, 但浮游动物现存量在海盆开放海域要高于海山海域; 另外, 稳定同位素特征表明两个调查海域在食物网结构上不存在显著差异。
2014年冬季调查的Y3海山区的水深均超过了200m, 山顶最浅海域的水深为295m, 本次调查大型浮游动物网的采样水深均为200m, 因而, 海山地形对大型浮游动物的采样效率影响不大。虽然, 大型浮游动物的最大丰度出现在海山北面的Y3-6站, 但是, 大型浮游动物的最大生物量却出现在海山区最西面的Y3-7站, 这说明Y3-6站的大型浮游动物群落物种组成中含水量较多的种类(例如胶质类生物)要多于Y3-7站, 因而, 海山地形对浮游动物群落结构还是造成了一定影响。从海山区大型浮游动物总丰度和生物量分布图上可以看出, 海山区山顶以北海域的丰度和生物量要高于山顶以南海域, 这与海山区中上层的海流走向密切相关。Y3海山区0—200m的上层海域主要受流速较强的北赤道流(North Equatorial Current)影响, 该海流的流向为由东向西, 流速可达200mm/s (Toole et al, 1988; Hu et al, 2015), 海流遇到海山地形会形成上升流, 并导致海山顶部洋流增强(Eriksen, 1991;马骏等, 2020), 或将在海山背流面形成浮游动物的聚集。在优势种/类群分布方面, 磷虾幼体和蛮𧊕的分布基本重叠, 主要分布在海山山顶以西海域, 但是成体磷虾的分布则跟磷虾幼体分布正好互补, 尖额磷虾主要分布在山顶的东南部海域, 这种分布格局更利于磷虾种群的生长和繁殖。
3.3 海山区和大洋海域大型浮游动物丰度分布与环境因子相关性的差异分析海山区的浮游动物群落能够在很大程度上反映由水团、中尺度和季节过程决定的周围海洋的群落组成(Valle-Levinson et al, 2004; Hosia et al, 2008; Carmo et al, 2013)。雅浦Y3海山区叶绿素a浓度最大层较浅(75—100m), 且未发现叶绿素a浓度比周围海区明显升高的现象(张文静等, 2016), 通过微型浮游动物数据(王超锋等, 2016), 均未在Y3海山发现泰勒柱和海山效应。此外, 王珍岩等(2017)认为可能是海山隆起的缘故, 导致了Y3海山上方水深60—120m处的温度和叶绿素等值线出现很大的波动。通过主成分分析可以看出, 海山区的首要影响环境因子是盐度, 而大洋海域则是温度, 这也使得海山区和大洋海域的大型浮游动物的总丰度分别与200m层盐度和平均温度呈负相关关系。海山区和大洋海域大型浮游动物群落组成结构的差异造成了二者主要影响环境因子的不同。Y3海山区的盐度在从表层到200m层呈先升后降的趋势, 且在50—125m的水层出现高盐区, 真光层下部的盐度高于上部(马骏等, 2020), 200m层盐度则在海山水平分布上呈现南高北低的趋势, 大型浮游动物群落在海山西北部的丰度要高于迎流面的东南部, 主要是由于海山隆起导致底层高盐度的海水向上层移动, 这也证实了Y3海山能够影响环境因子分布, 同时也影响了大型浮游动物群落的分布。大洋海域在0—200m温度的垂向分布上, 相对于海山海域等温线变化较缓, 整条大洋调查断面从北往南等温线逐步抬升(张文静等, 2014), 鉴于浮游动物在高纬度低温海域个体更大、能够储备更多物质能量的现象, 因而大型浮游动物在大洋海域更偏爱于稳定的较低温度环境。
Cartes等(2014)通过对东北大西洋Galicia Bank海山区的十足类大型浮游动物的调查研究发现, 十足类浮游动物的丰度分布与叶绿素a浓度相关性不显著。Denda等(2017)对东太平洋两座浅海山及其邻近海域的浮游动物和小型游泳生物进行了调查研究, 他们通过稳定同位素的方法证实了这两座海山对浮游动物群落营养结构影响较弱, 这个结果也支持了海山浮游动物群落很大程度上依赖于海洋水平洋流食物来源。本研究也得类似的分析结果, 2014年冬季Y3海山区大型浮游动物丰度与叶绿素a浓度不存在显著的相关关系。但是, 结合王超锋等(2016)的纤毛虫数据, Y3海山区的磷虾早期幼体丰度与纤毛虫丰度存在显著的正相关关系(P < 0.05, n=15), 这也在一定程度上说明了海山区大型浮游动物的食物来源具有多样性。
4 结论西太平洋雅浦Y3海山区和大洋海域的大型浮游动物群落存在一定差异, 两个海域的群落相似度系数为68.4%。海山区的大型浮游动物丰度要高于大洋海域, 但生物多样性指数、均匀度指数和生物量占比都要低于大洋海域。通过比较两个海域的大型浮游动物群落, 并未在Y3海山区发现明显的海山效应。对于大型浮游动物群落而言, 海山区和大洋海域首要环境因子分别是盐度和温度。两个海域的大型浮游动物丰度和生物量分布与叶绿素a浓度都不存在显著的相关关系。海山区和大洋海域的大型浮游动物丰度分别与200m层盐度和平均温度呈显著的负相关关系。目前, 针对海山区浮游动物方面的研究还太少, 还需要更多海山调查数据进行进一步的验证。此外, 浮游动物群落结构、物种组成、季节变化和空间分布模式的长期变化, 也已成为大洋生态系统研究的重点。
致谢 本研究中的CTD数据由中国科学院海洋研究所海洋专项办公室提供, 叶绿素数据由孙晓霞和郑珊老师提供, 微型浮游动物纤毛虫数据由张武昌老师和王超锋博士提供, “科学号”考察船的全体工作人员对海上调查和现场采样提供了支持和帮助, 谨致谢忱。
马骏, 宋金明, 李学刚等, 2020.西太平洋Y3海山对营养盐的影响及其生态环境效应.地学前缘: 1-11. https://doi.org/10.13745/j.esf.sf.2019.8.16
|
王珍岩, 张洪格, 高微. 2017. 冬季西太平洋雅浦海山(Y3)区次表层叶绿素最大值层分布及其对悬浮体粒度的影响. 海洋与湖沼, 48(6): 1404-1414 |
王超锋, 赵丽, 赵苑, 等. 2016. 热带西太平洋浮游纤毛虫的垂直分布. 海洋与湖沼, 47(2): 429-437 |
代鲁平, 李超伦, 孙晓霞, 等. 2014. 2012年冬季菲律宾海浮游动物丰度和生物量的水平分布. 海洋与湖沼, 45(6): 1225-1233 |
李学刚, 宋金明, 袁华茂, 等. 2017. 深海大洋最小含氧带(OMZ)及其生态环境效应. 海洋科学, 41(12): 127-138 DOI:10.11759/hykx20170821003 |
汪品先. 2013. 从海洋内部研究海洋. 地球科学进展, 28(5): 517-520 |
张文静, 孙晓霞, 陈芸燕, 等. 2016. 2014年冬季热带西太平洋雅浦Y3海山浮游植物叶绿素a浓度及粒级结构. 海洋与湖沼, 47(4): 739-747 |
张均龙, 徐奎栋. 2013. 海山生物多样性研究进展与展望. 地球科学进展, 28(11): 1209-1216 DOI:10.11867/j.issn.1001-8166.2013.11.1209 |
张武昌, 于莹, 李超伦, 等. 2014. 海山区浮游生态学研究. 海洋与湖沼, 45(5): 973-978 |
林茂, 王春光, 王彦国, 等. 2011. 西太平洋浮游动物种类多样性. 生物多样性, 19(6): 646-654 |
郑重, 李少菁, 许振祖. 1984. 海洋浮游生物学. 北京: 海洋出版社
|
徐兆礼, 陈亚瞿. 1989. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 8(4): 13-15, 19 |
Beaugrand G, Brander K M, Lindley J A et al, 2003. Plankton effect on cod recruitment in the North Sea. Nature, 426(6967): 661-664 DOI:10.1038/nature02164 |
Beaugrand G, Edwards M, Legendre L, 2010. Marine biodiversity, ecosystem functioning, and carbon cycles. Proceedings of the National Academy of Sciences of the United States of America, 107(22): 10120-10124 DOI:10.1073/pnas.0913855107 |
Behrenfeld M J, O'Malley R T, Siegel DA et al, 2006. Climate-driven trends in contemporary ocean productivity. Nature, 444(7120): 752-755 DOI:10.1038/nature05317 |
Carmo V, Santos M, Menezes G M et al, 2013. Variability of zooplankton communities at Condor seamount and surrounding areas, Azores (NE Atlantic). Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 98: 63-74 DOI:10.1016/j.dsr2.2013.08.007 |
Cartes J E, Papiol V, Frutos I et al, 2014. Distribution and biogeographic trends of decapod assemblages from Galicia Bank (NE Atlantic) at depths between 700 and 1800 m, with connexions to regional water masses. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 106: 165-178 DOI:10.1016/j.dsr2.2013.09.034 |
Denda A, Christiansen B, 2011. Zooplankton at a seamount in the eastern Mediterranean:distribution and trophic interactions. Journal of the Marine Biological Association of the United Kingdom, 91(1): 33-49 DOI:10.1017/S0025315410001153 |
Denda A, Christiansen B, 2014. Zooplankton distribution patterns at two seamounts in the subtropical and tropical NE Atlantic. Marine Ecology, 35(2): 159-179 DOI:10.1111/maec.12065 |
Denda A, Stefanowitsch B, Christiansen B, 2017. From the epipelagic zone to the abyss:Trophic structure at two seamounts in the subtropical and tropical Eastern Atlantic-Part I zooplankton and micronekton. Deep Sea Research Part I:Oceanographic Research Papers, 130: 63-77 DOI:10.1016/j.dsr.2017.10.010 |
Dower J F, Mackas D L, 1996. "Seamount effects" in the zooplankton community near Cobb Seamount. Deep Sea Research Part I:Oceanographic Research Papers, 43(6): 837-858 DOI:10.1016/0967-0637(96)00040-4 |
Dussart B H, 1965. Les différentes catégories de plancton. Hydrobiologia, 26(1-2): 72-74 DOI:10.1007/BF00142255 |
Epp D, Smoot N C, 1989. Distribution of seamounts in the North Atlantic. Nature, 337(6204): 254-257 DOI:10.1038/337254a0 |
Eriksen C C, 1991. Observations of amplified flows atop a large seamount. Journal of Geophysical Research:Oceans, 96(C8): 15227-15236 DOI:10.1029/91JC01176 |
Genin A, Dower J F, 2007. Seamount plankton dynamics. In: Pitcher T J, Morato T, Hart P J B et al eds. Seamounts: Ecology, Fisheries and Conservation. Oxford, United Kingdom: Blackwell Publishing, 85-100
|
Harris R, Wiebe P, Lenz J et al, 2000. ICES Zooplankton Methodology Manual. New York: Academic Press
|
Haury L, Fey C, Newland C et al, 2000. Zooplankton distribution around four eastern North Pacific seamounts. Progress in Oceanography, 45(1): 69-105 |
Hosia A, Stemmann L, Youngbluth M, 2008. Distribution of net-collected planktonic cnidarians along the northern Mid-Atlantic Ridge and their associations with the main water masses. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 55(1-2): 106-118 DOI:10.1016/j.dsr2.2007.09.007 |
Hu D X, Wu L X, Cai W J et al, 2015. Pacific western boundary currents and their roles in climate. Nature, 522(7556): 299-308 DOI:10.1038/nature14504 |
Kvile K O, Taranto G H, Pitcher T J et al, 2014. A global assessment of seamount ecosystems knowledge using an ecosystem evaluation framework. Biological Conservation, 173: 108-120 DOI:10.1016/j.biocon.2013.10.002 |
Martin B, Christiansen B, 2009. Distribution of zooplankton biomass at three seamounts in the NE Atlantic. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 56(25): 2671-2682 DOI:10.1016/j.dsr2.2008.12.026 |
Menard H W, 1964. Marine Geology of the Pacific. New York: McGraw-Hill
|
Papiol V, Cartes J E, Vélez-Belchí P et al, 2019. Near-bottom zooplankton over three seamounts in the east Canary Islands:Influence of environmental variables on distribution and composition. Deep Sea Research Part I:Oceanographic Research Papers, 149: 103025 DOI:10.1016/j.dsr.2019.04.003 |
Parsons T R, Maita Y, Lalli G M, 1984. A manual of chemical and biological methods for seawater analysis. Oxford and New York: Pergamon Press
|
Rogers A D, 2018. The biology of seamounts:25 Years on. Advances in Marine Biology, 79: 137-224 DOI:10.1016/bs.amb.2018.06.001 |
Satapoomin S S, Nielsen T G, Hansen P J, 2004. Andaman Sea copepods:spatio-temporal variations in biomass and production, and role in the pelagic food web. Marine Ecology Progress Series, 274: 99-122 DOI:10.3354/meps274099 |
Shank T M, 2010. Seamounts:Deep-ocean laboratories of faunal connectivity, evolution, and endemism. Oceanography, 23(1): 108-122 DOI:10.5670/oceanog.2010.65 |
Sørensen T, 1948. A method of establishing groups of equal amplitudes in plant sociology based on similarity of species content and its application to analyses of the vegetation on Danish commons. Det Kongelige Danske Videnskabernes Selskab Biologiske Skrifter, 5(4): 1-34 |
Stocks K I, Clark M R, Rowden A A et al, 2012. CenSeam, an international program on seamounts within the census of marine life:achievements and lessons learned. PLoS One, 7(2): e32031 DOI:10.1371/journal.pone.0032031 |
Sun S, Huo Y Z, Yang B, 2010. Zooplankton functional groups on the continental shelf of the Yellow Sea. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 57(11-12): 1006-1016 DOI:10.1016/j.dsr2.2010.02.002 |
Tittensor D P, Mora C, Jetz W et al, 2010. Global patterns and predictors of marine biodiversity across taxa. Nature, 466(7310): 1098-1107 DOI:10.1038/nature09329 |
Toole J M, Zou E, Millard R C, 1988. On the circulation of the upper waters in the western equatorial Pacific Ocean. Deep Sea Research Part A:Oceanographic Research Papers, 35(9): 1451-1482 DOI:10.1016/0198-0149(88)90097-0 |
Turner J T, 2015. Zooplankton fecal pellets, marine snow, phytodetritus and the ocean's biological pump. Progress in Oceanography, 130: 205-248 DOI:10.1016/j.pocean.2014.08.005 |
Valle-Levinson A, Castro AT, de Velasco GG et al, 2004. Diurnal vertical motions over a seamount of the southern Gulf of California. Journal of Marine Systems, 50(1-2): 61-77 DOI:10.1016/j.jmarsys.2003.09.016 |
Ware D M, Thomson R E, 2005. Bottom-up ecosystem trophic dynamics determine fish production in the Northeast Pacific. Science, 308(5726): 1280-1284 DOI:10.1126/science.1109049 |
Yesson C, Clark M R, Taylor M L et al, 2011. The global distribution of seamounts based on 30 arc seconds bathymetry data. Deep Sea Research Part I:Oceanographic Research Papers, 58(4): 442-453 DOI:10.1016/j.dsr.2011.02.004 |
 2020, Vol. 51
2020, Vol. 51


