中国海洋湖沼学会主办。
文章信息
- 于仁成, 吕颂辉, 齐雨藻, 周名江. 2020.
- YU Ren-Cheng, Lü Song-Hui, QI Yu-Zao, ZHOU Ming-Jiang. 2020.
- 中国近海有害藻华研究现状与展望
- PROGRESS AND PERSPECTIVES OF HARMFUL ALGAL BLOOM STUDIES IN CHINA
- 海洋与湖沼, 51(4): 768-788
- Oceanologia et Limnologia Sinica, 51(4): 768-788.
- http://dx.doi.org/10.11693/hyhz20200400127
文章历史
-
收稿日期:2020-04-23
收修改稿日期:2020-05-14
2. 暨南大学 广州 510632;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
4. 中国科学院大学 北京 100049;
5. 中国科学院海洋大科学中心 青岛 266071
2. Jinan University, Guangzhou 510632, China;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China;
5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
有害藻华是指水体中一些有毒有害微藻、大型藻或蓝细菌等生物量暴发性增长, 对水生生态系统及人类健康和福利造成危害的现象(GlobalHAB, 2017)。在淡水环境中, 由微囊藻等蓝细菌(cyanobacteria, 以往亦称蓝藻, blue-green algae)形成的“水华”是主要的有害藻华现象(Svirčev et al, 2019); 在海洋环境中, 常见的有害藻华包括微藻形成的“赤潮(red tide)”和“褐潮(brown tide)”, 以及大型藻形成的“绿潮(green tide)”和“金潮(golden tide)”等(Anderson et al, 2012b; Smetacek et al, 2013)。海洋中的有害藻华能够通过多种途径, 如产生毒素、危害海洋生物、破坏海洋生态环境、影响海水理化性质等, 威胁人类健康、生态安全和社会经济发展(表 1)。因此, 有害藻华常被作为一类海洋生态灾害问题进行研究和防控。
| 有害藻种 | 种名 | 危害对象与作用机理 | |||||||||||
| 海洋生物 | 海洋生态系统 | 人类健康 | 社会经济发展 | ||||||||||
| 特殊形态 | 活性物质 | 活性氧 | 食物链 | 环境 | 毒素 | 气溶胶 | 养殖业 | 旅游业 | 电站系统 | ||||
| 链状亚历山大藻 | Alexandrium catenella | √ | √ | √ | |||||||||
| 球形棕囊藻 | Phaeocystis globosa | √ | √ | √ | √ | √ | √ | ||||||
| 东海原甲藻 | Prorocentrum donghaiense | √ | |||||||||||
| 米氏凯伦藻 | Karenia mikimotoi | √ | √ | √ | |||||||||
| 抑食金球藻 | Aureococcus anophagefferens | √ | √ | √ | |||||||||
| 短凯伦藻 | Karenia brevis | √ | √ | √ | |||||||||
| 南方拟菱形藻 | Pseudo-niztschia australis | √ | |||||||||||
| 浒苔 | Ulva prolifera | √ | √ | √ | √ | √ | |||||||
| 铜藻 | Sargassum horneri | √ | √ | ||||||||||
以往研究中, 对于近海有害藻华的描述有一定变化。早期研究中往往采用和海水颜色变化(water discoloration)相关的描述, 如赤潮、褐潮、绿潮和金潮等, 重点关注藻类大量增殖或聚集后造成海水颜色异常变化的生态现象, 对藻华的暴发多强调其异常性和偶发性, 如exceptional、unusual和episodic等; 从20世纪90年代开始, 藻华造成的危害效应逐渐受到关注, 对藻华的描述开始强调其毒性和危害性, 如harmful、toxic、nuisance和ecosystem disruptive等, 有害赤潮和有害藻华等概念开始逐渐被接受和应用。有害藻华研究进一步拓展了以往海洋学研究中对藻华(algal bloom)问题的认识(Smayda, 1997)。在早期海洋学研究中, 重点关注以硅藻为优势类群的藻华现象, 如中纬度海域冬-春交汇之际出现的“春华(spring bloom)”, 或者在上升流海域出现的硅藻藻华等。研究中常常采用对浮游植物群落进行简约化处理的方法, 将叶绿素a作为指示浮游植物生物量的主要指标。而在有害藻华研究中, 研究重点逐渐转向甲藻等有毒有害的鞭毛藻类, 特别关注特定藻种数量或生物量的变化及其危害效应, 这进一步推动了海洋学与环境科学的交叉融合, 也对研究手段和方法提出了更高要求。
近几十年来, 国内外有害藻华研究快速发展, 已经形成了多学科交叉的研究体系(图 1)。本文在简介国际上有害藻华状况和研究进展的基础上, 对我国近海有害藻华发生情况和研究进展进行了综述, 并对未来有害藻华研究的思路和方向进行了探讨。
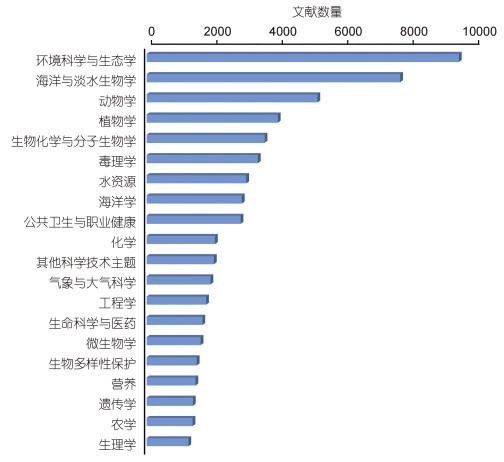 |
| 图 1 1950—2020年间发表的有害藻华论文中排名前20位的学科情况 Fig. 1 Top 20 subjects related to harmful algal bloom studies in publications from 1950 to 2020 注:结果检索自Web of Science网站, 网址https://apps.webofknowledge.com |
在海洋中, 微藻形成的赤潮和褐潮一直是有害藻华研究的主要对象, 海洋中的甲藻、硅藻、定鞭藻、针胞藻、硅鞭藻、裸藻、海金藻和蓝细菌等都有形成有害藻华的记录(Lassus et al, 2016)。有害藻华具有明显的区域性分布特征, 大部分有害藻华事件出现在河口、海湾和上升流区, 如波罗的海的泡沫节球藻(Nodularia spumigena)和束丝藻(Aphanizomenon sp.)等蓝细菌形成的有害藻华(Kahru et al, 2020), 欧洲北海和东亚海域的球形棕囊藻(Phaeocystis globosa)赤潮(Qi et al, 2004; Schoemann et al, 2005), 东海的东海原甲藻(Prorocentrum donghaisense)和米氏凯伦藻(Karenia mikimotoi)赤潮(Zhou et al, 2008), 墨西哥湾的短凯伦藻(Karenia brevis)赤潮(Steidinger, 2009), 美国加州和加拿大爱德华王子岛附近海域的拟菱形藻(Pseudo-nitzschia spp.)赤潮(Smith et al, 2018), 缅因湾的链状亚历山大藻(Alexandrium catenella, 以往研究中多称为芬迪亚历山大藻A. fundyense)赤潮(Anderson et al, 2012a), 北美东部海域的抑食金球藻(Aureococcus anophagefferens)褐潮等(Gobler et al, 2012)。这些有害藻华往往规模较大, 且连年发生, 成为全球最具代表性的有害藻华现象。除微藻形成的有害藻华之外, 海洋中的大型藻藻华近期也开始受到关注。石莼属(Ulva)和刚毛藻属(Cladophora)绿藻, 马尾藻属(Sargassum)褐藻, 以及江蓠属(Gracilaria)和龙须菜属(Gracilariopsis)红藻, 是比较常见的大型藻藻华原因种, 常常在海上形成大片漂浮藻席, 不仅影响景观, 对海草床生境和底栖生物群落也构成很大威胁(Gladyshev et al, 2019)。其中, 绿潮主要分布在南、北半球的温带海域, 如欧洲、北美和亚太地区的近岸海域, 以及南非、澳大利亚和新西兰附近海域。其中, 黄海、亚得里亚海、波罗的海及法国布列塔尼附近海域绿潮问题比较突出(Ye et al, 2011)。近年来, 马尾藻形成的金潮也备受关注, 在加勒比海、墨西哥湾、非洲西侧近海海域和黄海等都出现了大量马尾藻堆积成灾的问题(Smetacek et al, 2013; Wang et al, 2019a)。
自20世纪70年代以来, 近海有害藻华不断加剧, 已逐渐成为一类全球性的海洋生态灾害。由于有害藻华原因种的多样性和藻华发生的区域性特点, 早期研究中很少有针对全球有害藻华问题的系统分析。20世纪90年代初, Anderson (1989)和Hallegraeff (1993)在对全球有害藻华发生情况进行总结后指出, 有害藻华的分布区域、发生频率和暴发规模等表现出明显上升趋势, 其主要原因在于船舶压舱水等造成的有害藻华原因种扩散、对有害藻华和藻毒素关注程度提高、近海养殖业发展、富营养化问题加剧, 以及气候变化的潜在影响等(Anderson et al, 2012b)。经过近30年的研究, 这一认识已逐渐成为共识。令人关注的是, 近年来超大规模有害藻华事件频频出现, 明显有别于以往区域性暴发的小规模有害藻华现象。这些事件不仅反映了人类活动造成的富营养化在近海有害藻华形成中的作用, 更凸显了全球气候变化对有害藻华的影响(Trainer et al, 2020)。
1.2 国际有害藻华研究计划与主要进展自20世纪70年代开始, 全球有害藻华问题不断加剧, 受到国际社会的高度关注。1992年后, 联合国教科文组织政府间海洋学委员会(IOC-UNESCO)和海洋研究科学委员会(SCOR)等国际组织先后成立了多个赤潮工作专家组, 倡导开展赤潮生态学与海洋学研究。1998年, 在IOC和SCOR联合支持下, “全球有害藻华生态学与海洋学研究计划(GEOHAB)”启动, 该计划旨在推动国际上对相似生态系统中有害藻华的比较研究, 综合应用生物学、化学和物理学等手段, 开展有害藻华关键种的种群动态及其相关海洋学过程研究, 解析有害藻华形成的生态学和海洋学机制, 提高对有害藻华的模拟、预测和防控能力(GEOHAB, 2001)。GEOHAB计划先后围绕“富营养化系统中的有害藻华”、“层化系统中的有害藻华”、“上升流系统中的有害藻华”、“峡湾和海湾中的有害藻华”和“底栖系统中的有害藻华”设置了5项核心研究计划(core research project, CRP), 在美国、中国、欧洲和亚洲也启动了相应的区域和国家研究计划(如欧洲的EUROHAB, 亚洲的GEOHAB-Asia, 美国的ECOHAB, 中国的CEOHAB, 以及菲律宾的PhiHAB等)。
2013年4月, 在巴黎召开的GEOHAB开放科学大会对计划实施情况进行了总结, 并提出了组织新的有害藻华国际计划的设想。2016年, “全球变化下有害藻华研究计划(GlobalHAB)”正式启动。该计划旨在改进对水生生态系统中有害藻华的认识水平和预测能力, 更好地开展有害藻华的管理和减灾工作(GlobalHAB, 2017)。在GEOHAB计划提出的“生物多样性与生物地理分布”、“营养盐与富营养化”、“藻种适应策略”、“生态系统比较研究”及“观测、模拟与预测”等5项内容基础上, GlobalHAB计划又增加了“毒素”、“淡水有害藻华与蓝细菌藻华”、“底栖环境中的有害藻华”、“有害藻华与水产养殖”、“有害藻华与人类和动物健康”、“经济”、“气候变化与有害藻华”等7项内容, 将淡水环境中的有害藻华、底栖环境中的有害藻华以及全球气候变化对有害藻华的影响等也作为核心研究方向, 并加强了对有害藻华社会经济效应的关注(图 2)。
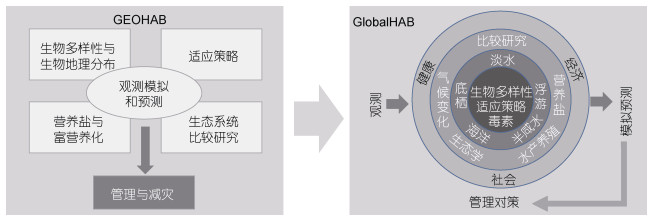 |
| 图 2 有害藻华国际研究计划概况 Fig. 2 Outline of the international programs of harmful algal blooms 注:根据GEOHAB(2001)和GlobalHAB(2017)报告改绘 |
在GEOHAB和GlobalHAB计划支持下, 全球有害藻华研究不断深入, 取得了一系列重要进展(Glibert et al, 2018)。本文选择部分研究工作进展进行综述, 以期反映近期国际上有害藻华研究的热点方向, 研讨我国未来有害藻华研究的发展趋势。
1.2.1 有害藻华原因种多样性、生物地理分布特征与适应策略海洋中的许多藻类能够形成有害藻华。有害藻华原因种的多样性及其复杂的适应策略, 是有害藻华研究中面临的最大挑战。Lassus等(2016)在系统总结全球有害藻华发生概况的基础上, 整理了有害藻华原因种名录, 共列出54个属170余种有害藻华原因种, 涵盖甲藻、硅藻、针胞藻、定鞭藻、硅鞭藻、海金藻、裸藻和蓝细菌等8个类群, 其中约三分之二的藻种属于甲藻。近年来, 随着分子生物学、仪器分析和信息技术的快速发展, 组学研究技术方法体系不断完善, 在有害藻华研究中得到广泛应用, 深化了对有害藻华原因种多样性、生物地理分布特征与适应策略的认识。
针对特定基因或整个生物基因组的进化关系研究, 在一定程度上重构了包括绝大部分有害藻类在内的真核生物分类体系(Adl et al, 2019; Burki et al, 2020)。这不仅推动了真核藻类分类从形态学种(morphological species)向种系进化种(phylogenetic species)转变, 也为藻种的鉴定和检测提供了新的思路和手段, 提高了对有害藻华原因种多样性和生物地理分布特征的认识。以塔玛亚历山大藻复合种(Alexandrium tamarense species complex)为例, 塔玛亚历山大藻复合种是全球最重要的有害藻华原因种之一, 也是麻痹性贝类毒素(paralytic shellfish toxins)的主要产毒藻, 最初是对亚历山大藻属中亲缘关系相近、形态特征相似的塔玛亚历山大藻(Alexandrium tamarense)、链状亚历山大藻和芬迪亚历山大藻的统称, 通常以藻细胞长宽比、甲板排组和有无腹孔等形态学特征进行分类鉴定。但许多研究表明, 仅通过形态学特征对藻种的分类鉴定并不准确。结合核糖体RNA基因和内转录间隔区序列信息, 可以将塔玛亚历山大藻复合种区分为不同的核糖体型(Lilly et al, 2007), 并据此对塔玛亚历山大藻复合种的分类进行了修订, 将塔玛亚历山大藻复合种分为链状亚历山大藻(A. catenella, 对应第Ⅰ类核糖体型)、地中海亚历山大藻(A. mediterraneum, 第Ⅱ类核糖体型)、塔玛亚历山大藻(A. tamarense, 第Ⅲ类核糖体型)、太平洋亚历山大藻(A. pacificum, 第Ⅳ类核糖体型)和澳大利亚亚历山大藻(A. australiense, 第Ⅴ类核糖体型) (John et al, 2014; Fraga et al, 2015)。对塔玛亚历山大藻复合种的分类修订具有重要意义:首先, 修订后的5种亚历山大藻在地理分布上相对独立, 其中3种有产生麻痹性贝类毒素的报道, 在藻种生物地理分布和产毒特征上更为清晰; 其次, 实时定量PCR和荧光原位杂交等分子生物学方法成为检测特定藻种的首要工具, 大大提高了藻种鉴定结果的客观性。
基于快速发展的组学研究技术, 获取了部分有害藻华原因种的基因组信息, 通过转录组学方法研究了藻种生长、营养盐吸收利用及环境适应性的分子机理, 提高了对有害藻华原因种适应策略的认识。目前, 已经围绕微囊藻(Microcystis)、柱胞藻(Cylindrospermopsis)和节球藻(Nodularia)等蓝细菌的基因组开展了系统研究(Hark et al, 2016), 对部分真核藻类的基因组也进行了探索。2011年, 完成了首个有害藻华原因种——抑食金球藻全基因组测序工作(Gobler et al, 2011), 目前多列拟菱形藻(Pseudo-nitzschia multiseries)的基因组草图也已完成。尽管甲藻在有害藻华原因种中占有很大比例, 但甲藻庞大的基因组和高度重复的序列信息严重制约了基因组测序工作, 目前仅完成了部分寄生性甲藻(如Breviolim minutum和Symbiodinium kawagutii)的基因组分析(Lin et al, 2015; Bi et al, 2019)。此外, 对于亚历山大藻属(Alexandrium)、原甲藻属(Prorocentrum)和异帽藻属(Heterocapsa)中的甲藻进行了初步的基因组调查(Ponmani et al, 2016), 也完成了许多藻种的质体基因组测序。相对于基因组研究, 对有害藻华原因种的转录组学研究开展得更为深入, 已经构建完成了150多个有害藻种的转录组数据库, 对甲藻、硅藻、海金藻、针胞藻和定鞭藻等藻类的基因表达情况进行了深入研究(Keeling et al, 2014), 不但深化了对藻种生长、碳代谢、营养物质吸收和利用、毒素合成以及环境适应性的机理性认识, 也加深了对甲藻等有害藻类基因表达调控机理的认知。近年来, 基于二维凝胶电泳和液相色谱-质谱联用的蛋白质组学技术快速发展, 已应用于亚历山大藻、原甲藻和抑食金球藻等有害藻种的生理学研究, 深化了对毒素产生、细胞周期和营养盐吸收利用等过程的认识(Wang et al, 2013)。
近年来, 宏组学(meta-omics)和整合组学(integrated omics)手段在有害藻华研究领域的应用不断深入, 有望提高对复杂环境影响下有害藻华发生过程和机理的认识。自20世纪末首次出现“宏基因组学”概念以来, 对环境样品的组学分析快速发展, 并应用于有害藻华研究, 如基于18S rDNA V4和V9区等序列的高通量测序, 研究藻华发生过程中真核藻类多样性及其变化情况, 通过宏转录组学手段解析浮游植物群落中有害藻种的独特适应机理, 以宏蛋白质组学手段跟踪分析有害藻华原因种特定蛋白质的表达状况及其功能等, 提升了对自然海域中有害藻华生物学机理的认识水平。整合多组学研究手段, 针对特定藻种或特定藻华过程开展研究, 有助于深刻理解有害藻华原因种的适应策略及其机制, 分析藻华发生过程中不同藻类之间的相互关系, 更好地解析富营养化和气候变化等复杂环境因子胁迫下有害藻华的发生过程(Hennon et al, 2020)。
1.2.2 典型有害藻华的生态学与海洋学研究在GEOHAB计划实施过程中, 通过5项核心研究计划和多项区域、国家研究计划的组织实施, 提高了对不同类型有害藻华生态学与海洋学机理的认识。
全球有害藻华中, 相当一部分高生物量有害藻华出现在富营养化系统中, 与近海富营养化过程密切相关。富营养化不仅决定有害藻华的规模, 也会影响到有害藻华的类型甚至危害效应(Glibert et al, 2017, 另见富营养化部分)。东海海域的大规模东海原甲藻赤潮和美国东部海域抑食金球藻褐潮都是富营养化系统中的典型有害藻华现象, 东海原甲藻赤潮暴发与长江口邻近海域硝酸盐污染和高氮磷比密切相关(Zhou et al, 2008); 抑食金球藻褐潮则与美国东海岸海湾中高浓度的溶解有机氮化合物有关(Gobler et al, 2005)。
针对上升流系统中的有害藻华, 研究主要集中在全球东边界流区, 如加利福尼亚海流、洪堡海流、加纳利海流及本格拉海流的影响海域(Pitcher et al, 2017)。在这些海域, 上升流输送的丰富营养物质支撑了生物生产过程, 也有利于有害藻华的形成。通常认为硅藻是上升流区浮游植物的优势类群, 但一些甲藻类群也能够在上升流区形成有害藻华(Trainer et al, 2010)。在加利福尼亚附近海域的拟菱形藻藻华、伊比利亚半岛附近的链状裸甲藻(Gymnodinium catenatum)和鳍藻(Dinophysis spp.)藻华, 是上升流系统中的典型有害藻华现象。对比不同上升流区有害藻华发生情况可以看出, 上升流区的有害藻华类型并不一致, 这与上升流形成、维持和消退过程中所形成的多样化的生境有关(Smayda et al, 2010)。上升流区有害藻华的发生往往与气候变化密切相关, 在研究中更需要长期观测和数值模式支持。
与富营养化系统和上升流系统的有害藻华不同, 峡湾和海湾中的有害藻华往往规模较小。部分有害藻华是经由平流输送自湾外进入湾内, 另外一部分藻华则由能够产生休眠孢囊的藻类形成, 往往会在海湾中连年出现(Berdalet et al, 2017a)。海湾中的藻华容易受到营养盐和腐殖质等陆源物质输入的影响, 经由地下水排放输入的营养盐对有害藻华的影响是近年来研究中重点关注的问题(Beusen et al, 2013)。同时, 有害藻华发生过程也受到近岸区复杂的环流、层化和潮汐动力过程调控。对于能够形成休眠孢囊的藻种, 其藻华过程还与底栖―水层耦合过程密切相关。在藻华后期, 水体中休眠孢囊的形成有利于藻类避开不利生存环境; 在环境条件适宜时, 沉积物中孢囊的萌发又是藻华形成的重要触发因子, 直接影响藻华的分布和规模。对缅因湾中链状亚历山大藻(以往研究中多称为芬迪亚历山大藻)藻华的研究是海湾中有害藻华研究的典型范例(Anderson et al, 2014)。该海域的研究表明, 除个别年份之外, 当年亚历山大藻藻华规模与前一年表层沉积物中亚历山大藻休眠孢囊的丰度和分布状况与有很好的相关性。基于沉积物中孢囊和水体中营养细胞的关系建立生态模型, 能够较好地模拟和预测亚历山大藻藻华的分布和动态过程。
针对层化系统中的有害藻华, 近年来的研究重点聚焦在水体中的浮游植物薄层与有害藻华的关系方面。薄层是层化水体中一种独特的垂向不连续分布现象, 其物理、化学和生物学特征明显有别于其他部分水体。薄层厚度从几毫米到几米, 持续时间可达数天甚至更长。薄层的形成不仅受到层化、湍流和剪切等物理学过程调控, 也与营养盐等化学要素的垂向分布以及藻种生长、聚集、浮力控制和逃避摄食等生物学过程有关。鳍藻、红色赤潮藻(Akashiwo sanguinea)、米氏凯伦藻等甲藻以及拟菱形藻等硅藻往往呈薄层分布, 对于有害藻华的形成、分布、扩散和危害具有重要影响。目前, 对伊比利亚半岛和加州近海的浮游植物薄层研究较多, 揭示了不同海洋学过程对薄层形成的作用(Berdalet et al, 2017a)。
底栖生态系统中的有害藻华重点关注热带和亚热带海域珊瑚礁生境中的底栖性有毒甲藻, 如冈比亚藻属(Gambierdiscus)、蛎甲藻属(Ostreopsis)和部分底栖性原甲藻属(Prorocentrum)中的藻种, 这些藻类能够产生西加鱼毒素、海葵毒素(palytoxins)和腹泻性贝类毒素等有毒化合物。底栖性甲藻很少像浮游性甲藻一样在水体中形成肉眼可见的藻华, 但其丰度的增加会造成底栖动物死亡, 也能够通过鱼类等媒介生物和气溶胶途径危害人类健康。近年来底栖性甲藻的采样方法和检测技术趋于完善, 显著提高了对底栖性甲藻多样性、分布特征和种群丰度变化的认识。最近, 在地中海等温带海域也发现了冈比亚藻分布, 在全球变暖背景下有毒底栖甲藻分布区域扩展的趋势值得关注(Berdalet et al, 2017b)。
1.2.3 富营养化和气候变化对有害藻华的影响富营养化是目前最受关注的有害藻华影响因素之一。富营养化本质上是生态系统中有机质加速生产的自然过程(Nixon, 1995)。因营养盐污染导致的富营养化是威胁近海生态系统的重要因素之一, 与近海的有害藻华密切相关(Anderson et al, 2002; Glibert, 2017)。研究表明, 随着近海富营养化程度的不断加剧, 海水中的优势藻类也在逐渐发生变化:在寡营养海域, 往往以多年生底栖大型藻类为主; 随着海域富营养化程度的提高, 底栖/附生性藻类开始占据优势; 富营养化程度进一步加剧后, 由大型绿藻形成的绿潮和微藻形成的赤潮开始出现; 在严重富营养化海域赤潮往往占有优势。近年来, 流域空间统计模型(spatially referenced regressions on watersheds, SPARROW)、水土评估模型(soil and water assessment tool, SWAT)和流域营养盐输出模型(nutrient export from watersheds, NEWS)、人类活动净氮输入模型(net anthropogenic nitrogen input, NANI)等一系列数学模型开始应用于全球或区域营养盐通量计算, 显著改善了对入海氮、磷通量的认识(Seitzinger et al, 2010)。据估算, 由于化肥生产量和使用量的快速上升, 全球每年约6000万吨氮经由河流输入近海(Howarth, 2008)。大量营养盐输入造成了近海营养盐浓度的上升, 也改变了营养盐的结构。近期研究进一步确认了氮在近海富营养化中的重要作用。总体来看, 近40年里全球氮肥用量增加了约9倍, 而磷肥仅增加了3倍左右(Sutton et al, 2013), 氮的入海通量远高于磷, 造成了近海氮磷比的显著上升。据模型估算, 入海氮磷比高达114—370(Peñuelas et al, 2012)。同时, 尿素作为化肥的大量使用, 以及畜牧业和海水养殖业的快速发展, 使得大量还原态氮(氨氮、尿素及其他溶解有机氮等)进入近海, 也导致了海水中还原态氮浓度的明显上升(Glibert et al, 2012)。
越来越多的证据表明, 富营养化过程不仅影响藻华规模, 也会造成藻华原因种多样性和优势类群的变化。由于不同微藻对营养盐的吸收和利用策略不同, 氮磷比的变化会导致浮游植物群落结构和藻华优势类群的改变。研究发现, 硅藻类的平均最适氮磷比最低, 甲藻、蓝细菌和绿藻次之, 这与不同藻类对磷的需求和吸收利用策略密切相关。因此, 尽管硅藻的生长速率较快, 但在氮磷比失衡条件下, 可能无法在与甲藻、蓝细菌和绿藻的竞争中占据优势(Hillebrand et al, 2013)。在欧洲北海、中国东海和美国切萨皮克湾等以高氮磷比为特征的富营养化海域, 均出现了大规模甲藻藻华的暴发现象。此外, 还原态氮和氧化态氮比例的改变也会对浮游植物优势类群造成影响。以硝酸盐为优势的氮源通常支持硅藻类的生长, 而还原态氮则会促进海金藻、蓝细菌、绿藻和甲藻的生长(Glibert, 2016)。富营养化状况不仅决定了藻华的多样性和优势类群, 还影响着藻华的危害效应。以有毒亚历山大藻为例, 高氮磷比条件能够显著提高藻细胞内的毒素含量, 从而增加有毒亚历山大藻藻华的潜在危害。
近20年来, 气候变化对有害藻华的影响开始受到关注。大气中二氧化碳浓度上升会造成全球变暖和海洋酸化, 有可能加剧近海有害藻华问题, 改变有害藻华的分布状况、发生规模、发生频率和季节动态(Hallegraeff, 2010)。围绕海洋变暖和酸化对有害藻华的影响已开展了大量模拟实验研究, 但结果往往因藻种甚至藻株而异, 很多研究指出升温和酸化会提高蓝细菌以及鳍藻和亚历山大藻等有毒甲藻的生长或产毒能力(Griffith et al, 2020)。综合不同藻种的生理生态特征和未来气候变化情景进行的模拟研究表明, 北美和北大西洋海域有害藻华的分布范围有可能会进一步扩展(Gobler et al, 2017)。在实际调查中也发现, 许多海域出现了新的有害藻华现象, 以冈比亚藻等底栖性有毒甲藻为例, 这些藻种通常分布在太平洋、大西洋和印度洋南北纬35°之间的热带和亚热带海域, 最近, 在地中海等温带海域也发现了冈比亚藻, 在葡萄牙和西班牙的一些岛屿甚至出现了西加鱼毒中毒问题(Berdalet et al, 2017b)。
近期一系列大规模藻华事件的出现, 凸显了异常气候事件对有害藻华发生的影响。从2011年开始, 加勒比海和热带大西洋海域开始出现马尾藻(主要原因种为漂浮马尾藻Sargassum natans和漂流马尾藻S. fluitans)形成的大规模金潮, 此后几乎每年夏季都会出现, 严重时能够形成自墨西哥湾到非洲西海岸横跨整个热带大西洋海域的漂浮马尾藻条带(Wang et al, 2019a)。有研究认为这一现象与亚马逊河营养盐输入、非洲西北部海域和赤道区上升流、非洲沙尘沉降及海表温度变化等因素有关, 也有研究提出2009—2010年间北大西洋涛动导致海洋环流的变化, 造成部分漂浮马尾藻向东扩展到直布罗陀海峡附近海域, 从而触发大西洋马尾藻分布格局的改变(Johns et al, 2020)。2015年4—6月, 北美西部海域出现以南方拟菱形藻(Pesudonitzschia australis)为主要原因种的大规模藻华, 影响范围几乎遍及整个北美西部海域, 拟菱形藻产生的软骨藻酸(domoic acid)直到当年11月份仍然可以在竹蛏和黄道蟹等海洋动物中检出。研究发现, 这次大规模的拟菱形藻藻华与2013—2016年间北太平洋海域的巨大暖水团(the Blob)有关(Bates et al, 2018; Trainer et al, 2020)。2016年1—5月, 在南美西部智利近海先后发生小疣拟卡盾藻(Pseudochattonella verruculosa)和链状亚历山大藻形成的大规模藻华, 造成4万吨养殖三文鱼和大量贝类死亡。研究表明, 2015—2016年厄尔尼诺期间, 高温、干旱的天气造成入海径流量下降、海表气温上升和风场的变化, 有利于富含营养盐的高盐外海水入侵, 促成了大规模藻华的暴发。2017年9月到2019年1月, 美国佛罗里达州近岸海域持续暴发短凯伦藻藻华, 该藻种能够产生短凯伦藻毒素(brevetoxin), 对海洋哺乳类动物、渔业资源和人类健康构成潜在威胁。有研究认为, 2018年期间墨西哥湾环流状况有利于佛罗里达西部海域上升流的形成, 促成了2005年以来最大规模的短凯伦藻藻华(Weisberg et al, 2019)。
1.2.4 藻毒素与人类健康海洋中的部分藻类能够产生多样化的藻毒素成分, 通过食物链传递后, 会导致海洋生物染毒, 造成麻痹性贝毒中毒等事件, 危害人类健康和生命安全(表 2)。按照毒素化学结构, 可以将常见的藻毒素分成氮杂螺环酸(azaspiracid)及其同系物、短凯伦藻毒素、环亚胺毒素(cyclic imine)、软骨藻酸、大田软海绵酸(okadaic acid)及其同系物、扇贝毒素(pectenotoxin, 亦称蛤毒素)、石房蛤毒素(saxitoxin)及其同系物、虾夷扇贝毒素(yessotoxin)等8类, 此外, 海葵毒素(palytoxins)在一些藻类中也有检出(Farabegoli et al, 2018)。藻毒素在鱼类、贝类中累积, 不仅影响海产品品质、危害人类健康, 还会破坏养殖业发展, 造成巨大的经济损失。据估算, 全球因藻毒素造成的中毒人数每年不下2000例, 经济损失约40亿美元(Berdalet et al, 2016; Brown et al, 2019)。在国际上高度关注的“海洋与人类健康(Oceans and Human Health, OHH)”研究计划中, 藻毒素是一项重要的内容(Knap et al, 2002; HARRNESS, 2005)。
| 中毒事件类型 | 毒素成分 | 产毒藻种 |
| 麻痹性贝毒中毒 | 石房蛤毒素及其衍生物(saxitoxin, STX) | Alexandrium acatenella, A. affine, A. andersonii, A.catenella, A. cohorticula, A. minutum, A. ostenfeldii, A. pacificum, A. tamiyavanichii, A. taylori.Gymnodinium catenatum. Pyrodinium bahamense var. compressum. |
| 腹泻性贝毒中毒 | 大田软海绵酸(okadaic acid, OA)和鳍藻毒素(dinophysis toxin, DTX) | Dinophysis acuminata, D. acuta, D. caudata, D. fortii, D. infundibula, D. miles, D. norvegica, D. ovum, D. sacculus, D. tripos. Phalacroma mitra, P. rotundatum. Prorocentrum belizeanum, P. borbonicum, P. caipirignum, P. concavum, P. faustiae, P. hoffmannianum, P. levis, P. lima, P. maculosum, P. rhathymum. |
| 记忆缺失性贝毒中毒 | 软骨藻酸(domoic acid, DA) | Nitzschia navis-varingica, N. bizertensis. Pseudo-nitzschia abrensis, P. australis, P. batesiana, P. brasiliana, P. caciantha, P. calliantha, P. cuspidata, P. delicatissima, P. fraudulenta, P. fukuyoi, P. galaxiae, P. granii, P. hasleana, P. kodamae, P. lundholmiae, P. multiseries, P. multistriata, P. obtusa, P. plurisecta, P. pseudodelicatissima, P. pungens, P. seriata, P. simulans, P. subfraudulenta, P. subpacifica, P. turgidula. |
| 神经性贝毒中毒 | 短凯伦藻毒素(brevetoxin, BTX) | Karenia brevis. |
| 西加鱼毒中毒 | 西加鱼毒素(cigutoxin, CTX), 刺尾鱼毒素(maitotoxin, MTX)等 | Gambierdiscus spp. (CTX+MTX), Fukuyoa spp. (MTX). |
| 氮杂螺环酸毒素中毒 | 氮杂螺环酸及其同系物(azaspiracid, AZA) | Azadinium dexteroporum, A. poporum, A. spinosum. Amphidoma languida. |
| 其他 | 虾夷扇贝毒素(yessotoxin, YTX) | Protoceratium reticulatum, Lingulodinium polyedrum, Gonyaulax spinifera. |
| 扇贝毒素/蛤毒素(pectenotoxins, PTXs) | Dinophysis spp. | |
| 环亚胺类毒素(spirolids, SPX; gymnodimine, GYM) | Alexandrium ostenfeldii (SPX), A. peruvianum (SPX), Karenia selliformis (GYM). | |
| 海葵毒素(palytoxins, PlTX) | Ostreopsis spp. |
近年来, 分析技术的快速发展显著提高了对藻毒素的检测能力。目前, 可用于藻毒素检测分析的方法包括小鼠生物测试、细胞毒性测试、离子通道受体结合测试、免疫学测试等生物学方法, 以及高效液相色谱、薄层色谱、毛细管电泳、液-质联用及核磁共振等化学分析方法。对生物测试法而言, 小鼠法长期以来一直是藻毒素毒性测试的标准方法, 但是, 由于小鼠法在脂溶性藻毒素测试中的假阳性问题, 以及使用生物测试涉及的动物伦理问题, 近年来的研究中倾向于寻找替代方法, 基于抗体结合-表面等离子共振技术构建的“人工小鼠”在藻毒素初筛中具有很好的应用潜力(Campbell et al, 2014)。在化学分析法方面, 分子印迹技术为藻毒素分离提取提供了一种很有潜力的途径, 亲水性相互作用色谱的应用提高了对石房蛤毒素和软骨藻酸等水溶性藻毒素的分析能力, 液-质联用技术实现了对不同类型藻毒素的高效同步分析, 已经取代小鼠法成为脂溶性藻毒素分析的“金标准”(Rutkowska et al, 2019)。
近年来的研究在麻痹性贝类毒素、软骨藻酸和脂溶性毒素产生机理方面取得了重要突破。甲藻和蓝细菌是麻痹性贝类毒素的主要来源, 但是, 由于甲藻庞大的基因组, 揭示毒素产生的分子机理非常困难, 在对蓝细菌的研究中首先发现了麻痹性贝类毒素合成基因簇(Verma et al, 2019)。通过转录组学和蛋白组学方法, 在甲藻中也找到了和石房蛤毒素合成相关的部分基因, 对甲藻中产毒基因sxtA和sxtG已进行了较为深入的研究。许多脂溶性藻毒素属于聚醚类化合物, 具有药用潜力, 对于这类化合物的生物合成机理开展了大量研究工作。研究表明, 聚酮合成酶(polyketidesynthase)在聚醚类化合物合成中具有重要作用, 该酶类型多样, 是一个酶家族, 与脂肪酸合成酶功能类似, 都是通过缩合反应、碳链延伸和功能修饰进行合成(Wan et al, 2019)。最近, 通过对多列拟菱形藻基因组的分析, 也基本确定了硅藻中软骨藻酸的产毒基因(Brunson et al, 2018)。
1.2.5 有害藻华的观测、预警和防控近年来, 海洋观测技术快速发展, 显著提高了对有害藻华观测的特异性、精细性、实时性和连续性。传统的有害藻华观测主要是通过船舶走航, 现场观测水文、气象等环境要素, 并采集海水样品, 通过显微镜对藻种进行鉴定和计数, 通过化学分析方法对藻毒素和营养盐等化学要素进行分析。近年来, 分子生物学技术和方法的应用极大提高了对藻种的特异性观测能力, 建立了一系列基于荧光原位杂交、三明治杂交、实时定量PCR、基因芯片和高通量测序等技术的有害藻种特异性检测方法, 纳米材料探针、样品磁浓缩分离系统、固相杂交系统、等温扩增技术和杂交链式反应等技术有望进一步提高藻种的检测效率(Medlin et al, 2017)。在藻毒素检测方面, 基于毒素免疫学检测和藻毒素产毒基因检测的方法逐渐成熟, 产出了一系列可用于有毒藻种和藻毒素检测的商业化产品。如用于原核和真核生物群落组成分析的Phylochip芯片, 可以检测微囊藻毒素和石房蛤毒素的Phytoxigene试剂盒, 以及MBio藻毒素检测设备等(Stauffer et al, 2019)。一系列基于藻类形态学、光学和分子生物学特征的原位观测设备, 如多通道荧光光谱仪、环境样品处理器(environmental sample processor)和水下浮游生物影像仪(imaging flow-cytobot)等, 成功应用于缅因湾亚历山大藻藻华和加州近海拟菱形藻藻华的观测和研究。针对薄层观测需求, 研制了高精度采样装置和观测设备(Berdalet et al, 2017a), 水下滑翔机和自主式水下潜器也开始应用于藻华过程观测, 在加州近海拟菱形藻藻华和墨西哥湾短凯伦藻藻华早期来源研究中得到应用。遥感观测和全球ARGO浮标观测网络也将为有害藻华观测提供有力支持。目前, 中国、美国、欧洲、日本和韩国等国家已发射和布局30多个具备水色遥感能力的卫星, 其中, 地球同步卫星的发射(如韩国GOCI系列卫星)和高分辨传感器的使用提高了对有害藻华观测的时空分辨率, 高光谱传感器为区分不同类型的有害藻华提供了有力支持。自1998年开始, 水色遥感数据已连续记录20多年, 可望为分析有害藻华长期演变规律及其与气候变化的关系提供重要数据(Groom et al, 2019)。在浮标观测方面, 全球ARGO浮标观测网络中已布设了近200组生物地球化学浮标(Roemmich et al, 2019), 配备了chl a荧光、溶解氧、pH和硝酸盐等传感器, 有助于对有害藻华发生情况及相关环境要素情况进行长期连续观测。随着对有害藻华形成机理和关键过程的认识不断深入, 对有害藻华的模拟和预测能力也在不断提高, 通过耦合水动力学模型和生态模型, 已经能够对有害藻华的发生发展过程进行预测和预警。特别值得关注的是, 近年来国际社会高度关注有害藻华综合观测预警体系建设(Stauffer et al, 2019), 美国海洋综合观测系统(IOOS)针对墨西哥湾、加州近海和缅因湾等有害藻华多发海域, 针对性地建立了有害藻华监测预警系统。欧洲和东亚国家也在布局构建有害藻华监测预警体系。在对有害藻华监测预警体系的建设中, 一个重要理念是没有“一刀切”式的通用解决方案, 需要针对不同的有害藻华类型, 针对性的建设有害藻华监测预警系统(Anderson et al, 2019)。
不断加剧的有害藻华对人类健康和沿海地区社会经济发展构成了巨大威胁, 已经成为一类典型的生态灾害, 对有害藻华进行治理和减灾成为亟待解决的问题(Gallardo-Rodríguez et al, 2019)。近年来, 针对赤潮和褐潮的改性粘土治理技术不断完善(Yu et al, 2017), 成功应用于中国、美国、秘鲁和智利的赤潮治理。针对大型藻华, 中国在黄海绿潮防控方面进行了有益的探索(颜天等, 2018), 基于对绿潮发展关键过程的认识提出了“三道防线”的绿潮防控策略, 针对形成藻华的大型藻类的开发利用也取得了很好进展。
2 中国近海有害藻华研究现状与进展 2.1 中国近海有害藻华发生状况富营养化和有害藻华是我国近海最突出的生态环境问题之一(苏纪兰, 2001; 周名江等, 2001)。20世纪90年代之前, 我国近海的有害藻华发生次数很少, 规模也比较小, 很少超过几百平方公里。2000年以后, 近海有害藻华发生频率持续上升、影响区域不断扩展。每年记录的赤潮次数都在50—80次, 赤潮面积可达数千甚至上万平方公里, 持续时间可以长达一个月以上。
我国近海有害藻华发生情况具有明显的区域性分布特征(图 3) (Yu et al, 2018; 吕颂辉等, 2019; 梁玉波等, 2019)。渤海海域的有害藻华原因种以甲藻、海金藻、定鞭藻和针胞藻为主, 近年来, 抑食金球藻形成的褐潮是最具代表性的有害藻华事件。在东海海域, 2000年以后, 东海原甲藻和米氏凯伦藻等有毒有害甲藻形成的大规模赤潮是典型的有害藻华现象。在我国东南沿海和广西北部湾海域, 定鞭藻和甲藻是主要有害藻华原因种, 球形棕囊藻(Phaeocystis globosa)赤潮是近20年来主要的有害藻华。在黄海海域, 浒苔(Ulva prolifera)绿潮和铜藻(Sargassum horneri)金潮等大型藻藻华是典型的有害藻华现象。我国近海有毒藻类的分布比较广泛, 但也有一定的区域性特征, 多年调查结果显示, 渤海秦皇岛近岸海域、莱州湾附近海域、北黄海海域、海州湾海域、长江口邻近海域、福建东山附近海域和广东大亚湾等海域, 有毒藻和藻毒素的问题较为突出。
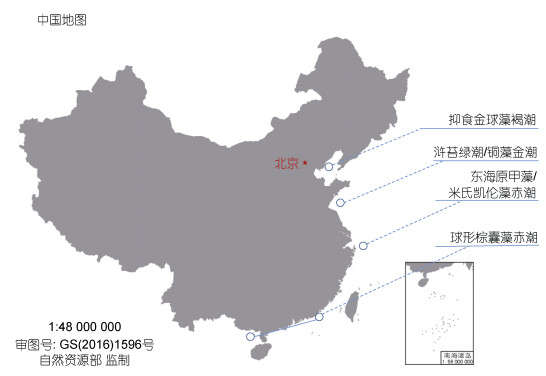 |
| 图 3 我国近海典型有害藻华分布状况 Fig. 3 Distribution of the representative harmful algal blooms in the China Seas |
长期来看, 我国近海有害藻华原因种已呈现出“多样化、小型化和有害化”的演变趋势(Yu et al, 2018)。在2000年之前, 我国近海记录的有害藻华主要是甲藻和硅藻形成的赤潮, 2007年我国首次出现浒苔形成的大规模绿潮, 2009年在渤海首次出现抑食金球藻形成的褐潮, 2016—2017年铜藻形成的金潮在黄海暴发成灾, 有害藻华类型表现出多样化的趋势, 藻华原因种涵盖甲藻、硅藻、绿藻、褐藻、隐藻、定鞭藻、针胞藻、海金藻和蓝细菌等诸多类群(Lu et al, 2014)。有害藻华原因种的小型化趋势非常明显, 褐潮原因种抑食金球藻的细胞大小仅有2—3μm, 球形棕囊藻尽管能够形成肉眼可见的囊状群体, 但其游离细胞大小只有5—8μm, 这些藻类形成的有害藻华对研究和监测工作提出了新的挑战。此外, 近年来有害藻华的发生造成了诸多危害, 不仅影响水产品食品安全, 破坏近海生态, 危害人类健康, 而且对滨海旅游业发展和大型核电设施的安全运行也造成了严重威胁。
2.2 中国近海有害藻华研究历程我国近海有害藻华问题一直备受关注。自20世纪70年代至今, 在科技部、国家自然科学基金委、中国科学院、自然资源部(包括前国家海洋局)、环保部(原国家环保局)和农业部等部门支持下, 围绕我国近海有害藻华的形成机制、危害机理、监测技术和防控对策等方面开展了大量研究工作, 对有害藻华的研究逐渐从现象、过程深入到对其生态学、海洋学机制的探究(周名江等, 2001; 邹景忠, 2004; 齐雨藻等, 2004; 中国海洋学会, 2015), 也为有害藻华防控提供了重要科学支撑。
1977年, 渤海湾海河口发生大规模微小原甲藻(Prorocentrum minimum)赤潮, 对渔业造成严重破坏, 赤潮研究开始受到重视。1978年, 国家环保局设立重大科研项目“渤海、黄海海域污染防治研究”, 中国科学院海洋研究所赤潮课题组承担第145专题“渤海湾赤潮的发生机制及预测方法研究”, 进行了渤海湾富营养化和赤潮问题的调查和研究工作, 我国近海系统的赤潮研究开始起步。
随着赤潮问题的加剧, 国家自然科学基金委员会在1986、1987年先后资助暨南大学和中科院海洋所两项自然科学基金项目的基础上, 启动了“中国东南沿海赤潮发生机理研究(1990—1994)”重大项目, 由暨南大学、国家海洋局南海分局、中国科学院海洋研究所和南海海洋研究所等单位联合承担; 1997年, 基金委再次资助“中国沿海典型增养殖区有害赤潮发生动力学及防治机理研究(1997—2000)”重大项目, 由暨南大学、中国科学院海洋研究所、国家海洋局南海分局和青岛海洋大学(现中国海洋大学)等单位共同承担, 赤潮研究跨入新的阶段, 研究工作从对赤潮现象的跟踪转向对赤潮过程、机理和危害效应的研究, 在甲藻分类与检测方法、甲藻生活史与孢囊、藻毒素分析与甲藻产毒特征、赤潮种群动力学、改性粘土治理赤潮技术等方面取得了突破性进展, 出版了《中国沿海赤潮》和《中国沿海甲藻孢囊与赤潮研究》等专著(齐雨藻等, 2004; 王朝晖, 2007), 相关研究获得了国家教委科技进步奖和海洋局科技进步奖等多项奖励。
2000年以来, 长江口邻近海域暴发大规模甲藻赤潮, 影响海域面积达上万平方千米, 其成因和效应受到高度关注。2001年, 科技部启动国家重点基础研究发展计划项目(973) “我国近海有害赤潮发生的生态学、海洋学机制及预测防治(2002—2006)”, 标志着我国近海有害藻华研究进入了海洋学时代。该项目由中国科学院海洋研究所、南海海洋研究所、国家海洋局一所、二所、暨南大学、青岛海洋大学(中国海洋大学)和厦门大学等单位联合承担, 聚焦东海长江口及其邻近海域大规模甲藻赤潮发生的生态学、海洋学机制, 从赤潮藻种生物学特征与生态策略、富营养化过程对赤潮的诱发和调控作用、关键物理过程的调控作用、有害赤潮的生态效应等角度, 对东海大规模甲藻赤潮的形成机制、危害机理和预测防治开展研究, 获得的成果深化了对长江口邻近海域甲藻赤潮形成的生态学与海洋学机制的认识, 为赤潮监测、预测和赤潮灾害防范提供了重要依据(周名江等, 2003, 2006)。部分研究结果在《应用生态学报》(2003年21卷第7期)出版专刊, 项目成果“我国近海有害赤潮发生的生态学、海洋学机制及预测防治”获山东省科技进步一等奖。
在长江口邻近海域甲藻赤潮连年暴发的同时, 2007年黄海海域出现了浒苔绿潮这一全新的有害藻华现象, 我国近海有害藻华的演变趋势及其生态效应开始受到关注。2010年, 科技部启动973项目“我国近海藻华灾害演变机制与生态安全(2010—2014)”, 支持中国科学院海洋研究所、国家海洋局一所、暨南大学、国家海洋局二所、中国海洋大学、厦门大学、中国水产科学院东海所和国家海洋环境监测中心等高校和研究单位联合开展研究工作。项目选择长江口南北海区作为目标海域, 以富营养化驱动下藻华灾害演变的过程、机制及其生态安全效应为研究核心, 开展生态系统比较和多学科交叉综合研究, 在长江口邻近海域春季藻华演替过程与生物学机制、南黄海浒苔绿潮起源与早期发展过程、长江口邻近海域有害藻华分布格局的关键控制因素、大规模甲藻藻华的生态安全效应以及我国近海藻华演变趋势与防范对策等方面取得了重要进展(Zhou et al, 2015)。在《Chinese Journal of Oceanology and Limnology》(2011年29卷第4期)出版了“Eutrophication and HABs”专刊, 在《Estuarine coastal and Shelf Science》(2015年163(A)卷)出版了“Green tides in the Yellow Sea”专刊, “黄海大规模浒苔绿潮起源与发生机制”获2017年度海洋科学技术奖特等奖。
2013年, 中国科学院启动海洋先导专项“热带西太平洋海洋系统物质能量交换及其影响”研究, 以热带西太平洋为重点, 开展海气相互作用、近海环境安全与生态系统演变、深海极端环境与生命综合研究(孙松等, 2017), 其中有害藻华研究是近海部分核心内容之一。经过多年研究, 综合多学科证据发现了黑潮入侵东海近岸底部分支(NKBC)是影响东海近岸海域的关键途径, 阐释了NKBC不同时空尺度的变化特征(杨德周等, 2017); 计算了NKBC对氮、磷生源要素的输送通量; 探讨了NKBC向长江口邻近海域赤潮区的藻种输送作用, 揭示了黑潮分支入侵和长江冲淡水输入对长江口邻近海域有害藻华的不同影响(于仁成等, 2017); 推动了改性粘土治理赤潮技术发展和推广应用, 在渤海抑食金球藻褐潮和北部湾球形棕囊藻赤潮治理中发挥了重要作用(俞志明等, 2019)。
2016年起, 青岛海洋科学与技术试点国家实验室设置鳌山科技计划项目“近海生态灾害发生机理与防控策略”, 组织了中国科学院海洋研究所、中国海洋大学和国家海洋局第一海洋研究所等8家单位, 重点针对黄海绿潮等生态灾害问题开展联合攻关。在绿潮研究方面, 通过对“漂浮生态型”浒苔的鉴定和分析, 进一步确认了黄海绿潮源自苏北浅滩海域, 分析了绿潮北侵的风险; 基于对2017年苏北浅滩区浒苔微观繁殖体、定生绿藻和漂浮绿藻的调查, 成功预测了黄海绿潮规模的显著变化; 2018年, 基于对绿潮发展关键过程的认识, 提出了设置“三道防线”防控绿潮的建议, 为青岛上合峰会召开提供了保障; 对黄海铜藻形成的金潮进行了初步研究, 揭示了黄海海域藻华灾害的多样化趋势(颜天等, 2018)。就黄海绿潮研究取得的部分结果, 项目在《海洋与湖沼》(2018年49卷第5期)出版了专刊。
“十三五”期间, 科技部通过设立“海洋环境安全保障”重大专项, 对我国近海几类典型有害藻华问题开展专题研究。2016年, 科技部支持自然资源部一所牵头承担“浒苔绿潮形成机理与综合防控技术研究及应用”项目, 研究黄海浒苔绿潮起源、形成机制、暴发过程和迁移规律, 发展浒苔绿潮立体监测和预警预报技术, 研发浒苔绿潮应急处置和高效资源化利用技术, 形成浒苔绿潮早期防控和综合治理对策(王宗灵等, 2018)。2017年, 启动中国科学院海洋研究所牵头的“我国近海致灾赤潮形成机理、监测预测及评估防治技术”项目, 以大规模球形棕囊藻赤潮和米氏凯伦藻赤潮为对象, 围绕其发生机理、演变规律、毒素污染、早期诊断、预警预报和防控示范等方面开展全链条研究, 解析典型致灾赤潮生态学过程、演变规律和分子调控机理, 研发赤潮生物和典型藻毒素的快速检测产品, 推动赤潮早期预警、风险评估和预测预报, 推动特效改性粘土材料及其配套装备研发和推广应用(俞志明等, 2019)。2019年, 依托燕山大学, 由暨南大学牵头承担的项目“秦皇岛海域生态灾害多发原因及监测预警系统研究”启动, 对赤潮、绿潮和水母等秦皇岛近海典型生态灾害问题开展研究。同时, 科技部于2018年启动了由中国科学院海洋研究所牵头的科技基础资源调查专项“我国近海有毒有害藻类与藻毒素调查及开放数据库构建”项目, 旨在厘清我国近海有毒有害藻种与藻毒素的总体分布状况, 为有害藻华监测防控提供基础数据。目前, 这些项目都在进行之中。
2.3 中国近海有害藻华研究进展四十年来, 中国近海有害藻华研究获得长足发展, 取得了一系列研究成果。本文从有害藻华原因种基础生物学研究、有害藻华生态学与海洋学研究、近海有毒藻和藻毒素研究、有害藻华监测与治理研究等四个方面对主要研究进展进行了总结和分析。
2.3.1 有害藻华原因种基础生物学研究根据对文献的总结和分析, 2000之前我国近海共记录151种赤潮原因种, 其中46种有形成赤潮的记录(邹景忠, 2004)。近20年来, 随着分子生物学研究方法和手段的应用, 进一步提高了对我国近海有害藻种多样性的认识。在以往研究较少的致灾甲藻和底栖性甲藻, 以及个体较小、形态分类困难的海金藻、裸甲藻和拟菱形藻的鉴定、分类和多样性研究方面取得突破, 订正了东海大规模甲藻赤潮肇事种的错误命名(Lu et al, 2001), 发现了许多有害藻华新记录种甚至新种(Lu et al, 2014)。如渤海海域抑食金球藻形成的褐潮, 在我国是首次报道(Kong et al, 2012; Zhang et al, 2012)。在中国近海发现了能够产生氮杂螺环酸的腹孔环胺藻(Azadinium poporum), 并命名两个新种大连环胺藻(A. dalianense)和朱氏环胺藻(A. zhuanum) (Luo et al, 2013, 2017a)。在甲藻凯伦藻科中, 新记录了长沟凯伦藻(Karenia longicanali)、K. papilionacea、指状凯伦藻(K. digitata, 近来研究建议修定为Karlodinium digitatum)、厦门塔卡藻(Takayama xiamenensis)、剧毒卡尔藻(Karlodinium veneficum)、南方卡尔藻(Karlodinium australe)等藻种, 新发现的一个卡尔藻属新种被命名为周氏卡尔藻(Karlodinium zhouanum) (Gu et al, 2013b; Lu et al, 2014; Luo et al, 2018)。在底栖甲藻方面, 发现了库利亚藻属(如Coolia canariensis, C. malayensis, C. palmyrensis)、福氏藻属(如Fukuyoa ruetzleri), 冈比亚藻属(如Gambierdiscus pacificus, G. australes, G. caribaeus)、蛎甲藻属(如Ostreopsis cf. ovate, O. lenticularis), 原甲藻属(如Prorocentrum caipirignum, P. hoffinannianum, P. lima, P. rhathymum)等多个新纪录种(Zhang et al, 2015a, 2016, 2018a; Leung et al, 2018; Luo et al, 2018; 梁玉波等, 2019)。对拟菱形藻的研究发现了伪装拟菱形藻(Pseudo-nitzschia simulans)和南澳拟菱形藻(P. nanaoensis)等两个新种, 以及尖细拟菱形藻(P. cuspidata)、并基拟菱形藻(P. decipiens)、伪善拟菱形藻(P. fraudulenta)、福氏拟菱形藻(P. fukuyoi)、伪柔弱拟菱形藻(P. pseudodelicatissima)、镰刀拟菱形藻(P. sabit)、中鼓拟菱形藻(P. inflatula)等新纪录种, 其中伪装拟菱形藻、尖细拟菱形藻、伪柔弱拟菱形藻、福氏拟菱形藻、伪善拟菱形藻等能够产生软骨藻酸(Li et al, 2017, 2018)。
组学技术和方法近年来在我国近海有害藻华研究中的应用也越来越深入。在基因组学方面, 对寄生性甲藻(Symbiodinium kawagutii)基因组的测序深化了对甲藻基因表达调控的认识(Lin et al, 2015)。应用转录组手段, 对东海原甲藻、抑食金球藻、赤潮异弯藻(Heterosigma akashiwo)和浒苔等有害藻华原因种进行了研究, 解析了这些藻对氮、磷营养物质的吸收和同化过程, 以及有性生殖和减数分裂过程中的基因表达情况(Dong et al, 2014; Zhang et al, 2019b; )。通过蛋白质组学手段分析了东海原甲藻和亚历山大藻细胞周期不同阶段中蛋白质合成情况, 以及细胞周期调控和毒素合成等生物学过程的变化(Zhang et al, 2018c)。近年来, 环境组学手段逐渐应用于有害藻华现场研究, 例如, 将特定靶区的高通量扩增测序用于解析褐潮过程中真核藻类群落的变化, 以及沉积物中甲藻孢囊多样性的分析(Chen et al, 2019; Gao et al, 2019); 将宏转录组技术应用于东海原甲藻、赤潮异弯藻以及抑食金球藻藻华形成过程中基因表达情况的变化, 分析了现场条件下藻华原因种的适应策略以及不同浮游植物类群响应情况的差异(Ji et al, 2018; Xu et al, 2020); 应用宏蛋白组学手段研究了东海原甲藻赤潮过程中细胞周期调控与藻种生理过程的变化等(Zhang et al, 2019a)。
2.3.2 有害藻华生态学与海洋学研究在我国近海, 大规模藻华不断出现且连年暴发, 针对这些藻华的研究, 为深入解析有害藻华形成的生态学与海洋学机制提供了重要案例。其中, 对长江口邻近海域大规模甲藻赤潮和黄海海域大规模绿潮的研究最为系统, 近期在渤海褐潮和北部湾球形棕囊藻赤潮的研究也有重要进展。
长江口邻近海域甲藻赤潮的主要原因种是东海原甲藻和米氏凯伦藻等甲藻, 近20年来的研究较为系统地揭示了长江口及其邻近海域东海原甲藻赤潮的生态学和海洋学过程和机理(周名江等, 2006)。研究表明, 长江输入的丰富营养盐是甲藻赤潮形成的重要物质基础(Zhou et al, 2008; Li et al, 2014)。东海原甲藻自身生长速率较高, 具有垂直迁移能力, 可以利用有机态营养物质, 能够适应长江口邻近海域的富营养化特征而形成赤潮(李英等, 2005; Ou et al, 2008)。水温上升、水体层化、上升流加强、磷酸盐胁迫及浮游动物摄食压力降低等是促成甲藻赤潮形成的重要因素, 而硝酸盐浓度降低和水温过高则是导致甲藻赤潮衰退的重要原因(周名江等, 2006)。大规模暴发的甲藻赤潮不仅对海洋生物具有毒害效应, 也严重威胁海洋生态安全(Yan et al, 2003; Lin et al, 2014)。长期来看, 长江口邻近海域有害藻华优势类群由硅藻逐渐转变为甲藻, 长期演变过程与硅、甲藻藻华的季节性演替密切相关(Zhou et al, 2008; Zhou et al, 2017a), 在一定程度上反映了硅藻和甲藻的竞争策略及其对海域环境适应性的差别(Zhou et al, 2017b, c)。营养盐浓度和结构的变化, 是导致甲藻赤潮大规模暴发及有害藻华优势类群由硅藻向甲藻演变的主要原因。除了藻华优势类群的演变之外, 长江口邻近海域的有害藻华还表现出明显的年际变异特征。近年来的研究指出, 来自台湾东北部黑潮次表层水的入侵, 有可能通过藻种输送、触发孢囊萌发和营养盐输送等多种途径调控甲藻赤潮的形成和发展过程, 影响甲藻赤潮的年际变化(Dai et al, 2013; 于仁成等, 2017)。
黄海浒苔绿潮从2007年刚刚出现就受到密切关注, 10年来的研究揭示了绿潮来源、关键过程和潜在的生态效应(Sun et al, 2008; Keesing et al, 2011; Liu et al, 2013; Wang et al, 2015b; Zhou et al, 2015; 王宗灵等, 2018; 于仁成等, 2018; Zhang et al, 2019c)。大量野外调查、遥感分析、数值模拟和分子生物学证据表明, 黄海海域漂浮绿藻最初出现在苏北浅滩附近海区, 与浅滩区大规模紫菜养殖密切相关(Liu et al, 2009; Wang et al, 2015b; Huo et al, 2016; Zhang et al, 2018b)。春季浅滩区养殖筏架上生长的浒苔为绿潮形成提供了数量可观的种源(Liu et al, 2010; Zhang et al, 2015b), 脱落的绿藻在浅滩区漂浮、生长, 并在夏季风和潮流驱动下离开苏北浅滩, 在南黄海形成大规模绿潮(Bao et al, 2015)。黄海大规模绿潮的形成有几方面原因(于仁成等, 2018):首先, 浒苔复杂的生活史和多样化的繁殖方式、快速生长能力和叶状体形态的可塑性等, 使其适合于在海水中漂浮生长; 其次, 苏北浅滩区高浊度水体、强扰动潮流和丰富的营养盐等环境特征, 对浮游植物生长不利, 却有利于漂浮绿藻的快速生长; 最后, 筏架养殖活动显著改变了浅滩区生境, 为浒苔生长提供了重要的附着基, 对绿潮早期发展起到了“放大器”和“转换器”的作用(Zhou et al, 2015)。这些因素综合作用, 导致了黄海绿潮的形成。绿潮后期死亡藻类的腐烂分解会产生大量营养物质和氨氮、硫化氢等有害物质, 可以预见, 大规模绿潮的连年暴发会对黄海海域生态环境造成威胁。近年来的研究发现, 绿潮后期大量漂浮绿藻主要沉降在山东半岛东南部海域(Geng et al, 2019), 其长期生态效应值得关注。
除以上两类有害藻华之外, 我国近海近年来还出现了抑食金球藻褐潮、球形棕囊藻赤潮及马尾藻金潮等大规模有害藻华现象。渤海褐潮从2009年开始出现, 多年研究表明, 抑食金球藻褐潮通常在5—7月份左右大规模出现, 但有明显的年际变化(Chen et al, 2019; Yao et al, 2019)。秦皇岛近岸海域溶解有机氮污染和扇贝养殖业是褐潮形成的重要原因之一(Ou et al, 2018; Yao et al, 2019)。针对抑食金球藻种群的检测发现, 褐潮主要在近岸水体暴发, 但在褐潮形成前后, 抑食金球藻主要出现在离岸较远的底层水体中(Zhang et al, 2020)。基于对沉积物中抑食金球藻DNA的检测, 推测抑食金球藻存在休眠体阶段, 已在渤海海域长期存在, 从一个角度否证了褐潮可能来自外来种入侵的猜想(Tang et al, 2019)。目前, 对于我国近海褐潮起源、分布和动态的认识仍有许多空白, 有待继续深入研究。南海海域的球形棕囊藻赤潮在20世纪90年代末开始出现, 国内针对球形棕囊藻的生物特征开展了大量研究, 解析了球形棕囊藻的生长和营养盐的吸收利用状况, 探讨了温度、营养盐和摄食压力等对囊体形成的影响, 分析了棕囊藻产生溶血毒素情况及其毒性效应(Wang et al, 2015; Xu et al, 2017; 沈萍萍等, 2018), 近几年在球形棕囊藻赤潮的生态学和海洋学方面也开展了比较系统的研究, 随着有关专项研究的深入, 可望会有新的认识突破。针对我国黄、东海海域的马尾藻金潮, 已开展的分子生物学研究发现漂浮马尾藻具有遗传多态性(Liu et al, 2018), 遥感分析结果显示, 2016年冬季大规模金潮暴发期间, 南黄海的漂浮马尾藻是由北向南输送(Xing et al, 2017; Liu et al, 2018), 有别于春季漂浮马尾藻的漂移轨迹。目前对金潮的研究工作仍非常有限, 还难以对其生态学和海洋学过程进行系统解释。
2.3.3 有毒藻和藻毒素研究对我国近海有毒藻和藻毒素的系统性研究始于20世纪90年代末, 近年来已有文献对我国近海有毒藻和藻毒素研究进行了梳理和总结(于仁成等, 2016; 梁玉波等, 2019)。
麻痹性贝类毒素是我国近海最重要的一类藻毒素。多年来调查结果表明, 广东沿海、福建沿海、长江口邻近海域、海州湾、北黄海和河北秦皇岛近岸海域麻痹性贝毒问题较为突出。亚历山大藻和链状裸甲藻是我国近海麻痹性贝类毒素的主要来源, 目前已经对链状亚历山大藻、太平洋亚历山大藻、微小亚历山大藻(Alexandrium minutum)、奥氏亚历山大藻(A. ostenfeldii)和链状裸甲藻等典型有毒藻种的毒素产生情况进行了分析(Gu, 2011; Gu et al, 2013a; Zou et al, 2014)。我国近海主要的亚历山大藻藻华原因种链状亚历山大藻和太平洋亚历山大藻虽同属于塔玛亚历山大藻复合种, 但在种群空间分布上具有明显隔离现象, 链状亚历山大藻主要分布在渤海和黄海, 而太平洋亚历山大藻主要分布在东海和南海(Gao et al, 2015a, b)。微小亚历山大藻主要分布在近岸海域, 现有的几株微小亚历山大藻均分离自台湾和江苏的近岸动物养殖池塘。链状裸甲藻在福建近海曾多次导致中毒事件, 根据对渤海浮游植物中藻毒素组成与含量的分析, 莱州湾附近海域也有链状裸甲藻相关的毒素成分(Liu et al, 2017), 需要特别关注。
近年来液-质联用技术的应用提高了对我国近海脂溶性藻毒素组成、分布和来源的认识。在我国近海的贝类和浮游植物样品中, 大田软海绵酸和鳍藻毒素(dinophysis toxins)、扇贝毒素、虾夷扇贝毒素是常见的脂溶性毒素成分, 氮杂螺环酸和环亚胺类毒素也偶有检出(Wu et al, 2018, 2019)。大田软海绵酸、鳍藻毒素和扇贝毒素通常由鳍藻属和原甲藻属中的有毒藻种产生。由于鳍藻属藻种难以室内培养, 通过挑取野外样品中的鳍藻细胞进行毒素分析, 已在我国近海渐尖鳍藻(Dinophysis acuminata)、倒卵形鳍藻(D. fortii)、具尾鳍藻(D. caudata)和圆形鳍藻(D. rotundata)等藻种中检出了大田软海绵酸、鳍藻毒素和扇贝毒素(罗璇等, 2014; Li et al, 2015)。通过分离培养藻株, 在利玛原甲藻(Prorocentrum lima)等多种底栖性原甲藻中也检测到了大田软海绵酸等毒素成分(Luo et al, 2017b; 梁玉波等, 2019)。对于虾夷扇贝毒素而言, 网状原角藻(Protoceratium reticulatum)是我国近海的主要产毒藻种, 近期研究发现我国近海的网状原角藻分属两个不同的核糖体型, 在产毒特征上也有明显差异(Wang et al, 2019b)。对于能够产生氮杂螺环类酸的有毒藻, 在我国近海已分离到腹孔环胺藻(Azadinium poporum)。目前在中国近海检测到的AZA2, 11, 36, 40, 41和42等毒素成分, 除AZA2之外, 其他都是腹孔环胺藻特有的毒素成分, 表明腹孔环胺藻可能是我国近海AZA毒素的重要来源(Krock et al, 2019)。螺环内脂毒素(spirolides)是由奥氏亚历山大藻产生的一类脂溶性毒素, 属于环亚胺类, 在我国近海分离的奥氏亚历山大藻能够产生螺环内脂毒素(Gu, 2011)。另外一类环亚胺毒素GYM(gymnodimine)在我国近海许多海域都有检出, 但通常含量较低, 其毒素来源尚不清楚。最近在我国近海分离到许多能够产生西加鱼毒素和海葵毒素的底栖性有毒甲藻, 但对其产毒状况的认识仍相对较少。
我国近海软骨藻酸及其产毒藻的研究最近取得重要突破, 已在中国近海分离到伪装拟菱形藻等多种有毒硅藻(Li et al, 2017), 在大亚湾海域的调查中也检测到了软骨藻酸的存在(Jiang et al, 2017)。目前来看, 软骨藻酸毒素和产毒藻主要分布在南海海域, 对其他海域的调查仍在进行之中。
2.3.4 有害藻华监测与治理研究针对我国近海有害藻华暴发成灾的问题, 国内学者开展了大量研究, 尝试发展有害藻华的监测、预警体系, 研发有害藻华治理技术, 推动有害藻华的防控工作。在有害藻华监测预警技术方面, 国内学者针对亚历山大藻、东海原甲藻、米氏凯伦藻、剧毒卡尔藻和抑食金球藻等有毒有害藻种, 应用荧光原位杂交、三明治杂交、肽核酸探针、qPCR、环介导等温扩增和超支化滚环扩增等技术, 建立了特异性的检测方法(林森杰等, 2019), 提高了对藻华原因种的鉴定和计数能力, 以及对藻种生物地理分布和藻华动态过程的认识。遥感方法在追踪绿潮和金潮等大型藻藻华的来源、分布和动态过程方面发挥了重要作用(Liu et al, 2009; Xing et al, 2017)。数值模型在有害藻华预警和灾害评估方面得到了一定应用(谢宏英等, 2019)。但与国际上同类研究相比, 在有害藻华原位观测和综合观测技术方面仍严重滞后。在有害藻华治理技术方面, 从物理、化学和生物学等许多途径开展了有害藻华治理的尝试, 在改性粘土治理赤潮的技术和应用方面取得了重要突破(Yu et al, 2017; 俞志明等, 2019)。改性粘土治理赤潮技术基于对粘土絮凝作用机理的认知, 通过吸附、插入等方法对粘土颗粒形状、表面电性等性状进行改良, 提高粘土材料絮凝赤潮生物的效率。近年来, 基于分子生物学研究进一步解析了改性粘土材料对藻类生长、繁殖和毒性的影响。2005年以后, 改性粘土赤潮治理技术多次成功应用于我国近海赤潮治理, 已经成为我国近海赤潮应急处置的常用方法并已向国外推广。2019年, “近海赤潮灾害应急处置关键技术与方法”获得国家技术发明二等奖。
经过多年建设, 国内已经形成了一支有害藻华研究的高水平团队, 与国际上有害藻华研究保持着紧密的合作关系, 产出了一系列重要成果。从国际上有害藻华领域(包括淡水和海水中的有害藻华)发表的学术论文来看, 中国位列第二, 仅次于美国(图 4)。在有害藻种分类学与多样性研究、基因组学与蛋白质组学研究、有毒藻与藻毒素研究等领域居于世界前列, 973项目“我国近海有害赤潮发生的生态学、海洋学机制及预测防治”作为区域与国家赤潮研究项目被列入GEOHAB计划执行计划, 长江口邻近海域东海原甲藻赤潮的生态学和海洋学研究成为国际上有害藻华研究的典型范例, 研发的改性粘土产品在美国、智利和秘鲁等国家的赤潮治理中得到应用, 我国有害藻华研究的国际地位和影响力在不断提升。国内学者也积极参与有害藻华领域的国际合作, 周名江曾任国际有害藻类研究学会(ISSHA)副主席, 朱明远曾任IOC赤潮工作小组副主席, 齐雨藻曾任SCOR第97(有害藻华生理学及生态学)和129(海洋浮游藻类及全球气候调节:以棕囊藻为模型)工作组正式成员, 陆斗定曾任北太平洋科学组织(PICES)赤潮生态学委员会共同主席, 张经、周名江、吕颂辉先后担任GEOHAB计划科学指导委员会成员, 殷克东担任GlobalHAB计划科学指导委员会成员。周名江等倡导发起了“东亚有害藻华研讨会(EASTHAB)”, 成功组织了GEOHAB计划富营养化与有害藻华核心计划开放科学大会和有害藻类国际大会。
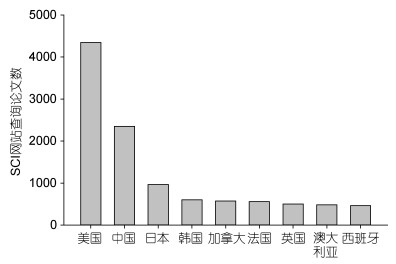 |
| 图 4 近70年来世界各国在有害藻华研究领域发表论文情况 Fig. 4 Publications on harmful algal blooms around the world 注:数据源于Web of Science https://apps.webofknowledge.com, 1950—2020年 |
进入2000年以来, 我国近海生态环境发生显著变化, 有害藻华的类型、规模、分布和危害出现巨大改变, 绿潮、褐潮、金潮等新的有害藻华现象不断出现, 藻华规模动辄达到数千到上万平方公里, 对沿海地区社会经济发展和人类健康的影响越来越突出。在全球变化和人类活动的共同作用下, 我国近海有害藻华暴发成灾的问题在短期内恐难以根除。针对我国近海的有害藻华问题, 有必要加强以下方面的工作:
(1) 加强对有害藻华形成及演变机理的研究。推动多组学研究手段、仪器分析技术和数值模拟方法在有害藻华研究领域的应用, 提高对我国近海藻华原因种多样性状况、藻种适应策略、藻华成因与演变趋势、藻华灾害的危害途径与机制的认识。
(2) 高度关注全球变化和人类活动影响对我国近海有害藻华的影响。我国近海大部分海域属于半封闭陆架浅海, 受全球变暖影响显著, 也容易出现富营养化问题。同时, 厄尔尼诺和拉尼娜等极端气候事件有可能显著改变我国近海环流及其对藻种和营养盐的输送状况, 从而间接影响有害藻华的分布、动态甚至危害效应, 目前在这一方面的认识有限, 需要更加深入的研究工作。
(3) 推动有害藻华监测预警体系建设。针对不同海域的有害藻华问题, 有针对性的建设有害藻华监测预警平台, 推动原位观测和遥感观测在有害藻华监测中的应用, 提高观测的实时性和连续性, 充分发挥数值模拟和大数据分析手段在有害藻华预测预警中的作用, 打造我国近海有害藻华的监测预警体系。
(4) 持续提高对藻华灾害的防控能力。近海不断出现的有害藻华现象, 对海水养殖业、人类健康、旅游景观、生态安全, 乃至沿海大型设施的安全运行构成严重威胁, 亟需有效的控制技术和应对策略, 要针对我国近海环境的改变, 从富营养化控制和生境保护等不同角度, 减少有害藻华事件, 防范有害藻华的危害效应。
(5) 积极参与有害藻华领域国际合作。国际社会高度关注海洋对全球可持续发展的影响, 联合国将海洋与海洋资源的保护和可持续利用列入可持续发展目标(SDG14), 正在组织实施“海洋科学促进可持续发展国际十年(2021-2030)”计划, 旨在扭转海洋健康衰退趋势并召集全球海洋利益相关方形成共同框架。其中, 有害藻华问题是“海洋科学十年计划”中重点关注的海洋生态环境问题之一, 需要沿海国家加强合作, 共同应对有害藻华问题。
于仁成, 孙松, 颜天, 等. 2018. 黄海绿潮研究:回顾与展望. 海洋与湖沼, 49(5): 942-949 |
于仁成, 张清春, 孔凡洲, 等. 2017. 长江口及其邻近海域有害藻华的发生情况、危害效应与演变趋势. 海洋与湖沼, 48(6): 1178-1186 |
于仁成, 罗璇. 2016. 我国近海有毒藻和藻毒素问题的研究现状与展望. 海洋科学集刊, (51): 155-166 DOI:10.12036/hykxjk20160726001 |
王宗灵, 傅明珠, 肖洁, 等. 2018. 黄海浒苔绿潮研究进展. 海洋学报, 40(2): 1-13 |
王朝晖. 2007. 中国沿海甲藻孢囊与赤潮研究. 北京: 海洋出版社, 211
|
中国海洋学会. 2015. 中国海洋学学科史. 北京: 中国科学技术出版社, 297
|
吕颂辉, 岑竞仪, 王建艳, 等. 2019. 我国近海米氏凯伦藻(Karenia mikimotoi)藻华发生概况、危害及其生态学机制. 海洋与湖沼, 50(3): 487-494 |
齐雨藻, 邹景忠, 梁松. 2004. 中国沿海赤潮. 北京: 科学出版社, 356
|
孙松, 孙晓霞. 2017. 热带西太平洋海洋系统物质能量交换及其影响——中国科学院海洋先导专项介绍. 海洋与湖沼, 48(6): 1127-1131 |
苏纪兰. 2001. 中国的赤潮研究. 中国科学院院刊, 16(5): 339-342 DOI:10.3969/j.issn.1000-3045.2001.05.006 |
李英, 吕颂辉, 徐宁, 等. 2005. 东海原甲藻对不同磷源的利用特征. 生态科学, 24(4): 314-317, 321 DOI:10.3969/j.issn.1008-8873.2005.04.005 |
杨德周, 尹宝树, 侯一筠, 等. 2017. 黑潮入侵东海陆架途径及其影响研究进展. 海洋与湖沼, 48(6): 1196-1207 |
邹景忠. 2004. 海洋环境科学. 济南: 山东教育出版社, 401
|
沈萍萍, 齐雨藻, 欧林坚. 2018. 中国沿海球形棕囊藻(Phaeocystis globosa)的分类、分布及其藻华. 海洋科学, 42(10): 146-162 DOI:10.11759/hykx20171225004 |
林森杰, 姬南京, 罗昊. 2019. 海洋有害藻华研究进展. 海洋与湖沼, 50(3): 495-510 |
罗璇, 于仁成, 周名江. 2014. 应用LC-MS联用方法分析青岛近海渐尖鳍藻(Dinophysis acuminata)细胞中的毒素成分. 海洋环境科学, 33(5): 781-787 |
周名江, 朱明远. 2003. 我国近海有害赤潮发生的生态学、海洋学机制及预测防治研究. 应用生态学报, (7): 1029 |
周名江, 朱明远. 2006. "我国近海有害赤潮发生的生态学、海洋学机制及预测防治"研究进展. 地球科学进展, 21(7): 673-679 DOI:10.3321/j.issn:1001-8166.2006.07.003 |
周名江, 朱明远, 张经. 2001. 中国赤潮的发生趋势和研究进展. 生命科学, 13(2): 54-59, 53 DOI:10.3969/j.issn.1004-0374.2001.02.002 |
俞志明, 陈楠生. 2019. 国内外赤潮的发展趋势与研究热点. 海洋与湖沼, 50(3): 474-486 |
梁玉波, 李冬梅, 姚敬元, 等. 2019. 中国近海藻毒素及有毒微藻产毒原因种调查研究进展. 海洋与湖沼, 50(3): 511-524 |
谢宏英, 王金辉, 马祖友, 等. 2019. 赤潮灾害的研究进展. 海洋环境科学, 38(3): 482-488 |
颜天, 于仁成, 周名江, 等. 2018. 黄海海域大规模绿潮成因与应对策略——"鳌山计划"研究进展. 海洋与湖沼, 49(5): 950-958 |
Adl S M, Bass D, Lane C E et al, 2019. Revisions to the classification, nomenclature, and diversity of eukaryotes. Journal of Eukaryotic Microbiology, 66(1): 4-119 |
Anderson D M, 1989. Toxic algal blooms and red tides: a global perspective. In: Okaichi T, Anderson D M, Nemoto T eds. Red Tides: Biology, Environmental Science and Toxicology. New York: Elsevier, 11-16
|
Anderson D M, Alpermann T J, Cembella A D et al, 2012a. The globally distributed genus Alexandrium:Multifaceted roles in marine ecosystems and impacts on human health. Harmful Algae, 14: 10-35 DOI:10.1016/j.hal.2011.10.012 |
Anderson C R, Berdalet E, Kudela R M et al, 2019. Scaling up from regional case studies to a global harmful algal bloom observing system. Frontier Marine Science, 6: 250 DOI:10.3389/fmars.2019.00250 |
Anderson D M, Cembella A D, Hallegraeff G M, 2012b. Progress in understanding harmful algal blooms:paradigm shifts and new technologies for research, monitoring, and management. Annual Review Marine Science, 4: 143-176 DOI:10.1146/annurev-marine-120308-081121 |
Anderson D M, Glibert P M, Burkholder J M, 2002. Harmful algal blooms and eutrophication:nutrient sources, composition, and consequences. Estuaries, 25(4): 704-726 DOI:10.1007/BF02804901 |
Anderson D M, McGillicuddy D J, DeGrasse S L et al, 2014. Harmful algae in the Gulf of Maine:Oceanography, population dynamics, and toxin transfer in the food web. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 103: 1-376 DOI:10.1016/j.dsr2.2014.02.007 |
Bao M, Guan W B, Yang Y et al, 2015. Drifting trajectories of green algae in the western Yellow Sea during the spring and summer of 2012. Estuarine, Coastal and Shelf Science, 163: 9-16 DOI:10.1016/j.ecss.2015.02.009 |
Bates S S, Hubbard K A, Lundholm N et al, 2018. Pseudo-nitzschia, Nitzschia, and domoic acid:New research since 2011. Harmful Algae, 79: 3-43 DOI:10.1016/j.hal.2018.06.001 |
Berdalet E, Fleming L E, Gowen R et al, 2016. Marine Harmful Algal Blooms, human health and wellbeing:challenges and opportunities in the 21st century. Journal of the Marine Biological Association of the United Kingdom, 96(S1): 61-91 |
Berdalet E, Montresor M, Reguera B et al, 2017a. Harmful algal blooms in fjords, coastal embayments, and stratified systems:Recent progress and future research. Oceanography, 30(1): 46-57 DOI:10.5670/oceanog.2017.109 |
Berdalet E, Tester P A, Chinain M et al, 2017b. Harmful algal blooms in benthic systems:Recent progress and future research. Oceanography, 30(1): 36-45 DOI:10.5670/oceanog.2017.108 |
Beusen A H W, Slomp C P, Bouwman A F, 2013. Global land-ocean linkage:direct inputs of nitrogen to coastal waters via submarine groundwater discharge. Environmental Research Letters, 8(3): 034035 DOI:10.1088/1748-9326/8/3/034035 |
Bi Y L, Wang F Z, Zhang W W, 2019. Omics analysis for dinoflagellates biology research. Microorganisms, 7(9): 288 DOI:10.3390/microorganisms7090288 |
Brown A R, Lilley M, Shutler J et al, 2019. Assessing risks and mitigating impacts of harmful algal blooms on mariculture and marine fisheries. Reviews in Aquaculture DOI:10.1111/raq.12403 |
Brunson J K, McKinnie S M K, Chekan J R et al, 2018. Biosynthesis of the neurotoxin domoic acid in a bloom-forming diatom. Science, 361(6409): 1356-1358 DOI:10.1126/science.aau0382 |
Burki F, Roger A J, Brown M W et al, 2020. The new tree of eukaryotes. Trends in Ecology & Evolution, 35(1): 43-55 |
Campbell K, McNamee S E, Huet A C et al, 2014. Evolving to the optoelectronic mouse for phycotoxin analysis in shellfish. Analytical and Bioanalytical Chemistry, 406(27): 6867-6881 DOI:10.1007/s00216-014-8156-2 |
Chen Z F, Zhang Q C, Kong F Z et al, 2019. Resolving phytoplankton taxa based on high-throughput sequencing during brown tides in the Bohai Sea, China. Harmful Algae, 84: 127-138 DOI:10.1016/j.hal.2019.03.011 |
Dai X F, Lu D D, Guan W B et al, 2013. The correlation between Prorocentrum donghaiense blooms and the Taiwan Warm Current in the East China Sea-evidence for the "Pelagic Seed Bank" hypothesis. PLoS One, 8(5): e64188 DOI:10.1371/journal.pone.0064188 |
Dong H P, Huang K X, Wang H L et al, 2014. Understanding strategy of nitrate and urea assimilation in a Chinese strain of Aureococcus anophagefferens through RNA-Seq Analysis. PLoS One, 9(10): e111069 DOI:10.1371/journal.pone.0111069 |
Farabegoli F, Blanco L, Rodríguez L P et al, 2018. Phycotoxins in marine shellfish:Origin, occurrence and effects on humans. Marine Drugs, 16(6): 188 DOI:10.3390/md16060188 |
Fraga S, Sampedro N, Larsen J et al, 2015. Arguments against the proposal 2302 by John & al. to reject the name Gonyaulax catenella (Alexandrium catenella). Taxon, 64(3): 634-635 DOI:10.12705/643.15 |
Gallardo-Rodríguez J J, Astuya-Villalón A, Llanos-Rivera A et al, 2019. A critical review on control methods for harmful algal blooms. Reviews in Aquaculture, 11(3): 661-684 |
Gao Y C, Dong Y H, Li H T et al, 2019. Influence of environmental factors on spatial-temporal distribution patterns of dinoflagellate cyst communities in the South China Sea. Marine Biodiversity, 49(2): 769-781 DOI:10.1007/s12526-018-0850-4 |
Gao Y, Yu R C, Chen J H et al, 2015a. Distribution of Alexandrium fundyense and A. pacificum (Dinophyceae) in the Yellow Sea and Bohai Sea. Marine Pollution Bulletin, 96(1-2): 210-219 DOI:10.1016/j.marpolbul.2015.05.025 |
Gao Y, Yu R C, Murray S A et al, 2015b. High specificity of a quantitative PCR assay targeting a saxitoxin gene for monitoring toxic algae associated with paralytic shellfish toxins in the Yellow Sea. Applied and Environmental Microbiology, 81(20): 6973-6981 DOI:10.1128/AEM.00417-15 |
Geng H X, Yu R C, Zhang Q C et al, 2019. Tracing the settlement region of massive floating green algae in the Yellow Sea. Journal of Oceanology and Limnology, 37(5): 1555-1565 DOI:10.1007/s00343-019-8348-x |
GEOHAB, 2001. Global ecology and oceanography of harmful algal blooms, science plan. Baltimore and Paris: SCOR and IOC, 87
|
Gladyshev M I, Gubelit Y I, 2019. Green tides:new consequences of the eutrophication of natural waters (Invited Review). Contemporary Problems of Ecology, 12(2): 109-125 DOI:10.1134/S1995425519020057 |
Glibert P M, 2016. Margalef revisited:A new phytoplankton mandala incorporating twelve dimensions, including nutritional physiology. Harmful Algae, 55: 25-30 DOI:10.1016/j.hal.2016.01.008 |
Glibert P M, 2017. Eutrophication, harmful algae and biodiversity-Challenging paradigms in a world of complex nutrient changes. Marine Pollution Bulletin, 124(2): 591-606 |
Glibert P M, Berdalet E, Burford M A et al, 2018. Global Ecology and Oceanography of Harmful Algal Blooms. Cham, Switzerland: Springer, 461
|
Glibert P M, Burford M A, 2017. Globally changing nutrient loads and harmful algal blooms:Recent advances, new paradigms, and continuing challenges. Oceanography, 30(1): 58-69 DOI:10.5670/oceanog.2017.110 |
Glibert P M, Burkholder J M, Kana T M, 2012. Recent insights about relationships between nutrient availability, forms, and stoichiometry, and the distribution, ecophysiology, and food web effects of pelagic and benthic Prorocentrum species. Harmful Algae, 14: 231-259 DOI:10.1016/j.hal.2011.10.023 |
GlobalHAB, 2017. Global harmful algal blooms, science and implementation plan. Delaware and Paris: SCOR and IOC, 64
|
Gobler C J, Berry D L, Dyhrman S T et al, 2011. Niche of harmful alga Aureococcus anophagefferens revealed through ecogenomics. Proceedings of the National Academy of Sciences of the United States of America, 108(11): 4352-4357 DOI:10.1073/pnas.1016106108 |
Gobler C J, Doherty O M, Hattenrath-Lehmann T K et al, 2017. Ocean warming since 1982 has expanded the niche of toxic algal blooms in the North Atlantic and North Pacific oceans. Proceedings of the National Academy of Sciences of the United States of America, 114(19): 4975-4980 DOI:10.1073/pnas.1619575114 |
Gobler C J, Lonsdale D J, Boyer G L, 2005. A review of the causes, effects, and potential management of harmful brown tide blooms caused by Aureococcus anophagefferens (Hargraves et sieburth). Estuaries, 28(5): 726-749 DOI:10.1007/BF02732911 |
Gobler C J, Sunda W G, 2012. Ecosystem disruptive algal blooms of the brown tide species, Aureococcus anophagefferens and Aureoumbra lagunensis. Harmful Algae, 14: 36-45 DOI:10.1016/j.hal.2011.10.013 |
Griffith A W, Gobler C J, 2020. Harmful algal blooms:A climate change co-stressor in marine and freshwater ecosystems. Harmful Algae, 91: 101590 DOI:10.1016/j.hal.2019.03.008 |
Groom S, Sathyendranath S, Ban Y et al, 2019. Satellite ocean colour:Current status and future perspective. Frontiers in Marine Science, 6: 485 DOI:10.3389/fmars.2019.00485 |
Gu H F, 2011. Morphology, phylogenetic position, and ecophysiology of Alexandrium ostenfeldii (Dinophyceae) from the Bohai Sea, China. Journal of Systematics and Evolution, 49(6): 606-616 DOI:10.1111/j.1759-6831.2011.00160.x |
Gu H F, Liu T T, Vale P et al, 2013a. Morphology, phylogeny and toxin profiles of Gymnodinium inusitatum sp. nov., Gymnodinium catenatum and Gymnodinium microreticulatum (Dinophyceae) from the Yellow Sea, China. Harmful Algae, 28: 97-107 DOI:10.1016/j.hal.2013.06.001 |
Gu H F, Luo Z H, Zhang X D et al, 2013b. Morphology, ultrastructure and phylogeny of Takayama xiamenensis sp. nov. (Gymnodiniales, Dinophyceae) from the East China Sea. Phycologia, 52(3): 256-265 DOI:10.2216/12-090.1 |
Hallegraeff G M, 1993. A review of harmful algal blooms and their apparent global increase. Phycologia, 32(2): 79-99 DOI:10.2216/i0031-8884-32-2-79.1 |
Hallegraeff G M, 2010. Ocean climate change, phytoplankton community responses, and harmful algal blooms:a formidable predictive challenge. Journal of Phycology, 46(2): 220-235 DOI:10.1111/j.1529-8817.2010.00815.x |
Harke M J, Steffen M M, Gobler C J et al, 2016. A review of the global ecology, genomics, and biogeography of the toxic cyanobacterium, Microcystis spp. Harmful Algae, 54: 4-20 DOI:10.1016/j.hal.2015.12.007 |
HARRNESS, 2005. Harmful Algal Research and Response:A National Environmental Science Strategy 2005-2015. Washington DC: Ecological Society of America, 96
|
Hennon G M M, Dyhrman S T, 2020. Progress and promise of omics for predicting the impacts of climate change on harmful algal blooms. Harmful Algae, 91: 101587 DOI:10.1016/j.hal.2019.03.005 |
Hillebrand H, Steinert G, Boersma M et al, 2013. Goldman revisited:faster-growing phytoplankton has lower N:P and lower stoichiometric flexibility. Limnology and Oceanography, 58(6): 2076-2088 DOI:10.4319/lo.2013.58.6.2076 |
Howarth R W, 2008. Coastal nitrogen pollution:a review of sources and trends globally and regionally. Harmful Algae, 8(1): 14-20 DOI:10.1016/j.hal.2008.08.015 |
Huo Y Z, Han H B, Hua L et al, 2016. Tracing the origin of green macroalgal blooms based on the large scale spatio-temporal distribution of Ulva microscopic propagules and settled mature Ulva vegetative thalli in coastal regions of the Yellow Sea, China. Harmful Algae, 59: 91-99 DOI:10.1016/j.hal.2016.09.005 |
Ji N J, Lin L X, Li L et al, 2018. Metatranscriptome analysis reveals environmental and diel regulation of a Heterosigma akashiwo (Raphidophyceae) bloom. Environmental Microbiology, 20(3): 1078-1094 DOI:10.1111/1462-2920.14045 |
Jiang T, Liu L, Li Y et al, 2017. Occurrence of marine algal toxins in oyster and phytoplankton samples in Daya Bay, South China Sea. Chemosphere, 183: 80-88 DOI:10.1016/j.chemosphere.2017.05.067 |
John U, Litaker R W, Montresor M et al, 2014. Formal revision of the Alexandrium tamarense species complex (Dinophyceae) taxonomy:the introduction of five species with emphasis on molecular-based (rDNA) classification. Protist, 165(6): 779-804 DOI:10.1016/j.protis.2014.10.001 |
Johns E M, Lumpkin R, Putman N F et al, 2020. The establishment of a pelagic Sargassum population in the tropical Atlantic:Biological consequences of a basin-scale long distance dispersal event. Progress in Oceanography, 182: 102269 DOI:10.1016/j.pocean.2020.102269 |
Kahrua M, Elmgren R, Kaiser J et al, 2020. Cyanobacterial blooms in the Baltic Sea:Correlations with environmental factors. Harmful Algae, 92: 101739 DOI:10.1016/j.hal.2019.101739 |
Keeling P J, Burki F, Wilcox H M et al, 2014. The marine microbial eukaryote transcriptome sequencing project (MMETSP):illuminating the functional diversity of eukaryotic life in the oceans through transcriptome sequencing. PLoS Biology, 12(6): e1001889 DOI:10.1371/journal.pbio.1001889 |
Keesing J K, Liu D Y, Fearns P et al, 2011. Inter- and intra-annual patterns of Ulva prolifera green tides in the Yellow Sea during 2007-2009, their origin and relationship to the expansion of coastal seaweed aquaculture in China. Marine Pollution Bulletin, 62(6): 1169-1182 DOI:10.1016/j.marpolbul.2011.03.040 |
Knap A, Dewailly E, Furgal C et al, 2002. Indicators of ocean health and human health:Developing a research and monitoring framework. Environmental Health Perspectives, 110(9): 839-845 DOI:10.1289/ehp.02110839 |
Kong F Z, Yu R C, Zhang Q C et al, 2012. Pigment characterization for the 2011 bloom in Qinhuangdao implicated "brown tide" events in China. Chinese Journal of Oceanology and Limnology, 30(3): 361-370 DOI:10.1007/s00343-012-1239-z |
Krock B, Tillmann U, Tebben J et al, 2019. Two novel azaspiracids from Azadinium poporum, and a comprehensive compilation of azaspiracids produced by Amphidomataceae, (Dinophyceae). Harmful Algae, 82: 1-8 DOI:10.1016/j.hal.2018.12.005 |
Lassus P, Chormérat N, Hess P et al, 2016. Toxic and harmful microalgae of the world ocean. Denmark: International Society for the Study of Harmful Algae/Intergovernmental Oceanographic Commission of UNESCO, 68
|
Leung P T Y, Yan M, Lam V T T et al, 2018. Phylogeny, morphology and toxicity of benthic dinoflagellates of the genus Fukuyoa (Goniodomataceae, Dinophyceae) from a subtropical reef ecosystem in the South China Sea. Harmful Algae, 74: 78-97 DOI:10.1016/j.hal.2018.03.003 |
Li Y, Dong H C, Teng S T et al, 2018. Pseudo-nitzschia nanaoensis sp. nov. (Bacillariophyceae) from the Chinese coast of the South China Sea. Journal of Phycology, 54(6): 918-922 DOI:10.1111/jpy.12791 |
Li Y, Huang C X, Xu G S et al, 2017. Pseudo-nitzschia simulans sp. nov. (Bacillariophyceae), the first domoic acid producer from Chinese waters. Harmful Algae, 67: 119-130 DOI:10.1016/j.hal.2017.06.008 |
Li A F, Sun G, Qiu J B et al, 2015. Lipophilic shellfish toxins in Dinophysis caudata picked cells and in shellfish from the East China Sea. Environmental Science and Pollution Research, 22(4): 3116-3126 DOI:10.1007/s11356-014-3595-z |
Li H M, Tang H J, Shi X Y et al, 2014. Increased nutrient loads from the Changjiang (Yangtze) River have led to increased Harmful Algal Blooms. Harmful Algae, 39: 92-101 DOI:10.1016/j.hal.2014.07.002 |
Lilly E L, Halanych K M, Anderson D M, 2007. Species boundaries and global biogeography of the Alexandrium tamarense complex (Dinophyceae). Journal of Phycology, 43(6): 1329-1338 DOI:10.1111/j.1529-8817.2007.00420.x |
Lin S J, Cheng S F, Song B et al, 2015. The Symbiodinium kawagutii genome illuminates dinoflagellate gene expression and coral symbiosis. Science, 350(6261): 691-694 DOI:10.1126/science.aad0408 |
Lin J N, Yan T, Zhang Q C et al, 2014. In situ detrimental impacts of Prorocentrum donghaiense blooms on zooplankton in the East China Sea. Marine Pollution Bulletin, 88(1-2): 302-310 DOI:10.1016/j.marpolbul.2014.08.026 |
Liu D Y, Keesing J K, Dong Z J et al, 2010. Recurrence of the world's largest green-tide in 2009 in Yellow Sea, China:Porphyra yezoensis aquaculture rafts confirmed as nursery for macroalgal blooms. Marine Pollution Bulletin, 60(9): 1423-1432 DOI:10.1016/j.marpolbul.2010.05.015 |
Liu D Y, Keesing J K, He P M et al, 2013. The world's largest macroalgal bloom in the Yellow Sea, China:Formation and implications. Estuarine, Coastal and Shelf Science, 129: 2-10 DOI:10.1016/j.ecss.2013.05.021 |
Liu D Y, Keesing J K, Xing Q G et al, 2009. World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China. Marine Pollution Bulletin, 58(6): 888-895 DOI:10.1016/j.marpolbul.2009.01.013 |
Liu F, Liu X F, Wang Y et al, 2018. Insights on the Sargassum horneri golden tides in the Yellow Sea inferred from morphological and molecular data. Limnology and Oceanography, 63(4): 1762-1773 DOI:10.1002/lno.10806 |
Liu Y, Yu R C, Kong F Z et al, 2017. Paralytic shellfish toxins in phytoplankton and shellfish samples collected from the Bohai Sea, China. Marine Pollution Bulletin, 115(1-2): 324-331 DOI:10.1016/j.marpolbul.2016.12.023 |
Lu D D, Qi Y Z, Gu H F et al, 2014. Causative species of harmful algal blooms in Chinese coastal waters. Algological Studies, 145-146: 145-168 DOI:10.1127/1864-1318/2014/0161 |
Lu D D, Goebel J, 2001. Five red tide species in Genus Prorocentrum including the description of Prorocentrum donghaiense Lu SP. nov. from the East China Sea. Chinese Journal of Oceanology and Limnology, 19(4): 337-344 DOI:10.1007/BF02850738 |
Luo Z H, Gu H F, Krock B et al, 2013. Azadinium dalianense, a new dinoflagellate species from the Yellow Sea, China. Phycologia, 52(6): 625-636 DOI:10.2216/13-178.1 |
Luo Z H, Krock B, Mertens K N et al, 2017a. Adding new pieces to the Azadinium (Dinophyceae) diversity and biogeography puzzle:Non-toxigenic Azadinium zhuanum sp. nov. from China, toxigenic A. poporum from the Mediterranean, and a non-toxigenic A. dalianense from the French Atlantic. Harmful Algae, 66: 65-78 DOI:10.1016/j.hal.2017.05.001 |
Luo Z H, Wang L, Chan L et al, 2018. Karlodinium zhouanum, a new dinoflagellate species from China, and molecular phylogeny of Karenia digitata and Karenia longicanalis (Gymnodiniales, Dinophyceae). Phycologia, 57(4): 401-412 DOI:10.2216/17-106.1 |
Luo Z H, Zhang H, Krock B et al, 2017b. Morphology, molecular phylogeny and okadaic acid production of epibenthic Prorocentrum (Dinophyceae) species from the northern South China Sea. Algal Research, 22: 14-30 DOI:10.1016/j.algal.2016.11.020 |
Medlin L K, Orozco J, 2017. Molecular techniques for the detection of organisms in aquatic environments, with emphasis on harmful algal bloom species. Sensors, 17(5): 1184 DOI:10.3390/s17051184 |
Nixon S W, 1995. Coastal marine eutrophication:a definition, social causes, and future concerns. Ophelia, 41(1): 199-219 DOI:10.1080/00785236.1995.10422044 |
Ou L J, Cai Y Y, Jin W Y et al, 2018. Understanding the nitrogen uptake and assimilation of the Chinese strain of Aureococcus anophagefferens (Pelagophyceae). Algal Research, 34: 182-190 DOI:10.1016/j.algal.2018.07.019 |
Ou L J, Wang D, Huang B Q et al, 2008. Comparative study of phosphorus strategies of three typical harmful algae in Chinese coastal waters. Journal of Plankton Research, 30(9): 1007-1017 DOI:10.1093/plankt/fbn058 |
Peñuelas J, Sardans J, Rivas-Ubach A et al, 2012. The human-induced imbalance between C, N and P in Earth's life system. Global Change Biology, 18(1): 3-6 |
Pitcher G C, Jiménez A B, Kudela R M et al, 2017. Harmful algal blooms in eastern boundary upwelling systems:A GEOHAB Core Research Project. Oceanography, 30(1): 22-35 DOI:10.5670/oceanog.2017.107 |
Ponmani T, Guo R, Ki J S et al, 2016. Analysis of the genomic DNA of the harmful dinoflagellate Prorocentrum minimum:a brief survey focused on the noncoding RNA gene sequences. Journal of Applied Phycology, 28(1): 335-344 DOI:10.1007/s10811-015-0570-0 |
Qi Y Z, Chen J F, Wang Z H et al, 2004. Some observations on harmful algal bloom (HAB) events along the coast of Guangdong, southern China in 1998. Hydrobiologia, 512(1-3): 209-214 DOI:10.1023/B:HYDR.0000020329.06666.8c |
Roemmich D, Alford M H, Claustre H et al, 2019. On the future of Argo:A global, full-depth, multi-disciplinary array. Frontiers in Marine Science, 6: 439 DOI:10.3389/fmars.2019.00439 |
Rutkowska M, Płotka-Wasylka J, Majchrzak T et al, 2019. Recent trends in determination of neurotoxins in aquatic environmental samples. TrAC Trends in Analytical Chemistry, 112: 112-122 DOI:10.1016/j.trac.2019.01.001 |
Schoemann V, Becquevort S, Stefels J et al, 2005. Phaeocystis blooms in the global ocean and their controlling mechanisms:a review. Journal of Sea Research, 53(1-2): 43-66 DOI:10.1016/j.seares.2004.01.008 |
Seitzinger S P, Mayorga E, Bouwman A F et al, 2010. Global river nutrient export:a scenario analysis of past and future trends. Global Biogeochemistry Cycles, 24(4): GB0A08 |
Smayda T J, 1997. What is a bloom? A commentary. Limnology and Oceanography, 42(5part2): 1132-1136 DOI:10.4319/lo.1997.42.5_part_2.1132 |
Smayda T J, Trainer V L, 2010. Dinoflagellate blooms in upwelling systems:Seeding, variability, and contrasts with diatom bloom behaviour. Progress in Oceanography, 85(1-2): 92-107 DOI:10.1016/j.pocean.2010.02.006 |
Smetacek V, Zingone A, 2013. Green and golden seaweed tides on the rise. Nature, 504(7478): 84-88 DOI:10.1038/nature12860 |
Smith J, Connell P, Evans R H et al, 2018. A decade and a half of Pseudo-nitzschia spp. and domoic acid along the coast of southern California. Harmful Algae, 79: 87-104 |
Stauffer B A, Bowers H A, Buckley E et al, 2019. Considerations in harmful algal bloom research and monitoring:Perspectives from a consensus-building workshop and technology testing. Frontiers in Marine Science, 6: 399 DOI:10.3389/fmars.2019.00399 |
Steidinger K A, 2009. Historical perspective on Karenia brevis red tide research in the Gulf of Mexico. Harmful Algae, 8(4): 549-561 DOI:10.1016/j.hal.2008.11.009 |
Sun S, Wang F, Li C L et al, 2008. Emerging challenges:massive green algae blooms in the Yellow Sea. Nature Proceedings DOI:10.1038/npre.2008.2266.1 |
Sutton M A, Bleeker A, Howard C M et al, 2013. Our nutrient world:the challenge to produce more food and energy with less pollution. Edinburgh, UK: Centre for Ecology and Hydrology, 114
|
Svirčev Z, Lalić D, Savić G B et al, 2019. Global geographical and historical overview of cyanotoxin distribution and cyanobacterial poisonings. Archives of Toxicology, 93(9): 2429-2481 DOI:10.1007/s00204-019-02524-4 |
Tang Y Z, Ma Z P, Hu Z X et al, 2019. 3, 000 km and 1, 500-year presence of Aureococcus anophagefferens reveals indigenous origin of brown tides in China. Molecular Ecology, 28(17): 4065-4076 DOI:10.1111/mec.15196 |
Trainer V L, Moore S K, Hallegraeff G et al, 2020. Pelagic harmful algal blooms and climate change:Lessons from nature's experiments with extremes. Harmful Algae, 91: 101591 DOI:10.1016/j.hal.2019.03.009 |
Trainer V L, Pitcher G C, Reguera B et al, 2010. The distribution and impacts of harmful algal bloom species in eastern boundary upwelling systems. Progress in Oceanography, 85(1-2): 33-52 DOI:10.1016/j.pocean.2010.02.003 |
Verma A, Barua A, Ruvindy R et al, 2019. The genetic basis of toxin biosynthesis in dinoflagellates. Microorganisms, 7(8): 222 DOI:10.3390/microorganisms7080222 |
Wan X K, Yao G, Liu Y L et al, 2019. Research progress in the biosynthetic mechanisms of marine polyether toxins. Marine Drugs, 17(10): 594 DOI:10.3390/md17100594 |
Wang M Q, Hu C M, Barnes B B et al, 2019a. The great Atlantic Sargassum belt. Science, 365(6448): 83-87 DOI:10.1126/science.aaw7912 |
Wang N, Mertens K N, Krock B et al, 2019b. Cryptic speciation in Protoceratium reticulatum (Dinophyceae):Evidence from morphological, molecular and ecophysiological data. Harmful Algae, 88: 101610 DOI:10.1016/j.hal.2019.05.003 |
Wang X D, Wang Y, Ou L J et al, 2015a. Allocation costs associated with induced defense in Phaeocystis globosa (Prymnesiophyceae):the effects of nutrient availability. Scientific Reports, 5: 10850 DOI:10.1038/srep10850 |
Wang Z L, Xiao J, Fan S L et al, 2015b. Who made the world's largest green tide in China?-an integrated study on the initiation and early development of the green tide in Yellow Sea. Limnology and Oceanography, 60(4): 1105-1117 DOI:10.1002/lno.10083 |
Wang D Z, Zhang Y J, Zhang S F et al, 2013. Quantitative proteomic analysis of cell cycle of the dinoflagellate Prorocentrum donghaiense (Dinophyceae). PLoS One, 8(5): e63659 DOI:10.1371/journal.pone.0063659 |
Weisberg R H, Liu Y G, Lembke C et al, 2019. The coastal ocean circulation influence on the 2018 West Florida Shelf K. brevis red tide bloom. Journal of Geophysical Research:Oceans, 124(4): 2501-2512 DOI:10.1029/2018JC014887 |
Wu D N, Chen J H, He X P et al, 2019. Distribution, partitioning, and seasonal variation of lipophilic marine algal toxins in aquatic environments of a typical semi-closed mariculture bay. Environmental Pollution, 255: 113299 DOI:10.1016/j.envpol.2019.113299 |
Wu H A, Luan Q S, Guo M M et al, 2018. Phycotoxins in scallops (Patinopecten yessoensis) in relation to source, composition and temporal variation of phytoplankton and cysts in North Yellow Sea, China. Marine Pollution Bulletin, 135: 1198-1204 DOI:10.1016/j.marpolbul.2018.08.045 |
Xing Q G, Guo R H, Wu L L et al, 2017. High-resolution satellite observations of a new hazard of golden tides caused by floating Sargassum in winter in the Yellow Sea. IEEE Geoscience and Remote Sensing Letters, 14(10): 1815-1819 DOI:10.1109/LGRS.2017.2737079 |
Xu N, Huang B Z, Hu Z X et al, 2017. Effects of temperature, salinity, and irradiance on the growth of harmful algal bloom species Phaeocystis globosa Scherffel (Prymnesiophyceae) isolated from the South China Sea. Chinese Journal of Oceanology and Limnology, 35(3): 557-565 DOI:10.1007/s00343-017-5352-x |
Xu X, Yu Z M, He L Y et al, 2020. Metabolic analyses by metatranscriptomics highlight plasticity in phosphorus acquisition during monospecific and multispecies algal blooms. Hydrobiologia, 847(4): 1071-1085 DOI:10.1007/s10750-019-04169-x |
Yan T, Zhou M J, Fu M et al, 2003. Effects of the dinoflagellate Alexandrium tamarense on early development of the scallop Argopecten irradians concentricus. Aquaculture, 217(1-4): 167-178 DOI:10.1016/S0044-8486(02)00117-5 |
Yao P, Lei L, Zhao B et al, 2019. Spatial-temporal variation of Aureococcus anophagefferens blooms in relation to environmental factors in the coastal waters of Qinhuangdao, China. Harmful Algae, 86: 106-118 DOI:10.1016/j.hal.2019.05.011 |
Ye N H, Zhang X W, Mao Y Z et al, 2011. 'Green tides' are overwhelming the coastline of our blue planet:taking the world's largest example. Ecological Research, 26(3): 477-485 |
Yu R C, Lü S H, Liang Y B, 2018. Harmful algal blooms in the coastal waters of China. In: Glibert P M, Berdalet E, Burford M A, Pitcher G C, Zhou M J eds. Global Ecology and Oceanography of Harmful Algal Blooms. Cham, Switzerland: Springer, 309-316
|
Yu Z M, Song X X, Cao X H et al, 2017. Mitigation of harmful algal blooms using modified clays:Theory, mechanisms, and applications. Harmful Algae, 69: 48-64 DOI:10.1016/j.hal.2017.09.004 |
Zhang Q C, Chen Z F, Zhao J Y et al, 2020. Development of a sensitive qPCR method for the detection of pelagophyte Aureococcus anophagefferens. Limnology and Oceanography:Methods, 18(2): 41-51 DOI:10.1002/lom3.10344 |
Zhang Y Y, He P M, Li H M et al, 2019c. Ulva prolifera green-tide outbreaks and their environmental impact in the Yellow Sea, China. National Science Review, 6(4): 825-838 DOI:10.1093/nsr/nwz026 |
Zhang H, Li Y, Cen J Y et al, 2015a. Morphotypes of Prorocentrum lima (Dinophyceae) from Hainan Island, South China Sea:Morphological and molecular characterization. Phycologia, 54(5): 503-516 DOI:10.2216/15-8.1 |
Zhang H, Liu J L, He Y B et al, 2019a. Quantitative proteomics reveals the key molecular events occurring at different cell cycle phases of the in situ blooming dinoflagellate cells. Science of the Total Environment, 676: 62-71 DOI:10.1016/j.scitotenv.2019.04.216 |
Zhang Q C, Liu Q, Yu R C et al, 2015b. Application of a fluorescence in situ hybridization (FISH) method to study green tides in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 112-119 DOI:10.1016/j.ecss.2014.09.005 |
Zhang H, Lu S H, Li Y et al, 2018a. Morphology and molecular phylogeny of Ostreopsis cf. ovata and O. lenticularis (Dinophyceae) from Hainan Island, South China Sea. Phycological Research, 66(1): 3-14 DOI:10.1111/pre.12192 |
Zhang Q C, Qiu L M, Yu R C et al, 2012. Emergence of brown tides caused by Aureococcus anophagefferens Hargraves et Sieburth in China. Harmful Algae, 19: 117-124 DOI:10.1016/j.hal.2012.06.007 |
Zhang Q C, Yu R C, Chen Z F et al, 2018b. Genetic evidence in tracking the origin of Ulva prolifera blooms in the Yellow Sea, China. Harmful Algae, 78: 86-94 DOI:10.1016/j.hal.2018.08.002 |
Zhang H, Wu Z, Cen J Y et al, 2016. First report of three benthic Dinoflagellates, Gambierdiscus pacificus, G. australes and G. caribaeus (Dinophyceae), from Hainan Island, South China Sea. Phycological Research, 64(4): 259-273 DOI:10.1111/pre.12137 |
Zhang S F, Yuan C J, Chen Y et al, 2019b. Transcriptomic response to changing ambient phosphorus in the marine dinoflagellate Prorocentrum donghaiense. Science of the Total Environment, 692: 1037-1047 DOI:10.1016/j.scitotenv.2019.07.291 |
Zhang S F, Zhang Y, Lin L et al, 2018c. iTRAQ-Based quantitative proteomic analysis of a toxigenic dinoflagellate Alexandrium catenella and its non-toxigenic mutant exposed to a cell cycle inhibitor colchicine. Frontiers in Microbiology, 9: 650 DOI:10.3389/fmicb.2018.00650 |
Zhou M J, Liu D Y, Anderson D M et al, 2015. Introduction to the special issue on green tides in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 3-8 DOI:10.1016/j.ecss.2015.06.023 |
Zhou M J, Shen Z L, Yu R C, 2008. Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang (Yangtze) River. Continental shelf Research, 28(12): 1483-1489 DOI:10.1016/j.csr.2007.02.009 |
Zhou Z X, Yu R C, Zhou M J, 2017a. Seasonal succession of microalgal blooms from diatoms to dinoflagellates in the East China Sea:A numerical simulation study. Ecological Modelling, 360: 150-162 DOI:10.1016/j.ecolmodel.2017.06.027 |
Zhou Z X, Yu R C, Zhou M J, 2017b. Resolving the complex relationship between harmful algal blooms and environmental factors in the coastal waters adjacent to the Changjiang River estuary. Harmful Algae, 62: 60-72 DOI:10.1016/j.hal.2016.12.006 |
Zhou Y P, Zhang Y M, Li F F et al, 2017c. Nutrients structure changes impact the competition and succession between diatom and dinoflagellate in the East China Sea. Science of the Total Environment, 574: 499-508 DOI:10.1016/j.scitotenv.2016.09.092 |
Zou C, Ye R M, Zheng J W et al, 2014. Molecular phylogeny and PSP toxin profile of the Alexandrium tamarense species complex along the coast of China. Marine Pollution Bulletin, 89(1-2): 209-219 DOI:10.1016/j.marpolbul.2014.09.056 |
 2020, Vol. 51
2020, Vol. 51


