中国海洋湖沼学会主办。
文章信息
- 王玥, 庞小鹏, 郭玉清. 2020.
- WANG Yue, PANG Xiao-Peng, GUO Yu-Qing. 2020.
- 广西北海金海湾红树林湿地海洋线虫群落研究初探
- STUDY ON MARINE NEMATODES COMMUNITY IN JINHAI BAY MANGROVE WETLAND, BEIHAI, GUANGXI
- 海洋与湖沼, 51(3): 583-590
- Oceanologia et Limnologia Sinica, 51(3): 583-590.
- http://dx.doi.org/10.11693/hyhz20191100239
文章历史
-
收稿日期:2019-11-30
收修改稿日期:2020-02-20
红树林作为海岸带重要的生态系统类型, 是分布在热带或亚热带海岸以木本植物为主构成的重要湿地生态系统, 具有维持海岸带生物多样性以及防风固岸、促淤造陆等重要生态功能(张乔民等, 2001;何斌源等, 2007;卢元平等, 2019)。广西是我国红树林的重要分布区, 2013年红树林面积为7243.15hm2, 其中北海市3263.66hm2、钦州市2097.41hm2和防城港市1882.07hm2 (陶艳成等, 2017)。广西北海金海湾红树林生态保护区, 位于北海市区东南方约15km处, 沉积物类型为砂质, 此处也是中国鲎(Tachypleus tridentatus)幼体的孵化场。
自由生活海洋线虫是海洋中最丰富的后生动物, 它属于小型底栖动物的永久性成员, 即分选时, 可通过0.5mm或1mm网筛但被0.031mm或0.042mm孔径网筛蓄留的动物(Coull, 1999)。海洋线虫作为红树林小型底栖动物中数量最大的类群, 通常占小型底栖动物数量的90%以上(蔡立哲等, 2000)。由于海洋线虫能促进营养物质的循环、刺激微生物的生产、加速有机质的降解, 因此在红树林的底栖生态系统的能量流动和物种循环中发挥着重要作用(Guo et al, 2018)。本次研究选取了广西北海金海湾白骨壤红树林为采样区域, 对海洋线虫群落进行研究, 重点对其优势属中的相似种进行特征参数对比分析, 目的在于丰富该区域海洋生物物种多样性研究, 为评价红树林湿地沉积环境质量, 以及中国鲎潜在饵料研究奠定基础。
1 材料与方法 1.1 断面设置与野外取样方法2019年夏季, 在广西北海金海湾红树林生态保护区, 21°N设置7个断面(见图 1), 分别选取红树林和光滩未受扰动的沉积物(依照红树林植被条带宽窄不同, 选取1—4个不等的红树林沉积物站位), 用内径2.9cm注射器改制的采样管, 采集小型底栖动物样品。每个站点取3个重复样, 共采集54份样品。同时测定温度、盐度和pH值等环境因子(见表 1)。样品封装后倒入5%的福尔马林现场摇匀固定, 然后常温保存带回实验室进行分析。
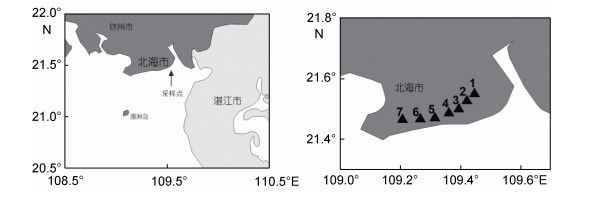 |
| 图 1 站位分布图 Fig. 1 Deployment of the sampling stations |
| 采样断面 | 泥温(℃) | 盐度 | pH值 |
| 1 | 28.5 | 27 | 6.6 |
| 2 | 29.5 | 26 | 7.4 |
| 3 | 30.0 | 21 | 7.6 |
| 4 | 29.5 | 20 | 7.1 |
| 5 | 31.5 | 24 | 7.9 |
| 6 | 31.0 | 22 | 6.9 |
| 7 | 28.5 | 30 | 6.1 |
在实验室将样品置于500mL的量筒中, 用经过滤的自来水进行淘洗多次, 直至流出液澄清, 以去除甲醛固定液和细小的沉积物。每次将悬浮液样品置于500μm的网筛和42μm网筛组成的套筛中。最后将套筛中的样品倒入离心管中, 利用Ludox溶液(比重1.15)提取小型底栖动物3次。将样品瓶中的样品转移到画有等宽平行线的培养皿中, 在解剖镜下将所有小型底栖动物按类群分类计数。再将海洋线虫转移到装有酒精甘油的水溶液(酒精︰甘油︰水= 1︰1︰18)中, 放置于干燥箱中静置1周左右后进行制片。
1.3 数据处理利用Excel 2007、Primer 6.0和SPSS 22进行数据处理和分析。
2 结果 2.1 小型底栖动物的类群组成及其丰度7个断面小型底栖动物样品的分析结果见表 2。共鉴定出海洋线虫、桡足类、多毛类、寡毛类、双壳类、有孔虫以及其他类共7类, 其中线虫是绝对的优势类群, 占小型底栖动物总数量的91.79%, 桡足类位于第二位, 占到小型底栖动物的4.29%, 多毛类、双壳类和寡毛类分别占2.31%、0.82%和0.59%。小型底栖动物的丰度介于(6.07±1.23)—(200.25±31.75) ind./10cm2之间, 其中断面5的丰度最高, 为(200.25± 31.79)ind./10cm2, 断面4最低, 为(6.07±1.23)ind./ 10cm2, 海洋线虫的丰度介于(4.16±1.7)—(195.23± 30.80)ind./10cm2之间。各个断面, 红树林区小型底栖动物的数量都大于相同断面光滩上的数量。
| 采样断面 | 类群 | 小型底栖动物 总丰度 |
|||||||
| 海洋线虫 | 桡足类 | 寡毛类 | 多毛类 | 双壳类 | 有孔虫 | 其他 | |||
| 1 | 红树林 | 63.49±2.42 | 0.61±0.65 | 0.95±0.98 | 0.87±1.28 | 0.09±0.15 | 0±0 | 0±0 | 66.00±5.19 |
| 光滩 | 10.3±1.48 | 4.51±3.46 | 0.43±0.15 | 0.61±0.15 | 0±0 | 0±0 | 0±0 | 15.85±4.94 | |
| 2 | 红树林 | 113.47±4.39 | 0.95±0.4 | 0.78±0.78 | 0.43±0.4 | 0.17±0.3 | 0±0 | 0±0 | 115.8±4.23 |
| 光滩 | 7.02±2.06 | 3.55±1.08 | 0.26±0.26 | 0.17±0.15 | 0±0 | 0.17±0.3 | 0±0 | 11.17±3.25 | |
| 3 | 红树林 | 50.58±9.33 | 19.83±12.49 | 3.47±3.65 | 1.3±1.62 | 0.09±0.15 | 0.26±0.45 | 0±0 | 75.53±6.26 |
| 4 | 红树林 | 22.78±3.25 | 0.17±0.3 | 0.17±0.15 | 0±0 | 0±0 | 0±0 | 0±0 | 23.13±2.99 |
| 光滩 | 4.16±1.7 | 1.21±0.65 | 0.69±0.54 | 0±0 | 0±0 | 0±0 | 0±0 | 6.07±1.23 | |
| 5 | 红树林-1 | 115.11±24.65 | 0.52±0.52 | 1.73±0.6 | 0.26±0.45 | 0.43±0.3 | 0±0 | 0±0 | 118.05±25.77 |
| 红树林-2 | 195.23±30.8 | 0.95±0.3 | 3.47±0.79 | 0.26±0.26 | 0±0 | 0.26±0.45 | 0.09±0.15 | 200.25±31.79 | |
| 红树林-3 | 171.15±15.77 | 0.61±1.05 | 1.3±0 | 0±0 | 0±0 | 0±0 | 0±0 | 173.06±16.76 | |
| 红树林-4 | 140.14±13.26 | 0.43±0.4 | 2.6±1.19 | 0±0 | 0±0 | 0±0 | 0±0 | 143.18±14.21 | |
| 光滩 | 19.23±4.05 | 0.26±0.26 | 0.52±0.52 | 0±0 | 0±0 | 0±0 | 0±0 | 20.01±4.3 | |
| 6 | 红树林-1 | 94.59±6.63 | 0.09±0.15 | 3.21±0.54 | 0.26±0.45 | 0.26±0.45 | 0±0 | 0.09±0.15 | 98.48±7.22 |
| 红树林-2 | 97.79±23.41 | 0.09±0.15 | 0.26±0.26 | 0.52±0.26 | 0±0 | 0±0 | 0±0 | 98.66±23.66 | |
| 红树林-3 | 123.69±33.34 | 0.52±0.9 | 1.3±1.62 | 0±0 | 0±0 | 0±0 | 0±0 | 125.51±34.96 | |
| 光滩 | 9.18±2.66 | 2.25±1.05 | 0.52±0.69 | 0.09±0.15 | 0±0 | 0±0 | 0±0 | 12.04±3.1 | |
| 7 | 红树林 | 97.27±46.11 | 4.24±5.64 | 10.74±13.01 | 3.12±3 | 11.26±18.83 | 0±0 | 1.99±2.8 | 128.62±84.27 |
| 光滩 | 47.03±71.23 | 23.82±39.03 | 2.51±3.91 | 1.04±1.8 | 0±0 | 0±0 | 0±0 | 74.4±115.96 | |
本次共鉴定出29个属, 以个体数量占线虫群落总数量的百分比大于5%的属, 确定出6个优势属, 其中Terschellingia为最优势属, 优势度为19.35%。同时它也是该红树林湿地的广布属, 除了断面3在各个断面的红树林区和光滩都有发现, 其次是Promonhystera、
| 采样断面 | 属名 | ||||||
| Terschellingia | Promonhystera | Paralongicyatholaimus | Dorylaimopsis | Halichoanolaimus | Metachromadora | ||
| 1 | 红树林 | 14.47% | 3.29% | 20.39% | 19.08% | 0.66% | |
| 光滩 | 14.49% | 37.68% | 26.09% | 2.90% | 2.90% | ||
| 2 | 红树林 | 30.06% | 0.61% | 14.11% | 6.75% | 22.70% | |
| 光滩 | 9.52% | 53.97% | 7.94% | 6.35% | |||
| 3 | 红树林 | 10.07% | 36.24% | 13.42% | 3.36% | 12.75% | |
| 4 | 红树林 | 42.38% | 35.10% | 7.95% | 1.99% | 1.32% | 1.32% |
| 光滩 | 12.50% | 37.50% | 6.25% | ||||
| 5 | 红树林 | 23.66% | 9.16% | 1.53% | 32.82% | 12.21% | 2.29% |
| 光滩 | 33.33% | 45.83% | 8.33% | ||||
| 6 | 红树林 | 14.88% | 0.83% | 1.65% | 12.40% | 2.48% | |
| 光滩 | 19.05% | 52.38% | 9.52% | 23.81% | |||
| 7 | 红树林 | 14.29% | 19.73% | 12.24% | 5.44% | ||
| 光滩 | 11.11% | 11.11% | 5.56% | ||||
| 总优势度 | 19.35% | 13.39% | 11.84% | 10.86% | 7.59% | 5.88% | |
微口线虫属(Terschellingia)具有细长的尾部, 6个头部的感觉乳突和4根头部的感觉刚毛, 圆形的化感器接近头端, 口腔微小, 食道后段膨大为明显的食道球(邹朝中, 2001)。本研究中Terschellingia属中的优势种T. longicaudata主要特征见图 2。雄性身体呈圆柱状, 体长1553—1638μm, 头部直径14—18μm, 化感器直径7μm, 距体前端距离3.9—4.9μm, 化感器所在体直径18μm。交接器头部膨大, 弦长为30.47—32.48μm, 弧长为46.57—47.72μm, 引带简单并具有明显的伸向背尾侧的骨突。尾部呈细长丝状, 461—541μm, 体长与尾长比例为2.86—3.37。但进一步测量分析该种的标本, 发现有些标本在尾长、化感器距体前端的距离、化感器直径等形态学数据有些差异, 初步可以认为为3个相近种(见表 4, 图 3)。
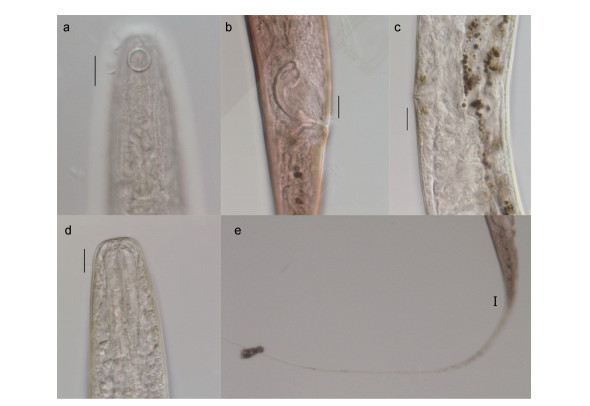 |
| 图 2 T. longicaudata显微形态结构 Fig. 2 Microstructure of T. longicaudata 注: a.示化感器; b.示雄性交接器; c.示雌性阴门; d.示口腔; e.示雄性尾部。比例尺: a, b, c, d, e = 10μm |
| 形态参数 | 种名 | |||||
| T. longicaudata 1 | T. longicaudata 2 | T. longicaudata 3 | ||||
| 性别 | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ |
| 尾长 | 523.87 | 545.9 | 409.19 | 429.5 | 585.78 | 586.7 |
| 化感器距体前端的距离 | 4.45 | 4.63 | 7.17 | 6.68 | 2.38 | 2.41 |
| 化感器直径 | 7.27 | 6.75 | 7.88 | 7.6 | 8.27 | 8.24 |
| 交接器弦长 | 30.47 | — | 37.37 | — | 44.98 | — |
| 交接器弧长 | 47.72 | — | 45.33 | — | 60.6 | — |
 |
| 图 3 T. longicaudata三个相近种的微形态结构 Fig. 3 Microstructure of three related species of T. longicaudata 注: a、b和c示三者的化感器; a1、b1和c1示三者的雄性交接器; a2、b2和c2示三者的雄性尾部。比例尺=10μm |
各断面海洋线虫群落结构的生物多样性指数结果如表 5, 其中断面1的种类数、物种丰富度指数、香农-威纳指数和优势度指数最高, 分别为23、4.0234、2.5681和0.9075;断面7的种类数、物种丰富度指数最低, 为8、1.3677, 断面4的均匀度指数、香农-威纳指数和优势度指数最低, 为0.5518、1.2705和0.6298。
| 断面 | 种类数 S |
物种丰富度 指数d |
均匀度 指数J′ |
香农-威纳 指数H′ |
优势度指数 (1-λ) |
| 1 | 23 | 4.0234 | 0.8191 | 2.5681 | 0.9075 |
| 2 | 15 | 2.5356 | 0.8261 | 2.2372 | 0.8724 |
| 3 | 12 | 2.2042 | 0.7898 | 1.9627 | 0.8115 |
| 4 | 10 | 1.7938 | 0.5518 | 1.2705 | 0.6298 |
| 5 | 13 | 2.4692 | 0.7595 | 1.9480 | 0.8073 |
| 6 | 16 | 3.0182 | 0.8403 | 2.3298 | 0.8892 |
| 7 | 8 | 1.3677 | 0.7960 | 1.6551 | 0.7642 |
线虫群落K-优势度曲线如图 4, 其中断面4的群落优势度曲线位于图形的最上方, 表明该站位线虫群落具有较高的物种优势度和较低的物种多样性, 而断面1的群落优势度曲线位于图形的最下方, 表明该站位具有较低的群落优势度和较高的物种多样性。
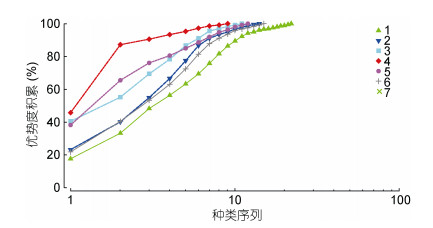 |
| 图 4 金海湾红树林湿地海洋线虫群落的K-优势度曲线 Fig. 4 K-dominance curve of marine nematodes community in the mangrove wetland in Jinhai Bay mangrove wetland |
影响小型底栖动物丰度和分布的因素除了温度、盐度外, 还有气候条件、红树植物类型、人为扰动程度和沉积物类型等。以上多方面因素都会导致造成小型底栖动物丰度的差异(Coull, 1999)。张志南(1991)在秦皇岛砂滩海洋线虫的数量研究中表明海洋线虫年平均密度中潮带为(1381±441)—(1264±538)ind./ 10cm2。李佳等(2012)在青岛太平湾第二海水浴场和石老人海水浴场四个季度采样研究表明小型底栖动物年平均丰度为(1167.3±768.3)和(1130.2±1419.1) ind./10cm2, 并且存在显著的季节差异。在浙江省南麂列岛国家海洋自然保护区潮间带进行的小型生物采样调查表明, 大沙岙沙滩小型底栖动物丰度为(291.9—516.8)ind./10cm2 (林岿璇等, 2003)。陈玉珍等(2020)在福建省主要岛屿沙滩四季采样研究表明小型底栖动物的年平均丰度为相同数量级, 具体为:东山岛(973.93±760.79)ind./10cm2 > 海坛岛(810.87±696.75) ind./10cm2 > 湄洲岛(276.8±335.31)ind./10cm2 > 火山岛(189.86±147.07)ind./10cm2 (陈玉珍等, 2020)。以上结果都远高于本次研究结果(6.07±1.23)—(200.25± 31.75)ind./10cm2。
Hua等(2016)对中国9个不同纬度的潮间带沙滩小型底栖动物分布的研究发现, 小型底栖动物的丰度在不同纬度区域表现出水平差异, 热带沙滩的小型底栖动物丰度从高潮带到低潮带显著增加; 在温带地区, 中潮带小型底栖动物丰度最高, 但三个潮带间小型底栖动物的丰度差异不显著; 在亚热带沙滩, 各潮带间的小型底栖动物丰度几乎无差异。本研究在断面4和断面5的红树林区设了多个站位, 也没有发现不同潮带间的小型底栖动物数量的差异。本研究区域是北海市著名的旅游景点, 游人赶海的最佳地段, 也可能是人为扰动沉积物影响了小型底栖动物丰度, 正如在青岛太平湾砂质滩所发现的, 旅游旺季小型底栖动物丰度及其优势类群海洋线虫的丰度明显低于淡季(华尔等, 2010)。
在福建洛阳江口红树林自然保护区的桐花树林研究发现, 小型底栖动物的丰度存在明显的季节差异, 年平均丰度在(97.4±28.3)—(38.9±24.3)ind./10cm2之间(常瑜等, 2014)。曹婧(2012)研究福建漳江口红树林秋茄、桐花树和白骨壤4个季度小型底栖动物的平均丰度分别为(1500.3±735.2)、(1717.5±621.7)和(2607.1±802.6)ind./10cm2。吴辰(2013)研究广东湛江高桥无瓣海桑、桐花树和木榄4个季度小型底栖动物的平均丰度分别为(1188.2±390.52)、(1071.8±613.6)和(739.0±237.8)ind./10cm2。陈昕韡等(2017)在厦门同安湾下潭尾人工红树林湿地的研究中提出由于红树林中具有丰富的单宁酸和有机质, 因此红树林区的小型底栖动物与非红树林区有着显著的差异。本次研究结果中, 同一断面红树林湿地小型底栖动物的丰度也都大于光滩。
分类学差异是用于识别生态系统各分类属性的良好标志。然而, 海洋线虫拥有形态学一致性和生物学多样性的双重特征, 海洋线虫不同种之间表面形态的相似性, 使其多样性通常被低估(杜永芬等, 2014)。本研究中的第一优势属Terschellingia是全球广分布的属(Gerlach et al, 1973)。国内, 在南黄海潮下带鳀鱼越冬场区域(沉积物类型为黏土质粉砂和粉砂质黏土)(黄勇, 2005)、渤海湾潮下带(沉积物类型为极细沙)(郭玉清等, 2002)、黄河口水下三角洲(张志南等, 2001)、厦门东西海域潮下带(郭玉清等, 2008)、香港维多利亚港潮下带(Liu et al, 2008)、福建红树林湿地(郭玉清等, 2018)等都有报道。它也在本次研究采样区域广泛存在。
长期以来, 鉴于海洋线虫的生物学特性及其在实践中的广泛应用, 其作为环境监测的潜在指示生物一直备受重视(Patrício et al, 2011)。尽管有许多学者认为, 在生态学中, 种级水平的详细界定并非必须, 属级或科级区分可满足需求, 因为人类活动压力较自然环境会在较高阶元上改变群落的结构组成(Warwick, 1988)。但是, 对于Terschellingia这样一个全球分布属来讲, 还是很有必要对其相似种进行深入研究。
该属现有的38个命名种中, 根据化感器的大小和位置、头刚毛的位置、颈刚毛的存在与否以及食道球的有无、大小和形状等, 认为15种为有效种, 也就是说该属中已经命名的种在分类学上存在着很多争议(Armenteros et al, 2009)。表 6是世界不同区域报道的Terschellingia longicaudata部分形态学特征参数比较。
| 特征参数 | 文献来源 | |||||
| De Mann, 1907 | Wieser, 1955 | Timm, 1962 | Platt, 1997 | 邹朝中, 2000 | 本文作者 | |
| 沉积物类型 | 火山泥质 | 滨海砂质/泥质 | 滨海砂质 | 潮间/潮下带泥质 | 潮间带泥质 | 潮间带砂质 |
| 体长 | 1062.5—1437.5 | 1400—3280 | 1070—1240 | 1500—1700 | 1000—1200 | 1553—1638 |
| 体宽 | 35—45 | 22—34 | 33—55 | |||
| 化感器与相应体宽比 | 0.33 | 0.45—0.5 | 0.3 | 0.4 | 0.36—0.42 | |
| 交接器弧长 | 24.4—27.5 | 45 | 42—52 | 47—48 | 39.73 | 46.57—47.72 |
| a | 19.8—28.4 | 35—72.1 | 24—40 | 39—43 | 37.8—47.23 | 28.37—49.57 |
| b | 10—15.65 | 11.3—15.4 | 9.8—14.7 | 8.7—10.94 | 12.27—15.3 | |
| c | 2.85—4.4 | 3.4—5.3 | 3.3—4.9 | 3.5—5.16 | 2.85—3.37 | |
| V% | 39—40 | 42—44.7 | 37—45 | 41—42 | 33.61—40.05 | 36.18—39.38 |
| 注: a=体长/最大体直径; b=体长/食道长度; c=体长/尾长; V’=阴门到体前端的距离; V%=V’/体长 | ||||||
从表 6中可以看出, 不同作者所测量的该种形态学数据不尽相同, 在体长、交接器弧长、a值上尤为明显, 说明该种不仅全球广布且形态学变异性大。本研究发现的3个相近种都有明显的食道球, 头刚毛长度、尾长等差异不大, 区别主要表现在化感器距体前端的距离、交接器的弧长和弦长。目前在形态学特征参数信息有限, 不足以精确区分种间差异时, 确实需要利用分子生物学技术手段进一步开展研究。
4 结论本研究于2019年夏季, 在广西北海金海湾红树林湿地设7个断面采集沉积物小型底栖动物样品, 研究小型底栖动物的丰度与海洋线虫的群落结构。结果发现:相对于国内其他地区砂滩, 该湿地小型底栖动物丰度较低, 而且红树林区小型底栖动物的数量大于相同断面光滩上的; 共鉴定出海洋线虫属29个, 优势属6个, 分别是Terschellingia、Promonhystera、Paralongicyatholaimus、Dorylaimopsis、Halichoanolaimus和Metachromadora, 其中Terschellingia为第一优势属, 优势度为19.35%;文中列表比较了世界多地报道物种Terschellingia longicaudata的主要形态特征, 同时分析了本研究区域样品中出现的3个相近种的尾长、化感器直径和化感器距体前端的距离等形态学特征, 提出了应用分子生物学技术在物种鉴定中的必要性。
卢元平, 徐卫华, 张志明, 等. 2019. 中国红树林生态系统保护空缺分析. 生态学报, 39(2): 684-691 |
华尔, 林佳宁, 冯颂, 等. 2010. 踩踏对砂质滩小型底栖动物的影响——现场扰动实验初步结果. 中国海洋大学学报, 40(10): 66-68, 78 |
杜永芬, 高抒, Warwick R M, 等. 2014. 海岸带湿地自由生活海洋线虫的生态功能研究进展. 科学通报, 59(31): 3043-3056 |
李佳, 华尔, 张志南. 2012. 青岛砂质潮间带小型底栖动物分布及季节动态. 应用生态学报, 23(12): 3458-3466 |
吴辰, 2013.湛江高桥红树林湿地不同植物生境小型底栖动物的多样性研究.厦门: 厦门大学硕士学位论文, 1-116
|
何斌源, 范航清, 王瑁, 等. 2007. 中国红树林湿地物种多样性及其形成. 生态学报, 27(11): 4859-4870 DOI:10.3321/j.issn:1000-0933.2007.11.056 |
邹朝中. 2001. 厦门岛附近自由生活海洋线虫的研究——微口线虫属(Genus:Terschellingia De Man. 1888)的两种. 四川动物, 20(1): 3-5 DOI:10.3969/j.issn.1000-7083.2001.01.001 |
张乔民, 隋淑珍. 2001. 中国红树林湿地资源及其保护. 自然资源学报, 16(1): 28-36 DOI:10.3321/j.issn:1000-3037.2001.01.006 |
张志南. 1991. 秦皇岛砂滩海洋线虫的数量研究. 中国海洋大学学报, 21(1): 63-75 |
张志南, 周红, 郭玉清, 等. 2001. 黄河口水下三角洲及其邻近水域线虫群落结构的比较研究. 海洋与湖沼, 32(4): 436-444 DOI:10.3321/j.issn:0029-814X.2001.04.013 |
陈玉珍, 郭玉清, 刘爱原. 2020. 福建省4个主要岛屿沙滩小型底栖动物的丰度与分布差异. 厦门大学学报(自然科学版), 59(2): 254-262 |
陈昕韡, 李想, 曾佳丽, 等. 2017. 厦门同安湾下潭尾人工红树林湿地小型底栖动物群落结构. 厦门大学学报(自然科学版), 56(3): 351-358 |
林岿璇, 张志南, 韩洁. 2003. 南麂列岛海洋自然保护区潮间带小型生物初步研究. 中国海洋大学学报, 33(2): 219-225 |
郭玉清, 刘爱原, 康斌, 等. 2018. 福建滨海湿地小型底栖动物与海洋线虫. 北京: 中国农业出版社, 1-41
|
郭玉清, 张志南, 慕芳红. 2002. 渤海小型底栖动物生物量的初步研究. 海洋学报, 24(6): 76-83 DOI:10.3321/j.issn:0253-4193.2002.06.008 |
郭玉清, 蔡立哲. 2008. 厦门东西海域海洋线虫群落种类组成及摄食类型的初步比较研究. 海洋湖沼通报, (3): 93-98 DOI:10.3969/j.issn.1003-6482.2008.03.013 |
陶艳成, 葛文标, 刘文爱, 等. 2017. 基于高分辨率卫星影像的广西红树林面积监测与群落调查. 自然资源学报, 32(9): 1602-1614 |
黄勇, 2005.南黄海小型底栖生物生态学和海洋线虫分类学研究.青岛: 中国海洋大学博士学位论文, 1-210
|
曹婧, 2012.福建漳江口红树林和盐沼湿地小型底栖动物的研究.厦门: 厦门大学硕士学位论文, 1-102
|
常瑜, 郭玉清. 2014. 福建洛阳江口红树林小型底栖动物的研究. 集美大学学报(自然科学版), 19(1): 7-12 DOI:10.3969/j.issn.1007-7405.2014.01.002 |
蔡立哲, 厉红梅, 邹朝中. 2000. 深圳河口福田泥滩海洋线虫的种类组成及季节变化. 生物多样性, 8(4): 385-390 DOI:10.3321/j.issn:1005-0094.2000.04.005 |
Armenteros M, Ruiz-Abierno A, Vincx M et al, 2009. A morphometric analysis of the genus Terschellingia (Nematoda:Linhomoeidae) with redefinition of the genus and key to the species. Journal of the Marine Biological Association of the United Kingdom, 89(6): 1257-1267 DOI:10.1017/S0025315409000381 |
Coull B C, 1999. Role of meiofauna in estuarine soft-bottom habitats. Australian Journal of Ecology, 24(4): 327-343 DOI:10.1046/j.1442-9993.1999.00979.x |
Gerlach S A, Riemann F, 1973. The Bremerhaven checklist of aquatic nematodes. A catalogue of nematoda adenophorea excluding the dorylaimida. Veröffentlichungen des Instituts für Meeresforschung in Bremerhaven, 4(Sl): 1-736 |
Guo Y Q, Chang Y, Yang P P, 2018. Two new free-living nematode species (Comesomatidae) from the mangrove wetlands in Fujian Province, China. Acta Oceanologica Sinica, 37(10): 161-167 DOI:10.1007/s13131-018-1320-3 |
Hua E, Zhang Z N, Zhou H et al, 2016. Meiofauna distribution in intertidal sandy beaches along China shoreline (18°-40°N). Journal of Ocean University of China, 15(1): 19-27 DOI:10.1007/s11802-016-2740-3 |
Liu X S, Xu W Z, Cheung S G et al, 2008. Subtropical meiobenthic nematode communities in Victoria Harbour, Hong Kong. Marine Pollution Bulletin, 56(8): 1491-1497 DOI:10.1016/j.marpolbul.2008.04.021 |
Patrício J, Adão H, Neto J M et al, 2011. Do nematode and macrofauna assemblages provide similar ecological assessment information?. Ecological Indicators, 14(1): 124-137 |
Warwick R M, 1988. The level of taxonomic discrimination required to detect pollution effects on marine benthic communities. Marine Pollution Bulletin, 19(6): 259-268 |
 2020, Vol. 51
2020, Vol. 51


