中国海洋湖沼学会主办。
文章信息
- 杨纯懿, 张龙辉, 杜永芬, 吴亚平, 张安国, 袁秀堂. 2020.
- YANG Chun-Yi, ZHANG Long-Hui, DU Yong-Fen, WU Ya-Ping, ZHANG An-Guo, YUAN Xiu-Tang. 2020.
- 双台子河口砂质潮间带小型底栖动物的群落结构及其对环境的响应
- MEIOFAUNAL COMMUNITY IN SANDY INTERTIDAL ZONE AND ITS ENVIRONMENTAL RESPONSE IN SHUANGTAIZI ESTUARY, NE CHINA
- 海洋与湖沼, 51(3): 572-582
- Oceanologia et Limnologia Sinica, 51(3): 572-582.
- http://dx.doi.org/10.11693/hyhz20191000202
文章历史
-
收稿日期:2019-10-31
收修改稿日期:2020-03-09
2. 南京大学地理与海洋科学学院 南京 210023;
3. 南京师范大学海洋科学与工程学院 南京 210023;
4. 国家海洋环境监测中心 大连 116023
2. School of Geography and Ocean Science, Nanjing University, Nanjing 210023, China;
3. College of Marine Science and Engineering, Nanjing Normal University, Nanjing 210023, China;
4. National Marine Environmental Monitoring Center, Dalian 116023, China
海洋小型底栖动物(简称小型动物)指分选时通过0.5mm孔径网筛但被0.042mm(深海研究用0.031mm)孔径网筛截留的后生动物, 主要包括自由生活海洋线虫、桡足类、涡虫类、动吻类和多毛类等(Higgins et al, 1988; Giere, 2009)。在底栖生态系统中, 小型动物与底栖细菌、微藻和原生动物等微型生物组成底栖小/微食物网(杜永芬等, 2011), 其本身又是许多经济鱼、虾和贝类幼体的优质饵料, 因此, 小型底栖动物在底栖生态系统的物质循环和能量流动中发挥重要作用(张志南等, 2017)。另外, 小型动物组成多样, 在普遍接受的34个动物门类中, 至少有22个门类属于小型动物类群; 小型动物的优势类群海洋线虫具有独特的生殖对策, 生命周期短, 繁殖速度快, 终生底栖, 便于取样和实验室培养等特征, 使其成为海洋环境监测、生态系统演变与健康评估的理想指示类群(Hua et al, 2016; Du et al, 2018)。因此海洋小型底栖动物的群落分布特征, 及其在生态环境评估的应用在基础研究和应用领域一直备受重视(Alves et al, 2013, 2015)。
潮间带是指平均最高潮位和平均最低潮位之间的海岸区域, 由于地处海陆交界, 水体呈现周期性地涨落, 沉积物规律性的被淹没或暴露在空气中, 环境(温度, 盐度, 沉积物粒度分布等)梯度变化明显。潮间带海洋沉积物能有效聚集、储存有机质, 为生物的生长繁殖提供重要的物质和能量来源, 是碳循环中重要的源/汇区(Ridgwell et al, 2005)。该区域不仅为生物提供了多样化的栖居场所, 也是净化污水, 削弱陆源污染物入海通量的一道屏障(刘海滨等, 2007)。因此潮间带生物资源特征、生态系统过程与机理、生态环境监测与评估等研究, 被列为海岸带研究的核心内容, 其中小型底栖动物的资源动态和群落结构是重要研究之一(张艳等, 2009; Giere, 2009)。
双台子河口(40°45′—40°51′N, 121°28′—121°44′E)位于渤海辽东湾, 主要由三条河流(双台子河, 大辽河和大凌河)冲积作用形成, 面积约6.7×104 hm2, 占滩涂总面积的56% (Yang et al, 2015)。作为我国最北端的河口潮间带, 每年11月份中下旬进入冰期, 至来年3月结束。潮流性质属于正规半日潮流, 潮流基本属往复流型。潮间带较为平缓, 属典型光滩(吴冠等, 1991), 文蛤等埋栖性贝类资源丰富(Zhang et al, 2016)。潮上带被开垦修建了大量的虾蟹田和海参养殖池, 资源开发和滥捕使滩涂生态系统遭到一定程度的破坏。本研究对双台子河口潮间带小型动物群落结构和时空分布, 进行了描述和定量分析, 是我国纬度最高并具有冰期的潮间带数据的首次报道; 同时应用小型动物特点对其环境状况进行了环境评估。研究结果不仅丰富了我国海岸带研究的基础资料, 也为环境监测与管理提供了基础理论数据支持。
1 材料与方法 1.1 样品采集研究区域位于双台子河口潮间带的中低潮区, 垂直于海岸线每隔2km布设一个断面, 共7条断面, 依次标记为A、B……G; 平行于海岸线在每个断面上, 每隔1km左右布设一个站位, 每条断面设置6—9站位。综合考虑工作量和代表性, 本研究在每个断面选取3个站位(共计21个站位), 最大程度的覆盖研究区, 并分别代表高位、中位、低位区域(图 1)。
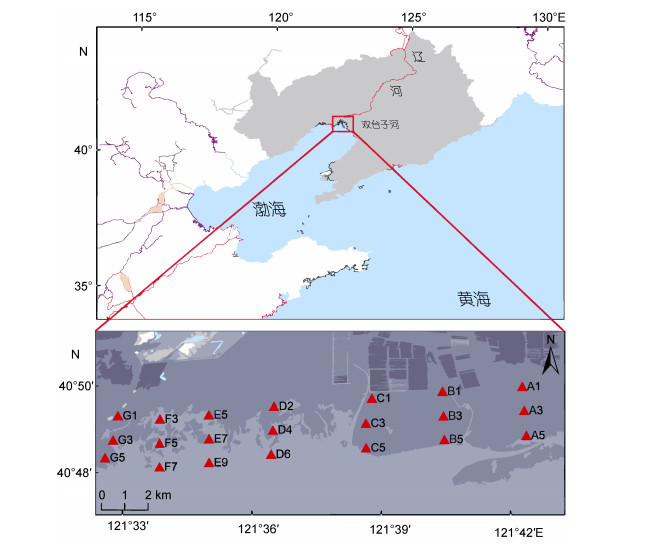 |
| 图 1 研究区域与站位分布 Fig. 1 The study area and sampling sites 注:红色三角形表示站位; A, B……G为断面 |
分别于2017年5月10—13日、8月21—25日和10月20—24日大潮期间, 在采样区设定的站点, 选取未经扰动的沉积物, 用内径为2.9cm的注射器改造的采样管, 采集0—5cm芯样8个, 以减少生物斑块分布的影响, 其中每2个芯样合并为1个平行样, 现场用福尔马林溶液(V/V, 10%)固定后用于小型底栖动物分析(Somerfield et al, 1996)。同时, 采集深度为5cm沉积物样品, 用黑色密封袋包装后, –20℃冷冻保存, 用于叶绿素a (chl a)、脱镁叶绿素a (Phae)、粒度、有机质及含水量分析。将温度计插入沉积物下约5cm深处, 现场测定沉积物温度。以现场挖穴(25cm× 25cm×30cm)渗出的海水采集水样, 低温静置24h后, 常温下使用手持盐度计(MASTER-S/Mill α, ATAGO)测定盐度, 重复3次, 取平均值作为沉积物盐度。
1.2 实验室分析小型底栖动物的提取采用Ludox密度梯度离心法(Giere, 2009; Liu et al, 2015)。据Somerfield等(1996)采样原则和分析要求, 室内分样以不低于200条海洋线虫为原则(低于200条取全样)。对研究区单个野外平行样抽样, 分选获得的海洋线虫的数量为3000—6000条, 因此统一取分样10%用于分析。样品用福尔马林溶液浓度(5%)定容到200mL, 颠倒混合均匀后取20mL分样, 经由500μm和31μm的孔径的套筛冲洗过滤后, 用LudoxTM硅胶溶液(1.15g/mL)将31μm孔径网筛上的滞留物全部转移至离心管中(硅胶液与滞留物的体积比例大于3︰1), 低速离心(1800r/min, 10min); 离心后的上清液移出至烧杯, 再加入3倍于沉积物的Ludox液, 与沉积物充分混合后离心, 取上清液; 重复离心提取3次。将3次离心获取的上清液合并, 31μm孔径网筛过滤, 用自来水反复冲洗, 最后将滞留物全部转移至培养皿中, 在解剖镜下按类群分选、鉴定和计数(Du et al, 2009)。
粒度分析采用马尔文激光粒度仪(Mastersizer 3000)进行, 取2—3g沉积物样品, 添加分散剂分散完全后上机测定。chl a和Phae用分光光度法测定, 取3—5g冷冻的沉积物样品至50mL离心管, 加入10mL浓度90%的丙酮溶液, 低温避光萃取24h后离心(4000r/min, 15min)后, 取上清液并用90%丙酮溶液定容后, 用分光光度仪(UV1750, SHIMADEZU)测定计算chl a和Phea含量(Environmental Sciences Section Inorganic Chemistry Unit, 1991), 其中Phae采用王荣(1986)修正的方法。含水量(WC)以沉积物烘干(60℃, 72h)前后质量的减少来计算。有机质含量(TOM)采用马弗炉烧失量法。沉积物样品先置于60℃烘箱中烘干至恒重(约72h), 然后以烘干样品在马弗炉灼烧(550℃)2h后的烧失量, 确定样品的有机质含量(Heiri et al, 2001;钱宝等, 2011)。
1.3 数据统计与分析小型动物丰度换算为每10cm2的个体数(ind./10cm2); 生物量以各个类群的丰度, 乘以对应类群的平均个体干重获得(郭玉清等, 2002;张志南等, 2004)。
统计分析包括单变量和多变量分析。单变量包括各环境因子和丰度/生物量。丰度/生物量与环境因子之间的相关性采用Spearman相关分析。季节、断面及位置对单变量的影响采用3因子ANOVA差异性分析。以上分析采用SPSS23.0软件包, 对不满足方差齐性的数据进行双平方根变换后进行。
季节、断面及位置对小型动物群落的影响, 采用3因子多变量PERMANOVA分析, 对数据进行4999次重复取样(P < 0.05为显著; P < 0.001为极显著); 采用主成分分析(PCA)区分沉积环境差异及其主要成分; 非度量多维标度(MDS)进行群落相似性分析(生物矩阵经双平方根转化); 生物-环境分析(Bio-env), 分析影响生物群落分布的最佳环境要素组合(周红等, 2003)。以上分析采用PRIMER 7.0软件进行。
2 结果 2.1 环境因子采样期间气温波动范围分别为(15.2±1.0)℃ (5月)、(24.2±1.3)℃ (8月)和(8.9±3.2)℃ (10月), 分别代表了春季、夏季和秋季。间隙水盐度波动为26.0—49.0最高和最低值均出现在A断面; 春季最高(A1), 秋季最低(A1, A3), 季节波动较大(P=0.008)。盐度的季节波动发生在A断面, 其显著差异导致整个区域的季节波动; 春季(36.48±2.35) > 夏季(34.67±2.85) > 秋季(32.05±4.59)。每个季节高、中和低位站位间无显著差异(表 1)。
| 环境因子 | 春季 | 夏季 | 秋季 | ||||||||
| 高位 | 中位 | 低位 | 高位 | 中位 | 低位 | 高位 | 中位 | 低位 | |||
| 中值粒径(μm) | 77.01±20.93c* | 90.66±20.08b* | 119.65±19.49a | 77.24±14.77b | 88.56±18.89a* | 115.95±24.63a | 77.47±15.98b | 85.33±11.5a | 116.03±20.53a | ||
| 砂含量(%) | 53.64±28.71a | 79.33±28.6a | 88.57±28.83a | 67.89±17.05b | 76.79±15.95a | 90.04±9.6a | 67.37±15.68b | 75.78±9.41b | 89.75±8.55a | ||
| 粉砂含量(%) | 30.38±20.72a | 19.7±12.21a | 10.91±11.38a | 30.06±16.5a | 21.95±15.16a | 9.19±8.98a | 30.8±15.19a | 22.79±9.02a | 9.78±7.96b | ||
| 黏土含量(%) | 1.84±1.37a | 0.98±0.78a | 0.52±0.74a | 2.05±0.63a | 1.26±0.86a | 0.78±0.64b | 1.83±0.54a | 1.43±0.4a | 0.47±0.68b | ||
| 含水量(%) | 21.29±0.89a | 20.20±0.88a | 20.32±1.07a | 21.12±0.74a | 20.93±1.13a | 20.49±0.85a | 21.31±1.35a | 21.46±0.92a | 20.04±1.08a | ||
| 盐度(‰) | 38.14±4.95a | 35.57±3.41a | 35.71±1.98a | 33.14±5.73a | 31.29±3.15a | 31.71±4.75a | 35.83±2.93a | 35±3.16a | 33.17±2.14a | ||
| 注:字母(a, b, c)表示不同潮位间环境因子的ANOVA分析结果, 标注字母相同(a vs a)表示彼此间差异不显著, 不同字母表示差异显著(a vs b vs c)表示彼此差异显著 | |||||||||||
沉积物粉砂和砂的含量较高, 黏土含量极低, 属于砂质粉砂(S-St)、粉砂质砂(St-S)和砂(S)(表 1)。采样区中值粒径范围为55.3—149.9μm, 季节波动小。自高位向低位平均中值粒径和砂含量呈增大趋势(中值粒径, 高位 < 中位≤低位; 砂含量, 高≤中≤低(春季), 高 < 中≤低(夏季); 高≤中 < 低(秋季), P < 0.05)。沉积物含水量和有机质含量均比较稳定, 分别为20.80%±1.07%和1.55%±0.23%, 季节和空间变化均较小。其中有机质含量从高位到低位略呈降低趋势(高≥中≥低)(图 2)。
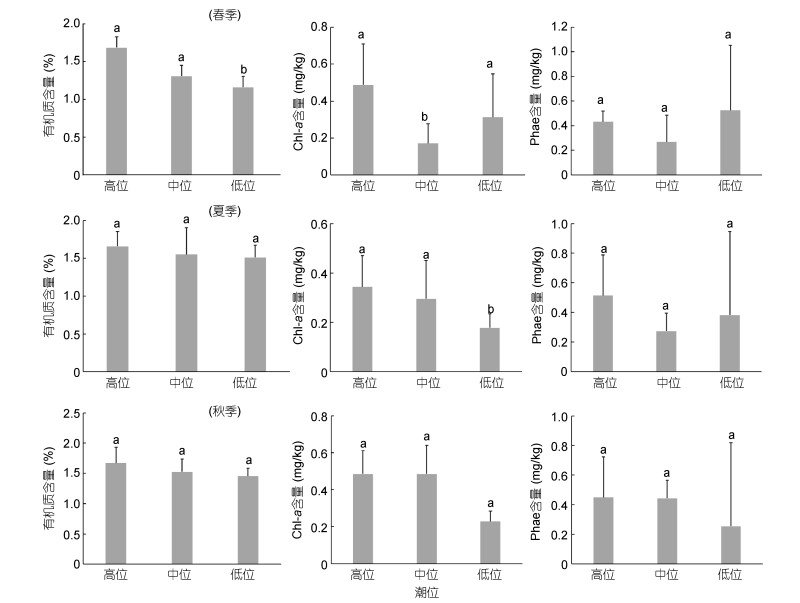 |
| 图 2 双台子河口砂质潮间带表层沉积物中有机质、叶绿素a (chl a)和脱镁叶绿酸(Phae)分布 Fig. 2 Distribution of the organic matter, chlorophyll a (chl a) and phaeopigment (Phae) contents in surface sediment in sandy intertidal of the Shuangtaizi estuary 注:柱状图上的字母(a, b)表示不同潮位间环境因子的ANOVA分析结果, 标注字母相同(a vs a)表示彼此间差异不显著, 不同字母表示差异显著(a vs b)表示彼此差异显著 |
Chl a含量为0.02—0.93mg/kg。最大值出现在春季高站位(F3), 最小值出现在秋季低站位(B5)。季节波动不明显; 空间分布上, 中位的季节波动较大, 高位和低位季节波动小, 呈现高位≥中位≥低位趋势。脱镁叶绿酸含量为0.06—1.56mg/kg, 高值出现在A—B断面低站位1.45—1.46mg/kg, 低值0.06— 0.08mg/kg出现在D—G断面的低站位, 平均含量为(0.39± 0.31)mg/kg, 季节间及空间变异不显著(图 2)。
综合各环境因子进行PCA分析结果见图 3。PC1轴解释环境变量的35.2%, PC1和PC2累计解释环境变量的61.4%。PC1相关因子较高的因子是中值粒径(0.487)、黏土含量(–0.480)、脱镁叶绿素酸(–0.468)和有机质0 (–0.437); PC2相关因子较高的因子是砂含量(0.627)和温度(–0.543)。沉积物环境主要受沉积物粒度组成和季节影响较大。
 |
| 图 3 双台子河口潮间带环境因子PCA分析结果 Fig. 3 PCA plot of the environmental factors in the intertidal zone of the Shuangtaizi estuary 注: Mgs.中值粒径; Sand.砂含量; Silt.粉砂含量; WC.含水量; TOM.有机质含量; chl a.叶绿素a含量; Phae.脱镁叶绿酸含量; Salinity.盐度; T.温度 |
共鉴定7个小型底栖动物类群(表 2), 其中自由生活海洋线虫(以下简称海洋线虫)为最优势类群, 占小型底栖动物总丰度的96.57%, 其次是双壳类(1.47%)和桡足类(1.28%)。小型底栖动物的总平均丰度为(3530±1474)ind./10cm2, 最高值出现在春季的高站位(C1), 高达(8293±357)ind./10cm2, 最低值在春季的低站位(E9), 丰度为(1368±419)ind./10cm2 (图 4)。三因子分析表明, 丰度分布只有受潮位影响, 呈高位[(4816±1425)ind./10cm2] > 中位[(3384±1130)ind./10cm2] > 低位[(2391±553)ind./10cm2]; 季节和采样断面对丰度分布无显著影响, 季节波动不明显[夏季(3871± 1480)ind./10cm2 ≥秋季(3532±1261)ind./10cm2 ≥春季(3189±1647)ind./10cm2]。海洋线虫作为丰度上的优势类群, 与小型底栖动物的分布模式基本一致。
| 小型动物类群 | 丰度(ind./10cm2) | 丰度占比(%) | 生物量 (μg dwt/10cm2) |
生物量占比(%) |
| 海洋线虫 | 3406±1414 | 96.57 | 1353.1±556.7 | 72.14 |
| 双壳类 | 62±99 | 1.47 | 255.9±408.1 | 10.45 |
| 桡足类 | 39±68 | 1.28 | 72.4±126.4 | 3.97 |
| 多毛类 | 6±14 | 0.17 | 82.6±188.3 | 3.53 |
| 腹足类 | 9±12 | 0.29 | 37.2±52.4 | 2.15 |
| 介形 | 8±20 | 0.19 | 199.6±502.8 | 5.94 |
| 水蚤 | 1±4 | 0.04 | 4.7±15.0 | 0.27 |
| 总计 | 3530±1474 | 100 | 1836.5±976.3 | 100 |
 |
| 图 4 双台子河口砂质潮间带小型底栖动物的丰度分布 Fig. 4 Distribution of meiofaunal abundance in the sandy intertidal zone of the Shuangtaizi estuary |
小型底栖动物的平均生物量为(1836.5±976.3)μg dwt/10cm2, 最高值出现在夏季F3站位(7157.6μg dwt/10cm2), 最低值出现在春季E9站位(547.3μg dwt/10cm2)(图 5)。海洋线虫在生物量上仍占优势, 约占总生物量的72.14%, 其次是双壳类(10.45%)。时空分布模式与丰度相似, 季节波动同样不明显, 夏季(2523.8±1516.9)μg dwt/10cm2 ≥(2004.9±948.2)μg dwt/10cm2 ≥春季(1541.3±947.7)μg dwt/10cm2; 断面间无差异; 潮位间差异显著, 高位(2714.8±1506.6)μg dwt/10cm2 ≥中位(2120.8±1051.6)μg dwt/10cm2 ≥低位(1326.2±662.4)μg dwt/10cm2。
 |
| 图 5 采样区域小型动物生物量分布 Fig. 5 Distribution of meiofaunal biomass in the sandy intertidal zone of the Shuangtaizi estuary |
小型底栖动物主要类群的丰度矩阵进行非度量多维标度(MDS)发现, 各站位的小型底栖动物群落在季节上可以区分:春季和夏季, 高潮位与中低潮位的群落可以区分, 秋季, 高中潮位与低潮位可以区分(图 6)。
 |
| 图 6 双台子河口砂质潮间带小型底栖动物的非度量多维标度(MDS) Fig. 6 MDS (multidimensional scaling) plot based on the meiofaunal abundance in the sandy intertidal zone of the Shuangtaizi estuary |
Spearman相关性分析表明, 小型底栖动物的丰度和生物量与沉积物中值粒径负相关, 与黏土含量、粉砂含量和chl a含量正相关(表 3)。此外, 丰度与砂含量、有机质及含水量显著相关。其中沉积物组分在3个季节均显著相关, 而chl a对丰度和生物量的影响主要发生在夏季。
| 因子 | 中值粒径 | 砂含量 | 粉砂含量 | 黏土含量 | 含水量 | 有机质 | 叶绿素a | 脱镁叶绿酸 | 盐度 | 温度 | |
| 丰度 | –0.519** | –0.411* | 0.420* | 0.512* | 0.346* | 0.351* | 0.306* | 0.235 | –0.002 | 0.043 | |
| 生物量 | –0.405** | –0.251 | 0.301* | 0.351* | 0.273 | 0.222 | 0.326* | 0.174 | 0.253 | 0.093 | |
| 注: **在0.01水平上(双侧)显著相关; *在0.05水平上(双侧)显著相关 | |||||||||||
对小型底栖动物群落的PERMANOVA分析结果显示(表 4), 季节和潮位对小型底栖动物结构具有显著性影响(P=0.001), 采样断面对群落结构无显著性影响(P=0.707);季节与潮区, 潮区与断面, 季节×断面×潮区的交互作用显著, 而季节×断面交互作用不显著。不同季节间和潮区间的群落组成均存在极显著差异(P=0.001)。
| 来源 | 自由度 | 离差平方和 | 均方差 | 伪F值 | P值 |
| 季节(Se) | 2 | 65300 | 32650 | 20.811 | 0.001** |
| 潮区(Tz) | 2 | 7834.5 | 3917.3 | 5.7239 | 0.001** |
| 断面(Tr) | 6 | 5959.8 | 993.29 | 1.4514 | 0.177 |
| 季节×潮区 | 4 | 4959.8 | 1240 | 2.6258 | 0.009* |
| 季节×断面 | 12 | 4219.1 | 351.59 | 0.74453 | 0.784 |
| 潮区×断面 | 12 | 8212.4 | 684.37 | 6.188 | 0.001** |
| 季节×潮区×断面 | 24 | 11333 | 472.23 | 4.2698 | 0.001** |
| Res | 126 | 13935 | 110.6 | ||
| 总计 | 188 | 121750 | |||
| 注: **在0.01水平上(双侧)显著相关; *在0.05水平上(双侧)显著相关 | |||||
砂质潮滩小型底栖动物的纬度分布研究表明, 其丰度和多样性在温带区域最高, 极地区域最低; 其多样性从极地到热带逐渐降低(Lee and Riveros, 2012)。我国海岸带跨越温带、亚热带和热带, 其中对潮间带小型底栖动物的研究最北端为仅见于北纬39°大连夏家河子(Hua et al, 2016)。因此, 研究资料的区域局限性制约了大尺度的生物多样性分布格局分析。本研究是我国高纬度潮间带小型底栖动物分布资料的重要补充。
3.1 小型底栖动物在我国高纬度砂质潮间带的分布特点研究区小型底栖动物的丰度与我国滨海潮滩处于同一数量级, 与大连夏家河子的数值较为接近(Hua et al, 2016), 但呈现了更高的丰度值。在季节分布上, 与温带青岛湾砂质潮间带分布相似(杜永芬等, 2011), 呈现夏季高春季和秋季低的趋势; 不同于青岛湾显著的季节差异, 双台子河口区季节间无显著差异。这表明高纬度影响削弱了丰度分布的季节影响。此外, 本次研究没有涉及冰期冬季的样品, 希望在后续研究中加以补充讨论。
海洋线虫的优势特征, 与国内大部分砂质海滩的研究相同(范士亮等, 2006;杜永芬等, 2011; Sun et al, 2014)。本研究海洋线虫的丰度优势高达96.8%, 较大连夏家河高(81.56%), 支持Hua等(2016)研究, 认为海洋线虫的优势度在我国砂质潮间带随纬度增高而增高, 在高纬区具有更高的丰度。不同于已有研究的桡足类和涡虫居次地位(Sun et al, 2014; Hua et al, 2016), 双壳类在本研究区居次。这与双台子河口潮滩环境有关, 该区域贝类自然资源丰富, 也被选为人工蛤类育苗场; 文蛤、四角蛤蜊、光滑河蓝蛤等双壳类是大型底栖动物的优势种(Zhang et al, 2016), 贝类幼体构成了小型动物的重要组分。桡足类喜好高盐和较为温暖的环境(Ingole et al, 1998; Priyalakshmi et al, 2014), 河口的淡水输入和高纬度冰期(11月到次年3月)会削弱了其生存环境适宜度。涡虫喜好生活在中度至粗砂和砾石为特征的海滩中, 在泥质环境下涡虫丰度较低(Delgado et al, 2009; Kotwicki et al, 2014)。研究区域沉积物类型以粉砂质砂和砂为主, 不适合涡虫生长。
3.2 环境因子对小型底栖动物分布的影响生物与环境协同进化的结果使得特定的沉积微环境生存特定的生物类群。潮滩生物受潮水冲击扰动的周期影响, 具有一定的微环境梯度, 沉积物粒径分布反映了沉积物所处的水文动力状况, chl a和有机质含量则代表了生物的食物来源。其中, 沉积物粒径对潮间带沉积物微环境具有主导作用, 尤其是在大尺度的空间分布上, 被认为是重要的物理因子(Giere, 2009)。通常认为125—250μm粒径的沉积物最有助于微/小型底栖动物的生长(Fenchel, 1969, 1978)。研究区域的沉积物粒径为60—150μm, 与大连河口夏季的粒径250—500μm比较, 更具有粒度优势, 因此呈现更高的丰度值。
在小尺度的潮带分布上, 砂质潮滩生物在水平尺度上受沉积物稳定性、暴露时间造成的捕食压力等影响, 在垂直分布上受化学因子(如氧气浓度梯度)等影响(Armonies et al, 2000)。因此, 高潮区环境恶劣, 丰度较低(Knox, 2001);中潮区是最佳生存环境(Gheskiere et al, 2004), 丰度最高, 这里不仅物化环境相对优化, 并且微生物活动丰富, 提供更多的食物来源(Takada et al, 2015)。同样地, Hua等(2016)在青岛和大连研究结果显示, 小型底栖动物在温带沙滩中以中潮区丰度较高。受滩涂围垦的影响, 本研究中的高位、中位和低位代表了相对海岸线的距离, 从海水淹没的角度属于中低潮区, 因此丰度的高位≥中位 > 低位分布趋势仍然支持中潮区丰度较高的分布趋势。丰度变化趋势与中值粒径由高位到低位增大趋势相反, 其粒径较小的沉积结构维持更高的丰度与Hua等(2016)结果一致。
沉积物粒度组成、有机质和Phae含量是影响研究区沉积环境区划的重要因子(PCA分析); 相关分析也表明了粒度组成、有机质和chl a是小型动物丰度和群落构成的重要影响因子。有机质和chl a含量略呈降低趋势, 与丰度分布趋势一致。综合表明温带砂质潮间带小型动物的分布受非生物和生物因素的共同影响, 其中粒度构成是主要因素。值得注意的是, 潮滩频繁的人类活动, 如潮上带围垦建设的养殖池, 不但会改变潮流动力过程, 伴随着污染物的排放, 进而改变沉积环境, 生态系统趋于变得简单化, 生态问题趋于复杂化。
3.3 小型底栖动物对环境生态的响应与评估线虫与桡足的比值(N/C)被认为海洋富营养化和有机污染程度的指标; N/C大于100意味着环境状况为有机污染区(Raffaelli et al, 1981)。随着相关研究数据的增多, 虽然该指标不断引起争议, 仍然被广泛采用(Alves et al, 2013)。研究区52.2%—76.2%的采样站位比值大于100, 即这些站位存在有机污染, 且研究区最西面的F和G断面的污染程度最高(表 5)。该结果与Yuan等(2017)关于16种多环芳烃的研究结果较为一致, 潮滩的西侧及近岸区域的沉积物中有机污染物浓度高, 生态风险高。表明N/C值作为一重要的生态指数, 在一定程度上可以为生物监测提供依据。但是, 正如上文讨论的结果, 随着纬度升高, 海洋线虫的优势度会增高, 桡足类的生存适宜度降低, 也会影响N/C比值。因此, 在应用中需要综合考虑环境、指示生物和群落结构等因素进行综合评估。
| 断面 | 春季 | 夏季 | 秋季 |
| A | 43.4 | 33.2 | 190.1 |
| B | 139.7 | 84.3 | 96.2 |
| C | 227.1 | 58.9 | 219.2 |
| D | 206.3 | 18.7 | 45.3 |
| E | 363.1 | 119.8 | 102.0 |
| F | 354.6 | 201.5 | 384.6 |
| G | 115.5 | 151.6 | 508.6 |
双台子河口潮间带代表了我国高纬度砂质潮间带, 除温度具有季节变化外, 其他环境因子主要与潮位有关, 中值粒径由陆向海呈增大趋势, 叶绿素、有机质略呈增高趋势。沉积物组成, 有机质和脱镁叶绿素含量是沉积微环境形成的重要因素。
共检获7个小型底栖动物主要类群, 其中海洋线虫为最优势类群, 双壳类次之; 小型底栖动物的总平均丰度和生物量分别为3530±1474ind./10cm2和1836.5±976.3μg dwt/10cm2, 丰度和线虫的优势度均高于我国其他砂质潮间带报道。
小型动物丰度季节波动小, 空间上自陆向海丰度值降低(高≥中 > 低); 小型底栖动物群落受季节和潮位影响显著。小型动物的分布受非生物和生物因素的共同影响, 其中粒度构成是主要因素。
海洋线虫与桡足的比值(N/C)评估显示该区域存在有机污染, 且研究区西部最严重, 与同区有机污染物的环境评价结果较为一致, 可为生物监测提供重要参考。
王荣. 1986. 荧光法测定浮游植物色素计算公式的修正. 海洋科学, 10(3): 1-5 |
刘海滨, 张志南, 范士亮, 等. 2007. 潮间带小型底栖生物生态学研究的某些进展. 中国海洋大学学报, 37(5): 767-774 |
杜永芬, 徐奎栋, 类彦立, 等. 2011. 青岛湾小型底栖生物周年数量分布与沉积环境. 生态学报, 31(2): 431-440 |
吴冠, 王锡侯, 刘恒魁. 1991. 辽东湾顶浅海区海流分布特征. 海洋通报, 10(5): 8-13 |
张艳, 张志南, 华尔. 2009. 南黄海小型底栖动物分布及其与环境因子的关系. 中国农学通报, 25(19): 323-329 |
张志南, 林岿旋, 周红, 等. 2004. 东、黄海春秋季小型底栖生物丰度和生物量研究. 生态学报, 24(5): 997-1005 |
张志南, 周红, 华尔, 等. 2017. 中国小型底栖生物研究的40年——进展与展望. 海洋与湖沼, 48(4): 657-671 |
范士亮, 刘海滨, 张志南, 等. 2006. 青岛太平湾砂质潮间带小型底栖生物丰度和生物量的研究. 中国海洋大学学报(自然科学版), 36(S): 98-104 |
周红, 张志南. 2003. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用. 青岛海洋大学学报, 33(1): 58-64 |
钱宝, 刘凌, 肖潇. 2011. 土壤有机质测定方法对比分析. 河海大学学报(自然科学版), 39(1): 34-38 |
郭玉清, 张志南, 慕芳红. 2002. 渤海小型底栖动物生物量的初步研究. 海洋学报, 24(6): 76-83 |
Alves A S, Adão H, Ferrero T J et al, 2013. Benthic meiofauna as indicator of ecological changes in estuarine ecosystems:the use of nematodes in ecological quality assessment. Ecological Indicators, 24: 462-475 DOI:10.1016/j.ecolind.2012.07.013 |
Alves A S, Caetano A, Costa J L et al, 2015. Estuarine intertidal meiofauna and nematode communities as indicator of ecosystem's recovery following mitigation measures. Ecological Indicators, 54: 184-196 DOI:10.1016/j.ecolind.2015.02.013 |
Armonies W, Reise K, 2000. Faunal diversity across a sandy shore. Marine Ecology Progress Series, 196: 49-57 DOI:10.3354/meps196049 |
Delgado J D, Riera R, Monterroso Ó et al, 2009. Distribution and abundance of meiofauna in intertidal sand substrata around Iceland. Aquatic Ecology, 43(2): 221-233 |
Du Y F, Gao S, Liu X S et al, 2018. Meiofauna and nematode community characteristics indicate ecological changes induced by geomorphic evolution:A case study on tidal creek systems. Ecological Indicators, 87: 97-106 DOI:10.1016/j.ecolind.2017.12.037 |
Du Y F, Xu K D, Lei Y L, 2009. Simultaneous enumeration of diatom, protozoa and meiobenthos from marine sediments using Ludox-QPS method. Chinese Journal of Oceanology and Limnology, 27(4): 775-783 DOI:10.1007/s00343-009-9224-x |
Environmental Sciences Section Inorganic Chemistry Unit, Wisconsin State Lab of Hygiene, 1991. ESS Method 150.1 Chlorophyll-spectrophotometric. Environmental Sciences Section Inorganic Chemistry Unit, Wisconsin State Lab of Hygiene, 3359-3363
|
Fenchel T M, 1978. The ecology of micro-and meiobenthos. Annual Review of Ecology and Systematics, 9: 99-121 DOI:10.1146/annurev.es.09.110178.000531 |
Fenchel T, 1969. The ecology of marine microbenthos IV. Structure and function of the benthic ecosystem, its chemical and physical factors and the microfauna commuities with special reference to the ciliated protozoa. Ophelia, 6(1): 1-182 |
Gheskiere T, Hoste E, Vanaverbeke J et al, 2004. Horizontal zonation patterns and feeding structure of marine nematode assemblages on a macrotidal, ultra-dissipative sandy beach (De Panne, Belgium). Journal of Sea Research, 52(3): 211-226 DOI:10.1016/j.seares.2004.02.001 |
Giere O, 2009. Meiobenthology: the Microscopic Motile Fauna of Aquatic Sediments. Berlin: Springer
|
Heiri O, Lotter A F, Lemcke G, 2001. Loss on ignition as a method for estimating organic and carbonate content in sediments:reproducibility and comparability of results. Journal of Paleolimnology, 25(1): 101-110 |
Higgins R P, Thiel H, 1988. Introduction to the Study of Meiofauna. Washington: Smithsonian
|
Hua E, Zhang Z N, Zhou H et al, 2016. Meiofauna distribution in intertidal sandy beaches along China shoreline (18°-40° N). Journal of Ocean University of China, 15(1): 19-27 DOI:10.1007/s11802-016-2740-3 |
Ingole B S, Parulekar A H, 1998. Role of salinity in structuring the intertidal meiofauna of a tropical estuarine beach:field evidence. Indian Journal of Marine Sciences, 27(3-4): 356-361 |
Knox G A, 2001. The Ecology of Seashores. Boca Raton, USA: CRC Press, 557
|
Kotwicki L, Deidun A, Grzelak K et al, 2014. A preliminary comparative assessment of the meiofaunal communities of Maltese pocket sandy beaches. Estuarine, Coastal and Shelf Science, 150: 111-119 DOI:10.1016/j.ecss.2013.12.008 |
Lee M R, Riveros M, 2012. Latitudinal trends in the species richness of free-living marine nematode assemblages from exposed sandy beaches along the coast of Chile (18-42°S). Marine Ecology, 33(3): 317-325 DOI:10.1111/j.1439-0485.2011.00497.x |
Liu X S, Huang D M, Zhu Y M et al, 2015. Bioassessment of marine sediment quality using meiofaunal assemblages in a semi-enclosed bay. Marine Pollution Bulletin, 100(1): 92-101 DOI:10.1016/j.marpolbul.2015.09.024 |
Priyalakshmi G, Menon N R, 2014. Ecology of Interstitial faunal assemblage from the Beaches along the coast of Kerala, India. International Journal of Oceanography: 284979 |
Raffaelli D G, Mason C F, 1981. Pollution monitoring with meiofauna, using the ratio of nematodes to copepods. Marine Pollution Bulletin, 12(5): 158-163 DOI:10.1016/0025-326X(81)90227-7 |
Ridgwell A, Zeebe R E, 2005. The role of the global carbonate cycle in the regulation and evolution of the Earth system. Earth and Planetary Science Letters, 234(3-4): 299-315 DOI:10.1016/j.epsl.2005.03.006 |
Somerfield P J, Warwick R M, 1996. Meiofauna in Marine Pollution Monitoring Programmes. A Laboratory Manual. Lowestoft: Ministry of Agriculture, Fisheries and Farming
|
Sun X Y, Zhou H, Hua E et al, 2014. Meiofauna and its sedimentary environment as an integrated indication of anthropogenic disturbance to sandy beach ecosystems. Marine Pollution Bulletin, 88(1-2): 260-267 |
Takada Y, Kajihara N, Mochizuki S et al, 2015. Effects of environmental factors on the density of three species of peracarid crustaceans in micro-tidal sandy shores in Japan. Ecological Research, 30(1): 101-109 DOI:10.1007/s11284-014-1215-5 |
Yang X L, Yuan X T, Zhang A G et al, 2015. Spatial distribution and sources of heavy metals and petroleum hydrocarbon in the sand flats of Shuangtaizi Estuary, Bohai Sea of China. Marine Pollution Bulletin, 95(1): 503-512 |
Yuan X T, Yang X L, Zhang A G et al, 2017. Distribution, potential sources and ecological risks of two persistent organic pollutants in the intertidal sediment at the Shuangtaizi Estuary, Bohai Sea of China. Marine Pollution Bulletin, 114(1): 419-427 DOI:10.1016/j.marpolbul.2016.09.058 |
Zhang A G, Yuan X T, Yang X L et al, 2016. Temporal and spatial distributions of intertidal macrobenthos in the sand flats of the Shuangtaizi Estuary, Bohai Sea in China. Acta Ecologica Sinica, 36(3): 172-179 DOI:10.1016/j.chnaes.2016.04.003 |
 2020, Vol. 51
2020, Vol. 51


