中国海洋湖沼学会主办。
文章信息
- 展源, 张颖, 郝向举, 李娟英, 陈丽平, 刘其根, 胡忠军. 2020.
- ZHAN Yuan, ZHANG Ying, HAO Xiang-Ju, LI Juan-Ying, CHEN Li-Ping, LIU Qi-Gen, HU Zhong-Jun. 2020.
- 长江口滴水湖大型底栖动物群落结构及其与环境因子的关系
- ON MACROZOOBENTHIC COMMUNITY AND ITS RELATIONSHIP TO ENVIRONMENTAL FACTORS IN DISHUI LAKE
- 海洋与湖沼, 51(3): 528-535
- Oceanologia et Limnologia Sinica, 51(3): 528-535.
- http://dx.doi.org/10.11693/hyhz20191200285
文章历史
-
收稿日期:2019-12-31
收修改稿日期:2020-03-05
2. 上海海洋大学农业农村部淡水水产种质资源重点实验室 上海 201306;
3. 上海海洋大学农业农村部鱼类营养与环境生态研究中心 上海 201306;
4. 全国水产技术推广总站 北京 100125;
5. 上海海洋大学海洋生态与环境学院 上海 201306
2. Key Laboratory of Freshwater Aquatic Germplasm Resources of Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
3. Research Center for Fish Nutrition and Environmental Ecology, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
4. National Fisheries Technology Extension Center, Beijing 100125, China;
5. College of Marine Ecology and Environment, Shanghai Ocean University, Shanghai 201306, China
底栖动物是由生活史的全部或大部分时间生活在水体底部的各种动物所组成的生态类群, 是水域生态系统的重要组成部分之一(刘其根等, 2012), 主要包括环节动物、软体动物、节肢动物等。底栖动物参与水生态系统物质循环和能量流动, 是许多经济鱼、虾和贝类幼体的优质饵料, 为水生态系统食物链的重要环节(Xie et al, 2003; 陈强等, 2015)。另外, 大型底栖动物具有分布广泛、生活周期长、生存环境相对稳定、移动能力小且易于采集的特点, 加之对微尺度环境改变的快速反应能力, 常被作为环境污染监测和水质评价的重要生物指标(Kerans et al, 1994; 王丽卿等, 2012)。
滴水湖位于上海东南方向, 是上海浦东临港新城主城区的人工湖泊, 湖水源自大治河。该湖呈圆形, 直径2.6km, 总面积5.56km2, 蓄水量1620万m3, 最深6.2m。自建成以来, 水源通过周边河网水系引水入湖, 接纳地表径流并经过水闸排入东海, 承担着防汛排涝、置换水体等重要功能(林青等, 2014)。自2003年蓄水以来, 由于水体不稳定易受外界环境的影响等特点, 滴水湖富营养化程度逐渐加重。迄今为止, 对滴水湖的研究主要集中在水质评价、沉积物污染和浮游生物等(王延洋等, 2008; 田华等, 2011; 童琰等, 2012; 梅卫平等, 2013; 林青等, 2014; 陶征楷等, 2014), 对大型底栖动物的研究鲜见。2009年6月至2010年5月对滴水湖大型底栖动物进行了为期一年的调查研究, 拟弄清它们的群落特征及其与环境因子之间的关系, 以期为该湖水质监测及综合治理提供基础数据和理论依据。
1 研究地区与方法 1.1 野外采样根据滴水湖的湖区特点, 在湖中心与各港口各设一个采样站点(图 1), 其中C港和D港是引水口, 滴水湖湖水引自大治河, 最后经A港流出排入东海。2009年6月—2010年5月逐月采集底栖动物样品。每个站点用1/16彼得逊采泥器采集两次, 底泥用450μm的尼龙网过滤并清洗, 剩余物装入500mL的塑料瓶中, 并加入10%—15%的福尔马林溶液固定。在实验室中, 用肉眼在白瓷盘中将底栖动物挑出, 放入20mL玻璃瓶中, 并加入8%的福尔马林溶液保存。在显微镜或解剖镜下进行分类和计数, 样品尽量鉴定到属或种, 然后计数和称重, 换算成单位面积的密度与生物量(谢志才等, 2007)。同时, 测定水深(WD)和透明度(SD), 用YSL多参数仪现场测水温(WT)、pH、溶解氧(DO)、盐度(SAL); 采集水样冷藏保存带回实验室, 用于测定总氮(TN)、叶绿素a (chl a)、总磷(TP)、氨氮(NH3-N)、高锰酸盐指数(CODMn)、磷酸盐(PO43--P)等理化因子, 测定方法参考《水和废水监测分析方法》。滴水湖年均理化指标见表 1。
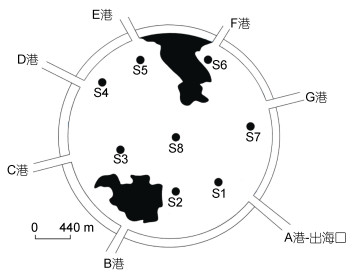 |
| 图 1 滴水湖底栖动物采样站点分布图 Fig. 1 Sampling stations of macrozoobenthos in the artificial Dishui Lake |
| 季节 | pH | WT (℃) |
DO (mg/L) |
SD (cm) |
WD (m) |
SAL | CODMn (mg/L) |
PO43--P (mg/L) |
TP (mg/L) |
NH3-N (mg/L) |
TN (mg/L) |
chl a (μg/L) |
| 春季 | 8.35 | 16.05 | 9.59 | 42.50 | 3.23 | 1.16 | 10.78 | 0.06 | 0.11 | 0.67 | 1.42 | 25.38 |
| 夏季 | 8.83 | 29.28 | 7.49 | 38.15 | 3.48 | 1.57 | 17.25 | 0.10 | 0.10 | 0.70 | 1.27 | 35.70 |
| 秋季 | 8.49 | 19.54 | 8.85 | 33.08 | 3.08 | 0.99 | 14.55 | 0.11 | 0.20 | 0.35 | 1.18 | 34.40 |
| 冬季 | 8.28 | 6.43 | 13.96 | 44.70 | 3.25 | 1.24 | 13.69 | 0.06 | 0.09 | 0.47 | 1.11 | 23.85 |
| 平均值 | 8.49 | 17.83 | 9.97 | 39.61 | 3.26 | 1.24 | 14.07 | 0.08 | 0.12 | 0.55 | 1.24 | 29.83 |
采用物种优势度指数(Y)确定底栖动物的优势种类。运用Shannon-Wiener香农-威纳多样性指数(H')和BPI生物学指数对水质进行评价, 计算公式如下:
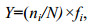 (1)
(1)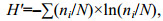 (2)
(2)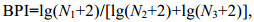 (3)
(3)式中, ni为样品中第i种的个体数, N为所有种类的总个体数, fi为该种出现的站点数占总站点的百分数(陈强等, 2015)。当Y≥0.02时, 该种即为优势种, 当Y≥0.01时, 该种即为常见种(Lampitt et al, 1993; 杨晨昱等, 2018)。N1为寡毛类、蛭类和摇蚊幼虫数量; N2为多毛类、甲壳类、除摇蚊幼虫以外其它水生昆虫数量; N3为软体动物数量。
H'=0(表示未采集到大型底栖动物, 以区别于只有1种动物)为严重污染; H'=0—1为重污染; H'=1—2为中污染; H'=2—3为轻污染; H' > 3为清洁(张蕾等, 2018)。BPI < 0.1为清洁; BPI=0.1—0.5为轻污染; BPI=0.5—1.5为β-中污染; BPI=1.5—5.0为α-中污染; BPI > 5.0为重污染(王浠浠等, 2014)。
1.3 统计分析用SPSS.20软件进行双因素方差分析, 检验季节与站点间底栖动物密度与生物量的差异。利用PRIMER 5.0软件, 分别对不同季节和站点的大型底栖动物物种的相对密度进行聚类分析, 以探讨群落物种组成的时空差异。分析之前, 对数据进行平方根反正弦转换。聚类分析中选择平均连接法和Bray- Curtis距离, 并利用ANOSIM相似性分析检验群落划分是否显著(Chen et al, 2015)。采用Canoco for windows 4.5软件分析大型底栖动物群落结构与环境因子的关系, 分析前对环境变量(除pH外)进行lg(x+1)转换, 对底栖动物数据进行去趋势对应分析(DCA, detrended correspondence analysis), 若最大梯度长度值大于3, 宜选择单峰模型(CCA)排序; 最大梯度长度值小于3, 宜选择线性模型(冗余分析RDA, redundancy analysis)排序(张琦等, 2018; 李科等, 2019), 并通过前选法(Forward selection)和蒙特卡罗检验(Monte Carlo permutation test)排除贡献小的因子。本研究中最大梯度值为2.506 < 3, 故采用冗余分析(RDA)探讨大型底栖动物与环境因子的关系。
2 结果与分析 2.1 物种组成及优势种分析调查结果显示, 共采集到大型底栖动物25种, 隶属于3门7纲, 其中环节动物门有9种, 包括多毛纲4种、寡毛纲4种、蛭纲1种, 占总物种数的36%;节肢动物门有14种, 包括昆虫纲6种、甲壳纲8种, 占总物种数的56%;软体动物门有2种, 均属于双壳纲, 占总物种数的8%。
优势度分析表明, 日本旋卷蜾蠃蜚(Corphium volutator)为全年主要优势种, 优势度是0.369, 其次为微小摇蚊(Microchironomus sp.)、背蚓虫(Notomastus latericeus)、黄色羽摇蚊(Chironomus plumosus)等。春季采集到21种大型底栖动物; 夏季采集到16种; 秋季采集到17种; 冬季采集到19种大型底栖动物(表 2)。
| 物种 | 优势度(Y) | 春季 | 夏季 | 秋季 | 冬季 |
| Ⅰ环节动物门Annelida | |||||
| 寡毛纲Oligochaeta | |||||
| 有栉管水蚓Aulodrilus pectinatus | < 0.001 | + | + | ||
| 线蚓科一种Enchytraeidae sp. | < 0.001 | + | |||
| 克拉泊水丝蚓Limnodrilus claparedeianus | < 0.001 | + | |||
| 霍甫水丝蚓Limnodrilus hoffmeisteri | < 0.01 | + | + | + | + |
| 多毛纲Polychaeta | |||||
| 石缨虫一种Laonome sp. | < 0.01 | + | + | + | + |
| 沙蚕属一种Nereis sp. | < 0.01 | + | + | + | + |
| 背蚓虫Notomastus latericeus | 0.058 | + + | + + | + + | + + |
| 疣吻沙蚕Tylorrhynchus heterochaetus | < 0.001 | + | |||
| 蛭纲Hirudinea | |||||
| 扁蛭属一种Glossiphonia sp. | < 0.001 | + | |||
| Ⅱ节肢动物门Arthropoda | |||||
| 昆虫纲Insecta | |||||
| 指突隐摇蚊Cryptochinonomus digitatus | < 0.01 | + | + | + | + |
| 摇蚊属一种Chironomus sp. | < 0.001 | + | + | + | |
| 雕翅摇蚊属一种Glyptotendipes sp. | < 0.001 | + | |||
| 微小摇蚊属一种Microchironomussp. | 0.159 | + + | + + | + + | + + |
| 红裸须摇蚊Propsilocerus akamusi | < 0.01 | + | + | + | + + |
| 黄色羽摇蚊Chironomus plumosus | 0.045 | + | + + | + + | + + |
| 甲壳纲Crustacea | |||||
| 中华蜾蠃蜚Corophium sinensis | < 0.001 | + | + | ||
| 日本旋卷蜾蠃蜚Corphium volutator | 0.369 | + + | + + | + + | + + |
| 日本大螯蜚Grandidierella japonica | < 0.001 | + | + | + | + |
| 蜾蠃蜚属第一种Corophium sp.1 | < 0.001 | + | + | + | + |
| 蜾蠃蜚属第二种Corophium sp.2 | < 0.001 | + | + | ||
| 钩虾属一种Gammarus sp. | < 0.01 | + | + | + | |
| 等足类一种Isopoda sp. | < 0.001 | + | |||
| 中国周眼钩虾Perioculodes meridichinensis | < 0.01 | + | + | + | + |
| Ⅲ软体动物门Mollusca | |||||
| 双壳纲Bivalvia | |||||
| 河蚬Corbicula fluminea | < 0.001 | + | + | + | |
| 湖球蚬Sphaerium lacustre | < 0.01 | + + | + | + | + |
| 总物种数 | 25 | 21 | 16 | 17 | 19 |
| 注: “+”代表该季节出现的种, “++”代表该季节优势种 | |||||
聚类分析显示, 大型底栖动物群落物种组成在空间上(ANOSIM, R=0.946, P=0.125 > 0.05)和季节上(ANOSIM, R=0.778, P=0.250 > 0.05)均无显著差异(图 2)。
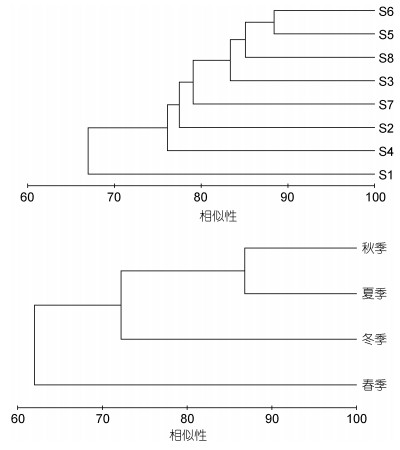 |
| 图 2 滴水湖大型底栖动物群落空间和季节聚类分析 Fig. 2 Spatial and seasonal cluster analysis of macrozoobenthos communities in Dishui Lake |
滴水湖大型底栖动物群落的香浓多样性指数平均为1.67±0.27, 年均密度是(910.5±107.64)ind./m2, 平均生物量是(8.62±2.01)g/m2。其中, 甲壳纲的密度最高, 为463.1ind./m2, 占50.86%, 其次为昆虫纲(297.2ind./m2, 32.64%)和多毛纲(91.9ind./m2, 10.10%), 双壳纲(33.9ind./m2, 3.72%)、寡毛纲(24.4ind./m2, 2.68%)、蛭纲(0.1ind./m2, 0.01%)密度较低; 双壳纲生物量最高(6.33g/m2, 73.46%), 甲壳纲(1.06g/m2, 12.25%)、昆虫纲(0.70g/m2, 8.18%)和多毛纲(0.51g/m2, 5.96%)较高, 寡毛纲(0.01g/m2, 0.14%)和蛭纲(< 0.001g/m2, < 0.001%)极低。就物种密度而言, 日本旋卷蜾蠃蜚最高(415.4ind./m2, 45.62%), 其次为微小摇蚊(208.5ind./m2, 22.90%), 其他物种的密度比例均低于7.73%;生物量河蚬(Corbicula fluminea)最高(5.40g/m2, 62.73%), 其次为日本旋卷蜾蠃蜚(1.04g/m2, 12.07%)和湖球蚬(Sphaerium lacustre, 0.92g/m2, 10.73%), 其他物种的生物量比例均低于5.69%。
春季密度最高为(1316.53±309.24)ind./m2, 其他3个季节较低, 在(751.0—783.0)ind./m2之间变化; 夏季生物量最高为11.86g/m2, 春季和冬季较低, 分别为6.07和6.16g/m2(图 3)。空间分布上, S4站点密度最高[(1612.4±446.57)ind./m2], S7站点密度最低[(291.2± 83.95)ind./m2]; S7站点生物量最高[(20.34±9.94)g/m2], S1最低[(2.07±0.89)g/m2] (图 4)。双因素方差分析表明, 密度、生物量和Shannon-Wiener多样性指数在季节(密度: F=0.719, P=0.546;生物量: F=0.598, P=0.619; Shannon-Wiener多样性指数: F=2.080, P=0.115)和站点(密度: F=1.762, P=0.117;生物量: F=1.352, P=0.247; Shannon-Wiener多样性指数: F=0.315, P=0.944)间均不存在显著差异, 也无交互作用(密度: F=0.627, P=0.877;生物量: F=1.519, P=0.116; Shannon-Wiener多样性指数: F=1.041, P=0.438)。
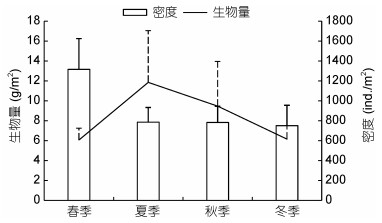 |
| 图 3 滴水湖大型底栖动物的密度和生物量的季节变化 Fig. 3 Seasonal variation in macrozoobenthos density and biomass in Dishui Lake |
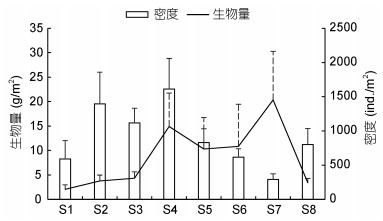 |
| 图 4 滴水湖大型底栖动物密度和生物量的空间变化 Fig. 4 Spatial changes in the macrozoobenthos density and biomass in Dishui Lake |
RDA分析的前两轴特征值分别为0.267和0.084, 解释了底栖动物群落总变异的35.1%。第1和第2轴物种与环境因子的相关系数分别为0.840和0.612, 前2轴属种与环境因子关系的方差累计百分比为84.6%, 说明此排序图较好地反映了底栖动物与环境因子的关系。第1轴主要与磷酸盐(0.734)、叶绿素a(0.710)、CODMn(0.653)、pH(0.528)和水温(0.427)正相关, 与溶解氧(–0.453)负相关; 第2轴主要与溶解氧(0.430)正相关, 与水温(–0.456)、叶绿素a(–0.246)和磷酸盐(–0.192)负相关; 说明轴1主要代表污染特征, 轴2主要主要反映水温特征及其与之相关的溶解氧变化。日本旋卷蜾蠃蜚、日本大螯蜚、红裸须摇蚊、沙蚕属一种、背蚓虫与溶解氧正相关, 与磷酸盐、叶绿素a、CODMn、pH、水温负相关; 微小摇蚊和黄色羽摇蚊等正好相反, 与磷酸盐、叶绿素a、CODMn、pH、水温正相关, 与溶解氧负相关(图 5); 说明日本旋卷蜾蠃蜚、日本大螯蜚、红裸须摇蚊、沙蚕属一种和背蚓虫主要出现在水温较低且溶解氧较高的季节, 微小摇蚊和黄色羽摇蚊主要出现在污染较为严重的水域或季节。
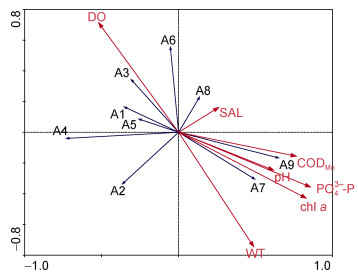 |
| 图 5 滴水湖大型底栖动物与环境因子的RDA二维排序图 Fig. 5 The RDAbiplot of macrozoobenthic species and environmental variables in Dishui Lake 注: A1:红裸须摇蚊Propsilocerus akamusi; A2:湖球蚬Sphaerium lacustre; A3:日本大螯蜚Crandidierella japonica; A4:日本旋卷蜾蠃蜚Corphium volutator; A5:沙蚕属一种Nereis sp.; A6:背蚓虫Heteromatus filiformis; A7:微小摇蚊Microchironomus; A8:石缨虫一种Laonome sp.; A9:黄色羽摇蚊Chironomus plumosus |
根据香浓多样性指数进行的水质评价结果表明, S7站点为轻污染, 其它7个站点属于中污染。BPI生物学指数水质评价结果显示, 8个站点均属于β-中污染(表 3)。
| 站点 | Shannon-Wiener | 水质 | BPI生物学指数 | 水质 |
| S1 | 1.57 | 中污染MP | 0.61 | β-中污染MP |
| S2 | 1.20 | 中污染MP | 0.51 | β-中污染MP |
| S3 | 1.50 | 中污染MP | 0.61 | β-中污染MP |
| S4 | 1.97 | 中污染MP | 0.55 | β-中污染MP |
| S5 | 1.70 | 中污染MP | 0.62 | β-中污染MP |
| S6 | 1.82 | 中污染MP | 0.64 | β-中污染MP |
| S7 | 2.03 | 轻污染LP | 0.51 | β-中污染MP |
| S8 | 1.60 | 中污染MP | 0.62 | β-中污染MP |
日本旋卷蜾蠃蜚和背蚓虫是滴水湖现阶段的优势种, 日本旋卷蜾蠃蜚在长江口潮间带有分布, 在有些潮间带为底栖动物优势种(刘文亮, 2007), 在离长江口很近的一些湖泊和水库如上海淀山湖、青草沙水库和崇明岛明珠湖有所发现或已经成为优势种(汤勇等, 2016; Hu et al, 2016; 刘乐丹等, 2018; 朱利明等, 2019), 但该物种很少在内陆水体中被采集到, 仅在离长江口不是很远的通江湖泊滆湖中有所发现(熊春晖等, 2016)。蜾蠃蜚属其他种也是出现在沿海湖泊或离海洋较近的湖泊中, 如该属一未定种在江苏昆承湖和上野蜾蠃蜚(Corophium uenoi)在厦门筼筜湖中有所报道(郑新庆等, 2011; 徐勇等, 2017)。背蚓虫为潮间带或海洋物种(陶世如等, 2009; 彭松耀, 2017; 李亚芳等, 2018; 张衡等, 2019), 偶尔也能在离河口或海洋较近的湖泊如太湖、淀山湖、固城湖、洪泽湖中发现(许浩等, 2015; Cai et al, 2017; 刘乐丹等, 2018; 王清华等, 2019)。推测日本旋卷蜾蠃蜚和背蚓虫为广盐性属种, 但在进入淡水生态系统还不是很成功。滴水湖盐度由2004年开始蓄水时候的3—3.5逐年下降到2010年的1.24(田华等, 2011), 说明滴水湖因为蓄水在逐渐淡化, 主要生活于海洋和潮间带环境的日本旋卷蜾蠃蜚和背蚓虫的种群数量将如何变化, 值得关注。
大型底栖动物群落结构的时空分布受到多种因素的影响, 这些因素主要包括生境的异质性、底质类型和营养水平等(张超文等, 2012)。底栖动物群落结构的空间差异与空间异质性有关(Gong et al, 2000; Shostell et al, 2007), 滴水湖面积较小, 底质以细沙为主, 空间异质性低, 因此该湖底栖动物群落物种组成、密度、生物量和多样性均无显著空间差异, 在预料之中; 底质异质性低的明珠湖(Hu et al, 2016)和淀山湖(刘乐丹等, 2018)亦无显著空间差异, 即使在比较狭长的上犹江水库仅生物量存在而密度不存在显著空间差异(李科等, 2019)。长江中下游水体底栖动物群落结构常存在较为明显的季节变化, 但也发现不存在季节变化的现象, 如上犹江水库、千岛湖底栖动物密度和生物量无季节变化(胡忠军等, 2010; 李科等, 2019)、杭州湾底栖动物除甲壳类密度外, 其它群落结构参数均不存在显著季节变化(寿鹿等, 2012)。生物群落结构的季节动态主要与繁殖、摄食等内源性因素和环境因子如水温的季节性波动有关(Balon et al, 1983), 滴水湖底栖动物群落结构无季节变化有待进一步研究。
叶绿素a、CODMn和PO43--P是表征水体污染程度的重要指标, 它们越高的地方污染越严重。本文RDA分析表明, 黄色羽摇蚊和微小摇蚊与叶绿素a、CODMn和PO43--P正相关, 与溶解氧负相关, 与它们是耐污染物种有关。微小摇蚊属物种耐污值为8, 属耐污类群(张跃平, 2006), 包含黄色羽摇蚊的羽摇蚊群物种均为有机污染水体的指示物种(姜苹红等, 2011; 张超文等, 2012)。本文结果显示, 红裸须摇蚊(Propsilocerus akamusi)、日本大螯蜚(Grandidierella japonica)、日本旋卷蜾蠃蜚、背蚓虫与水温、叶绿素a、CODMn和PO43--P负相关, 与溶解氧正相关。红裸须摇蚊幼虫为冷水性种类, 具季节性垂直迁移特性(Yamagishi et al, 1972; Guo, 1995), 在水温低于约20℃时, 将潜入底泥深处滞育。在滴水湖红裸须摇蚊为冬季底栖动物优势种, 在其他季节均有出现, 但密度较低, 特别是夏季密度低于0.7ind./m2, 因此红裸须摇蚊与水温负相关可以预料。有研究表明, 日本旋卷蜾蠃蜚与溶解氧正相关, 而与TN、TP和CODMn负相关(赵凤斌等, 2016), 本文结果与此类似。
综合营养状态指数表明, 本研究期间滴水湖处于轻度富营养化状态(田华等, 2011), 采用浮游动物和浮游植物进行生物学评价表明, 本研究前后时期, 该湖已经富营养化(王延洋等, 2008)或处于中度富营养化状态(童琰等, 2012; 林青等, 2014)。本文结果表明, 利用底栖动物对滴水湖水质评价结果与水化学以及浮游生物评价结果基本一致, Shannon-Wiener多样性指数和BPI生物学指数指示, 滴水湖处于中污染状态。如上段所述, 滴水湖优势种黄色羽摇蚊和微小摇蚊为有机污染水体的指示物种, 背蚓虫多分布在有机质丰富的沉积物中(彭松耀等, 2017), 因此指示物种也表明, 滴水湖受到了较为严重的污染。
4 结论(1) 滴水湖底栖动物物种数以节肢动物门居多, 密度以日本旋卷蜾蠃蜚最高, 生物量以河蚬为主导; 群落结构特征无显著季节和空间变化; 日本旋卷蜾蠃蜚和背蚓虫为优势种与该湖为围垦建造而成且经闸通海有关。
(2) 活性磷酸盐、叶绿素a、CODMn、pH和溶解氧是影响底栖动物物种分布的关键环境因子, 日本旋卷蜾蠃蜚、日本大螯蜚、红裸须摇蚊和背蚓虫与溶解氧正相关, 与营养盐水平和水温负相关, 微小摇蚊和黄色羽摇蚊正好相反。
(3) Shannon-Wiener多样性指数和BPI生物指数水质生物学评价表明, 滴水湖处于中度污染状态, 与本文指示物种法及文献报道的水化学和浮游生物评价结果一致, 表明这2个指数适合用于滴水湖水质评价。
王延洋, 李晓波, 吴波, 等. 2008. 上海滴水湖浮游动物研究初报. 上海师范大学学报(自然科学版), 37(2): 167-172 |
王丽卿, 吴亮, 张瑞雷, 等. 2012. 滆湖底栖动物群落的时空变化及水质生物学评价. 生态学杂志, 31(8): 1990-1996 |
王浠浠, 刘凌, 王哲, 等. 2014. 大纵湖大型底栖动物群落结构与水质生物学评价. 环境保护科学, 40(2): 1-7 |
王清华, 邢苏州, 陈红军, 等. 2019. 固城湖渔业生物资源现状与多样性分析. 水产养殖, 40(4): 12-18 |
田华, 刘水芹, 方伟, 等. 2011. 人工湖泊滴水湖水质演变趋势及富营养化分析. 水生态学杂志, 32(6): 26-31 |
朱利明, 肖文胜, 周东, 等. 2019. 淀山湖大型底栖动物群落结构及其与环境因子的关系. 水生态学杂志, 40(2): 55-65 |
刘文亮, 2007.长江河口大型底栖动物及其优势种探讨.上海: 华东师范大学硕士学位论文, 35-37
|
刘乐丹, 王先云, 陈丽平, 等. 2018. 淀山湖底栖动物群落结构及其与沉积物碳氮磷的关系. 长江流域资源与环境, 27(6): 1269-1278 |
刘其根, 查玉婷, 陈立侨, 等. 2012. 浙江分水江水库大型底栖动物群落结构及水质评价. 应用生态学报, 23(5): 1377-1384 |
汤勇, 王绍祥, 陈立婧. 2016. 青草沙水库大型底栖动物群落结构及水质生物学评价. 上海海洋大学学报, 25(6): 873-883 |
许浩, 蔡永久, 汤祥明, 等. 2015. 太湖大型底栖动物群落结构与水环境生物评价. 湖泊科学, 27(5): 840-852 |
寿鹿, 曾江宁, 廖一波, 等. 2012. 杭州湾大型底栖动物季节分布及环境相关性分析. 海洋学报, 34(6): 151-159 |
李科, 张萌, 刘雄军, 等. 2019. 陡水湖流域大型底栖动物群落结构及其环境影响因素. 长江流域资源与环境, 28(4): 939-949 |
李亚芳, 杜飞雁, 王亮根, 等. 2018. 粤西海陵湾养殖区邻近海域大型底栖动物生态学特征. 海洋与湖沼, 49(6): 1294-1307 |
杨晨昱, 张敏, 渠晓东, 等. 2018. 鄱阳湖大型底栖动物群落结构的空间分布及影响因子研究. 生态毒理学报, 13(4): 91-100 |
张琦, 王方鸣, 罗岳平, 等. 2018. 湘江流域大型底栖动物群落结构及其与环境因子的关系. 水生态学杂志, 39(2): 48-57 |
张蕾, 于海燕, 黄旻, 等. 2018. 浦阳江底栖动物群落特征与水质生物评价. 应用与环境生物学报, 24(1): 155-161 |
张衡, 张瑛瑛, 刁山洲, 等. 2019. 长江口盐沼湿地不同亚生境的大型底栖动物群落组成和多样性差异. 生态学杂志, 38(10): 3102-3109 |
张跃平, 2006.江苏大型底栖无脊椎动物耐污值、BI指数及水质生物评价研究.南京: 南京农业大学硕士学位论文, 15-18
|
张超文, 张堂林, 朱挺兵, 等. 2012. 洪泽湖大型底栖动物群落结构及其与环境因子的关系. 水生态学杂志, 33(3): 27-33 |
陈强, 郭行磐, 周轩, 等. 2015. 长江口潮下带大型底栖动物群落特征. 水产学报, 39(8): 1122-1133 |
林青, 由文辉, 徐凤洁, 等. 2014. 滴水湖浮游动物群落结构及其与环境因子的关系. 生态学报, 34(23): 6918-6929 |
郑新庆, 黄凌风, 王蕾, 等. 2011. 筼筜湖大型海藻群落的几种藻栖端足类的种群动态研究. 厦门大学学报(自然科学版), 50(5): 928-933 |
赵凤斌, 陈萍萍, 徐后涛, 等. 2016. 上海市河道底栖动物群落结构与环境因子的关系. 生态环境学报, 25(8): 1361-1368 |
胡忠军, 孙月娟, 刘其根, 等. 2010. 浙江千岛湖深水区大型底栖动物时空变化格局. 湖泊科学, 22(2): 265-271 |
姜苹红, 崔永德, 王海军, 等. 2011. 汉阳湖群底栖动物群落及其对环境质量的指示. 长江流域资源与环境, 20(5): 525-533 |
徐勇, 夏霆, 狄文亮, 等. 2017. 昆承湖大型底栖动物时空分布及对环境修复的指示性. 人民珠江, 38(4): 60-65 |
陶世如, 姜丽芬, 吴纪华, 等. 2009. 长江口横沙岛、长兴岛潮间带大型底栖动物群落特征及其季节变化. 生态学杂志, 28(7): 1345-1350 |
陶征楷, 毕春娟, 陈振楼, 等. 2014. 滴水湖沉积物中重金属污染特征与评价. 长江流域资源与环境, 23(12): 1714-1720 |
梅卫平, 阮慧慧, 吴昊, 等. 2013. 滴水湖水系沉积物中多环芳烃的分布及风险评价. 中国环境科学, 33(11): 2069-2074 |
彭松耀, 李新正, 徐勇, 等. 2017. 十年间黄海大型底栖动物优势种的变化. 海洋与湖沼, 48(3): 536-542 |
童琰, 马明睿, 林青, 等. 2012. 滴水湖浮游植物时空分布动态及其影响因子. 长江流域资源与环境, 21(12): 1499-1506 |
谢志才, 张君倩, 陈静, 等. 2007. 东洞庭湖保护区大型底栖动物空间分布格局及水质评价. 湖泊科学, 19(3): 289-298 |
熊春晖, 张瑞雷, 季高华, 等. 2016. 江苏滆湖大型底栖动物群落结构及其与环境因子的关系. 应用生态学报, 27(3): 927-936 |
Balon E K, Stewart D J, 1983. Fish assemblages in a river with unusual gradient (Luongo, Africa-Zaire system), reflections on river zonation, and description of another new species. Environmental Biology of Fishes, 9(3-4): 225-252 |
Cai Y J, Zhang Y, Wu Z S et al, 2017. Composition, diversity, and environmental correlates of benthic macroinvertebrate communities in the five largest freshwater lakes of China. Hydrobiologia, 788(1): 85-89 |
Chen L P, Zhang Y, Liu Q G et al, 2015. Spatial variations of macrozoobenthos and sediment nutrients in Lake Yangcheng:Emphasis on effect of pen culture of Chinese mitten crab. Journal of Environmental Science:English Edition, 37(11): 118-129 |
Gong Z J, Xie P, Wang S D, 2000. Macrozoobenthos in 2 shallow, mesotrophic Chinese lakes with contrasting sources of primary production. Journal of the North American Benthological Society, 19(4): 709-724 |
Guo X W, 1995. Studies on chironomid communities of Nanhu Lake (south Lake), Wuhan, China. Journal of Huazhong Agricultural University, 14(6): 578-585 |
Hu Z J, Jia X X, Chen X H et al, 2016. Spatial and seasonal pattern of macrozoobenthic assemblages and the congruence in water quality bioassessment using different taxa in artificial Mingzhu Lake in Shanghai. Chinese Journal of Oceanology and Limnology, 34(5): 928-936 |
Kerans B L, Karr J R, 1994. A benthic index of biotic integrity (B-IBI) for rivers of the Tennessee Valley. Ecological Applications, 4(4): 768-785 |
Lampitt R S, Wishner K F, Turley C M et al, 1993. Marine snow studies in the Northeast Atlantic Ocean:distribution, composition and role as a food source for migrating plankton. Marine Biology, 116(4): 689-702 |
Shostell J M, Williams B S, 2007. Habitat complexity as a determinate of benthic macroinvertebrate community structure in cypress tree reservoirs. Hydrobiologia, 575: 389-399 |
Xie Z C, Cai Q H, Tang T et al, 2003. Structure of macrozoobenthos of the East Dongting nature reserve, with emphasis on relationships with environmental variables. Journal of Freshwater Ecology, 18(3): 405-413 |
Yamagishi H, Fukuhara H, 1972. Vertical migration of Spaniotoma akamusi larvae (Diptera:Chironomidae) through the bottom deposits of Lake Suwa. Japanese Journal of Ecology, 22(5): 226-227 |
 2020, Vol. 51
2020, Vol. 51


