中国海洋湖沼学会主办。
文章信息
- 朱婷芳, 管峰, 苗亮, 史雨红, 陈炯. 2020.
- ZHU Ting-Fang, GUAN Feng, MIAO Liang, SHI Yu-Hong, CHEN Jiong. 2020.
- 大弹涂鱼(Boleophthalmus pectinirostris)单核巨噬细胞低氧胁迫比较转录组学分析
- COMPARATIVE TRANSCRIPTOME ANALYSIS OF MO/MΦ IN RESPONSE TO LOW OXYGEN STRESS IN MUDSKIPPER BOLEOPHTHALMUS PECTINIROSTRIS
- 海洋与湖沼, 51(2): 335-344
- Oceanologia et Limnologia Sinica, 51(2): 335-344.
- http://dx.doi.org/10.11693/hyhz20191100223
文章历史
-
收稿日期:2019-11-22
收修改稿日期:2019-12-27
2. 宁波大学海洋学院 生物化学与分子生物学实验室 宁波 315832;
3. 宁波大学海洋学院 应用海洋生物技术教育部重点实验室 宁波 315832
2. Laboratory of Biochemistry and Molecular Biology, School of Marine Science, Ningbo University, Ningbo 315832, China;
3. Key Laboratory of Applied Marine Biotechnology of Ministry of Education, School of Marine Science, Ningbo University, Ningbo 315832, China
对大多数生物体来说, 氧气是必不可少的, 因此, 生物体中氧的吸收和代谢受严格控制。然而, 环境、病理以及生理条件变化均可导致氧气供应减少(Van Der Meer et al, 2005)。与陆地环境相比, 水环境中溶解氧含量变化剧烈(Bickler et al, 2007)。因此, 与哺乳动物和鸟类相比, 鱼类更能适应溶解氧含量的变化(Xiao, 2015)。低氧胁迫可影响鱼类的行为、生长、摄食、性别和生理状态(Foss et al, 2002; Robertson et al, 2014; Abdel-Tawwab et al, 2015)。而且, 鱼类细胞也可感知和传导低氧胁迫信号, 通过基因表达调控改变生化反应, 从而响应低氧胁迫(Terova et al, 2008)。复杂的生化反应包括血糖浓度降低、糖有氧氧化等代谢反应抑制、乳酸积累、红细胞压积、血红蛋白O2亲和力以及无氧呼吸增加(Jensen et al, 1993; Virani et al, 2000; Cadiz et al, 2018)。在转录水平, 响应低氧胁迫的基因包括低氧诱导因子(hypoxia-inducible factors, HIF)、血管内皮生长因子(vascular endothelial growth factor-A, VEGF-A)、3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GAPDH)、促红细胞生成素(erythropoietin, EPO)和葡萄糖转运蛋白(glucose transporter, GLUT)等基因。HIF是一种主要由低氧诱导细胞产生的重要的转录因子, 介导基因表达的变化, 从而在维持动态氧平衡中发挥着重要作用(Semenza, 1999)。VEGF-A是一种具有血管通透性的蛋白, 可刺激血管生成, 增加O2供应(Zhong et al, 2009; Shibuya, 2011)。GAPDH是糖酵解通路的关键酶, 催化3-磷酸甘油醛+NAD++Pi反应生成1, 3-二磷酸甘油酸+NADH+H+(Chiche et al, 2015)。EPO是低氧胁迫诱导的与红细胞生成有关的蛋白(Xiao, 2015)。GLUT是低氧诱导的促进细胞葡萄糖摄取的蛋白(Zhang et al, 2003)。这些重要基因往往也是氧传感通路(oxygen-sensing pathway)中的关键成员。氧传感通路包括HIF信号转导途经、哺乳动物类雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号转导途经、未折叠蛋白反应(unfolded protein response, UPR)和核因子-κB (nuclear factor-κB, NF-κB)信号转导途经等(Wouters et al, 2008; Majmundar et al, 2010; Xiao, 2015)。上述信号转导途经通过激活转录和抑制翻译等方式促进动物响应和适应低氧胁迫(Wouters et al, 2008; Majmundar et al, 2010)。
大弹涂鱼(Boleophthalmus pectinirostris, mudskipper)主要分布在中国和日本的潮间带(Chen et al, 2015; 梁亚芳等, 2018)。大弹涂鱼构建的洞穴含水量较低, 水环境中经常出现低氧情况, 可能是少数在低氧环境中自然呼吸的脊椎动物(Aguilar et al, 2000)。由于其特殊的生理特性, 使其成为研究低氧胁迫对鱼类的影响以及鱼类响应低氧胁迫机制较为合适的动物模型。研究鱼类的低氧响应机制, 不仅有助于我们了解低氧信号通路的进化, 而且对耐低氧鱼类物种/品系的选育也具有重要的指导意义。
1 材料与方法 1.1 实验动物健康大弹涂鱼, 体重30—40g/尾, 购自浙江省宁波市路林市场。暂养期间水温为(24±1)℃, 盐度为10, 不间断充气, 每天投喂饲料一次, 每天换水50%。实验室条件下暂养两周, 并选择全身无病症的鱼进行实验。
1.2 实验方法 1.2.1 大弹涂鱼头肾源单核巨噬细胞(monocytes/ macrophages, MO/MФ)的原代培养用丁香酚(Eugenol)(国药集团化学试剂有限公司, 上海)麻醉大弹涂鱼, 取血后采集头肾。大弹涂鱼MO/MФ的分离培养参考本实验室已建立的方法(Ding et al, 2019), 采用Ficoll-Paque Premium (GE healthcare, 美国)密度梯度离心方法分离细胞, 获得含有MO/MΦ的白色细胞混悬层。用RPMI 1640培养基洗去未贴壁细胞, 重复2次, 用完全培养基(RPMI 1640、5%胎牛血清、5%大弹涂鱼血清和1%青霉素/链霉素) 24℃继续培养贴壁细胞。经Giemsa′s染色后镜检细胞的形态, 确认超过95%贴壁细胞属于MO/MΦ。
1.2.2 低氧胁迫处理大弹涂鱼MO/MΦ参考已发表论文, 大弹涂鱼MO/MФ置于细胞培养小室(Billups-Rothenberg, 美国) 24℃培养(Guan et al, 2017)。将大弹涂鱼MO/MФ随机分为2组:常氧处理组(Z组) (21% O2, 5% CO2, 4% N2)和低氧处理组(D组) (1% O2, 5% CO2, 94% N2), 每组3个平行实验, 各组处理8h。处理结束后清洗细胞立即置于液氮中冷冻, −80℃保存备用。
1.2.3 大弹涂鱼MO/MΦ转录组文库构建和测序用RNAiso试剂(Invitrogen, 上海)方法根据说明书提取大弹涂鱼MO/MΦ的总RNA。采用Illumina Hiseq 4000 (联川生物技术有限公司, 杭州)进行测序。每个样本取出5μg总RNA, 使用Oligo(dT)磁珠(Invitrogen)进行两轮纯化, 对其中带有多聚腺苷酸(PolyA)的mRNA进行特异性捕获。将捕获到的mRNA在高温条件下利用二价阳离子进行片段化。将片段化的RNA基于Illumina RNA连接法(Illumina, 美国)合成cDNA。在Illumina Hiseq 4000平台按照标准程序进行测序, 读长150bp。常氧处理组和低氧处理组各3个生物学重复均同时进行测序。
1.2.4 数据处理与差异表达基因(differentially expressed genes, DEGs)分析在Illumina Hiseq 4000平台获得原始序列(Raw data), 在RSeQC (2.4)中检测Raw data的质量, 在FastQC (0.10.1)中去除带接头(Adaptor)的reads, 含有N (N表示无法确定碱基信息)的比例大于5%的reads和低质量reads (质量值Q≤10的碱基数占整个reads的20%以上), 得到Clean data。利用HISAT (Hierarchical Indexing for Spliced Alignment of Transcripts) (2.0)软件将大弹涂鱼MO/MΦ各个文库的Clean data分别与现有的大弹涂鱼全基因组序列比对。参考基因和基因组注释文件下载自NCBI网站(https://www.ncbi.nlm.nih.gov/ assembly/GCA_000788275.1/)。String Tie (1.3.0)软件用于read比对组装, Ballgown软件用于差异分析。将每个Clean data序列的数目标准化为FPKM (fragments per kilobase of exon model per million mapped reads), 用以代表该基因的表达水平, 在P < 0.05和|log2(fold change)|≥1条件下(fold change:差异倍数, FC)筛选两个样本之间的DEGs。
1.2.5 基因的功能注释依据非冗余(Non- redundant, Nr)数据库中的注释信息, 将大弹涂鱼参考基因组转录本序列分别与基因本体论数据库(Gene Ontology, GO) (http://geneontology.org)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG) (www.genome.jp/kegg)数据库进行BlastX比对, 设置E-value为1E-5, 保留每个基因比对到的所有的GO term和KEGG通路, 从而获得每个基因的GO和KEGG注释并使用软件GOseq(1.18.0)和KOBAS软件对差异基因进行GO、KEGG富集。
1.2.6 实时荧光定量PCR (real-time quantitative PCR, qRT-PCR)随机选择10个DEGs,用Primer Premier 5软件设计引物(表 1), 进行qRT-PCR分析。将各样品进行3次生物学重复的RNA采用第一链cDNA合成试剂盒(Promega, 美国)反转录为cDNA, 以此为模板, 18S rRNA基因为内参, 采用TaKaRa公司的SYBR Green RT-PCR试剂盒, 利用Light Cycler 480 (Roche, 瑞士)进行荧光定量检测。各样品的每个基因重复4次, 按2–ΔΔCt相对定量法计算相对表达量。反应体系为20.0µL (cDNA模板1.0µL, 上下游引物各1.0µL, SYBR Green染料12.5µL, 无菌去离子水9.5µL)。扩增程序为: 95℃预变性5min, 95℃变性30s, 60℃退火30s, 72℃延伸30s, 变性至延伸共40个循环; 熔解曲线94℃ 30s, 72℃ 60s, 95℃ 30s。所有数据均以标准平均误(standard error of the mean, SEM)表示(Chen et al, 2019)。
| 基因 | 引物序列(5′—3′) | |
| 正向引物 | 反向引物 | |
| BAX | AAGGCATGGTGAAGGCAATG | TTCATCACCGATCTGCTGGA |
| VEGFA | CGTTGTAACAGGCTTGCAGT | GTCCTCTTTGTTGTGGCGTT |
| TBP | AACATGGTGGGTAGCTGTGA | CAGGGAAGAGCTCAGGTTCA |
| CAMMKK2 | CTCTGCCTGTTCCCTTCTGA | CCACATGAAGACACGGGTTC |
| GAPDH | TTCGGCATCATTGAGGGTCT | CGGGAATGATGTTCTGGCTG |
| GTF3A | ACCTCTGCAAGCATACTGGA | AGCCCTCAACAACACACTTG |
| MRPL53 | AAGTCTACCGTGGTGCTGAA | TGGTTGCTCGGACTTTCTCT |
| TMEM144 | GCTGGAATGTGTCTGCTCAG | CCAAAGCTGCCAGAGTTTGT |
| IDE | GTGAAGAGGGTGGTGACTGA | CACTGATGAGCATGGCCTTC |
| CHST12 | CACCCATGCCAGATCCAGTA | ACTCCACGACATTGTCCACT |
| Bp18S rRNA | GGCCGTTCTTAGTTGGTGGA | CCCGGACATCTAAGGGCATC |
| 注: BAX:凋亡蛋白; VEGFA:血管内皮生长因子A; TBP:端粒结合蛋白; CAMMKK2:钙/钙调素依赖性蛋白激酶2; GAPDH: 3-磷酸甘油醛脱氢酶; GTF3A:通用转录因子3A; MRPL53:线粒体核糖体蛋白L53; TMEM144:跨膜蛋白144; IDE:胰岛素降解酶; CHST12:硫酸软骨素磺基转移酶; Bp18S rRNA:内参基因 | ||
本研究以三组常氧处理组和三组低氧处理组的大弹涂鱼MO/MΦ总RNA为模板, 构建了6个cDNA文库。利用Illumina Hiseq 4000分别对大弹涂鱼MO/MΦ常氧处理组和低氧处理组进行了转录组测序。原始数据上传至NCBI Short Read Archive (SRA), 登录号分别为SRR9771486—SRR9771491 (Bioproject PRJNA543702)。常氧处理组平均获得46321325个Clean reads, 可比对到参考基因组reads数目平均为41186267个, 占所有reads的88.89%。碱基质量及组成分析显示, 每组GC含量区间为47.00%—48.50%, 各样品Q30的碱基质量值比例均不小于95.40% (表 2); 低氧处理组平均获得52155548个Clean reads, 可比对到参考基因组reads数目平均为47405512个, 占所有reads的90.85%, 碱基质量及组成分析显示, 每组GC含量区间为46.00%—46.50%, 各样品Q30的碱基质量值比例均不小于94.55% (表 2)。
| 样品 | 原始Reads数量 | 高质量Reads数量 | 数据大小(Gb) | GC含量(%) | Q30(%) |
| 常氧处理组 | |||||
| Z1 | 45009018 | 44513496 | 6.68 | 48.50 | 95.40 |
| Z2 | 47029388 | 46453642 | 6.97 | 47.00 | 96.19 |
| Z3 | 48594320 | 47996836 | 7.20 | 47.00 | 96.47 |
| 低氧处理组 | |||||
| D1 | 52006536 | 51386822 | 7.08 | 46.50 | 94.81 |
| D2 | 49485232 | 48844400 | 7.42 | 46.50 | 94.55 |
| D3 | 57012470 | 56235422 | 8.55 | 46.00 | 96.12 |
| 注: Q30:质量值≥30的碱基所占百分比 | |||||
参照大弹涂鱼全基因组转录本信息, 在P < 0.05和|log2(FC)|≥1条件下, 低氧处理组共获得4487个DEGs (图 1a)。其中上调DEGs有2507个, 下调DEGs有1980个(图 1b)。
 |
| 图 1 大弹涂鱼MO/MΦ低氧处理组DEGs分析 Fig. 1 Different expression gene analysis for the hypoxia groups of mudskipper MO/MΦ 注: a.火山图, 红色点指示上调的DEGs; 蓝色点指示下调的DEGs; 灰色点指示表达差异不显著的基因; b. DEGs数量统计 |
在低氧处理组中, 上调DEGs的GO富集分析结果显示, 共931个基因获得GO功能注释, 包括678个分子功能(molecular function) (34.24%)、308个细胞组分(cellular component) (15.56%)、994个生物过程(biological process) (50.20%)。下调DEGs的GO富集分析结果显示, 共662个基因获得GO功能注释, 包括674个分子功能(molecular function) (37.99%)、221个细胞组分(cellular component) (12.46%)、879个生物过程(biological process) (49.55%)。各选取3个类别中上调或下调DEGs最多的10个GO节点(图 2)。
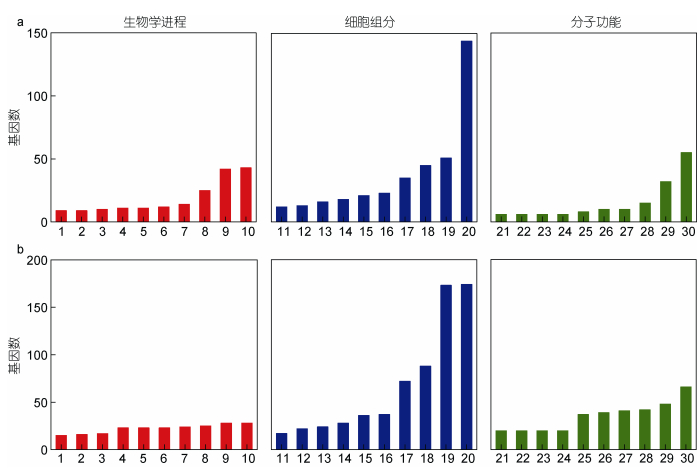 |
| 图 2 大弹涂鱼MO/MΦ低氧处理组上、下调DEGs的GO分析 Fig. 2 Gene ontology analyses of up- and down-regulated genes of hypoxia in mudskipper MO/MΦ 注: GO分为三类:细胞成分、分子功能和生物学过程。纵坐标表示主类中的不同亚类基因数量, 横坐标表示基因分类。a.上调差异基因。1: DNA复制起始; 2:细胞质翻译; 3:来自三顺反子rRNA转录本的SSU-rRNA的成熟(SSU-rRNA, 5.8S rRNA, LSU-rRNA); 4:细胞周期; 5:细胞对DNA损伤刺激的反应; 6:甲基化; 7: DNA修复; 8: DNA复制; 9:氧化还原过程; 10:翻译; 11:核糖体; 12:细胞内核糖核蛋白复合物; 13:线粒体内膜; 14:内质网膜; 15:胞质小核糖体亚基; 16:胞质大核糖体亚基; 17:核仁; 18:细胞溶质; 19:线粒体; 20:细胞核; 21: FK506结合; 22: RNA聚合酶III活性; 23: DNA解旋酶活性; 24: DNA钳装载器活性; 25: mRNA结合; 26:解旋酶活性; 27:肽酰-脯氨酰顺反式异构酶活性; 28: poly(A)RNA结合; 29: RNA结合; 30:核糖体的结构成分。b.下调差异基因。1: DNA依赖性转录; 2:代谢过程; 3:跨膜转运; 4:转运; 5:磷酸化; 6:蛋白质磷酸化; 7:氧化还原过程; 8:蛋白质水解; 9: DNA依赖性转录调控; 10:信号转导; 11:高尔基体; 12:细胞溶质; 13:内质网; 14:线粒体; 15:质膜; 16:质膜的整体成分; 17:细胞核; 18:细胞质; 19:膜; 20:膜的整体成分; 21: DNA结合; 22:激酶活性; 23:氧化还原酶活性; 24:蛋白结合; 25:水解酶活性; 26:转移酶活性; 27:核苷酸结合; 28:锌离子结合; 29: ATP结合; 30:金属离子结合 |
上调基因中, 排列前三的分子功能类型为翻译(translation)、氧化还原过程(oxidation-reduction process)、DNA复制(DNA replication), 数目分别是43、42、25个; 排列前三的细胞组分类型为细胞核(nucleus)、线粒体(mitochondrion)、细胞溶质(cytosol), 数目分别为144、51、45个; 排列前三的生物过程类型为核糖体的结构成分(structural constituent of ribosome)、RNA结合(RNA binding)、poly(A) RNA结合(poly(A) RNA binding), 数目分别是55、32、15个。下调基因中, 排列前三的分子功能类型为信号转导(signal transduction)、DNA依赖性转录调控(regulation of transcription, DNA-templated)、蛋白质水解(proteolysis), 数目分别是28、28、25个; 排列前三的细胞组分类型为膜的整体成分(integral component of membrane)、膜(membrane)、细胞质(cytoplasm), 数目分别是174、173、88个; 排列前三的生物过程类型为金属离子结合(metal ion binding)、ATP结合(ATP binding)、锌离子结合(zinc ion binding), 数目分别是66、48、42个。
具有注释的上调DEGs有500个, 涉及206条KEGG通路; 具有注释的下调DEGs有357个, 涉及211条KEGG通路相关。选取的上调DEGs前30条显著富集的代谢通路(图 3a)。包括核糖体(ribosome)、DNA复制(DNA replication)、错配修复(mismatch repair)、嘧啶代谢(pyrimidine metabolism)、核酸切除修复(nucleotide excision repair)、细胞周期(cell cycle)、RNA聚合酶(RNA polymerase)、同源重组(Homologous recombination)、氧化磷酸化(Oxidative phosphorylation)等通路。选取的下调DEGs前30条显著富集的代谢通路(图 3b)。下调DEGs涉及包括沙门氏菌感染(salmonella infection)、糖基磷脂酰肌醇-锚定生物合成(glycosylphosphatidylinositol-anchor biosynthesis)、脂肪酸降解(fatty acid degradation)、胰腺癌(Pancreatic cancer)、N-聚糖生物合成(N-Glycan biosynthesis)、胞吞(endocytosis)、糖胺聚糖生物合成-硫酸软骨素/硫酸皮肤素(glycosaminoglycan biosynthesis-chondroitin sulfate/dermatan sulfate)、急性髓系白血病(acute myeloid leukemia)、ABC转运蛋白(ABC transporters)等通路。
 |
| 图 3 KEGG富集分析上、下调DEGs参与的信号通路 Fig. 3 KEGG analysis for signaling pathways participated by up- and down-regulated DEGs 注:富集因子=在路径中富集的DEGs的数量/背景基因集中所有基因的数量。每个气泡的大小和颜色分别代表在路径中富集的DEGs的数量和富集的意义。a.上调差异基因。1:泛醌和其他萜醌生物合成; 2:甾体生物合成; 3:剪接体; 4: RNA转运; 5: RNA聚合酶; 6:核糖体; 7:嘧啶代谢; 8:嘌呤代谢; 9: p53信号通路; 10:氧化磷酸化; 11:叶酸碳库; 12:核苷酸切除修复; 13:氮代谢; 14:错配修复; 15:同源重组; 16:造血细胞系; 17:乙醛酸和二羧酸代谢; 18:甘氨酸、丝氨酸和苏氨酸代谢; 19:谷胱甘肽代谢; 20:脂肪酸延长; 21:范可尼贫血途径; 22:药物代谢-其他酶; 23:药物代谢-细胞色素P450; 24: DNA复制; 25:细胞溶质DNA传感途径; 26:细胞周期; 27:碳代谢; 28:氨基酸生物合成; 29:碱基切除修复; 30:精氨酸和脯氨酸代谢。b.下调差异基因。1:缬氨酸、亮氨酸和异亮氨酸降解; 2:沙门氏菌感染; 3:肾细胞癌; 4: PPAR信号通路; 5:磷脂酶D信号通路; 6:噬菌体; 7:戊糖与葡萄糖醛酸的相互转化; 8:癌症的途径; 9:胰腺癌; 10: N-聚糖生物合成; 11:黑色素生成; 12: MAPK信号通路; 13:溶酶体; 14:长寿调节途径-哺乳动物; 15:胰岛素信号通路; 16: GnRH信号通路; 17:糖基磷脂酰肌醇-锚定生物合成; 18:糖胺聚糖生物合成-硫酸角蛋白; 19:糖胺聚糖生物合成-硫酸乙酰肝素/肝素; 20:糖胺聚糖生物合成-硫酸软骨素/硫酸皮肤素; 21:甘油脂代谢; 22:脂肪酸代谢; 23:脂肪酸降解; 24:胞吞; 25:背腹轴形成; 26:结直肠癌; 27:抗坏血酸和新陈代谢; 28: AGE-RAGE信号通路在糖尿病并发症中的作用; 29:急性髓系白血病; 30: ABC转运蛋白 |
从转录组分析结果中随机挑选10个DEGs, 通过实时荧光定量PCR相对定量法检测其在低氧处理组与常氧处理组中的表达差异, 并与转录组分析结果进行比较(图 4)。基因BAX、VEGFA、TBP、CAMKK2、GAPDH、GTF3A、MRPL53、TMEM144、IDE和CHST1210条DEGs在低氧处理后的变化趋势与转录组中基因表达分析结果一致, 证明了转录组分析结果的真实性和可靠性。
 |
| 图 4 随机选择10个DEGs的qRT-PCR验证 Fig. 4 Verification of randomly selected 10 DEGs by qRT-PCR 注: 1: BAX; 2: VEGFA; 3: TBP; 4: CAMKK2; 5: TMEM144; 6: MRPL53; 7 GAPDH; 8: GTF3A; 9: IDE; 10: CHST12; 内参基因: Bp18S rRNA; n=4 |
低氧是一种重要的环境压力源, 影响水生生物的生存、繁殖、生长和发展, 进而对整个水生生态系统产生深远影响(Shang et al, 2004)。许多鱼类能够在转录水平上运作一套复杂的分子战略来响应低氧胁迫(Gracey et al, 2001; van Der Meer et al, 2005; Zhong et al, 2009)。HIF基因已被公认为低氧信号通路的主要调节因子; HIF基因在维持动态氧平衡和调节低氧条件下氧浓度的变化方面发挥着重要作用(Xiao, 2015)。低氧胁迫120d致使团头鲂(Megalobrama amblycephala, blunt snout bream)的不同组织中HIF-1α/2α基因mRNA表达增加(Li et al, 2015)。低氧胁迫1h后, 河鲈(Perca fluviatilis, Eurasian perch)脑和肝脏中HIF-1α基因的表达增加, 低氧胁迫15d后, 肌肉中HIF-1α基因表达显著增加, 脑和肝脏中HIF-1α基因的表达变化不显著(Rimoldi et al, 2012)。印度鲶鱼(Clarias batrachus, Indian catfish)低氧胁迫1h或6h后, 脑、肝和头肾中HIF-1α和HIF-2α基因表达显著增加, 而在自然条件下的长期低氧胁迫下, 脾脏HIF-1α基因表达显著增加, 肌肉HIF-2α基因表达显著增加(Mohindra et al, 2013)。但研究发现, 其他鱼类中HIF基因的表达方式并不一致。低氧胁迫处理72h后, 花斑裸鲤(Gymnocypris eckloni, piebald naked carp)多个组织中HIF-1α/2α基因均未检测到显著变化(Qi et al, 2018)。此外, 低氧胁迫1.5h后, 斑点叉尾鮰(Ictalurus punctatus, channel catfish)大部分组织中HIF-1α基因表达显著降低; 而低氧胁迫5h后, HIF-1α基因表达显著增加(Geng et al, 2014)。HIF-1可通过与HIF-1靶基因启动子和增强子区的低氧反应元件(hypoxia response elements, HREs)结合, 激活靶基因的转录表达以响应低氧胁迫, 如VEGF基因(Nikinmaa et al, 2005)。VEGF-A蛋白通过结合和激活VEGFR-1 (VEGF receptor-1)和VEGFR-2, 促进血管生成、血管通透性、细胞迁移和基因表达(Shibuya, 2011)。低氧胁迫7d诱导点带石斑鱼(Epinephelus coioides, orange-spotted grouper) VEGF基因的表达, 而该基因的表达有利于氧输送增加(Yu et al, 2008)。低氧胁迫诱导眼斑星丽鱼(Astronotus ocellatus, cichlid fish) 3h, 肝脏VEGF基因的表达显著增加(Baptista et al, 2016)。虽然GAPDH基因是HIF-1的靶向基因, 但低氧胁迫时GAPDH基因的表达也可激活NF-κB和HIF-1信号转导通路, 进而导致VEGF-A蛋白的分泌增加; 此外, GAPDH蛋白与RNA结合的能力在一定程度上也可以稳定HIF-1α或VEGF-A的mRNA表达(Chiche et al, 2015)。尼罗罗非鱼(Oreochromis niloticus, Nile tilapia)低氧胁迫12h后, 心脏GAPDH基因表达显著增加(Xia et al, 2018)。本研究中, 低氧胁迫大弹涂鱼MO/MΦ 8h, 转录组DEGs分析显示, HIF-1α基因转录本的表达无显著变化, 而VEGF-A和GAPDH基因表达上调。
功能注释可将基因分成功能相关的基因群或归入不同的通路, 可根据基因群的重要性排序, 借助高通量技术快速揭开其中的生物学机制(Xia et al, 2018)。据文献报道, 鱼类在应对短时低氧胁迫时, 氧化磷酸化(oxidative phosphorylation)、糖酵解(glycolysis)和糖原分解(glycogenolysis)通路相关基因表达量显著增加, 显示通过糖类物质分解和氧化磷酸化作为获取能量主要方式, 氧化磷酸化反应增加是低氧的早期反应, 有可能是利于维持ATP的稳定(Everett et al, 2012)。而在长期低氧胁迫中, 脂质分解(lipolysis)则作为能量供应的主要来源(Li et al, 2018)。低氧胁迫长颌姬鰕虎鱼(Gillichthys mirabilis, long-jawed mudsucker) 8h、24h、72h和144h, 心肌的氧化磷酸化通路中的细胞色素氧化酶I基因(cytochrome oxidase subunit I, COI)表达有不同程度的增加; 骨骼肌中, 细胞色素b (cytochrome b, Cyb)和COI基因表达也显著增加, 而在肝脏中这两个基因未显著变化, 但肝脏中糖酵解通路相关基因表达显著上调并且随着胁迫时间的延长而继续增加(Gracey et al, 2001)。低氧胁迫大底鳉(Fundulus grandis, gulf killifish) 4h的肝脏和96h的心脏中氧化磷酸化通路相关基因表达显著增加, 包括复合物I (NADH脱氢酶) (NADH dehydrogenase, ND)和复合物IV(细胞色素C氧化酶) (cytochrome coxidase, COX)的不同亚基基因的表达显著增加(Everett et al, 2012)。低氧胁迫5d后, 日本青鳉(Oryzias latipes, medaka)鳍中糖酵解和氧化磷酸化通路相关基因表达增加(Zhang et al, 2012)。低氧胁迫72h后, 花斑裸鲤(Gymnocypris eckloni)的肌肉中糖酵解/糖异生(glycolysis/gluconeogenesis)通路的相关基因表达增加(Qi et al, 2018)。低氧胁迫2d、4d、7d后, 草鱼(Ctenopharyngodon idella, grass carp)鳃组织中糖酵解途径相关蛋白表达增加(Xu et al, 2019)。低氧胁迫6h后, 杂交斑纹鲈(Morone saxatilis × Morone chrysops, striped bass × white bass)肝脏中脂肪酸代谢和脂蛋白代谢相关基因有明显下调(Beck et al, 2016)。低氧胁迫6h或12h后, 尼罗罗非鱼幼鱼心脏或成鱼肝脏的糖酵解/糖异生通路和脂肪酸代谢通路的相关基因表达均增加(Li et al, 2018; Xia et al, 2018)。低氧胁迫4周后, 尼罗罗非鱼肝脏中糖异生和脂质分解通路相关基因表达上调, 而糖酵解和脂质的合成通路相关基因表达下调(Li et al, 2018)。但也有例外, 如斑马鱼(Danio rerio, zebrafish)低氧胁迫3周后, 鳃中糖酵解通路相关基因表达增加, 氧化磷酸化通路(包括12个ND亚基基因下调, 2个COX亚基基因下调)以及脂质代谢相关基因表达降低(Van Der Meer et al, 2005)。本研究中低氧胁迫大弹涂鱼的MO/MΦ 8h后, 氧化磷酸化通路中有19个基因表达显著上调, 如细胞色素复合物(cytochrome b-c1, Cyb-c1)、COX、ND、ATP合酶(ATP synthase)部分亚基转录本增加。此外, 低氧处理组糖酵解/糖异生通路中GAPDH、磷酸果糖激酶(肌肉)(phosphofructokinase, muscle, PFKM)、果糖二磷酸醛缩酶B (fructose-bisphosphate aldolase B, ALDOB)等6个基因转录本上调。而脂类代谢相关通路(甘油脂代谢、脂肪酸代谢、脂肪酸降解)相关基因表达显著下降。这与上述多数鱼类中低氧胁迫后mRNA或蛋白表达分析一致。
根据上述分析, 本研究大弹涂鱼MO/MΦ短时低氧胁迫后, DEGs、GO以及KEGG富集分析结果与其他鱼类存在差异。低氧胁迫造成基因表达差异可能与物种有关(Qi et al, 2018)。涨潮或冬天, 大弹涂鱼会躲避在洞穴中, 而在洞穴中会经历低氧胁迫(Toba et al, 2014)。大弹涂鱼在洞穴低氧胁迫8h时, 不需进行无氧代谢并且不受到乳酸积累的影响(Toba et al, 2014)。此外, 鱼类在低氧胁迫条件下所产生的应激反应具有组织特异性(Richards, 2009)。而且适当的低氧胁迫可能改变鱼类头肾甚至是分离的MO/MΦ的免疫反应(Kvamme et al, 2013)。
4 结论综上所述, 本研究采用有参转录组分析方法揭示了在短时低氧胁迫下大弹涂鱼MO/MΦ基因表达及信号通路调控机制, 低氧诱导因子转录本的表达无显著变化, 血管内皮生长因子以及3-磷酸甘油醛脱氢酶基因转录本表达上调。揭示了糖酵解/糖异生和氧化磷酸化可能在MO/MΦ应对短时低氧胁迫中具有重要作用, 为鱼类在低氧条件下的响应机制提供了新的见解。
梁亚芳, 史雨红, 苗亮, 等. 2018. 大弹涂鱼(Boleophthalmus pectinirostris)Gal-8L基因序列及其细菌凝集活性的鉴定. 海洋与湖沼, 49(2): 413-421 |
Abdel-Tawwab M, Hagras A E, Elbaghdady H A M et al, 2015. Effects of dissolved oxygen and fish size on Nile tilapia, Oreochromis niloticus (L. ):growth performance, whole-body composition, and innate immunity. Aquaculture International, 23(5): 1261-1274 |
Aguilar N M, Ishimatsu A, Ogawa K et al, 2000. Aerial ventilatory responses of the mudskipper, Periophthalmodon schlosseri, to altered aerial and aquatic respiratory gas concentrations. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 127(3): 285-292 |
Baptista R B, Souza-Castro N, Almeida-Val V M F., 2016. Acute hypoxia up-regulates HIF-1α and VEGF mRNA levels in Amazon hypoxia-tolerant Oscar (Astronotus ocellatus). Fish Physiology and Biochemistry, 42(5): 1307-1318 DOI:10.1007/s10695-016-0219-1 |
Beck B H, Fuller S A, Li C et al, 2016. Hepatic transcriptomic and metabolic responses of hybrid striped bass (Morone saxatilis×Morone chrysops) to acute and chronic hypoxic insult. Comparative Biochemistry and Physiology Part D:Genomics and Proteomics, 18: 1-9 DOI:10.1016/j.cbd.2016.01.005 |
Bickler P E, Buck L T., 2007. Hypoxia tolerance in reptiles, amphibians, and fishes:life with variable oxygen availability. Annual Review of Physiology, 69: 145-170 DOI:10.1146/annurev.physiol.69.031905.162529 |
Cadiz L, Zambonino-Infante J L, Quazuguel P et al, 2018. Metabolic response to hypoxia in European sea bass (Dicentrarchus labrax) displays developmental plasticity. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 215: 1-9 DOI:10.1016/j.cbpb.2017.09.005 |
Chen W, Hong W S, Chen S X et al, 2015. Population genetic structure and demographic history of the mudskipper Boleophthalmus pectinirostris on the northwestern pacific coast. Environmental Biology of Fishes, 98(3): 845-856 DOI:10.1007/s10641-014-0320-1 |
Chen K, Shi Y H, Chen J et al, 2019. A soluble FcγR homolog inhibits IgM antibody production in ayu spleen cells. Zoological Research, 40(5): 404-415 DOI:10.24272/j.issn.2095-8137.2019.056 |
Chiche J, Pommier S, Beneteau M et al, 2015. GAPDH enhances the aggressiveness and the vascularization of non-Hodgkin's B lymphomas via NF-κB-dependent induction of HIF-1α. Leukemia, 29(5): 1163-1176 DOI:10.1038/leu.2014.324 |
Ding F F, Li C H, Chen J., 2019. Molecular characterization of the NK-lysin in a teleost fish, Boleophthalmus pectinirostris:antimicrobial activity and immunomodulatory activity on monocytes/macrophages. Fish & Shellfish Immunology, 92: 256-264 |
Everett M V, Antal C E, Crawford D L., 2012. The effect of short-term hypoxic exposure on metabolic gene expression. Journal of Experimental Zoology Part A:Ecological Genetics and Physiology, 317A(1): 9-23 DOI:10.1002/jez.717 |
Foss A, Evensen T H, iestad V., 2002. Effects of hypoxia and hyperoxia on growth and food conversion efficiency in the spotted wolffish Anarhichas minor (Olafsen). Aquaculture Research, 33(6): 437-444 DOI:10.1046/j.1365-2109.2002.00693.x |
Geng X, Feng J B, Liu S K et al, 2014. Transcriptional regulation of hypoxia inducible factors alpha (HIF-α) and their inhibiting factor (FIH-1) of channel catfish (Ictalurus punctatus) under hypoxia. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 169: 38-50 DOI:10.1016/j.cbpb.2013.12.007 |
Gracey A Y, Troll J V, Somero G N., 2001. Hypoxia-induced gene expression profiling in the euryoxic fish Gillichthys mirabilis. Proceedings of the National Academy of Sciences of the United States of America, 98(4): 1993-1998 DOI:10.1073/pnas.98.4.1993 |
Guan F, Lu X J, Li C H et al, 2017. Molecular characterization of mudskipper (Boleophthalmus pectinirostris) hypoxia-inducible factor-1α (HIF-1α) and analysis of its function in monocytes/macrophages. PLoS One, 12(5): e0177960 DOI:10.1371/journal.pone.0177960 |
Jensen F B, Nikinmaa M, Weber R E., 1993. Environmental perturbations of oxygen transport in teleost fishes:causes, consequences and compensations. In:Rankin J C, Jensen F B eds. Fish Ecophysiology. Dordrecht, Holland:Springer: 161-179 |
Kvamme B O, Gadan K, Finne-Fridell F et al, 2013. Modulation of innate immune responses in Atlantic salmon by chronic hypoxia-induced stress. Fish & shellfish immunology, 34(1): 55-65 |
Li F G, Chen J, Jiang X Y et al, 2015. Transcriptome analysis of blunt snout bream (Megalobrama amblycephala) reveals putative differential expression genes related to growth and hypoxia. PLoS One, 10(11): e0142801 DOI:10.1371/journal.pone.0142801 |
Li M X, Wang X D, Qi C L et al, 2018. Metabolic response of Nile tilapia (Oreochromis niloticus) to acute and chronic hypoxia stress. Aquaculture, 495: 187-195 DOI:10.1016/j.aquaculture.2018.05.031 |
Majmundar A J, Wong W J, Simon M C., 2010. Hypoxia-inducible factors and the response to hypoxic stress. Molecular Cell, 40(2): 294-309 DOI:10.1016/j.molcel.2010.09.022 |
Mohindra V, Tripathi R K, Singh R K et al, 2013. Molecular characterization and expression analysis of three hypoxia-inducible factor alpha subunits, HIF-1α, -2α and -3α in hypoxia-tolerant Indian catfish, Clarias batrachus[Linnaeus.. 1758]. Molecular Biology Reports, 40(10): 5805-5815 DOI:10.1007/s11033-013-2685-1 |
Nikinmaa M, Rees B B., 2005. Oxygen-dependent gene expression in fishes. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 288(5): R1079-R1090 DOI:10.1152/ajpregu.00626.2004 |
Qi D L, Chao Y, Wu R R et al, 2018. Transcriptome analysis provides insights into the adaptive responses to hypoxia of a Schizothoracine Fish (Gymnocypris eckloni). Frontiers in Physiology, 9: 1326 DOI:10.3389/fphys.2018.01326 |
Richards J G., 2009. Metabolic and molecular responses of fish to hypoxia. Fish Physiology, 27: 443-485 DOI:10.1016/S1546-5098(08)00010-1 |
Rimoldi S, Terova G, Ceccuzzi P et al, 2012. HIF-1α mRNA levels in Eurasian perch (Perca fluviatilis) exposed to acute and chronic hypoxia. Molecular Biology Reports, 39(4): 4009-4015 DOI:10.1007/s11033-011-1181-8 |
Robertson C E, Wright P A, K blitz L et al, 2014. Hypoxia-inducible factor-1 mediates adaptive developmental plasticity of hypoxia tolerance in zebrafish, Danio rerio. Proceedings of the Royal Society B:Biological Sciences, 281(1786): 20140637 DOI:10.1098/rspb.2014.0637 |
Semenza G L., 1999. Regulation of mammalian O2 homeostasis by hypoxia-inducible factor 1. Annual Review of Cell and Developmental Biology, 15: 551-578 DOI:10.1146/annurev.cellbio.15.1.551 |
Shang E H H, Wu R S S., 2004. Aquatic hypoxia is a teratogen and affects fish embryonic development. Environmental Science & Technology, 38(18): 4763-4767 |
Shibuya M., 2011. Vascular endothelial growth factor (VEGF) and its receptor (VEGFR) signaling in angiogenesis:a crucial target for anti- and pro-angiogenic therapies. Genes & Cancer, 2(12): 1097-1105 |
Terova G, Rimoldi S, Corà S et al, 2008. Acute and chronic hypoxia affects HIF-1α mRNA levels in sea bass (Dicentrarchus labrax). Aquaculture, 279(1-4): 150-159 DOI:10.1016/j.aquaculture.2008.03.041 |
Toba A, Ishimatsu A., 2014. Roles of air stored in burrows of the mudskipper Boleophthalmus pectinirostris for adult respiration and embryonic development. Journal of Fish Biology, 84(3): 774-793 DOI:10.1111/jfb.12324 |
Van Der Meer D L M, Van Den Thillart G E E J M, Witte F et al, 2005. Gene expression profiling of the long-term adaptive response to hypoxia in the gills of adult zebrafish. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 289(5): R1512-R1519 DOI:10.1152/ajpregu.00089.2005 |
Virani N A, Rees B B., 2000. Oxygen consumption, blood lactate and inter-individual variation in the gulf killifish, Fundulus grandis, during hypoxia and recovery. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 126(3): 397-405 |
Wouters B G, Koritzinsky M., 2008. Hypoxia signalling through mTOR and the unfolded protein response in cancer. Nature Reviews Cancer, 8(11): 851-864 DOI:10.1038/nrc2501 |
Xia J H, Li H L, Li B J et al, 2018. Acute hypoxia stress induced abundant differential expression genes and alternative splicing events in heart of tilapia. Gene, 639: 52-61 DOI:10.1016/j.gene.2017.10.002 |
Xiao W H., 2015. The hypoxia signaling pathway and hypoxic adaptation in fishes. Science China Life Sciences, 58(2): 148-155 |
Xu Z N, Zheng G D, Wu C B et al, 2019. Identification of proteins differentially expressed in the gills of grass carp (Ctenopharyngodon idella) after hypoxic stress by two-dimensional gel electrophoresis analysis. Fish Physiology and Biochemistry, 45(2): 743-752 DOI:10.1007/s10695-018-0599-5 |
Yu R M K, Ng P K S, Tan T F et al, 2008. Enhancement of hypoxia-induced gene expression in fish liver by the aryl hydrocarbon receptor (AhR) ligand, benzo. Aquatic Toxicology, 90(3): 235-242 DOI:10.1016/j.aquatox.2008.09.004 |
Zhang Z P, Wells M C, Boswell M G et al, 2012. Identification of robust hypoxia biomarker candidates from fin of medaka (Oryzias latipes). Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 155(1): 11-17 |
Zhang Z P, Wu R S S, Mok H O L et al, 2003. Isolation, characterization and expression analysis of a hypoxia-responsive glucose transporter gene from the grass carp, Ctenopharyngodon idellus. European Journal of Biochemistry, 270(14): 3010-3017 DOI:10.1046/j.1432-1033.2003.03678.x |
Zhong X P, Wang D, Zhang Y B et al, 2009. Identification and characterization of hypoxia-induced genes in Carassius auratus blastulae embryonic cells using suppression subtractive hybridization. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 152(2): 161-170 DOI:10.1016/j.cbpb.2008.10.013 |
 2020, Vol. 51
2020, Vol. 51


