中国海洋湖沼学会主办。
文章信息
- 许峰, 鲁建飞, 魏永伟, 苗亮, 陈炯. 2020.
- XU Feng, LU Jian-Fei, WEI Yong-Wei, MIAO Liang, CHEN Jiong. 2020.
- 一株大口黑鲈(Micropterus salmoides)虹彩病毒(Iridoviridae)的分离及鉴定
- CHARACTERIZATION OF AN IRIDOVIRUS ISOLATE FROM LARGEMOUTH BASS MICROPTERUS SALMOIDES
- 海洋与湖沼, 51(1): 156-162
- Oceanologia et Limnologia Sinica, 51(1): 156-162.
- http://dx.doi.org/10.11693/hyhz20190800163
文章历史
-
收稿日期:2019-08-30
收修改稿日期:2019-10-09
2. 应用海洋生物技术教育部重点实验室 宁波大学海洋学院 宁波 315832
2. Key Laboratory of Applied Marine Biotechnology of Ministry of Education, Meishan Campus, Ningbo University, Ningbo 315832, China
大口黑鲈(largemouth bass, Micropterus salmoides), 又名加州鲈, 属于广温、肉食性淡水鱼类。其原产于北美洲密西西比河流域, 自1983年引入我国广东地区后, 因其适应能力强、生长速度快、养殖周期短、且肉质鲜美等特点, 被广泛养殖(王广军等, 2008)。目前, 大口黑鲈已经成为我国重要的淡水养殖经济鱼类之一, 其年产量已超过37.4万吨(农业部渔业渔政管理局, 2017)。随着养殖密度的不断增加、水体环境恶化、以及病原微生物的传播, 大口黑鲈病害相关的报道也日趋增长(Fogelson et al, 2016; Jiang et al, 2019)。导致大口黑鲈病害的病原主要包括细菌(如柱状黄杆菌Flavobacterium columnare, 诺卡氏菌Nocardia)、病毒(如虹彩病毒Iridoviridae, 弹状病毒Rhabdoviridae)、寄生虫(如车轮虫Trichodina, 杯体虫Apiosoma)等(夏焱春等, 2018)。
由病毒感染引起的大口黑鲈疾病死亡率高, 且难以防治, 对世界范围内的大口黑鲈养殖业带来了较为严重的威胁。大口黑鲈病毒首次发现于1991年的美国弗罗里达州(Grizzle et al, 2002), 我国最早发现于2008年广东省的佛山地区, 被其感染的大口黑鲈死亡率高达60%以上(邓国成等, 2009)。大口黑鲈病毒性疾病主要有虹彩病毒导致的溃疡病、脾肾坏死病, 弹状病毒导致的旋转病等(邓国成等, 2011)。大口黑鲈在被虹彩病毒感染后, 体表会有斑块状出血性溃疡, 尾柄红肿溃疡, 病鱼肝脏肿大、颜色发白或发黄, 也有的发病鱼体表虽完好但脾脏肿大(黄耀锋, 2017)。
本研究从浙江宁波某养殖场采集了患病的大口黑鲈样本, 通过其体表病患特征及内脏剖检推测为病毒引起的溃疡综合征。综合采用鲤鱼上皮瘤细胞(epithelioma papulosum cyprinid, EPC)培养、透射电子显微镜超薄切片观察、分子生物学分析等方法, 分离得到一株病毒, 鉴定其为虹彩病毒科蛙病毒属病毒, 命名为大口黑鲈虹彩病毒宁波分离株(LMBIV- NB001)。本报道为后续针对该病毒的防控及免疫相关研究工作提供了基础参考。
1 材料与方法 1.1 样品采集2018年7月于浙江宁波某养殖场采集了10尾体表出血或溃疡症状的大口黑鲈, 病鱼体长约15—20cm, 鱼体于水面下暗游, 反应迟钝, 发病时鱼塘水温24℃, 水质正常。采集的样本分别使用封口袋单独保存, 并通过冰盒低温运送到实验室, 于–80℃超低温冰箱内冻存以备实验室分析。
1.2 细胞系、试剂与主要仪器EPC系由本实验室保存, 其培养基为M199(Hyclone), 含10%胎牛血清(fetal bovine serum, FBS; Gibico), 培养温度25℃; LA Taq DNA聚合酶、pMD19T simple、dNTPs、DL2000 DNA Marker均购自大连TaKaRa公司; DNA提取、胶回收、质粒抽提试剂盒均购自美国Omega公司; 磷酸缓冲盐溶液(phosphate buffer saline, PBS)、细菌培养基等常用试剂均购自生工生物工程(上海)股份有限; 大肠杆菌(Escherichia coli)TG1由本实验室保存; CO2细胞培养箱购自Thermo Fisher公司; 普通光学显微镜购自日本Nikon公司; 透射电子显微镜购自日本Hitachi公司; PCR核酸扩增仪购自Eppendorf公司; 引物合成及序列测定均由生工生物工程(上海)股份有限公司完成。
1.3 病原分离将患病大口黑鲈解剖后, 在无菌状态下取肝脏、脾脏、肾脏、肌肉等样品, 分别加入10倍体积(V/W)的无菌PBS, 冰浴条件下研磨匀浆, 将匀浆液分为两份, 其中一份分别在BHI平板、血平板和RS培养基平板上进行划线, 28℃培养24h分离细菌; 另一份转移至50mL离心管中, 置于–70℃室温条件下反复冻融3次后, 5000g、4℃低温离心30min, 取上清液, 经0.22μm滤器(Millipore)过滤, –70℃冻存备用。
EPC细胞在T25细胞培养瓶(Corning)中传代培养, 细胞汇合度为80%—90%时, 弃去培养基, 实验组取200μL病鱼组织匀浆过滤液与800μL M199培养基混匀, 对照组为200μL无菌PBS与800μL M199培养基混匀, 分别接种于健康EPC细胞, 25℃吸附1h, 期间每隔15min轻轻晃动培养瓶以便均匀吸附。1h后, 均补加4mL含2% FBS的M199培养基, 置于25℃含5% CO2的细胞培养箱中继续培养, 每日于显微镜(Nikon)下观察细胞状态至发现实验组细胞单层80%出现细胞病变时收获培养物。收集的病毒液按上述步骤继续感染新的健康EPC细胞, 重复至收获第6代病毒液。
1.4 电镜样品制备将上述经第6代病毒悬液感染后病变的EPC细胞培养物收集, 800g离心25min去除细胞培养液, 收集细胞沉淀。固定:将细胞沉淀用2.5%戊二醛固定; 用0.1mol/L磷酸漂洗液漂洗三次, 每次15min; 1%锇酸固定液固定2h;再用0.1mol/L磷酸漂洗液漂洗三次, 每次15min。脱水: 50%乙醇15min; 70%乙醇15min; 90%乙醇15min; 90%乙醇+90%丙酮(1:1) 15min; 90%丙酮15min; 100%丙酮20min。包埋: 100%丙酮+包埋液(2:1)室温2h; 100%丙酮+包埋液(1:2)室温2h;包埋液室温过夜。固化: 37℃烘箱12h; 60℃烘箱48h。切片:超薄切片机切片。染色: 3%醋酸铀-枸橼酸铅双染色。最后将样品置于透射电子显微镜下观察、拍照。
1.5 分子克隆鉴定病鱼肝脏、脾脏、肾脏、肌肉组织DNA的提取按照Omega的DNA提取试剂盒说明进行操作。参考GenBank中已发表的虹彩病毒MCP基因保守区序列设计引物, 序列如下: LMBV-F: 5′-TTTCGGGCAGC AGTTTTCGGT-3′; LMBV-R: 5′-CCGTAGTTGGTGG A GCC-3′。以提取的病鱼组织DNA为模板, PCR扩增MCP部分保守序列, 扩增的反应体系为25μL, 其中包括: DNA模板1μL, 上下游引物各(10μmol/L) 1.0μL, 10 × LA buffer 2.5μL, dNTP (2.5mmol/L) 3.5μL, LA Taq DNA聚合酶0.5μL, ddH2O 15.5μL。反应条件为: 94℃预变性5min; 94℃变性30s, 56℃退火30s, 72℃延伸90s, 变性至延伸共32个循环; 72℃延伸10min。扩增产物经1% (W/V)琼脂糖凝胶电泳分离、胶回收试剂盒回收纯化后, 与pMD19-T simple载体16℃连接3h, 连接的反应体系为:切胶回收的DNA片段4μL, pMD19-T Simple 1μL, Solution Ⅰ 5μL。将连接产物转化TG1感受态细胞后, 涂布于含100mg/mL氨苄青霉素(Amp)的Luria Broth (LB)平板上, 37℃培养过夜, 挑取5个菌落进行扩大培养, 抽提质粒, PCR鉴定, 选取阳性克隆进行测序。
1.6 PCR扩增产物序列分析将测序得到的病毒MCP部分核苷酸序列用BioEdit软件和BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对分析, 然后选取GenBank中与测得序列相似的参考毒株, 采用Mega 7.0软件构建系统进化树(邻接法)。构建进化树使用的参考毒株及其序列登录号分别为:鳜鱼蛙病毒(MG941005)、桑蒂库珀蛙病毒(NC_038508)、大口黑鲈溃疡综合征病毒(GU2 56635)、孔雀鱼病毒(FR677325)、小口黑鲈病毒(KY82 5779)、锦鲤蛙病毒(KJ939444)、流行性造血器官坏死病病毒(AY187045)、虎纹蛙病毒(AY033630)、中华鳖病毒(DQ335253)、蛙病毒3型(FJ459783)、传染性脾肾坏死病毒(AF370008)、条石鲷虹彩病毒(HQ105005)和淋巴囊肿病病毒I型(EF103188)。
2 结果与分析 2.1 病鱼主要症状患病大口黑鲈主要症状为体表出血。在其体表可见多处溃烂及出血点, 鳍条基部、尾柄处红肿出血(图 1a); 解剖发现其脾脏肿大, 颜色暗红发黑, 肝脏发白并有出血点(图 1b)。病鱼具有因病毒感染引发的溃疡综合征的典型症状。
 |
| 图 1 患病大口黑鲈体表及内脏病症 Fig. 1 The external and visceral symptoms of diseased largemouth bass 注: a.病鱼体表病变特征; b.病鱼内脏病变特征 |
从病鱼肝脏、脾脏、肾脏、肌肉中均未分离得到细菌。
由于病鱼具有被虹彩病毒感染后的典型症状, 而该病毒能引起EPC细胞病变(Halaly et al, 2019), 所以采用EPC细胞进行感染实验。病鱼组织匀浆过滤液感染EPC细胞36h后, 可见紧密生长的EPC细胞出现变圆、脱落的病变现象(cytopathic effect, CPE), 继续培养12h后可见因细胞死亡脱落形成的空洞(图 2)。被感染的EPC细胞在72h内全部收缩呈球状, 脱离瓶壁。
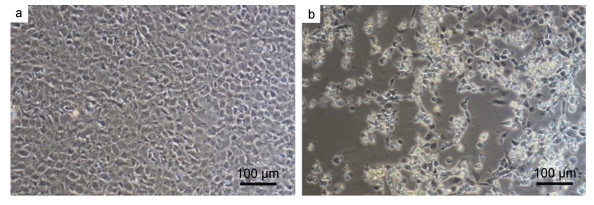 |
| 图 2 患病大口黑鲈分离病毒液感染EPC细胞形成的病变 Fig. 2 Cytopathic effect of virus liquid on EPC cells under a microscope 注: a.健康EPC细胞; b.病毒液感染48h后EPC细胞出现细胞病变 |
通过电子显微镜技术可以直观地观察到病毒粒子形态特征。病鱼组织匀浆液感染EPC细胞后, 经电镜超薄切片观察, 可见细胞内存在大量直径约120nm、具有囊膜的正六边形病毒颗粒(图 3)。
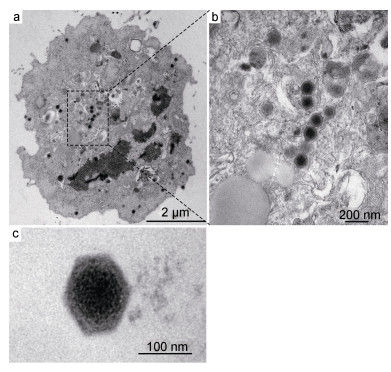 |
| 图 3 病毒悬液感染EPC细胞的超薄切片透射电镜观察 Fig. 3 Ultra-thin section observation of virus liquid-infected EPC cells under TEM |
提取的病鱼肝脏、脾脏、肾脏和肌肉组织DNA分别采用引物LMBV-F和LMBV-R进行PCR扩增, 均获得长度约1kb的目的条带(图 4a), 将其切胶回收、连接至pMD19-T simple克隆载体, 转化TG1感受态细胞, 涂平板培养后选取6个菌落, 扩大培养后抽提质粒, 进行PCR鉴定, 结果如图 4b所示, 所选菌落的PCR扩增产物在约1kb处有明显条带, 与预期结果相同。选取其中的2个阳性克隆菌落进行PCR扩增产物测序, 获得长度为1029bp的序列, 经NCBI数据库中BLAST比对, Bioedit软件分析, 结果显示, 扩增得到的序列与鳜鱼蛙病毒NH-1609、大口黑鲈溃疡综合征病毒BG/TH/CU3、EPC060608-08的MCP核苷酸同源性最高, 相似度均为99.13%(表 1)。系统进化分析结果表明, 本研究分离得到的病毒与鳜鱼蛙病毒、大口黑鲈溃疡综合征病毒聚成一簇, 属于虹彩病毒科的蛙病毒属(图 5), 将其命名为大口黑鲈虹彩病毒宁波分离株(Largemouth bass iridovirus, LM BIV-NB001), 上传至GenBank后获得的登录号为MN176304。
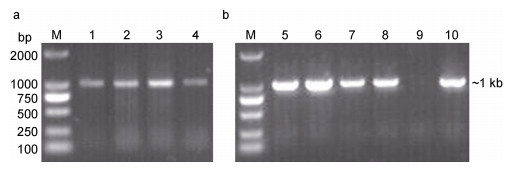 |
| 图 4 患病大口黑鲈分离病毒MCP片段的PCR鉴定结果 Fig. 4 PCR identification of the partial MCP of virus from diseased fish and the cloned plasmid 注: M: DL2000 DNA Marker; 1—4:分别为病鱼肝脏、脾脏、肾脏和肌肉组织DNA为模板的PCR扩增; 5—10:克隆质粒样品 |
| 病毒名称 | 中文名 | 分离株 | 登录号 | 同源性(%) |
| Mandarin fish ranavirus | 鳜鱼蛙病毒 | NH-1609 | MG941005 | 99.13 |
| Santee Cooper ranavirus | 桑蒂库珀蛙病毒 | BG/TH/CU3 | NC_038508 | 99.13 |
| Largemouth bass ulcerative syndrome virus | 大口黑鲈溃疡综合症病毒 | EPC060608-08 | GU256635 | 99.13 |
| Guppy virus | 孔雀鱼病毒 | F93-20#6 | FR677325 | 98.25 |
| Smallmouth bass virus | 小口黑鲈病毒 | 12-342 | KY825779 | 97.86 |
| Koi ranavirus | 锦鲤蛙病毒 | In01 | KJ939444 | 98.20 |
| Short-finned eel ranavirus | 短鳍鳗鱼蛙病毒 | ANGA14001 | KX353311 | 80.39 |
| Pike perch iridovirus | 梭鲈蛙病毒 | SLU14001 | KX574341 | 80.29 |
| European catfish virus | 欧洲鲶鱼病毒 | 14612/2012 | KT989885 | 80.25 |
 |
| 图 5 采用邻接法基于MCP基因部分序列同源性的系统进化树分析 Fig. 5 Phylogenetic analysis of LMBIV-NB001strain with other iridovirus based on MCP gene partial sequence homologues using the neighbor-joining method |
虹彩病毒科(Iridoviridae)包括蛙病毒属(Ranavirus)、肿大细胞虹彩病毒属(Megalocytivirus)、淋巴囊肿病毒属(Lymphocystivirus)、虹彩病毒属(Iridovirus)和绿虹彩病毒属(Chloriridovirus), 是一个大型二十面体病毒家族, 其双链DNA基因组的大小从103kb到220kb不等(Chinchar et al, 2017a, b)。不同属的病毒在感染同种或不同物种后的影响可能从没有明显的损伤或行为变化到严重的损伤甚至死亡(Lesbarrères et al, 2012)。近年来, 由虹彩病毒科蛙病毒属引发的疾病在世界范围内广泛流行(Brenes et al, 2014), 其在两栖动物、鱼类以及爬行动物中均有报道(Price et al, 2017; McKenzie et al, 2019; Saucedo et al, 2019)。大口黑鲈蛙病毒病高发于水温25—30℃的夏季, 主要危害成鱼, 且致死率高, 一旦暴发将会给我国水产养殖业带来巨大的经济损失(邓国成等, 2011)。中国大鲵(Andrias davidianus)在被蛙病毒属病毒感染后出现体表溃疡、头部胀大且有出血点、尾部溃烂等病理特征(张星朗等, 2014); 大口黑鲈在被病毒感染后常出现皮肤溃疡、肝脾肾肿大、肌肉坏死以及鳍基、尾柄充血或出血等症状(马冬梅等, 2016), 这与本研究中采集的病鱼所表现出的病症非常相似。蛙病毒属病毒可以感染中国大鲵胸腺细胞(Chinese giant salamander thymus cells, GSTC)和EPC细胞, 使细胞发生病变(Ke et al, 2019)。为了确定病原, 本研究首先进行了细菌分离, 在未分离得到病原菌的情况下, 通过制备病鱼组织匀浆液感染EPC细胞, 观察到EPC发生细胞死亡、脱落等病变现象, 其病变特征与关于蛙病毒属病毒感染EPC细胞的报道相似(Deng et al, 2011; Mu et al, 2018)。进一步通过电子显微镜观察, 发现直径约120nm的正六边形有囊膜病毒粒子, 其形态特征与虹彩病毒为具有囊膜、直径在120—300nm的二十面体结构特征相似(Williams, 1996), 推测其为一株虹彩病毒科病毒。
使用分子生物学方法是鉴定病毒性病原常用的可靠手段, 通过对病毒的保守基因序列进行扩增和分析能够明确病原的分类地位(Grizzle et al, 2003; 刘群等, 2018; Leis et al, 2018)。MCP是虹彩病毒最主要的结构蛋白基因, 其基因序列在不同种病毒间既具有高度的保守性, 又有一定的差异性, 所以MCP序列的分析常用于虹彩病毒的分类和鉴定(Webby et al, 1998; Ohlemeyer et al, 2011)。Sivasankar等(2017)利用MCP基因序列分析, 从雀鲷(Pomacentrus similis)中鉴定了一株虹彩病毒科蛙病毒; 本实验根据已知虹彩病毒的MCP基因序列保守区设计了一对特异性引物, 采用PCR扩增、测序后获得1029bp的病毒核苷酸序列, 经BLAST搜索比对, 其与鳜鱼蛙病毒、大口黑鲈溃疡综合征病毒的MCP基因核苷酸同源性最高, 相似度均高达99.13%, 表明该分离株属于虹彩病毒科。通过基于MCP核苷酸部分序列构建的系统发育树可以明确看出, 分离得到的LMBIV-NB001毒株与虹彩病毒科蛙病毒属参考毒株聚为一类, 应为蛙病毒属成员。不同地区蛙病毒属成员毒株的分离和鉴定将对其起源、进化、分类及免疫相关研究等提供重要的基础材料。
4 结论本研究报道了一株从患病大口黑鲈中分离的病毒, 通过EPC细胞分离培养、电镜观察、PCR扩增特异性基因片段, 明确了其分类地位属于虹彩病毒科蛙病毒属, 将该株病毒命名为大口黑鲈虹彩病毒病毒宁波分离株(LMBIV-NB001)。为进一步研究该病毒的生物学特性、免疫原性、感染机制以及疫苗的制备奠定了基础。
马冬梅, 邓国成, 白俊杰, 等. 2016. 大口黑鲈溃疡综合征病毒MCP基因的原核表达及重组蛋白的免疫效果初步分析. 生物技术通报, 32(8): 139-144 |
王广军, 关胜军, 吴锐全, 等. 2008. 大口黑鲈肌肉营养成分分析及营养评价. 海洋渔业, 30(3): 239-244 DOI:10.3969/j.issn.1004-2490.2008.03.008 |
邓国成, 白俊杰, 李胜杰, 等. 2011. 大口黑鲈池塘养殖常见病害及其防治. 广东农业科学, 38(18): 102-103, 137 DOI:10.3969/j.issn.1004-874X.2011.18.040 |
邓国成, 谢骏, 李胜杰, 等. 2009. 大口黑鲈病毒性溃疡病病原的分离和鉴定. 水产学报, 33(5): 871-877 |
刘群, 韩进刚, 王菁, 等. 2018. 天津地区养殖鲤鱼(Cyprinus carpio)鲤浮肿病毒(CEV)PCR检测与人工感染试验. 海洋与湖沼, 49(3): 638-645 |
农业部渔业渔政管理局. 2017. 中国渔业统计年鉴. 北京: 中国农业出版社
|
张星朗, 周小愿, 张辉. 2014. 大鲵虹彩病毒的分离纯化及其MCP基因序列分析. 西北农林科技大学学报(自然科学版), 42(12): 23-28 |
夏焱春, 曹铮, 蔺凌云, 等. 2018. 大口黑鲈主要病害研究进展. 中国动物检疫, 35(9): 72-76 DOI:10.3969/j.issn.1005-944X.2018.09.019 |
黄耀锋. 2017. 加州鲈虹彩病毒病的主要症状及预防方法. 海洋与渔业·水产前沿, (9): 86-87 DOI:10.3969/j.issn.1672-4046.2017.09.043 |
Brenes R, Gray M J, Waltzek T B et al, 2014. Transmission of ranavirus between ectothermic vertebrate hosts. PLoS One, 9(3): e92476 DOI:10.1371/journal.pone.0092476 |
Chinchar V G, Hick P, Ince I A et al, 2017a. ICTV virus taxonomy profile: Iridoviridae. The Journal of General Virology, 98(5): 890-891 DOI:10.1099/jgv.0.000818 |
Chinchar V G, Waltzek T B, Subramaniam K, 2017b. Ranaviruses and other members of the family Iridoviridae: Their place in the virosphere. Virology, 511: 259-271 DOI:10.1016/j.virol.2017.06.007 |
Deng G C, Li S J, Xie J et al, 2011. Characterization of a ranavirus isolated from cultured largemouth bass (Micropterus salmoides) in China. Aquaculture, 312(1-4): 198-204 DOI:10.1016/j.aquaculture.2010.12.032 |
Fogelson S B, Petty B D, Reichley S R et al, 2016. Histologic and molecular characterization of Edwardsiella piscicida infection in largemouth bass (Micropterus salmoides). Journal of Veterinary Diagnostic Investigation, 28(3): 338-344 DOI:10.1177/1040638716637639 |
Grizzle J M, Altinok I, Fraser W A et al, 2002. First isolation of largemouth bass virus. Diseases of Aquatic Organisms, 50(3): 233-235 |
Grizzle J M, Altinok I, Noyes A D, 2003. PCR method for detection of largemouth bass virus. Diseases of Aquatic Organisms, 54(1): 29-33 |
Halaly M A, Subramaniam K, Koda S A et al, 2019. Characterization of a novel megalocytivirus isolated from European chub (Squalius cephalus). Viruses, 11(5): 440 DOI:10.3390/v11050440 |
Jiang B, Lu G L, Du J J et al, 2019. First report of trypanosomiasis in farmed largemouth bass (Micropterus salmoides) from China: pathological evaluation and taxonomic status. Parasitology Research, 118(6): 1731-1739 DOI:10.1007/s00436-019-06323-9 |
Ke F, Wang Z H, Ming C Y et al, 2019. Ranaviruses bind cells from different species through interaction with heparan sulfate. Viruses, 11(7): 593 DOI:10.3390/v11070593 |
Leis E, McCann R, Standish I et al, 2018. Comparison of lethal and nonlethal sampling methods for the detection of largemouth bass virus (LMBV) from largemouth bass in the upper Mississippi river. Journal of Aquatic Animal Health, 30(3): 217-225 DOI:10.1002/aah.10029 |
Lesbarrères D, Balseiro A, Brunner J et al, 2012. Ranavirus: past, present and future. Biology Letters, 8(4): 481-483 DOI:10.1098/rsbl.2011.0951 |
McKenzie C M, Piczak M L, Snyman H N et al, 2019. First report of ranavirus mortality in a common snapping turtle Chelydra serpentina. Diseases of Aquatic Organisms, 132(3): 221-227 DOI:10.3354/dao03324 |
Mu W H, Geng Y, Yu Z H et al, 2018. FV3-like ranavirus infection outbreak in black-spotted pond frogs (Rana nigromaculata) in China. Microbial Pathogenesis, 123: 111-114 DOI:10.1016/j.micpath.2018.06.047 |
Ohlemeyer S, Holopainen R, Tapiovaara H et al, 2011. Major capsid protein gene sequence analysis of the Santee-Cooper ranaviruses DFV, GV6, and LMBV. Diseases of Aquatic Organisms, 96(3): 195-207 DOI:10.3354/dao02370 |
Price S J, Ariel E, Maclaine A et al, 2017. From fish to frogs and beyond: Impact and host range of emergent ranaviruses. Virology, 511: 272-279 DOI:10.1016/j.virol.2017.08.001 |
Saucedo B, Serrano J M, Jacinto-Maldonado M et al, 2019. Pathogen risk analysis for wild amphibian populations following the first report of a ranavirus outbreak in farmed American bullfrogs (Lithobates catesbeianus) from Northern Mexico. Viruses, 11(1): 26 DOI:10.3390/v11010026 |
Sivasankar P, John K R, George M R et al, 2017. Characterization of a virulent ranavirus isolated from marine ornamental fish in India. Virus Disease, 28(4): 373-382 |
Webby R, Kalmakoff J, 1998. Sequence comparison of the major capsid protein gene from 18 diverse iridoviruses. Archives of Virology, 143(10): 1949-1966 DOI:10.1007/s007050050432 |
Williams T, 1996. The iridoviruses. Advance of Virus Research, 46: 345-412 DOI:10.1016/S0065-3527(08)60076-7 |
 2020, Vol. 51
2020, Vol. 51


