中国海洋湖沼学会主办。
文章信息
- 杨斯琪, 郑洪武, 孙颖, 朱爱意. 2019.
- YANG Si-Qi, ZHENG Hong-Wu, SUN Ying, ZHU Ai-Yi. 2019.
- 氨氮、温度和体重对大口黑鲈(Micropterus salmoides)幼鱼耗氧率和窒息点的影响
- EFFECTS OF AMMONIA EXPOSURE, TEMPERATURE, AND BODY WEIGHT ON OXYGEN CONSUMPTION RATE AND ASPHYXIATION POINT OF JUVENILE LARGEMOUTH BASS MICROPTERUS SALMOIDES
- 海洋与湖沼, 50(6): 1328-1333
- Oceanologia et Limnologia Sinica, 50(6): 1328-1333.
- http://dx.doi.org/10.11693/hyhz20190600115
文章历史
-
收稿日期:2019-06-14
收修改稿日期:2019-07-17
大口黑鲈(Micropterus salmoides), 俗称加州鲈鱼, 原产于北美, 为淡水的广温性鱼类(房英春等, 2001), 生长适温为12—30℃, 最低温度2℃, 最高温度34℃, 因其适应性强、生长快、易起捕、养殖周期短等优点, 加之肉质鲜美细嫩, 无肌间刺, 外形美观, 深受养殖者和消费者欢迎(顾树庭等, 2016)。1983年初从台湾引入广州后, 经过三十多年的养殖实践, 现已推广到全国各地, 成为国内主要淡水养殖品种之一(Bai et al, 2008), 并形成产业规模, 产业分工也根据市场需求进行了明确划分, 整个养殖技术也达到比较高的水准(余鹏等, 2014)。
氨氮作为含氮化合物的主要最终产物和积聚于水体中的重要无机污染物(Prenter et al, 2004), 不仅影响水域环境, 而且对水生生物的生存状况产生威胁。高密度集约化养殖下, 投饵量大, 摄食高蛋白饲料易使鱼体产生代谢负担, 增加鱼体自身氨的排泄(Sun et al, 2007)。未被摄食的残饵作为含氮化合物, 也是污染水环境的原因之一。氨氮对水生动物的毒性主要归因于形成非离子氨及NO2-, 而离子NH4+的毒性较小(Russo et al, 1991)。高浓度的氨氮对鱼体的代谢、生长与存活有严重的制约作用(Frances et al, 2000)。
呼吸和排泄是生物能量学研究的重要内容之一, 不仅反映了生物生理代谢规律, 而且反应了环境对生物生存活动的影响。通过了解耗氧率与各种因素的相互关系及变化规律可以了解鱼类的代谢水平、活动规律、生理水平、能量需求水平以及维持最低代谢水平的需氧量等, 由此可以为鱼类的养殖生产、环境条件的改造、鱼类新品种的培育、鱼类的移植驯化、养殖水体水质的调控和鱼类的运输等提供基础数据(陈松波等, 2004)。对于水生动物呼吸代谢的研究报道有很多, 如邹李昶等(2015)研究在氨氮急性胁迫下对日本沼虾(Macrobrachium nipponensis)死亡率、耗氧率及窒息点的影响, 刘鹏等(2009)对大菱鲆(Scophthalmus maximus)幼鱼, 分别针对温度、体重和昼夜节律呼吸代谢进行了研究, 孙宝柱等(2010)对厚颌鲂(Megalobrama pellegrini)和圆口铜鱼(Coreius guichcnoti)耗氧率与窒息点进行测定。本实验探讨了3种因素对大口黑鲈耗氧率、窒息点的影响以及耗氧率昼夜节律变化, 旨在探讨大口黑鲈在各种条件下的新陈代谢规律, 为鱼苗培育、运输及规模养殖等提供基础数据。
1 材料与方法 1.1 实验材料实验用大口黑鲈(Micropterus salmoides)于2019年2月购自浙江鸿利饲料苗种厂, 运回实验室后在75m3封闭式循环水养殖系统中驯养, 早晚分别投饵一次, 于3—4月期间选取其中体型适中、反应迅速、鳞片完整的健康个体作为实验对象。
NH4CI为分析纯AR, 购自国药集团化学试剂有限公司, 按需要用蒸馏水将NH4CI配成10g/L的母液, 配成后立即使用, 实验浓度以氨氮浓度计算。
实验用水为曝气48h的自来水, pH 7.5±0.05, DO (10.56±0.17)mg/L, 除温度组外, 其余各实验组水温均控制在13.5±0.3℃, 水质符合《NY5051-2001无公害食品淡水养殖用水水质》(中华人民共和国农业部, 2001)。
实验鱼分别在实验前各个预设条件下适应48h以上并停食24h。
1.2 实验方法鱼体长用量鱼板测定; 鱼体重测量用湿毛巾包裹后放到千分之一电子天平上称量, 然后去皮重, 精确到0.01g;溶氧用HACH HQ 30D溶氧仪测定; pH值测量用梅特勒FE20K pH计。耗氧率测定采用流水式方法。
实验自制的耗氧率测定仪包括蓄水池(规格为81cm×60.5cm×59cm的塑料箱), 呼吸室(规格为4L的塑料箱)、收集室(刻度为500mL锥形瓶)以及连接用软管、止水夹等, 设有1个水箱用于平衡实验水压, 确保进出呼吸室的水流速稳定, 液体石蜡(AR, 国药出品)作为呼吸室隔绝氧气材料。
每个实验组设三个平行组, 组内每个单元各放入实验鱼10尾。实验鱼均在呼吸室内适应60mim以上则开始实验。根据预实验, 呼吸室进出水流速控制在(3600±77.44)mL/h, 呼吸室出水口的溶解氧浓度控制在4mg/L以上, 进出呼吸室的水中溶解氧和水流量每隔1h测定1次, 连续测定3h。各组均设计在9:00开始实验。除温度实验组外, 其余实验组温度为(13.5±0.3)℃。除体重实验组外, 其余实验组的实验鱼体重均为(9.54±1.41)g。
氨氮质量浓度参考崔宽宽等(2018)对花鲈(Lateolabrax japonicus)幼鱼在氨氮胁迫下得出的96h LC50值为依据, 估算出大口黑鲈的氨氮安全质量浓度, 并以此为基准设置本实验氨氮浓度分别为0(对照组)、2.15、4.31、6.46和8.61mg/L共5个梯度组对应的非离子氨浓度分别为0、0.0162、0.0325、0.0487和0.0650mg/L; 体重设置(6.66±1.31)、(9.96±1.27)、(11.87±1.42)、(13.65±1.35)、(15.87±1.39)g共5个梯度; 温度设置13、17、21、25、29、33℃共6个梯度, 温度控制由加热棒和循环水泵组成, 分别在进、出水口及呼吸室外恒温箱内各放1支温度计。
窒息点测定在密闭的呼吸室中放置10尾实验鱼。当半数实验鱼失去平衡、呼吸停止以及侧翻沉底时, 可以判定为濒临死亡, 立即测定水中的溶氧。
昼夜节律实验采用封闭流水式方法测定耗氧率, 放置10尾试验鱼进呼吸室内, 每2h作为一个时间段, 每40mim测1次进出溶氧, 把这个3个数据平均, 作为该组该时间段的耗氧率。耗氧率以6:00—18:00为白天, 18:00—6:00为夜间, 白天光照为室内自然光, 晚上用黑布遮光, 在不影响操作的情况下尽量避免灯光直射呼吸室及外界无关因素干扰, 给实验鱼提供安静环境。
1.3 数据处理耗氧率的计算公式: OCR= (DO0–DO1)×V/W; OCR为耗氧率, 单位为mg/(g·h); DO0为进水溶氧(mg/L); DO1为出水溶氧(mg/L); V为单位时间水流量(L/h), W为实验鱼体质量(g)。
实验结果数据用平均值±标准差(mean±SD)表示, 利用Excel和SPSS软件进行数据统计分析, 利用单因素方差分析检验各种因素对大口黑鲈耗氧率的影响显著性, 组间差异的显著性检验均采用LSD多重比较法, 显著水平为P < 0.05, 极显著水平为P < 0.01。
2 结果与分析 2.1 大口黑鲈耗氧率的昼夜节律变化大口黑鲈的昼夜节律耗氧率(图 1), 夜间18:00—6:00平均耗氧率为0.214mg/(g·h)和昼均6:00—18:00耗氧率为0.199mg/(g·h), 夜均 > 日均, 夜均耗氧率比昼均高约7%, 二者差异性显著(P < 0.05)。昼夜耗氧率最高出现在18:00—20:00, 数值为0.282mg/(g·h); 最低则出现在8:00—10:00, 数值为0.159mg/(g·h)。在16:00—20:00和4:00—6:00为昼夜节律变化的高峰期, 其耗氧率均显著高于其他时间段(P < 0.01)。
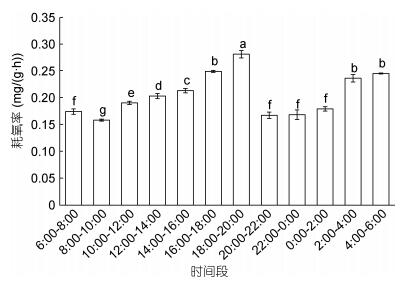 |
| 图 1 大口黑鲈耗氧率的昼夜节律变化 Fig. 1 The circadian rhythm of oxygen consumption rate of M. salmoides 注:标不同字母表示组间存在显著差异(P < 0.05)。下同 |
在设计的13—33℃的范围内, 随着水温的升高, 大口黑鲈幼鱼耗氧率的变化呈现逐渐上升再下降的趋势(图 2), 29℃时耗氧率达到峰值0.392mg/(g·h); 水温33℃时耗氧率下降为0.338mg/(g·h); 水温从21℃升高至25℃时, 耗氧率虽有增加但变化不显著(P > 0.05)。水温与耗氧率间关系可用方程Y=–0.0096X2 + 0.1092X + 0.0485拟合(R2 = 0.9396, Y为耗氧率, X为温度)。
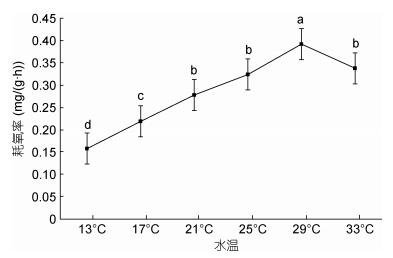 |
| 图 2 水温对大口黑鲈耗氧率的影响 Fig. 2 The effect of temperature on oxygen consumption rate of M. salmoides |
在实验鱼6.66—15.87g体重范围内, 随着体重的增加, 耗氧率逐渐下降, 且下降趋势逐渐减缓(图 3); 耗氧率最大值为0.178mg/(g·h), 出现在6.66g实验组中。最低值为0.112mg/(g·h), 在15.87g实验组。方差分析结果显示, 体重在6.66g的实验组中, 除了与9.96g的实验组呈现无显著差异, 与其他实验组均存在显著差异(P < 0.05)。体重对大口黑鲈的耗氧率影响差异显著(P < 0.05)。二者之间的关系可用一元二次方程Y=0.0051X2 – 0.0465X + 0.2176 (R2 = 0.9884, Y为耗氧率, X为体重)表示。
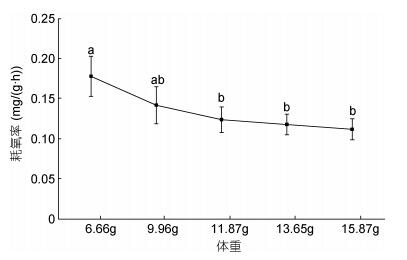 |
| 图 3 体重对大口黑鲈耗氧率的影响 Fig. 3 The effect of weight on oxygen consumption rate of M. salmoides |
在静水实验过程中, 刚开始大口黑鲈幼鱼的活动状况正常, 在呼吸室底部有规律地呼吸。随着呼吸室内溶氧减少, 其呼吸及鳃摆动频率逐渐加快, 个体表现出躁动不安, 不时从底部游窜至呼吸室顶部大口吞咽, 之后群体出现高频率摆动、游窜; 随着时间延长, 鱼体逐渐出现侧旋、游动无力状态, 最后是沉于水底, 鳃张合缓慢, 直至昏迷; 昏迷的幼鱼体色逐渐变白, 口张大, 眼球颜色变浅, 鳃张大。
在设定氨氮浓度0—8.61mg/L范围内, 大口黑鲈幼鱼窒息点随着氨氮质量浓度的增加快速升高, 组间差异极显著(P < 0.01), 在氨氮浓度从4.31mg/L增加至8.61mg/L时, 尽管窒息点也随之升高, 但相邻梯度组间差异不显著(P > 0.05)(图 4)。在氨氮质量浓度为0mg/L时, 窒息点是0.42mg/L; 在浓度为8.61mg/L, 窒息点是0.68mg/L。二者之间的关系可用一元二次方程Y = –0.0171X2 + 0.1629X + 0.282 (R2 = 0.9671, Y为耗氧率, X为氨氮质量浓度)表示。
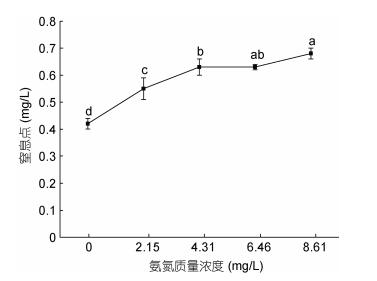 |
| 图 4 氨氮胁迫对大口黑鲈窒息点的影响 Fig. 4 The effect of ammonia-N on asphyxiation point of M. salmoides |
氨氮浓度范围在0—8.61mg/L内, 随着浓度的增加, 耗氧率呈现出先升高再降低的变化趋势(见图 5), 表明本研究氨氮质量浓度范围内的氨氮可致大口黑鲈耗氧率表现出比较显著的毒物兴奋效应, 而当超过可承受的水平后则出现抑制现象。在浓度为4.31mg/L时耗氧率达到峰值0.338mg/(g·h)而后下降。经单因素方差分析得出, 4个氨氮胁迫组与对照组比较均有显著差异(P < 0.05)。二者之间的关系可用一元二次方程Y = –0.0254X2 + 0.1732X + 0.02 (R2=0.8676, Y为耗氧率, X为氨氮质量浓度)表示。
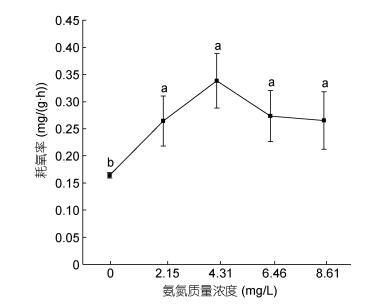 |
| 图 5 氨氮胁迫对大口黑鲈耗氧率的影响 Fig. 5 The effect of ammonia-N on oxygen consumption rate of M. salmoides |
昼夜节律是生物长期进化, 顺应生物钟作用的结果, 也是一种本能性的调节机制, 不仅能够把身体内部环境和外部环境条件的节奏紧密结合起来, 而且能预先感受到环境因子的周期性变化, 然后经神经系统和内分泌系统的调节和支配作用, 使生理状态发生相应的节律变化, 以适应环境的变化进而有利于生存。鱼类代谢水平的昼夜变化有3种类型: (1)白天大于夜间, 如花狼鱼(Anarhichas minor Olafsen) (Foss et al, 2003); (2)夜间大于白天, 如青石斑鱼(Epinephelus awoara) (戴庆年等, 1994); (3)昼夜差异不明显, 如黑鲷(Sparusm acrocephalus) (朱爱意等, 2007)。本试验研究对象大口黑鲈幼鱼的耗氧率夜均 > 昼均, 且差异显著(P < 0.05), 属于昼伏夜出型, 这与蔡磊等(2012)对大口黑鲈幼鱼进行昼夜耗氧率研究得出的结论基本一致。Clausen(1936)认为, 鱼类耗氧率有规律的昼夜变化, 代表鱼类在自然环境中的活动周期, 耗氧率高时表示鱼类进食或进行其他活动。根据本研究结果2:00—6:00和18:00—20:00这两个时间段是大口黑鲈的两个耗氧高峰期, 应该是其在长期进化过程中形成的结果, 因此在日常养殖管理过程中, 建议在这两个时段进行投饲, 有利于提高饲料的利用率、促进生长。
3.2 氨氮胁迫对大口黑鲈耗氧率的影响鱼类是变温生物, 随着水温升高, 维持生命的脑、心、肝等重要组织器官的活性增强, 各种酶活性提高, 鱼类活动强度增大, 基础代谢旺盛, 表现出耗氧率升高现象(沈勤等, 2008; 龚达荣等, 2018)。闫茂仓等(2008)运用实验生态学的方法研究了不同温度条件下对条石鲷幼鱼(Oplegnathus fasciatus)的呼吸、排泄的影响, 发现耗氧率随温度的升高而增大, 当超过最适合生长温度后, 表现出耗氧率下降的情况, 本实验结果与之相符; 当水温从13℃增加至21℃时随着水温上升, 其耗氧率快速上升, 水温对耗氧率影响显著(P < 0.05);水温从21℃上升至25℃耗氧率变化不显著(P > 0.05), 水温29℃时耗氧率达到峰值, 33℃时耗氧率显著低于29℃, 由此可以推断该生长阶段的大口黑鲈最适生长水温在21—25℃, 25—29℃间耗氧率快速上升(P < 0.05), 当水温超过29℃时, 导致代谢抑制, 耗氧率随之降低。尽管据报道大口黑鲈在34℃也能存活, 一方面不同生长阶段其耐温能力有所不同, 另一方面生存不同与生长; 本实验数据表明, 水温超过29℃其生命活动会受到抑制, 已不利于生长。
3.3 体重对大口黑鲈耗氧率的影响体重是影响生物耗氧率的重要因素之一, 是能量营养学研究中不可忽视的内容。Winberg(1956)提出二者之间的相关公式为指数函数关系, 即: R = aWb, 式中, a、b均为常数。Singer(2006)的研究表明, a值一般因条件和种类不同, 引起的差异也较大; b值则反映出生物的异速生长特征。通常来说, 同一物种, 随着生长时间增加, 体重越大, 耗氧量越大, 耗氧率相对减小。本实验中大口黑鲈幼鱼随着体重增加耗氧率逐渐下降, 11.87±1.42g是一个重要拐点, 小于这个体重的幼鱼体重对耗氧率的影响较明显(P > 0.05), 大于11.87±1.42g变化趋势逐渐趋缓。主要体重越大, 其脑、肝、脾、肾等代谢旺盛的重要器官占体重的比越小, 耗氧率也随着体重的增加而降低(姜祖辉等, 1999)。另一方面, 不同生长阶段的仔、幼鱼代谢活动要比大鱼旺盛(王永昌等, 2018)。因此, 在日常管理中幼鱼阶段更需要保证充足的氧气满足生长需求。
3.4 氨氮胁迫对大口黑鲈窒息点、耗氧率的影响据孙宝柱等(2010)报道, 青鱼(Mylopharyngodon piceus)的窒息点为0.63—0.89mg/L, 鳙鱼(Aristichthys nobilis)为0.19mg/L, 鲫鱼(Carassius auratus)为0.11— 0.13mg/L, 草鱼(Ctenopharyngodon idellus)为0.24mg/L, 白鲢(Hypophthalmichys molitrix)为0.26mg/L, 在13.5℃、pH 7.5和体重为9.54±1.41g的条件下, 大口黑鲈幼鱼对照组的窒息点为0.42±0.02mg/L, 远高于鳙鱼、白鲢、草鱼、鲫鱼, 但低于青鱼; 一般淡水养殖水质标准要求非离子氨浓度要求控制在0.02mg/L以内, 当氨氮浓度从0上升到2.15mg/L时(非离子氨浓度0.0162mg/L)大口黑鲈幼鱼窒息点和耗氧率均显著升高(P < 0.05), 窒息点随着氨氮浓度的增加而持续升高; 耗氧率则呈先升高后降低的趋势, 当氨氮浓度超过4.31mg/L(非离子氨浓度为0.0325mg/L, 超过淡水养殖水质标准62.5%)时, 耗氧率随之降低, 表明此时氨氮浓度已超过鱼体承受能力, 毒物兴奋效应减弱, 出现呼吸抑制, 这与何强等(2016)雅罗鱼(Leuciscus waleckii Dybowski)的结果相近。过高会损坏水生动物的鳃, 侵入消化系统以致威胁免疫系统, 使鱼类抗病能力下降以及生理代谢、生存遭受威胁, 本研究表明大口黑鲈对水体中的非离子氨浓度比较敏感, 在集约化养殖过程中要密切注意水体的溶氧及氨氮浓度。
4 结论根据研究结果认为大口黑鲈对水体中的非离子氨浓度变化比较敏感, 在日常管理中小于11.87± 1.42g幼鱼尤其要注意充足的溶氧; 21—25℃为其最适生长温度; 建议在2:00—6:00和18:00—20:00两个时间段进行投饲。
王永昌, 梅方超, 王四维. 2018. 鱼的消化生理与鱼饵料的加工工艺. 饲料工业, 39(2): 1-8 |
中华人民共和国农业部. 2001. NY 5051-2001无公害食品淡水养殖用水水质. 北京: 中国农业出版社, 1-5
|
朱爱意, 谢佳彦, 章韶兵. 2007. 黑鲷耗氧率昼夜变化及与体重、水温的关系研究. 南方水产, 3(6): 63-66 DOI:10.3969/j.issn.2095-0780.2007.06.011 |
刘鹏, 宋协法, 葛长字. 2009. 温度、体重和昼夜节律对大菱鲆幼鱼代谢的影响. 河北渔业, 5: 1-4, 27 |
闫茂仓, 单乐州, 谢起浪, 等. 2008. 温度、盐度及体重对条石鲷幼鱼耗氧率和排氨率的影响. 海洋科学进展, 26(4): 486-496 DOI:10.3969/j.issn.1671-6647.2008.04.010 |
孙宝柱, 黄浩, 曹文宣, 等. 2010. 厚颌鲂和圆口铜鱼耗氧率与窒息点的测定. 水生生物学报, 34(1): 88-93 |
何强, 常玉梅, 苏宝锋, 等. 2016. 高碱度和高氨对达里湖瓦氏雅罗鱼耗氧率和排氨率的影响. 生物学杂志, 33(6): 48-51, 77 |
余鹏, 李忠伟, 丁淑荃, 等. 2014. 安徽大口黑鲈成鱼高产养殖模式初步研究. 水产养殖, 35(9): 1-3 DOI:10.3969/j.issn.1004-2091.2014.09.001 |
邹李昶, 任夙艺, 王志铮, 等. 2015. 氨氮急性胁迫对日本沼虾(Macrobrachium nipponensis)死亡率、耗氧率及窒息点的影响. 海洋与湖沼, 46(1): 206-211 |
沈勤, 徐善良, 严小军, 等. 2008. 温度对花鲈饥饿代谢的影响. 中国水产科学, 15(3): 500-505 DOI:10.3321/j.issn:1005-8737.2008.03.018 |
陈松波, 陈伟兴, 范兆廷. 2004. 鱼类呼吸代谢研究进展. 水产学杂志, 17(1): 82-89 DOI:10.3969/j.issn.1005-3832.2004.01.018 |
房英春, 王忠超, 王玉红. 2001. 加州鲈池塘养殖试验. 中国水产, (1): 48 DOI:10.3969/j.issn.1002-6681.2001.01.028 |
姜祖辉, 王俊, 唐启升. 1999. 菲律宾蛤仔生理生态学研究Ⅰ. 温度、体重及摄食状态对耗氧率及排氨率的影响.海洋水产研究, 20(1): 40-44 |
顾树庭, 聂家凯, 王荣泉. 2016. 大口黑鲈"优鲈1号"池塘生态养殖试验总结. 水产养殖, 37(6): 12-13 DOI:10.3969/j.issn.1004-2091.2016.06.005 |
龚达荣, 李光华, 董书春, 等. 2018. 短须裂腹鱼幼鱼耗氧率和临界窒息点的测定. 水产科技情报, 45(1): 30-33, 41 |
崔宽宽, 尤宏争, 丁子元, 等. 2018. 氨氮对中国鲈幼鱼的急性毒性试验. 科学养鱼, (5): 54-55 |
蔡磊, 白俊杰, 李胜杰, 等. 2012. 大口黑鲈幼鱼低温耐受、耗氧率和窒息点研究. 上海海洋大学学报, 21(6): 971-975 |
戴庆年, 赵莉莉. 1994. 青石斑鱼耗氧率研究. 水产科学, 13(3): 6-9 |
Bai J J, Lutz-Carrillo D J, Quan Y C et al, 2008. Taxonomic status and genetic diversity of cultured largemouth bass Micropterus salmoides in China. Aquaculture, 278(1-4): 27-30 DOI:10.1016/j.aquaculture.2008.03.016 |
Clausen R G, 1936. Oxygen consumption in fresh water fishes. Ecology, 17(2): 216-226 DOI:10.2307/1931461 |
Foss A, Vollen T, Øiestad V, 2003. Growth and oxygen consumption in normal and O2 supersaturated water, and interactive effects of O2 saturation and ammonia on growth in spotted wolffish (Anarhichas minor Olafsen). Aquaculture, 224(1-4): 105-116 DOI:10.1016/S0044-8486(03)00209-6 |
Frances J, Nowak B F, Allan G L, 2000. Effects of ammonia on juvenile silver perch (Bidyanus bidyanus). Aquaculture, 183(1-2): 95-103 DOI:10.1016/S0044-8486(99)00286-0 |
Prenter J, MacNeil C, Dick J T A et al, 2004. Lethal and sublethal toxicity of ammonia to native, invasive, and parasitised freshwater amphipods. Water Research, 38(12): 2847-2850 DOI:10.1016/j.watres.2004.03.042 |
Russo R C, Thurston R V, 1991. Toxicity of ammonia, nitrite, and nitrate to fishes. In: Brune D E, Tomasso J R eds. Aquaculture and Water Quality. Baton Rouge: World Aquaculture Society, 58-89
|
Singer D, 2006. Size relationship of metabolic rate:oxygen availability as the "missing link" between structure and function?. Thermochimica Acta, 446(1-2): 20-28 DOI:10.1016/j.tca.2006.05.006 |
Sun L H, Chen H R, Huang L M, 2007. Growth, faecal production, nitrogenous excretion and energy budget of juvenile yellow grouper (Epinephelus awoara) relative to ration level. Aquaculture, 264(1-4): 228-235 DOI:10.1016/j.aquaculture.2006.12.036 |
Winberg G G, 1956. Rate of metabolism and food requirements of fishes. Transl Fish Res Board Can, 194: 1-253 |
 2019, Vol. 50
2019, Vol. 50


