中国海洋湖沼学会主办。
文章信息
- 宋柳, 吕建建, 王磊, 孙东方, 刘萍. 2019.
- SONG Liu, LÜ Jian-Jian, WANG Lei, SUN Dong-Fang, LIU Ping. 2019.
- 三疣梭子蟹几丁质酶基因(PtCht6)的克隆及其在免疫中的功能分析
- CLONING OF CHITINASE GENE (PTCHT6) IN PORTUNUS TRITUBERCULATUS AND ITS FUNCTIONAL ANALYSIS IN IMMUNITY
- 海洋与湖沼, 50(5): 1080-1090
- Oceanologia et Limnologia Sinica, 50(5): 1080-1090.
- http://dx.doi.org/10.11693/hyhz20190100001
文章历史
-
收稿日期:2019-01-01
收修改稿日期:2019-03-06
2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266235;
3. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛 266071
2. Qingdao National Laboratory of Marine Science and Technology, Functional Laboratory of Marine Fishery Science and Food Production Process, Qingdao 266235, China;
3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fisheries Science, Key laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Qingdao 266071, China
几丁质酶(chitinase)是一种广泛存在于节肢动物, 参与机体蜕皮生长、变态发育及免疫应答等生理过程的关键酶类, 可通过裂解几丁质(chitin)从而发挥多种功能(李旭光等, 2017; 张文宜等, 2018; Ravichandran et al, 2018)。节肢动物几丁质酶属于18-糖苷键水解酶(GH18)多基因家族, 目前大多研究集中于昆虫中, 其成员被归类为8个组别(Group1—8) (Zhou et al, 2018a)。相比于昆虫, 甲壳动物在该方面的研究相对滞后, 目前仅发现7组几丁质酶基因, 其中在日本沼虾(Macrobrachium nipponense)中发现了10个, 在中华绒螯蟹(Eriocheir sinensis)中发现了6个, 研究表明其在消化、蜕皮及免疫应答调控中发挥一定功能(Salma et al, 2012; Zhou et al, 2018b)。三疣梭子蟹(Portunus trituberculatus)几丁质酶基因研究刚刚起步, 仅有PtCht3(Group 3)(张凤等, 2017)、PtCht (Group 7)(张凤等, 2015)和PtChti(Group 3)(王伟等, 2015)等几例, 功能研究主要聚焦于蜕皮及盐度适应等。Group 5是甲壳动物几丁质酶基因家族的重要成员, 在斑节对虾(Penaeus monodon)(Zhou et al, 2018a)、南美白对虾(Litopenaeus vannamei)(Huang et al, 2010)及拟穴青蟹(Scylla paramamosain)(Zhou et al, 2018b)等中均已被挖掘, 研究发现其在机体免疫防御中发挥重要功能(Niu et al, 2018)。但目前尚未见三疣梭子蟹Group 5几丁质酶基因的相关研究报道。
三疣梭子蟹是重要的海水经济蟹类(任海波等, 2018), 对虾白斑综合征病毒(WSSV) (Marques et al, 2011)和副溶血弧菌(Vibrio parahaemolyticus)(Sullivan et al, 2018)是致其死亡的主要病原。盐度是三疣梭子蟹养殖中的重要环境因子(张凤等, 2015), 由于阴雨天气及大换水等常会导致养殖水体盐度急剧变化, 使得三疣梭子蟹产生应激反应, 生理代谢紊乱(韩晓琳等, 2014; 张凤等, 2015, 2017), 进而免疫力下降, 极易引起疾病的爆发, 甚至大量死亡。我们的实验也表明在低盐度11的情况下, 无论是感染WSSV还是副溶血弧菌, 其死亡率均显著高于正常盐度海水。
本实验克隆了三疣梭子蟹几丁质酶基因PtCht6, 属于GH18家族Group 5成员, 分析了其结构特征和功能, 查清了该基因在不同组织、不同蜕皮时期及病原感染和盐度胁迫下的响应模式, 研究结果证明了PtCht6在三疣梭子蟹免疫防御中的功能, 对于解析低盐影响三疣梭子蟹免疫的分子机制具有重要意义。
1 材料与方法 1.1 实验样品的采集实验材料为随机挑选的平均体重为25±6g的80日龄健康三疣梭子蟹。实验全程于黄海水产研究所实验基地山东省昌邑市海丰水产有限公司进行, 在20m3的室内水泥池中暂养7天, 暂养期间, 维持水温25±3℃, 盐度35, pH 8.7, 持续充氧, 每天更换1/3体积的海水且定时投喂新鲜杂鱼。随机选取9只暂养后健康有活力的三疣梭子蟹分别取其9个组织(血细胞、心脏、肝胰腺、鳃、肠、肌肉、表皮、胃、眼柄)存于液氮, 设3个平行, 每个平行3只, 用于组织表达分布分析, 其中血细胞的获得方法参照Yue等(2010)。
根据沈洁等(2011)三疣梭子蟹蜕皮分期的鉴定方法, 取部分暂养后健康的三疣梭子蟹分成三个蜕皮时期:蜕皮后期(A/B)、蜕皮间期(C)、蜕皮前期(D), 各时期均取3只, 设3个平行。将分期的蟹的肝胰腺分离, 置于液氮中冷冻保存, 为后期实验备用。
1.2 实验方法 1.2.1 病原感染实验随机选取30只暂养后健康的三疣梭子蟹, 平均分成3组, 依据张杰等(2017)报道的注射WSSV和副溶血弧菌的剂量浓度进行预实验, 在自然海水饲养条件下, 感染副溶血弧菌6h后出现死亡个体, 感染WSSV 12h后出现死亡个体, 由此确定其致病性和浓度。正式实验另选取270只三疣梭子蟹, 平均分成3组, 均于游泳足第一关节基膜处(谢建军等, 2011; Ren et al, 2017)进行注射, 空白对照组注射100μL无菌的海洋甲壳动物生理盐水, 实验组分别注射100μL的3.7×107 copy/mL WSSV和107CFU/mL副溶血弧菌, 其中WSSV粗提液和副溶血弧菌悬液参照窦全伟等(2018)的方法提取制备。实验期间饲养管理与暂养期一致。在注射后0、3、6、12、24、48、72h各时间点分别取血细胞和肝胰腺组织置于液氮中保存, 每组取3只。
1.2.2 低盐胁迫及胁迫下的病原感染实验随机选取30只暂养后健康的三疣梭子蟹进行72h半致死盐度(72h-LC50)预实验(隋延鸣等, 2012a, b; 韩晓琳等, 2014), 确定72h-LC50为11。在此基础上, 另取暂养后三疣梭子蟹进行正式实验, 分为2组:一组进行低盐胁迫实验, 分为空白对照组(自然海水盐度35)和实验组(低盐度11), 各30只, 重复3次, 低盐度的调配方法详见隋延鸣等(2012a); 另一组, 进行低盐胁迫下的病原感染实验, 重复1.2.1注射操作后置于低盐度(11)条件下进行胁迫。实验期间饲养管理与暂养期一致。在胁迫后0、3、6、12、24、48、72h各时间点分别取血细胞和肝胰腺组织置于液氮中保存, 每组取3只。
1.3 PtCht6 cDNA全长的克隆取未处理三疣梭子蟹的心脏、鳃、肝胰腺、表皮等组织样品采用TRIzol® Reagent (Roche公司)方法进行总RNA提取, 利用紫外分光光度计(NanoDrop 2000, Thermo)和1%琼脂糖凝胶电泳检测提取的总RNA的质量和浓度。将各组织中高质量的总RNA均匀混合, 使用SMARTer® RACE cDNA Amplification Kit (TaKaRa公司)合成3′和5′ RACE cDNA模板。根据从本实验室构建的三疣梭子蟹转录组数据库中筛选验证得到的PtCht6基因EST序列, 利用Primer Premier 5.0软件设计3′和5′ RACE特异性引物及通用引物(表 1) (上海生工生物工程有限公司合成), 使用TransTaq® DNA Polymerase High Fidelity (HiFi)高保真聚合酶(北京全式金生物公司)参照说明书进行RACE 3′和5′末端巢式PCR扩增。将获得的PCR产物回收纯化、连接转化, 挑取阳性单克隆, M13-47/48引物进行菌落PCR鉴定后筛选目的菌液送至上海生工生物工程有限公司进行测序。
| 引物 | 序列(5′—3′) | 用途 |
| PtCht6-3′ F1 | AGCGAAGAAGGAGACGAAGGG | 3′-RACE |
| PtCht6-3′ F2 | GCCCACAGCGGCACCTATTTCA | 3′-RACE |
| PtCht6-5′ R1 | GGTGCCTGTGGACGCTTGGAG | 5′-RACE |
| PtCht6-5′ R2 | CACGCCATCACGGGCTCCT | 5′-RACE |
| PtCht6-vcf | ATGTATAGCCCAAAGTCTTCATCTT | ORF验证 |
| PtCht6-vcr | TCAGTAGGAGTAATTGGAAGGGGAT | ORF验证 |
| PtCht6-F | CTTCGTCTCCTTCTTCGC | qRT-PCR |
| PtCht6-R | GATGCTCGGCTACAATGA | qRT-PCR |
| UPM-long | CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT | RACE通用引物 |
| UPM-short | CTAATACGACTCACTATAGGGC | RACE通用引物 |
| NUP | AAGCAGTGGTATCAACGCAGAGT | RACE通用引物 |
| M13F (-47) | CGCCAGGGTTTTCCCAGTCACGAC | DNA测序 |
| M13R (-48) | AGCGGATAACAATTTCACACAGGA | DNA测序 |
| β-actin-F | CGAAACCTTCAACACTCCCG | qRT-PCR内参 |
| β-actin-R | GGGACAGTGTGTGAAACGCC | qRT-PCR内参 |
利用Contig Express软件将克隆序列与EST序列进行拼接、验证, 得到PtCht6基因的cDNA全长, 分别采用NCBI-BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)、ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)在线软件对序列进行比对分析及开放阅读框(ORF)的预测。蛋白质基本物理性质、功能结构域、信号肽、糖基化活性位点及抗菌肽位点均通过SMART (http://smart.emblheidelberg.de/)、ExPASy (https://web.expasy.org/computepi/)、Signal4.1 (http://www.cbs.dtu.dk/services/SignalP/)和AMP C(http://tcoffee.crg.cat/apps/ampa/do)在线程序进行预测。借助MEME Suite (http://memesuite.org/index.html)在线程序及TB Tools软件预测构建不同物种的Motif图, 并利用MEGA6.0软件采用邻接法(neighbor-joining method)构建系统进化树。
1.5 PtCht6的组织表达及各实验组的表达特征分析使用TRIzol (Roche公司)方法提取总RNA, 总RNA的质量和浓度的检测方法同1.3。选取高质量的RNA样品借助HiScript Ⅱ Q RT SuperMix for qPCR (+gDNA wiper) kit (南京诺维赞)进行反转录成cDNA, 用于后续的实时荧光定量PCR分析。根据已获得的PtCht6 cDNA全长序列, 通过Primer Premier 5.0软件设计实时荧光定量PCR特异性引物, 内参基因选用β-actin(表 1)。使用Applied BiosystemsTM 7500 Real Time PCR instrument定量仪, 采用2–△△Ct的计算方法进行样品的相对荧光定量分析, 10μL反应体系: 5μL 2×ChamQ Universal SYBR Qpcr Master Mix、0.2μL Primer F (10μmol/L)、0.2μL Primer R (10μmol/L)、2μL Template cDNA、2.6μL ddH2O, 程序: 95℃ 10min; 95℃ 30s, 95℃ 5s, 60℃ 34s, 40个循环; 95℃ 15s; 60℃ 1min; 95℃ 15s。使用SPSS19.0软件对实验过程中产生的数据进行单因素方差分析, 借助OriginPro和Excel软件将统计结果整理形成图表, P < 0.05为差异显著。
2 结果与分析 2.1 PtCht6基因cDNA全长及序列的结构特征实验已获得的三疣梭子蟹几丁质酶基因PtCht6 (GenBank登录号MH160827)的结构特征见图 1。cDNA全长为2736bp, 包括348bp 5′-UTR、2103bp ORF和285bp 3′-UTR, 共编码700个氨基酸, 预测分子量为76.603kDa, 理论等电点(pI)为6.29, 由于其较高的不稳定系数(Instability index)53.24和亲水性平均系数(Grand average of hydropathicity, GRAVY)-0.381, 推测为不稳定亲水蛋白。借助Signal4.1及SMART在线软件预测分析PtCht6氨基酸结构特征, 结果显示, 该氨基酸序列具有几丁质酶GH18家族典型特征(图 2), 包括N端38个氨基酸组成的信号肽、第18家族催化结构域、含6个半胱氨酸残基(Cys)的几丁质结合结构域及位于后两者之间的富含苏氨酸和脯氨酸的连接区域。此外, NCBI Conserved Domains分析PtCht6糖基化活性位点为271FDGLDLDWE279, AMCA预测此氨基酸存在13个抗菌肽残基(图 3)。
 |
| 图 1 三疣梭子蟹PtCht6基因cDNA全长及其推导的氨基酸序列 Fig. 1 The nucleotide sequence and deduced amino acids sequence of P. trituberculatus PtCht6 注:红色方框:起始密码子(ATG)和终止密码子(TGA); 黑色加粗字体: N-信号肽; 灰色阴影区:几丁质酶第18家族催化结构域(Glyco_18 catalytic domain); 实线下划线:几丁质结合结构域(ChtBD2);虚线下划线:苏氨酸和脯氨酸连接区域; 红色三角形:半胱氨酸残基; 黑色方框:几丁质酶第18家族保守基序; 斜体字: Poly A结构 |
 |
| 图 2 三疣梭子蟹PtCht6基因编码蛋白结构域位置 Fig. 2 The protein domain architecture of P. trituberculatus PtCht6 |
 |
| 图 3 利用AMPA算法形成的三疣梭子蟹PtCht6抗菌谱(阈值0.249, 仅用于确定抗菌延伸的长度, 不影响抗菌谱)及预测的抗菌肽区域在基因中的位置 Fig. 3 The antimicrobial profile of P. trituberculatus PtCht6 (the threshold value is 0.249, which is used to determine the length of antimicrobial stretches only and does not affect the antimicrobial profile). The positions of the predicted antibacterial peptide regions in the gene are generated by AMPA algorithm 注:蓝色方框表示抗菌肽区域 |
使用NCBI-BLAST在线软件对三疣梭子蟹PtCht6基因编码的氨基酸序列与其他物种几丁质酶基因编码的蛋白进行同源性比对分析, 结果显示, 该氨基酸序列与拟穴青蟹SpCht5的同源性最高(85%), 其次是南美白对虾LvCht5(64%)、斑节对虾PmCht5 (63%)及南美白对虾LvCht5' (62%)。通过DNAMAN 5.2.9软件对这5个不同的氨基酸序列进行比对发现(图 4), 其氨基酸序列均存在几丁质酶GH18家族的典型结构。利用MEGA 6.0软件对三疣梭子蟹PtCht6基因氨基酸序列进行系统进化分析, 采用Bootstrap方法计算1000次后构建系统进化树(图 5)。结果表明, 这些甲壳类几丁质酶基因分为七组, 其中Group1、Group2、Group3和Group6分别由Cht1、Cht2、Cht3和Cht6家族基因组成, Group 5由PtCht6和SpCht5、LvCht5、PmCht5、LvCht5' 等组成, 单独将三疣梭子蟹PtCht基因分为Group 7。此外, 结合Motif图(图 5, 表 2)分析发现, 几丁质酶GH18家族基因均含有4个保守基序(吕黎等, 2011; Huang et al, 2012; Zhou et al, 2018a) (motif1-FDGXDLDWEYP-MotifⅡ, motif2- MXYDXXG-motifⅢ, motif3-GXXXXXDD-motifⅣ, motif8-KXXXXXGGW-motifⅠ; X代表非特异性氨基酸), 而其他氨基酸序列的进化同样具有一定的保守性。
 |
| 图 4 三疣梭子蟹PtCht6氨基酸序列的多序列比对 Fig. 4 The multiple sequences alignment of amino acid sequences of P. trituberculatus PtCht6 注:各物种名称及GenBank登录号:拟穴青蟹SpCht5 AWU46593.1;南美白对虾: LvCht5 AWD73767.1, LvCht5’ ACR23315.1;斑节对虾: PmCht5 ARM20252.1) |
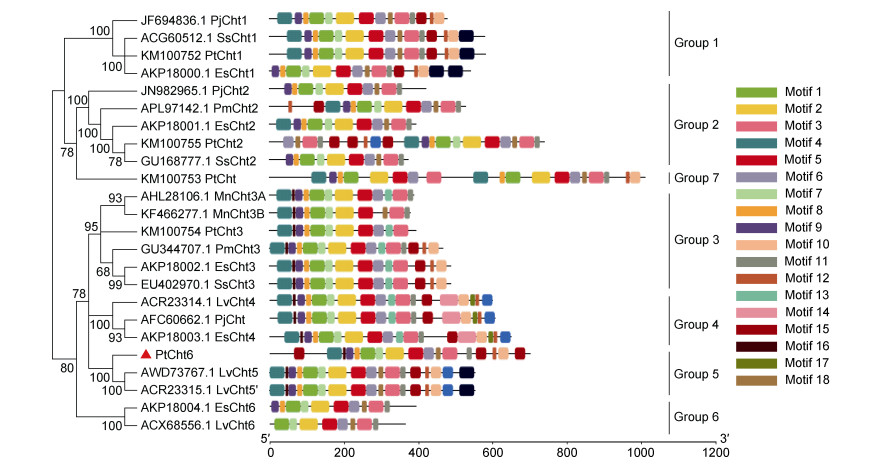 |
| 图 5 基于PtCht6氨基酸序列构建的不同物种的系统进化树及其对应的Motif图 Fig. 5 Phylogenetic tree and the corresponding Motif of each species based on PtCht6 amino acid sequences 注:各物种名称:三疣梭子蟹Pt; 日本沼虾Mn; 南美白对虾Lv; 斑节对虾Pm; 锯缘青蟹Ss; 日本仿长额虾Pj; 中华绒螯蟹Es |
2.3 PtCht6组织表达分布
利用实时荧光定量PCR分析三疣梭子蟹PtCht6基因在不同组织中的相对表达情况, 结果如图 6所示, 该基因在心脏、肝胰腺、眼柄、肌肉、血淋巴、鳃、表皮、胃和肠9个组织中均有表达, 但在肝胰腺中表达量最高, 其次是眼柄、肌肉、胃和心脏, 与其他组织表达量比较有显著性差异(P < 0.05)。
 |
| 图 6 三疣梭子蟹PtCht6在不同组织中的表达 Fig. 6 Relative expression of PtCht6 gene in the various tissues of P. trituberculatus 注: H:心脏; He:肝胰腺; E:眼柄; M:肌肉; B:血细胞; G:鳃; S:胃; C:表皮; I:肠。不同小写字母代表表达量的差异显著性(P < 0.05) |
PtCht6基因在三疣梭子蟹不同蜕皮时期的肝胰腺中均有表达(图 7), 蜕皮后期(A/B)表达量最高, 蜕皮间期(C)次之, 蜕皮前期(D)最低, 呈明显下降的趋势, 各时期之间的表达量呈显著性差异(P < 0.05)。
 |
| 图 7 三疣梭子蟹PtCht6在不同蜕皮时期的肝胰腺中的表达 Fig. 7 Relative expression of PtCht6 gene in hepatopancreas during molting cycle of P. trituberculatus 注: A/B:蜕皮后期; C:蜕皮间期; D:蜕皮前期。不同小写字母代表表达量的差异显著性(P < 0.05) |
在不同病原刺激下, PtCht6在肝胰腺及血细胞中的表达情况如图 8所示。注射WSSV后, PtCht6在肝胰腺中的表达主要呈先上升后下降的趋势, 在12h达到最大值(P < 0.05), 为对照组的3.11倍, 此后相比于对照组均呈上调表达, 而在血细胞中的表达趋势为先上升后下降再上升, 相较于对照组, 除24h外均呈上调表达, 12h达到最大值(P < 0.05), 为对照组的6.14倍。感染副溶血弧菌后, PtCht6在肝胰腺中的表达呈上升、下降后再上升的趋势, 72h达到最大值(P < 0.05), 为对照组的3.15倍, 12h表达量为最小值(P < 0.05), 为对照组的0.2倍, PtCht6在血细胞中的表达量与对照组相比, 感染后的12—72h均呈上调表达, 24h达到最大值(P < 0.05), 为对照组的2.6倍。
 |
| 图 8 PtCht6在不同病原刺激下的三疣梭子蟹的肝胰腺和血细胞中的表达 Fig. 8 Relative expression of PtCht6 gene response to the challenges of different pathogens in hepatopancreas and blood cell of P. trituberculatus 注:不同小写字母代表表达量的差异显著性(P < 0.05) |
三疣梭子蟹在处理后72h内, PtCht6在肝胰腺及血细胞中的表达结果(图 9)显示:在低盐胁迫下, 与对照组相比, PtCht6在肝胰腺及血细胞中0—24h的表达均呈显著下调(P < 0.05), 48h均为显著上调表达(P < 0.05), 不同之处在于, 在胁迫72h后, PtCht6在肝胰腺中的表达继续升高至峰值(P < 0.05), 为对照组的3.40倍, 而在血细胞中的表达急剧下降至对照组的0.84倍(P < 0.05)。注射WSSV后, PtCht6在肝胰腺中的表达与对照组相比, 12h前均呈显著下调(P < 0.05), 6h达到最小值, 为对照组的0.40倍, 12h后(含12h)呈显著上调(P < 0.05), 24h达到最大值, 为对照组的25.38倍。在血液中, 其表达在感染WSSV后24h内(含24h)呈先下降再上升的趋势, 但与对照相比, 均为显著下调表达(P < 0.05), 24h后, PtCht6的表达量呈直线上升至72h达到峰值, 为对照组的6.74倍, 均为显著上调表达(P < 0.05)。注射副溶血弧菌后, 三疣梭子蟹于12h即全部死亡, PtCht6在肝胰腺及血细胞中的表达具有相同的趋势(先下降再上升再下降), 与对照相比, 感染3h后均为显著下调表达(P < 0.05), 之后上升至6h达到峰值, 分别为对照的2.41倍和2.17倍, 为显著上调表达(P < 0.05), 随之再下降至最低值(12h), 分别为对照的0.96倍和0.85倍。
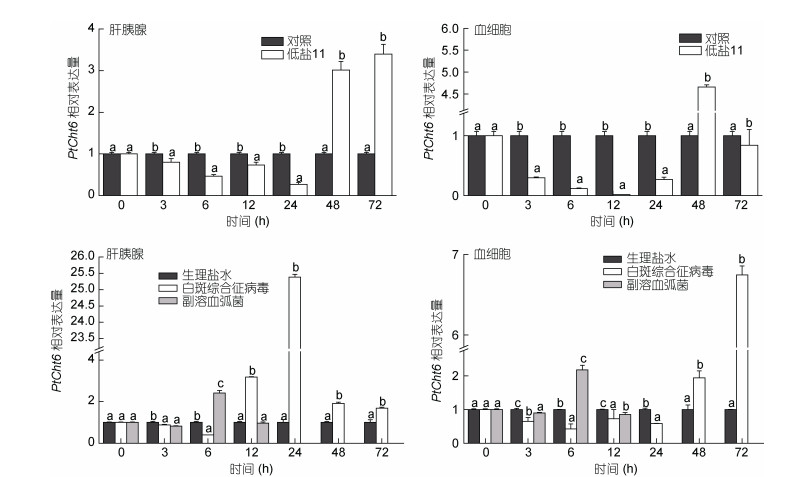 |
| 图 9 PtCht6在低盐胁迫及胁迫下感染不同病原的三疣梭子蟹的肝胰腺和血细胞中的表达 Fig. 9 Relative expression of PtCht6 gene in hepatopancreas and blood cell of P. trituberculatus under ambient low salinity stress in which different pathogens are infected 注:不同小写字母代表表达量的差异显著性(P < 0.05) |
本研究中成功克隆了三疣梭子蟹PtCht6 cDNA全长, 该基因与南美白对虾的LvCht5、斑节对虾的PvCht5聚为甲壳动物几丁质酶Group 5, 这也是三疣梭子蟹几丁质酶基因Group 5的首个克隆。PtCht6基因具有GH18几丁质酶家族基因的典型结构(王伟等, 2015), 其中, 根据Merzendorfer(2003)的研究表明, ChtBD2结合结构域和T/P连接区域是几丁质酶结合不溶性几丁质的主要结构, 本研究中的三疣梭子蟹几丁质酶基因PtCht6具有一个内含3个由6个半胱氨酸形成的二硫键和7个芳香族残基(FYWWFFF)的ChtBD2结合结构域, 及富含苏氨酸(T)和脯氨酸(P)的T/P连接区域, 这保证了基因对不溶性几丁质的水解能力(Tjoelker et al, 2000), 为其参与机体的免疫防御提供了结构基础。
序列分析表明PtCht6基因存在13个抗菌肽位点(阈值0.249), 推测其具有一定的免疫功能, 且该基因在肝胰腺中的表达量显著高于其他组织(P < 0.05), 而肝胰腺是参与机体免疫防御的重要组织(Zhou et al, 2017, 2018a), 这也部分支持了我们的推测。为深入研究PtCht6是否具有免疫功能, 我们设计了人工病原感染实验。发现注射WSSV和副溶血弧菌后, PtCht6的表达量相较于对照组, 整体呈上调表达, 在肝胰腺中分别于12h、72h达到最大值, 在血细胞中分别于12h、24h达到最大值, 结果进一步证明了PtCht6基因可能作为重要免疫因子参与三疣梭子蟹的免疫防御(郭志勋等, 2006)。
盐度是三疣梭子蟹养殖中重要的环境因子, 为了研究Ptcht6基因是否在低盐影响三疣梭子蟹免疫力中具有一定的作用, 我们设置了低盐胁迫以及低盐胁迫下的病原感染实验。发现在低盐胁迫条件下, PtCht6的表达量在48h前的肝胰腺和血液中均为显著下调(P < 0.05)。在低盐胁迫下注射WSSV后, PtCht6在肝胰腺和血液中的表达量分别在24h和72h达到峰值, 比正常情况下感染WSSV达到峰值的时间出现明显延迟。在低盐胁迫下注射副溶血弧菌后, 由于其对三疣梭子蟹的强致死性, 使得与正常情况下感染同样浓度的副溶血弧菌的病蟹(72h全部死亡)相比, 单位时间内死亡率显著提高(P < 0.05), 且12h病蟹死亡率达到最大值时PtCht6的表达量降至最小值。研究结果预示着低盐胁迫可能抑制或延后几丁质酶等免疫基因的正常表达, 从而导致机体免疫力下降。
本研究中同时检测了该基因在不同蜕皮时期的肝胰腺中的表达模式, 发现PtCht6在肝胰腺中的表达量由蜕皮后期(A/B)、蜕皮间期(C)、蜕皮前期(D)依次递减(P < 0.05), 与南美白对虾(Rocha et al, 2012)中的研究结果类似, 这可能与三疣梭子蟹在蜕皮过程中的形态特征有关, 蜕皮后期蟹体各部位充水柔软, 极易受到病原的侵袭, 此时PtCht6的表达量为最大值, 随着蜕皮时期的变化, 蟹背甲及身体各部逐渐变硬, 角质层显著增加(Guerao et al, 2010), 形成天然保护屏障, 受到外界环境波动的影响随之减小, 而PtCht6的表达也逐渐降低, 由此推测PtCht6参与三疣梭子蟹蜕皮时期的免疫防御, 与王伟等(2015)关于三疣梭子蟹PtChi基因的报道相一致。这一结果也印证了PtCht6可能作为免疫因子参与机体免疫应答的结论。
王伟, 吴旭干, 潘桂平, 等. 2015. 三疣梭子蟹几丁质酶基因的克隆及其在蜕皮过程中的表达分析. 水产学报, 39(9): 1291-1301 |
吕黎, 宁黔冀. 2011. 甲壳动物几丁质酶基因结构与功能的研究进展. 生理科学进展, 42(6): 457-459 |
任海波, 李燕波, 张肖荣, 等. 2018. 三疣梭子蟹抗菌肽Scygonadin基因的克隆与序列分析. 生物学杂志, 35(4): 21-24 DOI:10.3969/j.issn.2095-1736.2018.04.021 |
李旭光, 周刚, 周军, 等. 2017. 水生甲壳类几丁质酶类基因家族功能与表达调控的研究进展. 水产养殖, 38(4): 26-30 DOI:10.3969/j.issn.1004-2091.2017.04.006 |
沈洁, 朱冬发, 胡则辉, 等. 2011. 三疣梭子蟹蜕皮周期的分期. 水产学报, 35(10): 1481-1487 |
张凤, 吕建建, 刘萍, 等. 2015. 三疣梭子蟹几丁质酶基因克隆鉴定及在低盐胁迫和蜕皮周期中的表达分析. 海洋与湖沼, 46(4): 948-957 |
张凤, 吕建建, 刘萍, 等. 2017. 三疣梭子蟹(Portunus trituberculatus)几丁质酶PtCht3基因克隆鉴定及表达分析. 渔业科学进展, 38(2): 167-176 |
张杰, 吕建建, 刘萍, 等. 2017. 三疣梭子蟹HMGBa基因克隆及其应答不同病原入侵的表达特征. 水生生物学报, 41(6): 1193-1199 |
张文宜, 张世勇, 陈校辉, 等. 2018. 日本沼虾几丁质酶1C(MnCht1C)基因的克隆及表达分析. 基因组学与应用生物学, 37(2): 723-732 |
郭志勋, 冯娟, 王江勇. 2006. 斑节对虾血淋巴细胞对鳗弧菌的清除作用. 中国水产科学, 13(1): 28-32 DOI:10.3321/j.issn:1005-8737.2006.01.005 |
隋延鸣, 高保全, 刘萍, 等. 2012a. 三疣梭子蟹"黄选1号"盐度耐受性及适宜生长盐度分析. 大连海洋大学学报, 27(5): 398-401 |
隋延鸣, 高保全, 刘萍, 等. 2012b. 三疣梭子蟹"黄选1号"盐度耐受性分析. 渔业科学进展, 33(2): 63-68 |
韩晓琳, 高保全, 王好锋, 等. 2014. 低盐胁迫对三疣梭子蟹鳃和肝胰腺显微结构及家系存活的影响. 渔业科学进展, 35(1): 104-110 DOI:10.3969/j.issn.1000-7075.2014.01.015 |
谢建军, 许文军, 施慧, 等. 2011. 溶藻弧菌诱导对三疣梭子蟹血淋巴非特异性免疫水平的影响. 水产学报, 35(9): 1392-1398 |
窦全伟, 李吉涛, 刘萍, 等. 2018. 脊尾白虾血蓝蛋白大亚基基因的克隆及表达分析. 水生生物学报, 42(1): 86-93 |
Guerao G, Rotllant G, Anger K, 2010. Characterization of larval moulting cycles in Maja brachydactyla (Brachyura, Majidae) reared in the laboratory. Aquaculture, 302(1-2): 106-111 DOI:10.1016/j.aquaculture.2010.02.010 |
Huang Q S, Xie X L, Liang G et al, 2012. The GH18 family of chitinases: their domain architectures, functions and evolutions. Glycobiology, 22(1): 23-34 DOI:10.1093/glycob/cwr092 |
Huang Q S, Yan J H, Tang J Y et al, 2010. Cloning and tissue expressions of seven chitinase family genes in Litopenaeus vannamei. Fish & Shellfish Immunology, 29(1): 75-81 |
Marques J S, Müller I C, Moser J R et al, 2011. Wild captured crab, Chasmagnathus granulata (Dana..1851), a new host for white spot syndrome virus (WSSV). Aquaculture, 318(1-2): 20-24 DOI:10.1016/j.aquaculture.2011.04.031 |
Merzendorfer H, 2003. Chitin metabolism in insects: structure, function and regulation of chitin synthases and chitinases. Journal of Experimental Biology, 206(24): 4393-4412 DOI:10.1242/jeb.00709 |
Niu S W, Yang L W, Zuo H L et al, 2018. A chitinase from pacific white shrimp Litopenaeus vannamei involved in immune regulation. Developmental & Comparative Immunology, 85: 161-169 |
Ravichandran G, Kumaresan V, Mahesh A et al, 2018. Bactericidal and fungistatic activity of peptide derived from GH18 domain of prawn chitinase 3 and its immunological functions during biological stress. International Journal of Biological Macromolecules, 106: 1014-1022 DOI:10.1016/j.ijbiomac.2017.08.098 |
Ren X Y, Wang Z Q, Gao B Q et al, 2017. Effects of florfenicol on the antioxidant status, detoxification system and biomolecule damage in the swimming crab (Portunus trituberculatus). Ecotoxicology and Environmental Safety, 143: 6-11 DOI:10.1016/j.ecoenv.2017.05.003 |
Rocha J, Garcia-Carreño F L, Muhlia-Almazán A et al, 2012. Cuticular chitin synthase and chitinase mRNA of whiteleg shrimp Litopenaeus vannamei during the molting cycle. Aquaculture, 330-333: 111-115 DOI:10.1016/j.aquaculture.2011.12.024 |
Salma U, Uddowla M H, Kim M et al, 2012. Five hepatopancreatic and one epidermal chitinases from a pandalid shrimp (Pandalopsis japonica): cloning and effects of eyestalk ablation on gene expression. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 161(3): 197-207 DOI:10.1016/j.cbpb.2011.11.005 |
Sullivan T J, Neigel J E, 2018. Effects of temperature and salinity on prevalence and intensity of infection of blue crabs, Callinectes sapidus, by Vibrio cholerae, V. parahaemolyticus, and V. vulnificus in Louisiana. Journal of Invertebrate Pathology, 151: 82-90 DOI:10.1016/j.jip.2017.11.004 |
Tjoelker L W, Gosting L, Frey S et al, 2000. Structural and functional definition of the human chitinase chitin-binding domain. Journal of Biological Chemistry, 275(1): 514-520 DOI:10.1074/jbc.275.1.514 |
Yue F, Pan L Q, Xie P et al, 2010. Immune responses and expression of immune-related genes in swimming crab Portunus trituberculatus exposed to elevated ambient ammonia-N stress. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 157(3): 246-251 |
Zhou K M, Zhou F L, Huang J H et al, 2017. Characterization and expression analysis of a chitinase gene (PmChi-4) from black tiger shrimp (Penaeus monodon) under pathogen infection and ambient ammonia nitrogen stress. Fish & Shellfish Immunology, 62: 31-40 |
Zhou F L, Zhou K M, Huang J H et al, 2018a. Characterization and expression analysis of a chitinase gene (PmChi-5) from black tiger shrimp (Penaeus monodon) under pathogens infection and ambient ammonia-N stress. Fish & Shellfish Immunology, 72: 117-123 |
Zhou Z K, Gu W B, Wang C et al, 2018b. Seven transcripts from the chitinase gene family of the mud crab Scylla paramamosain: their expression profiles during development and moulting and under environmental stresses. Aquaculture Research, 49(10): 3296-3308 DOI:10.1111/are.13793 |
 2019, Vol. 50
2019, Vol. 50



