中国海洋湖沼学会主办。
文章信息
- 邱晨, 姜涛, 陈修报, 刘洪波, 杨健. 2019.
- QIU Chen, JIANG Tao, CHEN Xiu-Bao, LIU Hong-Bo, YANG Jian. 2019.
- 鲤(Cyprinus carpio)仔鱼耳石锶(Sr)标记及其时滞特征的研究
- CHARACTERCTERISTICS OF OTOLITH STRONTIUM MARKING AND ITS TIME LAGS OF LARVAL CYPRINUS CARPIO
- 海洋与湖沼, 50(4): 903-912
- Oceanologia et Limnologia Sinica, 50(4): 903-912.
- http://dx.doi.org/10.11693/hyhz20190100003
文章历史
-
收稿日期:2019-01-03
收修改稿日期:2019-03-03
2. 中国水产科学研究院淡水渔业研究中心 院长江中下游渔业 生态环境评价与资源养护重点实验室 无锡 214081
2. Key Laboratory of Fishery Ecological Environment Assessment and Research Conservation in Middle and Lower Reaches of the Yangtze River, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
增殖放流活动是一项以恢复水生物资源、修复水域生态环境、促进渔民增收为目的科学性工作(杨君兴等, 2013), 近几年来, 农业部和各级政府都非常重视这项工作, 为落实《中华人民共和国渔业法》、《中国水生生物资源养护行动纲要》和《关于做好“十三五”水生生物增殖放流工作的指导意见》等相关精神, 每年都开展了大规模的增殖放流活动。值得注意的是, 标记放流技术是帮助人们获得人工向公共水域(海洋、江河、湖泊等)增殖放流后鱼类种群信息的重要手段之一。为了更好地保护和合理利用渔业资源, 开发及优化更客观的、更有效的评价增殖放流效果的标记放流方法成为了需要迫切解决的技术难题。
目前, 适用于规模化群体标记鱼类早期个体的的方法主要有体外标记、化学标记和分子标记等方法(周辉霞等, 2017)。体外标记(如挂牌、切鳍标记等)等方法虽操作简捷、不需要专门的检测装置, 但存在易对鱼体造成机械性损伤、劳动强度大、标记易遗失等不足, 且很难用于鱼苗的大规模群体标记(张堂林等, 2003; 张雪等, 2013); 有机荧光物质等化学标记可能涉及标记的有效保留时间和外源物质的安全性问题(耿倩等, 2016); 分子标记(如微卫星标记等)随相关技术的发展, 虽已可做到准确安全, 识别简单, 成本也在降低, 但对鱼苗繁殖中的亲本群体的背景、遗传档案等有很高的要求, 在一定程度上限制了其应用, 且尚处于研究阶段(宋娜等, 2010)。因而, 继续针对不同的放流种类和评价目的来探寻合适的标记技术仍具有非常重要的意义。
增殖放流鱼类(特别是苗种)的规模化标记问题长期是水生生物增殖放流关键技术研究领域的一大难点。研究表明, 耳石微量元素(如锶(Sr))作为一种天然的化学标记工具被开发出来, 具有保留时间长、易识别、成本低、标记后鱼体存活率高等优点, 且具单次可大规模标记受精卵、仔稚鱼的潜力(Warren-Myers et al, 2018)。Sr在淡水中含量很低, 而海水中的Sr浓度是淡水中的近100倍(Limburg, 1995), 已被作为有效客观重建鱼类经历过淡水、海水等不同自然生境的一种“元素指纹”(Melancon et al, 2009; Collingsworth et al, 2010; 窦硕增等, 2011; 刘洪波等, 2018)。迄今, 耳石Sr标记技术在国内外已成为了研究热点之一。在鲑鱼苗(Schroder et al, 1995)、鳗鱼幼鱼(Wickström et al, 2014)、大麻哈鱼(Oncorhynchus keta)胚胎(王臣, 2015; 王臣等, 2015)、大黄鱼(Larimichthys crocea)幼鱼(张辉等, 2015)、鳙(Aristichthys nobilis)1龄鱼(李秀启等, 2017)、黑鲷(Spuars macrocephalus)幼鱼(张翼等, 2018)、褐牙鲆(Paralichthys olivaceus)幼鱼(李爽等, 2018)等鱼类上均有报道。
鲤(Cyprinus carpio)是我国代表性的淡水经济鱼类(封功能等, 2011)。为初步探索早期个体大规模耳石Sr标记技术的可行性, 本研究拟尝试在养殖水环境中人工添加一定量的外源Sr对鲤仔鱼耳石进行浸泡标记, 以使其耳石上能产生相应的Sr标记区, 探索鲤仔鱼耳石Sr标记效果, 并经过长时间续养恢复验证Sr标记在耳石上存在的稳定性、可靠性、长久性, 以期初步归纳出适用于鱼类耳石微化学标记技术的实验条件, 为今后研究鱼类其他硬组织(鳍条、鳞片)标记及其他鱼类早期生活史个体的增殖放流中应用该技术提供理论和技术支撑。并首次对耳石微结构进行观察以期进一步了解Sr标记在耳石上沉积的时滞效应, 为准确预测鱼类环境特征提供相关的理论基础。
1 材料与方法 1.1 试验材料本研究在江苏省无锡市中国水产科学研究院淡水渔业研究中心南区实验基地开展。实验用鱼为上述基地人工繁育的健康福瑞鲤(FFRC strain common carp, Cyprinus carpio)个体, 采于2017年4月26日, 尚属仔鱼(14日龄)阶段(曹文宣等, 2007)。本研究用的六水氯化锶(SrCl2·6H2O)化合物(分析纯)购自上海抚生实业有限公司。
1.2 锶化合物浸泡标记方法随机挑选300尾鱼作为标记组, 500尾实验鱼作为对照组, 初始全长为8—10mm。实验前, 鱼在装有曝气水的100cm×45cm×50cm(长×宽×高)玻璃缸中暂养1d, 不喂食。
配置10mg/L SrCl2·6H2O (Sr2+理论浓度3.3mg/L)水溶液进行2d的鱼浸泡标记实验, 标记组的溶液浓度经电感耦合等离子质谱仪(ICP MS)测定Sr2+浓度为3.6mg/L(与预期Sr2+的理论浓度相似), 而对照组的养殖用水中的Sr2+背景含量很低, 为0.24mg/L(表 1)。浸泡标记期间, 分别统计对照组和标记组的个体急性死亡情况, 并及时清除死鱼, 不断向实验水体充氧, 不喂食。
| 组别 | SrCl2·6H2O浓度(mg/L) | Sr2+实际浓度(mg/L) | 总样本数(n) | 死亡数(n) | |
| 浸泡标记期间 | 续养恢复期间 | ||||
| 对照组 | 0 | 0.24 | 500 | 2 | 245 |
| 标记组 | 10 | 3.61 | 300 | 1 | 158 |
浸泡标记2d后, 将对照组和标记组鱼分别置于一个同上规格、盛有100L曝气自来水的玻璃缸中续养恢复。期间投喂蛋黄水和碾磨成粉状的普通配合饲料, 每日清理鱼排泄物及换水1次, 换水量占养殖水体的25%。在此过程中进行取样, (1)了解不同续养恢复天数Sr标记效果定期取样:对照组和标记组每隔5d定期取样, 持续至30d, 每次随机选取5尾。续养恢复30d之后, 还分别进行了续养恢复第35、50、140天的5尾实验鱼的取样。(2)探索长时间续养恢复Sr标记效果:续养140d之后, 仅进行续养而停止取样, 待续养恢复250d时取样。测量鱼体重和全长(分别精确到0.01g和0.001mm), 保存于100%无水乙醇中。整个实验期间水温在18—24℃之间, 不控光周期。
1.3 耳石的摘取与检测方法硬骨鱼类有三类耳石, 即矢耳石、星耳石和微耳石(图 1)。从耳石样本的采取和加工及三对耳石的荧光标记效果(邱晨等, 2018)来看, 本研究以星耳石作为三对耳石的代表来进行相关分析。星耳石先用去离子水清除耳石表面的杂质, 脱水、干燥备用, 用环氧树脂(Epofix, 丹麦Struers公司)进行包埋, 再使用500目砂纸和1200目砂纸打磨至核心可见为止, 配合抛光液用磨抛机(LaboPol-35, 丹麦Struers公司)将其抛光至核心完全暴露在表面且耳石表面无明显划痕。样品放入去离子水中超声清洗5min后, 再用Millo-Q水冲洗12遍, 完全干燥后, 用真空镀膜机(JEE-420, 日本电子株式会社)镀膜(36A, 25s)。参考Yang等(2006)、杨健等(2010)的分析方法, 利用X射线电子探针微区分析仪(EPMA, 简称电子探针, JXA-8100型, 日本电子株式会社, 下同)对耳石进行定量线和面分布(含量用16色棒图谱表示)分析。
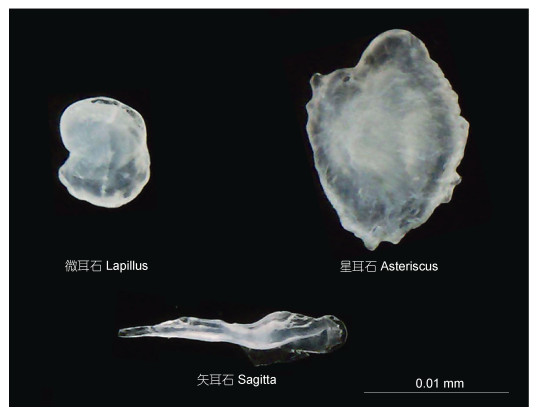 |
| 图 1 鲤鱼三类耳石(微耳石, 星耳石, 矢耳石) Fig. 1 Three types of otoliths in larvae C. carpio (Lapillus, Asteriscus, Sagitta) |
本研究中数据采用Excel 2007进行汇总及作图。耳石上不同区域Sr/Ca比值用平均值±标准差表示, 采用SPSS 19.0的单因素方差分析进行不同续养恢复时间下实验组与对照组的Sr/Ca比差异显著性分析, 设定差异显著性水平P为0.05, 当P < 0.05时为差异显著。由于耳石中Sr含量远小于Ca含量, 按惯例Sr/Ca指经过标准化的比值, 即(Sr/Ca)×103。
2 结果 2.1 锶浸泡处理对鲤仔鱼生存及生长的影响 2.1.1 锶浸泡处理对鲤仔鱼生存的影响在2d的浸泡标记期间, 对照组(N=500)和标记组(N=300)死亡数分别为2尾和1尾(表 1), 两组死亡情况相差不大且死亡率很小, 标记组中鲤活动行为与对照组无明显区别, 游动和摄食正常, 说明在高Sr溶液的水环境中鲤仔鱼的应激性死亡无影响。长达250d的续养恢复期间, 对照组死亡数为245尾, 标记组为158尾(表 1), 两组死亡率相近, 活动行为及摄食等与对照组也无明显区别, 说明Sr标记处理并不会对本实验中鲤仔鱼养殖造成额外的影响。
2.1.2 锶浸泡处理对鲤仔鱼生长的影响经过一段时间的恢复续养, 鲤仔鱼对照组和标记组的全长和体重均增加(表 2), 经差异性检验, 对照组与标记组在续养恢复0—30d的养殖过程中平均全长及平均体重及相互之间的关系均无显著差异(P > 0.05), 可见Sr标记处理后对鲤仔鱼的生长也不会带来额外的影响。
| 续养恢复天数(d) | 取样数(n) | 平均全长(mm) | 平均体重(g) | ||
| 对照组 | 标记组 | 对照组 | 标记组 | ||
| 5 | 5 | 9.90±0.81 | 10.90±0.86 | 0.008±0.001 | 0.012±0.004 |
| 10 | 5 | 10.65±0.64 | 10.55±0.70 | 0.010±0.001 | 0.010±0.003 |
| 15 | 5 | 11.56±1.00 | 11.40±1.32 | 0.012±0.003 | 0.014±0.007 |
| 20 | 5 | 11.46±0.55 | 11.38±0.94 | 0.010±0.002 | 0.014±0.004 |
| 25 | 5 | 12.47±1.08 | 11.96±0.57 | 0.010±0.006 | 0.018±0.014 |
| 30 | 5 | 13.40±0.77 | 13.64±2.64 | 0.034±0.005 | 0.016±0.040 |
从本研究的面分布结果可以看出: (1)标记效果好, 标记率高:鲤仔鱼在添加外源Sr水环境中标记浸泡2d后, 标记组所有个体星耳石核心区及其边缘均为Sr含量较低的蓝色区, 但在耳石边缘可见极为明显的高Sr含量的红色区, 表现为“高Sr标记环”, 标记率为100%, 而对照组个体耳石边缘均无变化, 整个耳石表现为较为单一的低Sr含量的蓝色区(图 2)。(2) Sr标记存在时间长久:经2d浸泡标记处理后的标记组鲤仔鱼在自然养殖水环境中续养恢复5d直至250d的期间内, 耳石上“高Sr标记环”均极为明显(图 3), 未表现减退或消失的趋势, 说明Sr标记在鲤耳石上至少能存在250d, 甚至更久。
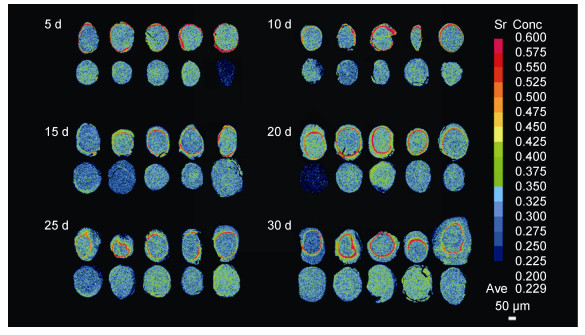 |
| 图 2 不同续养恢复时间的标记组(上)和对照组(下)鲤仔鱼耳石锶含量面分布图谱 Fig. 2 The Sr marking in otoliths of the marking group (upper) and control group (lower) of larval C. carpio under different days of recovery after being immersed in SrCl2·6H2O 注: 16色棒(从黑到红)表示Sr含量从低到高 |
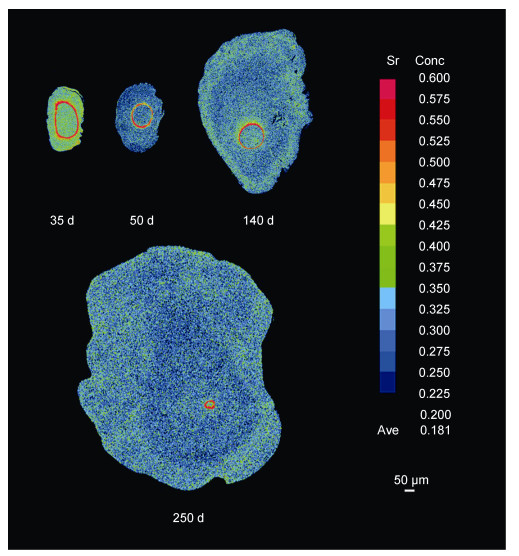 |
| 图 3 续养恢复35—250d鲤耳石上的锶标记图谱 Fig. 3 The Sr marking in otoliths of larval C. carpio recovered 35—250 days after being immersed in SrCl2·6H2O 注: 16色棒(从黑到红)表示Sr含量从低到高 |
对照组耳石从核心到边缘(最长轴半径, 下同)Sr/Ca比值(均在3.0左右)变化幅度小且稳定, Sr/Ca比值分别为3.06±0.29(图 4)。但各标记组在距核心66—131μm处, Sr/Ca比值变化都比较稳定(对应耳石核心中央蓝色同心圆区域), 3.26±0.06, 与对照组不存在显著差异(P > 0.05);距核心66—161μm处Sr/Ca比值开始明显升高, 均出现1个明显的相对平稳的峰(对应黄绿色和红色同心圆区域), Sr/Ca比值为15.46±1.96 (远 > 3.0), 是标记前的4.74倍, 与标记前相比, 差异显著(P < 0.05), 该高Sr区域即Sr标记区; 随后在距核心70—202μm处Sr/Ca比值逐渐下降, 恢复到和标记前及对照组类似的正常水平且趋于稳定(对应耳石边缘蓝色同心圆区域), Sr/Ca比值为3.15±0.10, 与对照组及标记前不存在显著差异(P > 0.05)(图 2, 图 4)。
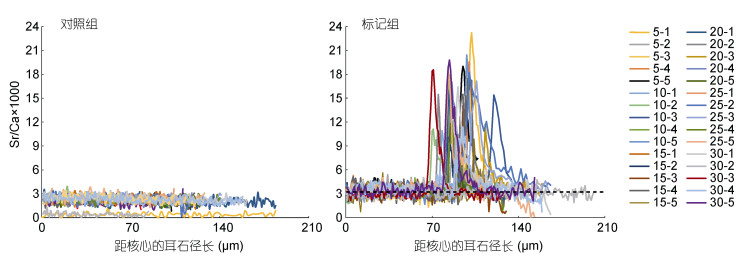 |
| 图 4 鲤仔鱼耳石从核心(0μm)到边缘定量线分析所获Sr/Ca比值图谱 Fig. 4 The Sr/Ca ratios along line transects from the core (0μm) to edge of otoliths of larval C. carpio 注:虚线表示成功标记基线, 数值是对照组Sr/Ca比值, 为3.06 |
外源Sr浸泡标记鲤仔鱼2d后, 在其耳石上出现了Sr沉积, 且可发现Sr的沉积过程与鱼体Sr溶液浸泡时间并不一致, 在浸泡结束后, Sr仍能持续向耳石上沉积一段时间, 耳石上Sr标记的形成和完成时间与鱼体Sr浸泡开始和结束的时间存在一定时间差(即时滞)(图 5)。
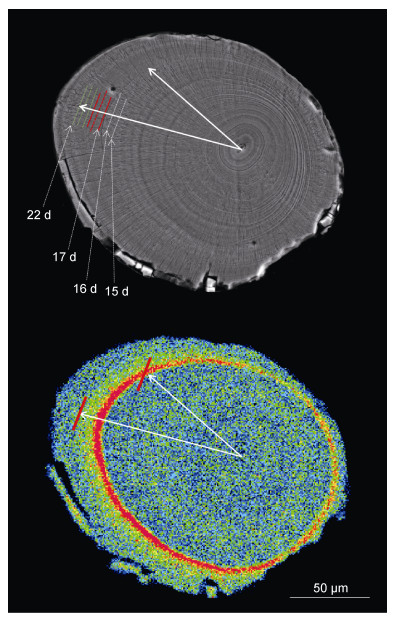 |
| 图 5 鲤仔鱼星耳石中锶标记形成和完成时滞的推算 Fig. 5 Retroactive calculation of possible time lag for the occurrence and disappearance of Sr marking in asteriscus of larval C. carpio 注:图中白色直线箭头表示由耳石核心指向荧光标记轮边缘, 15, 16, 17, 22d指示第15, 16, 17, 22日轮形成结束时; 上图图中白色线即15—16d表示浸泡标记时间, 红色和黄绿色线即17—22d表示“Sr标记区” |
由于鲤耳石上的生长轮具有日沉积规律, 可以准确定时, 且董双林等(1989)研究指出其第一个生长轮通常出现在孵化后的24h之内, 故耳石上读取的轮纹数应该与鱼的实际日龄相同。本研究是在添加外源Sr的水环境中对14日龄的鲤仔鱼进行2d(15—16日龄为浸泡时间)的浸泡处理, 通过鲤仔鱼耳石上微化学图谱可以发现, Sr在耳石上开始标记时间是在第18日龄(靠近核心的红色同心圆)(箭头显示Sr沉积时间为第17日轮形成结束时), 在第19日龄时标记结束(靠近耳石边缘的红色同心圆), 说明标记轮为2轮; 在第20、21、22日轮上存在高Sr拖尾现象(黄绿色同心圆区域), 第23日龄开始Sr/Ca比值才能恢复到与鱼体浸染标记前类似的正常值(耳石边缘的蓝色同心圆区域)(图 5), Sr标记持续了5d。这一现象说明Sr标记开始标记的时间与开始浸泡的时间存在3d的时滞, 而Sr标记完成的时间与浸泡结束的时间存在6d的时滞。
基于上述时滞结果, 笔者建议为获得有效、完整的鲤耳石“高Sr标记环”图谱, 至少应该在鱼体Sr浸泡结束并恢复续养后的第2天后才可采集耳石标本用于电子探针微化学分析。
3 讨论 3.1 耳石锶标记在鲤鱼放流标记上的安全性和可靠性Sr存在于自然水域中, 也是生物必需的微量元素之一, 急性毒性风险较小(陈德敏等, 2003; 李峰等, 2006; 蔺艳等, 2012, 2013a, b, c; 任艳丽等, 2018), 对生物的生长发育有着促进作用或者抑制作用(蔺艳等, 2012, 2013b, c; 宋洪建, 2013)。宋洪建(2013)研究表明当Sr浓度为10mg/L时, 大麻哈鱼(Oncorhynchus keta)稚鱼的各项生长指标均最高, 但随着Sr浓度的增加, 各项生长指标均逐渐降低, 较高的Sr浓度还可能对其生长有抑制作用。可想而知, 每种生物对Sr浓度需求都有一个最适范围, 过高或过低都有可能不利于其生长。因此, 在实际运用“浸泡式”耳石Sr标记技术时, 首先应考虑其标记物及标记物浓度的安全性。迄今, 耳石Sr标记技术对鱼类的生长、发育和生理方面的影响尚不得而知, 值得探讨。本研究结果显示出, 在标记处理过程中标记鱼死亡率、全长和体重及游泳摄食等方面与对照组无显著差异, 反映了在10mg/L SrCl2.6H2O的高Sr养殖水环境中短期浸泡对鲤仔鱼的生存和生长状况无额外影响。Ophel等(1968)利用Sr标记金鱼及Yamada等(1979)用Sr标记鲑鱼的研究结果同样表明了, Sr并没有对鱼体产生有害的影响。另外, 本研究在养殖水中添加3.6mg/L的Sr2+不超过国家饮用水Sr浓度标准(Sr2+浓度大于0.2mg/L为Sr矿泉水, 其限量指标为小于5mg/L)。因此, 本研究选定的10mg/L Sr浸泡标记浓度对标记鱼及水环境应该具有安全性。而且本研究线分布结果显示出在自然水域中经过15d以上的续养恢复, 其耳石上的Sr/Ca比值已逐渐恢复到了标记前的正常水平, 说明在将经过15d或以上的恢复续养标记鱼放流到江河、湖泊等中, 可以排除经短时间高Sr浸泡过的标记鱼污染放流水域的可能性。而关于Sr在标记鱼体内的残留问题, 将在以后的研究内容中进一步探讨。
Kennedy等(2000)研究表明外源Sr是一种有效的标记途径, 本研究结果表明耳石Sr标记技术对于鱼类早期个规模化放流标记具有较强的可行性。鲤仔鱼浸泡于高Sr溶液中2d后, 可以在耳石上产生了极易识别的红色“高Sr标记环”, 参考前期同类研究(张辉等, 2015), 得到标记率为100%的结论。不仅如此, 在操作过程中简捷方便、劳动力小、成本低, 具有适于鲤大规模资源群体放流标记的潜力, 这与前人在其他鱼类上所得出的研究趋势相一致(Yamada et al, 1987; Schroder et al, 1995; 王臣, 2015; 王臣等, 2015; 张辉等, 2015; 李秀启等, 2017)。虽然很多研究已证实耳石Sr标记技术的可行性, 但在众多研究及实际运用中, 很多人都质疑耳石Sr标记存在时间的长短及标记是否会消失(退)的问题。Ophel等(1968)认为该途径可永久性地标记鱼, Schroder等(1995)利用Sr溶液标记鲑苗时, 也指出Sr标记能长期存在, Yamada等(1987)更发现外源Sr水体浸泡标记大麻哈鱼苗后, 续养169d后仍能检测到耳石上的Sr标记区。这是因为Sr通过结晶作用从水体中进入鱼内耳淋巴液, 沉积在耳石中(罗军燕等, 2008), 由于耳石的非细胞性和代谢惰性, 随着鱼类及其耳石的同步生长, 其组成成分不会随时间推移而发生改变(Campana, 1999), 进而产生永久性可识别的“Sr标记环”。在目前为止, 国内已报道的鱼类耳石Sr标记最长的存在时间是120d(王臣等, 2015), 本研究结果显示甚至在经过长达250d的续养恢复后, 鱼耳石上的“高Sr标记环”依然清晰存在, 这说明Sr标记在鲤仔鱼耳石上可长久地存在, 具有稳定性、持久性及可靠性。
3.2 X射线电子探针微区分析技术检测锶标记的优势为客观有效地评价增殖放流效果, 规范、便捷和可行的大规模标记技术是必不可少的, 但客观而直观的标记检测方法也尤为重要。本研究利用X射线电子探针微区分析技术来检测Sr“浸泡式”鲤耳石Sr标记图谱的存在, 显示出了灵敏度高、快速且对样品无损坏的特点, 同时得到了准确度高的定量线分析和直观的面分析图像, 而两者的结合说明, 可更准确直观显示耳石锶标记的效果, 这些优势在前人大麻哈鱼、鳙的类似研究上同样得到了体现(王臣等, 2015; 李秀启, 2017; 李爽等, 2018)。
X射线电子探针微区分析技术作为一种有效测定固相微区元素成分的技术, 具有能提供高分辨率图谱及微米级精确、定量性的数据、分析过程快速且不损坏样品等一系列优势, 故广泛地应用于冶金、地质、电子材料、生物、医学、考古等领域, 是矿物等固相材料微化学分析的重要工具(内山郁等, 1982; 李斌之, 2011)。近年来, 随着鱼类耳石的生态学意义被不断发掘, 耳石微化学的潜在应用价值在国内外引起了广泛的兴趣极大关注, 电子探针技术也被引入了耳石微化学领域, 并解决了很多常规手段难以解决的鱼类生态学问题, 取得了众多研究成果: 李孟孟等(2017)确定了长江安庆江段所获刀鲚均为典型的溯河洄游个体; 卢明杰等(2015)发现了大辽河口红狼牙鰕虎鱼(Odontamblyopus rubicundus)孵化和早期生活史生境的多样化及对不同盐度水体环境的高度适应性; 熊瑛等(2015)掌握了黄海南部银鲳和鮸鱼生境利用的种间差异性; Khumbanyiwa等(2018)重建了钱塘江野生刀鲚的生活史及生境“履历”; 窦硕增等(2011)研究了长江口水域四种鱼类(刀鲚Coilia nasus、凤鲚C. mystus、带鱼Trichiurus haumela及长吻鮠Leiocassis iongirostris)的生活履历及生活史型。
3.3 鲤仔鱼耳石锶标记出现及完成的时滞性不同自然水体中Sr的含量与分布方式通常存在显著差异(淡水区含量低、河口半咸水区中、海水区高)(Zlokovitz et al, 2003), 在耳石上Sr的沉积含量可反映这种差异, 故耳石中不同Sr含量水平可作为反演鱼类生活史所经历的不同盐度水环境过程的有效指标。环境元素和生理条件对耳石中Sr摄取和沉积的影响机制尚未完全弄清。总体来看, 耳石上Sr的沉积是一个生理动态过程, 与水温或水体中的特定物质浓度密切相关(Radtke et al, 1992)。研究表明, 在元素沉积过程中, 由于同一族的Sr和Ca具有相似的化学性质, CaCO3在耳石上沉积的过程中, Sr可通过类质同象置换Ca离子或晶格间隙占位及蛋白质分子多肽链相结合等途径沉积在耳石上(Campana, 1999; Campana et al, 2001)。但Sr从水环境到耳石的元素通道是一个多阶段的过程, 涉及复杂的离子、蛋白之间的相互作用和多种生理屏障。元素需要经过一定的时间来通过这些屏障, 然后才能在耳石上沉积(Elsdon et al, 2003)。Yokouchi等(2011)的研究表明, 鳗幼鱼耳石中的耳石中的基本成分与水体环境完全平衡所需的时间可能达30—60d。王臣等(2015)发现, 大麻哈鱼发眼卵后期胚胎从Sr开始浸泡到Sr在耳石上沉积有延时现象, 浸泡时间仅为2d, 但Sr峰值却持续12d以上, 表明Sr在“养殖水-实验鱼-耳石”系统的迁移、沉积过程是渐进的。在鳙幼鱼(李秀启等, 2017)、布氏棘鲷(Acanthopagrus butcheri)幼鱼(Elsdon, 2005)等耳石上也存在一样的时滞效应。本研究结果显示, 水体环境中的外源Sr沉积鲤仔鱼耳石上并不会立即响应, 耳石Sr峰值的出现和消失均有明显滞后(即时滞)效应。本研究在前人对时滞的认识的基础上, 通过对14日龄的鲤耳石微结构的观察进一步直接确认了从鱼Sr溶液浸泡到耳石Sr标记开始形成存在3d的时滞, 而从Sr溶液浸泡结束到耳石Sr标记消失则存在6d的时滞。标记鱼在外源Sr溶液中浸泡标记了2d, Sr标记却在耳石上持续了5d。
结合前人及本研究可以发现, 不同生长阶段的不同鱼种在不同的水域环境种的时滞效应是不同的, 这种时滞特征机制可能需从不同鱼种的Sr的沉积机制和耳石结构等方面开展进一步研究(罗军燕等, 2008; Ren et al, 2013)。除了水环境的基本因素, 如盐度(Tzeng, 1996; Panfili et al, 2015)、温度(Tzeng, 1994)等, 鱼类遗传、发育阶段、生长速率、食物和生理条件等生物因素也可能影响Sr沉积在耳石的时滞时间(Sturrock et al, 2014, 2015)。因此, 更好地把握Sr在不同增殖放流鱼种间耳石上沉积时滞效应特征, 将会更有助于客观评价耳石锶标记的效果并制定相应的规范。
4 结论本研究以经济鱼类的代表性鱼类鲤为对象, 通过对其仔鱼的外源Sr浸泡, 检验了耳石Sr标记的效果。X射线电子探针微区分析技术确认了耳石上的Sr标记效果十分理想, 标记成功率为100%。Sr标记区甚至可在耳石上保留250d。这显示出了该标记方法在鲤仔鱼的大规模放流标记上具有稳定性、可靠性和可行性。本研究还通过耳石的微结构掌握了鲤仔鱼耳石Sr沉积的动态特征, 发现Sr浸泡鱼体与其沉积到耳石上存在时滞效应。鲤仔鱼Sr浸泡开始、结束时间与耳石Sr标记出现、消失时间上分别有3d和6d的时滞。下一步笔者将设置不同梯度的Sr浓度、浸泡标记时间对不同规格鲤及其他经济鱼类的硬组织(耳石、鳍条、鳞片等)来开展更系统的研究, 探寻最佳或最基本的标记条件及非致死的研究途径, 以便为其他名贵鱼类增殖放流效果评价及制定相关的微化学标记技术规范和标准提供更好的理论和技术支撑。
王臣, 2015.基于大麻哈鱼耳石的化学标记及其应用研究.上海: 上海海洋大学硕士学位论文
|
王臣, 刘伟, 战培荣, 等. 2015. 外源Sr2+在大麻哈鱼胚胎耳石上的沉积. 应用生态学报, 26(10): 3189-3194 |
卢明杰, 刘洪波, 姜涛, 等. 2015. 大辽河口红狼牙鰕虎鱼耳石微化学的初步研究. 海洋渔业, 37(4): 310-317 DOI:10.3969/j.issn.1004-2490.2015.04.003 |
任艳丽, 王建林. 2018. 锶的生物学效应研究进展. 北京联合大学学报, 32(1): 44-49 |
刘洪波, 姜涛, 邱晨, 等. 2018. 长江口水域四种鱼类的耳石微化学研究. 海洋与湖沼, 49(6): 1358-1364 |
李峰, 刘斌, 赵信义, 等. 2006. 含锶磷酸钙骨水泥的细胞毒性. 中国现代医学杂志, 16(20): 3080-3082 DOI:10.3969/j.issn.1005-8982.2006.20.012 |
李爽, 李耕, 潘玉洲, 等. 2018. 褐牙鲆幼鱼耳石上的外源Sr标记试验. 江苏农业科学, 46(12): 140-143 |
李秀启, 丛旭日, 师吉华, 等. 2017. 耳石锶标记在识别鳙(Aristichthys nobilis)放流个体的可行性. 湖泊科学, 29(4): 914-922 |
李孟孟, 姜涛, 陈婷婷, 等. 2017. 长江安庆江段刀鲚耳石微化学及洄游生态学意义. 生态学报, 37(8): 2788-2795 |
李斌之. 2011. 微区分析技术电子探针的原理应用与溯源. 计量与测试技术, 38(3): 26-28 DOI:10.3969/j.issn.1004-6941.2011.03.018 |
杨健, 刘洪波. 2010. 长江口崇明水域鲻鱼耳石元素微化学分析. 中国水产科学, 17(4): 853-858 |
杨君兴, 潘晓赋, 陈小勇, 等. 2013. 中国淡水鱼类人工增殖放流现状. 动物学研究, 34(4): 267-280 |
邱晨, 姜涛, 陈修报, 等. 2018. 茜素络合物对鲤仔鱼耳石标记特征研究. 水产学报, 42(11): 1754-1765 |
宋娜, 高天翔, 韩刚, 等. 2010. 分子标记在渔业资源增殖放流中的应用. 中国渔业经济, 3(28): 111-117 |
宋洪建, 2013.大麻哈鱼仔鱼异速生长和锶对其稚鱼生理指标的影响.哈尔滨: 东北农业大学硕士学位论文
|
张雪, 郭艳娜, 张虎成. 2013. 水电站鱼类人工增殖放流标记方法研究概述. 环境科学与管理, 38(12): 127-130 DOI:10.3969/j.issn.1673-1212.2013.12.030 |
张辉, 姜亚洲, 袁兴伟, 等. 2015. 大黄鱼耳石锶标志技术. 中国水产科学, 22(6): 1270-1277 |
张翼, 姜亚洲, 徐开达, 等. 2018. 锶元素对黑鲷幼鱼耳石的标记效果分析. 海洋渔业, 40(2): 171-178 DOI:10.3969/j.issn.1004-2490.2018.02.006 |
张堂林, 李钟杰, 舒少武. 2003. 鱼类标志技术的研究进展. 中国水产科学, 10(3): 246-253 DOI:10.3321/j.issn:1005-8737.2003.03.013 |
陈敏德, 傅远飞. 2003. 不同含锶量的掺锶羟磷灰石陶瓷细胞毒性评价. 现代口腔医学杂志, 17(6): 501-503 DOI:10.3969/j.issn.1003-7632.2003.06.007 |
罗军燕, 李胜荣, 申俊峰. 2008. 鱼耳石中锶和钡富集的影响因素及其环境响应. 地学前缘, 15(6): 18-24 DOI:10.3321/j.issn:1005-2321.2008.06.003 |
周辉霞, 甘维熊. 2017. 鱼类标记技术研究进展及在人工增殖放流中的应用. 湖北农业科学, 56(7): 1206-1210 |
封功能, 杨文平, 王爱民, 等. 2011. 饥饿胁迫对鲤形体、体成分及血液生理指标的影响. 上海海洋大学学报, 20(6): 814-819 |
耿倩, 张淑荣, 段妍, 等. 2016. 荧光标记技术在增殖放流中的应用现状. 水产科学, 35(3): 308-312 |
曹文宣, 常剑波, 乔晔, 等. 2007. 长江鱼类早期资源. 北京: 中国水利水电出版社, 169-170
|
董双林, 王志余, 于信勇, 等. 1989. 鲤鱼仔、稚和幼鱼早期耳石上日轮的初步观察. 大连水产学院学报, 4(1): 58-62 |
窦硕增, 横内一树, 于鑫, 等. 2011. 基于EPMA的耳石Sr:Ca比分析及其在鱼类生活履历反演中的应用实例研究. 海洋与湖沼, 42(4): 512-520 |
蔺艳, 张莹茜, 盘强文, 等. 2013a. 高锶矿泉水的细胞毒性研究. 广东医学, 34(14): 2125-2128 |
蔺艳, 张莹茜, 盘强文, 等. 2013b. 锶矿泉水对人血管内皮细胞的增殖和功能的影响. 中国食品卫生杂志, 25(2): 136-139 |
蔺艳, 盘强文, 冯志强, 等. 2012. 锶矿泉水对人肾小管上皮细胞增殖及ATP酶活性的影响. 中国组织工程研究, 16(15): 2801-2804 DOI:10.3969/j.issn.1673-8225.2012.15.031 |
蔺艳, 盘强文, 冯志强, 等. 2013c. 不同浓度的高锶矿泉水对人肝细胞增殖及功能的影响. 泸州医学院学报, 36(1): 23-26 |
熊瑛, 刘洪波, 姜涛, 等. 2015. 黄海南部野生银鲳和  的耳石元素微化学研究. 海洋学报, 37(2): 36-43 DOI:10.3969/j.issn.0253-4193.2015.02.004 的耳石元素微化学研究. 海洋学报, 37(2): 36-43 DOI:10.3969/j.issn.0253-4193.2015.02.004 |
内山郁, 渡辺融, 纪本静雄编著, 刘济民译.. 1982. 电子探针X射线显微分析仪. 北京: 国防工业出版社
|
Campana S E, 1999. Chemistry and composition of fish otoliths:pathways, mechanisms and applications. Marine Ecology Progress Series, 188: 263-297 DOI:10.3354/meps188263 |
Campana S E, Thorrold S R, 2001. Otoliths, increments, and elements:keys to a comprehensive understanding of fish populations?. Canadian Journal of Fisheries and Aquatic Sciences, 58(1): 30-38 DOI:10.1139/f00-177 |
Collingsworth P D, van Tassell J J, Olesik J W et al, 2010. Effects of temperature and elemental concentration on the chemical composition of juvenile yellow perch (Perca flavescens) otoliths. Canadian Journal of Fisheries and Aquatic Sciences, 67(7): 1187-1196 DOI:10.1139/F10-050 |
Elsdon T S, 2005. Strontium incorporation into calcified structures:separating the effects of ambient water concentration and exposure time. Marine Ecology Progress Series, 285: 233-243 DOI:10.3354/meps285233 |
Elsdon T S, Gillanders B M, 2003. Reconstructing migratory patterns of fish based on environmental influences on otolith chemistry. Reviews in Fish Biology and Fisheries, 13(3): 217-235 DOI:10.1023/B:RFBF.0000033071.73952.40 |
Kennedy B P, Blum J D, Folt C L et al, 2000. Using natural strontium isotopic signatures as fish markers:methodology and application. Canadian Journal of Fisheries and Aquatic Sciences, 57(11): 2280-2292 DOI:10.1139/f00-206 |
Khumbanyiwa D D, Li M M, Jiang T et al, 2018. Unraveling habitat use of Coilia nasus from Qiantang River of China by otolith microchemistry. Regional Studies in Marine Science, 18: 122-128 DOI:10.1016/j.rsma.2018.02.001 |
Limburg K E, 1995. Otolith strontium traces environmental history of subyearling American shad Alosa sapidissima. Marine Ecology Progress Series, 119: 25-35 DOI:10.3354/meps119025 |
Melancon S, Fryer B J, Markham J L, 2009. Chemical analysis of endolymph and the growing otolith:fractionation of metals in freshwater fish species. Environmental Toxicology and Chemistry, 28(6): 1279-1287 DOI:10.1897/08-358.1 |
Ophel I L, Judd J M, 1968. Marking fish with stable strontium. Journal of the Fisheries Research Board of Canada, 25(7): 1333-1337 DOI:10.1139/f68-119 |
Panfili J, Darnaude A M, Vigliola L et al, 2015. Experimental evidence of complex relationships between the ambient salinity and the strontium signature of fish otoliths. Journal of Experimental Marine Biology and Ecology, 467: 65-70 DOI:10.1016/j.jembe.2015.03.007 |
Radtke R L, Shafer D J, 1992. Environmental sensitivity of fish otolith microchemistry. Australian Journal of Marine and Freshwater Research, 43(5): 935-951 DOI:10.1071/MF9920935 |
Ren D N, Meyers M A, Zhou B et al, 2013. Comparative study of carp otolith hardness:lapillus and asteriscus. Materials Science and Engineering:C, 33(4): 1876-1881 DOI:10.1016/j.msec.2012.10.015 |
Schroder S L, Knudsen C M, Volk E C, 1995. Marking salmon fry with strontium chloride solutions. Canadian Journal of Fisheries and Aquatic Sciences, 52(6): 1141-1149 DOI:10.1139/f95-111 |
Sturrock A M, Hunter E, Milton J A et al, 2015. Quantifying physiological influences on otolith microchemistry. Methods in Ecology and Evolution, 6(7): 806-816 DOI:10.1111/mee3.2015.6.issue-7 |
Sturrock A M, Trueman C N, Milton J A et al, 2014. Physiological influences can outweigh environmental signals in otolith microchemistry research. Marine Ecology Progress Series, 500: 245-264 DOI:10.3354/meps10699 |
Tzeng W N, 1994. Temperature effects on the incorporation of strontium in otolith of Japanese eel Anguilla japonica. Journal of Fish Biology, 45(6): 1055-1066 DOI:10.1111/jfb.1994.45.issue-6 |
Tzeng W N, 1996. Effects of salinity and ontogenetic movements on strontium:calcium ratios in the otoliths of the Japanese eel, Anguilla japonica Temminck and Schlegel. Journal of Experimental Marine Biology & Ecology, 199(1): 111-122 |
Warren-Myers F, Dempster T, Swearer S E, 2018. Otolith mass marking techniques for aquaculture and restocking:benefits and limitations. Reviews in Fish Biology and Fisheries, 28(3): 485-501 DOI:10.1007/s11160-018-9515-4 |
Wickström H, Sjberg N B, 2014. Traceability of stocked eels-the Swedish approach. Ecology of Freshwater Fish, 23(1): 33-39 DOI:10.1111/eff.12053 |
Yamada S B, Mulligan T J, 1987. Marking nonfeeding salmonid fry with dissolved strontium. Canadian Journal of Fisheries and Aquatic Sciences, 44(8): 1502-1506 DOI:10.1139/f87-180 |
Yamada S B, Mulligan T J, Fairchild S J, 1979. Strontium marking of hatchery-reared coho salmon (Oncorhynchm kisutch, Walbaum). Journal of Fish Biology, 14(3): 267-275 DOI:10.1111/jfb.1979.14.issue-3 |
Yang J, Arai T, Liu H et al, 2006. Reconstructing habitat use of Coilia mystus and Coilia ectenes of the Yangtze River estuary, and of Coilia ectenes of Taihu Lake, based on otolith strontium and calcium. Journal of Fish Biology, 69(4): 1120-1135 DOI:10.1111/jfb.2006.69.issue-4 |
Yokouchi K, Fukuda N, Shirai K et al, 2011. Time lag of the response on the otolith strontium/calcium ratios of the Japanese eel, Anguilla japonica to changes in strontium/calcium ratios of ambient water. Environmental Biology of Fishes, 92(4): 469-478 DOI:10.1007/s10641-011-9864-5 |
Zlokovitz E R, Secor D H, Piccoli P M, 2003. Patterns of migration in Hudson River striped bass as determined by otolith microchemistry. Fisheries Research, 63(2): 245-259 DOI:10.1016/S0165-7836(03)00069-9 |
 2019, Vol. 50
2019, Vol. 50


