中国海洋湖沼学会主办。
文章信息
- 胡章喜, 邓蕴彦, 唐赢中. 2019.
- HU Zhang-Xi, DENG Yun-Yan, TANG Ying-Zhong. 2019.
- 我国北部湾球形棕囊藻(Phaeocystis globosa)的表面形态和细胞超微结构的电镜观察
- SCANNING AND TRANSMISSION ELECTRON MICROSCOPY OBSERVATION ON MORPHOLOGY AND ULTRASTRUCTURE OF PHAEOCYSTIS GLOBOSA FROM BEIBU GULF, CHINA
- 海洋与湖沼, 50(3): 621-629
- Oceanologia et Limnologia Sinica, 50(3): 621-629.
- http://dx.doi.org/10.11693/hyhz20180700180
文章历史
-
收稿日期:2018-07-24
收修改稿日期:2018-09-17
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
球形棕囊藻(Phaeocystis globosa Scherffel)隶属定鞭藻纲(Haptophyceae或Prymnesiophyceae)、定鞭藻目(Prymnesiales), 是一种广温广盐性的浮游植物, 在全世界范围内的近海和开阔海洋中有着广泛的分布, 在中国、越南、泰国、巴基斯坦、缅甸、荷兰、阿拉伯海、北海等国家和地区都曾报道形成有害赤潮且导致养殖区大量鱼类的死亡, 赤潮暴发时形成的大量囊体还可堵塞核电站冷源取水系统, 给海洋环境、水产养殖业和核电安全等造成极大危害(Cadée, 1996; Qi et al, 2004; Schoemann et al, 2005; Rousseau et al, 2013; Smith et al, 2014;覃仙玲等, 2016;曹西华等, 2017; Xu et al, 2017)。球形棕囊藻能产生粘多糖、二甲基丙磺酸(DMSP)和二甲基硫醚(DMS)等, 因此被认为可能在碳和硫的生物地球化学循环过程中具有重要的调控作用(杨和福, 2004)。
生活史(life history, life cycle), 是指藻类细胞或个体在不同形态、生理、遗传状态, 以及时空位置上转换的全过程, 如从浮游到底栖、运动到静止、光合自养到异养、自由生活到寄生、高代谢到低代谢、无性有丝分裂及伴随的种群增加、有性融合和与此伴随的细胞从单倍体到二倍体甚至多倍体等(唐赢中等, 2016)。球形棕囊藻最主要的特征是具有复杂的异型生活史, 具有两种迥异的生活形态:含有众多细胞的囊体和具鞭毛的游离单细胞。单细胞大小为3—10μm, 而囊体一般在几百μm以上, 我国沿海发现的囊体直径甚至高达3cm, 是目前全球发现的最大囊体(Parke et al, 1971;陈菊芳等, 1999;齐雨藻等, 2001; Rousseau et al, 2007, 2013)。球形棕囊藻特殊异型生活史的不同阶段, 具有不同的生态学意义, 如囊体的细胞具有较快的生长速度、抵御小型捕食者的捕食及病毒的侵袭等(Hamm, 2000; Brussaard et al, 2005; Veldhuis et al, 2005; Rousseau et al, 2013), 游离单细胞具有能快速进行无性繁殖、较快地适应营养盐限制条件和具有快速的运动能力等(Riegman et al, 1992; Rousseau et al, 1994)。国外学者研究认为球形棕囊藻具有四种不同的细胞类型, 包括二倍体的群体(囊体)细胞(Diploid colonial cells)、二倍体的具鞭毛细胞(Diploid flagellates)及两种不同类型的单倍体具鞭毛细胞(Haploid flagellates), 这些不同类型的细胞均参与到了球形棕囊藻“单倍体-二倍体”异型生活史(Parke et al, 1971; Rousseau et al, 1994, 2007, 2013; Vaulot et al, 1994)。然而, 有关球形棕囊藻具鞭毛细胞的类型、倍性(单倍体或二倍体)等的认识仍然不是很清楚。在过去的研究中, 这些细胞被称为棕囊藻鞭毛游动细胞(phaeocystis flagellates, swarmer)、自由生活细胞(free-living cells)、大、小动孢子(macrozoospore, microzoospore)等(Rousseau et al, 1994;沈萍萍等, 2000), 主要原因是对于球形棕囊藻生活史中不同类型细胞的形态特征缺乏清晰和全面的认识(Rousseau et al, 2013), 仅有部分研究通过光镜或扫描电镜观察到了其中的一种具鞭毛细胞(Parke et al, 1971; Rousseau et al, 1994, 2007; Vaulot et al, 1994; Antajan et al, 2004; Medlin et al, 2007)。Guiselin等(2009)通过电镜观察具鞭毛细胞和囊体细胞, 并且观察到了具鞭毛细胞表面的鳞片, 但是鳞片的形态不是很清楚, 很难辨别鳞片是否有大小之分; Rousseau等(2013)通过扫描电镜以及流式细胞仪, 观察到了二倍体囊体细胞、二倍体具鞭毛细胞和单倍体具鞭毛细胞, 并且也观察到了圆形和椭圆形两种类型的鳞片, 但是从文中的图片很难看出差别。综上, 球形棕囊藻不同类型的细胞在染色体倍性、鞭毛、鳞片等方面存在着比较大的差别, 在其异型生活史中可能有着不同的生态学意义(Rousseau et al, 1994, 2007, 2013), 因此, 弄清球形棕囊藻生活史中不同细胞的类型对于认识由该藻引发的赤潮暴发机理具有重要的意义。
最近二十多年来, 我国近海球形棕囊藻赤潮发生的范围、频次、规模呈现出增加的趋势, 如1997年, 在我国东南沿海包括福建省厦门以南至广东省东部海域首次报道球形棕囊藻赤潮, 这也是该藻在我国沿海的首次赤潮记录(陈菊芳等, 1999), 2000年以后, 在广东的珠江口、湛江等地沿海均有不同规模的球形棕囊藻赤潮发生(江涛等, 2006;王超等, 2010); 2004年, 在我国渤海首次暴发了球形棕囊藻赤潮(曲凌云等, 2008); 2011年, 在我国广西北部湾海域首次暴发了球形棕囊藻赤潮(覃仙玲等, 2016), 随后几年又有不同规模的赤潮发生(曹西华等, 2017)。这些不同规模的球形棕囊藻赤潮对我国沿海海洋环境、水产养殖业、核电安全造成了不同程度的影响, 引起了科学家和地方政府的高度重视。国内关于球形棕囊藻已经开展了大量研究, 包括较早的分子鉴定及最近通过分子手段来确定种源(陈月琴等, 2002;陈丽芬等, 2003;曲凌云等, 2008;覃仙玲等, 2016)、生活史(沈萍萍等, 2000)、赤潮形成与环境因子的关系(陈菊芳等, 1999)、影响DMSP产生的因素(王艳等, 2003; Shen et al, 2011)、影响囊体形成的因素(王艳等, 2007, 2010;王小冬等, 2012; Wang et al, 2015;丁立等, 2018)、赤潮防控(晏荣军等, 2006;刘玉芳等, 2011;曹西华等, 2017)等方面, 这些研究为认识球形棕囊藻生物学特性、赤潮的形成机理及防控等方面提供了重要基础和科学依据。然而, 到目前为止, 除通过光镜对单细胞进行形态学观察外(陈菊芳等, 1999;沈萍萍等, 2000;覃仙玲等, 2016), 尚未见到对球形棕囊藻细胞形态的详细特征(鳞片、鞭毛和分泌物等)和胞内超微结构的研究。早前的分子系统进化分析认为球形棕囊藻可能是一个包括暖温带亚种和寒温带亚种的复合种(Lange et al, 2002; Verity et al, 2007), 但它们在细胞形态上是否有差别目前还不清楚。因此, 详细研究我国球形棕囊藻不同类型细胞的形态、超微结构等, 并与欧洲等地的株系进行比较, 可以为深入认识其生物学特征及其成囊机理提供基础。我们2015年从广西防城港近海海域分离到一株棕囊藻纯培养, 通过分子鉴定及基于电镜的形态学观察确证其为球形棕囊藻, 本文报道了其分子系统学地位、表面形态和超微结构。
1 材料与方法 1.1 藻种及培养条件2015年12月自广西防城港近海海域采集棕囊藻赤潮衰亡期水样, 带回实验室后通过毛细管分离单个棕囊藻囊体, 经灭菌海水反复清洗后置于24孔板中培养。培养基中添加1%—2%青-链霉素混合液(北京索莱宝科技有限公司), 建立棕囊藻纯培养系。藻种置于光照培养箱培养:温度为(21±1)℃, 光照强度约为100μmol/ (m2·s), 光暗比为12L︰12D。选用不添加Si的f/2培养基(Guillard, 1975), 基础介质为天然海水(盐度为32)。
1.2 分子测序与系统进化分析 1.2.1 分子测序取10mL处于对数生长期的藻液, 离心收集藻细胞, 根据植物DNA提取试剂盒(DP305, 天根生化科技(北京)有限公司)说明书推荐的方法提取总DNA。提取的DNA序列作为PCR的模板来扩增大约1400bp的核糖体大亚基序列(LSU rDNA), 扩增引物为D1R (Scholin et al, 1994)和28-1483R (Daugbjerg et al, 2000)。PCR反应体系为25μL, 包括9.5μL ddH2O, 12.5μL 2×Taq PCR MasterMix, 1μL正向引物D1R (10mmol/L), 1μL反向引物28-1483R (10mmol/L)和1μL DNA模板。PCR反应程序为: 94℃预变性5min, 94℃ 20s, 55℃ 30s, 72℃ 2min, 35个循环, 72℃延伸10min。PCR产物在溴化乙锭染色的1.0%琼脂糖平板进行电泳, 最后在凝胶成像分析仪下进行凝胶成像与图谱分析。将目的DNA条带从琼脂糖凝胶中切下, 并使用DNA回收试剂盒(GK2043-50, 上海捷瑞生物工程有限公司)回收纯化PCR产物, DNA与载体连接, 连接产物的转化后, 挑取阳性克隆菌液送至生物公司测序。序列结果上传到GenBank中, 登录号为MH657229。
1.2.2 序列比对和系统分析将我们获得的序列在NCBI中进行检索, 选取与之亲缘关系较近的其它30个分类群进行序列分析(序列号见进化树上物种名后), 甲藻Crypthecodinium sp. (序列号AB871543)作为外类群。首先, 使用MAFFTv.7 (http://mafft.cbrc.jp/alignment/server/; Katoh et al, 2002)对所有序列进行比对, 并使用BioEdit(v7.2.5) (Hall, 1999)对序列进行修剪至1573个碱基(包括缺失(gap))。使用jModelTest 2.1.14 (Darriba et al, 2012)程序中的AIC功能选择最适合的分子进化模型, 分析结果选择GTR+I+G模型。使用PhyML (Guindon et al, 2003; Guindon et al, 2010)构建最大似然树(Maximum likelihood, ML), 选择的最适合替换模型为GTR+I+G, bootstrap值设置为1000。使用MrBayes3.2.6 (Ronquist et al, 2003)构建贝叶斯树(Bayesian tree), 选择的最适合替换模型为GTR+I+G, 四条MCMC链运行20000000代, 每1000代进行一次取样。使用FigTree (v1.4.3)对进化树进行分析和编辑。
1.3 光镜观察将培养在培养板中处于对数生长期的棕囊藻置于倒置显微镜(IX73, 奥林巴斯, 日本)下观察, 使用CCD制冷显微数码相机(DP80, 奥林巴斯, 日本)分别对不同大小的囊体进行拍照。
1.4 扫描电镜样品的制备游离单细胞样品制备:取一定体积处于对数生长期的棕囊藻藻液, 先经尼龙膜(Millipore, 孔径为11μm)过滤, 滤出液中绝大部分只有游离单细胞, 取2mL滤出液加入到等体积4%的锇酸中固定, 固定时间为40—50min, 然后收集藻细胞, 在不同浓度丙酮溶液(10%, 30%, 50%, 70%, 90%, 100%, 100%, 100%, 每个浓度处理15min)中脱水, 经CO2临界点干燥仪(EM CPD 300, 莱卡, 奥地利)干燥, 镀膜仪(Sputter/Carbon Thread, EM ACE200, 莱卡, 奥地利)喷金, 使用扫描电子显微镜(S-3400N, 日立, 日本)观察藻细胞形态, 细胞大小、鳞片和鞭毛等通过电镜软件进行测量。
囊体样品制备:用毛细管挑取多个囊体, 加入到锇酸(终浓度为2%)中固定, 其他处理方法同“游离单细胞样品制备”。
1.5 透射电镜样品的制备取一定体积处于对数生长期的棕囊藻藻液, 其中包括游离单细胞和囊体细胞, 加入到25%戊二醛中, 终浓度为2.5%, 固定3h, 5000r/min离心, 去掉上清, 加入新鲜培养基清洗3遍, 收集藻细胞加入到4%的锇酸中固定, 终浓度为1%, 4℃过夜后, 5000r/min离心, 去掉上清, 加入新鲜培养基清洗3遍, 在不同浓度丙酮溶液(10%, 30%, 50%, 70%, 90%, 每个浓度处理10min)中脱水, 然后经100%丙酮脱水3次, 每次处理时间为15min。树脂包埋(Spurr, 1969), 切片(EM UC7, 莱卡, 奥地利), 染色(3%醋酸铀和2%柠檬酸铅), 使用透射电子显微镜(HT7700, 日立, 日本)观察藻细胞超微结构。
2 结果与分析 2.1 系统进化分析通过正向引物D1R和反向引物28-1483R获得棕囊藻北部湾株的核糖体大亚基(LSU rDNA) D1—D6区, 长度为1412bp, NCBI登录号为MH657229。将所获得棕囊藻序列与GenBank中已报道的其它棕囊藻进行比较, 发现其与P. globosa (NCBI登录号JX660933和JX660937)、Phaeocystis sp. (NCBI登录号JX660805和EU502882)以及环境样品中的定鞭金藻(NCBI登录号EU616448)的相似性分别为99.5% (815bp/819bp)、98.8% (802bp/812bp)、99.6% (933bp/ 937bp)、99.5% (830bp/834bp)和98.8% (823bp/833bp), 与同属中鉴定为P. antarctica (NCBI登录号为AF289040和KP144256)的相似性分别为98.7% (1393bp/1412bp)和98.8% (711bp/720bp), P. rex (NCBI登录号KP144259)为97.6% (727bp/745bp), P. cordata (NCBI登录号EU729459和JX660941)为94.6% (789bp/834bp)和95.5% (784bp/821bp), 以及P. jahnii (NCBI登录号KP144257)为86.9% (628bp/723bp)。
以甲藻Crypthecodinium sp. (NCBI登录号为AB871543)为外类群, 用最大似然法和贝叶斯法构建进化树(图 1)。从系统发育树上看, 棕囊藻北部湾株与GenBank中的太平洋株(NCBI登录号JX660937)、北大西洋株(NCBI登录号JX660933)及其它几种棕囊藻(Phaeocystis sp.; NCBI登录号EU502882, JX660805和JX660939)聚在一起, 表明我们从北部湾分离到的棕囊藻是球形棕囊藻(图 1)。与球形棕囊藻亲缘关系最近的是P. antarctica (NCBI登录号AF289040和KP144256), 棕囊藻属的P. rex (NCBI登录号KP144259)、P. cordata (NCBI登录号EU729459和JX660941)和P. jahnii (NCBI登录号KP144257)则在与球形棕囊藻独立的分支上(图 1)。
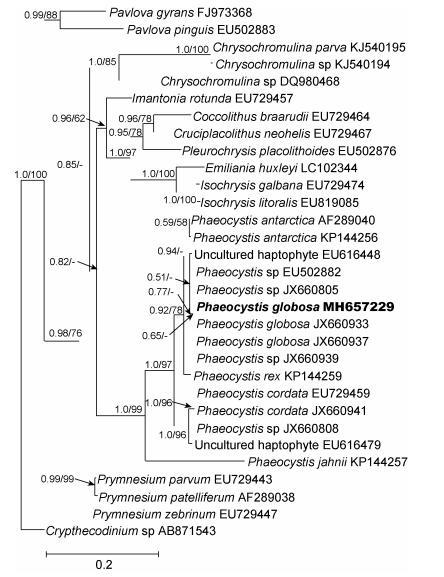 |
| 图 1 基于核糖体大亚基D1—D6区所构建的球形棕囊藻的分子系统发育树 Fig. 1 Phylogenetic analysis for P. globosa based on the D1—D6 rDNA sequences |
通过光镜和电镜观察到了球形棕囊藻(北部湾株)两种类型的细胞以及星形分泌物, 这两种细胞包括具鞭毛游动细胞和囊体细胞。
(1) 具鞭毛游动细胞(small flagellates)
细胞呈椭圆形至球形, 大小为2.30—3.98μm (平均值(2.96±0.43)μm; n=20), 具两根等生鞭毛, 长4.6—6.4μm (n=10), 一根定鞭毛位于两根等生鞭毛中间, 是等生鞭毛长度的1/5—1/4 (图 2a, c, e和f), 鞭毛直径约0.4μm。细胞表面分布有椭圆形至圆形鳞片(scale), 大小为0.15—0.23μm (平均值(0.18±0.02)μm; n=50, 随机挑选了10个细胞, 每个细胞随机挑选5个鳞片), 每个鳞片边缘有凸起的脊(图 2a和b)。每个细胞上有1—2个圆盘状凸起结构, 在细胞上的位置不固定, 大小为1.37—1.80μm (平均值(1.58±0.16)μm; n=10) (图 2a, c, d, e和f), 凸起结构上也有鳞片分布, 鳞片数量不等, 形状和大小与细胞表面其它部位分布的鳞片无异, 大小为0.16—0.23μm (平均值0.18±0.02μm; n=25, 随机挑选了5个细胞, 每个细胞中的“凸起”结构随机挑选5个鳞片)。
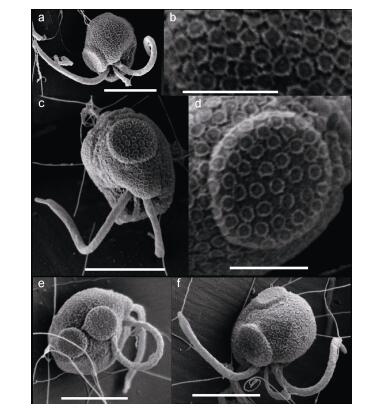 |
| 图 2 球形棕囊藻具鞭毛游动细胞的形态 Fig. 2 SEM micrographs of small flagellate 注: a, b:具鞭毛游动细胞及细胞表面鳞片的详细形态; c, d:具“凸起”结构细胞及“凸起”形态; e, f:具两个“凸起”的细胞(比例尺: a, c, e, f=3μm; b, d=1μm) |
(2) 囊体及无鞭毛的囊体细胞(colonial cells)
实验室培养的球形棕囊藻囊体大小为几十到几千微米(图 3), 囊体细胞不规则的分布在囊体表面, 细胞呈圆形或椭圆形(图 3, 图 4a, b和c), 大小为3.69—6.49μm (平均值(5.22±0.65)μm; n=20), 部分细胞正在进行分裂(图 3)。由于有有机物覆盖在细胞表面, 很难观察到包裹在囊体中细胞表面的结构(图 4a)。从囊体上脱落的细胞呈球形至椭球型, 细胞表面光滑, 无鳞片, 细胞的一端有3个几乎是起源于同一位置的较短的附属物(图 4b, c)。部分囊体细胞正在进行分裂, 但细胞上的附属物数量与单个囊体细胞有差别(图 4d)。
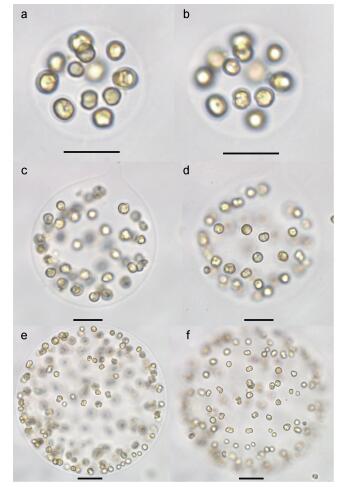 |
| 图 3 不同大小囊体及囊体上细胞的形态 Fig. 3 LM micrographs of colonies and colonial cells with different sizes 注: a, b:不同聚焦位置的小型囊体及囊体细胞; c, d:不同聚焦位置的中型囊体及囊体细胞; e, f:不同聚焦位置的较大囊体及囊体细胞(比例尺: 20μm) |
(3) 星形分泌物
通过扫描电镜观察到较多的丝状体以及五角星状的星形分泌物, 星形分泌物的每个角都连接着一根丝状体, 其直径大小为0.51—0.93μm (n=12)(图 5a)。部分丝状体上还有大小不等的“瘤状”结构(图 5b)。
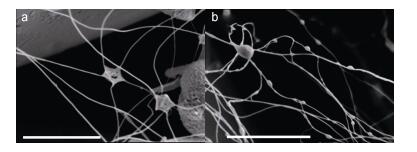 |
| 图 5 星形分泌物及丝状体的形态 Fig. 5 SEM micrographs of typical pentagonal star-like filaments 注: a:两个星形分泌物及与之相连的丝状体; b:丝状体及其“瘤状”物(比例尺: 3μm) |
通过透射电镜观察到了具鞭毛游动细胞(图 6a, b和c)和囊体细胞(图 6d)。具鞭毛游动细胞的细胞核位于其中上部, 近似椭圆形(图 6a和b); 有2个或4个叶绿体, 叶绿体呈长棒状(图 6a, b和c); 淀粉核跟叶绿体相连, 位于叶绿体中间, 呈纺锤体形(图 6a和b); 高尔基体位于细胞的中下部(图 6a和b); 线粒体为椭圆形或长椭圆形(图 6a和b); 细胞中有较大的液泡(图 6a和b)。囊体细胞的细胞器与具鞭毛细胞类似, 细胞核位于细胞中下部, 近似椭圆形, 叶绿体长棒状, 与淀粉核相连, 细胞的一侧有较大的液泡(图 6d)。
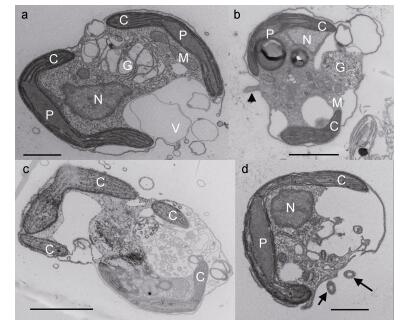 |
| 图 6 球形棕囊藻具鞭毛游动细胞和囊体细胞的超微结构 Fig. 6 TEM micrographs of flagellate and colonial cells 注: a、c:具鞭毛游动细胞横切显示细胞内部结构; b:具鞭毛游动细胞纵切显示细胞内部结构(箭头所示为鞭毛); d:囊体细胞纵切显示细胞内部结构(箭所示为鞭毛)(比例尺: a, d=1μm, b, c=2μm)。C:叶绿体, P:淀粉核, N:细胞核, M:线粒体, G:高尔基体, V:液泡 |
在棕囊藻的分类中, 形态特征非常重要, 包括是否能形成囊体(群体), 囊体的形态、大小和囊体细胞的分布, 鞭毛藻细胞的形态特征、大小、分泌物的形状等(Parke et al, 1971;齐雨藻等, 2001; Medlin et al, 2007; Rousseau et al, 2007, 2013)。对于细胞较小、很难通过光镜观察到精细的表面结构等的藻类如棕囊藻, 随着分子生物学技术在藻类分类中的广泛应用, 通过形态学特征、超微结构结合系统进化分析对于这类微藻的分类和鉴定起到了非常重要的作用(Zingone et al, 1999; Lange et al, 2002; Andersen et al, 2015)。我国自1997年首次暴发棕囊藻赤潮以来, 广东、福建、广西和天津等地沿海也暴发了不同规模的棕囊藻赤潮(陈菊芳等, 1999;江涛等, 2006;曲凌云等, 2008;王超等, 2010;覃仙玲等, 2016), 这些赤潮原因种主要是通过囊体形态以及分子测序(18S rDNA)鉴定为球形棕囊藻(陈月琴等, 2002;陈丽芬等, 2003;曲凌云等, 2008;覃仙玲等, 2016), 而且, 通过系统进化分析认为分布于我国东南海域的球形棕囊藻可能是一种本地起源的暖水种(陈月琴等, 2002)。然而, 有关我国球形棕囊藻的细胞形态、类型、超微结构等还没有详细的研究, 与欧洲等地的冷水种相比较, 形态上是否有差异还不清楚。
对分离于我国北部湾的一株球形棕囊藻的单细胞形态、超微结构的观察表明, 北部湾株存在两种不同类型的细胞:具鞭毛游动细胞和囊体细胞。这也是首次观察到了中国近海球形棕囊藻不同类型细胞的精细结构, 与欧洲的株系相似(Parke et al, 1971; Antajan et al, 2004; Rousseau et al, 2007, 2013), 但是也存在部分差别。我们在具鞭毛游动细胞上观察到了一种近似圆盘状的“凸起”结构, 每个细胞上1—2个, 有些细胞上没有观察到, 可能是进行电镜观察时受细胞所处位置的限制被遮挡, 也可能是部分细胞没有此结构, 但是在欧洲的所有株系上都没有观察到这一结构(Parke et al, 1971; Antajan et al, 2004; Rousseau et al, 2007, 2013)。我们推测可能是北部湾株这一暖水种区别于欧洲冷水种的重要特征, 但还需对中国近海其它的株系以及欧洲株系进行进一步的形态学研究。Parke等(1971)观察到棕囊藻(Edvardse等(2000)认为该种是球形棕囊藻)小型鞭毛细胞有两种大小的鳞片(圆形的, 0.18μm×0.19μm; 椭圆形的, 0.10μm×0.13μm), 但并没有说明统计了多少细胞上的鳞片数量; Rousseau等(2013)对球形棕囊藻不同类型细胞的形态进行了详细的研究, 观察到了两种大小的鳞片(~0.18—0.22μm和~0.15—0.18μm), 二者差别较小, 从其电镜图片上很难看出差别, 小鳞片的尺寸较Parke等(1971)观察到的稍大, 而我们观察到的鳞片(图 1, 0.15—0.23μm, 平均值(0.18±0.02)μm)与Rousseau等(2013)描述的类似, 但是很难将这些鳞片分成大、小两种类型, 而同属的P. scrobiculata和P. jahnii形成的两种类型的鳞片大小差别则较大(Moestrup, 1979; Zingone et al, 1999)。Rousseau等(2013)首次观察到了大型具鞭毛细胞的精细结构, 与小型具鞭毛细胞最大的差别除细胞大小外, 这种类型的细胞表面没有鳞片, 而我们在球形棕囊藻北部湾株中观察到了一种细胞, 其形态与Rousseau等(2013)观察到的大型鞭毛细胞相似, 大小较具鞭毛游动细胞无明显的差别, 鞭毛较短, 鞭毛起始的地方无明显凹陷, 与Rousseau等(2013)研究结果最大的差别是这种细胞有鳞片, 我们推测这种细胞可能是一种中间状态, 是否将其作为一种细胞类型还有待于进一步的研究。我们观察到的囊体细胞与Rousseau等(2013)相似, 包括单个的囊体细胞及正在分裂的囊体细胞(图 4)。星形分泌物被认为是棕囊藻分类的重要特征之一, Parke等(1971)最早在棕囊藻中观察到了五角星形的结构, 但五角星形结构为中空的; Antajan等(2004)也观察到了星形结构, 每个角分别与一根丝状体相连; Rousseau等(2013)也观察到了类似的结果; 我们的结果与Antajan等(2004)和Rousseau等(2013)类似, 而且我们也观察到了有些丝状体上形成了“瘤状”结构以及可能正在形成的星形结构(图 5b)。同属P. pouchetii和P. cordata的分泌物也能形成五角星形的结构, 而P. scrobiculata则形成九角星形的结构(Moestrup, 1979; Hallegraeff, 1983; Zingone et al, 1999)。综上, 球形棕囊藻北部湾株与欧洲的株系相比较, 表面形态相似, 但是北部湾株具鞭毛游动细胞表面有“凸起”结构, 鳞片并无明显的大小之分, 这是否是暖水种和冷水种的差别还需要进一步的研究。
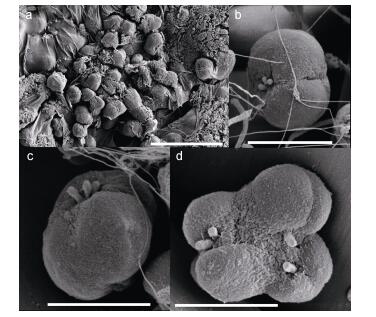 |
| 图 4 囊体细胞的形态 Fig. 4 SEM micrographs for cells in colonies 注: a:包裹在囊体中细胞的形态; b, c:单个的囊体细胞及细胞上的附属物; d:正在分裂的囊体细胞(比例尺: a=20μm, b=5μm, c, d=4μm) |
过去关于棕囊藻的分类主要是基于囊体、单细胞形态特征等, Medlin等(2007)首次利用核糖体小亚基序列(18S rDNA)来分析棕囊藻几个种的系统进化, 结果有力地支持了这个种属的分类地位。后来, 有更多的研究将DNA分析作为棕囊藻分类及种类鉴定的重要手段(Zingone et al, 1999;陈月琴等, 2002; Lange et al, 2002;陈丽芬等, 2003; Rousseau et al, 2013; Andersen et al, 2015;覃仙玲等, 2016)。我们利用核糖体大亚基(28S rDNA)对已有棕囊藻的几个种进行了分析(NCBI上除了P. pouchetii没有核糖体大亚基序列外, 其它5个种均可获得), 通过进化树可以进一步确认我们从北部湾获得的是球形棕囊藻, 球形棕囊藻与P. antarctica和P. rex的亲缘关系较近, 而与P. jahnii的亲缘关系较远, 这也与过去的研究相符合(Zingone et al, 1999; Rousseau et al, 2013; Andersen et al, 2015)。
4 结论通过分子序列和形态学特征证实了我国广西北部湾的棕囊藻为球形棕囊藻, 并且观察到了两种类型的细胞:具鞭毛游动细胞和囊体细胞。具鞭毛游动细胞表面具有圆盘状“凸起”结构但囊体上的细胞无此结构, 凸起结构上的鳞片与细胞表面其它处的鳞片没有差别。
致谢 感谢中国科学院实验海洋生物学重点实验室的孙园园博士在透射电镜样品切片中给予的帮助, 感谢中国科学院海洋生态与环境科学重点实验室俞志明研究员课题组提供的棕囊藻赤潮水样, 谨致谢忱。
丁立, 王小冬, 王艳. 2018. 不同摄食压力下球形棕囊藻的防御策略. 海洋科学进展, 36(1): 139-144, 145 DOI:10.3969/j.issn.1671-6647.2018.01.013 |
王艳, 王小冬, 李韶山. 2010. 充气和搅动对球形棕囊藻生长及囊体形成的影响. 生态学报, 30(12): 3368-3374 |
王艳, 齐雨藻, 李韶山. 2007. 球形棕囊藻生长的营养需求研究. 水生生物学报, 31(1): 24-29 DOI:10.3321/j.issn:1000-3207.2007.01.004 |
王艳, 齐雨藻, 沈萍萍, 等. 2003. 温度和盐度对球形棕囊藻细胞DMSP产量的影响. 水生生物学报, 27(4): 367-371 DOI:10.3321/j.issn:1000-3207.2003.04.007 |
王超, 李新辉, 赖子尼, 等. 2010. 珠江口球形棕囊藻(Phaeocystis globosa)赤潮后期的浮游植物群落结构特征研究. 生态科学, 29(2): 140-146 DOI:10.3969/j.issn.1008-8873.2010.02.009 |
王小冬, 王艳. 2012. 高摄食压力下球形棕囊藻凝聚体的形成. 生态学报, 32(2): 414-420 |
刘玉芳, 赵玲, 尹平河, 等. 2011. 季磷盐改性蒙脱土去除球形棕囊藻的实验研究. 中国环境科学, 31(8): 1295-1299 |
齐雨藻, 沈萍萍, 王艳. 2001. 棕囊藻属(Phaeocystis)的分类与生活史(综述). 热带亚热带植物学报, 9(2): 174-184 DOI:10.3969/j.issn.1005-3395.2001.02.016 |
江涛, 江天久, 李鹏, 等. 2006. 湛江球形棕囊藻赤潮除藻试验. 热带亚热带植物学报, 14(1): 14-18 DOI:10.3969/j.issn.1005-3395.2006.01.003 |
曲凌云, 吕颂辉, 高春蕾, 等. 2008. 棕囊藻渤海株核糖体18S rDNA和ITS基因结构序列分析. 海洋科学进展, 26(2): 200-206 DOI:10.3969/j.issn.1671-6647.2008.02.010 |
杨和福. 2004. 棕囊藻的生物学概述Ⅰ.形态分类和生理生态学. 东海海洋, 22(1): 49-63 DOI:10.3969/j.issn.1001-909X.2004.01.007 |
沈萍萍, 王艳, 齐雨藻, 等. 2000. 球形棕囊藻的生长特性及生活史研究. 水生生物学报, 24(6): 635-643 DOI:10.3321/j.issn:1000-3207.2000.06.010 |
陈月琴, 王宁, 周惠, 等. 2002. 棕囊藻赤潮原因种的分子鉴定和起源分析. 海洋学报, 24(6): 99-103 DOI:10.3321/j.issn:0253-4193.2002.06.011 |
陈丽芬, 章群, 骆育敏, 等. 2003. 18S rDNA序列分析鉴定棕囊藻香港株P2为球形棕囊藻. 生态科学, 22(4): 349-350 DOI:10.3969/j.issn.1008-8873.2003.04.013 |
陈菊芳, 徐宁, 江天久, 等. 1999. 中国赤潮新记录种-球形棕囊藻(Phaeocystis globosa). 暨南大学学报(自然科学版), 20(3): 124-129 |
晏荣军, 尹平河, 潘剑宇, 等. 2006. 棕囊藻囊泡的培养与去除研究. 热带海洋学报, 25(3): 69-71 DOI:10.3969/j.issn.1009-5470.2006.03.013 |
唐赢中, 胡章喜, 邓蕴彦. 2016. 休眠孢囊作为甲藻有害藻华年际频发和地理扩散一种关键机制的研究进展. 海洋科学集刊, 51: 132-154 DOI:10.12036/hykxjk20160730001 |
曹西华, 俞志明, 邱丽霞. 2017. 改性黏土法消除球形棕囊藻赤潮的现场实验与效果评估. 海洋与湖沼, 48(4): 753-759 |
覃仙玲, 赖俊翔, 陈波, 等. 2016. 棕囊藻北部湾株的18S rDNA分子鉴定. 热带亚热带植物学报, 24(2): 176-181 |
Andersen R A, Bailey J C, Decelle J et al, 2015. Phaeocystis rex sp. nov. (Phaeocystales, Prymnesiophyceae): a new solitary species that produces a multilayered scale cell covering. European Journal of Phycology, 50(2): 207-222 DOI:10.1080/09670262.2015.1024287 |
Antajan E, Chrétiennot-Dinet M J, Leblanc C et al, 2004. 19′-Hexanoyloxyfucoxanthin may not be the appropriate pigment to trace occurrence and fate of Phaeocystis: the case of P. globosa in Belgian coastal waters. Journal of Sea Research, 52(3): 165-177 DOI:10.1016/j.seares.2004.02.003 |
Brussaard C P D, Kuipers B, Veldhuis M J W, 2005. A mesocosm study of Phaeocystis globosa population dynamics: Ⅰ. Regulatory role of viruses in bloom control. Harmful Algae, 4(5): 859-874 DOI:10.1016/j.hal.2004.12.015 |
Cadée G C, 1996. Accumulation and sedimentation of Phaeocystis globosa in the Dutch Wadden Sea. Journal of Sea Research, 36(3-4): 321-327 DOI:10.1016/S1385-1101(96)90799-6 |
Darriba D, Taboada G L, Doallo R et al, 2012. jModelTest 2: more models, new heuristics and parallel computing. Nature Methods, 9(8): 772 |
Daugbjerg N, Hansen G, Larsen J et al, 2000. Phylogeny of some of the major genera of dinoflagellates based on ultrastructure and partial LSU rDNA sequence data, including the erection of three new genera of unarmoured dinoflagellates. Phycologia, 39(4): 302-317 DOI:10.2216/i0031-8884-39-4-302.1 |
Edvardsen B, Eikrem W, Green J C et al, 2000. Phylogenetic reconstructions of the Haptophyta inferred from 18s ribosomal DNA sequences and available morphological data. Phycologia, 39(1): 19-35 DOI:10.2216/i0031-8884-39-1-19.1 |
Guillard R R L, 1975. Culture of phytoplankton for feeding marine invertebrates. In: Smith W L, Chanley M H eds. Culture of Marine Invertebrate Animals. New York, USA: Plenum Press, 26—60
|
Guindon S, 2010. Bayesian estimation of divergence times from large sequence alignments. Molecular Biology and Evolution, 27(8): 1768-1781 DOI:10.1093/molbev/msq060 |
Guindon S, Gascuel O, 2003. A simple, fast, and accurate algorithm to estimate large phylogenies by maximum likelihood. Systematic Biology, 52(5): 696-704 DOI:10.1080/10635150390235520 |
Guiselin N, Courcot L, Artigas L F et al, 2009. An optimised protocol to prepare Phaeocystis globosa morphotypes for scanning electron microscopy observation. Journal of Microbiological Methods, 77(1): 119-123 DOI:10.1016/j.mimet.2009.01.002 |
Hall T A, 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symposium Series, 41: 95-98 |
Hallegraeff G M, 1983. Scale-bearing and loricate nanoplankton from the East Australian Current. Botanica Marina, 26(11): 493-516 |
Hamm C E, 2000. Architecture, ecology and biogeochemistry of Phaeocystis colonies. Journal of Sea Research, 43(3-4): 307-315 DOI:10.1016/S1385-1101(00)00014-9 |
Katoh K, Misawa K, Kuma K I et al, 2002. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucleic Acids Research, 30(14): 3059-3066 DOI:10.1093/nar/gkf436 |
Lange M, Chen Y Q, Medlin L K, 2002. Molecular genetic delineation of Phaeocystis species (Prymnesiophyceae) using coding and non-coding regions of nuclear and plastid genomes. European Journal of Phycology, 37(1): 77-92 DOI:10.1017/S0967026201003481 |
Medlin L, Zingone A, 2007. A taxonomic review of the genus Phaeocystis. Biogeochemistry, 83(1-3): 3-18 DOI:10.1007/s10533-007-9087-1 |
Moestrup Ø, 1979. Identification by electron microscopy of marine nanoplankton from New Zealand, including the description of four new species. New Zealand Journal of Botany, 17(1): 61-95 DOI:10.1080/0028825X.1979.10425161 |
Parke M, Green J C, Manton I, 1971. Observations on the fine structure of zoids of the genus Phaeocystis [Haptophyceae]. Journal of the Marine Biological Association of the United Kingdom, 51(4): 927-941 DOI:10.1017/S0025315400018063 |
Qi Y Z, Chen J F, Wang Z H et al, 2004. Some observations on harmful algal bloom (HAB) events along the coast of Guangdong, southern China in 1998. Hydrobiologia, 512(1-3): 209-214 DOI:10.1023/B:HYDR.0000020329.06666.8c |
Riegman R, Noordeloos A A M, Cadée G C, 1992. Phaeocystis blooms and eutrophication of the continental coastal zones of the North Sea. Marine Biology, 112(3): 479-484 DOI:10.1007/BF00356293 |
Ronquist F, Huelsenbeck J P, 2003. MrBayes 3: Bayesian phylogenetic inference under mixed models. Bioinformatics, 19: 1572-1574 DOI:10.1093/bioinformatics/btg180 |
Rousseau V, Chrétiennot-Dinet M J, Jacobsen A et al, 2007. The life cycle of Phaeocystis: state of knowledge and presumptive role in ecology. Biogeochemistry, 83(1-3): 29-47 DOI:10.1007/s10533-007-9085-3 |
Rousseau V, Lantoine F, Rodriguez F et al, 2013. Characterization of Phaeocystis globosa (Prymnesiophyceae), the blooming species in the Southern North Sea. Journal of Sea Research, 76: 105-113 DOI:10.1016/j.seares.2012.07.011 |
Rousseau V, Vaulot D, Casotti R et al, 1994. The life cycle of Phaeocystis (Prymnesiophycaea): evidence and hypotheses. Journal of Marine Systems, 5(1): 23-39 DOI:10.1016/0924-7963(94)90014-0 |
Schoemann V, Becquevort S, Stefels J et al, 2005. Phaeocystis blooms in the global ocean and their controlling mechanisms: a review. Journal of Sea Research, 53(1-2): 43-66 DOI:10.1016/j.seares.2004.01.008 |
Scholin C A, Herzog M, Sogin M et al, 1994. Identification of group- and strain-specific genetic markers for globally distributed Alexandrium (Dinophyceae). Ⅱ. Sequence analysis of a fragment of the LSU rRNA gene. Journal of Phycology, 30(6): 999-1011 DOI:10.1111/j.0022-3646.1994.00999.x |
Shen P P, Qi Y Z, Wang Y et al, 2011. Phaeocystis globosa Scherffel, a harmful microalga, and its production of dimethylsulfoniopropionate. Chinese Journal of Oceanology and Limnology, 29(4): 869-873 DOI:10.1007/s00343-011-0515-7 |
Smith Jr W O, Liu X, Tang K W et al, 2014. Giantism and its role in the harmful algal bloom species Phaeocystis globosa. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 101: 95-106 DOI:10.1016/j.dsr2.2012.12.005 |
Spurr A R, 1969. A low-viscosity epoxy resin embedding medium for electron microscopy. Journal of Ultrastructure Research, 26(1-2): 31-43 DOI:10.1016/S0022-5320(69)90033-1 |
Vaulot D, Birrien J L, Marie D et al, 1994. Morphology, ploidy, pigment composition, and genome size of cultured strains of Phaeocystis (Prymnesiophyceae). Journal of Phycology, 30(6): 1022-1035 DOI:10.1111/j.0022-3646.1994.01022.x |
Veldhuis M J W, Brussaard C P D, Noordeloos A A M, 2005. Living in a Phaeocystis colony: a way to be a successful algal species. Harmful Algae, 4(5): 841-858 DOI:10.1016/j.hal.2004.12.013 |
Verity P G, Brussaard C P, Nejstgaard J C et al, 2007. Current understanding of Phaeocystis ecology and biogeochemistry, and perspectives for future research. Biogeochemistry, 83(1-3): 311-330 DOI:10.1007/s10533-007-9090-6 |
Wang X D, Wang Y, Ou L J et al, 2015. Allocation costs associated with induced defense in Phaeocystis globosa (Prymnesiophyceae): the effects of nutrient availability. Scientific Reports, 5: 10850 DOI:10.1038/srep10850 |
Xu N, Huang B Z, Hu Z X et al, 2017. Effects of temperature, salinity, and irradiance on the growth of harmful algal bloom species Phaeocystis globosa Scherffel (Prymnesiophyceae) isolated from the South China Sea. Chinese Journal of Oceanology and Limnology, 35(3): 557-565 DOI:10.1007/s00343-017-5352-x |
Zingone A, Chrétiennot-Dinet M J, Lange M et al, 1999. Morphological and genetic characterization of Phaeocystis cordata and P. jahnii (Prymnesiophyceae), two new species from the Mediterranean Sea. Journal of Phycology, 35(6): 1322-1337 DOI:10.1046/j.1529-8817.1999.3561322.x |
 2019, Vol. 50
2019, Vol. 50


