中国海洋湖沼学会主办。
文章信息
- 杨小东, 江兴龙, 乐普敏, 龚铭杰. 2019.
- YANG Xiao-Dong, JIANG Xing-Long, LE Pu-Min, GONG Ming-Jie. 2019.
- 南美洲鳗鲡(Anguilla rostrata)的耗氧率(ROC)、窒息点(AP)和适温范围(RT)及对非离子氨(NIA)、NO2-的LC50和SC的研究
- STUDIES ON OXYGEN CONSUMPTION RATE (ROC), ASPHYXIAL POINT (AP) AND OPTIMUM WATER TEMPERATURE RANGE (RT) OF ANGUILLA ROSTRATA AND LC50 AND SC OF NON-IONIC AMMONIA (NIA) AND NITRITE IN WATER
- 海洋与湖沼, 50(2): 455-464
- Oceanologia et Limnologia Sinica, 50(2): 455-464.
- http://dx.doi.org/10.11693/hyhz20181200295
-
文章历史
- 收稿日期:2018-12-15
- 收修改稿日期:2019-01-13
2. 鳗鲡现代产业技术教育部工程研究中心 厦门 361021
2. Engineering Research Center of the Modern Industry for Eel, Ministry of Education, Xiamen 361021, China
鳗鲡属(Anguilla)的主要经济种类有日本鳗鲡(A. japonica)、欧洲鳗鲡(A. anguilla)、美洲鳗鲡(A. rostrata)、花鳗鲡(A. marmorata)、太平洋双色鳗鲡(A. bicolor pacifica)等, 目前已经成为许多国家和地区的集约化养殖对象(吴成业等, 2004)。鳗鲡(地方名鳗鱼)营养丰富, 经济价值高, 是世界性最重要的水产养殖种类之一。我国是养鳗大国, 鳗鲡养殖产量长期居世界第一, 2017年我国鳗鲡养殖产量约21.7万吨(农业部渔业渔政管理局, 2018)。美洲鳗鲡(A. rostrata)根据产地和苗期的不同, 可分为北美洲鳗鲡和南美洲鳗鲡。北美洲鳗鲡产自北美洲东岸, 分布在北美洲东部至圭亚那、格陵兰附近。产苗季节在每年1—6月(洪万树, 1998);南美洲鳗鲡产于中南美洲的厄瓜多尔、多米尼加、尼加拉瓜、海地等沿海地区, 苗期为9月到翌年的3月。南美洲鳗苗具有相对日本鳗鲡苗价格较低和具有一定资源量等优势。作为一种发展前景良好的鳗鲡养殖种类, 2015年被福建的鳗鱼养殖场大量引进(刘俊杰等, 2017)。南美洲鳗鲡的养殖规模逐渐扩大, 但是对养殖过程中影响其生长、存活的主要生态因子和生理学研究相对较少。周立红等(2013)研究了南美洲鳗鲡白仔对温度、pH、溶解氧、氨氮、亚硝酸盐以及光强等生态因子的适宜范围及耐受极限。但没有学者对黑仔、幼鳗及成鳗养殖过程中生态因子对其影响作相关研究, 对耗氧率和窒息点的研究更是匮乏。鱼类的耗氧率和窒息点是反映鱼体代谢活动的基本生理指标, 是鱼类生理学研究的重要内容, 其大小和变化规律反映了鱼类的代谢特征和规律, 是野生鱼类人工养殖驯化的一个重要参数。关于鳗鲡属鱼类的耗氧率研究, 国内外学者对主要的养殖对象进行了试验研究, 如日本鳗鲡(Chan et al, 1978)、澳洲鳗鲡(A. australis)(Forster, 1981)、花鳗鲡(闵志勇等, 1998)、欧洲鳗鲡(Degani et al, 1989)和北美洲鳗鲡(Degani et al, 1985)等, 但对鳗鲡窒息点的研究较少, 对南美洲鳗鲡的耗氧率相关研究未见报道。本论文开展了南美洲鳗鲡黑仔对水温、非离子氨和亚硝酸盐等水质主要因子的耐受性研究, 以及不同规格南美洲鳗鲡的耗氧率和窒息点的研究, 以期为南美洲鳗鲡的养殖和生理生态研究提供科学依据。
1 材料与方法 1.1 试验材料南美洲鳗鲡取自集美大学水产试验场养殖的鳗鲡; 试验鱼在实验前均停食暂养48h;试验用水为经曝气一周以上的自来水, pH 6.95—7.10。
1.2 试验方法 1.2.1 黑仔鳗对水温的耐受性试验试验在恒温培养箱(无光照)内进行, 使用容积为5L的水族箱作为试验容器, 并预加入4L经曝气的自来水, 试验设置3个平行, 每个水族箱内放入重(10.13±0.25)g的黑仔鳗10尾。以水温22℃为基础进行升温或降温处理, 幅度每次±1℃, 达到目标温度后观察2h, 如果出现死亡或休克现象延长1h观察时间。耐高温试验从22℃梯度升温至40℃; 耐低温试验从22℃依次降低至0℃ (5—0℃使用冰块降温)。在0℃条件下维持24h后自然升温到试验前温度, 观察休克鱼的存活情况。记录鳗鲡的活动情况、比例和死亡率。
1.2.2 非离子态氨对南美洲鳗鲡黑仔的毒性试验向经曝气的自来水中加入NH4Cl配置不同浓度的试验溶液, 使用1mol/L NaOH、1mol/L HCl将pH控制在7.0±0.5 (林祥日等, 1998)。试验非离子态氨的浓度梯度为0.125、0.5、2、8、32mg/L (樊海平, 1997), 以曝气自来水为对照组。试验在25℃室温条件下进行, 每个水族箱内加入4L试验溶液, 均重(10.13±0.25)g黑仔鳗10条。试验过程中每天测试水体pH、溶解氧、水温、盐度等水质常规理化因子, 每24h更换试验液。记录鱼的活动状态及死亡数量。采用直线内插法计算非离子态氨对南美洲鳗鲡黑仔24h、48h、72h、96h的半致死浓度(LC50), 应用公式:安全浓度(SC)=LC50(96h)×0.1计算安全浓度(姜礼燔, 1995)。
1.2.3 亚硝酸盐对南美洲黑仔的毒性试验向经曝气的自来水中加入NaNO2配置不同浓度的试验溶液, 亚硝酸盐氮的浓度梯度为20、40、60、80、100mg/L, 以曝气自来水为对照组。试验在25℃室温条件下进行, 每个水族箱内加入4L试验溶液, 均重10.13±0.25g黑仔鳗10条。每天测试水体pH、溶解氧、水温、盐度等, 每24h更换试验液。记录鱼的活动状态及死亡数量。计算半致死浓度(LC50)和安全浓度。
1.2.4 南美洲鳗鲡窒息点的研究在水温(25±1)℃, pH (7.1±0.2)的条件下对均重(10.3±2.1)g(黑仔)、(42.4±7.8)g(幼鳗)、(157.0±7.9)g(成鳗)3种规格南美洲鳗鲡进行窒息点试验, 将鱼装入呼吸室后放入恒温容器, 同时测定起始的溶氧, 观察并记录鳗鲡的行为活动。记录南美洲鳗鲡死亡1尾、死亡50%以及全部死亡时的溶解氧、pH和水温。以50%死亡时的呼吸室水体溶氧为窒息点。自制静水式呼吸室, 如图 1所示。
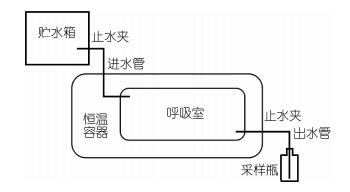 |
| 图 1 南美洲鳗鲡窒息点测定试验装置 Fig. 1 Test apparatus for measuring the asphyxial point for A. rostrata |
使用空调控制室内温度, 水温调节使用自动恒温加热棒升温或冰块降温。耗氧量测定装置如图 2, 采用有效水体积约为1.5t, 水位高度为0.5m的圆形聚乙烯养殖桶进行试验。试验开始前停止曝气, 并使用气密性良好的聚酯薄膜(PET)紧贴水面覆盖, 四周用胶带粘牢固定。再将整个桶用塑料薄膜箍紧, 桶沿和塑料薄膜之间以水贴合, 加热棒电缆和虹吸采样管通过弹性密封孔与两层塑料薄膜紧密贴合, 达到密封效果。水温控制在(25.0±0.5) ℃, 鱼规格为(85.64±3.21)g, 数量30尾。待试验鱼在呼吸装置中恢复适应后断氧并密封装置开始试验, 连续24h整点采样, 重复测定三次。
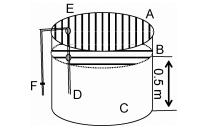 |
| 图 2 南美洲鳗鲡耗氧率测定试验装置 Fig. 2 Test apparatus for measuring the oxygen consumption rate for A. rostrata 注: A.外侧塑料膜, B.聚酯薄膜(PET), C.水体, D.采样虹吸管, E.弹性密封孔, F.开关 |
用两因素等重复实验设计方法, 设定15℃、20℃、25℃、30℃共4个温度组, 选取平均鱼体质量规格分别约85g、55g、31g、11g的鳗鱼各约2kg。测定不同规格的南美洲鳗鲡在不同温度条件下24h的耗氧率。试验规格设置温度分组和鱼体质量如表 1。
| 15℃ | 20℃ | 25℃ | 30℃ | |||||||
| 体质量(g) | 数量(ind) | 体质量(g) | 数量(ind) | 体质量(g) | 数量(ind) | 体质量(g) | 数量(ind) | |||
| 10.97±1.21 | 168 | 11.12±1.25 | 170 | 11.22±1.13 | 167 | 10.62±1.14 | 172 | |||
| 30.82±2.32 | 66 | 31.31±2.31 | 64 | 30.91±2.86 | 69 | 30.49±3.16 | 62 | |||
| 55.13±2.79 | 38 | 55.44±2.61 | 40 | 55.35±2.69 | 36 | 54.87±2.59 | 35 | |||
| 84.83±3.18 | 24 | 85.11±3.01 | 28 | 84.94±3.13 | 24 | 85.24±2.71 | 26 | |||
实验数据处理使用SPSS24.0进行统计分析, 以P < 0.05作为显著性差异的标志。文中数据表述方式均为平均值±标准差。耗氧率(ROC)和耗氧量的计算按照下式计算:
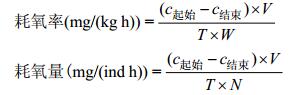
式中, c起始代表实验开始时装置内溶解氧浓度, 单位mg/L; c结束代表实验结束时装置内溶液氧浓度, 单位mg/L; V表示装置内有效水体积, 测定24h耗氧率变化规律时V=V1–V2; V1表示采样前体积, V2表示采样损耗的体积, 单位L; T表示时间, 单位h; W表示鱼的总重, 单位kg; N表示鱼的个体数量, 单位ind。
耗氧量和鱼体质量之间通常呈幂函数关系, 即M=aWb, M代表耗氧量, 单位mg/(ind h); W表示鱼个体重, 单位g; a、b为常数, b又称为体重指数。
2 结果 2.1 水温对南美洲鳗鲡黑仔的影响南美洲鳗鲡黑仔在水温22—28.5℃无异常反应, 大多数保持集群, 静卧于水族箱内, 偶有应激现象都因外界的声响或者光线导致。水温上升到28.5—29℃, 鳗鲡集群开始分散, 并出现非应激性窜游; 在29—32℃过程中游动数量游动幅度逐渐增加, 完全失去集群效应; 从33℃开始, 鳗鲡开始上浮剧烈游动; 36℃时所有的鳗鲡狂游不止, 试图挣脱水体, 呼吸急促, 开始死亡; 38—39℃为死亡高峰, 死亡率达75%;在39.5℃全部死亡。南美洲鳗鲡黑仔对低水温的反应一般为迟钝、僵直、活动微弱, 实验从22—13℃以前鳗鲡活动都正常, 仅外界刺激会对鳗鲡活动造成影响, 从12.5℃开始鳗鲡开始出现不活跃的现象, 集群分散; 1—2℃时鳗鲡几乎没有活动, 即使受到外界刺激, 也无反应; 保持水温为0.1℃, 70%个体受到刺激仍为僵硬状态, 保持24h未出现死亡。低温恢复试验阶段, 0—5℃, 鳗鲡逐渐的出现轻微游动; 5—10℃, 鳗鲡游动更加自然, 逐渐分散游动, 但容易不安及惊恐; 10—18℃, 鳗鲡开始表现为强烈的应激反应, 大幅度抽搐, 在15℃开始, 抽搐慢慢减缓, 并且随时回复时间增多, 温度升高, 转为轻微的抽搐, 应激也逐渐减弱, 活动状态慢慢恢复。不同水温的南美洲鳗鲡黑仔活动状态见表 2。
| 温度(℃) | 累计死亡率(%) | 鳗鲡黑仔活动状态 |
| 39 | 100 | 全部死亡 |
| 38 | 75 | 出现死亡高峰 |
| 36—37 | 8.33 | 全部水面剧烈游动, 出现死亡 |
| 34—35 | 0 | 部分狂游不止, 试图挣脱水面 |
| 32—33 | 0 | 出现部分上浮剧烈游动 |
| 30—31 | 0 | 大部分不停游动 |
| 28—29 | 0 | 集群分散, 部分不停游动 |
| 22—27 | 0 | 无外界刺激静卧水底, 受刺激反应迅捷 |
| 22—12.5 | 0 | 无外界刺激静卧水底, 受刺激反应迅捷 |
| 12—7 | 0 | 个体不活跃并且数量逐渐增多 |
| 6—5 | 0 | 原来的集群分散 |
| 4—3 | 0 | 鳗鲡反应比较迟钝 |
| 2 | 0 | 十分迟钝, 受刺激只能在底部扭动 |
| 1 | 0 | 无活动, 僵卧 |
| 0 | 0 | 僵直, 迟钝, 毫无反应 |
| 0—5 | 0 | 出现轻微活动 |
| 5—10 | 0 | 活动增多, 有不安现象 |
| 10—18 | 0 | 有抽搐, 后慢慢恢复正常状态 |
在0.125mg/L、0.5mg/L非离子态氨浓度条件下的黑仔均无异常反应, 2mg/L浓度条件下在72h开始出现躁动不安, 96h出现死亡, 死亡鳗鲡身体僵硬略弯曲, 口张开, 头上翘, 死亡率为20%;在8mg/L浓度条件下24h、48h、72h、96h死亡率分别为10%、30%、70%、70%, 实验过程中鳗鲡的状态由不适到串游到抖动再到僵硬最后死亡, 未死亡鳗鲡则严重抽搐, 口吻及肛门部发红; 在32mg/L浓度条件下鳗鲡一开始便严重抽搐, 并在48h后全部死亡。对照组均无死亡现象发生, 详细结果见表 3。非离子态氨对南美洲鳗鲡黑仔24h、48h、72h和96h的半致死浓度分别为32.14、15.97、12.58和12.22mg/L, 安全浓度为1.222mg/L。
| 时间(h) | 配制浓度(mg/L) | ||||
| 0.127 | 0.57 | 1.92 | 7.88 | 32.2 | |
| 24 | 0 | 0 | 0 | 10 | 50 |
| 48 | 0 | 0 | 0 | 30 | 100 |
| 72 | 0 | 0 | 0 | 70 | 100 |
| 96 | 0 | 0 | 10 | 70 | 100 |
20mg/L浓度组的黑仔鳗均无异常反应; 40mg/L浓度组部分表现为易受惊、向上窜游、身体扭曲等现象, 死亡鳗鲡躯体僵硬略弯曲、表皮充血、口张开、头上翘; 60mg/L浓度组有较多黑仔鳗出现躁动不安、抽搐等现象, 此浓度下24h、48h、72h、96h的死亡率为20%、30%、50%、50%; 80mg/L浓度组死亡率进一步升高, 鳗鲡大多数为抽搐僵硬状态, 实验过程中体色灰暗, 腹部银白, 部分鱼体腹部出现绿色肿块; 100mg/L在72h全部死亡。对照组均无死亡现象发生, 试验结果见表 4。亚硝酸盐氮对南美洲鳗鲡黑仔24h、48h、96h的半致死浓度分别为105.40、75.54、64.60和61.68mg/L, 安全浓度为6.17mg/L。
| 时间(h) | 配制浓度(mg/L) | ||||
| 22.5 | 45.2 | 66 | 87.5 | 109 | |
| 24 | 0 | 10 | 20 | 30 | 50 |
| 48 | 0 | 10 | 30 | 50 | 80 |
| 72 | 0 | 10 | 50 | 60 | 100 |
| 96 | 0 | 30 | 50 | 60 | 100 |
在水温(25±1)℃, PH7.1±0.2的条件下对均重10g(黑仔)、40g(幼鳗)、160g(成鳗)3种规格6组南美洲鳗鲡进行窒息点试验, 试验结果如表 5。黑仔鳗的窒息点在1.14—1.22mg/L之间, 当溶氧降低至1.72mg/L时开始出现死亡; 成鳗开始出现死亡的最低溶氧为0.81mg/L, 在该溶氧下黑仔鳗已接近全部死亡; 成鳗的窒息点为0.42—0.51mg/L; 幼鳗的窒息点为0.83—0.99mg/L, 在该条件下黑仔鳗50%以上已经死亡, 成鳗开始死亡。南美洲鳗鲡的窒息点随着体重的增加而降低, 表现为规格越大的鳗鲡耐低氧能力越强。南美洲鳗鲡的窒息过程为:刚进入呼吸室时, 溶氧相对充足, 鳗鱼在呼吸室底部正常游动; 数小时后随着溶氧下降, 鱼体表现不安, 开始出现浮头现象, 半数在呼吸室中上水体来回游动; 之后鱼逐渐安静下来, 少部分将头伸到呼吸室顶部呼吸, 大部分伏在水底缓慢呼吸, 口微张, 鳃孔有气泡冒出; 不久之后, 鱼体缓缓沉入呼吸室底部, 仰腹或侧翻, 口张开, 身体剧烈抽搐, 体色变浅(脱黏), 最后身体僵直或弯曲死亡。
| 平均体重(g) | 平均体长(cm) | 试验鱼数量(ind) | 溶氧量(mg/L) | ||
| 死亡1尾 | 50%死亡 | 全部死亡 | |||
| 10.59±2.47 | 19.3±1.6 | 10 | 1.58±0.07 | 1.14±0.02 | 0.79±0.01 |
| 10.08±1.78 | 18.9±1.2 | 10 | 1.72±0.01 | 1.22±0.04 | 0.93±0.04 |
| 44.66±8.25 | 29.6±1.8 | 10 | 1.39±0.05 | 0.83±0.04 | 0.45±0.02 |
| 40.15±7.01 | 28.7±1.9 | 10 | 1.46±0.02 | 0.99±0.05 | 0.58±0.04 |
| 157.24±7.94 | 41.3±1.2 | 6 | 0.81±0.23 | 0.42±0.01 | 0.33±0.01 |
| 156.83±8.51 | 41.1±1.9 | 6 | 1.16±0.10 | 0.51±0.05 | 0.31±0.02 |
图 3显示了平均重量为(85.64±3.21)g的南美洲鳗鲡在水温25℃时耗氧率的昼夜变化情况。结果表明, 在18:00—19:00时南美洲鳗鲡的耗氧率最高为(182.69± 12.95)mg/(kg·h); 在6:00—7:00时最低值为(38.69± 6.95)mg/(kg·h)。以昼间6:00—18:00夜间18:00至次日6:00划分, 昼间均耗氧率为(86.46±37.77)mg/(kg h), 夜间耗氧率为(123.58±22.56)mg/(kg·h), 且存在明显的耗氧高峰值, 通过方差分析二者存在显著性差异(P≤0.01), 表明南美洲鳗鲡耗氧率存在明显的昼夜节律。
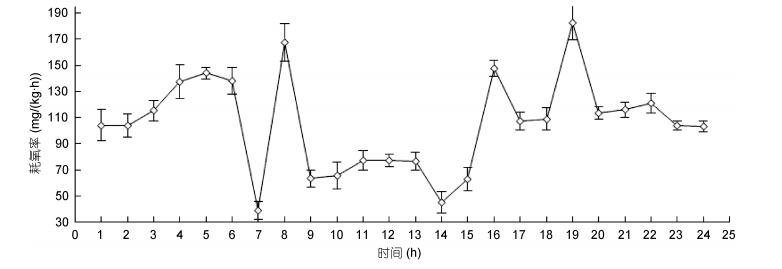 |
| 图 3 南美洲鳗鲡的24h耗氧率变化 Fig. 3 The variety of 24-hour oxygen consumption rate of A. rostrata |
按表 1中不同水温和体质量的分组测定耗氧率, 并对同一温度下不同体质量的鳗鲡耗氧率均值进行分析, 结果如图 4所示。南美洲鳗鲡耗氧率从15℃的(98.69±14.67)mg/(kg·h)上升到30℃的(151.18±21.88) mg/(kg·h), 增加约1.53倍。其中15—25℃耗氧率上升趋势明显, 25—30℃上升趋势减缓。通过方差分析表明15℃与30℃温度组间的差异显著(P < 0.05), 15℃与25℃温度组间的差异显著(P < 0.05), 20℃、25℃和30℃温度组间没有显著差异(P > 0.05)。水温对南美洲鳗鲡耗氧率的影响符合回归方程, y =–0.1316x2 + 9.4507x –13.712 (R2=0.9523)。
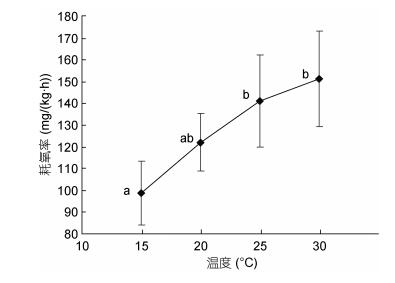 |
| 图 4 水温对南美洲鳗鲡耗氧率的影响 Fig. 4 Effects of water temperature on oxygen consumption rate of A. rostrata |
图 5显示了在不同水温下随着南美洲鳗鲡的体质量增加其耗氧率的变化。在试验装置水温为15℃时, 鳗鱼体质量由(10.97±1.21)g增加到(84.83±3.18)g时, 其耗氧率由(125.75±7.97)mg/(kg·h)降低至(84.57± 7.28)mg/(kg·h); 试验装置水温为20℃时, 随鳗鱼体质量由(11.12±1.25)g增加到(85.11±3.01)g时, 其耗氧率由(144.08±7.89)mg/(kg·h)降低至(103.15± 8.43)mg/(kg·h); 试验装置水温为25℃时, 鳗鱼体质量由(11.22±1.13)g增加到(84.94±3.13)g时, 其耗氧率由(163.60±8.62)mg/(kg·h)降低至(115.28± 8.03)mg/(kg·h); 当试验装置水温为30℃时, 鳗鱼体质量由(10.62±1.14)g增加到(85.24±2.71)g, 其耗氧率由(176.17±9.91)mg/(kg h)下降至(124.96±12.08) mg/(kg·h)。
 |
| 图 5 南美洲鳗鲡体质量对耗氧率的影响 Fig. 5 Effects of body weight on oxygen consumption rate of A. rostrata |
对不同体质量的南美洲鳗鲡测定其耗氧率及耗氧量时, 相近规格的鳗鲡取其不同温度耗氧率均值进行分析, 其耗氧率与体质量的函数关系如图 6所示。耗氧率随体质量增加而降低, 耗氧率与体质量呈显著的负相关, 回归方程为: y = 158.99e–0.005x (R2 = 0.9957);耗氧量随体质量增加而增大, 耗氧量与体质量呈显著的正相关, 回归方程为: y = 0.2321x0.8334 (R2 = 0.9979), 鱼体重指数为0.8334。
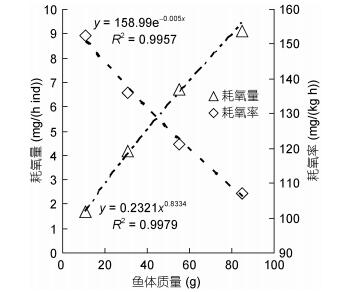 |
| 图 6 南美洲鳗鲡体质量对耗氧率的影响 Fig. 6 Effects of individual weight on oxygen consumption rate and oxygen consumption amount of A. rostrate |
温度对生物体的生命活动有着较为重要的影响, 鱼类属水栖变温动物, 更容易受到环境温度的影响, 温度主要通过对鱼类代谢反应速率起控制作用, 影响着生理生化过程, 温度不仅影响鱼类的所有代谢过程, 还会作用于鱼类整个生命周期(洪磊等, 2004;聂芬等, 2007)。一般来说, 在一定范围内, 较高的温度使鱼生长较快, 较低的温度生长较慢。低温下, 鱼类神经激素分泌少, 消化酶活性低, 鱼类死亡率较高; 鱼类耐受高温比耐受低温更为困难, 因为鱼体中的生物活性物质(蛋白质、酶等)在高温下会变性失活; 如果水温急剧升降, 鱼类因不能马上适应新的环境而导致死亡(龙华等, 2005)。实验表明:在水温高于29℃或低于13℃时, 南美洲鳗鲡黑仔出现明显的行为异常; 当水温超过36℃时, 南美洲鳗鲡黑仔开始死亡。而低水温下对于鳗鲡的影响是可逆的, 在冰水混合物状态0.1℃条件下保持了24h仍未出现死亡, 自然升温后全部恢复了正常, 低温对于鳗鲡的影响要小于高温。13—29℃为南美洲鳗鲡的适温范围, 在适温范围内水温越高, 生长越快, 养殖水温控制在28—29℃可以获得最快生长速度。
3.2 南美洲鳗鲡黑仔对非离子态氨和亚硝酸盐的耐受性氨是鱼虾蛋白质代谢的重要产物, 我们所测定的氨的含量是指氨的总量, 它包含非离子态氨(游离态氨)(NH3)和离子态铵(NH4+), 非离子态氨对水生生物是有毒的, 而离子态铵是无毒性的, 两者可以按照下式达到平衡: NH3 +H+⇌NH4+ (林祥日等, 1998)。水中过高的非离子态氨对鱼类体内酶的催化作用和细胞膜的稳定性产生严重影响, 并破坏排泄系统和渗透平衡(王彦波等, 2002)。亚硝酸盐是一种溶于水的盐类, 亚硝酸盐的来源有: (1)氨通过亚硝酸单胞菌的硝化作用, 被氧化为亚硝酸盐; (2)硝酸盐还原及浮游植物的代谢活动也产生亚硝酸盐(李波, 2010)。养殖水体中亚硝酸盐达到一定浓度时, 会对鱼类产生毒性, 主要表现在影响鱼类体内氧的运输、重要化合物的氧化, 甚至造成器官损坏(王彦波等, 2002)。现有的鳗鲡养殖品种, 许多学者对其氨氮和亚硝酸盐耐受性都有研究, 不同品种和其个体大小表现的耐受性均有一定差异。在本试验中, 非离子态氨和亚硝酸盐氮对均重(5.13±0.25)g的南美洲鳗鲡的安全浓度分别为1.22mg/L和6.17mg/L, 与其他鳗鲡相比其耐受力相对较强, 仅次于莫桑比克鳗鲡(A. mossambica)(见表 6);鳗鲡个体大小与其对非离子态氨和亚硝酸氮的耐受力呈正相关, 亚硝酸盐氮对欧洲鳗鲡和南美洲鳗鲡较大规格的鱼体安全浓度均高于其小规格鱼体。
| 毒力因子 | 物种 | 大小(g) | 半致死浓度(LC50)(mg/L) | 安全浓度(mg/L) | 参考文献 | |||
| 24h | 48h | 72h | 96h | |||||
| 非离子态氨 | 莫桑比克鳗鲡 | 1.25±0.01 | 14.25 | 11.93 | 10.68 | 9.04 | 2.51 | 樊海平等, 2008 |
| 美洲鳗鲡 | 2.0 | 5.6 | 5.1 | / | 4.5 | 0.45 | 樊海平等, 1997 | |
| 欧洲鳗鲡 | 7.2 | 4.26 | 3.27 | / | 2.19 | 0.219 | 潘小玲等, 1998 | |
| 中美洲鳗鲡 | 0.58±0.17 | 4.54 | 4.08 | 4.08 | 2.62 | 0.262 | 周立红等, 2013 | |
| 南美洲鳗鲡 | 10.13±0.25 | 32.14 | 15.97 | 12.58 | 12.22 | 1.22 | 本试验 | |
| 亚硝酸盐氮 | 莫桑比克鳗鲡 | 1.25±0.01 | 341.45 | 277.73 | 277.73 | 268.20 | 55.12 | 樊海平等, 2008 |
| 日本鳗鲡 | 3.6±1.3 | 460 | 299 | 245 | 205 | 20.5 | 山形阳一等, 1981 | |
| 欧洲鳗鲡 | 2.4±0.8 | 351 | 279 | 210 | 150 | 15.0 | ||
| 欧洲鳗鲡 | 1.3 | 100.0 | 84.1 | / | 26.6 | 2.66 | 潘小玲等, 1998 | |
| 南美洲鳗鲡 | 0.58±0.17 | 92.05 | 65.81 | 45.54 | 37.06 | 3.71 | 周立红等, 2013 | |
| 南美洲鳗鲡 | 10.13±0.25 | 105.40 | 75.54 | 64.60 | 61.68 | 6.17 | 本试验 | |
Modlin等(1997)认为鱼类的耗氧率直接或间接地反映出鱼类新陈代谢规律、生理和生存状况, 是有氧代谢强度的重要指标之一, 窒息点则是鱼类忍受低溶解氧的极限指标。杜宗君等(2013)研究表示影响鱼类窒息点的因素有很多, 除种类差异外, 还包括温度、体质量、CO2分压、pH等。在适温范围内, 一些鱼类的窒息点随水温的升高而升高, 这是因为随着水温升高, 耗氧率增大, 导致窒息点也随之升高, 如北方须鳅(Barbatula barbatula nuda)(王晓光等, 2018);水温恒定时, 窒息点和耗养率与体重负相关, 随着鱼体质量的增大, 窒息点降低, 耐低氧能力越强(刘立志等, 2013)。周立红等(2013)研究低氧对中美洲鳗鲡白仔苗的影响结果显示当鳗苗死亡50%时, 水中溶氧为0.70mg/L。本试验中均重10g、40g和160g的南美洲鳗鲡窒息点分别为0.98±0.25、0.46±0.06和0.32±0.02mg/L, 窒息点随着体重的增加而降低, 表现为规格越大的鳗鲡耐低氧能力越强, 符合鱼类窒息点的一般规律。
3.4 南美洲鳗鲡耗氧率的昼夜变化鱼类耗氧率的变化在一定程度上直接反映了其代谢的特征和规律。Clausen(1936)研究认为, 淡水鱼昼夜有规律的变化可能代表着自然环境中鱼类的生活周期, 耗氧大的时期一般为鱼类进食或活动旺盛时期。本试验结果表明, 南美洲鳗鲡耗氧率存在明显的昼夜节律性, 夜间耗氧量明显高于白天, 属于昼伏夜出型。闵志勇等(1998)对花鳗鲡和欧洲鳗鲡的耗氧率研究证明两者耗氧率也具有明显的昼夜变化规律。鳗鲡在养殖条件下投喂操作为白天时段, 故耗氧量高峰会出现在昼间; 夜间没有投喂操作, 20:00—3:00耗氧率波动幅度相对较小。本研究显示鳗鲡在8:00、16:00和19:00耗氧率出现峰值, 原因为该时间与鳗鲡的投喂时间吻合; 图 3显示为在出现峰值后耗氧率水平迅速下降并保持一段时间相对恒定, 这是由于鳗鲡在摄食后活动频率下降, 大部分会挂在饵料台上休息或者静卧在下层养殖水体中; 在8:00和16:00耗氧量高峰出现前, 耗氧率会陡然下降, 原因为饥饿状态下代谢水平低, 耗氧率相对较小(丁益群等, 2013)。根据南美洲鳗鲡耗氧率的波动和峰值出现的时段对养殖日常管理提出以下建议:每日投喂时间设置在8:00、16:00和19:00这些耗氧率高峰时段, 每日投喂2餐可选在8:00和19:00进行, 若进行3餐投喂, 16:00可进行少量投喂; 进行选别、药浴、运输等操作宜选在一天中耗氧率低峰期的7:00和14:00;投喂期间和凌晨4:00—6:00要防止缺氧。
3.5 南美洲鳗鲡耗氧率与水温的关系鱼类是变温动物, 环境温度是影响鱼类生长发育最重要的因子, 鱼体温的高低直接影响着体内生物化学的反应速率和生理活动强度, 因此水温在养殖管理中是一个重要监测指标。鱼类的耗氧率变化与水温密切相关, 当水温升高, 新陈代谢增强, 对氧的需求增加; 当水温降低, 新陈代谢减弱, 对氧的需求减少(龙华, 2005)。在适宜温度范围内, 温度越高, 鱼类的呼吸代谢水平越高, 耗氧量随之增大; 当水温超过适温范围后, 耗氧率反而下降(闫杰, 2014)。通常认为, 鱼类在耗氧率变幅较小的温度范围内, 其呼吸消耗的能量上升的倍率较小, 即体内能量贮存较多, 这样对鱼体生长有利, 可认为该条件下水温为该鱼类的最适生长水温。本试验中, 南美洲鳗鲡的耗氧率与水温有高度相关性, 在水温15—30℃范围内, 南美洲鳗鲡的耗氧率随温度上升而增大, 且不受体质量的影响。25—30℃耗氧率增速明显低于15—25℃, 表明在水温25—30℃, 南美洲鳗鲡的代谢活动相对稳定。结合本试验结果表明水温13—29℃为南美洲鳗鲡的适温范围, 因此综合分析认为, 25—29℃, 为其生长适宜水温区间。
3.6 南美洲鳗鲡耗氧率与体质量的关系鱼体质量大小会影响其耗氧率, 一般研究认为鱼类耗氧量与体重呈正相关性, 但耗氧率与体质量呈负相关性, 该规律在幼鱼阶段表现的尤为明显(乔德亮等, 2005)。鱼类耗氧率变化规律与机体发育规律存在以下联系:在胚胎发育和幼鱼生长阶段, 组织分化、器官形成、个体发育非常迅速, 这就导致小鱼相对耗氧率较高; 之后随着鱼体长大, 组织分化、器官形成等已经完成, 各器官组织发育速度相对减慢, 新陈代谢相对减弱, 所以耗氧率相对较低(董在杰, 1996)。目前为止, 很多学者都对鱼体质量和耗氧率之间的关系进行了深入细致的研究, 并发现耗氧量(M)和鱼体质量(W)之间通常呈幂函数关系, 即M=aWb, a、b为常数, b又被称为体重指数(Winberg et al, 1956)。对鱼类来讲, 其体重指数b为0.67—1.00, 大多数的鱼类b值都接近0.80 (林浩然, 1999)。本试验中, 在不同温度条件下, 南美洲鳗鲡的耗氧率均呈现出随鱼体质量增加而下降的现象, 耗氧率与体质量呈显著的负相关; 耗氧量随体质量增加而增大, 耗氧量与体质量呈显著的正相关, 该结果与国内外其他学者研究体质量与耗氧量关系得出结论一致。通过比较不同种类的鳗鱼的耗氧量(见表 7), 在同一水温条件下, 规格相同的鳗鲡耗氧量最大的是花鳗鲡, 美洲鳗和欧洲鳗次之, 然后是南美洲鳗鲡, 最小的是日本鳗鲡。在分析耗氧率和体重的关系时, 水温对耗氧率的作用随时存在且不可忽略, 在不同水温下耗氧率(耗氧量)和体重关系差异明显。
| 物种 | 温度(℃) | 关系式 | 相关系数 | 数据来源 |
| 北美洲鳗鲡 | 25 | M=0.56W0.64 | 0.94 | Degani et al, 1985 |
| 花鳗鲡 | 25 | M=0.396W1.0969 | 0.99 | Tarr et al, 1979 |
| 日本鳗鲡 | 25 | M=0.23W0.707 | 0.99 | Egusa, 1958 |
| 欧洲鳗鲡 | 18 | M=0.0038W1.291 | 0.92 | Degani et al, 1989 |
| 20 | M=0.2132W0.773 | 0.99 | ||
| 24 | M=0.4660W0.6781 | 0.99 | ||
| 27 | M=0.5583W0.6886 | 0.99 | ||
| 南美洲鳗鲡 | 15 | M=0.2004W0.8035 | 0.9999 | 本研究 |
| 20 | M=0.2075W0.8541 | 0.9960 | ||
| 25 | M=0.2600W0.8256 | 0.9934 | ||
| 30 | M=0.2639W0.8418 | 0.9965 |
(1) 南美洲鳗鲡的耗氧率存在明显的昼夜变化, 夜晚耗氧率高于白天耗氧率。
(2) 南美洲鳗鲡的耗氧率随水温上升而升高, 呈高度正相关性。水温25—29℃为南美洲鳗鲡的生长适宜水温。
(3) 在水温恒定条件下, 体质量与耗氧率、窒息点呈反比, 耗氧量与体重成正比, 窒息点随着体重的增加而降低, 表现为规格越大的鳗鲡耐低氧能力越强。
(4) 随着鳗鲡规格增大, 其对非离子氨和亚硝酸盐的耐受性在增强。
丁益群, 刘小玲, 雷思佳. 2013. 摄食水平和温度对日本鳗鲡耗氧率与ETS活性的影响. 华中农业大学学报, 32(5): 95-99 DOI:10.3969/j.issn.1000-2421.2013.05.017 |
山形阳一, 丹羽诚, 应杰. 1981. 论亚硝酸氮对鳗鱼的毒性. 国外水产, (2): 49-50 |
王彦波, 许梓荣, 邓岳松. 2002. 水产养殖中氨氮和亚硝酸盐氮的危害及治理. 饲料工业, 23(12): 46-48 DOI:10.3969/j.issn.1001-991X.2002.12.018 |
王晓光, 王兴兵, 寇凌霄, 等. 2018. 北方须鳅的耗氧节律、耗氧率和窒息点的研究. 水产科学, 37(3): 309-315 |
龙华. 2005. 温度对鱼类生存的影响. 中山大学学报:自然科学版, 44(S1): 254-257 |
乔德亮, 李思发, 凌去非, 等. 2005. 白斑狗鱼耗氧率和窒息点研究. 上海海洋大学学报, 14(2): 202-206 DOI:10.3969/j.issn.1004-7271.2005.02.019 |
刘立志, 赵文, 石振广. 2013. 体重和时间节律对俄罗斯鲟(Acipenser gueldenstaedti Brandt)幼鱼耗氧率和窒息点的影响. 生物学杂志, 30(3): 51-53 DOI:10.3969/j.issn.2095-1736.2013.03.051 |
刘俊杰, 袁华, 施福生, 等. 2017. 南美洲鳗鲡白仔鱼培育技术及成本分析. 科学养鱼, (1): 10-11 |
闫杰, 2014.流速、温度对麦穗鱼耗氧率的影响研究.南京: 南京农业大学硕士学位论文, 19-21
|
农业部渔业渔政管理局. 2018. 中国渔业统计年鉴2017. 北京: 中国农业出版社
|
杜宗君, 邹建平, 李正杰, 等. 2013. 红尾副鳅耗氧率和窒息点的初步研究. 四川动物, 32(5): 695-700 |
李波, 2010.氨氮和亚硝酸盐对黄颡鱼的毒性研究.武汉: 华中农业大学硕士学位论文
|
吴成业, 刘兆钧. 2004. 中国鳗业面临的问题与对策. 福建水产, (4): 16-19 |
闵志勇, 王艺磊. 1998. 花鳗鲡和欧洲鳗鲡耗氧率的研究. 集美大学学报(自然科学版), 3(1): 15-18 |
林浩然. 1999. 鱼类生理学. 广州: 广东高等教育出版社, 56-81, 103-105
|
林祥日, 黄少涛. 1998. 氨、亚硝酸盐对鳗和鳖的毒害. 鱼类病害研究, (1): 37-40 |
周立红, 关瑞章, 陈学豪. 2013. 中美洲原产地鳗鲡苗种对几种生态因子的耐受性研究. 水生态学杂志, 33(1): 58-64 |
姜礼燔. 1995. 第三讲鱼药的安全浓度评价方法. 中国渔业经济, (6): 27 |
洪磊, 张秀梅. 2004. 环境胁迫对鱼类生理机能的影响. 海洋科学进展, 22(1): 114-121 DOI:10.3969/j.issn.1671-6647.2004.01.017 |
洪万树. 1998. 美洲鳗鲡生物学. 海洋科学, 22(2): 34-35 |
聂芬, 石小涛, 李大鹏, 等. 2007. 拥挤胁迫对史氏鲟稚鱼血浆溶菌酶活性和补体水平的影响. 水生生物学报, 31(4): 581-584 DOI:10.3321/j.issn:1000-3207.2007.04.021 |
董在杰. 1996. 漫谈鱼类的耗氧率. 科学养鱼, (11): 26 |
樊海平, 林煜, 钟全福, 等. 2008. 莫桑比克鳗鲡养殖生物学主要特性研究. 渔业研究, (4): 7-12 |
樊海平, 潘小玲, 陈百悦, 等. 1997. 非离子态氨对美洲鳗鲡(Anguilla rostrata)的急性毒性试验. 福建水产, (1): 19-21 |
潘小玲, 陈百悦, 樊海平. 1998. 非离子态氨及亚硝酸盐对欧洲鳗鲡的急性毒性试验. 水产科技情报, 25(1): 20-23 |
Chan D K O, Woo N Y S, 1978. The respiratory metabolism of the Japanese eel, Anguilla japonica: effects of ambient oxygen, temperature, season, body weight, and hypophysectomy. General and Comparative Endocrinology, 35(2): 160-168 DOI:10.1016/0016-6480(78)90158-2 |
Clausen R G, 1936. Oxygen consumption in fresh water fishes. Ecology, 17(2): 216-226 DOI:10.2307/1931461 |
Degani G, Lee-Gallagher M, 1985. The relationship between growth, food conversion and oxygen consumption in developed and underdeveloped American eels, Anguilla rostrata Lesueur. Journal of Fish Biology, 27(5): 635-641 DOI:10.1111/jfb.1985.27.issue-5 |
Degani G, Gallagher M L, Meltzer A, 1989. The influence of body size and temperature on oxygen consumption of the European eel, Anguilla anguilla. Journal of Fish Biology, 34(1): 19-24 DOI:10.1111/jfb.1989.34.issue-1 |
Egusa S, 1958. On the oxygen consumption rate of the pond-cultured eel, Anguilla japonica. Jap J Ichthyol, 7(2-4): 24-56 |
Forster M E, 1981. Oxygen consumption and apnoea in the shortfin eel, Anguilla australis schmidtii. New Zealand Journal of Marine and Freshwater Research, 15(1): 85-90 DOI:10.1080/00288330.1981.9515900 |
Modlin R F, Froelich A J, 1997. Influence of temperature, salinity, and weight on the oxygen consumption of a laboratory population of Americamysis bahia (Mysidacea). Journal of Crustacean Biology, 17(1): 21-26 DOI:10.1163/193724097X00043 |
Tarr R J Q, Hill B J, 1979. Oxygen consumption, food assimilation and energy content of southern African elvers (Anguilla sp.). Aquaculture, 15(2): 141-150 |
Winberg G G, 1956. Rate of metabolism and food requirements of fishes. Fish Res Bd Can Transl Series, 194: 1960 |
 2019, Vol. 50
2019, Vol. 50


