中国海洋湖沼学会主办。
文章信息
- 赵振鲁, 刘甲星, 张跃环, 刘甜甜, 谭烨辉. 2019.
- ZHAO Zhen-Lu, LIU Jia-Xing, ZHANG Yue-Huan, LIU Tian-Tian, TAN Ye-Hui. 2019.
- 离体培养的虫黄藻(Symbiodinium voratum)对温度和光照的生理响应
- PHYSIOLOGICAL RESPONSES OF SYMBIODINIUM VORATUM TO TEMPERATURE AND LIGHT INTENSITY
- 海洋与湖沼, 50(2): 316-323
- Oceanologia et Limnologia Sinica, 50(2): 316-323.
- http://dx.doi.org/10.11693/hyhz20180900229
-
文章历史
- 收稿日期:2018-09-28
- 收修改稿日期:2018-11-20
2. 中国科学院大学 北京 100049;
3. 中山大学环境科学与工程学院 广州 510275
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of Environmental Science and Engineering, Sun Yat-sen University, Guangzhou 510275, China
虫黄藻(zooxanthellae)是一类黄褐色单细胞甲藻, 一般分为9个系群(A—I)(Pochon et al, 2010; Jeong et al, 2014), 可与珊瑚礁生态系统中的珊瑚、砗磲、海葵、海绵等宿主形成稳定的互惠共生关系。通常认为, 宿主为虫黄藻提供住处和保护, 虫黄藻将光合产物(如O2、糖、氨基酸、小分子肽)提供给宿主, 同时也从宿主的代谢产物中得到CO2、氮(N)和磷(P)等作为光合原料(Muscatine, 1990; Mieog et al, 2009)。研究发现, 虫黄藻可将高达90%的光合产物供应给宿主(Davies, 1984; Johnson, 2011)。作为珊瑚礁生态系统中最主要的初级生产者, 虫黄藻与宿主之间这种高效的营养供应和呼吸代谢关系确保共生体能够适应贫瘠的热带海洋环境。
珊瑚礁生态系统分布范围很广, 从赤道到南北纬35°以内(Jeong et al, 2014), 从海面到水下甚至百米。如此广阔的区域随之而来的是温度、光照、压强等环境因素的变化, 哪种环境条件最适宜生长, 不同光温条件下虫黄藻的生理响应如何, 这些都是值得探究的。尤其是当前环境压力下修复珊瑚礁的紧迫性, 珊瑚和砗磲幼体的培养和存活, 都必须从外界获得虫黄藻, 达到共生平衡。所以, 离体培养虫黄藻, 大量培养后提供给共生体幼虫是珊瑚礁恢复的关键技术, 也有利于更好地研究虫黄藻与宿主间特殊的共生机制。但是, 复杂的共生关系和分离后变化的生存环境增加了虫黄藻离体培养的难度。从最早对虫黄藻离体培养进行探究(Kawaguti, 1944), 到Ahles (1967)尝试对来自70个不同宿主的虫黄藻进行体外培养, 却发现只有不到25%的虫黄藻能够在ASP-8A培养基短暂存活。国内学者尝试用ASP-8A和f/2培养基进行虫黄藻离体培养, 细胞陆续死亡, 有的存活7天, 最长的存活15天(朱葆华, 2005; 沈城, 2014)。
离体培养的困难, 说明共生关系的复杂与共生体液的特殊, 生长条件限制着共生虫黄藻的分离培养。目前, 国外科学家探究过虫黄藻的热耐受性(Huertas et al, 2011; Takahashi et al, 2013; Chakravarti et al, 2017)、最适生长温度和光照(Klueter et al, 2017)以及光温条件对细胞周期的影响(Fujise et al, 2018), 国内尚未见探究生长条件的相关报道。而且, 目前获取藻类最适温度、适温范围的途径一般是根据实验室温度梯度培养实验得到或者现场监测, 但是由于实验结果和现场监测结果的离散性, 难以准确地定量表达出藻类的温度生态幅参数。
本实验通过虫黄藻分离培养(张跃环等, 2018), 关注温度和光照这两个藻类生长的关键因素, 借鉴温度生态幅模型(文世勇等, 2018), 希望通过探究其对温度和光照的生理响应, 获取最适生长温度, 为珊瑚幼体繁殖、砗磲苗培育提供更多的共生藻; 同时也可将虫黄藻分离培养的生理特性与共生状态下作比较, 更好地解释共生的必要性。
1 材料与方法 1.1 实验藻种实验用虫黄藻(Symbiodinium voratum, E型)分离自中国南海西沙海域的鳞砗磲(Tridacna squamosa), 经纯化后用f/2培养基(Guillard, 1975)培养, 保存于中国科学院南海海洋研究所。
1.2 藻类培养条件 1.2.1 虫黄藻温度梯度培养实验在光周期为12L:12D, 光照强度为(90±20)μE (张跃环等, 2018), 温度设为(20±0.8)、(23±0.8)、(27±0.8)℃的条件下, 采用f/2培养基培养7天。藻细胞初始浓度为5×103cells/mL, 培养体积为200mL。
1.2.2 虫黄藻光照梯度培养实验在光周期为12L:12D, 温度为(23±0.8)℃条件下, 光强梯度设0、50、100、150、200、300μE六个梯度, 采用f/2培养基培养8天。藻细胞初始浓度为5×103cells/mL, 培养体积为300mL。
以上实验样品均设三个重复, 每天摇动3—4次。
1.3 测定指标 1.3.1 细胞计数从实验的第1天开始, 每隔24h取0.1mL藻液于0.1mL浮游生物计数框, 在显微镜下计数得出细胞密度, 三个重复取平均后计算比生长速率(μ): μ=ln(N2/N1)/(t2-t1)。其中, μ为生长速率(/d), N2、N1分别是t2、t1时刻的细胞密度(cells/mL)。
1.3.2 PSⅡ原初光能转化效率(Fv/Fm)从实验的第2天开始, 每隔24h取5mL藻液, 先暗处理15min, 然后用Fluorometer荧光仪(FL3500)测定, 计算公式参照: Fv/Fm=(Fm-F0)/Fm。其中, F0为原初荧光值, Fm为最大荧光值, Fv为最大可变荧光值。
1.3.3 碳氮元素组成温度梯度实验培养期间, 于6、7天每瓶培养基各取10mL藻液, 过GF/F玻璃纤维滤膜(0.7μm, Whatman, 450℃灼烧5h), 过滤后的滤膜于-20℃冷冻保存, 实验结束后统一酸化、干燥处理, 再用元素分析仪(Elemental Analyzer, EA3000)测定其碳氮元素组成, 并计算碳氮比。
1.3.4 单位细胞内叶绿素a含量光照梯度实验培养期间, 于0、2、4、6、8天每瓶培养基各取2mL藻液, 过GF/F玻璃纤维滤膜(0.7μm, Whatman)收集细胞, 过滤后的滤膜用中性滤纸吸干水分后用锡箔纸包裹标记, -20℃冷冻保存, 实验结束后统一分析。叶绿素a用萃取荧光法测定, 在低温避光的条件下将叶绿素滤膜于10mL浓度为90%的丙酮中萃取24h, 在台式离心机上以3000r/min的转速离心10min, 取上清液于Turner Design 10-AU下测定叶绿素a浓度, 再依据样品对应的细胞密度换算为单位细胞含量。
1.4 数据处理实验数据以“平均值±标准差”(Mean±SD)表示(n=3), 以培养指数生长期数据作统计分析, 统计软件采用PASW Statistics 18.0 (以P < 0.05判断显著性, 以P < 0.01判断极显著性), 模型拟合采用数据分析平台OriginPro 9.2, 实验结果用Sigmaplot 10.0作图。
2 结果 2.1 虫黄藻对温度的生理响应 2.1.1 生长曲线与生长速率结果显示, 在2—7天, 20、23和27℃培养下虫黄藻的平均生长速率分别是0.395、0.459和0.270/d (图 2); 23℃组虫黄藻生长速率极显著高于其余两组(P < 0.01); 20℃组虫黄藻的平均生长速率极显著高于27℃组(P < 0.01)。温度对虫黄藻生长速率的影响极显著(P < 0.01)。
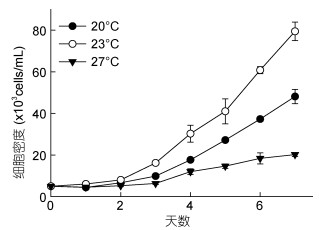 |
| 图 1 不同温度对虫黄藻细胞密度的影响 Fig. 1 Effect of different temperatures on the cell density of Symbiodinium voratum |
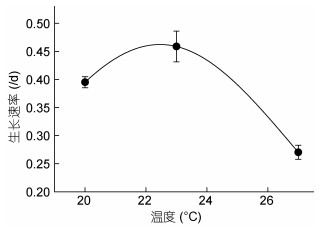 |
| 图 2 虫黄藻生长速率与温度的关系曲线 Fig. 2 Relationship between the growth rate of Symbiodinium voratum and temperature |
根据图 2, 并结合藻类生长遵循的谢尔福德耐受性定律, 利用OriginPro 9.2模型拟合, 得到虫黄藻生长速率与温度之间的关系响应模型[公式(1)]、及其对应的模型参数。
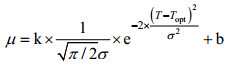 (1)
(1)其中, μ为生长速率(/d); T为温度(℃); Topt为藻类最适生长温度(℃); σ为藻类对温度的耐受度; k、b为参数。
藻类的最适温度是在其他环境条件不变的情况下, 生长处于最佳状态的温度。藻类的适温范围是指藻类处于较好生长状态的温度范围。根据已建立的生态幅定量表达公式(1), 获取虫黄藻的最适温度Topt为22.56℃、适温范围为16.72—28.40℃(适宜藻类生长的温度上限和下限)、σ=5.84℃、k=2.06、b=0.19、调整R2=0.94。
2.1.3 温度对虫黄藻Fv/Fm值的影响在2—7天, 27℃组Fv/Fm值始终保持高值趋势(图 3), 20℃组与23℃组Fv/Fm的数值和变化趋势非常相似。结果显示, 在20、23和27℃培养下虫黄藻Fv/Fm的平均值分别是0.509、0.507和0.527, 27℃组Fv/Fm值极显著高于其余两组(P < 0.01), 而20℃组与23℃组之间差异不显著(P > 0.05)。
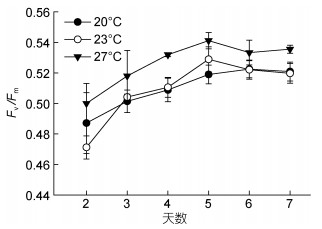 |
| 图 3 不同温度下虫黄藻Fv/Fm随时间的变化 Fig. 3 Fv/Fm of Symbiodinium voratum in different temperatures from Day 2 to Day 7 |
在第6、7天收集藻细胞, 测定其碳氮比(C/N) (表 1)。结果表明:随时间变化, 每个温度组的C、N含量(%)在第7天都比第6天略有增长; 相比而言, C增加得更多, 因为每个温度组的C/N比值在第7天都比第6天略高, 范围在5.73—9.97之间。随温度变化, 23℃组的C含量(%)、N含量(%)在第6、7天均高于同期其他两组; 27℃组的C/N比值在第6、7天分别为7.57、9.97, 均高于同期其他两组。
| 天数 | 温度组(℃) | 碳平均含量(%) | 氮平均含量(%) | 碳氮元素质量比(C/N) |
| 6 | 20 | 18.15 | 3.17 | 5.73 |
| 23 | 21.89 | 3.33 | 6.58 | |
| 27 | 14.38 | 1.90 | 7.57 | |
| 7 | 20 | 24.14 | 3.55 | 6.80 |
| 23 | 31.97 | 3.93 | 8.14 | |
| 27 | 22.75 | 2.28 | 9.97 |
由图 4可知, 在2—7天, 虫黄藻在没有光照的条件下, 细胞密度逐渐下降, 平均生长速率为负值(图 5)。50μE光照下, 细胞开始分裂增殖, 平均生长速率为0.168/d (图 5)。100、150、200μE光照下, 细胞的生长曲线很相似(图 4), 平均生长速率分别为0.364、0.378、0.355/d (图 5), 其中150μE光照下生长速率最大, 三者之间差异不显著(P > 0.05)。300μE光照下, 生长曲线处于100、150、200μE的下方(图 4), 生长受到抑制, 平均生长速率为0.324/d (图 5), 显著高于50μE光照下的生长速率(P < 0.05), 但低于100、150、200μE光照下的生长速率, 其中与100、200μE组差异不显著(P > 0.05), 与150μE组差异显著(P < 0.05)。由此可见, 光强对虫黄藻生长速率有极显著影响(P < 0.01)。
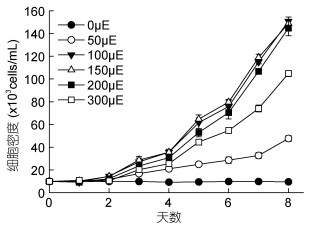 |
| 图 4 不同光照对虫黄藻细胞密度的影响 Fig. 4 Effect of different light intensities on the cell density of Symbiodinium voratum |
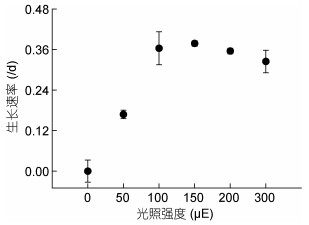 |
| 图 5 虫黄藻生长速率与光照的变化趋势 Fig. 5 The relation between growth rate of Symbiodinium voratum and light intensity |
为比较6个光照处理组虫黄藻单位细胞内的叶绿素含量, 在光照培养实验期间, 于0、2、4、6、8天同时测定了叶绿素浓度, 并结合不同光照条件下当日细胞密度换算为单位细胞内叶绿素含量(图 6)。光强从0—50μE, 虫黄藻单位细胞内叶绿素a含量随着光照强度的增大而增加。结果显示:各光照条件下单位细胞内叶绿素a含量分别为3.12×10–3、6.12×10–3、2.24×10–3、1.95×10–3、1.51×10–3、1.21×10–3pg/cell, 50μE组极显著高于其他组(P < 0.01); 100μE组虽然高于150、200、300μE三组, 但与150μE组差异不显著(P > 0.05), 与200、300μE两组差异极显著(P < 0.01)。光强对单位细胞内叶绿素a含量有极显著的影响(P < 0.01)。
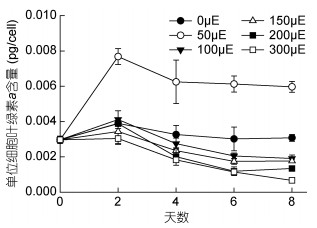 |
| 图 6 不同光照处理组虫黄藻单位细胞内叶绿素a含量 Fig. 6 Chl a content per cell of Symbiodinium voratum at different light intensities |
光照实验培养期间, 于0、2、4、6、8天测定了虫黄藻Fv/Fm值(图 7)。无光组, Fv/Fm值在6种光照条件中较低, 但不是最低, 最低的是300μE处理组; 光强50μE, Fv/Fm值在6组中最高。对指数生长期Fv/Fm值作统计分析, 0、50、100、150、200、300μE组Fv/Fm值分别为0.444、0.589、0.484、0.476、0.467、0.370; 50μE组Fv/Fm值显著高于其余5组(P < 0.05); 100μE组Fv/Fm值虽然高于150、200、300μE三组, 但与150、200μE两组差异不显著(P > 0.05), 与300μE组差异极显著(P < 0.01)。光强对虫黄藻Fv/Fm值有极显著影响(P < 0.01)。对Fv/Fm与单位细胞内叶绿素a含量作Pearson相关性分析, 发现两者存在显著正相关关系(R=0.33, P < 0.05)。
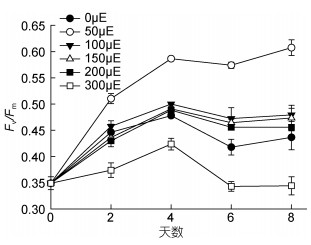 |
| 图 7 不同光照处理组虫黄藻Fv/Fm随时间的变化 Fig. 7 Fv/Fm of Symbiodinium voratum under different light intensities during the experiment period |
珊瑚礁生态系统分布区的水温一般在18—36℃之间(郭丰, 2010), 但生物正常生长和最适生长又有区别。根据温度梯度培养实验的结果, 借助虫黄藻生态幅定量表达公式(1), 可知22.56℃是E型虫黄藻最适生长温度, 最大生长速率为0.470/d。有研究利用NO3–与NH4+两种氮源分别培养虫黄藻, 生长速率分别为0.41和0.48/d (Taguchi et al, 2001), 速率差异可能与虫黄藻利用NO3–需要两步还原有关(Dagenais-Bellefeuille et al, 2013)。本实验的结果在两者之间。
Klueter等(2017)发现26℃较适宜虫黄藻(A, B, D型)生长, 比本实验中E型虫黄藻的22.56℃要高。这是E型虫黄藻特殊之处, 因为最初人们关注虫黄藻源于珊瑚礁, 而普遍印象中珊瑚礁存在于温度较高的热带和亚热带海域, 所以尽管已发现9种虫黄藻(A—I), 但人们一度认为只有六种虫黄藻(A—D, F, G)可以与造礁石珊瑚共生(LaJeunesse, 2001; 董志军等, 2008; 邱大俊, 2011)。直到从济州岛的穴孔珊瑚(Alveopora japonica)中分离出E型虫黄藻, 人们逐渐接受E型虫黄藻也可以与造礁石珊瑚共生的观点(Jeong et al, 2012)。能够生长在较高纬度(23°—35°N), 或许是因为E型虫黄藻的最适生长温度低于其他类型虫黄藻的最适生长温度。类似地, S. psygmophilum (B)既可以生活在热带海洋(LaJeunesse et al, 2012; Lee et al, 2014), 也可以生活在温带海洋(Thornhill et al, 2008)。
Fv/Fm是反映植物受胁迫时光合作用变化的指标, 表征植物潜在最大光能转化效率, 在高等植物的逆境生理研究中应用广泛(李晓等, 2006), 同时也应用于造礁石珊瑚光生理研究中(董志军, 2008)。从本实验三个温度梯度来看, 随温度升高, Fv/Fm值升高, 说明在该温度范围内并未受到胁迫, 温度耐受性模型给出的适温范围也证实这一点(见2.1.2)。如Pearson相关性分析显示, Fv/Fm与单位细胞内叶绿素a含量存在显著正相关关系(见2.2.3), Fv/Fm值升高与PSⅡ的发育有关。本实验中虫黄藻在27℃下Fv/Fm高于23℃下, 与Takahashi等(2013)的研究结果相似, 他们发现E型虫黄藻的Fv/Fm值在28℃时的Fv/Fm值略高于25℃, 但25—28℃时, Fv/Fm值的范围在0.36—0.45之间, 低于本实验的结果。同为甲藻的东海原甲藻和米氏凯伦藻也有相同现象(沈盎绿, 2014), 它们的最适光合作用温度(24℃和28℃)要高于最适生长温度(20℃和24℃)。产生这种差异的原因可能是藻类生长受到的影响因素不仅包括光合作用还有其他新陈代谢过程(暗呼吸速率、有机碳通量、蛋白质和其他有机分子的合成等)(Davison, 1991)。一般认为, 温度直接影响生物有机体的新陈代谢速率, 在适温范围内, 当温度升高时, 新陈代谢速率随之加快(沈国英等, 2010)。
碳氮比, 是指有机物中碳的总含量与氮的总含量的比值。在指数生长期, 随着细胞生长, 有机物质不断合成, 所以每个温度组的C、N含量(%)在第7天都比第6天略有增长, 但从C/N比值可以看出C增加得更多, 这与Jing等(2017)实验的结果不同, 东海原甲藻在对数期连续两天的C、N、C/N比值都没有发生显著变化。本实验中C/N比值在5.73—9.97之间, 与Redfield C/N比值(106:16)相接近(Redfield, 1960)。23℃组的C、N含量最高, 说明该温度利于有机物质的积累, 与22.56℃是最适生长温度相印证(见3.1)。27℃组的C、N含量(%)不是最高, 但C/N比值最高, 推测原因是27℃时虫黄藻新陈代谢旺盛, 不利于氨基酸、蛋白质等含氮有机物的转化、积累。
3.2 虫黄藻生理参数对光强变化的响应分析光照梯度培养实验的结果显示, 虫黄藻的生长速率对光强的响应并不呈正态分布。所以, 本文并未建立光强耐受性模型。如2.2.1, 虫黄藻在无光条件下不生长, 并且会死亡、分解, 这与在长江口探究光强对浮游植物生长的结果一致(方涛等, 2006), 推测本实验虫黄藻若在无光中继续培养下去会彻底死亡。光强100、150、200μE三组的生长速率差异不显著, 而300μE下虫黄藻生长受到抑制(图 4, 图 5)。综上, E型虫黄藻光强的适宜范围为100—200μE。在光强影响虫黄藻(B, C, D)细胞周期和光合性能的实验中, 发现高低光强(262与80μE)下, 细胞周期无明显差异(Fujise et al, 2018), 或许这也是E型虫黄藻光强广适性的原因。此外, 随着培养光照强度的升高, 藻种的生长速率呈现“先升后降”的变化趋势, 表明过低和过高的光照强度都不利于实验藻种的生长, 只有在合适的光照强度下才最有利于生长, 这个结果与谢尔福德耐受性定律相一致(Shelford, 1911)。
本实验测定了虫黄藻单位细胞内叶绿素a含量和Fv/Fm。6个光照实验组中, 低光下(50μE), 单位细胞内叶绿素a含量和Fv/Fm均很高; 100、150、200μE时, 这两个参数依次降低; 300μE时, 单位细胞内叶绿素a含量和Fv/Fm在6组内最低。光强对植物的叶绿素合成起到调控作用, 一般来说, 在适宜的光照强度范围内, 光照强度越大, 单位细胞中的捕光色素含量就越低(Goericke et al, 1998; Henriksen et al, 2002; Rodríguez et al, 2006; 李汉生等, 2014)。无光时(0μE), 光合系统不发育, Fv/Fm较低。低光下(50μE), 光合系统因光的存在而开始发育, 单位细胞内叶绿素a含量增加和Fv/Fm升高, 虫黄藻通过增加叶绿素含量及类囊体膜面积的方式(Falkowski et al, 1981; Stambler, 1998), 来增加对有限光能的吸收。而高光下(300μE), 单位细胞内叶绿素a含量和Fv/Fm在实验组内最低, 虫黄藻长势又弱于100、150、200μE三组, 推测原因是过强的光照对光合系统产生了抑制。众多研究结果都发现, 光照过强会使虫黄藻的Fv/Fm迅速下降, 这种变化是用来保护光合器官的, 即通过非光化学淬灭将过多的激发能转变为荧光和热能(Gorbunov et al, 2001; Iglesias-Prieto et al, 2004; Rodrigues et al, 2008; 黄玲英等, 2011)。如果光合作用受到抑制, 细胞制造有机物能力减弱, 直接影响细胞生长和分裂。
4 结论本实验实际观测结果中, E型虫黄藻在23℃下生长速率最大, 有机碳(C)、氮(N)积累最多, 借助生态幅定量表达公式(1), 得到最适生长温度22.56℃, 最大生长速率为0.470/d。虫黄藻在27℃下Fv/Fm值高于其余两组(20和23℃), 但该温度下生长速率并不是最大, 原因是27℃下虫黄藻新陈代谢较快, 消耗能量较多, 用于生长的能量较少。E型虫黄藻的光强的适宜范围为100—200μE, 光强生态幅比较宽, 但仍符合谢尔福德耐受性定律。可通过两种方式应对低光强:提高单位细胞内叶绿素a含量; 提高Fv/Fm。
本实验只是虫黄藻对温度和光照生理响应的初步研究, 未来仍有许多工作要深入开展, 如更多类型的虫黄藻、更多的影响因素(CO2、盐度、pH、营养盐、微生物群落)有待于考虑, 并进一步研究其生理变化机制等。
致谢 感谢中国科学院南海海洋研究所喻子牛研究员课题组为实验提供藻种, 感谢黄小平研究员为实验提供帮助。
文世勇, 刘希真, 王紫竹, 等. 2018. 不同光照条件下米氏凯伦藻和东海原甲藻生长的温度生态幅. 生态学报, 38(14): 5187-5194 |
方涛, 李道季, 余立华, 等. 2006. 光照和营养盐磷对微型及微微型浮游植物生长的影响. 生态学报, 26(9): 2783-2790 DOI:10.3321/j.issn:1000-0933.2006.09.002 |
朱葆华, 2005.几种腔肠动物共生藻的离体培养及其相关的生理学研究.青岛: 中国科学院海洋研究所博士学位论文, 23-38
|
李晓, 冯伟, 曾晓春. 2006. 叶绿素荧光分析技术及应用进展. 西北植物学报, 26(10): 2186-2196 DOI:10.3321/j.issn:1000-4025.2006.10.037 |
李汉生, 徐永. 2014. 光照对叶绿素合成的影响. 现代农业科技, (21): 161-164 DOI:10.3969/j.issn.1007-5739.2014.21.101 |
邱大俊, 2011.南海珊瑚礁生态系统甲藻分子生态学研究.北京: 中国科学院研究生院博士学位论文, 3-4
|
沈城, 2014.温度胁迫对珊瑚共生虫黄藻超微结构及相关基因表达的影响.湛江: 广东海洋大学硕士学位论文, 30-36
|
沈国英, 施并章, 2010.海洋主要生态因子及其对生物的作用.见: 沈国英, 黄凌风, 郭丰等.海洋生态学. 3版.北京: 科学出版社, 47-65
|
沈盎绿, 2014.东海原甲藻和米氏凯伦藻种间竞争对海水温度变化的响应机制.上海: 华东师范大学博士学位论文, 30-41
|
张跃环, 肖述, 张扬等, 2018-01-12.一种砗磲虫黄藻的分离纯化、离体培养及规模化生产方法: 中国, 201710979322.9
|
郭丰, 2010.珊瑚礁.见: 沈国英, 黄凌风, 郭丰等.海洋生态学. 3版.北京: 科学出版社, 233-239
|
黄玲英, 余克服, 施祺, 等. 2011. 三亚造礁石珊瑚虫黄藻光合作用效率的日变化规律. 热带海洋学报, 30(2): 46-50 DOI:10.3969/j.issn.1009-5470.2011.02.007 |
董志军, 2008.中国南海造礁石珊瑚共生藻的分子系统分类和遗传多样性研究.北京: 中国科学院研究生院博士学位论文, 72-82
|
董志军, 黄晖, 黄良民, 等. 2008. 虫黄藻的分类和遗传多样性研究进展. 海洋通报, 27(3): 95-101 DOI:10.3969/j.issn.1001-6392.2008.03.015 |
Ahles M D, 1967. Some aspects of the morphology and physiology of Symbiodinium microadriaticum. New York, USA: Doctor Dissertation of Fordham University, 173
|
Chakravarti L J, Beltran V H, van Oppen M J H, 2017. Rapid thermal adaptation in photosymbionts of reef-building corals. Global Change Biology, 23(11): 4675-4688 DOI:10.1111/gcb.2017.23.issue-11 |
Dagenais-Bellefeuille S, Morse D, 2013. Putting the N in dinoflagellates. Frontiers in Microbiology, 4: 369 |
Davies P S, 1984. The role of zooxanthellae in the nutritional energy requirements of Pocillopora eydouxi. Coral Reefs, 2(4): 181-186 |
Davison I R, 1991. Environmental effects on algal photosynthesis:temperature. Journal of Phycology, 27(1): 2-8 DOI:10.1111/j.0022-3646.1991.00002.x |
Falkowski P G, Dubinsky Z, 1981. Light-shade adaptation of Stylophora pistillata, a hermatypic coral from the Gulf of Eilat. Nature, 289(5794): 172-174 DOI:10.1038/289172a0 |
Fujise L, Nitschke M R, Frommlet J C et al, 2018. Cell cycle dynamics of cultured coral endosymbiotic microalgae (Symbiodinium) across different types (species) under alternate light and temperature conditions. Journal of Eukaryotic Microbiology, 65(4): 505-517 DOI:10.1111/jeu.2018.65.issue-4 |
Goericke R, Montoya J P, 1998. Estimating the contribution of microalgal taxa to chlorophyll a in the field-variations of pigment ratios under nutrient- and light-limited growth. Marine Ecology Progress Series, 169(4): 97-112 |
Gorbunov M Y, Kolber Z S, Lesser M P et al, 2001. Photosynthesis and photoprotection in symbiotic corals. Limnology and Oceanography, 46(1): 75-85 DOI:10.4319/lo.2001.46.1.0075 |
Guillard R R L, 1975. Culture of phytoplankton for feeding marine invertebrates. In:Smith W L, Chanley M H eds. Culture of Marine Invertebrate Animals. Boston, MA:Springer, 26 |
Henriksen P, Riemann B, Kaas H et al, 2002. Effects of nutrient-limitation and irradiance on marine phytoplankton pigments. Journal of Plankton Research, 24(9): 835-858 DOI:10.1093/plankt/24.9.835 |
Huertas I E, Rouco M, López-Rodas V et al, 2011. Warming will affect phytoplankton differently:evidence through a mechanistic approach. Proceedings of the Royal Society B:Biological Sciences, 278(1724): 3534-3543 DOI:10.1098/rspb.2011.0160 |
Iglesias-Prieto R, Beltran V H, LaJeunesse T C et al, 2004. Different algal symbionts explain the vertical distribution of dominant reef corals in the eastern Pacific. Proceedings of the Royal Society B:Biological Sciences, 271(1549): 1757-1763 DOI:10.1098/rspb.2004.2757 |
Jeong H J, Lee S Y, Kang N S et al, 2014. Genetics and morphology characterize the dinoflagellate Symbiodinium voratum, n. sp. (Dinophyceae) as the sole representative of Symbiodinium Clade E. Journal of Eukaryotic Microbiology, 61(1): 75-94
|
Jeong H J, Yoo Y D, Kang N S et al, 2012. Heterotrophic feeding as a newly identified survival strategy of the dinoflagellate Symbiodinium. Proceedings of the National Academy of Sciences of the United States of America, 109(31): 12604-12609 DOI:10.1073/pnas.1204302109 |
Jing X L, Lin S J, Zhang H et al, 2017. Utilization of urea and expression profiles of related genes in the dinoflagellate Prorocentrum donghaiense. PLoS One, 12(11): e0187837 DOI:10.1371/journal.pone.0187837 |
Johnson M D, 2011. The acquisition of phototrophy:adaptive strategies of hosting endosymbionts and organelles. Photosynthesis Research, 107(1): 117-132 DOI:10.1007/s11120-010-9546-8 |
Kawaguti S, 1944. On the physiology of reef corals VI. Palao Tropical Biology Station Studies 2: 675-679
|
Klueter A, Trapani J, Archer F I et al, 2017. Comparative growth rates of cultured marine dinoflagellates in the genus Symbiodinium and the effects of temperature and light. PLoS One, 12(11): e01887707 |
LaJeunesse T C, 2001. Investigating the biodiversity, ecology, and phylogeny of endosymbiotic dinoflagellates in the genus Symbiodinium using the ITS region:in search of a "species" level marker. Journal of Phycology, 37(5): 866-880 DOI:10.1046/j.1529-8817.2001.01031.x |
LaJeunesse T C, Parkinson J E, Reimer J D, 2012. A genetics-based description of Symbiodinium minutum sp. nov. and S. psygmophilum sp. nov. (Dinophyceae), two dinoflagellates symbiotic with Cnidaria. Journal of Phycology, 48(6): 1380-1391
|
Lee S Y, Jeong H J, Kang N S et al, 2014. Morphological characterization of Symbiodinium minutum and S. psygmophilum belonging to clade B. Algae, 29(4): 299-310 |
Mieog J C, Olsen J L, Berkelmans R et al, 2009. The roles and interactions of symbiont, host and environment in defining coral fitness. PLoS One, 4(7) |
Muscatine L, 1990. The role of symbiotic algae in carbon and energy flux in reef corals. In:Dubinsky Z ed. Ecosystems of the World:Coral Reefs. New York:Elsevier, 75 |
Pochon X, Gates R D, 2010. A new Symbiodinium clade (Dinophyceae) from soritid foraminifera in Hawai'i. Molecular Phylogenetics & Evolution, 56(1): 492-497 |
Redfield A C, 1960. The biological control of chemical factors in the environment. Science Progress, 11: 150-170 |
Rodríguez F, Chauton M, Johnsen G et al, 2006. Photoacclimation in phytoplankton:implications for biomass estimates, pigment functionality and chemotaxonomy. Marine Biology, 148(5): 963-971 DOI:10.1007/s00227-005-0138-7 |
Rodrigues L J, Grottoli A G, Lesser M P, 2008. Long-term changes in the chlorophyll fluorescence of bleached and recovering corals from Hawaii. Journal of Experimental Biology, 211(15): 2502-2509 DOI:10.1242/jeb.012369 |
Shelford V E, 1911. Physiological animal geography. Journal of Morphology, 22(3): 551-618 DOI:10.1002/(ISSN)1097-4687 |
Stambler N, 1998. Effects of light intensity and ammonium enrichment on the hermatypic coral Stylophora pistillata and its zooxanthellae. Symbiosis, 24(1): 127-146 |
Taguchi S, Kinzie R A Ⅲ, 2001. Growth of zooxanthellae in culture with two nitrogen sources. Marine Biology, 138(1): 149-155 DOI:10.1007/s002270000435 |
Takahashi S, Yoshioka-Nishimura M, Nanba D et al, 2013. Thermal acclimation of the symbiotic alga Symbiodinium spp. alleviates photobleaching under heat stress. Plant Physiology, 161(1): 477-485 |
Thornhill D J, Kemp D W, Bruns B U et al, 2008. Correspondence between cold tolerance and temperate biogeography in a western Atlantic Symbiodinium (Dinophyta) lineage. Journal of Phycology, 44(5): 1126-1135 DOI:10.1111/jpy.2008.44.issue-5 |
 2019, Vol. 50
2019, Vol. 50


