中国海洋湖沼学会主办。
文章信息
- 王斌, 武敏敏, 胡利腾, 张建设. 2019.
- WANG Bin, WU Min-Min, HU Li-Teng, ZHANG Jian-She. 2019.
- 太平洋真宽水蚤(Eurytemora pacifica) CRH-BP基因克隆及表达分析
- cDNA CLONING AND EXPRESSION OF CRH-BP GENE OF COPEPOD EURYTEMORA PACIFICA
- 海洋与湖沼, 50(1): 210-219
- Oceanologia et Limnologia Sinica, 50(1): 210-219.
- http://dx.doi.org/10.11693/hyhz20180500139
-
文章历史
- 收稿日期:2018-05-31
- 收修改稿日期:2018-09-20
促肾上腺激素释放激素结合蛋白(CRH-BP)又称促肾上腺激素释放因子结合蛋白(CRF-BP), 是CRH家族一员。CRH家族在应激反应中发挥重要作用, 依靠CRH→受体→+G蛋白→cAMP→PKA→功能蛋白表达→生物学效应这一信使途径在应激反应中发挥作用, 调节下丘脑-垂体-肾上腺轴(HPA)和整个应激系统(Lee et al, 2008)。Behan等分离出与CRH有很高亲和力的CRH-BP, 认为CRH-BP通过与游离的CRH结合调节CRH利用率从而发挥作用(Behan et al, 1989), CRH-BP基因最早克隆自哺乳动物(Linton et al, 1988), 多种脊椎动物与无脊椎动物CRH-BP及其同源基因也得到鉴定(Seasholtz et al, 2002; Huising et al, 2005)。研究发现不同物种的CRH-BP序列结构在进化过程中高度保守, 这种结构特征的保持对于其生物活性的发挥是很有必要的(Westphal et al, 2006)。脊椎动物中, CRH-BP抑制CRH释放而被视为CRH信号通路的拮抗剂(Chan et al, 2000)。此后也有报道认为CRH-BP对HPA轴和应激系统具有一定的调节功能(Seasholtz et al, 2001)。此外, CRH-BP在啮齿类和灵长类脑中都有表达, 许多研究也表明CRH-BP对大脑中枢起调节作用(Westphal et al, 2006)。Burrows等(2001)对转基因小鼠研究中发现, 在抑制性应激条件下, 应激系统做出应答, CRH-BP表达量代偿性增加, 从而增强自主活动能力。无脊椎动物中尤其是昆虫中CRH基因研究较多, 对CRH-BP相关研究有限。蜜蜂CRH-BP全序列分析认为其高度保守, 且昆虫CRH家族中利尿剂激素(DH-Ⅰ)极有可能亲和CRH-BP (Liu et al, 2011)。日本虎斑猛水蚤CRH-BP的研究认为CRH-BP基因高度保守, CRH-BP基因活性与个体发育程度及性别有关联, 参与应激反应, 能够缓解急性应激维持内环境稳定(Lee et al, 2008)。作为应激反应中重要的调控因子, 对环境胁迫下CRH-BP基因表达特征的研究是很有必要的。
太平洋真宽水蚤广泛分布于太平洋东部海域, 是舟山海域的季节性优势浮游动物之一。其生活的近岸和潮间带区域水温、盐度和pH等环境因子变动较大, 成为影响桡足类生长、存活和发育的主要环境因子(吴利等, 2011; 李光福, 2015)。目前, 对太平洋真宽水蚤CRH-BP基因的克隆及环境胁迫下的基因表达相关研究还未见报道。本研究采用RACE方法获得太平洋真宽水蚤CRH-BP基因全长序列, 并对序列的各种生物学特征进行分析, 并进一步分析了其在盐度、温度及海水酸化等生态因子急性胁迫下的表达特征, 为阐释太平洋真宽水蚤CRH-BP在应对环境变化过程中的功能提供依据。
1 材料与方法 1.1 实验材料 1.1.1 桡足类培养本实验所用太平洋真宽水蚤是使用小型浮游生物拖网, 拖取自浙江省舟山市舟山群岛长峙岛附近海域。拖取样品后暂养于10L塑料桶内, 于1h内运回实验室, 筛选纯化后于培养箱中驯化培养, 实验用海水为煮沸后的0.45μm膜过滤海水, 实验培养温度为(20.0±0.5)℃, 海水盐度为30.0, 光照条件为12L:12D, 培养过程中24h持续充氧, 定期投喂饵料, 本实验选取饵料为海水小球藻。正式实验时, 选取子代中外观形态与附肢完整, 生命活性强的健康太平洋真宽水蚤成体作为实验对象。
海水小球藻购自上海光语生物科技有限公司藻种库, 在f/2培养液、温度(20.0±0.5)℃、盐度28.0±0.5、光暗周期12L:12D条件下培养至藻类指数生长期时实验备用。
1.1.2 实验样品处理盐度胁迫组选择10.0、30.0和45.0三个盐度组, 每个处理组设3个平行, 0.45μm膜过滤海水加海水晶与超纯水分别配置45.0与10.0两组海水。每个处理每个平行分别挑选驯化后的健康个体100只置于1L烧杯内进行实验, 分别于胁迫后0、3、6、12、24、48h取水蚤个体, 液氮保存, 用于RNA的提取, 每个时间点取10—15只。实验培养温度为(20.0±0.5)℃, 光照条件为12L:12D。
温度胁迫组实验选择(15.0±0.5)℃、(20.0±0.5)℃和(25.0±0.5)℃三个温度组, 三个培养箱设置所需温度, 每个温度处理下设置三个平行。每个处理每个平行分别挑选驯化后的健康个体100只置于1L烧杯内进行实验, 分别于胁迫后0、3、6、12、24、48h取水蚤个体, 液氮保存, 用于RNA的提取, 每个时间点取10—15只。实验所用海水为0.45μm膜过滤海水, 光照条件为12L:12D。
海水酸化组实验选择pH分别为6.20、7.30、8.10, 每个处理组设3个平行。过滤海水的pH在8.10左右, 用1mol/L HCl调节出实验组所需pH值, 配制过程中要注意不断搅匀。每个处理每个平行分别挑选驯化后的健康个体100只置于1L烧杯内进行实验, 分别于胁迫后0、3、6、12、24、48h取水蚤个体, 液氮保存, 用于RNA的提取, 每个时间点取10—15只。实验培养温度为20.0±0.5℃, 所用海水为0.45μm膜过滤海水, 光照条件为12L:12D。
处理后的实验样品由液氮速冻并保存于–80℃超低温冰箱。每组对照组中随机选取10只太平洋真宽水蚤作为克隆材料, 选取盐度、温度及pH不同梯度组胁迫处理后的太平洋真宽水蚤总RNA作为qRT-PCR实验材料。每个实验组下个体重复进行3次qRT-PCR实验。
1.2 RNA提取和cDNA合成取对照组收集样品进行总RNA提取, 试剂选用TaKaRa公司Trizol Total RNA提取试剂盒, 按照说明书进行操作, 获得的总RNA以1.5%非变性琼脂糖电池进行凝胶电泳检测, 并置于紫外分光光度计(Bio-Rad, USA)下观察电泳条带。反转录采用TaKaRa M-MLV RTase Cdna Synthesis Kit试剂盒(TaKaRa)进行, 获得相应cDNA。
1.3 目的基因全长cDNA扩增参照以往研究获得的桡足类CRH-BP全长序列进行简并引物设计, 进一步获得太平洋真宽水蚤CRH-BP基因的中间片段。根据中间片段设计CRH-BP基因特异性引物进行5′ RACE和3′ RACE操作, 采用TaKaRa 5′/3′-Full RACE试剂盒, 按照试剂盒说明书进行RACE实验。分离纯化获得的目的片段后链接到载体pMD18-T, 然后转化到DH5α感受态细胞中, 进行阳性克隆筛选, 后续测序工作交由上海美吉生物技术有限公司。实验所用引物见表 1。
| 基因 | 引物 | 序列(5′—3′) | 扩增片段(bp) | 功能 |
| CRH-BP | CRH-BP F | GGGCTAAAAGGAGCCAAGAC | 813 | 核心心序列 |
| CRH-BP R | CCGCAGATAGTTTCCGAGGT | |||
| CRH-BP 5′outer | CTTGTGTCTGAATTAGGTCACCAT | 841 | 5′RACE | |
| CRH-BP 5′inner | AACTCTGACACTGAACCCCTC | |||
| CRH-BP 3′outer | CCTCAACACAGAATACACAGATTTG | 296 | 3′RACE | |
| CRH-BP 3′inner | AGGAGTTGGGATCTTATAAGAGAC |
利用DNAMAN 8.0软件拼接工具拼接测序结果, 得到Ep.CRH-BP基因全长cDNA序列。NCBI在线网站ORF finder (http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)预测编码区及非编码区。Expasy网站(http://web.expasy.org/compute.pi/)分析分子量和等电点。信号肽以及跨膜区的预测分别使用SignalP 4.1 Server网址与TMHMM Serverv.2.0进行; 使用Swissport在线软件(http://swissmodel.expasy.org/)进行CRH-BP基因蛋白质结构的预测分析; 用DNAMAN8.0软件多重序列比对工具将CRH-BP基因氨基酸序列与其他物种进行同源性比对, 使用MEGA6.0以Maximum Likelihood method构建进化树分析物种进化关系。
1.5 荧光定量PCR(qRT-PCR)表达分析根据已获得的Ep.CRH-BP基因ORF区, 利用Prime 5.0设计qRT-PCR所需引物, 内参引物选择18S rRNA, 引物序列交由上海华大生物公司合成。样品分别经过盐度、温度以及pH三个梯度组急性胁迫处理48h, 于3、6、12、24、48h五个时间段取样进行总RNA提取, 反转录得到cDNA模板进行qRT-PCR实验。目的基因与内参均设置3个技术重复与3个实验重复。重复实验中差异较大的数据排除, 其余采用2–ΔΔCt法进行Ep.CRH-BP基因相对表达分析, 采用SPSS 22.0进行数据分析, 主要进行单因素方差分析以及显著性差异分析, 设定当P < 0.05时为具有显著性差异。
| 引物 | 序列(5′—3′) | 扩增片段(bp) | 作用 |
| CRH-BP F | AGGAGACACCACTACGAA | 189 | qRT-PCR primer |
| CRH-BP R | GTCTTCCCTCAGGTCACTTT | ||
| 18S F | TGCATGGCCGTTCTTAGTTG | 209 | qRT-PCR control primer |
| 18S R | TCAATTCAGTGTAGCGCGTG |
RACE结果如图 1所示, 分别为CRH-BP基因5′与3′RACE电泳图, 所用DNA Marker为2000bp(已标注)。将扩增得到的5′RACE及3′RACE序列片段与ORF区进行拼接, 拼接工具选用DNAMAN8.0软件。拼接得到Ep.CRH-BP基因cDNA序列全长(MF289345) 1950bp, ORF 1245bp, 共编码415个氨基酸(AA), 5′UTR与3′UTR核苷酸数分别为841bp、296bp, 具有典型结构polyA尾巴以及AATAAA加尾信号, 如图 2分析CRH-BP基因全长序列发现HSP 70.1(热休克蛋白70.1)和XRE(X反应元件)位点, 这表明, 太平洋真宽水蚤CRH-BP基因参与对环境胁迫的响应以及对太平洋真宽水蚤生长发育的调控。
 |
| 图 1 RNA, CRH-BP 5′/3′RACE电泳图片 Fig. 1 Electrophoresis patterns of RNA, and 5′/3′ RACE of CRH-BP |
 |
| 图 2 CRH-BP cDNA序列及编码氨基酸序列 Fig. 2 Nucleotide and deduced amino acid sequences of Ep.CRH-BP 注: “*”表示终止密码子, 预测的XRE及Hsp70.1家族结构特征用红色箭头标示, 终止信号用横线标示。XRE(X反应元件), Hsp70.1(热休克蛋白70.1) |
使用DNAMAN8.0进行多重序列同源比对, 将Ep.CRH-BP基因编码的氨基酸序列与部分桡足类及昆虫纲的CRH-BP基因进行比对(图 3), 并计算Ep.CRH-BP蛋白序列与比对序列之间的同源相似性(表 3)。Blast结果显示, 太平洋真宽水蚤(Eurytemora pacifica) CRH-BP基因与近亲真宽水蚤(Eurytemora affinis)相似度为63%, 与虎斑猛水蚤(Tigriopus japonicus)同源性为42%, 与大型蚤(Daphnia magna)同源性40%, 与昆虫纲同源性在30%—45%之间, 与近亲真宽水蚤同源性最高。Ep.CRH-BP基因属于CRH-BP家族基因成员。
 |
| 图 3 Ep.CRH-BP氨基酸序列比对 Fig. 3 Multiple sequence alignment of deduced amino acid sequence of Ep.CRH-BP gene |
| 序列名称 | GenBank登录号 | 来源物种 | 同源性 |
| 太平洋真宽水蚤CRH-BP | MF289345 | Eurytemora pacifica | |
| 近亲真宽水蚤CRH-BP | XP023333201.1 | Eurytemora affinis | 63% |
| 虎斑猛水蚤CRH-BP | ABK76307.1 | Tigriopus japonicus | 42% |
| 烟粉虱 | XP018898271.1 | Bemisia tabaci | 42% |
| 大型蚤CRH-BP | KZS20787.1 | Daphnia magna | 40% |
| 截头堆砂白蚁CRH-BP | XP023709297.1 | Cryptotermes secundus | 40% |
| 翅目CRH-BP | XP017770809.1 | Nicrophorus vespilloides | 40% |
| 长角跳虫CRH-BP | ODN06056.1 | Orchesella cincta | 38% |
| 芜菁叶蜂CRH-BP | XP012260479.1 | Athalia rosae | 45% |
| 温带臭虫CRH-BP | XP014254909.1 | Cimex lectularius | 41% |
| 马铃薯甲虫CRH-BP | XP023018565.1 | Leptinotarsa decemlineata | 40% |
使用MEGA 7.0软件构建系统进化树, 计算方法采用Maximum Likelihood method, 重复计算10000次。表 3详细列出构建系统进化树所用物种名及GenBank序列登录号等相关信息。进化树结果如图 4所示, 太平洋真宽水蚤CRH-BP基因与近亲真宽水蚤(E. affinis)位于同一进化枝, 同源性分析结果显示二者氨基酸序列相似度最高, 表明二者亲缘关系最近, 总体上, 桡足类(Copepods)与温带臭虫(Cimex lectularius)系统进化发育树聚为一簇, 与其它昆虫类的进化关系较远。
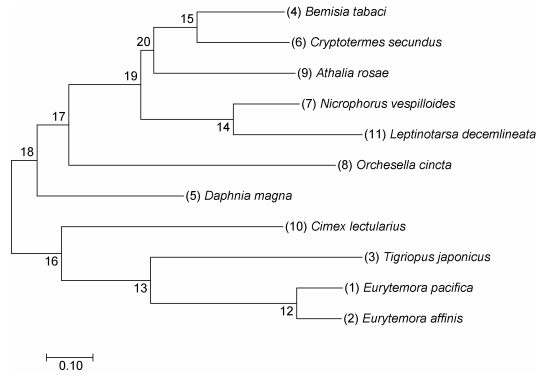 |
| 图 4 CRH-BP的系统进化树 Fig. 4 Molecular phylogenetic analysis of CRH-BP by maximum likelihood method |
使用DNAMAN软件对CRH-BP蛋白进行氨基酸疏水性分析, 结果如图 5, 氨基酸的疏水性最大为3.93, 最小值为–3.15, 亲水氨基酸为251个, 疏水性氨基酸163个, 亲水性氨基酸显著多于疏水性氨基酸, 推测该蛋白为亲水性蛋白。
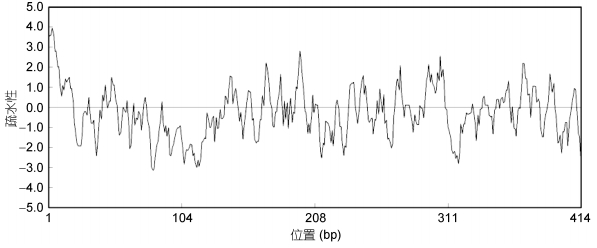 |
| 图 5 Ep.CRH-BP氨基酸疏水性分析 Fig. 5 Analysis of Ep.CRH-BP hydrophobic amino acid |
使用TMHMM 2.0在线软件对蛋白进行跨膜区分析, 结果如图 6所示; 该蛋白的氨基酸具有明显的跨膜区。使用SignalP 4.0在线软件对蛋白质信号肽进行预测, 结果如图 7所示, CRH-BP蛋白存在一个由17个氨基酸组成的信号肽。使用Swiss Pdb Viewer4.0.1软件对CRH-BP蛋白进行功能位点模式(Prosite pattern)分析(见表 4), 结果显示该蛋白存在6个蛋白翻译后修饰位点: PS00001 N-糖基化位点; PS00002糖胺聚糖附着位点; PS00005磷酸化位点; PS00006酪蛋白激酶II磷酸化位点; PS00008豆蔻酰化位点; PS00342微体C-末端的定位信号。
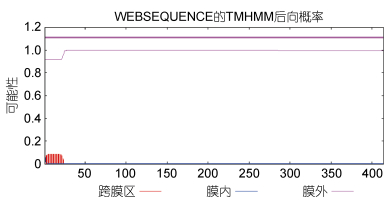 |
| 图 6 Ep.CRH-BP氨基酸序列跨膜区分析 Fig. 6 Transmembrance region analysis of Ep.CRH-BP amino acid sequence |
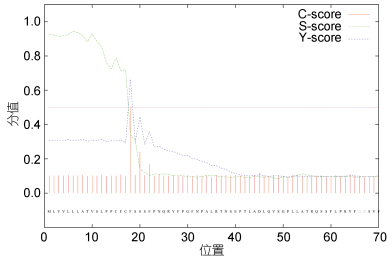 |
| 图 7 Ep.CRH-BP信号肽预测结果 Fig. 7 The signal peptide prediction of Ep.CRH-BP |
| 位置 | 名称 | 序列 |
| PS00001 | N-glycosylationsite | N-{P}-[ST]-{P} |
| PS00002 | Glycosaminoglycanattachmentsite | S-G-x-G. |
| PS00005 | ProteinkinaseCphosphorylationsite | [ST]-x-[RK]. |
| PS00006 | CaseinkinaseIIphosphorylationsite | [ST]-x(2)-[DE] |
| PS00008 | N-myristoylationsite | G-{EDRKHPFYW}-x(2)-[STAGCN]-{P} |
| PS00342 | MicrobodiesC-terminaltargetingsignal | [STAGCN]-[RKH]-[LIVMAFY] > |
通过real time PCR方法对Ep.CRH-BP基因在海水盐度、温度及pH变化三种环境因子胁迫下的表达情况进行检测, 以太平洋真宽水蚤18S rRNA基因作为内参基因, 选取对照组太平洋真宽水蚤的表达量作为参照, 每个处理下做了3个重复, 采用2–ΔΔCt方法计算相对表达量, 并用SPSS 22.0软件进行显著性分析。实验结果表明, Ep.CRH-BP基因在不同环境因子胁迫下均会出现显著性表达, 具有一定的时间梯度表达性与浓度梯度表达性特征(图 8, 图 9, 图 10)。
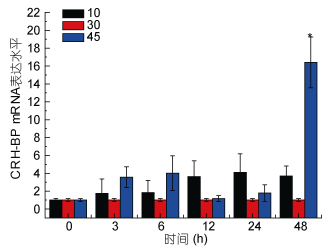 |
| 图 8 盐度胁迫Ep. CRH-BP mRNA表达水平 Fig. 8 The mRNA expression levels of Ep. CRH-BP under salinity stress 注:柱上短线表示平均值±标准差, 星号表示有显著差异(P < 0.05, n=3) |
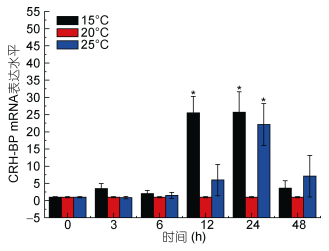 |
| 图 9 温度胁迫Ep. CRH-BP mRNA表达水平 Fig. 9 The mRNA expression levels of Ep. CRH-BP under temperature stress 注:柱上短线表示平均值±标准差, 星号表示有显著差异(P < 0.05, n=3) |
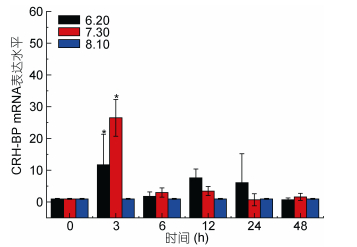 |
| 图 10 海水酸化Ep. CRH-BP mRNA表达水平 Fig. 10 The mRNA expression levels of Ep. CRH-BP under seawater acidification 注:柱上短线表示平均值±标准差, 星号表示有显著差异(P < 0.05, n=3) |
分析结果如下: Real-time PCR结果表明, 盐度胁迫应激条件下, CRH-BP基因表达上调, 盐度为10时无显著影响, 48h内基因表达量逐渐升高, 24h内处于较稳定状态; 盐度为45刺激48h, 基因表达量显著升高, 盐度45刺激造成的基因上调幅度明显大于盐度10。6h内, 低温和高温胁迫下CRH-BP基因表达与温度为20℃相比无明显变化, 15℃刺激3h出现基因表达轻微上调, 12h、24h基因表达量显著上调。25℃刺激24h内基因表达量逐渐上调, 24h显著升高, 48h降低。pH 6.20及pH 7.30刺激3h基因表达量显著上升, 3h后基因表达量下降无显著性。
3 讨论本研究首次克隆了太平洋真宽水蚤CRH-BP基因序列全长1 950bp, 其中完全开放阅读框为1 245bp编码415个氨基酸, 5′非编码区841bp, 3′非编码区296bp, 分子量约45.816kDa, 理论等电点5.87。CRH-BP编码蛋白质疏水性分析显示为亲水性蛋白质。通过与其他物种CRH-BP氨基酸序列进行比对分析, Ep.CRH-BP与近亲真宽水蚤亲缘性最高, 其蛋白序列当中有明显的跨膜结构域和信号肽, 表明CRH-BP蛋白质为可溶性蛋白。蛋白质一级结构序列是其蛋白质特定功能的结构基础。太平洋真宽水蚤的守恒残基数目及位点较多, 包括脯氨酸(P)、丝氨酸(S)、天冬氨酸(D)、组氨酸(H)、精氨酸(R)、半胱氨酸(C)等26个保守位点, 可以推测这些种类的功能相似性很大。这些保守位点对该基因功能的实现有很大的影响, 为CRH-BP功能的研究提供结构基础(蒲龄, 2014)。蛋白后翻译位点分析显示该蛋白包含糖基化、磷酸化等多个功能位点, 对于更深一步研究蛋白质的稳定性结构、主要定位及功能作用的发掘是有帮助的。为了比较CRH-BP基因的种系发育情况, 使用Maximum likelihood method法构建系统发育树, 太平洋真宽水蚤CRH-BP基因与近亲真宽水蚤(E. affinis)位于同一进化枝, 同源性分析显示二者氨基酸序列相似度最高, 表明二者亲缘关系最近。
哺乳动物和某些鱼类中, CRH-BP作用机制及生理功能已经得到明确定义(Majzoub, 2006), 哺乳动物中CRH-BP是关键的应激调节因子, 通过与CRH或亲和力较高的CRH类似物结合从而抑制CRH作用, 因此哺乳动物应激过程中CRH-BP主要起分子伴侣作用。以往的急性抑制应激实验中发现, 应激后CRH-BP基因的表达水平比正常状况下的表达水平均有显著提高(Seasholtz et al, 2002), 急性应激导致小鼠中CRH-BP基因表达水平提高2—3倍且这种高水平表达从抑制开始会持续两个小时左右(Chatzaki et al, 2002)。Doyon等人在早期对虹鳟的研究中发现, 追逐和限制生活空间等物理压力会导致虹鳟CRF-BP基因表达量上调。并进一步提出CRF-BP参与调节虹鳟应激轴的活性, 可能是通过隔离CRH受体, 这可能有助于恢复应激后稳态(Doyon et al, 2005)。温度升高同样导致草鱼不同组织中CRH-BP基因表达上调(蒲龄, 2014)。Mazon等(2006)的研究表明, CRH-BP在鲤鱼鳃和皮肤中表达, 以响应急性应激和博氏锥虫引起的寄生虫感染。桡足类相关研究目前主要是针对虎斑猛水蚤, 在温度及盐度改变造成的生理压力下, 虎斑猛水蚤CRH-BP基因表达量随温度和盐度的升高而上调, 这两种压力条件下CRH-BP的上调表明CRH-BP基因调节虎斑猛水蚤应激反应(Lee et al, 2008)。但仍需进一步的研究来确定CRH-BP在桡足类中应激反应过程中的作用机制。温度、盐度和pH是影响桡足类生长和存活的环境因子(夏品华等, 2011), 制约海洋生物的生长、发育、生殖、蜕皮、免疫等生理机能(陈光荣等, 2010; 王庆等, 2012)。本研究通过荧光定量PCR法检测太平洋真宽体内CRH-BP基因在不同环境因子胁迫下的表达情况, 探讨了盐度、温度及海水酸化三种环境条件胁迫与太平洋真宽水蚤CRH-BP基因相关性, 发现在应激胁迫后均有表达, 但随浓度时间变化有所不同。结果显示:低盐10胁迫下整体基因表达比较稳定; 高盐45胁迫下, 48h基因表达量显著升高。低温15℃胁迫12h后基因表达量显著上调。高温25℃胁迫24h内基因表达量逐渐上调, 24h显著升高。海水酸化胁迫下3h具有显著性。预示着CRH-BP基因表达量上调, 对于机体应激反应的缓解起重要作用。
大量研究证明脊椎动物与无脊椎动物中CRH-BP都起重要调节作用, 但对桡足类中调控机制的了解尚待完善。对于太平洋真宽水蚤CRH-BP基因的序列分析和表达检测, 为研究其他桡足类乃至甲壳类生物体内免疫、防御机制等提供了重要的参考资料。
4 结论本研究利用RACE技术首次克隆获得太平洋真宽水蚤CRH-BP基因全长cDNA序列, 并利用多种生物软件进一步分析其生物学信息特征。采用qRT-PCR对三种环境因子胁迫下CRH-BP基因在太平洋真宽水蚤体内的差异表达情况进行检测并进行数据分析。研究结果显示出太平洋真宽水蚤CRH-BP在生态毒理学及环境胁迫研究中良好的应用前景, 也为进一步探讨太平洋真宽水蚤CRH-BP基因相关功能性研究奠定基础, 为桡足类CRH-BP基因的克隆研究及系统分类与演化提供依据。
| 王庆, 刘丽君, 杨宇峰, 2012. 南方某水库轮虫群落特征及其对环境因子的响应. 生态学报, 30(13): 3385–3395 |
| 李光福, 2015.四种环境因子对指状伪镖水蚤摄食、繁殖和发育的影响.青岛: 中国海洋大学硕士学位论文, 15-20 |
| 吴利, 冯伟松, 张堂林, 等, 2011. 春、秋季武湖浮游动物群落特征及其与环境因子的关系. 水生态学杂志, 32(2): 31–37 |
| 陈光荣, 雷泽湘, 谭镇, 等, 2010. 环境因子对广东城市湖泊后生浮游动物的影响. 水生态学杂志, 3(4): 28–32 |
| 夏品华, 马健荣, 李存雄, 等, 2011. 红枫湖水库冬春季浮游生物群落与环境因子的典范对应分析. 环境科学研究, 24(4): 378–386 |
| 蒲龄, 2014.草鱼CRH-BP基因cDNA全长克隆与表达分析.长沙: 湖南农业大学硕士学位论文, 38-40 |
| Behan D P, Linton E A, Lowry P J, 1989. Isolation of the human plasma corticotrophin-releasing factor-binding protein. Journal of Endocrinology, 122(1): 23–31 DOI:10.1677/joe.0.1220023 |
| Chan R K W, Vale W W, Sawchenko P E, 2000. Paradoxical activational effects of a corticotropin-releasing factor-binding protein "ligand inhibitor" in rat brain. Neuroscience, 101(1): 115–129 DOI:10.1016/S0306-4522(00)00322-5 |
| Chatzaki E, Margioris A N, Gravanis A, 2002. Expression and regulation of corticotropin-releasing hormone binding protein (CRH-BP) in rat adrenals. Journal of Neurochemistry, 80(1): 81–90 DOI:10.1046/j.0022-3042.2001.00667.x |
| Doyon C, Trudeau V L, Moon T W, 2005. Stress elevates corticotropin-releasing factor (CRF) and CRF-binding protein mRNA levels in rainbow trout (Oncorhynchus mykiss). Journal of Endocrinology, 186(1): 123–130 DOI:10.1677/joe.1.06142 |
| Huising M O, Flik G, 2005. The remarkable conservation of corticotropin-releasing hormone (CRH)-binding protein in the honeybee (Apis mellifera) dates the CRH system to a common ancestor of insects and vertebrates. Endocrinology, 146(5): 2165–2170 DOI:10.1210/en.2004-1514 |
| Lee K W, Rhee J S, Raisuddin S, et al, 2008. A corticotropin-releasing hormone binding protein (CRH-BP) gene from the intertidal copepod, Tigriopus japonicus. General and Comparative Endocrinology, 158(1): 54–60 DOI:10.1016/j.ygcen.2008.05.002 |
| Linton E A, Wolfe C D A, Behan D P, et al, 1988. A specific carrier substance for human corticotrophin releasing factor in late gestational maternal plasma which could mask the acth-releasing activity. Clinical Endocrinology, 28(3): 315–324 DOI:10.1111/j.1365-2265.1988.tb01218.x |
| Liu L, Yu X L, Meng F, et al, 2011. Identification and characterization of a novel corticotropin-releasing hormone-binding protein (CRH-BP) gene from Chinese honeybee (Apis cerana cerana). Archives of Insect Biochemistry & Physiology, 78(3): 161–175 |
| Majzoub J A, 2006. Corticotropin-releasing hormone physiology. European Journal of Endocrinology, 155(S1): S71–S76 |
| Mazon A F, Verburgvan-Van Kemenade B M, Flik G, et al, 2006. Corticotropin-releasing hormone-receptor 1 (CRH-R1) and CRH-binding protein (CRH-BP) are expressed in the gills and skin of common carp (Cyprinus carpio L.) and respond to acute stress and infection. Journal of Experimental Biology, 209(3): 510–517 DOI:10.1242/jeb.01973 |
| Seasholtz A F, Burrows H I, Karolyi I J, et al, 2001. Mouse models of altered CRH-binding protein expression. Peptides, 22(5): 743–751 DOI:10.1016/S0196-9781(01)00387-4 |
| Seasholtz A F, Valverde R A, Denver R J, 2002. Corticotropin-releasing hormone-binding protein:biochemistry and function from fishes to mammals. Journal of Endocrinology, 175(1): 89–97 DOI:10.1677/joe.0.1750089 |
| Westphal N J, Seasholtz A F, 2006. CRH-BP:the regulation and function of a phylogenetically conserved binding protein. Frontiers in Bioscience, 11: 1878–1891 DOI:10.2741/1931 |
 2019, Vol. 50
2019, Vol. 50


