中国海洋湖沼学会主办。
文章信息
- 岳陈陈, 丁巍, 徐军伟, 李涛, 赵鹏, 余旭亚. 2019.
- YUE Chen-Chen, DING Wei, XU Jun-Wei, LI Tao, ZHAO Peng, YU Xu-Ya. 2019.
- 褪黑素对雨生红球藻(Haematococcus pluvialis)生理和虾青素积累的影响
- THE EFFECTS OF MELATONIN ON THE PHYSIOLOGICAL INDEX AND THE ACCUMULATION OF ASTAXANTHIN IN HAEMATOCOCCUS PLUVIALIS
- 海洋与湖沼, 50(1): 166-172
- Oceanologia et Limnologia Sinica, 50(1): 166-172.
- http://dx.doi.org/10.11693/hyhz20180300067
-
文章历史
- 收稿日期:2018-03-27
- 收修改稿日期:2018-06-23
虾青素(3, 3’-二羟基-β, β-胡萝卜素-4, 4’-二酮)是一种红色酮类胡萝卜素, 具有强抗氧化性、中和自由基、清除活性氧的特性(Fasstt et al, 2012; Han et al, 2013), 在食品、水产养殖、化妆品以及医药保健等方面应用广泛, 具有较高的商业价值(Guerin et al, 2003; Li et al, 2011; 韩春梅等, 2014)。虾青素的主要来源有雨生红球藻、真菌和水产品废弃物等(梁英等, 2009), 其中雨生红球藻在生物或非生物胁迫下能够积累虾青素(Su et al, 2014), 含量最高可达细胞干重的5% (Poonkum et al, 2015), 积累量高于其它天然虾青素来源。因此, 雨生红球藻广泛应用于虾青素的生产, 却存在着生产成本高、产量低等问题, 采用有效策略提高雨生红球藻虾青素产量就显得尤为重要。
近几年来, 外源添加一些化合物, 诱导、刺激雨生红球藻细胞的生长和虾青素的积累, 成为虾青素生产和研究领域的热点。有报道显示, 添加抗氧化剂黄腐酸和茴香醚作为诱导子, 与对照相比雨生红球藻虾青素含量分别增加86.89%和105%(Zhao et al, 2015; 丁巍等, 2017)。MLT是色氨酸的一种衍生物, 也是一种抗氧化剂, 最初发现于牛的松果体中, 随后发现广泛存在于动物、植物以及微生物中(Reiter et al, 2000; Tan et al, 2003), 有研究表明MLT能降低活性氧、清除自由基、调节生物周期节律和光合作用等功能(Tan et al, 2012; Shi et al, 2015), 从而对生物体代谢途径进行调控。PDS(八青番茄红素脱氢酶)和BKT(类胡萝卜素酮酶)是雨生红球藻虾青素合成中的关键酶, 即八青番茄红素经PDS催化生成ζ-胡萝卜素, 为进一步生成β-胡萝卜素提供原料; β-胡萝卜素经BKT催化生成海胆酮, 在BKT催化下进而合成角黄质, 最后合成虾青素。大量研究发现pds和bkt基因对虾青素合成至关重要, 达到某一阈值时, 雨生红球藻开始积累虾青素(Huang et al, 2006; Gwak et al, 2014; Huang et al, 2016)。先前研究表明褪黑素能大幅提高单针藻(Monoraphidium sp.)中脂肪酸含量(Li et al, 2017), 而脂肪酸含量的增加有利于虾青素的积累(Chen et al, 2015; Liang et al, 2015), 这就为本研究将褪黑素用于雨生红球藻诱导产虾青素提供了理论依据。
1 材料与方法 1.1 实验材料与培养条件雨生红球藻Haematococcus pluvialis LUGU由本实验室筛选、保存。
本实验选用Bold’s Basal Medium (BBM) (Ebrahimian et al, 2014)为藻种生长的基础培养基, 诱导期使用缺氮的BBM培养基。生长培养条件:温度(25±1) C, 光照强度2800 lx, 持续通入0.1vvm的无菌空气, 培养10d。诱导培养条件:温度(27±1) C, 12000 lx持续光照, 连续通入0.04vvm的无菌空气, 培养15d。
1.2 实验方法将MLT溶于乙醇中配制成浓度为0.21mol/L的MLT母液, 备用。离心收集培养后的微藻, 无菌水洗去培养基, 重悬浮于诱导培养基中, 加入MLT使得浓度为0、5、10和15μmol/L (保持加入相同的乙醇), 每个梯度设置三个平行样。进行隔天取样, 测定各项指标。
1.3 分析方法 1.3.1 生物量的测定隔天定期取10mL诱导培养基中的藻液, 离心收集细胞, 经冷冻、干燥后, 称重, 计算出单位体积藻液中的生物量, 公式如下:
细胞生物量(g/L) =藻粉干重/藻液体积
1.3.2 虾青素含量的测定采用高效液相色谱法测定雨生红球藻虾青素的含量。隔天定期取5mL诱导培养基中的藻液, 5000r/min离心3min, 弃上清收集藻细胞, 使用超纯水洗三次, 加入5mL甲醇-二氯甲烷(3︰1)提取液, 冰水浴下用匀浆机2800r/min匀浆20s, 匀浆液10000g低温离心15min, 转移上清至另一试管中。重复提取2—3次, 至沉淀物基本呈现无色为止。将收集的所有提取液10000g再次低温离心15min, 取上清用高效液相色谱仪测定, 色谱柱为C18柱(waters, 25cm×4.6mm, 5mm)流动相A(丙酮)和流动相B(甲醇︰水=9︰1, V/V)遵循: 25min B 80%—20%, 10min 20% B, 5min B 20%—80%, 流速为1.25mL / min; 检测器为Waters 996光电二极管阵列检测器, 进样量为30μL, 测定波长476nm, 积分得到虾青素质量浓度C(mg/L)。进而计算出虾青素含量公式如下:
虾青素含量(mg/g) =虾青素质量浓度/细胞生物量
1.3.3 细胞内总叶绿素、蛋白质和碳水化合物含量以及褪黑素消耗的测定为了检测细胞内生理参数(总叶绿素、蛋白质和碳水化合物), 离心收集了5mL诱导阶段的藻细胞, 蒸馏水水洗两次, 将藻细胞磨碎, 使用90%丙酮重复提取直至细胞变成无色。在663nm和645nm测定混合萃取物的吸光度, 按照Arnon(1949)的方法计算总叶绿素的含量。以牛血清蛋白作为标准, 按照Berges等(1993)的方法提取和检测总蛋白的含量。用不同葡萄糖浓度制备标准曲线, 对照组和MLT诱导组的冻干藻粉用于分析总碳水化合物含量(Ma et al, 2016)。按照Li等(2017)的方法使用高效液相色谱测定培养基中褪黑素的含量。
1.3.4 测定雨生红球藻虾青素合成相关酶基因表达量为了探究MLT诱导对虾青素生物合成相关基因的影响, 本试验使用Primer 5.0设计, 上海生工合成bkt和pds酶基因的上下游扩增引物(表 1), 扩增后产物经上海生工测序后BLAST比对, 以此为模板设计荧光定量引物(表 2)。
| 引物 | 引物序列(5′—3′) | 退火温度 |
| bkt F | GACCTGCACTGGGAGCACCAC | 62 C |
| bkt R | GACGTTGGCCACCGCTACTGA | |
| pds F | TCCATGATCTTTGCCATGC | 60 C |
| pds R | CGGGAGTTGAACATGAGGTC |
| 引物 | 引物序列(5′—3′) | 退火温度 |
| bkt F | CAATCTTGTCAGCATTCCGC | 61 C |
| bkt R | CAGGAAGCTCATCACATCAGA | |
| pds F | ACCACGTCGAAGGAATATCG | 58 C |
| pds R | TCTGTCGGGAACAGCCG |
收集藻细胞, 保存在–80 C, 备用。在液氮中将藻细胞磨成粉状, 使用Trizol法提取总RNA, 利用逆转录试剂盒TaKaRa逆转录合成cDNA, 以此为模板进行RT-PCR扩增, 通过ABI 7500荧光定量仪对pds和bkt基因表达量进行定量, 以18S (引物: 5′-CGGTCTGCCTCTGGTATG-3′与5′-GCTTGCTTT GAACACGCT-3′)基因作为内标来调节RNA的用量和循环数, 使内标基因在不同浓度诱导下的表达丰度一致。
1.4 数据处理试验均设置三个平行样, 所有图表中数据为平均值±标准偏差, 使用ANOVA(SPSS 19.0)一步法分析实验数据。最小显著性差异进行多重比较检验调查不同试验的组间差异, 当P < 0.05时具有显著性。
2 结果与分析 2.1 MLT对雨生红球藻细胞生物量的影响为了探究外源添加MLT对雨生红球藻生长的影响, 本研究测定了不同浓度不同时间微藻的生长情况。如图 1所示, 所有组在诱导条件下的生长情况不同, 培养15d后, 对照组生物量达到了0.77g/L, 15、10和5μmol/L MLT处理浓度的细胞量峰值分别达到0.62、0.69和0.64g/L, 低于对照组。根据生物量变化趋势可知, 对照组、5和10µmol/L MLT处理组都是先上升随后趋于稳定, 而15µmol/L MLT处理组生长中后期有明显的下降趋势。这一现象表明低浓度的MLT处理对H. pluvialis LUGU生长没有积极影响, 而高浓度的MLT处理抑制微藻细胞的生长。
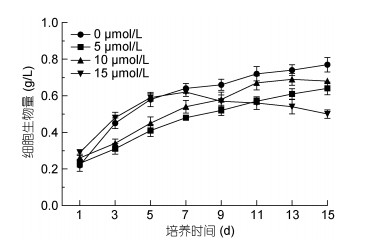 |
| 图 1 不同浓度的MLT对雨生红球藻生长的影响 Fig. 1 Effect of different concentration of MLT on the biomass of H. pluvialis 注: *同一时间与其他组差异显著(P < 0.05); **同一时间与其他组差异极显著(P < 0.01)。下同 |
由图 2可知, 在诱导条件下不同浓度的MLT对细胞内虾青素积累影响存在差异, 虾青素积累量与MLT间存在明显的剂量效应, MLT处理组中, MLT浓度为10μmol/L时虾青素含量显著增加, 其他浓度时没有明显变化。10μmol/L MLT处理组在开始诱导9d后虾青素积累显著增加, 13d时虾青素积累量达到最大(31.32mg/g), 是对照组(13.27mg/g)的2.36倍。图 3为10μmol/L MLT诱导组培养基中MLT的变化情况, 诱导开始的前5天, MLT的降幅较大, 随后MLT含量逐步下降, 15d时含量仅为0.43μmol/L。MLT浓度为5μmol/L时, 虾青素的最大积累量分别为15.41mg/g, 略高于对照; 15μmol/L MLT处理雨生红球藻时, 虾青素产量为7.86mg/g, 明显低于对照。10μmol/L的MLT处理虽然对微藻生物量没有积极影响, 但是明显提高了虾青素的积累量。
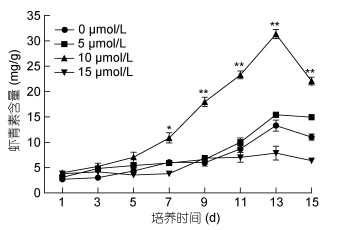 |
| 图 2 不同浓度MLT对雨生红球藻虾青素含量的影响 Fig. 2 Effect of different concentration of MLT on astaxanthin content of H.pluvialis |
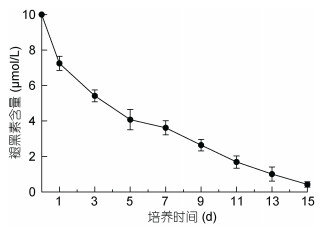 |
| 图 3 培养基褪黑素浓度的变化 Fig. 3 Changes in MLT concentration in the medium |
叶绿素存在于能进行光合作用的生物体中, 反映着光合作用能力(梁英等, 2007)。MLT处理组和对照组的总叶绿素浓度表现出相似的变化趋势(图 4), 培养3d后, 10μmol/L MLT诱导组和对照组总叶绿素略微增加分别达到11.0和12.07mg/L, 随后叶绿素浓度开始逐渐下降, 但与最高浓度相比并没有显著降低, 结果表明, 10μmol/L MLT诱导组和对照相比对总叶绿素含量没有显著影响。
 |
| 图 4 不同浓度的MLT对微藻细胞内总叶绿素含量的影响 Fig. 4 Effect of different concentration of MLT on the total chlorophyll content of H. pluvialis |
由图 5可知, 在诱导培养阶段, 10μmol/L MLT诱导组和对照组碳水化合物含量均先上升后逐渐下降。10μmol/L MLT处理组在5d时, 达到峰值(95.6%, 干重, 下同), 比对照高35.55%, 7d时开始下降, 15d时仅为39.4%;而对照在9d达到最高(93.1%), 随之开始下降但降幅较低。此外, 外源添加MLT对微藻细胞内蛋白含量也有较大的影响, 10μmol/L MLT诱导雨生红球藻细胞对蛋白含量有较大的影响, 诱导初期蛋白含量呈现上升趋势, 5d时达到最大(9.09mg/g)(图 6), 对照组表现出相似的变化趋势, 先有上升趋势, 11d时达到最高(7.5mg/g), 之后开始下降。
 |
| 图 5 不同浓度的MLT诱导对雨生红球藻细胞碳水化合物含量的影响 Fig. 5 Effect of different concentration of MLT on carbohydrate content of H. pluvialis |
 |
| 图 6 不同浓度的MLT诱导对雨生红球藻细胞蛋白质含量的影响 Fig. 6 Effect of different concentration of MLT on protein content of H. pluvialis |
用qRT-PCR方法检测不同诱导时间内, 10μmol/L MLT诱导组和对照组间雨生红球藻虾青素相关合成基因pds和bkt的表达水平, 由图 7和图 8可知, bkt和pds的表达量1d起, 显著高于对照组, 9d时, bkt的表达量达到最高, 是对照的12.21倍, 随后呈现下降趋势; pds酶基因的表达量与bkt相似, 都是在9d时达到最大值, 其后呈现下降趋势。
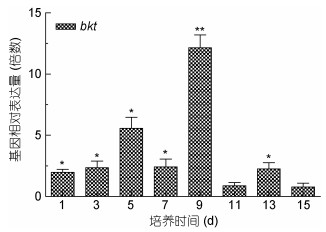 |
| 图 7 MLT对雨生红球藻bkt基因表达量的影响 Fig. 7 Effect of MLT on the bkt transcriptional expression level of H. pluvialis |
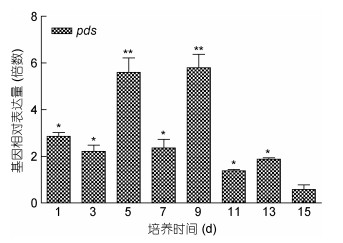 |
| 图 8 MLT对雨生红球藻pds基因表达量的影响 Fig. 8 Effect of MLT on the pds transcriptional expression level of H. pluvialis |
MLT是一种广泛存在于生物体中的激素, 调控着生物体的各种生理功能(梁竹等, 2014)。本试验在高光照、氮限制条件下, 研究了不同浓度MLT对雨生红球藻中虾青素积累的影响, 结果表明, 不同浓度的MLT对藻细胞影响不同, 存在明显的剂量效应, 与对照相比, 5和10μmol/L MLT能促进藻细胞中虾青素的积累, 10μmol/L条件下, 虾青素含量可达31.32mg/g。Wen等(2015)使用乙醇诱导雨生红球藻合成虾青素最高达到25.10mg/g; Shang等(2016)利用抗氧化剂茴香醚诱导雨生红球藻合成虾青素最高时29.30mg/g, 这均低于本研究的结果。植物激素茉莉酸和脱落酸诱导雨生红球藻时发现, 低浓度有利于虾青素的积累, 高浓度则对藻细胞生长影响显著, 也不利于虾青素的积累(Kobayashi et al, 1998; Raman et al, 2011), 这与本研究结果相似。
虾青素生物合成受多种条件影响, 试验结果显示碳水化合物和蛋白含量起初都有先上升后下降的趋势, 推测它们可能经一系列生化反应作用于虾青素的合成。Wei等(2015)研究表明, MLT能促进光合作用的碳吸收, 进而转化为碳骨架用于虾青素的合成。巩彪等(2017)发现MLT能提高植物在高光照和温度胁迫下的抗氧化酶活性, 本研究中MLT处理提高了高光照和氮限制胁迫下雨生红球藻内蛋白含量, 可见, MLT可能是通过调节植物和藻细胞内各种酶活性来应对胁迫压力的。此外, 虾青素的积累伴随着MLT的消耗, 虾青素的积累可能与褪黑素的消耗相关。然而, MLT在虾青素生物合成中的具体调控机制仍不清晰。因此, 研究MLT对雨生红球藻虾青素合成关键酶基因表达水平的影响, 有助于在分子水平上阐述虾青素大量积累的原因。
pds和bkt基因是虾青素生物合成过程中的关键酶基因, Gao等(2012a)和Lu等(2010)发现外源添加一些植物激素能提高pds和bkt的表达水平, 促进虾青素的积累, 这与本研究有相同的结果, 本研究中10μmol/L MLT促进了胁迫条件下pds和bkt基因的表达, 虾青素的积累量随之提高。另外, pds和bkt基因的表达量1d开始就显著高于对照组, 早于虾青素明显高于对照的时间(7d), 表明酶基因与虾青素积累间有一定的延迟性, Shang等(2016)和Gao等(2012b)使用茴香醚和水杨酸诱导雨生红球藻时也发现了这一现象。因此, MLT可能是通过某种途径促进雨生红球藻中虾青素生物合成关键酶基因的表达来提高虾青素积累量的。
4 结论综上所述, 适当浓度的MLT诱导有利于雨生红球藻虾青素的积累, 且在10μmol/L时, 虾青素的含量可达31.32mg/g, 是对照组的2.36倍; 同时也提高了与虾青素生物合成相关酶基因pds和bkt的表达水平。随着对MLT诱导雨生红球藻虾青素生物合成分子机制的深入研究, MLT有望成为虾青素工业化生产的有效诱导子。
| 丁巍, 尚敏敏, 余旭亚, 等, 2017. 茴香醚对雨生红球藻(Haematococcus pluvialis LUGU)虾青素积累和脂肪酸合成的影响. 食品与发酵工业, 43(2): 26–32 |
| 巩彪, 史庆华, 2017. 园艺作物褪黑素的研究进展. 中国农业科学, 50(12): 2326–2337 DOI:10.3864/j.issn.0578-1752.2017.12.013 |
| 梁竹, 魏玮, 陶利, 2014. 褪黑素在治疗睡眠障碍中的研究进展. 解放军药学学报, 30(1): 82–85 |
| 梁英, 冯力霞, 尹翠玲, 等, 2007. 叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景. 海洋科学, 31(1): 71–76 DOI:10.3969/j.issn.1000-3096.2007.01.013 |
| 梁英, 陈书秀, 2009. 温度对雨生红球藻叶绿素荧光特性及虾青素含量的影响. 海洋湖沼通报,(3): 112–120 DOI:10.3969/j.issn.1003-6482.2009.03.017 |
| 韩春梅, 刘建国, 张勇, 2014. 不同激素配伍对雨生红球藻(Haematococcus pluvialis)细胞生长和虾青素累积的调节作用、藻株差异及应用. 海洋与湖沼, 40(4): 430–436 |
| Arnon D I., 1949. Copper enzymes in isolated chloroplasts.Polyphenoloxidase in Beta vulgaris. Plant Physiology, 24(1): 1–15 DOI:10.1104/pp.24.1.1 |
| Berges J A, Fisher A E, Harrison P J., 1993. A comparison of Lowry, Bradford and Smith protein assays using different protein standards and protein isolated from the marine diatom Thalassiosira pseudonana. Marine Biology, 115(2): 187–193 DOI:10.1007/BF00346334 |
| Chen G Q, Wang B B, Han D X, et al, 2015. Molecular mechanisms of the coordination between astaxanthin and fatty acid biosynthesis in Haematococcus pluvialis (Chlorophyceae). The Plant Journal, 81(1): 95–107 DOI:10.1111/tpj.12713 |
| Ebrahimian A, Kariminia H R, Vosoughi M., 2014. Lipid production in mixotrophic cultivation of Chlorella vulgaris in a mixture of primary and secondary municipal wastewater. Renewable Energy, 71: 502–508 DOI:10.1016/j.renene.2014.05.031 |
| Fasstt R G, Coombes J S., 2012. Astaxanthin in cardiovascular health and disease. Molecules, 17(2): 2030–2048 DOI:10.3390/molecules17022030 |
| Gao Z Q, Meng C X, Zhang X W, et al, 2012a. Differential expression of carotenogenic genes, associated changes on astaxanthin production and photosynthesis features induced by JA in H. pluvialis. PLoS One, 7(8): e42243 DOI:10.1371/journal.pone.0042243 |
| Gao Z Q, Meng C X, Zhang X W, et al, 2012b. Induction of salicylic acid (SA) on transcriptional expression of eight carotenoid genes and astaxanthin accumulation in Haematococcus pluvialis. Enzyme and Microbial Technology, 51(4): 225–230 DOI:10.1016/j.enzmictec.2012.07.001 |
| Guerin M, Huntley M E, Olaizola M., 2003. Haematococcus astaxanthin:applications for human health and nutrition. Trends in Biotechnology, 21(5): 210–216 DOI:10.1016/S0167-7799(03)00078-7 |
| Gwak Y, Hwang Y S, Wang B, et al, 2014. Comparative analyses of lipidomes and transcriptomes reveal a concerted action of multiple defensive systems against photooxidative stress in Haematococcus pluvialis. Journal of Experimental Botany, 65(15): 4317–4334 DOI:10.1093/jxb/eru206 |
| Han D X, Li Y T, Hu Q., 2013. Astaxanthin in microalgae:pathways, functions and biotechnological implications. Algae, 28(2): 131–147 DOI:10.4490/algae.2013.28.2.131 |
| Huang J C, Chen F, Sandmann G., 2006. Stress-related differential expression of multiple β-carotene ketolase genes in the unicellular green alga Haematococcus pluvialis. Journal of Biotechnology, 122(2): 176–185 DOI:10.1016/j.jbiotec.2005.09.002 |
| Huang W P, Ye J R, Zhang J J, et al, 2016. Transcriptome analysis of Chlorella zofingiensis to identify genes and their expressions involved in astaxanthin and triacylglycerol biosynthesis. Algal Research, 17: 236–243 DOI:10.1016/j.algal.2016.05.015 |
| Kobayashi M, Todoroki Y, Hirai N, et al, 1998. Biological activities of abscisic acid analogs in the morphological change of the green alga Haematococcus pluvialis. Journal of Fermentation and Bioengineering, 85(5): 529–531 DOI:10.1016/S0922-338X(98)80076-7 |
| Li D F, Zhao Y T, Ding W, et al, 2017. A strategy for promoting lipid production in green microalgae Monoraphidium sp.QLY-1 by combined melatonin and photoinduction. Bioresource Technology, 235: 104–112 DOI:10.1016/j.biortech.2017.03.114 |
| Li J, Zhu D L, Niu J F, et al, 2011. An economic assessment of astaxanthin production by large scale cultivation of Haematococcus pluvialis. Biotechnology Advances, 29(6): 568–574 DOI:10.1016/j.biotechadv.2011.04.001 |
| Liang C, Zhai Y, Xu D, et al, 2015. Correlation between lipid and carotenoid synthesis and photosynthetic capacity in Haematococcus pluvialis grown under high light and nitrogen deprivation stress. Grasas Aceites, 66(2): e077 DOI:10.3989/gya.2015.v66.i2 |
| Lu Y D, Jiang P, Liu S F, et al, 2010. Methyl jasmonate-or gibberellins A3-induced astaxanthin accumulation is associated with up-regulation of transcription of β-carotene ketolase genes (bkts) in microalga Haematococcus pluvialis. Bioresource Technology, 101(16): 6468–6474 DOI:10.1016/j.biortech.2010.03.072 |
| Ma X N, Liu J, Liu B, et al, 2016. Physiological and biochemical changes reveal stress-associated photosynthetic carbon partitioning into triacylglycerol in the oleaginous marine alga Nannochloropsis oculata. Algal Research, 16: 28–35 DOI:10.1016/j.algal.2016.03.005 |
| Poonkum W, Powtongsook S, Pavasant P., 2015. Astaxanthin induction in microalga H.pluvialis with flat panel airlift photobioreactors under indoor and outdoor conditions. Preparative Biochemistry and Biotechnology, 45(1): 1–17 DOI:10.1080/10826068.2013.867871 |
| Raman V, Ravi S., 2011. Effect of salicylic acid and methyl jasmonate on antioxidant systems of Haematococcus pluvialis. Acta Physiologiae Plantarum, 33(3): 1043–1049 DOI:10.1007/s11738-010-0623-6 |
| Reiter R J, Tan D X, Osuna C, et al, 2000. Actions of melatonin in the reduction of oxidative stress. Journal of Biomedical Science, 7(6): 444–458 DOI:10.1007/BF02253360 |
| Shang M M, Ding W, Zhao Y T, et al, 2016. Enhanced astaxanthin production from Haematococcus pluvialis using butylated hydroxyanisole. Journal of Biotechnology, 236: 199–207 DOI:10.1016/j.jbiotec.2016.08.019 |
| Shi H, Jiang C, Ye T, et al, 2015. Comparative physiological, metabolomic and transcriptomic analyses reveal mechanisms of improved abiotic stress resistance in bermudagrass (Cynodon dactylon (L).Pers.) by exogenous melatonin. Journal of Experimental Botany, 66(3): 681–694 DOI:10.1093/jxb/eru373 |
| Su Y X, Wang J X, Shi M L, et al, 2014. Metabolomic and network analysis of astaxanthin-producing Haematococcus pluvialis under various stress conditions. Bioresource Technology, 170: 522–529 DOI:10.1016/j.biortech.2014.08.018 |
| Tan D X, Manchester L C, Hardeland R, et al, 2003. Melatonin:a hormone, a tissue factor, an autocoid, a paracoid, and an antioxidant vitamin. Journal of Pineal Research, 34(1): 75–78 DOI:10.1034/j.1600-079X.2003.02111.x |
| Tan D X, Hardeland R, Manchester L C, et al, 2012. Functional roles of melatonin in plants, and perspectives in nutritional and agricultural science. Journal of Experimental Botany, 63(2): 577–597 DOI:10.1093/jxb/err256 |
| Wei W, Li Q T, Chu Y N, et al, 2015. Melatonin enhances plant growth and abiotic stress tolerance in soybean plants. Journal of Experimental Botany, 66(3): 695–707 DOI:10.1093/jxb/eru392 |
| Wen Z W, Liu Z Y, Hou Y Y, et al, 2015. Ethanol induced astaxanthin accumulation and transcriptional expression of carotenogenic genes in Haematococcus pluvialis. Enzyme and Microbial Technology, 78: 10–17 DOI:10.1016/j.enzmictec.2015.06.010 |
| Zhao Y T, Shang M M, Xu J W, et al, 2015. Enhanced astaxanthin production from a novel strain of Haematococcus pluvialis using fulvic acid. Process Biochemistry, 50(12): 2072–2077 DOI:10.1016/j.procbio.2015.09.004 |
 2019, Vol. 50
2019, Vol. 50


