中国海洋湖沼学会主办。
文章信息
- 李蒙, 王金凤, 黄骞, 李才文. 2019.
- LI Meng, WANG Jin-Feng, HUANG Qian, LI Cai-Wen. 2019.
- 三疣梭子蟹含硒谷胱甘肽过氧化物酶基因克隆及其表达分析
- MOLECULAR CLONING AND EXPRESSION OF A SELENIUM-DEPENDENT GLUTATHIONE PEROXIDASE GENE FROM PORTUNUS TRITUBERCULATUS
- 海洋与湖沼, 50(1): 149-158
- Oceanologia et Limnologia Sinica, 50(1): 149-158.
- http://dx.doi.org/10.11693/hyhz20180500128
-
文章历史
- 收稿日期:2018-05-24
- 收修改稿日期:2018-08-29
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 中国科学院大学 北京 100049
2. Marine Ecology and Environmental Science Laboratory, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
谷胱甘肽过氧化物酶(Glutathione peroxidase, GPx)是一类广泛存在于需氧生物体内的重要抗氧化酶。GPxs家族成员一般可分为两大类型, 分别为不含硒谷胱甘肽过氧化物酶(non-selenium-dependent GPx, non-SeGPx)和含硒谷胱甘肽过氧化物酶(selenium- dependent GPx, SeGPx) (Arthur, 2001; Brigelius-Flohé et al, 2013)。而且, 在哺乳动物中, GPxs家族成员可进一步分为8种不同亚型(Herbette et al, 2007; Margis et al, 2008; Toppo et al, 2008)。作为重要抗氧化酶, 谷胱甘肽过氧化物酶可将活性氧种类(Reactive oxygen species, ROS), 如无机过氧化物(H2O2)或者有机过氧化物催化产生水或者酒精, 进而参与生物体内氧化还原稳态的调控过程(Ursini et al, 1995)。而最新研究表明, GPxs除了具有对ROS的催化功能外, 还可在生物机体中发挥某些新型生理功能, 例如GPx1对胰岛素信号通路的调控作用、GPx2的致癌过程、GPx3参与机体炎症反应、GPx4参与细胞凋亡过程、GPx5参与精子发生过程以及GPx7和GPx8参与潜在的蛋白折叠过程(Brigelius-Flohé et al, 2013)。
相较于脊椎动物而言, GPxs在甲壳动物中的功能研究仍相对较少。目前, GPx基因仅在少数虾、蟹甲壳类动物中, 如凡纳滨对虾(Litopenaeus vannamei)、脊尾白虾(Exopalaemon carinicauda)、克氏原螯虾(Procambarus clarkii)、中国明对虾(Fenneropenaeus chinensis)、罗氏沼虾(Macrobrachium rosenbergii)、斑节对虾(Penaeus monodon), 以及拟穴青蟹(Scylla paramamosain)中克隆获得(Liu et al, 2007; Ren et al, 2009; Yeh et al, 2009; Liu et al, 2010; Fu et al, 2012; Duan et al, 2013; Xia et al, 2013)。而且, 近年来的研究结果表明, GPx基因可参与甲壳动物对细菌、病毒等病原感染的免疫响应过程, 在甲壳动物的固有免疫中发挥重要作用(Liu et al, 2007; Ren et al, 2009; Yeh et al, 2009; Liu et al, 2010; Fu et al, 2012; Duan et al, 2013; Xia et al, 2013)。
三疣梭子蟹是广泛分布于东亚沿海地区的重要海产经济蟹类之一。在我国, 三疣梭子蟹养殖在海产蟹类养殖业中具有重要地位, 近年来其年产量均超过10万吨, 其中2016年养殖产量为125000吨, 产值逾100余亿元(农业部渔业渔政管理局, 2017)。然而, 自2004年以来, 血卵涡鞭虫逐渐成为引发三疣梭子蟹流行病害“牛奶病”的重要寄生性病原, 给我国三疣梭子蟹养殖业造成巨大的经济损失, 严重妨碍我国海产蟹类养殖业的可持续、健康发展(许文军等, 2007; 李才文等, 2014a, b; 王金凤等, 2015; Li et al, 2013; Wang et al, 2017)。而探究三疣梭子蟹对血卵涡鞭虫的免疫机制可为该寄生虫流行性疾病的防控提供重要理论依据。因此, 在本研究中, 我们克隆分析了三疣梭子蟹GPx基因的全长cDNA序列, 并进一步检测了经血卵涡鞭虫侵染后该基因在三疣梭子蟹多个重要组织中的转录表达变化, 初步探究了GPx基因在甲壳动物固有免疫中的重要作用。
1 材料和方法 1.1 实验动物和病原准备从山东青岛市胶南当地养殖场采购三疣梭子蟹[体重(140±10)g], 采用血涂片镜检法和特异性PCR扩增法对用于本实验的三疣梭子蟹进行血卵涡鞭虫感染检测分析(Stentiford et al, 2005; Small et al, 2007a), 确认无该寄生虫感染。将三疣梭子蟹置于室内水循环系统中[盐度=30, 温度=(23±0.5)℃, 氨=0—0.3mg/L, 亚硝酸盐=0—0.6mg/L, pH=7.4—8.2]驯养1周后开展后续相关实验。
采集血卵涡鞭虫重度感染蟹作为免疫刺激实验中的病原供体, 病原分离准备工作可参见Small等(2007b)。简言之, 将约0.5mL感染血卵涡鞭虫的蟹血淋巴液加入含有10mL MAM缓冲液(Small et al, 2007b)的无菌25cm2细胞培养瓶中, 室温放置30min。然后, 将培养瓶中的虫体细胞悬浮液转入新的无菌25cm2细胞培养瓶中, 室温放置30min。收集虫体细胞悬浮液并在转速为400g和7℃条件下离心10min, 弃上清后保留虫体细胞沉淀。采用MAM缓冲液洗涤血卵涡鞭虫两次后, 对悬浮液中血卵涡鞭虫的数量进行计数, 将虫体细胞浓度稀释至1.0×106cells/mL, 用于后续2.5部分的实验中。
1.2 总RNA提取和反转录PCR采用Trizol试剂(TaKaRa, Japan)提取组织总RNA, 采用无RNA酶的DNAase Ⅰ (TaKaRa, 日本)去除基因组DNA污染。RNA样品质量及浓度采用NanoDrop 2000紫外分光光度计(A260nm/A280nm)进行测定分析, 并通过1%的琼脂糖凝胶电泳分析RNA样品中28S rRNA和18S rRNA条带的完整性检测RNA样品完整性。使用PrimeScriptTM反转录试剂盒(TaKaRa公司, 日本), 根据说明书操作反转录合成cDNA第一链, 保存于-80℃超低温冰箱中用于后续基因转录表达分析。
1.3 三疣梭子蟹GPx基因的全长cDNA序列克隆根据已克隆获得三疣梭子蟹GPx基因的cDNA序列中间片段(GenBank序列号: KU529652), 使用Primer Premier 5.0软件设计基因特异性引物序列(表 1), 采用SMART RACE cDNA扩增试剂盒(Clontech, USA)分别克隆获得GPx基因的5′和3′末端cDNA序列。首先按照RACE试剂盒的操作说明, 将三疣梭子蟹肝胰腺组织总RNA样品反转录合生用于后续5′和3′ RACE PCR扩增的cDNA第一链模板。RACE扩增的外层5′和3′末端PCR反应分别采用基因特异性引物5gsp1和3gsp1与UPM引物配对, PCR反应程序设置为: 94℃预变性5min; 94℃变性30s, 68℃退火30s (每个循环降1℃), 72℃延伸1min(15个循环); 94℃变性30s, 58℃退火30s, 72℃延伸1min(28个循环), 最后72℃延伸10min。RACE扩增的内层5′和3′末端PCR反应分别采用基因特异性引物5gsp2和3gsp2与NUP引物配对, PCR程序同上。采用TA克隆试剂盒(TaKaRa公司, 日本)将5′和3′ RACE-PCR内层扩增产物插入pMD19-T载体中, 挑选含有重组质粒的10个阳性单克隆菌落送至Invitrogen公司测序。最后, 通过Lasergene软件(DNAStar公司, 美国)对GPx基因的中间cDNA序列、5′和3′末端cDNA序列进行拼接, 从而获得三所梭子蟹GPx基因的全长cDNA序列。
| 引物名称 | 引物序列(5′—3′) | 引物用途 |
| PtSeGPx-5gsp1 | TCCACCTTGCCAAACATCTCCAT | 5′RACE |
| PtSeGPx-5gsp2 | CTCCTCGTGAGTGGTGTTTTCCTG | |
| PtSeGPx-3gsp1 | GCTDATCCAGAACACGGCG | 3′RACE |
| PtSeGPx-3gsp2 | GTCCTGGTAACAACTTTGAGCC | |
| PtSeGPx-QRT-F | GTCCTGGTAACAACTTTGAGCC | qRT-PCR |
| PtSeGPx-QRT-R | ATGATACACTTGGGGTCTGCC | |
| β-actin-qF | TCACACACTGTCCCCATCTACG | qRT-PCR |
| β-actin-qR | ACCACGCTCGGTCAGGATTTTC | |
| UPM | Long-CTAATACGACTCACTATAGGGCAAGCAG-TGGTATCAACGCAGAGT Short-CTAATACGACTCACTATAGGGC | 5′和3′RACE |
| NUP | AAGCAGTGGTATCAACGCAGAGT | 5′和3′RACE |
采用MUSCLE在线软件对PtSeGPx氨基酸序列与其他物种GPxs氨基酸序列进行比对分析(http://www.ebi.ac.uk/Tools/msa/muscle/), 通过Lasergene软件中的MegAlign程序分析PtSeGPx氨基酸序列与已报道GPxs氨基酸序列的相似性。采用MEGA 5.0软件(http://www.megasoftware.net/)基于邻接法构建系统发育树对PtSeGPx进行系统发育分析。上述序列分析中所使用的其他物种GPxs序列可参见表 2。此外, 通过在线分析工具InterPro(http://www.ebi.ac.uk/interpro/) MotifScan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)对PtSeGPx蛋白序列中的保守结构域进行预测分析。N-连接糖基化位点通过NetNGlyc 1.0 Server进行预测分析(http://www.cbs.dtu.dk/services/NetNGlyc/)。PtSeGPx蛋白的三维结构通过在线分析软件Swiss-model(http://swissmodel.expasy.org/)进行分析, 其分子量和等电点则通过LasergeneR软件(DNASTAR Inc., USA)中的EditSeq程序分析获得。
| 序列名称 | GenBank序列号 | 来源物种 |
| 三疣梭子蟹GPx | KY216076 | Portunus trituberculatus |
| 拟穴青蟹GPx | AEN69448 | Scylla paramamosain |
| 日本沼虾GPx | ADV17661 | Macrobrachium nipponense |
| 罗氏沼虾GPx | ACM68948 | Macrobrachium rosenbergii |
| 脊尾白虾GPx | AGJ03551 | Exopalaemon carinicauda |
| 栉孔扇贝GPx | ACF25900 | Chlamys farreri |
| 文蛤GPx | ADR51677 | Meretrix meretrix |
| 紫贻贝GPx | ADY38576 | Mytilus galloprovincialis |
| 背角无齿蚌GPx | ANG56607 | Sinanodonta woodiana |
| 菲律宾蛤仔GPx | ACU83220 | Ruditapes philippinarum |
| 九孔鲍GPx | ADF80272 | Haliotis diversicolor supertexta |
| 非洲爪蟾GPx1 | NP_001088896 | Xenopus laevis |
| 非洲爪蟾GPx3a | NP_001085319 | X. laevis |
| 非洲爪蟾GPx4a | NP_001165215 | X. laevis |
| 非洲爪蟾GPx7 | NP_001088904 | X. laevis |
| 斑马鱼GPx1 | NP_001007282 | Danio rerio |
| 斑马鱼GPx2 | NP_001316688 | D. rerio |
| 斑马鱼GPx3 | NP_001131027 | D. rerio |
| 斑马鱼GPx4a | NP_001333466 | D. rerio |
| 斑马鱼GPx4b | NP_001025241 | D. rerio |
| 斑马鱼GPx7 | NP_001018337 | D. rerio |
| 小鼠GPx1 | NP_032186 | Mus musculus |
| 小鼠GPx2 | NP_109602 | M. musculus |
| 小鼠GPx3 | NP_032187 | M. musculus |
| 小鼠GPx4 | AAI06148 | M. musculus |
| 小鼠GPx5 | NP_034473 | M. musculus |
| 小鼠GPx6 | NP_663426 | M. musculus |
| 小鼠GPx7 | NP_077160 | M. musculus |
| 小鼠GPx8 | NP_081403 | M. musculus |
| 人GPx1 | AAH07865 | Homo sapiens |
| 人GPx2 | AAH22820 | H. sapiens |
| 人GPx3 | NP_002075 | H. sapiens |
| 人GPx4 | AAH39849 | H. sapiens |
| 人GPx5 | NP_001500 | H. sapiens |
| 人GPx6 | NP_874360 | H. sapiens |
| 人GPx7 | NP_056511 | H. sapiens |
| 人GPx8 | NP_001008398 | H. sapiens |
为了获得PtSeGPx基因经血卵涡鞭虫免疫刺激后的转录表达变化, 本文经由70%酒精擦拭后的第五步足关节膜对实验组中的三疣梭子蟹(n=40)注射100μL含有血卵涡鞭虫滋养体细胞的Nephrops缓冲液(Shields et al, 2000), 注射剂量为105虫体细胞/个体; 对照组中的三疣梭子蟹(n=40)则注射等体积Nephrops缓冲液。本实验已有研究表明, 上述血卵涡鞭虫注射剂量可有效引发三疣梭子蟹的免疫响应(Li et al, 2015a, b)。实验期间, 实验组和对照组分别放置于相同环境条件下的独立循环水系统中进行喂养。在实验起始后6、12、24、48、96和192h时进行样品采集, 于实验组和对照组中在每个时间点随机选取5只梭子蟹进行解剖取样, 采集鳃、肝胰腺和血细胞样品, 采集方法可参见Li等(2015a, b)。此外, 本文在免疫刺激实验起始前采集5只未处理的三疣梭子蟹个体相应的组织样品作为后续数据分析的空白对照。
经血卵涡鞭虫侵染后, 采用实时荧光定量PCR检测分析PtSeGPx基因在三疣梭子蟹中三个重要组织中(鳃、肝胰腺和血细胞)的转录表达水平, 实时荧光定量PCR的引物参见表 1, 引物序列的特异性通过溶解曲线和1%琼脂糖凝胶电泳分析进行确认。实时荧光定量PCR仪器采用Rotor-Gene Q 2plex HRM热循环仪(QIAGEN, 德国), 采用25μL PCR反应体系, 包括12.5μL SYBR Premix Ex Taq Ⅱ (2×) (TaKaRa, Japan)、10μmol/L上、下游引物各0.5、1μL cDNA模板和10.5μL无菌水, 每个反应设置3个重复。PCR程序设定为: 95℃预变性30s, 然后95℃变性5s, 60℃退火30s (40个循环)。PCR反应完成后添加溶解曲线评估PCR扩增反应的特异性, 并依据公式E=10(−1/slope)测定实时荧光定量PCR的扩增效率(Rasmussen, 2001)。采用2−ΔΔCt方法(Livak et al, 2001), 以β-actin作为内参基因计算目的基因的相对mRNA表达量(Liu et al, 2013; Li et al, 2015a, b)。
1.6 数据分析实验数据以平均值±标准差(mean±SD)的形式呈现, 采用统计分析软件SPSS 20.0对数据进行单因素方差分析(ANOVA)和Duncan多重比较显著性分析。P < 0.05表示数据具有显著性差异。
2 结果与讨论 2.1 PtSeGPx基因全长cDNA序列的克隆分析我们采用RACE技术首次从三疣梭子蟹中成功克隆获得SeGPx基因的全长cDNA序列, 并已提交至GenBank数据库(GenBank序列号: KY216076)。PtSeGPx基因的cDNA序列全长为696bp, 开放阅读框长度为507bp, 编码168个氨基酸, 5′UTR长度为102bp, 3′UTR长度为87bp(图 1)。此外, cDNA序列中的起始密码子ATG、终止密码子TAG以及poly (A)尾见图 1。PtSeGPx氨基酸序列中的蛋白石密码子(220TGA222)编码硒半胱氨酸(40U), 它是硒蛋白家族成员的典型特征(Allmang et al, 2006)。与前人研究结果类似(Yeh et al, 2009; Liu et al, 2010; Duan et al, 2013), 在PtSeGPx蛋白序列中预测发现了GPx家族签名序列64LAFPCNQF71、活性位点序列152WNFEKF157等保守结构域(图 1), 并发现与其催化功能相关的保守氨基酸位点, 包括谷氨酰胺Gln(74Q)、色氨酸(142W)以及2个精氨酸(90R和168R) (Aumann et al, 1997)(图 1)。同时, 与甲壳动物中的研究结果一致(Yeh et al, 2009; Liu et al, 2010; Duan et al, 2013), 在PtSeGPx蛋白序列中预测到2个天冬酰胺连接的糖基化位点76NTT78和108NGT110(图 1)。
 |
| 图 1 PtSeGPx的cDNA序列及其编码氨基酸序列 Fig. 1 The nucleotide and deduced amino acid sequences of PtSeGPx 注:起始密码子ATG和终止密码子ATG以粗体标出, 保守结构域GPx家族签名序列(64LAFPCNQF71)和活性位点序列(152WNFEKF157)以阴影标出, 保守功能氨基酸位点(74Q) and Trp (142W) (90R, 168R)以粗体和阴影标出, 硒半胱氨酸(40U)以方框标出, 天冬酰胺连接的糖基化位点(76NTT78和108NGT110)以下划线标出 |
此外, PtSeGPx蛋白的预测分子量为18.8kDa, 等电点为7.98, 其三维结构由3个α螺旋和7个β折叠片组成, 硒半胱氨酸(40U)位于α1螺旋和β3折叠片形成的位于蛋白表面的口袋中(图 2)。在克氏原螯虾中, 其GPx蛋白的三维结构中含有5个α螺旋和5个β折叠片(Xia et al, 2013)。而在罗氏沼虾中, 其GPx蛋白的三级结构则由5个α螺旋和7个β折叠片组成(Yeh et al, 2009)。由此可以看出, 甲壳动物中GPx蛋白的三级结构组成可能会因甲壳动物种类不同而有所区别。
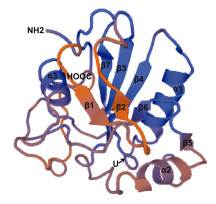 |
| 图 2 PtSeGPx蛋白的三维结构预测图 Fig. 2 The predicted three dimensional (3D) structure of PtSeGPx |
多重序列比对结果显示, PtSeGPx蛋白序列与已报道甲壳动物中的SeGPxs蛋白序列相似性(> 70%)要高于与其他物种GPxs的相似性(30%—60%), 其中与拟穴青蟹SeGPx蛋白序列相似性最高为91.0%(图 3)。并且, PtSeGPx中的保守结构域GPx家族签名序列(64LAFPCNQF71)、活性位点序列(152WNFEKF157)以及硒半胱氨酸残基(40U)在无脊椎动物和脊椎动物的GPxs蛋白中具有很高的保守性(图 3)。
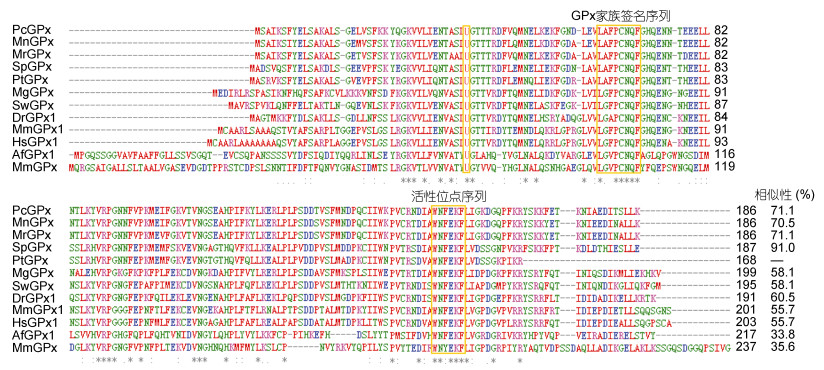 |
| 图 3 PtSeGPx蛋白序列与其他物种GPxs序列的相似性比对 Fig. 3 Comparison and percent identity (%) of PtSeGPx protein sequence with the counterparts of other species 注:保守结构域, 包括GPx家族签名序列(64LAFPCNQF71)、活性位点序列(152WNFEKF157)与硒半胱氨酸残基(U)均以黄色方框标注; 氨基酸位点的保守性程度由高到低依次分别以不同符号(*)、(:)和(.)进行标注 |
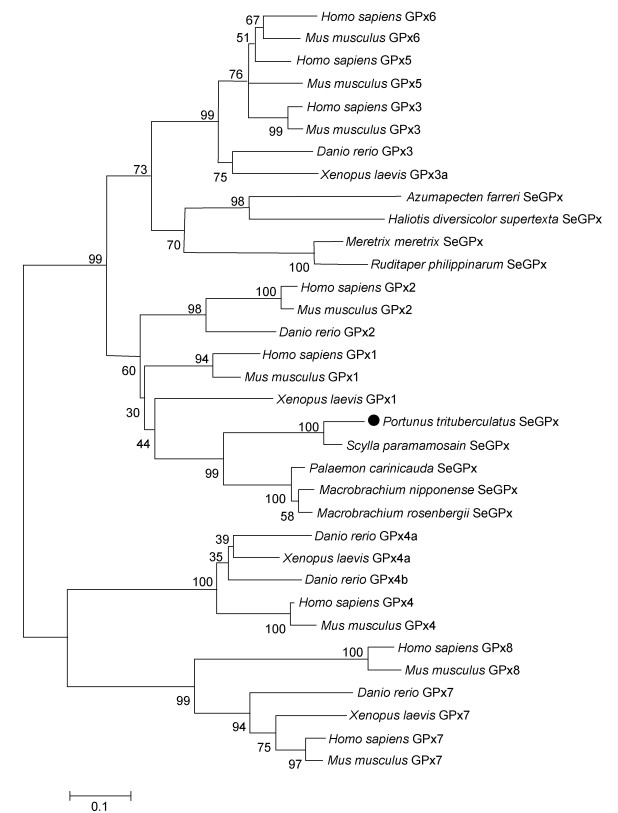
基于邻接法对PtSeGPx氨基酸序列与其他物种GPxs序列进行系统发育分析, 结果显示PtSeGPx与甲壳动物SeGPx序列同源性较高, 并与其聚为一支(图 4)。目前, 依据蛋白石密码子编码的硒半胱氨酸的存在与否(Herbette et al, 2007), 谷胱甘肽过氧化物酶通常被分为含硒谷胱甘肽过氧化物酶(SeGPx)和不含硒谷胱甘肽过氧化物酶(non-SeGPx)两个亚家族(Arthur, 2001; Brigelius-Flohé et al, 2013)。因此, 由以上分析结果可以发现, 本研究克隆获得的三疣梭子蟹GPx基因是甲壳动物中一个新发现的含硒谷胱甘肽过氧化物酶基因。
2.3 PtSeGPx基因经血卵涡鞭虫侵染后的转录表达变化经血卵涡鞭虫侵染后, PtSeGPx基因在三疣梭子蟹血细胞、肝胰腺和鳃组织中的转录水平均发生显著性变化。PtSeGPx基因在三个被检测组织中的转录表达均可受到血卵涡鞭虫的诱导并发生显著性表达上调(图 5)。本研究中, PtSeGPx基因在三疣梭子蟹血细胞和肝胰腺中的转录表达显著上调结果与之前的研究结果是一致的(Li et al, 2016)。经血卵涡鞭虫侵染后, PtSeGPx基因在三疣梭子蟹血细胞(图 5a)和肝胰腺组织(图 5b)中的转录水平变化呈现类似的表达变化模式, 均可在6—192h侵染期间发生显著性表达上调(P < 0.05)。在三疣梭子蟹鳃组织中, PtSeGPx基因的转录表达在经血卵涡鞭虫侵染12、48和192h时发生显著性上调(P < 0.05), 而在侵染24h时发生显著性下调(P < 0.05)(图 5c)。以上结果表明, PtSeGPx基因在三疣梭子蟹鳃中的表达变化与其在血细胞和肝胰腺中的表达变化具有差异性, 一方面这可能与本研究中对三疣梭子蟹的侵染方式相关; 另一方面可能是由组织器官的免疫功能差异性所导致的不同组织器官在应对血卵涡鞭虫侵染过程中的免疫应答差异性, 进而导致PtSeGPx基因在三个不同组织器官中出现差异性表达。
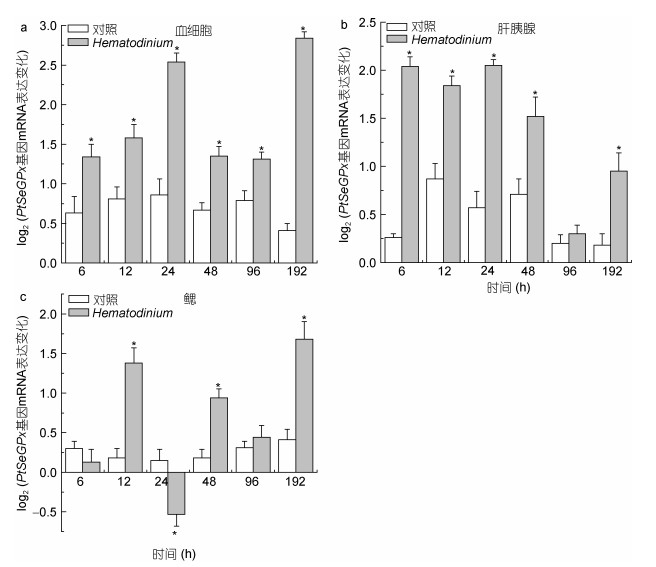 |
| 图 5 PtSeGPx基因的转录表达分析 Fig. 5 Relative mRNA expression profiles of PtSeGPx transcripts 注:数据显著性差异以*表示(P < 0.05, n=5) |
血细胞和肝胰腺是甲壳动物中的重要免疫组织, 对细菌和病毒等病原发挥重要的免疫防御功能。已有研究发现, 在脊尾白虾和克氏原螯虾中受到细菌或病毒侵染后, GPx基因在其血细胞和肝胰腺组织中的转录水平发生显著性表达上调, 表明GPx基因在甲壳动物免疫系统中具有重要作用(Duan et al, 2013; Xia et al, 2013)。同时, 研究表明, 作为一种重要抗氧化酶, GPx基因在甲壳动物应对入侵病原的免疫反应中的转录表达上调可促进清除机体产生的过量ROS, 使甲壳宿主减轻或避免发生氧化损伤, 在甲壳宿主自我防护过程中发挥重要作用(Liu et al, 2007; Yeh et al, 2009; Liu et al, 2010)。Duan等(2015)研究发现, 副溶血弧菌可通过紊乱斑节对虾体内的抗氧化酶(如GPx、CAT和SOD等)影响甲壳宿主的抗氧化状态, 进而引起斑节对虾中鳃组织和肝胰腺组织中的氧化应激反应, 甚至导致其肝胰腺组织损伤。因此, 本研究中PtSeGPx基因的显著性表达上调结果表明, PtSeGPx在三疣梭子蟹对血卵涡鞭虫的免疫响应过程发挥重要作用, 参与调控平衡甲壳宿主在免疫反应中的氧化还原状态, 使其重要组织避免遭受氧化损伤从而对宿主起到重要防护作用。
3 结论本研究首次于三疣梭子蟹中克隆获得含硒谷胱甘肽过氧化物酶基因PtSeGPx的全长cDNA序列并对其进行了序列分析, 进一步采用qRT-PCR方法探究了血卵涡鞭虫侵染条件下PtSeGPx基因在三疣梭子蟹中3个重要组织中的转录表达变化。本研究表明, PtSeGPx基因在三疣梭子蟹对血卵涡鞭虫的免疫响应过程中发挥重要作用, 这将有助于我们进一步了解甲壳动物响应寄生虫感染的分子免疫机制。
| 许文军, 施慧, 徐汉祥, 等, 2007. 养殖梭子蟹血卵涡鞭虫感染的初步研究. 水生生物学报, 31(5): 637–642 DOI:10.3321/j.issn:1000-3207.2007.05.004 |
| 李才文, 许文军, 2014a. 海水甲壳类寄生性病原血卵涡鞭虫(Hematodinium spp.)研究进展. 海洋与湖沼1,(1): 1–10 |
| 李才文, 宋书群, 刘云, 等, 2014b. 寄生性病原血卵涡鞭虫(Hematodinium sp.)感染山东半岛养殖梭子蟹的初步研究. 海洋与湖沼,(4): 776–782 |
| 王金凤, 李才文, 李蒙, 等, 2015. 血卵涡鞭虫感染三疣梭子蟹的病原形态学及组织病理学变化. 海洋与湖沼, 46(4): 748–757 |
| 农业部渔业渔政管理局, 2017. 中国渔业统计年鉴. 北京: 中国农业出版社, 1-157 |
| Allmang C, Krol A, 2006. Selenoprotein synthesis:UGA does not end the story. Biochimie, 88(11): 1561–1571 DOI:10.1016/j.biochi.2006.04.015 |
| Arthur J R, 2001. The glutathione peroxidases. Cell Mol Life Sci, 57(13-14): 1825–1835 |
| Aumann K D, Bedorf N, Brigelius-Flohé R, et al, 1997. Glutathione peroxidase revisited-simulation of the catalytic cycle by computer-assisted molecular modelling. Biomed Environ Sci, 10(2-3): 136–155 |
| Brigelius-Flohé R, Maiorino M, 2013. Glutathione peroxidases. Biochim Biophys Acta, 1830(5): 3289–3303 DOI:10.1016/j.bbagen.2012.11.020 |
| Duan Y F, Liu P, Li J T, et al, 2013. Expression profiles of selenium dependent glutathione peroxidase and glutathione S-transferase from Exopalaemon carinicauda in response to Vibrio anguillarum and WSSV challenge. Fish Shellfish Immunol, 35(3): 661–670 DOI:10.1016/j.fsi.2013.05.016 |
| Duan Y F, Zhang J S, Dong H B, et al, 2015. Oxidative stress response of the black tiger shrimp Penaeus monodon to Vibrio parahaemolyticus challenge. Fish Shellfish Immunol, 46(2): 354–365 DOI:10.1016/j.fsi.2015.06.032 |
| Fu M J, Zou Z H, Liu S F, et al, 2012. Selenium-dependent glutathione peroxidase gene expression during gonad development and its response to LPS and H2O2 challenge in Scylla paramamosain. Fish Shellfish Immunol, 33(3): 532–542 DOI:10.1016/j.fsi.2012.06.004 |
| Herbette S, Roeckel-Drevet P, Drevet J R, 2007. Seleno-independent glutathione peroxidases.More than simple antioxidant scavengers. FEBS J, 274(9): 2163–2180 DOI:10.1111/ejb.2007.274.issue-9 |
| Li C W, Song S Q, Liu Y, et al, 2013. Hematodinium infections in cultured Chinese swimming crab, Portunus trituberculatus, in northern China. Aquaculture, 396-399: 59–65 DOI:10.1016/j.aquaculture.2013.02.022 |
| Li M, Li C W, Wang J F, et al, 2015a. Immune response and gene expression in hemocytes of Portunus trituberculatus inoculated with the parasitic dinoflagellate Hematodinium. Mol Immunol, 65(1): 113–122 |
| Li M, Wang J F, Song S Q, et al, 2015b. Early transcriptional response to the parasitic dinoflagellate Hematodinium in hepatopancreas of Portunus trituberculatus. J Invertebr Pathol, 130: 28–36 DOI:10.1016/j.jip.2015.06.005 |
| Li M, Wang J F, Song S Q, et al, 2016. Molecular characterization of a novel nitric oxide synthase gene from Portunus trituberculatus and the roles of NO/O2.--generating and antioxidant systems in host immune responses to Hematodinium. Fish Shellfish Immunol, 52: 263–277 DOI:10.1016/j.fsi.2016.03.042 |
| Liu C H, Tseng M C, Cheng W, 2007. Identification and cloning of the antioxidant enzyme, glutathione peroxidase, of white shrimp, Litopenaeus vannamei, and its expression following Vibrio alginolyticus infection. Fish Shellfish Immunol, 23(1): 34–45 DOI:10.1016/j.fsi.2006.09.002 |
| Liu K F, Yeh M S, Kou G H, et al, 2010. Identification and cloning of a selenium-dependent glutathione peroxidase from tiger shrimp, Penaeus monodon, and its transcription following pathogen infection and related to the molt stages. Dev Comp Immunol, 34(9): 935–944 DOI:10.1016/j.dci.2010.04.001 |
| Liu Y, Cui Z X, Li X H, et al, 2013. A newly identified anti-lipopolysaccharide factor from the swimming crab Portunus trituberculatus with broad spectrum antimicrobial activity. Fish Shellfish Immunol, 34(2): 463–470 DOI:10.1016/j.fsi.2012.11.050 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Margis R, Dunand C, Teixeira F K, et al, 2008. Glutathione peroxidase family-an evolutionary overview. FEBS J, 275(15): 3959–3970 DOI:10.1111/j.1742-4658.2008.06542.x |
| Rasmussen R, 2001. Quantification on the LightCycler. In: Meuer S, Wittwer C, Nakagawara K I eds. Rapid Cycle Real-time PCR. Berlin, Heidelberg: Springer Press, 21-34 |
| Ren Q, Sun R R, Zhao X F, et al, 2009. A selenium-dependent glutathione peroxidase (Se-GPx) and two glutathione S-transferases (GSTs) from Chinese shrimp (Fenneropenaeus chinensis). Comp Biochem Physiol C:Toxicol Pharmacol, 149(4): 613–623 DOI:10.1016/j.cbpc.2009.01.007 |
| Shields J D, Squyars C M, 2000. Mortality and hematology of blue crabs, Callinectes sapidus, experimentally infected with the parasitic dinoflagellate Hematodinium perezi. Fish Bull, 98: 139–152 |
| Small H J, Shields J D, Hudson K L, et al, 2007a. Molecular detection of Hematodinium sp.infecting the blue crab, Callinectes sapidus. J Shellfish Res, 26(1): 131–139 DOI:10.2983/0730-8000(2007)26[131:MDOHSI]2.0.CO;2 |
| Small H J, Shields J D, Neil D M, et al, 2007b. Differences in enzyme activities between two species of Hematodinium, parasitic dinoflagellates of crustaceans. J Invertebr Pathol, 94(3): 175–183 DOI:10.1016/j.jip.2006.10.004 |
| Stentiford G D, Shields J D, 2005. A review of the parasitic dinoflagellates Hematodinium species and Hematodinium-like infections in marine crustaceans. Dis Aquat Organ, 66(1): 47–70 |
| Toppo S, Vanin S, Bosello V, et al, 2008. Evolutionary and structural insights into the multifaceted glutathione peroxidase (Gpx) superfamily. Antioxid Redox Signal, 10(9): 1501–1514 DOI:10.1089/ars.2008.2057 |
| Ursini F, Maiorino M, Brigelius-Flohé R, et al, 1995. Diversity of glutathione peroxidases. Methods Enzymol, 252: 38–53 DOI:10.1016/0076-6879(95)52007-4 |
| Wang J F, Li M, Xiao J, et al, 2017. Hematodinium spp.infections in wild and cultured populations of marine crustaceans along the coast of China. Dis Aquat Organ, 124(3): 181–191 DOI:10.3354/dao03119 |
| Xia X F, Zheng J J, Shao G M, et al, 2013. Cloning and functional analysis of glutathione peroxidase gene in red swamp crayfish Procambarus clarkii. Fish Shellfish Immunol, 34(6): 1587–1595 DOI:10.1016/j.fsi.2013.03.375 |
| Yeh S P, Liu K F, Chiu S T, et al, 2009. Identification and cloning of a selenium dependent glutathione peroxidase from giant freshwater prawn, Macrobrachium rosenbergii. Fish Shellfish Immunol, 27(2): 181–191 DOI:10.1016/j.fsi.2009.03.022 |
 2019, Vol. 50
2019, Vol. 50