中国海洋湖沼学会主办。
文章信息
- 钟爱华, 储张杰, 牟毅, 赵其柱. 2018.
- ZHONG Ai-Hua, CHU Zhang-Jie, MOU Yi, ZHAO Qi-Zhu. 2018.
- 斜带髭鲷(Hapalogenys nitens)血细胞发生及外周血细胞化学染色观察
- THE HEMOCYTOPOIESIS AND CYTOCHEMICAL STAINING OF PERIPHERAL BLOOD CELL IN HAPALOGENYS NITENS
- 海洋与湖沼, 49(6): 1341-1349
- Oceanologia et Limnologia Sinica, 49(6): 1341-1349.
- http://dx.doi.org/10.11693/hyhz20180200044
-
文章历史
- 收稿日期:2018-02-28
- 收修改稿日期:2018-06-18
斜带髭鲷[Hapalogenys nitens (Richardson)], 俗称“包公鱼”, 属于鲈形目(Perciformes)、石鲈科(Pamadasyidae)、髭鲷属(Hapalogenys), 属中下层鱼类, 我国沿海以及日本、朝鲜均有分布, 无肋间刺、肉味鲜美, 是一种优质食用海水鱼, 尤其是产卵前的成鱼, 肉质特别鲜美。斜带髭鲷生长快(当年能上市)、生命力强、能耐低温, 已成为海水养殖鱼类之一。
鱼类血细胞具有运输、损伤修复、维持酸碱平衡等功能, 在维持机体内环境稳态方面具有重要作用。白细胞是鱼类免疫系统的重要组成部分, 在抵抗病原入侵和疾病免疫方面肩负重要作用。开展鱼类血细胞研究对于鱼类生理学和免疫学有重要意义, 国内外学者已对虹鳟(Salmo gaindner)、日本黄姑鱼(Nibea japonica)、长鳍裸颊鲷(Lethrinus erythropterus)、隆头鱼(Labrus bergylta)等多种鱼类的血细胞形态结构、发生、细胞化学进行了研究(Dewilde et al, 1967; 苑淑宾等, 2011; 曹伏君等, 2014; Haugland et al, 2014)。
目前有关斜带髭鲷的研究主要集中在养殖技术、人工繁殖技术、幼鱼生长和生态转换效率以及遗传多样性等方面(蔡良候等, 1997; 邹记兴等, 2002; 王朝新, 2008; 梁君荣等, 2005; 王世锋等, 2007; 陈竹等, 2011), 有关斜带髭鲷血细胞发生和外周血细胞化学染色的研究很少有报道。通过斜带髭鲷血细胞发生以及外周血细胞化学染色研究, 旨在为其生理学和免疫学研究积累基础资料。
1 材料与方法 1.1 实验材料实验用鱼来自浙江省舟山市定海区, 选体色正常、体表无伤、反应灵敏的斜带髭鲷8尾, 活体运回实验室, 在室内暂养1d后进行实验。其体质量450-650g。
1.2 方法 1.2.1 血细胞发生观察鱼体MS-222麻醉后立即解剖, 取出头肾、体肾、肝脏、脾脏, 生理盐水冲去表面血污, 擦干, 用洁净的刀片将每个器官居中作横切、纵切, 每个切面在病理级载玻片上轻轻印5个以上迹面, 印片空气中干燥, 用Wright-Giemsa染液(南京建成)染色10min, 流水缓慢冲洗30s, 晾干中性树胶封片, 油镜(Olympus CX23)下观察拍照。每种细胞随机取样20个, 测量胞体长短径, SPSS17软件统计分析。
各阶段细胞形态标准参照《野生动物血液细胞学图谱》(刘志洁, 2002), 中幼阶段红细胞胞质大部分仍嗜碱性, 将其归为早幼红细胞(金丽等, 2007)。
1.2.2 细胞化学染色用含0.2mL柠檬酸三钠抗凝剂(3.0%)的注射器(规格1.0mL)心脏取血, 立即涂片, 干燥后加入预冷固定剂(含1%蔗糖和1%戊二醛)4℃固定10min, 蒸馏水冲洗, 晾干后染色。
过碘酸-希夫氏(PAS)染色 固定后的血细胞在1%过碘酸中避光孵育20min, 流水缓慢冲洗3min。Schiff’s试剂(1g碱性品红溶于100mL 80℃热蒸馏水中, 冷却后加入2mL浓盐酸和2g偏重亚硫酸钠, 避光静置24h后过滤, 定溶至200mL, 棕色瓶4℃保存待用)中避光孵育30min, 流水缓慢冲洗30s。分色液(10%偏重亚硫酸钠6mL与1mol/L盐酸5mL混合于100mL蒸馏水中)分色2min, 水洗镜检, 糖原及多糖成分被染为红色。
碱性磷酸酶染色 固定后血细胞在反应液[A液: 20mg萘酚AS-BI-磷酸盐溶于500μL DMF; B液:坚牢蓝B盐20mg溶于0.2mol/L巴比妥钠缓冲液(pH9.2)20mL; A、B液混合为染色反应液]中室温避光孵育2h, 水洗后入1%苏木素复染10min, 水洗镜检。阳性反应呈棕黑色颗粒, 表明有碱性磷酸酶(alkaline phosphatase, AKP)活性物质。
酸性磷酸酶染色 固定后血细胞在反应液[A液: 20mg萘酚AS-BI-磷酸盐溶于500μL DMF; B液:固紫酱GBC盐20mg加入20mL 0.1mol/L SAB (pH 4.6)振摇10min后过滤; A、B液混合为染色反应液]中37℃避光孵育1h, 水洗后入1%苏木素染色液复染10min, 水洗镜检。阳性反应呈红色, 表明有酸性磷酸酶(acid phosphatase, ACP)活性物质。
氯乙酸AS-D萘酚酯酶染色 固定后血细胞在反应液[A液: 10mg氯乙酸AS-D萘酚溶于500μL DMF; B液:固紫酱GBC盐10mg加入10mL veronal (pH 7.4)醋酸缓冲液中振摇10min后过滤; A、B液混合即为反应液]中室温避光孵育30min, 水洗后入1% Lillie-Mayer苏木素染色液复染10min, 水洗, 镜检。阳性反应呈红色颗粒状沉淀, 表明有氯乙酸AS-D萘酚酯酶(naphthol-AS-D-chloroacetate esterase, NACE)活性物质。
α-乙酸萘酚酯酶染色 固定后血细胞在反应液[A液: 10mg α-乙酸萘酚溶于500μL DMF; B液:坚牢蓝B盐10mg加入10mL 0.07mol/L Na2HPO4 (pH 7.4)中剧烈振摇10min后过滤; A、B液混合即为反应液]中37℃避光孵育1h, 水洗后入1%苏木素染色液复染10min, 水洗镜检。阳性反应呈灰黑色或棕黑色沉淀, 表明有α-乙酸萘酚酯酶(α-naphthyl acetate esterase, αNAE)活性物质。
过氧化物酶染色 固定后血细胞在反应液[含0.05% DAB (3, 3′-二氨基联苯胺四盐酸盐)和0.01% H2O2]中室温避光孵育15min, 水洗, 1% Weigert氏苏木素液复染10min, 水洗镜检。阳性反应成棕灰至棕黑色, 表明有过氧化物酶(peroxidase, POX)活性物质。
2 结果 2.1 血细胞形态特征 2.1.1 原红细胞圆形或椭圆形, 偶见伪足。胞体较大, 长径(12.51±0.58)μm, 短径(12.21±0.42)μm。胞质极少, 在核周围形成极薄的一层, 强嗜碱性, 染成深蓝色或墨水蓝色。核圆形或椭圆形, 占细胞绝大部分, 核质比大, 染色质呈细网状分布, 染成紫红色, 核仁明显。核周围有明显的浅色环带区。
2.1.2 早幼红细胞细胞椭圆形, 胞体长径(11.41±0.48)μm, 短径(10.21±0.42)μm, 比原红细胞小, 早期核质比仍较大。随着细胞发育分化, 胞体逐渐变小, 胞质嗜碱性逐渐减弱, 颜色变浅, 由深蓝色到浅灰蓝色, 血红蛋白从无到多; 核内染色质凝集变粗, 染成紫红色, 到晚期染色质更粗, 核质比逐渐变小, 核仁逐渐消失(图 1b, c)。
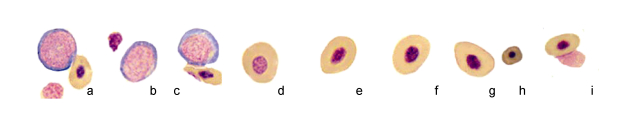 |
| 图 1 斜带髭鲷不同发育阶段的血细胞(1) Fig. 1 Blood cells in different stages of H. nitens (1) 注: a.原红细胞, b、c.早幼红细胞, d、e.晚幼红细胞, f、g.红细胞, h.衰老红细胞, i.红细胞胞质小体 |
胞体长径(10.41±0.58)μm, 短径(7.21±0.42)μm, 细胞卵圆形或椭圆形、偶见分叶核, 胞质中血红蛋白丰富而呈现暗黄色或土黄色。细胞核圆形或椭圆形, 居中或稍偏位, 染色质凝集呈粗线状, 染成深紫红色。核周围有一浅色带(图 1d, e)。
2.1.4 红细胞细胞卵圆形或椭圆形, 长径为(10.21±0.64)μm, 短径为(7.23±0.54)μm。核周浅色带消失, 胞质充满血红蛋白, 呈暗黄色或土黄色。胞核椭圆形、偶见圆形或杆状核, 居中或稍偏位, 染色质凝集呈致密粗线状, 染成紫黑色; 红细胞系中其核质比最小(图 1f, g)。衰老的红细胞(图 1h)呈椭圆形或不规则形, 胞体、胞核体积缩小, 染色质固缩, 呈紫黑色, 快溶解时核靠近质膜。头肾、脾脏印片上还发现了红细胞胞质小体, 无细胞核, 细胞膜不明显(图 1i)。
2.1.5 原粒细胞(图 2a)胞体圆形或卵圆形, 长径(12.86±0.68)μm, 短径(12.21±0.52)μm, 与原红细胞相似, 但胞质比原红细胞稍多, 嗜碱性稍弱呈蓝色, 无颗粒。胞核圆形或椭圆形, 居中或偏位, 染色质呈细网状, 染成浅紫红色, 核仁明显, 核质比大。
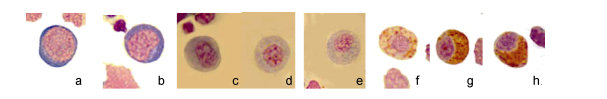 |
| 图 2 斜带髭鲷不同发育阶段的血细胞(2) Fig. 2 Blood cells in different stages of H. nitens (2) 注: a.原粒细胞, b.早幼粒细胞, c.嗜中性中幼粒细胞, d.嗜中性晚幼粒细胞, e.嗜中性粒细胞, f.嗜酸性中幼粒细胞, g.嗜酸性晚幼粒细胞, h.嗜酸性粒细胞 |
胞体圆形或卵圆形, 长径为(11.86±0.79)μm, 短径为(11.53±0.77)μm。胞质增多, 嗜碱性减弱呈浅蓝色, 胞质中有少量嗜天青颗粒, 染成浅紫红色。胞核圆形、椭圆形或稍凹陷, 偏位, 染色质凝集变粗, 染成紫红色, 核仁模糊, 核质比大。从中幼粒细胞开始, 胞质中出现特殊颗粒, 随着细胞分化成熟, 特殊颗粒数量增多。
2.1.7 嗜中性中幼粒细胞(图 2c)细胞圆形或椭圆形, 胞体长径为(11.15±0.76)μm, 短径为(10.98± 0.87)μm。胞质比早幼粒细胞稍多, 嗜碱性减弱呈浅灰蓝色或浅灰色, 胞质中有嗜天青颗粒和特殊的嗜中性颗粒, 嗜中性颗粒分布稀疏染成浅红色。核椭圆形或稍有凹陷, 偏位, 核内染色质呈粗线状。核质比变小, 约为1/3-1/2。
2.1.8 嗜中性晚幼粒细胞(图 2d)细胞圆形或椭圆形, 胞体长径为(10.52±0.67)μm, 短径为(10.32± 0.69)μm, 比中幼粒细胞小。胞核圆形或椭圆形, 较小, 偏位, 核内染色质凝集呈粗线状, 核仁消失。胞质丰富, 嗜天青颗粒增多, 浅红色特殊颗粒增多。
2.1.9 嗜中性粒细胞(图 2e)细胞圆形或椭圆形, 胞体长径为(10.21±0.69)μm, 短径为(9.92±0.62)μm。胞质无色或极浅的灰色, 内有许多细小的浅紫红色和浅红色颗粒。核多偏位, 圆形或椭圆形、少量肾形或棒状, 染色质凝集呈粗块状, 核质比最小。外周白细胞中其数量最多。
2.1.10 嗜酸性中幼粒细胞(图 2f)细胞椭圆形, 胞体长径为(10.41±0.57)μm, 短径为(9.50±0.42)μm, 胞体较大, 细胞质暗黄色, 内有大小不一粗大的嗜酸性颗粒, 分布较稀疏, 染成桔红色, 油镜下观察略带折光性。胞核较大, 核椭圆形或不规则形, 多偏位, 核内染色质凝集变粗呈紫红色, 有时核上有嗜酸性颗粒致使核膜不清。
2.1.11 嗜酸性晚幼粒细胞(图 2g)细胞椭圆形或不规则形, 胞体长径为(9.63±0.53)μm, 短径为(8.59±0.30)μm, 体积较嗜酸性中幼粒细胞小。核椭圆形或不规则形, 多偏位, 核内染色质浓聚呈粗线状, 染成紫红色。胞质浅黄色或暗黄色, 嗜酸性颗粒增多, 有时细胞核上有颗粒。偶有伪足伸出。
2.1.12 嗜酸性粒细胞细胞椭圆形或者不规则形, 胞体较小, 长径(8.93±0.98)μm, 短径为(8.21± 0.83)μm。胞核形态多样, 椭圆形、肾形、棒状、不规则形、偶见分叶, 偏位, 染色质浓缩致密有时呈粗块状, 深紫红色。胞质暗黄色或浅黄色, 胞质充满桔红色嗜酸性颗粒, 有时细胞膜和核膜上有颗粒, 致使膜不清晰。偶有伪足伸出。
2.1.13 嗜碱性中幼粒细胞(图 3a)
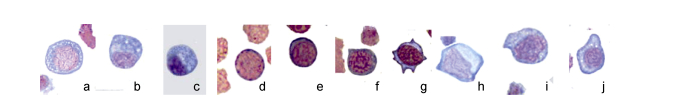 |
| 图 3 斜带髭鲷不同发育阶段的血细胞(3) Fig. 3 Blood cells in different stages of H. nitens (3) 注: a.嗜碱性中幼粒细胞, b.嗜碱性晚幼粒细胞, c.嗜碱性粒细胞, d.原淋巴细胞, e.幼淋巴细胞, f.小淋巴细胞, g.大淋巴细胞, h.原单核细胞, i.幼单核细胞, j.单核细胞 |
细胞圆形或椭圆形, 胞体长径(11.71±0.88)μm, 短径(11.02±0.72)μm, 比早幼粒细胞小。胞质灰蓝色或浅蓝色, 有大小不一的嗜碱性颗粒, 分布较稀疏。核多偏位, 圆形或椭圆形, 染色质稍粗, 染成紫红色, 核质比大, 有时核上有嗜碱性颗粒。
2.1.14 嗜碱性晚幼粒细胞(图 3b)细胞椭圆形或不规则形, 胞体长径(11.01±0.88)μm, 短径(10.41±0.62)μm, 胞体变小。胞质灰蓝色, 嗜碱性颗粒分布较密集; 胞核圆形、椭圆形、肾形或一侧扁平, 多偏位, 染色质粗糙, 染成深紫红色, 核质比小。
2.1.15 嗜碱性粒细胞(图 3c)细胞椭圆形或不规则形, 胞体长径(10.51±0.98)μm, 短径(9.75± 0.72)μm。胞核椭圆或不规则形, 偏位, 染色质浓聚呈粗线状, 染成深紫色。嗜碱性颗粒密集分布, 有时核上有颗粒。
2.1.16 原淋巴细胞(图 3d)圆形或椭圆形, 偶有伪足。胞体长径(10.15±0.73)μm, 短径(10.01± 0.63)μm, 是最小的原血细胞。胞质嗜碱性染成深蓝色, 少量胞质在核周围成极薄的一层。胞核圆形或椭圆形, 占细胞大部分, 核质比大, 染色质呈细网状。核仁清晰可见。
2.1.17 幼淋巴细胞(图 3e)细胞圆形或椭圆形, 胞体长径(9.32±0.55)μm, 短径(8.96±0.53)μm, 常有伪足。胞质比原淋巴细胞多, 嗜碱性减弱呈蓝色或灰蓝色, 有时可见嗜天青颗粒。核圆形或椭圆形, 多偏位, 染色质凝集呈稍粗线状, 染成深紫红色。核仁模糊。
2.1.18 淋巴细胞分为大淋巴细胞和小淋巴细胞。
小淋巴细胞(图 3f) 胞体小, 胞体长径(7.09±0.89)μm, 短径(5.97±0.89)μm。胞质少, 嗜碱性, 染成灰蓝色, 核一侧胞质稍多。胞核呈圆形或椭圆形, 染色质致密成粗线状, 染成深紫红色或紫黑色, 沿核膜呈车轮状分布。偶有嗜天青颗粒。
大淋巴细胞(图 3g) 椭圆形或不规则形, 有多个伪足, 胞体长径(8.34±0.85)μm, 短径(8.07± 0.57)μm。胞质灰蓝色。胞核圆形、椭圆形或不规则形状, 染色质凝集, 粗网状分布, 染成深紫红色, 颜色比小淋巴细胞稍浅。
2.1.19 原单核细胞(图 3h)长椭圆形或不规则形, 胞体长径(16.89±2.35)μm, 短径(14.14±1.31)μm, 是最大的原血细胞。胞质比其他原血细胞多, 靠近质膜的胞质呈深蓝色, 靠近核膜处胞质呈浅蓝色。核椭圆形、肾形或不规则形, 偏位, 染色质呈纤细网状, 分布比其他原血细胞稀疏, 染成淡紫红色, 核仁清晰可见。
2.1.20 幼单核细胞(图 3i)细胞长椭圆形或不规则形, 胞体长径为(15.86±1.56)μm, 短径为(13.08± 1.21)μm, 常有伪足。胞质比原单核细胞稍多, 呈灰蓝色, 内有少量细小的嗜天青颗粒, 有时有空泡。胞核长椭圆形或不规则形状, 多偏位, 染色质比原单核细胞粗糙, 呈网状分布, 染成紫红色, 核质比较原单核细胞小。核仁不清晰。
2.1.21 单核细胞(图 3j)胞体长径为(14.48± 1.81)μm, 短径为(11.02±1.32)μm, 呈长椭圆形或不规则形, 有时有多个伪足。胞质多, 呈灰蓝色, 内有细小的淡紫红色嗜天青颗粒, 有时有多个空泡。核呈椭圆形、肾形、马蹄形和不规则形, 多偏位, 染色质粗糙, 染成紫红色。
2.1.22 其他细胞巨噬细胞(图 4a) 胞体大, 核较小, 多偏位, 靠近细胞膜, 染色质着色深, 有时有空泡。
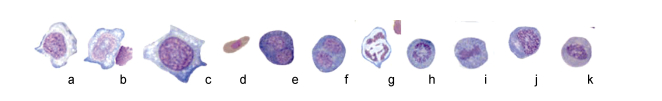 |
| 图 4 斜带髭鲷不同发育阶段的血细胞(4) Fig. 4 Blood cells in different stages of H. nitens (4) 注: a.巨噬细胞, b.幼巨嗜细胞, c.网状细胞, d.血栓细胞, e.有丝分裂的原红细胞, f.有丝分裂的原粒细胞, g.有丝分裂的原单核细胞, h.有丝分裂的原淋巴细胞, i、j.有丝分裂的早幼粒细胞, k.有丝分裂的嗜中性中幼粒细胞 |
幼巨噬细胞(图 4b) 胞体比巨噬细胞大, 核染色质疏松着色较浅, 多偏位。核质比大。
网状细胞(图 4c) 细胞极大, 胞体不规则形, 有多个突起。胞质灰蓝色, 有时近质膜处胞质深蓝色, 有时有空泡。细胞核椭圆形或圆形, 居中或稍偏位, 染色质浓聚呈粗线状分布, 染成深紫色。细胞边缘常常有血细胞。
血栓细胞(图 4d) 胞体小, 椭圆形、纺锤形或泪滴状, 是最细长的血细胞。细胞核椭圆形、梭性或不规则形状, 较小, 染成紫红色, 居中或稍偏位。胞质呈暗黄色或黄褐色。
在头肾印片中还发现正在有丝分裂的原红细胞(图 4e)、原粒细胞(图 4f)、原单核细胞(图 4g)、原淋巴细胞(图 4h)、早幼粒细胞(图 4i, j)和嗜中性中幼粒细胞(图 4k)。
2.2 血细胞计数四器官涂片中, 不同发育阶段血细胞分类计数和百分比见表 1。头肾印片中发现各种原始和未成熟的血细胞, 脾脏中发现原淋巴细胞。根据各细胞系原始和未成熟细胞计数及百分比结果推断, 原始细胞主要存在头肾中, 头肾能发育生成各类型血细胞, 体肾和脾脏能生成红细胞、淋巴细胞、单核细胞和嗜中性粒细胞。肝脏中未发现幼稚血细胞, 不是血细胞发生的场所。
| 细胞类型 | 头肾 | 体肾 | 脾脏 | 肝脏 | |||||||
| 个数 | (%) | 个数 | (%) | 个数 | (%) | 个数 | (%) | ||||
| 原红细胞 | 8 | 0. 16 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| 幼红细胞 | 75 | 1.48 | 12 | 0.28 | 9 | 0.19 | 0 | 0 | |||
| 红细胞 | 3925 | 77.66 | 3837 | 89.52 | 3924 | 85.49 | 3808 | 96.33 | |||
| 原单核细胞 | 6 | 0.12 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| 幼单核细胞 | 12 | 0.24 | 3 | 0.07 | 4 | 0.09 | 0 | 0 | |||
| 单核细胞 | 19 | 0.38 | 9 | 0.21 | 11 | 0.24 | 5 | 0.13 | |||
| 原淋巴细胞 | 7 | 0.14 | 0 | 0.00 | 1 | 0.02 | 0 | 0 | |||
| 幼淋巴细胞 | 12 | 0.24 | 4 | 0.09 | 9 | 0.19 | 0 | ||||
| 淋巴细胞 | 396 | 7.84 | 193 | 4.51 | 417 | 9.09 | 43 | 1.09 | |||
| 原粒细胞 | 23 | 0.46 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| 早幼粒细胞 | 27 | 0.53 | 5 | 0.12 | 4 | 0.08 | 0 | 0 | |||
| 嗜中性中幼粒细胞 | 22 | 0.44 | 3 | 0.07 | 2 | 0.04 | 0 | 0 | |||
| 嗜中性晚幼粒细胞 | 38 | 0.75 | 5 | 0.12 | 5 | 0.11 | 0 | 0 | |||
| 嗜中性粒细胞 | 397 | 7.86 | 206 | 4.81 | 198 | 4.31 | 93 | 2.35 | |||
| 嗜酸性中幼粒细胞 | 9 | 0.18 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| 嗜酸性晚幼粒细胞 | 11 | 0.22 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| 嗜酸性粒细胞 | 35 | 0.69 | 6 | 0.14 | 5 | 0.11 | 3 | 0.08 | |||
| 嗜碱性中幼粒细胞 | 5 | 0.11 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| 嗜碱性晚幼粒细胞 | 8 | 0.16 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| 嗜碱性粒细胞 | 19 | 0.37 | 2 | 0.05 | 2 | 0.04 | 1 | 0.03 | |||
外周血细胞中, 嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞和单核细胞呈阳性反应, 即胞质中含有糖原或多糖。嗜中性粒细胞中有许多细小的暗红色颗粒, 核上偶有颗粒; 嗜碱性粒细胞中有许多粗大的大小不一暗红色颗粒; 单核细胞中有细小的颗粒, 靠近细胞膜处颗粒稍大; 嗜酸性粒细胞颗粒不着色, 胞质成较淡的暗红色。淋巴细胞呈阴性反应(图 5a-e)。
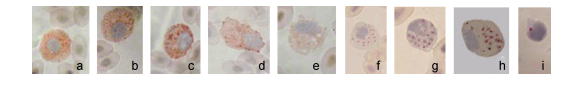 |
| 图 5 斜带髭鲷外周血细胞化学染色(1) Fig. 5 Cytochemical stain of H. nitens blood cell (1) 注: a、b.嗜中性粒细胞PAS染色, c.嗜碱性粒细胞PAS染色, d.单核细胞PAS染色, e.嗜酸性粒细胞PAS染色, f.嗜中性粒细胞ACP染色, g.嗜酸性粒细胞ACP染色, h.单核细胞ACP染色, i.小淋巴细胞ACP染色 |
嗜中性粒细胞、嗜酸性粒细胞、单核细胞以及小淋巴细胞中均呈阳性反应, 即胞质中有酸性磷酸酶, 呈颗粒状。嗜中性粒细胞颗粒稀疏细小, 呈宝石红色或暗红色, 核上偶有颗粒; 嗜酸性粒细胞和单核细胞颗粒大小不均一; 小淋巴细胞常见一至二个颗粒(图 5f-i)。
2.3.3 碱性磷酸酶染色外周血细胞只有嗜中性粒细胞呈阳性反应, 胞质中有棕黑色颗粒, 有时颗粒相连, 核上偶有颗粒(图 6a)。
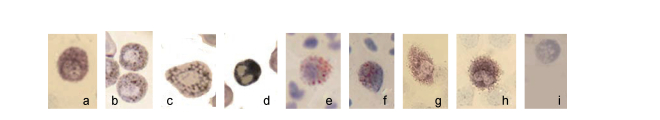 |
| 图 6 斜带髭鲷外周血细胞化学染色(2) Fig. 6 Cytochemical stain of H. nitens blood cell (2) 注: a.嗜中性粒细胞ALP染色, b.嗜中性粒细胞POX染色, c.单核细胞POX染色, d.嗜酸性粒细胞PAS染色, e.嗜中性粒细胞NCAE染色, f.嗜酸性粒细胞NCAE染色, g.单核细胞αNAE染色, h.嗜中性粒细胞αNAE染色阳性, i.嗜碱性粒细胞NCAE阴性 |
嗜中性粒细胞呈阳性反应, 胞质中有细小的棕灰色颗粒, 分布稀疏, 核上偶有颗粒。单核细胞呈阳性反应, 胞质中有棕灰色颗粒, 分布稍稀疏, 有时覆盖在核上。嗜酸性粒细胞呈阳性反应, 胞质中有许多棕灰色颗粒, 颗粒叠加肉眼呈灰黑色。嗜碱性粒细胞和淋巴细胞呈阴性反应(图 6b-d)。
2.3.5 氯乙酸AS-D萘酚酯酶染色嗜中性粒细胞呈阳性反应, 胞质中有细小的颗粒, 呈暗红色或红色, 核上有颗粒出现, 导致核膜不清晰。嗜酸性粒细胞呈弱阳性反应, 胞质中有细小的红色颗粒, 颜色不及嗜中性粒细胞鲜艳。其他细胞均呈阴性反应, 即胞质中不含氯乙酸AS-D萘酚酯酶(图 6e, f)。
2.3.6 α-乙酸萘酚酯酶染色单核细胞呈阳性反应, 胞质中有棕黑色颗粒, 核上偶有颗粒, 导致核膜界限不清楚。嗜中性粒细胞也呈阳性反应, 胞质中有许多细小的棕黑色颗粒, 有时颗粒相连。其他细胞呈阴性反应(图 6g, h)。
3 讨论 3.1 斜带髭鲷血细胞发生规律各种血细胞的寿命是有限的, 原始细胞在造血器官内造血诱导微环境(hematopoietic inductive microenvironment, HIM)的影响和调节下, 经历一系列变化, 分化发育成熟, 新生血细胞不断补充以保持外周循环系统中血细胞动态平衡。不同鱼类血细胞发育过程、形态变化并不一致。
斜带髭鲷红细胞发育经历了原红细胞、早幼红细胞、晚幼红细胞和红细胞四个阶段, 有些鱼类仅观察到原红细胞、幼红细胞和红细胞三个阶段(陈刚等, 2005; 张健东等, 2007; 苑淑宾等, 2011)。在成熟过程中, 胞体逐渐变小, 与草鱼、海鳗、日本黄姑鱼等鱼类红细胞发育过程中胞体变化相一致(郭琼林等, 1994; 谢嘉华, 2004; 苑淑宾等, 2011); 而另一些鱼类如大弹涂鱼、暗纹东方鲀、长鳍裸颊鲷、长吻鮠等, 原红细胞向幼红细胞发育过程中变小, 而后又逐渐变大(李长玲等, 2001; 金丽等, 2007; 顾曙余等, 2007; 曹伏君等, 2014)。
淋巴细胞和单核细胞发育也表现出种间多样性。斜带髭鲷原淋巴细胞发育分化至淋巴细胞时, 胞体由大变小, 与长鳍裸颊鲷、长吻
由原单核细胞发育分化至单核细胞时, 胞体由大变小。日本黄姑鱼、兴国红鲤(林光华等, 1998)等硬骨鱼类在发育过程中幼单核细胞最大; 而大弹涂鱼、斜带石斑鱼(张海发等, 2004)等鱼类在发育过程中幼单核细胞最小。
粒细胞的分化在不同鱼类中存在差异。斜带髭鲷原粒细胞发育至早幼粒细胞后, 分化为嗜中性中幼粒细胞、嗜碱性中幼粒细胞和嗜酸性中幼粒细胞, 与长鳍裸颊鲷粒细胞发育过程相似; 有些鱼类没有观察到嗜碱性粒细胞, 如长吻
三种粒细胞在发育过程中形态变化也不一样。斜带髭鲷嗜中性粒细胞在成熟过程中, 胞体逐渐变小, 南方鲶、兴国红鲤、泥鳅等相同; 有些鱼类嗜中性粒细胞在发育过程中, 胞体先变大后变小, 如军曹鱼(陈刚等, 2005)、长吻
具有造血功能的组织器官, 不同鱼类研究结果不一致。长吻
白细胞是重要的免疫细胞, 在鱼体非特异性免疫和特异性免疫应答中发挥重要作用。白细胞非特异性免疫作用主要通过吞噬作用、呼吸爆发等先天性免疫机制来抵抗病原微生物, 其抗病微生物作用可以通过特异性酶来证明(Shigdar et al, 2009)。
PAS染色一般用来显示糖原和其他多糖物质的存在。糖原的存在为白细胞发挥吞噬作用提供了必要的物质基础, 白细胞在吞噬过程中不仅需要内源性能量也需要外源性能量(Ueda et al, 2001)。斜带髭鲷嗜中性粒细胞、单核细胞、嗜酸性粒细胞呈PAS阳性反应, 这与齐口裂腹鱼(Fang et al, 2013)、鲤鱼(Tripathi et al, 2004)、鳕(Shigdar et al, 2009)、胭脂鱼(金丽等, 2011b)、花斑裸鲤(唐银, 2015)反应相似, 与小锯盖鱼(Santos et al, 2009)单核细胞PAS呈阴性反应有所不同。
在细胞吞噬过程中, 细胞内会产生大量H2O2, 而髓过氧化物酶与H2O2和Cl–等作用可产生次氯酸等较强的杀菌剂, 形成机体强有力的抗感染体系, 过氧化物酶的存在表明血细胞具有抗细菌和吞噬功能。过氧化物酶是哺乳动物嗜中性粒细胞特征性酶之一。斜带髭鲷嗜中性粒细胞POX反应呈阳性, 与齐口裂腹鱼、长吻
酸性磷酸酶ACP为溶酶体标志酶, 是白细胞发挥吞噬、杀菌等功能的重要酶类。斜带髭鲷嗜中性粒细胞和单核细胞ACP反应均呈阳性, 与齐口裂腹鱼、花斑裸鲤、小锯盖鱼、斑点叉尾
斜带髭鲷嗜中性粒细胞碱性磷酸酶(ALP)呈阳性反应, 与小锯盖鱼、鲤鱼相似; 金头鲷(Weinreb, 1963)嗜酸性粒细胞和单核细胞中均发现了ALP; 而花斑裸鲤、胭脂鱼、长薄鳅(黄小铭等, 2012)等血细胞中没有发现ALP。酯酶是血细胞中另一类酶类, 能使酯键断裂, 在细胞防御尤其是吞噬作用中也扮演重要角色(Da Silva et al, 2011), 分特异性酯酶(如氯乙酸AS-D萘酚酯酶)和非特异性酯酶(如α-乙酸萘酚酯酶)。斜带髭鲷嗜中性粒细胞NCAE反应呈阳性, 与鳕鱼相似, 与隆头鱼(Haugland et al, 2014)相反; 嗜酸性粒细胞NCAE呈阳性反应, 与隆头鱼相似。斜带髭鲷单核细胞αNAE反应呈阳性, 与隆头鱼、鳕鱼相同; 嗜中性粒细胞αNAE反应呈阳性, 与隆头鱼不同。ALP和酯酶的存在更进一步增强了细胞的吞噬能力。
4 结论吞噬作用、呼吸爆发作用是白细胞非常重要的非特异性免疫机制, 非特异性免疫与淋巴细胞的特异性免疫共同抵抗病原微生物的入侵。斜带髭鲷多种器官能生成白细胞, 其白细胞含有多种与免疫相关的酶类, 是一种抗病较强的鱼类, 可作为主养品种之一。本研究所用细胞化学染色方法也可作为斜带髭鲷病害诊断的辅助手段。
| 王世锋, 杜佳莹, 苏永全, 等, 2007. 斜带髭鲷野生与养殖群体遗传结构的ISSR分析. 海洋学报, 29(4): 105–110 DOI:10.3321/j.issn:0253-4193.2007.04.012 |
| 王朝新, 2008. 斜带髭鲷海水网箱养殖技术总结. 科学养鱼,(1): 24–25 |
| 刘志洁, 宗英, 2002. 野生动物血液细胞学图谱. 北京: 科学出版社, |
| 张健东, 周晖, 陈刚, 等, 2007. 卵形鲳鲹血细胞发生的观察. 水生生物学报, 31(6): 780–787 DOI:10.3321/j.issn:1000-3207.2007.06.003 |
| 张海发, 王云新, 林蠡, 等, 2004. 斜带石斑鱼血液性状及生化指标的研究. 华南师范大学学报(自然科学版), 1: 102–107 |
| 李长玲, 曹伏君, 刘楚吾, 等, 2001. 大弹涂鱼血细胞发生的研究. 中国水产科学, 8(1): 10–14 DOI:10.3321/j.issn:1005-8737.2001.01.003 |
| 肖义军, 金雅平, 郑翠芳, 等, 2001. 泥鳅头肾、脾脏和肝脏中血细胞发生的观察. 福建师范大学学报(自然科学版), 17(3): 65–69 DOI:10.3969/j.issn.1000-5277.2001.03.016 |
| 邹记兴, 邬国民, 2002. 广东主要海水养殖鱼类繁养殖的现状与展望. 海洋湖沼通报,(4): 83–93 DOI:10.3969/j.issn.1003-6482.2002.04.015 |
| 陈刚, 周晖, 叶富良, 等, 2006. 美国红鱼血细胞观察. 热带海洋学报, 25(2): 59–65 DOI:10.3969/j.issn.1009-5470.2006.02.011 |
| 陈刚, 周晖, 张健东, 等, 2005. 军曹鱼血液指标及血细胞发生的观察. 水生生物学报, 29(5): 564–570 DOI:10.3321/j.issn:1000-3207.2005.05.015 |
| 陈竹, 钟山, 罗大极, 等, 2011. 基于线粒体D-loop区比较分析野生与养殖斜带髭鲷种群的遗传多样性. 水生生物学报, 35(5): 761–767 |
| 陈晓耘, 2000. 南方鲶幼鱼血细胞发生的研究. 西南师范大学学报, 25(3): 281–287 DOI:10.3969/j.issn.1000-5471.2000.03.016 |
| 林光华, 林琼, 洪一江, 等, 1998. 兴国红鲤血细胞发生的研究. 动物学报, 22(4): 488–489 DOI:10.3321/j.issn:0001-7302.1998.04.016 |
金丽, 张耀光, 2007. 长吻 血细胞发生的研究. 水生生物学报, 31(6): 807–816 DOI:10.3321/j.issn:1000-3207.2007.06.006 血细胞发生的研究. 水生生物学报, 31(6): 807–816 DOI:10.3321/j.issn:1000-3207.2007.06.006 |
金丽, 杜长雷, 张耀光, 2011a. 长吻 血细胞的显微、亚显微结构及细胞化学研究.. 西南大学学报(自然科学版), 32(12): 79–85 血细胞的显微、亚显微结构及细胞化学研究.. 西南大学学报(自然科学版), 32(12): 79–85 |
| 金丽, 赵娜, 黄林, 等, 2011b. 胭脂鱼外周血细胞的显微、超微结构与细胞化学观察. 水生生物学报, 35(3): 550–556 |
| 顾曙余, 赵璧影, 杨家新, 2007. 暗纹东方鲀血细胞发生的观察. 淡水渔业, 37(1): 13–18 DOI:10.3969/j.issn.1000-6907.2007.01.003 |
| 郭琼林, 卢全章, 1994. 草鱼肾脏和脾脏血细胞发育过程的观察. 水生生物学报, 17(1): 40–45 |
| 唐银, 2015.养殖花斑裸鲤外周血液生理指标及血细胞形态参数的研究.雅安: 四川农业大学硕士学位论文 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=J0127053 |
| 梁君荣, 王军, 苏永全, 等, 2005. 斜带髭鲷养殖群体遗传多样性RAPD分析. 海洋科学, 29(12): 47–50 DOI:10.3969/j.issn.1000-3096.2005.12.011 |
| 黄小铭, 张耀光, 江星, 等, 2012. 长薄鳅外周血细胞的显微结构和细胞化学特征研究. 四川动物, 31(1): 59–63 DOI:10.3969/j.issn.1000-7083.2012.01.012 |
| 谢嘉华, 2004. 海鳗血细胞的发生. 南昌大学学报(理科版), 28(4): 386–389 DOI:10.3969/j.issn.1006-0464.2004.04.023 |
| 蔡良候, 叶金聪, 温凭, 等, 1997. 斜带髭鲷人工繁殖的初步研究. 现代渔业信息, 12(10): 20–23 |
| 曹伏君, 叶宁, 罗杰, 等, 2014. 长鳍裸颊鲷(Lethrinus erythropterus)血细胞的发生. 海洋与湖沼, 45(2): 387–394 |
| 苑淑宾, 朱爱意, 江丽华, 等, 2011. 日本黄姑鱼血细胞发生的观察. 水产学报, 35(9): 1374–1383 |
| Da Silva W F, Egami M I, Santos A A, et al, 2011. Cytochemical, immunocytochemical and ultrastructural observations on leukocytes and thrombocytes of fat snook (Centropomus parallelus). Fish & Shellfish Immunology, 31(4): 571–577 |
| Dewilde M A, Houson A H, 1967. Hematological aspects of the thermoacclimatory process in the rainbow trout, Salmo gairdner. Journal of the Fisheries Research Board of Canada, 24(11): 2267–2281 DOI:10.1139/f67-185 |
| Fang J, Chen K, Cui H M, et al, 2013. Morphological and cytochemical studies of peripheral blood cells of Schizothorax prenanti. Anatomic Histologia Embryologia, 43(5): 386–394 DOI:10.1111/ahe.12089 |
| Haugland G T, Rønneseth A, Wergeland H I, 2014. Flow cytometry analyses of phagocytic and respiratory burst activities and cytochemical characterization of leucocytes isolated from wrasse (Labrus bergylta A).. Fish & Shellfish Immunology, 39(1): 51–60 |
| Santos A A, Egami M I, Ranzani-Paiva M J T, et al, 2009. Hematological parameters and phagocytic activity in fat snook (Centropomus parallelus): Seasonal variation, sex and gonadal maturation. Aquaculture, 296(3): 359–366 |
| Shigdar S, Harford A, Ward A C, 2009. Cytochemical characterisation of the leucocytes and thrombocytes from Murray cod (Maccullochella peelii peelii, Mitchell). Fish & Shellfish Immunology, 26(5): 731–736 |
| Tavares-Dias M, De Moraes F R, 2007. Leukocyte and thrombocyte reference values for channel Catfish (Ictalurus punctatus Raf), with an assessment of morphologic, cytochemical, and ultrastructural features. Veterinary Clinical Pathology, 36(1): 49–54 DOI:10.1111/vcp.2007.36.issue-1 |
| Tripathi N K, Latimer K S, Burnley V V, 2004. Hematologic reference intervals for koi (Cyprinus carpio), including blood cell morphology, cytochemistry, and ultrastructure. Veterinary Clinical Pathology, 33(2): 74–83 DOI:10.1111/vcp.2004.33.issue-2 |
| Ueda I K, Egami M I, da Silva Sasso W, et al, 2001. Cytochemical aspects of the peripheral blood cells of Oreochromis (Tilapia) niloticus. (Linnaeus..1758) (Cichlidae, Teleostei): Part Ⅱ. Brazilian Journal of Veterinary Research and Animal Science, 38(6): 273–277 |
| Weinreb E L, 1963. Studies on the fine structure of teleost blood cells. Ⅰ. Peripheral blood. The Anatomical Record, 147(2): 219–238 DOI:10.1002/(ISSN)1097-0185 |
 2018, Vol. 49
2018, Vol. 49

