中国海洋湖沼学会主办。
文章信息
- 李娜, 孔凡娜, 李超, 孙佩佩, 董道英, 茅云翔. 2018.
- LI Na, KONG Fan-Na, LI Chao, SUN Pei-Pei, DONG Dao-Ying, MAO Yun-Xiang. 2018.
- 条斑紫菜丝裂原活化蛋白激酶PyMAPK3基因的克隆及胁迫条件下的功能分析
- CLONING AND EXPRESSION OF PYMAPK3 IN PYROPIA YEZOENSIS UNDER DIFFERENT STRESSES
- 海洋与湖沼, 49(6): 1279-1285
- Oceanologia et Limnologia Sinica, 49(6): 1279-1285.
- http://dx.doi.org/10.11693/hyhz20180400094
-
文章历史
- 收稿日期:2018-04-16
- 收修改稿日期:2018-07-06
条斑紫菜(Pyropia yezoensis)分布于潮间带, 随着潮汐的变化周期性的经历水分、渗透压及温度的胁迫, 是研究潮间带海藻生理生态及逆境胁迫适应机制的代表性模式物种。丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联反应是真核生物中最具特征的信号放大级联反应, 在进化上具有保守性, 能将细胞外刺激转化为细胞内的反应(Xu et al, 2015)。已有众多研究证实MAPK级联途径参与了植物的生长发育及众多生物及非生物胁迫的调节, 包括干旱、低温、高盐、缺氧及病原菌的侵染(Colcombet et al, 2008; Meng et al, 2013; Benhamman et al, 2017; Zhao et al, 2017)。
MAPK级联途径的基本组成部分包含三个相互关联的激酶模块: MAPKKK/MEKK, MAPKK/MKK和MAPK/MPK (Mészáros et al, 2006)。MAPKKK作为MAPK级联信号途径的最上游功能分子, 将细胞膜上受体分子感受的信号传入MAPK信号通路, 活化的MAPKKK通过磷酸化MAPKK活化环上的丝氨酸和苏氨酸将二级功能分子MAPKK激活, 活化的MAPKK进而磷酸化MAPK蛋白的T-X-Y motif中的T和Y从而激活MAPK。被激活的MAPK有的停留在细胞质中激活骨架蛋白或磷酸化蛋白酶类, 有的进入细胞核激活相应的转录因子从而调控基因的转录水平, 并最终引起细胞中的一系列生理响应(Mishra et al, 2006; Zhang et al, 2006)。根据编码氨基酸保守域TxY基序的不同可将植物中的MAPK基因分为TEY类和TDY类(Asai et al, 2002)。TEY类可分为A、B和C三大亚族, TDY类属于D亚族。MAPKs的结构域特征相似度较高, 蛋白序列中含有11个Ser/Thr保守结构域, 且在Ⅶ和Ⅷ的Ser/Thr结构域之间存在一个T-loop (Activation-loop)的环状结构。T-loop环中具有一个保守的Ser-x-Tyr三肽基序(TxY), TxY基序中的x常为E (谷氨酸)或D(天冬氨酸), 即ATP磷酸化位点或活性片段。
MAPK的A、B、C、D亚族在植物的逆境胁迫响应中也发挥着不同的作用。A亚族的MAPKs主要参与植物的逆境胁迫和激素应答。如拟南芥中AtMPK3和AtMPK6参与了病原侵染、氧化胁迫及植物激素等信号传递过程; 水稻的OsMPK5可被不同的病原菌及环境刺激所诱导(Huang et al, 2000; Petersen et al, 2000; Droillard et al, 2002, 2004)。B亚族的MAPKs研究较少, 已有研究证明其参与了环境胁迫应答和细胞周期的调节。C亚族的MAPKs参与了机械损伤及激素的调节, 如拟南芥的AtMPK1、AtMPK2受机械损伤、JA、ABA及H2O2的诱导(Dahan et al, 2009; Zhang et al, 2011; Shin et al, 2014; Liu et al, 2017)。D亚族的MAPKs与A、B及C亚族存在较大的结构差异, 关于D类MAPKs的研究多集中在单子叶植物中, 如水稻的OsBWMK1与植物病原菌侵染的抗病反应有关, OsMPK13、OsMPK15、OsMPK17均可被病原菌, SA及ET诱导表达(Agrawal et al, 2002; Soyano et al, 2003)。
条斑紫菜(Pyropia yezoensis)是广泛分布于潮间带的大型海藻, 由于其特殊的生长环境及自身具有的较强抗逆性使其成为研究潮间带逆境胁迫适应机制的代表性模式物种。然而, 目前对条斑紫菜MAPK基因的克隆及非生物胁迫下的表达研究尚未见报道。本研究以条斑紫菜叶状体为实验材料, 通过分子生物学手段对PyMAPK3基因的生物学特性及逆境胁迫下的表达模式进行研究分析。
1 材料与方法 1.1 材料实验材料为实验室培养的条斑紫菜纯系RZ叶状体。
1.2 方法 1.2.1 条斑紫菜干旱、盐度及温度胁迫处理选择叶片完整光滑、色深且有光泽的生长旺盛的健康藻体为材料, 通气瓶中培养驯化1—2周, 培养条件:光照为35—45μmol photons/(m2·s), 光周期为12L:12D, 10℃通气培养。不同的处理条件见表 1(每个处理设置3个平行), 处理后的样品置于液氮中保存。
| 样品名称 | 处理条件 |
| 对照组(正常培养) | 盐度33的无菌海水, 4h, 10℃ |
| 失水率10% | 放在有干燥剂的密闭培养皿中直至失水率达到10%, 10℃ |
| 失水率30% | 放在有干燥剂的密闭培养皿中直至失水率达到30%, 10℃ |
| 失水率50% | 放在有干燥剂的密闭培养皿中直至失水率达到50%, 10℃ |
| 失水率70% | 放在有干燥剂的密闭培养皿中直至失水率达到70%, 10℃ |
| 失水率80%后复水15min | 放在有干燥剂的密闭培养皿中直至失水率达到80%, 然后放在盐度33的无菌海水中复水15min, 10℃ |
| 失水率80%后复水30min | 放在有干燥剂的密闭培养皿中直至失水率达到80%, 然后放在盐度33的无菌海水中复水30min, 10℃ |
| 海水盐度8 (超低渗) | 250mL盐度33的无菌海水中加750ml去离子水, 4h, 10℃ |
| 海水盐度16 (低渗) | 500mL盐度33的无菌海水中加500ml去离子水, 4h, 10℃ |
| 海水盐度47 (高渗) | 1L盐度33的无菌海水中加16g NaCl, 4h, 10℃ |
| 海水盐度60 (超高渗) | 1L盐度33的无菌海水中加33g NaCl, 4h, 10℃ |
| -8℃ | 盐度33的无菌海水, 4h, -8℃ |
| 0℃ | 盐度33的无菌海水, 4h, 0℃ |
| 16℃ | 盐度33的无菌海水, 4h, 16℃ |
| 24℃ | 盐度33的无菌海水, 4h, 24℃ |
利用植物组织RNA提取试剂盒(E.Z.N.A total RNA Kit)提取不同处理条件下叶状体的RNA, 1%琼脂糖凝胶检测其完整性, NanoDrop检测浓度及质量, 将质量合格(A260/A230=2.0—2.2, A260/A280=1.8—2.0)的RNA合成cDNA, 合成方法参照PrimeScript RT reagent kit with gDNA Eraser试剂盒的说明。DNA的提取使用植物基因组DNA提取试剂盒(TIANGEN)。
1.2.3 PyMAPK3基因克隆与生物信息学分析根据条斑紫菜转录组数据(ID PRJNA235353), 筛选得到一条丝裂原活化蛋白激酶基因。利用本地blast对筛选获得的基因进行拼接延伸。将拼接后的序列在NCBI的ORF Finder上进行预测。
根据拼接获得的序列, 利用primer5.0设计引物, 分别以DNA和cDNA为模板进行序列扩增。将纯化的PCR产物与pMD18-T连接后转化入大肠杆菌, 通过蓝白班筛选, 挑取白色单菌落, 经PCR验证后, 将阳性克隆送至擎科公司测序。
利用NCBI的ORF Finder网站预测基因的开放阅读框。DNAMAN软件进行氨基酸序列的比对, 运用在线软件ExPASy (http://web.expasy.org/compute_pi/)预测PyMAPK3基因编码的蛋白的等电点及分子量。利用PFAM数据库(http://pfam.xfam.org/)预测蛋白激酶结构域, 利用在线软件PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测顺式作用元件。
1.2.4 PyMAPK3基因的荧光定量PCR分析利用荧光定量PCR方法检测PyMAPK3在不同胁迫下的转录差异。PCR反应体系(20μL)为: SYBR Green I Real-time PCR Master Mix 10μL, cDNA模板2μL, 上、下游引物各0.6μL, 灭菌ddH2O 6.8μL。扩增所用引物为PyMAPK3-F, PyMAPK3-R, 内参基因选择PyEIF和PyUBC(Kong et al, 2015)(引物序列见表 2)。每个处理样品设置3个生物学重复和3个技术重复, 相对表达量的计算利用2-ΔΔCT法(Livak et al, 2001)。利用SPSS软件对试验数据进行差异性分析。
| 基因名称 | 引物序列(5′—3′) |
| PyEIF | F: GCTTTCTGTCTGGACGAGG R: TCTTCACAAGGATGCGGAT |
| PyUBC | F: TCACAACGAGGATTTACCACC R: GAGGAGCACCTTGGAAACG |
| PyMAPK3 | F: GACCAGGTGCGGCGGATTGT R: CTTGCCATACCCGAGGCTGTC |
利用Western-blot的方法检测PyMAPK3蛋白在不同胁迫下的表达量差异。利用植物组织蛋白试剂盒提取不同处理条件下的总蛋白, 用Qubit定量仪测量蛋白浓度, 将等量蛋白与loading混匀后点样于SDS-PAGE胶上电泳, 以电泳后的Rubisco蛋白条带为参照(Kim et al, 2001), 电泳后利用蛋白免疫印迹技术检测不同处理条件下的蛋白表达量。一抗为PyMAPK3全蛋白的鼠源多克隆抗体, 二抗为兔源抗鼠多克隆抗体。利用Image Proplus计算不同处理条件下目的蛋白条带的灰度值。
2 结果与分析 2.1 条斑紫菜PyMAPK3基因的克隆及生物信息学分析将克隆所得序列进行测序验证, 同时在NCBI上对核酸序列进行比对分析及ORF的查找, 其ORF为1401bp, 编码466个氨基酸。在开放阅读框两端设计引物, 利用DNA及cDNA为模板分别进行扩增, 序列比对发现PyMAPK3基因含有两个内含子。氨基酸序列分析显示, PyMAPK3的等电点为7.17, 蛋白分子量为51.6KDa。亚细胞定位的预测结果显示, PyMAPK3定位于叶绿体。通过对PyMAPK3的氨基酸序列分析发现, PyMAPK3蛋白的磷酸化位点的氨基酸基序为TDY。启动子顺势作用元件结果显示, PyMAPK3启动子区含有ABA响应元件ABRE和调控元件G-box。
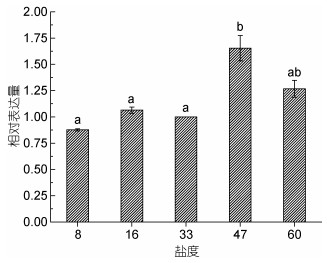
2.2 PyMAPK3基因在水分、盐度、温度胁迫响应中的表达分析为了探究PyMAPK3基因在干旱、盐度及温度胁迫下的表达模式, 采用荧光定量PCR的方法检测了PyMAPK3在转录水平的变化规律。结果显示(图 1), PyMAPK3基因的表达量随失水程度的增加呈上升趋势, 在失水初期(失水10%和30%), PyMAPK3的表达量没有显著性增加; 在失水50%及以上时, 基因表达与正常条件下基因表达量相比显著增加; 在复水条件下, PyMAPK3基因的表达量显著降低。而在不同的盐度胁迫下, PyMAPK3基因的表达量没有显著性差异(图 2)。
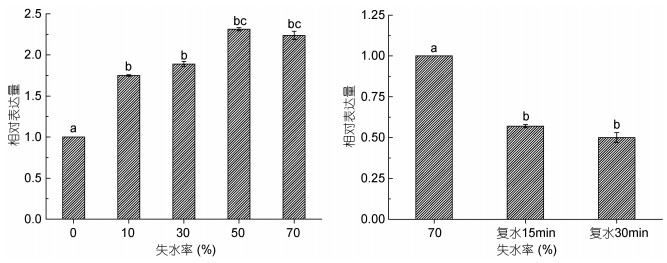 |
| 图 1 失水处理条件下PyMAPK3基因的相对表达量 Fig. 1 The relative expression of PyMAPK3 gene under water stress |
 |
| 图 2 盐度处理条件下PyMAPK3基因的相对表达量 Fig. 2 The relative expression of PyMAPK3 gene under salinity stress |
温度胁迫处理条件下(图 3), PyMAPK3基因的表达量随温度的增加表现出先降低后增加的趋势。在低温(0和-8℃)胁迫下, PyMAPK3基因的表达量随温度的降低而增加, 且在冰冻温度(-8℃)下基因表达量显著增加; 在高温(16和24℃)胁迫下, 基因的表达量随温度的升高而增加, 且在极端高温(24℃)下, 基因的表达量显著增加。
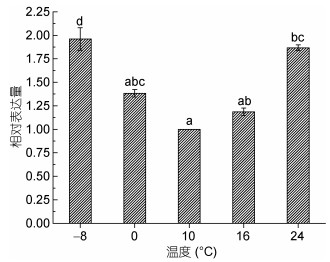 |
| 图 3 温度处理条件下PyMAPK3基因的相对表达量 Fig. 3 The relative expression of PyMAPK3 gene under thermal stress |
为了探究PyMAPK3蛋白在干旱、盐度及温度胁迫下的表达模式, 采用蛋白免疫印迹(western-blot)的方法对PyMAPK3蛋白进行检测。结果显示, PyMAPK3蛋白表达量随失水程度的增加表现出先降低后增加的趋势(图 4), 在失水初期(失水10%—30%), PyMAPK3蛋白表达量随失水程度的增加而降低; 随着失水程度的进一步增加(失水50%—70%), PyMAPK3蛋白表达量随失水程度的增加而增加。在复水环境下, PyMAPK3蛋白表达量随复水时间的增加而增加。
 |
| 图 4 PyMAPK3蛋白在水分胁迫条件下的相对表达量 Fig. 4 The relative expression of a PyMAPK3 protein under water stress 注: Rubisco为核酮糖-1, 5-二磷酸羧化酶, 作为内参蛋白 |
在盐度胁迫下, PyMAPK3蛋白的表达量随渗透压的改变没有表现出显著性的变化(图 5)。当渗透压低于正常生长盐度(33)时, PyMAPK3的蛋白表达量出现轻微上升趋势。当渗透压高于正常生长盐度(33)时, PyMAPK3的表达量升高。
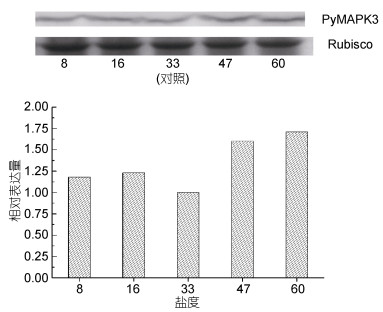 |
| 图 5 PyMAPK3蛋白在盐度胁迫条件下的相对表达量 Fig. 5 The relative expression of a PyMAPK3 protein under salinity stress |
在温度胁迫下, PyMAPK3蛋白的表达量随温度的升高表现出先降低后增加之后再降低的趋势(图 6)。在低温(-8和0℃)胁迫下, PyMAPK3蛋白表达量随温度的降低先降低后增加; 在高温(16和24℃)胁迫下, PyMAPK3蛋白表达量随温度的升高而降低。
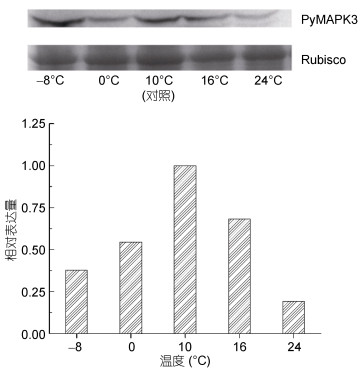 |
| 图 6 PyMAPK3蛋白在温度胁迫条件下的相对表达量 Fig. 6 The relative expression of a PyMAPK3 protein under thermal stress |
近年来, MAPK家族基因的功能在高等植物中已被广泛的研究与报道, 其在植物的逆境胁迫响应中发挥了重要的作用。本研究从条斑紫菜中克隆了一个MAPK基因, 其开放阅读框为1401bp, 含有两个内含子, 编码的氨基酸序列中含有磷酸化的基序TDY, 属于D亚族。目前, 对D亚族的MAPK基因的研究多集中于单子叶植物中, 如水稻的OsBWMK1基因与植物的抗病性相关, 在烟草中过表达OsBWMK1基因会使组成型的抗病基因PR基因表达从而增强植物对真菌(寄生性霉菌)和细菌(假单胞菌)感染的抗性(Cheong et al, 2003)。拟南芥的一个D亚族MAPK基因MPK9优先在保卫细胞中表达并作为活性氧物质(ROS)下游的正调节物参与到保卫细胞中的脱落酸信号传导途径中。
本研究通过荧光定量PCR检测条斑紫菜PyMAPK3基因在不同胁迫下的表达情况, 发现PyMAPK3基因被多种胁迫所诱导, 且在不同的胁迫下呈现出不同的变化趋势, 如在干旱胁迫下, PyMAPK3表达量随失水程度的增加而增加, 在复水条件下表达量降低; 而在盐度胁迫下, 其基因表达量没有显著性差异; 在低温和高温胁迫下, 基因随温度的变化而变化, 且在极端温度(-8和24°4)时基因表达量显著性增加。众多研究表明大多数对失水, 盐度及低温胁迫的响应基因是通过外源的ABA诱导的, 失水胁迫可以触发ABA的产生, 从而诱导基因的表达, ABA在植物对干旱、高盐和寒冷的耐受性中具有重要的作用(Shinozaki et al, 1996; Bray 1997)。而ABA对基因的诱导是通过基因启动子中的顺势作用元件来调节的, 包括ABA的识别元件ABRE、干旱响应元件DRE等。在PyMAPK3顺式作用元件的分析中发现其含有ABA的响应元件ABRE, 因此PyMAPK3对胁迫的响应过程可能是通过内源ABA的积累产生所诱导激活的。许多证据已证实MAPK级联反应在植物的非生物胁迫(如干旱, 渗透压及温度)响应中起到积极的作用(Ichimura et al, 2002; Teige et al, 2004)。如拟南芥的ATMPK3在mRNA水平上能被干旱, 低温, 高盐及伤害所诱导(Mizoguchi et al, 1996)。苜蓿MMK4在翻译后水平上能被多种胁迫包括干旱, 低温及机械刺激所激活(Jonak et al, 1996)。
此外, 在本研究中, 我们发现PyMAPK3在不同的胁迫下转录水平和翻译水平上有不同的表达规律。如在失水胁迫下, PyMAPK3在转录水平上呈上调表达, 其蛋白在翻译水平上呈现下调表达趋势。在渗透压胁迫下, PyMAPK3在转录水平和翻译水平上均没有显著性差异; 在温度胁迫下, 在低温胁迫下, 转录水平上和蛋白水平上表达均上调, 而在高温胁迫下, 转录水平上表达上调, 而蛋白水平上表达下调。在水稻中也有类似的报道, 在各种胁迫因子刺激下, BWMK1基因在转录水平发生了不同的变化, 其在蛋白水平上却没有明显的变化(Cheong et al, 2003)。这可能是在信号传递过程中PyMAPK3在翻译水平上通过调控蛋白的活性来实现信号的传导。
4 结论本研究从条斑紫菜克隆了一个丝裂原活化蛋白激酶基因PyMAPK3, 开放阅读框为1401bp, 编码一个含466个氨基酸残基的多肽, 氨基酸序列分析结果显示其属于TDY型。在失水、渗透压和温度胁迫下, 在基因水平及蛋白水平上均表现出不同的表达规律。条斑紫菜作为一种研究潮间带藻类逆境胁迫响应机制的代表性模式物种, 本文对丝裂原活化蛋白激酶的研究能够为揭示条斑紫菜逆境适应机制奠定基础。
| Agrawal G K, Rakwal R, Iwahashi H, 2002. Isolation of novel rice (Oryza sativa L.) multiple stress responsive MAP kinase gene, OsMSRMK2, whose mRNA accumulates rapidly in response to environmental cues. Biochemical and Biophysical Research Communications, 294(5): 1009–1016 DOI:10.1016/S0006-291X(02)00571-5 |
| Asai T, Tena G, Plotnikova J, et al, 2002. MAP kinase signalling cascade in Arabidopsis innate immunity. Nature, 415(6875): 977–983 DOI:10.1038/415977a |
| Benhamman R, Bai F W, Drory S B, et al, 2017. The Arabidopsis Mitogen-activated protein Kinase Kinase Kinase 20 (MKKK20) acts upstream of MKK3 and MPK18 in two separate signaling pathways involved in root microtubule functions. Frontiers in Plant Science, 8: 1352 DOI:10.3389/fpls.2017.01352 |
| Bray E A, 1997. Plant responses to water deficit. Trends in Plant Science, 2(2): 48–54 DOI:10.1016/S1360-1385(97)82562-9 |
| Cheong Y H, Moon B C, Kim J K, et al, 2003. BWMK1, a rice mitogen-activated protein kinase, locates in the nucleus and mediates pathogenesis-related gene expression by activation of a transcription factor. Plant Physiology, 132(4): 1961–1972 DOI:10.1104/pp.103.023176 |
| Colcombet J, Hirt H, 2008. Arabidopsis MAPKs:a complex signalling network involved in multiple biological processes. Biochemical Journal, 413(2): 217–226 DOI:10.1042/BJ20080625 |
| Dahan J, Pichereaux C, Rossignol M, et al, 2009. Activation of a nuclear-localized SIPK in tobacco cells challenged by cryptogein, an elicitor of plant defence reactions. Biochemical Journal, 418(1): 191–200 |
| Droillard M J, Boudsocq M, Barbier-Brygoo H, et al, 2002. Different protein kinase families are activated by osmotic stresses in Arabidopsis thaliana cell suspensions. FEBS Letters, 527(1-3): 43–50 DOI:10.1016/S0014-5793(02)03162-9 |
| Droillard M J, Boudsocq M, Barbier-Brygoo H, et al, 2004. Involvement of MPK4 in osmotic stress response pathways in cell suspensions and plantlets of Arabidopsis thaliana:activation by hypoosmolarity and negative role in hyperosmolarity tolerance. FEBS Letters, 574(1-3): 42–48 DOI:10.1016/j.febslet.2004.08.001 |
| Huang Y F, Li H, Gupta R, et al, 2000. ATMPK4, an Arabidopsis homolog of mitogen-activated protein kinase, is activated in vitro by AtMEK1 through threonine phosphorylation. Plant Physiology, 122(4): 1301–1310 DOI:10.1104/pp.122.4.1301 |
| Ichimura K, Shinozaki K, Tena G, et al, 2002. Mitogen-activated protein kinase cascades in plants:a new nomenclature. Trends in Plant Science, 7(7): 301–308 DOI:10.1016/S1360-1385(02)02302-6 |
| Jonak C, Kiegerl S, Ligterink W, et al, 1996. Stress signaling in plants:a mitogen-activated protein kinase pathway is activated by cold and drought. Proceedings of the National Academy of Sciences of the United States of America, 93(20): 11274–11279 DOI:10.1073/pnas.93.20.11274 |
| Kim S T, Cho K S, Jang Y S, et al, 2001. Two-dimensional electrophoretic analysis of rice proteins by polyethylene glycol fractionation for protein arrays. Electrophoresis, 22(10): 2103–2109 DOI:10.1002/(ISSN)1522-2683 |
| Kong F N, Cao M, Sun P P, et al, 2015. Selection of reference genes for gene expression normalization in Pyropia yezoensis using quantitative real-time PCR. Journal of Applied Phycology, 27(2): 1003–1010 DOI:10.1007/s10811-014-0359-6 |
| Liu C, Wei C, Zhang M, et al, 2017. Mulberry MnMAPK1, a group C mitogen-activated protein kinase gene, endowed transgenic Arabidopsis with novel responses to various abiotic stresses. Plant Cell, Tissue and Organ Culture (PCTOC), 131(1): 151–162 DOI:10.1007/s11240-017-1272-x |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Mészáros T, Helfer A, Hatzimasoura E, et al, 2006. The Arabidopsis MAP kinase kinase MKK1 participates in defence responses to the bacterial elicitor flagellin. The Plant Journal, 48(4): 485–498 DOI:10.1111/tpj.2006.48.issue-4 |
| Meng X Z, Zhang S Q, 2013. MAPK cascades in plant disease resistance signaling. Annual Review of Phytopathology, 51: 245–266 DOI:10.1146/annurev-phyto-082712-102314 |
| Mishra N S, Tuteja R, Tuteja N, 2006. Signaling through MAP kinase networks in plants. Archives of Biochemistry and Biophysics, 452(1): 55–68 DOI:10.1016/j.abb.2006.05.001 |
| Mizoguchi T, Irie K, Hirayama T, et al, 1996. A gene encoding a mitogen-activated protein kinase kinase kinase is induced simultaneously with genes for a mitogen-activated protein kinase and an S6 ribosomal protein kinase by touch, cold, and water stress in Arabidopsis thaliana. Proceedings of the National Academy of Sciences of the United States of America, 93(2): 765–769 DOI:10.1073/pnas.93.2.765 |
| Petersen M, Brodersen P, Naested H, et al, 2000. Arabidopsis MAP kinase 4 negatively regulates systemic acquired resistance. Cell, 103(7): 1111–1120 DOI:10.1016/S0092-8674(00)00213-0 |
| Shin H Y, You M K, Jeung J U, et al, 2014. OsMPK3 is a TEY-type rice MAPK in Group C and phosphorylates OsbHLH65, a transcription factor binding to the E-box element. Plant Cell Reports, 33(8): 1343–1353 DOI:10.1007/s00299-014-1620-9 |
| Shinozaki K, Yamaguchi-Shinozaki K, 1996. Molecular responses to drought and cold stress. Current Opinion in Biotechnology, 7(2): 161–167 DOI:10.1016/S0958-1669(96)80007-3 |
| Soyano T, Nishihama R, Morikiyo K, et al, 2003. NQK1/NtMEK1 is a MAPKK that acts in the NPK1 MAPKKK-mediated MAPK cascade and is required for plant cytokinesis. Genes & Development, 17(8): 1055–1067 |
| Teige M, Scheikl E, Eulgem T, et al, 2004. The MKK2 pathway mediates cold and salt stress signaling in Arabidopsis. Molecular Cell, 15(1): 141–152 DOI:10.1016/j.molcel.2004.06.023 |
| Xu J, Zhang S Q, 2015. Mitogen-activated protein kinase cascades in signaling plant growth and development. Trends in Plant Science, 20(1): 56–64 DOI:10.1016/j.tplants.2014.10.001 |
| Zhang A Y, Jiang M Y, Zhang J H, et al, 2006. Mitogen-activated protein kinase is involved in abscisic acid-induced antioxidant defense and acts downstream of reactive oxygen species production in leaves of maize plants. Plant Physiology, 141(2): 475–487 DOI:10.1104/pp.105.075416 |
| Zhang L, Xi D M, Li S W, et al, 2011. A cotton group C MAP kinase gene, GhMPK2, positively regulates salt and drought tolerance in tobacco. Plant Molecular Biology, 77(1-2): 17–31 DOI:10.1007/s11103-011-9788-7 |
| Zhao C Z, Wang P C, Si T, et al, 2017. MAP kinase cascades regulate the cold response by modulating ICE1 protein stability. Developmental Cell, 43(5): 618–629 DOI:10.1016/j.devcel.2017.09.024 |
 2018, Vol. 49
2018, Vol. 49


