中国海洋湖沼学会主办。
文章信息
- 韩帅帅, 曹文浩, 严涛, 谢恩义, 林岳光, 程志强, 林明晴. 2018.
- HAN Shuai-Shuai, CAO Wen-Hao, YAN Tao, XIE En-Yi, LIN Yue-Guang, CHENG Zhi-Qiang, LIN Ming-Qing. 2018.
- 雷州半岛东部近海浮标大型固着生物污损特点
- BIOFOULING BY SESSILE MACRO-ORGANISMS ON OFFSHORE BUOYS EAST OF THE LEIZHOU PENINSULA, THE NORTHERN SOUTH CHINA SEA
- 海洋与湖沼, 49(4): 851-857
- Oceanologia et Limnologia Sinica, 49(4): 851-857.
- http://dx.doi.org/10.11693/hyhz20171000255
-
文章历史
- 收稿日期:2017-10-10
- 收修改稿日期:2018-02-19
2. 中国科学院大学 北京 100049;
3. 中国科学院海洋环境腐蚀与生物污损重点实验室 青岛 266071;
4. 广东海洋大学水产学院 湛江 524088
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Key Laboratory of Marine Environmental Corrosion and Bio-fouling, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
4. Faculty of Fisheries, Guangdong Ocean University, Zhanjiang 524088, China
随着海洋经济的发展, 近海离岸海区的人工设施越来越多, 它们一方面会导致原有的自然环境状况发生改变(Glasby, 1999; Connell, 2000, 2001; Holloway et al, 2002), 另一方面也可为海洋生物提供新的栖息场所。然而, 海洋生物的附着会改变人工设施表面微环境, 加速金属腐蚀过程(Little et al, 1991; Videla et al, 1992; 杨天笑等, 2013), 增大粗糙度(Schultz et al, 2011), 显著增加载荷效应, 影响设施的安全(Edyvean et al, 1985)。开展近海设施污损生物生态的研究, 不仅有助于了解和掌握污损生物群落形成及发展的规律, 为海洋污损生物的防除提供科学依据, 还可为受损生境的修复和重建积累数据资料。
南海海域纵跨热带与亚热带, 具有水温高、盐度大、透明度好的特点, 相对于渤海、黄海和东海而言, 其污损生物种类多、附着量大, 长期以来一直是我国污损生物生态调查的重点海区(方芳等, 2004)。雷州半岛位于南海北部, 虽然其周边海域浮标上的污损生物曾被系统调查(黄宗国等, 1982; 林盛等, 1989; 严岩等, 1994; 严涛等, 1998; 曹文浩等, 2017)。然而, 在离岸数十公里远的东部近海海域, 有关资料至今仍为空白。因此, 分析研究该海区生物污损特点, 探讨其发展变化趋势, 不仅在国民经济建设方面具有重要的意义, 而且在科学研究上也具有重要的价值。
1 材料与方法 1.1 样品采集于2016年8月末调查了布设在雷州半岛东部海域的3个近海浮标, 其中1号浮标离岸距离约42km, 4号浮标距岸约35km, 7号浮标距岸约30km (图 1)。3个浮标的浸海时间均约24个月。在1号浮标水线、4号浮标水线和侧面、7号浮标水线、侧面、底部和尾管处定量取样, 其中水线部位取样面积为20cm× 20cm, 其余部位为30cm×30cm。
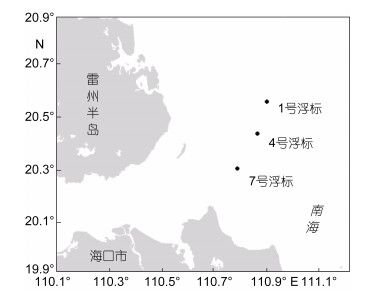 |
| 图 1 雷州半岛东部近海浮标调查站位布设示意图 Fig. 1 Location of the offshore buoys east of the Leizhou Peninsula, the northern South China Sea |
样品从浮标上采集后立即用5%福尔马林溶液浸泡, 带回实验室内对样品进行称重和计数, 记录其生物附着量和附着密度, 并对所有样品个体一般鉴定到种, 至少到属。分析鉴定后, 将样品浸泡在70%酒精溶液内保存。样本采集、样品处理以及室内分析等均按照《海洋调查规范》 (中华人民共和国国家质量监督检验检疫总局等, 2007)进行。
1.2 数据处理 1.2.1 群落优势种根据Pinkas相对重要性指数(IRI)(Lin et al, 2017), 对大型固着污损生物群落优势种进行了探讨。其计算公式为:
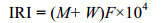
式中, M为某一种类的个体数占总个体数的百分比; W为某一种类的附着量占总生物附着量的百分比; F为某一种类出现的站数占调查总站数的百分比。本文规定IRI≥500为优势种, 100≤IRI<500为常见种, 10≤IRI<100为一般种, IRI<10为罕见种。
1.2.2 方差分析采用SPSS 19.0软件分别对浮标水线(1、4、7号浮标), 侧面(4、7号浮标), 底部和尾管部位(7号浮标)的大型固着污损生物的附着量进行单因子方差(One-way ANOVA)分析, 当差异显著时采用Duncan法, 比较各组之间的差异, 显著水平P设为0.05。
1.2.3 群落多样性指数物种多样性是衡量一个群落稳定性的重要指标。采用Primer 6软件包中的Shannon-Wiener多样性指数(H')、Margalef物种丰富度指数(d)和Pielou均匀度指数(J')对浮标上大型固着污损生物群落多样性进行研究(Pielou, 1975; Ulanowicz, 2001; 林和山等, 2012)。
Shannon-Wiener多样性指数:
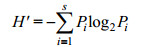
Margalef物种丰富度指数:
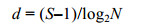
Pielou均匀度指数:
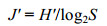
式中, N为样品中总的生物附着量, S为样品种类总数, Pi为第i种生物的附着量与总生物附着量的比值。
2 结果 2.1 种类组成在雷州半岛东部近海海域3个浮标上共采集和鉴定出大型固着污损生物35种, 其中无柄蔓足类8种(占22.85%), 有柄蔓足类2种(占5.71%), 双壳类20种(占57.14%), 管栖多毛类1种(占2.86%), 藻类1种(占2.86%), 苔藓动物1种(占2.86%), 水螅类1种(占2.86%), 腔肠动物1种(占2.86%)。
表 1列出了雷州半岛东部近海各浮标不同部位大型固着污损生物的相对重要性指数(IRI)。可见其会随浮标布设位置及采样部位的不同而发生相应的变化, 另外, 相关数据还显示该调查海域大型固着污损生物优势种以侧花海葵(Anthopleura spp.)、变化短齿蛤(Brachidontes variabilis)和网纹藤壶(Balanus reticulatus)为主, 其次为翡翠贻贝(Perna viridis)、刺巨藤壶(Megabalanus volcano)和钟巨藤壶(M. tintinnabulum tintinnabulum)。常见种则分别为三角藤壶(Balanus trigonus)、齿缘牡蛎(Dendostrea folium)和中华小藤壶(Chthamalus sinensis), 一般种则分别为东方缝栖蛤(Hiatella orientalis)、红巨藤壶(Megabalanus rosa)和豆荚钳蛤(Isognomon legumen)等, 至于习见圆蛤(Cycladicama ethima)、短翼珍珠贝(Pteria brevialata)和内刺盘管虫(Hydroides ezoensis)等则偶尔出现。
| 种类 | 水线 | 侧面 | 底部 | 尾管 | 总体平均值 | ||||||
| 1号标 | 4号标 | 7号标 | 4号标 | 7号标 | 7号标 | 7号标 | |||||
| 高峰星藤壶(Chirona amaryllis) | 50.78 | 15.19 | 8.11 | ||||||||
| 网纹藤壶(Balanus reticulatus) | 6899.16 | 682.25 | 862.64 | 9098.02 | 3208.17 | 1301.17 | 4297.43 | 3331.98 | |||
| 三角藤壶(B. trigonus) | 64.90 | 831.44 | 1237.77 | 311.78 | 817.18 | 311.39 | |||||
| 红巨藤壶(Megabalanus rosa) | 14.68 | 150.08 | 72.08 | 26.34 | |||||||
| 钟巨藤壶(M. tintinnabulum tintinnabulum) | 1890.07 | 966.28 | 765.60 | 1242.51 | 670.72 | 823.29 | |||||
| 刺巨藤壶(M. volcano) | 2887.08 | 3161.46 | 7038.24 | 2759.81 | 1039.12 | 260.44 | 60.28 | 2362.16 | |||
| 中华小藤壶(Chthamalus sinensis) | 832.68 | 87.26 | 94.17 | 71.06 | 25.36 | 4.46 | 118.70 | ||||
| 鳞笠藤壶(Tetraclita squamosa squamosa) | 215.00 | 37.60 | 7.57 | 23.77 | |||||||
| 茗荷(Lepas anatifera) | 53.75 | 3.04 | |||||||||
| 鹅茗荷(L. anserifera) | 101.61 | 1.28 | |||||||||
| 棕蚶(Barbatia bicolorata) | 5.27 | 0.33 | |||||||||
| 布纹蚶(B. grayana) | 1.24 | 0.07 | |||||||||
| 青蚶(B. virescens) | 1.77 | 18.72 | 1.49 | ||||||||
| 糙猿头蛤(Chama asperella) | 28.51 | 0.45 | |||||||||
| 东方缝栖蛤(Hiatella orientalis) | 198.58 | 82.64 | 88.10 | 2.83 | 85.33 | 2.02 | 11.57 | 65.26 | |||
| 豆荚钳蛤(Isognomon legumen) | 5.61 | 6.92 | 33.70 | 134.93 | 14.08 | 214.67 | 39.99 | ||||
| 椭圆异心蛤(Heterocardia gibbasula) | 2.44 | 0.07 | |||||||||
| 变化短齿蛤(Brachidontes variabilis) | 4165.91 | 12297.53 | 6908.86 | 255.72 | 1377.88 | 29.08 | 344.14 | 4821.46 | |||
| 珊瑚绒贻贝(Gregariella coralliophaga) | 3.35 | 3.72 | 2.22 | 1.23 | |||||||
| 带偏顶蛤(Modiolus comptus) | 3.29 | 0.49 | |||||||||
| 小肌蛤(Musculus nanus) | 44.89 | 50.43 | 71.53 | 34.56 | 81.60 | 33.68 | 41.79 | ||||
| 凸壳肌蛤(M. senhousei) | 32.54 | 9.87 | 5.46 | ||||||||
| 翡翠贻贝(Perna viridis) | 467.28 | 418.73 | 523.22 | 26.94 | 2815.04 | 7477.26 | 5698.79 | 2417.76 | |||
| 黑荞麦蛤(Xenostrobus atratus) | 193.04 | 46.26 | 44.76 | 13.65 | 1.26 | 29.33 | |||||
| 缘齿牡蛎(Dendostrea crenulifera) | 4.26 | 5.04 | 3.85 | 2.15 | |||||||
| 齿缘牡蛎(D. folium) | 140.08 | 20.48 | 569.76 | 358.01 | 232.48 | 152.07 | |||||
| 短翼珍珠贝(Pteria brevialata) | 1.63 | 0.09 | |||||||||
| 鹌鹑珍珠贝(P. coturnix) | 5.42 | 0.36 | |||||||||
| 温和翘鳞蛤(Irus mitis) | 12.59 | 0.87 | 6.67 | 2.24 | 2.46 | ||||||
| 习见圆蛤(Cycladicama ethima) | 1.59 | 0.07 | |||||||||
| 侧花海葵(Anthopleura spp.) | 319.08 | 3101.75 | 3414.28 | 5816.52 | 7030.99 | 8302.20 | 6696.81 | 4622.26 | |||
| 双叉薮枝螅水母(Obelia dichotoma) | 238.65 | 6.89 | 27.41 | 18.60 | |||||||
| 萨氏膜孔苔虫(Membranipora savartii) | 5.90 | 23.87 | 26.74 | 2.68 | |||||||
| 内刺盘管虫(Hydroides ezoensis) | 1.57 | 0.07 | |||||||||
| 石莼(Ulva lactuca) | 98.05 | 3.86 | |||||||||
3个浮标水下各部位均遭受大型固着生物的严重污损, 相关的生物附着量见图 2。在水线部位, 1号浮标生物附着量为6696.38g/m2, 4号浮标8013.90g/m2, 7号浮标4369.63g/m2, 各浮标间差异不显著(P>0.05);在浮体侧面, 4号和7号浮标生物附着量分别为8226.26g/m2和7871.29g/m2, 组间也无显著性差异(P>0.05);至于7号浮标的底部和尾管, 虽然前者生物附着量(8641.71g/m2)高于后者(3994.20g/m2), 但其间差异仍不显著(P>0.05)。
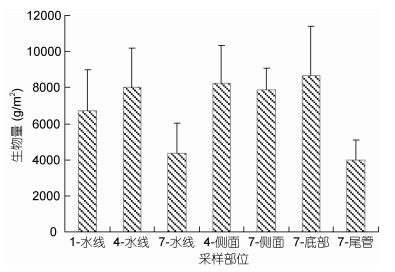 |
| 图 2 雷州半岛东部近海浮标大型固着生物的附着量 Fig. 2 Biomass of sessile macro-organisms on offshore buoys east of the Leizhou Peninsula |
表 2列出了固着生物优势种在3个浮标不同部位的附着密度。在水线部位, 变化短齿蛤的附着密度最高, 且最高值出现在4号浮标上, 为21017个/m2; 在侧面部位, 网纹藤壶、刺巨藤壶等无柄蔓足类在4号浮标的附着密度均高于7号浮标; 至于7号浮标底部和尾管部位, 变化短齿蛤的附着密度明显减少, 翡翠贻贝在浮标底部的附着密度为467个/m2, 是尾管部位的3倍左右。
| 种类 | 水线 | 侧面 | 底部 | 尾管 | ||||||
| 1号标 | 4号标 | 7号标 | 4号标 | 7号标 | 7号标 | 7号标 | ||||
| 变化短齿蛤(Brachidontes variabilis) | 1692 | 21017 | 4542 | 293 | 1081 | 22 | 159 | |||
| 侧花海葵(Anthopleura spp.) | 158 | 9950 | 2808 | 6499 | 6884 | 6429 | 3592 | |||
| 网纹藤壶(Balanus reticulatus) | 1992 | 583 | 467 | 4355 | 1244 | 689 | 1118 | |||
| 翡翠贻贝(Perna viridis) | 67 | 92 | 83 | 19 | 167 | 467 | 163 | |||
| 刺巨藤壶(Megabalanus volcano) | 83 | 92 | 117 | 33 | 22 | 19 | 11 | |||
| 钟巨藤壶(M. tintinnabulum tintinnabulum) | 100 | 67 | 7 | 26 | 15 | |||||
在生物附着量的百分比组成方面(图 3), 无柄蔓足类和双壳类共占总附着量的90%以上, 其中无柄蔓足类主要分布在浮标水线和侧面, 最高值出现在侧面, 为96.05%;而双壳类则主要附着在浮标的底部和尾管等部位, 其中在浮标底部最高, 可达72.19%;腔肠动物在浮标水线部位的附着量百分比较低, 其最高值也出现在浮标底部, 为2.43%;至于有柄蔓足类和藻类则仅在浮标水线部位出现, 其附着量百分比分别为1.79%和2.84%。
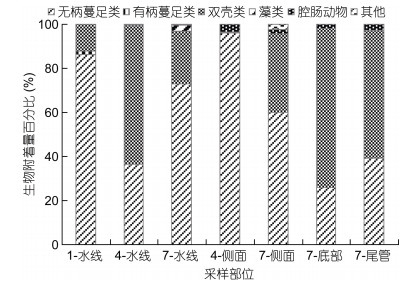 |
| 图 3 雷州半岛东部近海浮标大型固着生物附着量的百分比组成 Fig. 3 Percentage of sessile macro-organisms biomass on offshore buoys east of the Leizhou Peninsula |
雷州半岛东部近海浮标大型固着污损生物的多样性指数变化如表 2所示, 其中物种多样性指数介于1.49—2.99, 丰富度指数1.34—2.68, 均匀度指数0.38—0.64。水平方向上, 多样性指数最高值出现在1号浮标水线部位; 垂直方向上, 侧面部位多样性指数要高于水线部位, 但浮标底部的多样性指数却低于浮标的侧面和尾管等部位, 多样性指数随深度的增加表现出先增加后减少再增加的趋势。
| 站位 | 采样部位 | 多样性指数 | ||
| H′ | d | J′ | ||
| 1号浮标 | 水线 | 2.38 | 1.70 | 0.60 |
| 4号浮标 | 水线 | 1.49 | 1.34 | 0.40 |
| 侧面 | 1.79 | 1.55 | 0.46 | |
| 7号浮标 | 水线 | 1.63 | 1.55 | 0.43 |
| 侧面 | 2.99 | 2.68 | 0.64 | |
| 底部 | 1.50 | 1.55 | 0.38 | |
| 尾管 | 2.08 | 2.53 | 0.47 | |
有关研究表明, 随着离岸距离的增加, 污损生物群落的组成也会发生相应的变化(李静等, 2010)。在雷州半岛东部海域, 茗荷类生物只在离岸最远的1号浮标上出现, 类似现象在珠江口以东和北部湾东北部海域也可观察到(严涛等, 1998, 1999)。另外, 大型藻类虽是污损雷州半岛东南沿岸浮标的优势种类(曹文浩等, 2017), 但本次调查仅在离岸最近的7号浮标发现少量石莼, 这一现象除与离岸距离有关外, 很可能还与本次调查时间安排在夏季有关, 因为在南海北部海域, 大型藻类的生长高峰期通常为冬春季。
作为污损7号浮标绝对优势种的翡翠贻贝, 其附着密度和附着量最高值均出现在浮标底部。这一现象则应与深度和光线的影响有关。首先, 翡翠贻贝的垂直分布呈抛物线形, 其稚贝附着的最佳深度在1—2m(蔡立哲等, 1986), 另外, 不同种类污损生物幼虫的附着, 对光照强度的要求不同(Kennelly, 1989; Schmidt et al, 1984), 由于同属双壳类贻贝科的紫贻贝(Mytilus edulis)和斑马纹贻贝(Dreissena polymorpha)均偏爱在黑暗环境中附着(Bayne, 1964; Kobak et al, 2007), 因此, 翡翠贻贝幼虫的附着可能具有同样特点, 但目前未见相关报道, 需要进一步研究证实。正是由于翡翠贻贝在浮标底部的大量生长, 从而导致该部位的生物多样性指数明显低于侧面和尾管。
湛江港海域污损生物优势种与本次调查结果基本一致(严岩等, 1994), 这可能主要与污损生物的来源相近有关, 因为污损生物通常是来自本地和周边邻近海域的底栖或漂浮性生物群落(Zhang et al, 2015)。在南海北部广东沿岸, 粤西沿岸流基本上终年都是自东北流向西南方向, 然后通过琼州海峡进入北部湾(黄企洲等, 1992; 陈达森等, 2006), 因此, 广东沿岸海域底栖生物群落的幼虫和孢子可以在水体中随粤西沿岸流被输送到本次调查海域, 使之成为该海区浮标上的大型固着污损生物主要来源。
水域的开放与封闭程度, 同样会对污损生物群落的种类组成产生显著影响(曾地刚等, 1999a, b)。在本次调查中, 未见被囊动物出现, 然而, 处在该海域西北方的水东港和博贺港, 浮标污损生物群落中却出现3种被囊动物, 其中硬突小齐海鞘的出现频率甚至高达70%以上(林盛等, 1989)。至于这种现象的发生, 很可能是因为处在雷州半岛东部的近海水域极为开阔, 不同于封闭程度极高的水东港和博贺港, 故不利于那些青睐栖息在水体交换不畅、半封闭环境中布设的人工设施上的海鞘生存(严涛等, 2017)。
在南海北部近海海域, 以牡蛎为代表的双壳类生物通常是污损生物顶级群落中的主导种类(方芳等, 2004), 然而, 本次调查显示, 牡蛎在污损浮标的大型固着生物群落中仅占很少比例, 这应与本次调查的浮标布设时间仅2年左右有关。一般情况下, 海洋污损生物群落从形成到稳定, 大概需要7—8年甚至更长的时间(严涛等, 2003)。为了更好地揭示热带海域污损生物时空变化规律及关键制约因素的影响, 促进热带海洋生态研究的发展, 今后除了开展长期连续观察分析外, 还需进一步探讨优势种生物学特性及其之间的相互关系。
4 结论从以上调查结果可以看出, 在雷州半岛东部近海浮标上共采集和鉴定出大型固着污损生物35种, 其中侧花海葵、变化短齿蛤、网纹藤壶、翡翠贻贝、刺巨藤壶和钟巨藤壶是该海区污损浮标的固着生物优势种, 与周边广东沿岸海域污损生物群落结构基本一致, 另外, 生物群落中还会有少量的有柄蔓足类出现, 使之又表现出一定的大洋性特点。离岸距离、采样季节、采样深度、光照强度、海流状况、水域的开阔与封闭程度等可能是影响固着污损生物群落结构的关键因素。
| 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2007. GB/T12763. 6-2007, 海洋调查规范第6部分: 海洋生物调查. 北京: 中国标准出版社: 29-32 |
| 方芳, 严涛, 2004. 南海污损生物研究的现状及展望. 热带海洋学报, 23(1): 76–85 |
| 严岩, 董钰, 严文侠, 1994. 湛江港浮标污损生物生态研究. 热带海洋, 13(2): 68–74 |
| 严涛, 严文侠, 董钰, 等, 1998. 北部湾东北部海区污着生物研究. 热带海洋, 17(2): 38–44 |
| 严涛, 严文侠, 董钰, 等, 2003. 珠江口东南近海海区污损生物研究. 海洋学报, 25(6): 117–125 |
| 严涛, 韩帅帅, 王建军, 等, 2017. 污损性海鞘的生态特点研究展望. 生态学报, 37(20): 6647–6635 |
| 严涛, 严文侠, 王华接, 等, 1999. 珠江口以东近海水域污损生物的组成与分布. 台湾海峡, 18(3): 325–331 |
| 李静, 严涛, 曹文浩, 等, 2010. 近海污损生物生态研究进展. 海洋通报, 29(1): 113–119 |
| 杨天笑, 严涛, 陈池, 等, 2013. 大型海洋污损生物对金属材料腐蚀影响及研究展望. 工业安全与环保, 39(11): 69–71 DOI:10.3969/j.issn.1001-425X.2013.11.022 |
| 陈达森, 陈波, 严金辉, 等, 2006. 琼州海峡余流场季节性变化特征. 海洋湖沼通报,(2): 12–17 |
| 林盛, 黄宗国, 李传燕, 等, 1989. 广东电白浮标污损生物生态研究. 海洋学报, 11(1): 70–78 |
| 林和山, 王建军, 郑成兴, 等, 2012. 东山湾污损生物生态研究. 海洋学报, 34(6): 160–169 |
| 曹文浩, 严涛, 谢恩义, 等, 2017. 雷州半岛东南海域污损浮标的大型藻类. 生态环境学报, 26(4): 658–662 |
| 黄企洲, 王文质, 李毓湘, 等, 1992. 南海海流和涡旋概况. 地球科学进展, 7(5): 1–9 |
| 黄宗国, 蔡如星, 江锦祥, 等, 1982. 琼州海峡及雷州半岛沿岸浮标的污损生物. 海洋与湖沼, 13(3): 259–266 |
| 曾地刚, 蔡如星, 黄宗国, 等, 1999a. 东海污损生物群落研究Ⅰ.种类组成和分布. 东海海洋, 17(1): 48–55 |
| 曾地刚, 蔡如星, 黄宗国, 等, 1999b. 东海污损生物群落研究Ⅱ.数量组成和分布. 东海海洋, 17(1): 56–59 |
| 蔡立哲, 李复雪, 1986. 厦门港大型污损生物的垂直分布. 热带海洋, 5(4): 10–18 |
| Bayne B L, 1964. The responses of the larvae of Mytilus edulis L.to light and to gravity. Oikos, 15(1): 162–174 DOI:10.2307/3564753 |
| Connell S D, 2000. Floating pontoons create novel habitats for subtidal epibiota. Journal of Experimental Marine Biology and Ecology, 247(2): 183–194 DOI:10.1016/S0022-0981(00)00147-7 |
| Connell S D, 2001. Urban structures as marine habitats:an experimental comparison of the composition and abundance of subtidal epibiota among pilings, pontoons and rocky reefs. Marine Environmental Research, 52(2): 115–125 DOI:10.1016/S0141-1136(00)00266-X |
| Edyvean R G J, Terry L A, Picken G B, 1985. Marine fouling and its effects on offshore structures in the North Sea:A review. International Biodeterioration, 21(4): 277–284 |
| Glasby T M, 1999. Differences between subtidal epibiota on pier pilings and rocky reefs at marinas in Sydney, Australia. Estuarine, Coastal and Shelf Science, 48(2): 281–290 DOI:10.1006/ecss.1998.0417 |
| Holloway M G, Connell S D, 2002. Why do floating structures create novel habitats for subtidal epibiota. Marine Ecology Progress Series, 235: 43–52 DOI:10.3354/meps235043 |
| Kennelly S J, 1989. Effects of kelp canopies on understorey species due to shade and scour. Marine Ecology Progress Series, 50: 215–224 DOI:10.3354/meps050215 |
| Kobak J, Nowacki P, 2007. Light-related behaviour of the zebra mussel (Dreissena polymorpha, Bivalvia). Fundamental and Applied Limnology, 169(4): 341–352 DOI:10.1127/1863-9135/2007/0169-0341 |
| Lin H S, Wang J J, Liu W, et al, 2017. Fouling community characteristics in subtropical coastal waters of the southwestern East China Sea. Acta Oceanologica Sinica, 36(10): 70–78 DOI:10.1007/s13131-017-1007-1 |
| Little B, Wagner P, Mansfeld F, 1991. Microbiologically influenced corrosion of metals and alloys. International Materials Reviews, 36(6): 253–272 |
| Pielou E C, 1975. Ecological Diversity. New York: Wiley Inters: 165 |
| Schmidt G H, Warner G F, 1984. Effects of caging on the development of a sessile epifaunal community. Marine Ecology Progress Series, 15: 251–263 DOI:10.3354/meps015251 |
| Schultz M P, Bendick J A, Holm E R, et al, 2011. Economic impact of biofouling on a naval surface ship. Biofouling, 27(1): 87–98 DOI:10.1080/08927014.2010.542809 |
| Ulanowicz R E, 2001. Information theory in ecology. Computers & Chemistry, 25(4): 393–399 |
| Videla H A, Characklis W G, 1992. Biofouling and microbially influenced corrosion. International Biodeterioration & Biodegradation, 29(3-4): 195–212 |
| Zhang H, Cao W H, Wu Z W, et al, 2015. Biofouling on deep-sea submersible buoy systems off Xisha and Dongsha Islands in the northern South China Sea. International Biodeterioration & Biodegradation, 104: 92–96 |
 2018, Vol. 49
2018, Vol. 49


