中国海洋湖沼学会主办。
文章信息
- 陈畅, 傅亮, 毕乃双, 葛汝平, 刘光兴, 庄昀筠, 杨作升, 范德江, 姚鹏, 刘瑞志, 陈洪举. 2018.
- CHEN Chang, FU Liang, BI Nai-Shuang, GE Ru-Ping, LIU Guang-Xing, ZHUANG Yun-Yun, YANG Zuo-Sheng, FAN De-Jiang, YAO Peng, LIU Rui-Zhi, CHEN Hong-Ju. 2018.
- 南海西沙永乐龙洞浮游动物的群落组成及昼夜垂直分布特征
- ZOOPLANKTON COMMUNITY COMPOSITION AND DIEL VERTICAL DISTRIBUTION IN THE YONGLE BLUE HOLE, XISHA ISLANDS, SOUTH CHINA SEA
- 海洋与湖沼, 49(3): 594-603
- Oceanologia et Limnologia Sinica, 49(3): 594-603.
- http://dx.doi.org/10.11693/hyhz20171200328
-
文章历史
- 收稿日期:2017-12-28
- 收修改稿日期:2018-03-13
2. 中国海洋大学环境科学与工程学院 青岛 266100;
3. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266200;
4. 三沙航迹珊瑚礁保护研究所 三沙 573199;
5. 中国海洋大学海底科学与探测技术教育部重点实验室 青岛 266100;
6. 中国海洋大学海洋化学理论与工程技术教育部重点实验室 青岛 266100;
7. 中国环境科学研究院河口与海岸环境国家重点实验室 北京 100018
2. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;
3. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266200, China;
4. Sansha Trackline Institute of Coral Reef Environment Protection, Sansha 573199, China;
5. Key Laboratory of Submarine Geosciences and Prospecting Technique, Ocean University of China, Ministry of Education, Qingdao 266100, China;
6. Key Laboratory of Marine Chemistry Theory and Technology, Ocean University of China, Ministry of Education, Qingdao 266100, China;
7. Chinese Research Academy of Environmental Sciences, State Environmental Protection Key Laboratory of Estuarine and Coastal Environment, Beijing 100018, China
海洋蓝洞水体是一种特殊的海洋生态环境, 在潮汐作用下通过表层水以及洞内细小通道与洞外水体交换, 但周边珊瑚礁、浅滩等地形的包围导致交换的水量非常有限(Fichez, 1991; Iliffe et al, 2009; Martin et al, 2012), 造成蓝洞内的理化参数与邻近水域存在差异。蓝洞内水体混合效果较弱, 具有稳定的水层划分, 层化明显, 常存在缺氧和富含硫化氢的水层(Canganella et al, 2007; Seymour et al, 2007; Iliffe et al, 2009)。蓝洞相对独立的水体环境和特殊的理化参数, 使得其与周边水体及相关生态系统的生物联系受到限制(Iliffe et al, 2009; Becking et al, 2011; Bishop et al, 2015)。
目前, 南海西沙永乐龙洞被确认为世界已知最深的蓝洞。这个特殊蓝洞生态系统中存在的海洋生物群落及其与周围海域存在的差异尚未得到研究。永乐龙洞的跃层强, 深层缺氧, 90m以深溶解氧(DO)降至0 (毕乃双等, 2018)。这种特殊环境中的海洋生物多样性以及特殊环境因素对龙洞海洋生物分布的影响, 都值得深入研究。
浮游动物作为最重要的海洋生物类群之一, 其群落结构一直是海洋生物调查研究的重点。包括蓝洞在内的海洋洞穴具有半封闭的稳定环境, 洞穴内栖息的生物群落具有地方性, 并可能发生特化(Harmelin et al, 1985; Chevaldonné et al, 2003)。过去对海洋洞穴的调查发现了许多新的物种, 这些物种包括各类甲壳动物和有孔虫等(Yager, 1981; Fosshagen et al, 1988; Yager et al, 1996; Lejeusne et al, 2006; Boxshall et al, 2012)。Iliffe与Kornicker等自20世纪80年代起对百慕大、巴哈马群岛以及墨西哥沿岸的一系列蓝洞中多个类群的浮游动物进行了调查, 这些海域甲壳动物占据明显的主导地位, 并且生物多样性较高, 不少种类是蓝洞特有的, 在周边海域未发现(Iliffe, 2002; Kornicker et al, 2007; Iliffe et al, 2009)。
为了解永乐龙洞浮游动物的群落特征, 本研究于2017年3月在西沙永乐龙洞及周边海域展开浮游生物调查, 研究龙洞浮游动物的种类组成和数量分布, 分析龙洞存在的跃层对浮游动物昼夜垂直分布的影响, 并探讨了浮游动物群落特征与潟湖和邻近海域的区别。
1 材料与方法本研究采样区域位于永乐龙洞及其周边潟湖与外礁坡(图 1)。浮游动物样品采用浅水Ⅱ型浮游生物网(筛绢孔径160μm, 网口面积0.08m2)采集, 拖网速度为0.8—1.0m/s。2017年3月17日11:30—13:00(白天)和3月17日21:00—23:00(夜间)在龙洞分6层(0—10、10—20、20—40、40—60、60—90和90—150m)垂直分层拖网。澙湖内(16°31.205′N, 111°45.538′E)于2017年3月18日14:50—15:00(白天)和3月18日21:00—21:10(夜间)进行2次底表垂直拖网。此外, 3月22日18:10—18:30(白天)在外礁坡(16°32.040′N, 111°47.953′E)进行底表垂直拖网(200m—表层)。
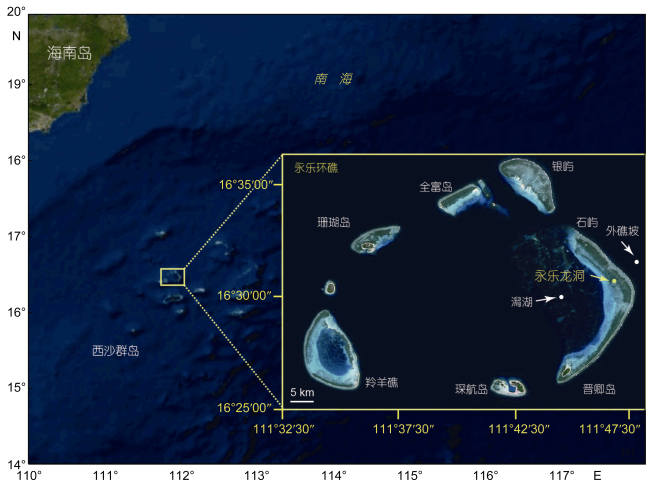 |
| 图 1 采样位点图 Fig. 1 Map of sampling location |
浮游动物样品保存于5%的福尔马林海水溶液中, 运回实验室后, 镜检、计数。
浮游动物丰度(Abundance)以每立方米水体出现的浮游动物个体数表示(ind./m3)。
用Margalef种类丰富度指数(D)、香农-威纳指数(H')及Pielou均匀度指数(J')分析生物多样性(Shannon et al, 1949; Margalef, 1958; Pielou, 1975)。累积优势度表示物种丰度占总丰度百分比的累计数值。将各种浮游生物丰度由大到小排序后, 以累积优势度曲线(K-dominance curve)直观地表征群落的物种均匀度和丰度百分比(Lambshead et al, 1983)。采用多元统计软件PRIMER V6.1进行浮游动物的聚类分析(Cluster)和多维定标(Multidimensional scaling, MDS)分析。
采用SBE 19 plus型(温、盐、深和浊度)和JFE- Advantech公司ASTD 102型(温、盐、深、溶解氧、叶绿素、浊度)CTD的联合观测系统进行了水体剖面多参数观测, 最大观测深度约为270m(图 2)。由于盐度、叶绿素和浊度传感器在150m以下出现异常, 150m以下盐度根据实验室盐度计测定的水样盐度插值得到。
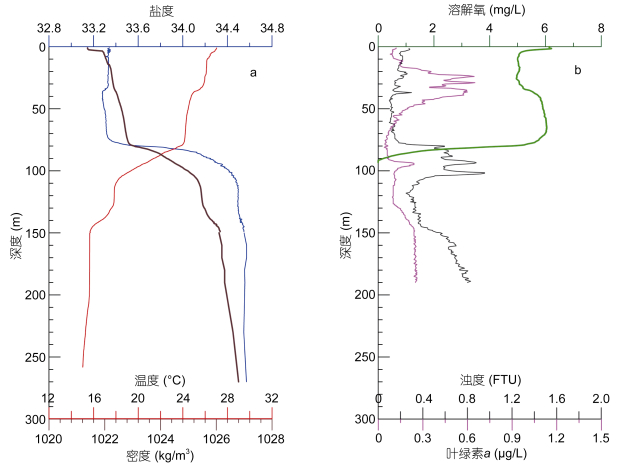 |
| 图 2 2017年3月永乐龙洞水体多参数剖面图 Fig. 2 Profiles of multiple parameters of the water column in the Yongle blue hole, March 2017 |
2017年3月永乐龙洞水体及外礁坡多参数剖面显示, 洞内水体分层现象相比外礁坡更为明显。洞内在80—100m深度存在强烈的温盐跃层, 而外礁坡在30—70m深度存在温盐跃层。洞内溶解氧(DO)浓度随深度逐渐下降, 在90m以下为0, 而外礁坡溶解氧浓度则随深度逐渐升高(图 2)。
2.2 种类组成龙洞内共记录各种类浮游动物41种(含未定种), 浮游幼虫14类, 合计种类数55个。澙湖内记录各类浮游动物(含未定种)15种及浮游幼虫7类, 其中17种(含幼体)在龙洞内出现。外礁坡记录各类浮游动物(含未定种)124种, 浮游幼虫20类, 其中浮游动物有17种(含幼体)在龙洞中出现, 主要为桡足类、毛颚动物与水母(表 1)。
| 类群 | 种类数 | 水柱平均丰度(ind./m3) | |||||||||
| 日间龙洞 | 夜间龙洞 | 日间澙湖 | 夜间澙湖 | 坡外礁 | 日间龙洞 | 夜间龙洞 | 日间澙湖 | 夜间澙湖 | 坡外礁 | ||
| 原生动物 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 3.2 | |
| 水螅水母 | 3 | 3 | 1 | 1 | 16 | 0.4 | 0.5 | 1.7 | 0.8 | 12.7 | |
| 栉水母动物 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0.1 | |
| 环节动物 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0.2 | |
| 软体动物 | 0 | 0 | 0 | 0 | 5 | 0 | 0 | 0 | 0 | 3.3 | |
| 枝角类 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1.6 | |
| 介形类 | 0 | 1 | 0 | 1 | 6 | 0 | 0.1 | 0 | 2.5 | 5.1 | |
| 桡足类 | 21 | 20 | 5 | 6 | 55 | 328.1 | 739.7 | 4752.5 | 3430.0 | 423.1 | |
| 等足类 | 1 | 1 | 0 | 0 | 1 | 1.6 | 1.7 | 0 | 0 | 0.1 | |
| 端足类 | 1 | 2 | 0 | 1 | 4 | 0.6 | 0.9 | 0 | 0.8 | 0.3 | |
| 磷虾类 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0.4 | |
| 涟虫类 | 1 | 1 | 0 | 0 | 0 | < 0.1 | 0.7 | 0 | 0 | 0 | |
| 十足类 | 1 | 1 | 0 | 0 | 1 | 0.1 | 1.0 | 0 | 0 | 0.2 | |
| 糠虾类 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 1.6 | 0 | |
| 毛颚动物 | 2 | 1 | 1 | 1 | 11 | 4.0 | 3.1 | 50.0 | 25.0 | 23.9 | |
| 被囊动物 | 1 | 1 | 1 | 1 | 15 | 3.3 | 5.1 | 75.0 | 50.0 | 124.1 | |
| 浮游幼虫 | 14 | 11 | 5 | 5 | 20 | 65.8 | 75.8 | 87.5 | 23.3 | 97.0 | |
| 总计 | 45 | 42 | 13 | 18 | 144 | 403.9 | 828.5 | 4966.7 | 3534.0 | 695.3 | |
浮游动物的主要类群为浮游甲壳类、浮游幼虫和水螅水母类。浮游甲壳动物的种类数量达到总种类数的约60%, 桡足类是浮游甲壳类的主要类群。
2.3 浮游动物的丰度、垂直分布和昼夜变化龙洞内各水层浮游动物丰度范围在64.8—2852.5ind./m3, 日间丰度最大值为791.7ind./m3, 在60—90m水层; 夜间丰度最大值为2852.5ind./m3, 在20—40m水层。龙洞内水柱的平均丰度接近于外礁坡, 潟湖丰度则比前者高出约4—10倍。但就水层而言, 龙洞夜间20—40m处丰度非常高, 接近于潟湖丰度。
龙洞内夜间丰度垂直分布相比于日间更不均匀(图 3)。夜间浮游生物在20—40m水层的丰度远高于其他水层; 日间浮游动物丰度最大层则出现在60—90m水层, 但整个水柱丰度分布相对均匀。龙洞内浮游动物昼夜垂直分布存在明显的变化。
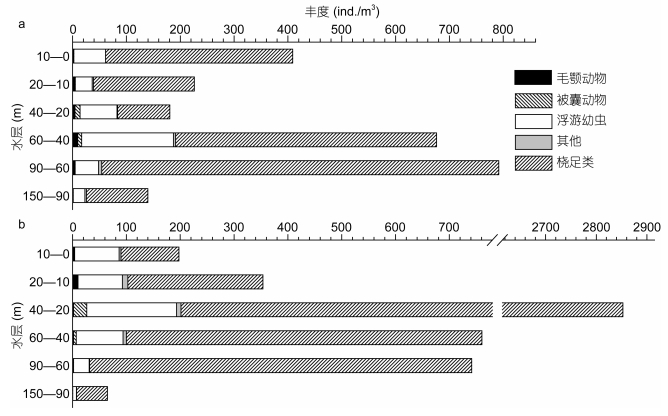 |
| 图 3 龙洞内浮游动物丰度垂直分布(a:龙洞日间; b:龙洞夜间) Fig. 3 Distribution in zooplankton abundance of the Yongle blue hole (a: daytime; b: nighttime) |
龙洞内各水层主要的浮游动物类群均为桡足类。此外浮游幼虫也占据总丰度一定的比例。其他类群中, 除毛颚动物和被囊动物, 剩余类群丰度之和也均不超过总丰度的5%。桡足类在龙洞内浮游动物中占据优势, 超过总丰度的50%, 在夜间0—10m水层和日间20—40m水层中占比最少。昼夜对比发现, 桡足类在60m以深水层的丰度占比变化很小。在60m以浅水体中, 日间桡足类在较浅水层占比高于较深水层, 而夜间则相反。龙洞内的优势类群桡足类在60m以浅的水体中存在明显的昼夜垂直迁移。
龙洞内日间丰度较高的3个种为细长腹剑水蚤(Oithona attenuata)、坚长腹剑水蚤(O. rigida)和长刺小厚壳水蚤(Scolecithricella longispinosa), 夜间则是细长腹剑水蚤和长刺小厚壳水蚤。细长腹剑水蚤在日间与夜间都是龙洞内占绝对优势的物种(图 4)。澙湖浮游动物的优势种是坚长腹剑水蚤, 占总丰度的90%以上; 其次占优势地位的种类为奥氏胸刺水蚤(Centropages orsinii), 占总丰度的4%。外礁坡生物多样性高, 优势种不明显, 丰度占比超过10%的仅有长尾基齿哲水蚤(Clausocalanus furcatus)和瘦拟哲水蚤(Paracalanus gracilis)。
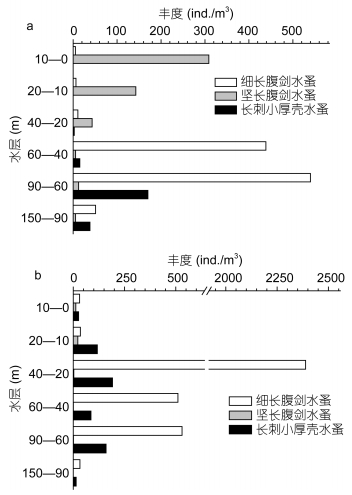 |
| 图 4 浮游动物优势种丰度垂直分布(a:龙洞日间; b:龙洞夜间) Fig. 4 The distribution in abundance of dominant species of the Yongle blue hole (a: daytime; b: nighttime) |
龙洞内各水层浮游动物生物多样性指数存在明显的昼夜变化。日间种类数、香农维纳指数、丰富度、均匀度的最大值均出现在20—40m水层, 而夜间都出现在10m以浅(表 2)。澙湖浮游动物生物多样性低于龙洞, 而外礁坡水体中生物多样性则明显高于龙洞和澙湖(图 5)。
| 样品 | 种类数S | 香农维纳指数H' | 丰富度D | 均匀度J |
| 龙洞日间10—0m | 20 | 1.65 | 2.19 | 0.38 |
| 龙洞日间20—10m | 20 | 2.37 | 2.43 | 0.55 |
| 龙洞日间40—20m | 31 | 3.74 | 4.00 | 0.75 |
| 龙洞日间60—40m | 24 | 1.90 | 2.45 | 0.41 |
| 龙洞日间90—60m | 23 | 1.54 | 2.28 | 0.34 |
| 龙洞日间150—90m | 25 | 2.72 | 3.37 | 0.59 |
| 龙洞夜间10—0m | 26 | 3.66 | 3.28 | 0.78 |
| 龙洞夜间20—10m | 22 | 3.17 | 2.48 | 0.71 |
| 龙洞夜间40—20m | 25 | 1.08 | 2.09 | 0.23 |
| 龙洞夜间60—40m | 25 | 1.82 | 2.51 | 0.39 |
| 龙洞夜间90—60m | 17 | 1.29 | 1.68 | 0.31 |
| 龙洞夜间150—90m | 17 | 2.36 | 2.66 | 0.58 |
| 澙湖日间 | 13 | 0.68 | 0.98 | 0.18 |
| 澙湖夜间 | 18 | 0.58 | 1.44 | 0.14 |
| 外礁坡 | 144 | 4.83 | 21.84 | 0.67 |
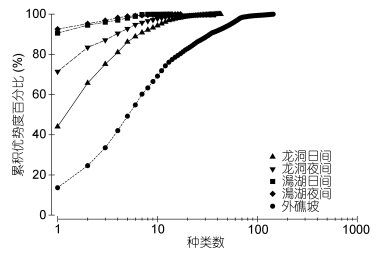 |
| 图 5 龙洞内及邻近水域浮游动物K-优势度曲线 Fig. 5 K-dominance curves of total zooplankton in the Yongle blue hole and adjacent waters |
聚类分析结果显示, 龙洞的浮游动物群落结构与澙湖更为相似, 而与外礁坡差异较大(图 6)。龙洞内夜间0—20m水层的群落结构与日间20—40m水层相似, 夜间20—40m水层的群落结构与日间40—60m水层相似, 表现出昼夜垂直移动现象。
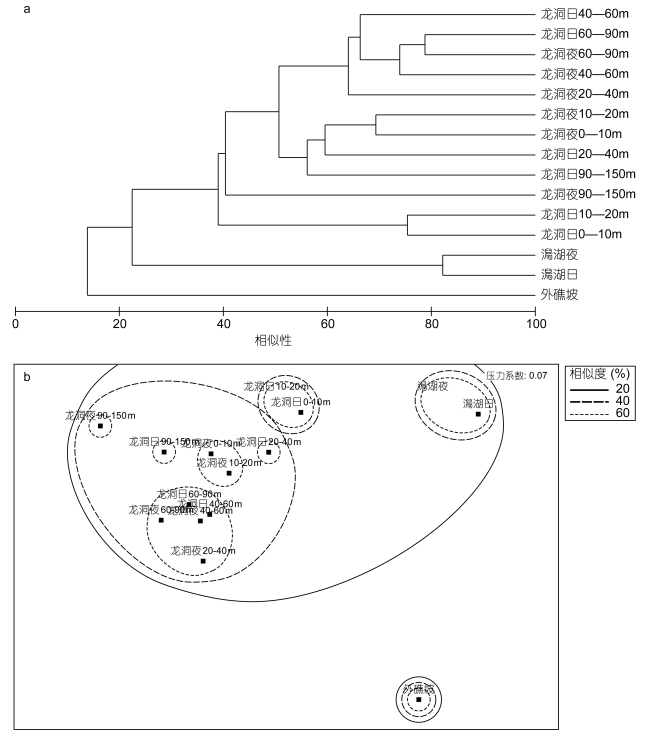 |
| 图 6 Cluster聚类(a)和MDS多维定标结果(b) Fig. 6 Results of the Cluster(a) and MDS analysis(b) |
龙洞与潟湖内浮游动物群落结构与南海珊瑚礁区相比存在着相似性但也有差异。龙洞与潟湖记录到的浮游动物总种类数为62个(含浮游幼虫), 除桡足类和浮游幼虫外, 水螅水母种类也较多, 占比11.3%。浮游动物的主要类群为桡足类、浮游幼虫和毛颚类。龙洞与澙湖浮游动物总种类数相比南海其他珊瑚礁区偏少, 主要类群相似, 各类群比例略有不同。2006年对三亚珊瑚礁分布海区的调查中, 桡足类种类数占比低于龙洞, 而水母类种类数占比则高出龙洞许多, 达22.4%(柯志新等, 2011)。2004年雷州半岛灯楼珊瑚礁海区调查显示, 桡足类与浮游幼虫占比最接近于龙洞(尹健强等, 2008)。2004年对南沙群岛渚碧礁的调查中, 桡足类种类数占比较龙洞更高, 浮游幼虫占比则较低, 水母种类很少(尹健强等, 2011)。细长腹剑水蚤在日间与夜间都是龙洞内丰度占据绝对优势的物种, 灯楼珊瑚礁海区第一优势种——强额孔雀哲水蚤(Pavocalanus crassirostris)在龙洞中未被发现, 但细长腹剑水蚤在两地都占据优势, 其他物种组成也有一定相似之处。澙湖内的坚长腹剑水蚤丰度极高, 占浮游动物总丰度的90%以上, 在灯楼珊瑚礁也有分布; 其次奥氏胸刺水蚤也占浮游动物总丰度的近4%, 在美济礁、渚碧礁等地也是优势种(杜飞雁等, 2015)。南海部分珊瑚礁区的浮游动物种类组成和优势种或主要种类见表 3。
| 调查年份 | 种类组成 | 优势种或主要种类 | 海域 | 参考文献 |
| 2004 | 共记录浮游动物72种和浮游幼虫19个类群, 桡足类的种类最多, 占比49.5%, 其次为浮游幼虫, 占比20.9% | 强额孔雀哲水蚤Pavocalanus crassirostris、蔓足类无节幼虫Cirripedia nauplius、细长腹剑水蚤等 | 雷州半岛灯楼珊瑚礁 | 尹健强等, 2008 |
| 2004 | 共记录浮游动物96种和浮游幼虫17个类群, 桡足类的种类最多, 占比57.5%, 其次为浮游幼虫, 占比15.0% | 奥氏胸刺水蚤、珍妮纺锤水蚤Acartia shuzheni、长尾住囊虫Oikopleura longicauda等 | 南沙群岛渚碧礁 | 尹健强等, 2011 |
| 2006 | 共记录浮游动物66种和浮游幼虫10个类群, 桡足类的种类最多, 占比38.1%, 其次为水母类, 占比22.4% | 莹虾幼虫Lucifer larvae、多毛类幼虫Polychaeta larvae、肥胖箭虫Sagitta enflata、小型箭虫S. neglecta等 | 三亚珊瑚礁分布海区 | 柯志新等, 2011 |
| 2012 | 共记录浮游动物114种和浮游幼虫24个类群, 桡足类的种类最多, 占比30.4%, 其次为浮游幼虫, 占比17.4% | 长尾住囊虫、奥氏胸刺水蚤、粗壮箭虫S. robusta、长尾类幼体Macrura larvae等 | 南沙群岛美济礁 | 杜飞雁等, 2015 |
| 2017 | 共记录浮游动物48种和浮游幼虫14个类群, 桡足类的种类最多, 占比45.2%, 其次为浮游幼虫, 占比22.6% | 细长腹剑水蚤、坚长腹剑水蚤、长刺小厚壳水蚤、奥氏胸刺水蚤等 | 西沙永乐龙洞及潟湖 | 本文 |
聚类分析结果显示龙洞浮游动物群落结构与潟湖存在不同, 但与外礁坡差异更大。龙洞内共记录各种类浮游动物(含未定种)和浮游幼虫合计种类数55个, 高于潟湖内记录的22个, 外礁坡则鉴定出各类浮游动物(含未定种)和浮游幼虫共144种。澙湖浮游动物生物多样性低于龙洞, 而外礁坡浮游动物生物多样性则明显高于龙洞和澙湖。龙洞内浮游动物丰度昼夜变化显著, 龙洞夜间丰度最大层与潟湖丰度相当, 日间丰度明显减小, 与外礁坡丰度接近。尹健强等(2003)在渚碧环礁研究结果显示, 潟湖区浮游动物的种类数明显高于礁坪, 潟湖区浅水Ⅰ型网和浅水Ⅱ型网网采样品的种类数分别为礁坪的2.25倍和2.93倍; 潟湖区浮游动物丰度明显高于礁坪区, 可达礁坪区的33.4倍。杜飞雁等(2015)发现美济礁浮游动物生物多样性在外礁坡高于澙湖, 礁坪最低。而在本研究中, 处于礁坪区的龙洞与潟湖相比生物多样性更高, 丰度也处于较高水平。这可能意味着龙洞独特的时空环境条件给浮游动物提供了更高的空间异质性, 从而使得生物多样性得到提高(Griffin et al, 2009)。
同步温盐数据显示, 龙洞内在水深80—100m左右有强烈的跃层存在(图 2)。通过对比龙洞内各水层浮游动物总丰度和主要生物类群所占总丰度的比例可以发现, 在60m以深的水层中浮游动物类别组成的变化很小, 在90—150m水层中浮游动物丰度迅速降低。同时聚类分析结果显示, 90—150m水层与其他水层相似度较低(图 6), 浮游动物的昼夜垂直移动主要表现在90m以浅的水层中(图 3)。这可能与强烈跃层的存在有关, 由于跃层的阻隔, 80m水深上下的浮游动物的跨越存在障碍, 导致龙洞内浮游动物的昼夜垂直移动现象主要发生在90m以浅。部分浮游动物, 如细长腹剑水蚤和坚长腹剑水蚤, 在日间与夜间的整个水柱内总丰度存在非常明显的差异(图 5)。细长腹剑水蚤在夜间20—40m水层大量出现, 而其他水层丰度昼夜变化则相对较小, 大量出现的细长腹剑水蚤如果不是来自其他水层, 那么很有可能是来自同水层的水平移动。龙洞是一个半封闭柱状的水下坑洞, 其侧壁可以作为浮游动物栖息场所, 以躲避捕食者或寻找食物。细长腹剑水蚤可能日间栖息在龙洞侧壁, 夜间移动到龙洞水体中。坚长腹剑水蚤昼夜丰度差异的产生也具有类似机理。
此外, 本文研究结果表明深层无氧环境中同样有生物生存, 并且数量可观, 如细长腹剑水蚤和长刺小厚壳水蚤等。缺氧现象发展和持续的生物学、物理学水柱特征包括: (1)来自上层水体富含有机质的物质产生, 通量和积累; (2)由于分层和长周转时间造成的水柱稳定化(Mann et al, 1991)。龙洞周边珊瑚礁中的有机质在潮汐和波浪等作用下流入龙洞, 连同龙洞上层水体的有机质沉降到下层水体。这些有机质在分解过程中消耗大量的氧, 同时由于龙洞内稳定的分层现象和相对隔绝的洞体, 导致溶解氧无法得到补充, 这是洞内形成深层无氧环境的主要原因。通常认为能在这类极端环境下生存的只有病毒、细菌和古菌(Wielen et al, 2005; Lipp et al, 2008)。一些单细胞真核生物能有效适应无氧的生存环境, 例如原生纤毛虫(Orsi et al, 2012)。同时, 有调查指出一些底栖有孔虫在海洋无氧环境下也有发现(Bernhard, 1993)。此外, 一些室内实验显示桡足类, 尤其是部分猛水蚤, 也能够在一定时期内生存在无氧条件下, 但其摄食等行为受到了影响(Vopel et al, 1998; Grego et al, 2013)。Danovaro等(2010)在地中海海盆中首次报道了能在无氧环境下生存整个生命周期的后生生物。龙洞无氧水体中采集到桡足类等多种浮游生物这种特殊现象的原因, 还有待进一步研究。
4 结论(1) 本次调查共在永乐龙洞内记录到浮游动物41种(包括未定种)、浮游幼虫14个类群, 合计种类数55个。龙洞内浮游动物的主要类群为浮游甲壳类、浮游幼虫和水螅水母类。浮游甲壳动物的种类数量达到总种类数的约60%, 桡足类是浮游甲壳类的主要类群。龙洞内日间丰度较高的3个种为细长腹剑水蚤、坚长腹剑水蚤和长刺小厚壳水蚤, 夜间则是细长腹剑水蚤和长刺小厚壳水蚤。
(2) 龙洞与澙湖内的浮游动物种类组成有一定相似性, 但澙湖生物多样性低于龙洞; 外礁坡物种组成则与龙洞内存在明显差异, 属于不同的浮游动物群落。
(3) 龙洞内浮游动物有明显的昼夜垂直移动。由于跃层存在, 浮游动物的昼夜垂直移动主要表现在90m以浅的水层中。龙洞深层无氧环境中同样有生物生存, 且数量可观。
致谢 三沙航迹珊瑚礁保护研究所琼琼海渔03138号考察船船长陈宜川及全体船员在调查过程中提供了后勤支持和协助, 杨丽标、马洪林、陈霖等协助取样, 在此一并致谢。| 毕乃双, 傅亮, 陈洪举等, 2018. 南海三沙永乐龙洞关键水体环境要素特征及其影响因素. 科学通报, http://engine.scichina.com/doi/10.1360/N972017-01329 |
| 尹健强, 陈清潮, 谭烨辉, 等, 2003. 南沙群岛渚碧礁春季浮游动物群落特征. 热带海洋学报, 22(6): 1–8 |
| 尹健强, 黄晖, 黄良民, 等, 2008. 雷州半岛灯楼角珊瑚礁海区夏季的浮游动物. 海洋与湖沼, 39(2): 131–138 |
| 尹健强, 黄良民, 李开枝, 等, 2011. 南沙群岛珊瑚礁浮游动物多样性与群落结构. 生物多样性, 19(6): 685–695 |
| 杜飞雁, 王雪辉, 林昭进, 2015. 南沙群岛美济礁海域夏季浮游动物群落特征. 生态学报, 35(4): 1014–1021 |
| 柯志新, 黄良民, 谭烨辉, 等, 2011. 三亚珊瑚礁分布海区浮游生物的群落结构. 生物多样性, 19(6): 696–701 |
| Becking L E, Renema W, Santodomingo N K, et al, 2011. Recently discovered landlocked basins in Indonesia reveal high habitat diversity in anchialine systems. Hydrobiologia, 677(1): 89–105 DOI:10.1007/s10750-011-0742-0 |
| Bernhard J M, 1993. Experimental and field evidence of Antarctic foraminiferal tolerance to anoxia and hydrogen sulfide. Marine Micropaleontology, 20(3-4): 203–213 DOI:10.1016/0377-8398(93)90033-T |
| Bishop R E, Humphreys W F, Cukrov N, et al, 2015. 'Anchialine' redefined as a subterranean estuary in a crevicular or cavernous geological setting. Journal of Crustacean Biology, 35(4): 511–514 DOI:10.1163/1937240X-00002335 |
| Boxshall G A, Jaume D, 2012. Centropages orsinii Giesbrecht.1889 (Copepoda, Calanoida, Centropagidae) from an anchialine cave in Vanuatu. Zoosystema, 34(2): 377–387 DOI:10.5252/z2012n2a11 |
| Canganella F, Bianconi G, Kato C, et al, 2007. Microbial ecology of submerged marine caves and holes characterized by high levels of hydrogen sulphide. Reviews in Environmental Science and Bio/Technology, 6(1-3): 61–70 DOI:10.1007/s11157-006-9103-2 |
| Chevaldonné P, Lejeusne C, 2003. Regional warming-induced species shift in north-west Mediterranean marine caves. Ecology Letters, 6(4): 371–379 DOI:10.1046/j.1461-0248.2003.00439.x |
| Danovaro R, Dell'Anno A, Pusceddu A, et al, 2010. The first metazoa living in permanently anoxic conditions. BMC Biology, 8: 30 |
| Fichez R, 1991. Benthic oxygen uptake and carbon cycling under aphotic and resource-limiting conditions in a submarine cave. Marine Biology, 110(1): 137 DOI:10.1007/BF01313100 |
| Fosshagen A, Iliffe T M, 1988. A new genus of Platycopioida (Copepoda) from a marine cave on Bermuda. Hydrobiologia, 167-168(1): 357–361 DOI:10.1007/BF00026325 |
| Grego M, Riedel B, Stachowitsch M, et al, 2013. Meiofauna winners and losers of coastal hypoxia:case study harpacticoid copepods. Biogeosciences Discussions, 10(7): 12385–12416 DOI:10.5194/bgd-10-12385-2013 |
| Griffin J N, Jenkins S R, Gamfeldt L, et al, 2009. Spatial heterogeneity increases the importance of species richness for an ecosystem process. Oikos, 118(9): 1335–1342 DOI:10.1111/oik.2009.118.issue-9 |
| Harmelin J G, Vacelet J, Vasseur P, 1985. Les grottes sous-marines obscures:un milieu extrême et un remarquable biotope refuge. Téthys, 11(3-4): 214–229 |
| Iliffe T M, 2002. Conservation of anchialine cave biodiversity. In: Martin J B, Wicks C M, Sasowsky I D eds. Hydrogeology and Biology of Post-Paleozoic Carbonate Aquifers. Karst Waters Institute, Charles Town: 99-102 |
| Iliffe T M, Kornicker L S, 2009. Worldwide diving discoveries of living fossil animals from the depths of anchialine and marine caves. In: Lang M A, Macintyre I G, Rützler K eds. Proceedings of the Smithsonian Marine Science Symposium. Washington: Smithsonian Institution Scholarly Press, 269-280 |
| Kornicker L S, Iliffe T M, Harrison-Nelson E, 2007. Ostracoda (Myodocopa) from anchialine caves and ocean blue holes. Zootaxa, 1565: 1–151 |
| Lambshead P J D, Platt H M, Shaw K M, 1983. The detection of differences among assemblages of marine benthic species based on an assessment of dominance and diversity. Journal of Natural History, 17(6): 859–874 DOI:10.1080/00222938300770671 |
| Lejeusne C, Chevaldonné P, 2006. Brooding crustaceans in a highly fragmented habitat:the genetic structure of Mediterranean marine cave-dwelling mysid populations. Molecular Ecology, 15(13): 4123–4140 DOI:10.1111/j.1365-294X.2006.03101.x |
| Lipp J S, Morono Y, Inagaki F, et al, 2008. Significant contribution of Archaea to extant biomass in marine subsurface sediments. Nature, 454(7207): 991–994 DOI:10.1038/nature07174 |
| Mann K H, Lazier J R N, 1991. Dynamics of Marine Ecosystems: Biological-Physical Interactions in the Oceans. Boston: Blackwell Scientific Publications |
| Margalef D R, 1958. Information theory in ecology. General Systems, 3: 36–71 |
| Martin J B, Gulley J, Spellman P, 2012. Tidal pumping of water between Bahamian blue holes, aquifers, and the ocean. Journal of Hydrology, 416-417: 28–38 DOI:10.1016/j.jhydrol.2011.11.033 |
| Orsi W, Edgcomb V, Faria J, et al, 2012. Class Cariacotrichea, a novel ciliate taxon from the anoxic Cariaco Basin, Venezuela. International Journal of Systematic and Evolutionary Microbiology, 62(Pt 6)): 1425–1433 |
| Pielou E C, 1975. Ecological Diversity. New York: John Wiley and Sons |
| Seymour J R, Humphreys W F, Mitchell J G, 2007. Stratification of the microbial community inhabiting an anchialine sinkhole. Aquatic Microbial Ecology, 50: 11–24 DOI:10.3354/ame01153 |
| Shannon C E, Weaver W, 1949. The Mathematical Theory of Communication. Urbana: University of Illinois Press, 1 |
| Van Der Wielen P W J J, Bolhuis H, Borin S, et al, 2005. The enigma of prokaryotic life in deep hypersaline anoxic basins. Science, 307(5706): 121–123 DOI:10.1126/science.1103569 |
| Vopel K, Dehmlow J, Johansson M, et al, 1998. Effects of anoxia and sulphide on populations of Cletocamptus confluens (Copepoda, Harpacticoida). Marine Ecology Progress, 175: 121–128 DOI:10.3354/meps175121 |
| Yager J, 1981. Remipedia, a new class of crustacea from a marine cave in the Bahamas. Journal of Crustacean Biology, 1(3): 328–333 DOI:10.2307/1547965 |
| Yager J, Humphreys W F, 1996. Lasionectes exleyi, sp, nov., the first remipede crustacean recorded from Australia and the Indian Ocean, with a key to the world species. Invertebrate Taxonomy, 10(1): 171–187 DOI:10.1071/IT9960171 |
 2018, Vol. 49
2018, Vol. 49


