中国海洋湖沼学会主办。
文章信息
- 高杨, 李江, 宋益民. 2018.
- GAO Yang, LI Jiang, SONG Yi-Min. 2018.
- 印尼热泉菌产热稳定褐藻胶裂解酶的酶学性质研究
- BIOCHEMICAL CHARACTERISTICS OF THERMOSTABLE ALGINATE LYASE OF A STRAIN FROM AN INDONESIAN HOT SPRING
- 海洋与湖沼, 49(3): 577-585
- Oceanologia et Limnologia Sinica, 49(3): 577-585.
- http://dx.doi.org/10.11693/hyhz20170800213
-
文章历史
- 收稿日期:2017-08-28
- 收修改稿日期:2018-03-16
2. 国家海洋局第一海洋研究所 青岛 266061
2. The First Institute of Oceanography, SOA, Qingdao 266061, China
褐藻胶是一种由α-L-古罗糖醛酸(G)和其C5差向异构体β-D-甘露糖醛酸(M)随机组合形成的线性高分子聚合物(徐凡等, 2017)。因其螯合金属离子、黏性高、原料成本低、功能活性多等优点被广泛应用于食品、医药、纺织、化工、饲料等行业(李云涛等, 2017)。而褐藻胶寡糖因分子量小、溶解度高且具有抗肿瘤、降血糖血脂、抗凝血、抗炎症、增强免疫等多种活性, 可作为糖尿病、肥胖症、消化性溃疡、免疫力低下患者的疗效食品(祝玲等, 2006), 因而具有更加广阔的应用前景。
褐藻胶寡糖的制备方式主要有三种(邰宏博等, 2015), 包括化学法、物理法和酶解法。其中化学法操作步骤繁琐, 需使用大量化学试剂, 易腐蚀设备, 污染环境; 物理法制备的褐藻胶寡糖产量低, 难以达到工业化生产的要求; 而酶解法因其具有反应条件温和、底物专一性强、产量高、副产物少、环境友好等优点, 成为目前制备褐藻胶寡糖的主要方法。
褐藻胶裂解酶主要通过β消除作用催化降解褐藻胶, 切割位点在单体间的(1→4)O-糖苷键, 于六元环上的C4与C5之间形成双键, 使4-O-糖苷键被消除, 褐藻胶被降解, 同时在非还原性末端产生4-脱氧-L-异丙基-4-烯醇式吡喃糖醛酸。根据褐藻胶裂解酶降解底物的专一性, 可以将褐藻胶裂解酶分为三类:专一裂解甘露糖醛酸均聚体(poly M)的裂解酶, 如铜绿假单胞菌E03产生的褐藻胶裂解酶(Zhu et al, 2015); 专一裂解古罗糖醛酸均聚体(poly G)的裂解酶, 如由Streptomyces sp. ALG-5产生的褐藻胶裂解酶(Kim et al, 2009); 以及可以同时裂解甘露糖醛酸和古罗糖醛酸异聚体(poly M/G)的裂解酶, 又被称为双功能褐藻胶裂解酶, 如来自假交替单胞菌CY24的褐藻胶裂解酶(Duan et al, 2009)。褐藻胶裂解酶作用位点及作用方式见图 1。
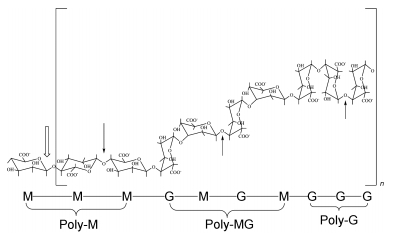 |
| 图 1 褐藻胶裂解酶酶切位点及作用方式图(罗丹丹等, 2016) Fig. 1 The degradation position and the action of alginate lyase in alginate acid |
褐藻胶裂解酶具有十分广泛的生物来源, 如细菌(Li et al, 2011)、真菌(Singh et al, 2011), 海洋腹足类软体动物(Rahman et al, 2011)、土壤微生物(高王宇等, 2017)等, 其中细菌是褐藻胶裂解酶的最主要来源。不同来源的褐藻胶裂解酶分子量差异较大, 根据分子量的不同, 可以将其大致分为三类(Miyake et al, 2004):第一类分子量在20—35kDa之间; 第二类分子量约为40kDa; 第三类分子量约为60kDa。另外, 依据酶的初级结构, 碳水化合物酶数据库(CAZy)将多糖裂解酶(polysaccharide lyase, PL)分为27个家族, 褐藻胶裂解酶被划分在PL-5、PL-6、PL-7、PL-14、PL-15、PL-17和PL-18等7个家族中, 其中poly M型褐藻胶裂解酶主要分布在PL-5家族中, poly G型褐藻胶裂解酶主要分布在PL-7家族中(李丽妍等, 2011)。作为生产褐藻寡糖的重要工具酶, 尽管其来源广泛, 种类繁多, 但现有的褐藻胶裂解酶普遍存在的酶活较低以及对生产条件要求苛刻等问题, 成为了制约褐藻胶利用和转化的关键因素。因此, 发掘反应温度高、热稳定性好的新酶仍具有重要意义。
热泉是发掘生物催化剂最具吸引力的资源之一, 生存于热泉中的微生物由于能够产生多种热稳定性高、有机溶剂和变性剂耐受强的酶类, 成为近年来微生物行业研究的热点。高温能够改善底物及产物溶解性, 减少杂菌污染, 降低染菌风险, 有利于产物的富集、回收; 同时加速反应进程, 减少反应时间, 提高产物转化率, 缓解物质与反应器的贴壁效应, 降低生产成本, 有望在食品、医疗、饲料、废弃物处理等领域替代传统常温酶。本文从印度尼西亚的热泉样品中筛选获得一株高产褐藻胶裂解酶的菌株, 并对该菌产生的褐藻胶裂解酶的酶学性质进行初步研究以期开发获得新型热稳定的褐藻胶裂解酶。
1 材料与方法 1.1 实验材料 1.1.1 出发菌株产褐藻胶酶的菌株分离自印度尼西亚卡利安达岛东海岸的热泉样品(5°44′46″N, 105° 35′12″E), 纯化菌株现保存于国家海洋局海洋生物活性物质重点实验室菌种库中(–80℃)。
1.1.2 培养基LB培养基:蛋白胨10g, 酵母粉5g, 氯化钠10g, 1000mL蒸馏水配制;
固体平板培养基:蛋白胨5g, 酵母粉1g, 琼脂10g, 海藻酸钠10g, 1000mL蒸馏水配制;
分离培养基:蛋白胨5g, 酵母粉1g, 琼脂10g, 褐藻酸钠10g, 氯化钙5g, 1000mL蒸馏水配制;
液体发酵培养基:蛋白胨5g, 酵母粉1g, 褐藻酸钠5g, 1000mL蒸馏水配制;
富集培养基:褐藻酸钠10g, 蛋白胨5g, K2HPO4·3H2O 2g, FeSO4·7H2O 0.1g, MgSO4·7H2O 1g, NaCl 30g, 1000mL蒸馏水配制。
1.1.3 仪器与试剂蛋白胨、酵母粉(Oxoid公司); 褐藻酸钠(国药集团上海化学试剂有限公司); 3, 5-二硝基水杨酸、酒石酸钾钠、氢氧化钠、苯酚、亚硫酸氢钠和氯化钙等均为分析纯。
紫外分光光度计(上海尤尼柯公司); 台式冷冻离心机(德国赛默飞世尔公司); 数显恒温水浴锅(常州丹瑞实验仪器公司); 恒温振荡培养箱(北京东联哈尔有限公司); 高压蒸汽灭菌器(日本三洋电器集团); 数显黏度计(上海邦西仪器科技有限公司)。
1.2 实验方法 1.2.1 平板初筛将富集培养的印尼热泉菌接种到筛选平板上, 55℃培养2d, 对降解圈明显的菌落分离纯化后甘油保种至-80℃超低温保存箱。
1.2.2 摇瓶复筛初筛具有酶活的菌株按2%的接种量接入到装有50mL液体发酵培养基的150mL的锥形瓶中, 55℃、120r/min培养42h, 在4℃、7500r/min条件下离心20min后取上清, 即为粗酶液。通过测定粗酶的酶活, 获得高产酶菌株。
1.2.3 褐藻胶裂解酶产生菌的16S rDNA鉴定以产酶菌株基因组DNA为模板, 利用通用引物27F和1492R (Ludwig, 2007)对产酶菌株进行PCR扩增, 扩增产物委托青岛擎科梓熙生物有限公司进行测序拼接。测序结果通过BLAST进行分析比对。
1.2.4 酶活的测定酶活测定采用3, 5-二硝基水杨酸(3, 5-Dinitrosalicylic acid, DNS)比色法(赵凯等, 2008)。取1mL酶液, 与1mL0.3%的褐藻酸钠在65℃、pH7.0的磷酸氢二钠-磷酸二氢钠缓冲液中反应15min后, 通过测定反应体系中还原糖的含量来计算酶活。1个酶活力单位(U)定义为1mL酶液在65℃和pH为7的条件下, 1min内催化褐藻酸钠产生1μmol还原糖所需的酶量。
1.2.5 酶的分离纯化取1L Aly-B5菌株的发酵液在4℃、7500r/min条件下离心20min, 制成粗酶液。粗酶液在冰浴中逐渐加入研磨均匀的硫酸铵至80%饱和度, 将含硫酸铵的粗酶液离心后收集沉淀, 取适量的磷酸缓冲液(20mmol/L pH7.0)溶解后透析除盐36h。除盐后的酶液手动上样至DEAE-Sepharose FF柱(2.6cm×30cm), 用含0—0.5mol/L NaCl的磷酸缓冲液(20mmol/L pH7.0), 以流速为1.5mL/min进行线性梯度洗脱。测定每管洗脱液在280nm下的紫外吸光值, 并采用DNS法测定洗脱液的褐藻胶裂解酶酶活。将高酶活洗脱液合并后进行Sephadex G-100 (1.6cm×30cm)层析柱纯化, 用20mmol/L的磷酸缓冲液(pH7.0)以0.3mL/min的流速进行洗脱, 收集并合并酶活高的洗脱液, 浓缩、去离子水透析36h后, 真空冷冻浓缩, 保存在4℃, 用于后续酶学性质研究。
1.2.6 酶学性质分析(1) 最适作用温度和热稳定性取l00μL酶液加入到900μL含0.3%褐藻酸钠的磷酸缓冲液(20mmol/L pH7.0)中, 分别置于不同温度条件(45、50、55、60、65、70、80℃)下反应15min, DNS法测定酶活力, 以确定其最适反应温度。为研究该酶的热稳定性, 将酶液分别置于55、65和75℃下保存180min, 每隔30min测定酶活。以初始酶活为100%。
(2) 最适pH及pH稳定性分别用不同的缓冲液体系(pH为4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0)配制0.3%的褐藻酸钠底物, 加入l00μL酶液, 在65℃条件下反应15min, 测定酶活力, 以确定其pH适应范围。为研究该酶的酸碱稳定性, 取l00μL酶液分别加入到不同pH值(pH分别为5.0、7.0、9.0)的底物中, 在65℃条件下静置180min, 每隔30min测定酶活力。以初始酶活为100%。
(3) 金属离子对酶活的影响分别向反应体系中加入终浓度为10mmol/L的金属离子(KCl、NaCl、ZnCl2、MgCl2、CaCl2、FeSO4)和乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)溶液, 于pH7.0、65℃条件下反应15min, 反应结束后测定酶活, 以研究金属离子对酶活的影响。以未添加金属离子的酶活为100%。
(4) 底物特异性分析分别向900μL含0.3%聚甘露糖醛酸、0.3%聚古罗糖醛酸和0.3%褐藻酸钠的底物中加入100μL酶液, 置于65℃条件下反应15min。DNS法测定Aly-B5对两种底物的酶活, 以确定其底物特异性。
(5) 酶解产物分析分别向900μL含0.3%聚甘露糖醛酸、0.3%聚古罗糖醛酸的和0.3%褐藻酸钠的底物中加入100μL酶液, 置于65℃条件下反应, 对不同反应时间(15min、30min、45min、1h、2h、3h、7h、12h)的酶解产物进行薄层层析分析(Li et al, 2011)和黏度测量, 并对反应12h的产物进行质谱分析, 以确定其酶解产物的种类和类型。质谱分析(MS)采用6320型离子阱质谱仪, 分析前须将酶解产物经Amicon的超滤管(Ultra15, 5kDa)浓缩和纯化, 分析条件为:电喷雾(ESI)离子源(美国Agilent公司), 毛细管电压1.8kV, 干燥气流速4L/min, 干燥气温度325℃, 质量扫描范围m/z 300—700。
2 结果与分析 2.1 筛选结果经过初筛和复筛, 获得12株具有褐藻胶裂解酶酶活的菌株, 产酶菌株的筛选及鉴定结果见表 1。选择酶活最高的Aly-B5作为进一步研究的目标菌株。
| 序号 | 菌株编号 | 种属鉴定 | 酶活 |
| 1 | Aly-B1 | Pseudoalteromonas sp. | + |
| 2 | Aly-B2 | Bacillus sp. | ++ |
| 3 | Aly-B5 | Bacillus sp. | +++ |
| 4 | Aly-B7 | Bacillus sp. | ++ |
| 5 | Aly-B8 | Pseudoalteromonas sp. | ++ |
| 6 | Aly-B13 | Bacillus sp. | ++ |
| 7 | Aly-B16 | Bacillus sp. | + |
| 8 | Aly-B17 | Colwellia sp. | + |
| 9 | Aly-B19 | Bacillus sp. | ++ |
| 10 | Aly-B21 | Bacillus sp. | ++ |
| 11 | Aly-B25 | Shewanella sp. | + |
| 12 | Aly-B26 | Bacillus sp. | ++ |
| 注: “+”代表该菌具有弱褐藻胶裂解酶活性; “++”代表该菌具有较强褐藻胶裂解酶活性; “+++”代表该菌具有强褐藻胶裂解酶活性 | |||
经过硫酸铵沉淀、DEAE-Sepharose FF柱和Sephadex G-100层析纯化(表 2), 获得纯酶。SDS-PAGE凝胶电泳图显示, 纯化后的褐藻胶裂解酶Aly-B5在40—50kDa间有一条相对明显的条带, 表明其相对分子质量约为45kDa。
| 纯化过程 | 总酶活力(U) | 总蛋白(mg) | 比活力(U/mg) | 纯化倍数 | 收率(%) |
| 发酵上清液 | 4.14 | 119.89 | 0.04 | 1 | 100 |
| 80%硫酸铵沉淀 | 2.27 | 30.34 | 0.08 | 2.17 | 54.89 |
| DEAE-Sepharose FF | 1.27 | 2.91 | 0.44 | 12.62 | 30.68 |
| Sephadex G-100 | 0.72 | 0.61 | 1.18 | 34.08 | 17.40 |
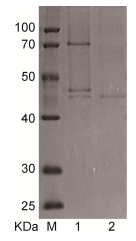 |
| 图 2 不同纯度Aly-B5的SDS-PAGE电泳图 Fig. 2 TheAly-B5 separationby DEAE-Sepharose FF and Sephadex G-100 and SDS-PAGE of the elution part of alginate lyase activity 注: M:已知分子量的标准蛋白; 1:经DEAE-Sepharose FF柱层析后具有褐藻胶酶活性的洗脱液; 2:经Sephadex G-100层析后具有褐藻胶酶活性洗脱液 |
温度对酶活的影响如图 3所示, 该酶在45—65℃的温度范围内酶活随温度升高而增加, 该酶的最适反应温度为65℃, 当反应温度高于65℃后酶活迅速降低, 但该酶在70℃时仍保持75%以上的酶活。
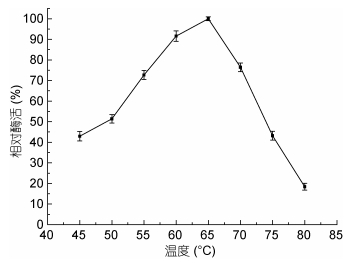 |
| 图 3 温度对酶活的影响 Fig. 3 Effect of temperatures on enzyme activity |
Aly-B5在55、65和75℃体系中反应180min后, 剩余的酶活如图 4所示。该酶在65℃水浴条件下, 半衰期约为180min; 在75℃条件下, 半衰期约为90min; 而在55℃水浴180min后仍有60%以上的活性。总的来说该酶具有较好的热稳定性。
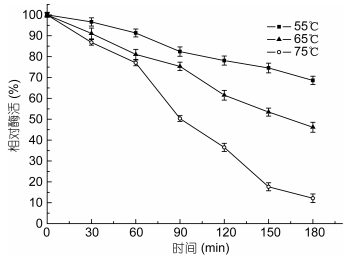 |
| 图 4 酶的稳定性研究 Fig. 4 Effect of temperatures on enzyme stability |
由图 5可见, 该酶在pH小于7.0时, 酶活力随pH升高而升高, 当pH大于7.0时酶活呈现下降的趋势, 该酶的最适pH为7.0。由图 6可知, pH在7.0时, 酶的稳定性最好; pH在5.0和9.0时, 酶的稳定性较差。在pH9.0时, 半衰期约为130min, 在pH5.0时半衰期仅为60min, 因此相对与酸性环境而言, Aly-B5在碱性条件下更加稳定。
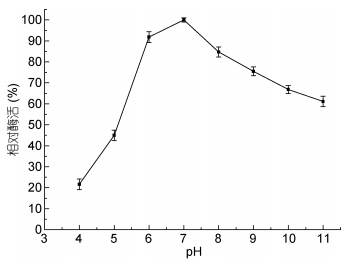 |
| 图 5 pH对酶活的影响 Fig. 5 Effect of pH on enzyme activity |
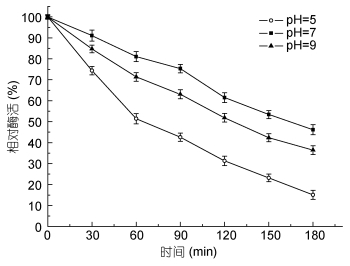 |
| 图 6 pH稳定性研究 Fig. 6 Effect of pH on enzyme activity stability |
从图 7中可以看出, 在添加的各种金属离子中, Na+、K+及Ca2+对酶活性均略有促进作用; 而Zn2+、Mg2+、Fe2+对酶活具有显著的抑制作用; 同时实验结果表明EDTA对该酶无显著影响, 由此可见, 该酶的催化活性并不依赖于金属离子的参与。
 |
| 图 7 金属离子及EDTA对酶活的影响 Fig. 7 Effect of metal ions and EDTA on enzyme activity |
从图 8可以看出, Aly-B5对于聚甘露糖醛酸和聚古罗糖醛酸以及褐藻酸钠均具有降解能力, 但其对聚古罗糖醛酸的降解活性略高于聚甘露糖醛酸, 因此是一种偏好聚古罗糖醛酸的polyM/G型双功能褐藻胶裂解酶。
 |
| 图 8 Aly-B5的底物特异性 Fig. 8 The substrate specificity of Aly-B5 |
图 9的薄层层析结果显示, 经过不同的反应时间(15min—12h), Aly-B5降解褐藻酸钠的主要产物均为二糖(图 10), 且未检测到中间产物。结合不同反应时间(15min—12h)反应体系的黏度变化曲线可见(图 11), 反应体系的黏度未出现骤然下降, 而是呈现缓慢下降的趋势, 同时伴随着产物中寡糖含量(OD520)的持续升高。综上表明Aly-B5可能是一种外切型褐藻胶裂解酶, 并且其最终产物是二糖。其产物种类的单一性使得后续寡糖的分离纯化操作更为简便, 可以有效节省回收及制剂成本。
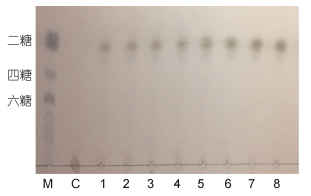 |
| 图 9 不同时间酶解产物的薄层层析 Fig. 9 TLC analysis of enzymatic hydrolysate at different time 注: M:标准二糖、四糖、六糖混合物; C:对照组; 1: 15min酶解产物; 2: 30min酶解产物; 3: 45min酶解产物; 4: 1h酶解产物; 5: 2h酶解产物; 6: 3h酶解产物; 7: 7h酶解产物; 8: 12h酶解产物 |
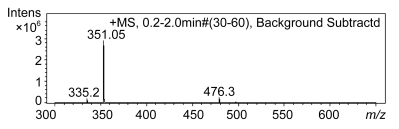 |
| 图 10 酶解12h产物的质谱图 Fig. 10 ESI-MS analysis of the main product at 12h |
 |
| 图 11 不同时间反应体系的黏度变化 Fig. 11 Viscosity reduction during enzymatic degradation of alginate |
近年来, 褐藻寡糖在医药、食品、化工等领域的广泛应用使得寻找催化活性高、稳定性好的褐藻胶裂解酶成为一个行业热点。目前碳水化合物活性酶数据库(CAZy, http://www.cazy.org/)已有各种来源的80多种褐藻胶裂解酶得到分离并完成了性质研究, 本文中所筛选的产酶菌株来自印尼热泉, 经16S rDNA鉴定确定该菌为芽孢杆菌属。褐藻胶裂解酶产生菌的来源十分广泛(表 3), 其中多数为细菌, 主要包括有铜绿假单胞菌(Kraiwattanapong et al, 1999; Preston et al, 2000; Xiao et al, 2006; Li et al, 2011; Zhu et al, 2015)、假交替单胞菌(Ma et al, 2008; Duan et al, 2009; Li et al, 2011; 韩伟等, 2017)、棒状杆菌(Matsubara et al, 1998), 弧菌(Song et al, 2003; Hu et al, 2006; Wang et al, 2006; Fu et al, 2007)以及芽孢杆菌属(Nakagawa et al, 1998), 但来源于热泉菌的热稳定褐藻胶裂解酶尚未见报道。
| 菌株名称 | 最适作用温度(℃) | 底物特异性 | 参考文献 |
| Bacillus sp. Aly-B5 | 65 | poly M/G | 本研究 |
| Aspergillus oryzae | 35 | poly M/G | (Singh et al, 2011) |
| Pseudoalteromonas sp. CY24 | 40 | poly M/G | (Duan et al, 2009) |
| Pseudomonas sp. QD03 | 37 | poly G | (Xiao et al, 2006) |
| Pseudomonas sp. Os-ALG-9 | 30 | poly M | (Kraiwattanapong et al, 1999) |
| Pseudomonas syringae pv. syringae | 42 | poly M | (Preston et al, 2000) |
| Vibrio sp. 510 | 35 | poly G | (Hu et al, 2006) |
| Vibrio sp. QY101 | 30 | poly M/G | (Song et al, 2003) |
| Vibrio sp.YWA | 25 | poly M | (Wang et al, 2006) |
| Vibrio sp. YKW-34 | 40 | poly M/G | (Fu et al, 2007) |
| Pseudoalteromonas elyakovii | 30 | poly M/G | (Ma et al, 2008) |
| Streptomyces sp. A5 | 37 | poly G | (Cao et al, 2007) |
| Streptomyces sp. ALG-5 | 30 | poly G | (Kim et al, 2009) |
| Corynebacterium sp. | 55 | poly G | (Matsubara et al, 1998) |
| Pseudomonas sp. E03 | 30 | poly M | (Zhu et al, 2015) |
| Pseudomonas fluorescens HZJ216 | 35 | poly M/G | (Li et al, 2011) |
| Pseudoalteromonas sp. SM0524 | 50 | poly M/G | (Li et al, 2011) |
| Pseudoalteromonas sp. BYS-2 | 45 | poly M/G | (韩伟等, 2017) |
| Bacillus sp. Strain ATB-1015 | 37 | poly M/G | (Nakagawa et al, 1998) |
现有褐藻胶裂解酶最适温度大多在30—50℃之间(表 3), Singh等(2011)从Aspergillus oryzae中得到的一种米曲霉类褐藻胶裂解酶, 其最适温度及最适pH分别为35℃、pH 6.5, 在50℃反应30min后完全失活; 在pH 7.0的条件下, 酶活仅为最适pH的70%左右。Li等(2011)对Pseudoalteromonas sp. SM0524进行了研究, 从中得到的褐藻胶裂解酶aly-SJ02其最适温度和pH分别为50℃、pH 8.5, 在40℃下条件下半衰期为41min, 在50℃条件下半衰期仅为20min, pH 7.0条件下酶活为最适pH的60%。本文所研究的褐藻胶裂解酶Aly-B5最适温度为65℃, 远高于一般褐藻胶裂解酶, 且具有较好的热稳定性。良好的热稳定性可以有效减少反应冷却装置的使用, 从而降低能耗, 节约生产成本, 减少因冷却造成的环境污染。同时高温加热褐藻胶不但可以提高褐藻胶的溶解性, 还可以使杂菌在反应体系中难以生存, 减少杂菌对产物的污染, 并且减少物质的贴壁效应, 有利于后续产物收集。另外, 相较于上述两种酶(Li et al, 2011; Singh et al, 2011)而言, 该酶的最适pH为7.0, 在反应过程中无需调节pH即可达到最佳酶活, 提高了生产效率, 并且在后期褐藻胶寡糖的富集回收中也无需中和反应体系, 有利于褐藻胶寡糖的生产。
此外, 底物特异性实验表明Aly-B5能够同时降解聚甘露糖醛酸和聚古罗糖醛酸, 属于poly M/G型褐藻胶裂解酶, 其酶解产物主要为二糖。底物的专一性可能与微生物生存环境中可利用的褐藻胶的来源有关。另外, 根据褐藻胶裂解酶的作用方式可以将褐藻胶裂解酶分离为内切型和外切型两类, 其中, 已探明的褐藻胶裂解酶大多为内切型, 只有少数为外切型, 其主要是从褐藻胶酸的非还原性末端切下单糖或者二聚体寡糖。本研究结果表明, 随着反应的进行, 褐藻酸钠溶液的黏度逐渐降低, 且其变化幅度较为缓慢, 变化趋势也与体系中寡糖含量的升高(A520值)紧密相关, 结合降解过程中酶解产物仅为二糖、未检测到大片段中间产物的情况, 推测Aly-B5可能是外切型的褐藻胶裂解酶。由于Aly-B5较宽的底物特异性, 结合其最适反应温度高、热稳定性好的优良性质, 该酶是一种极具工业应用潜力的褐藻胶裂解酶。
金属离子通常会对酶的活性产生影响, 在本文中Zn2+、Mg2+、Fe2+对酶活具有明显的抑制作用, 这是因为重金属离子可以跟蛋白催化或结合区域结合从而抑制酶的催化效率。EDTA是一种金属离子螯合剂, 可以螯合酶蛋白中的辅基金属离子从而抑制酶的活性, 然而EDTA对Aly-B5并没有明显的抑制作用, 在含终浓度为10mmol/L EDTA的反应体系中反应15min, 酶活力仍可达初始值的90%, 这与以往报道中EDTA对褐藻胶裂解酶抑制作用不同, 韩伟等(2017)研究的褐藻胶裂解酶rAlg738最适温度为45℃, 在含终浓度为1mmol/L EDTA的反应体系中反应15min, 剩余酶活仅为初始值的67.91%, 而在5mmol/L EDTA的反应体系中, 酶活仅剩56.93%; Nakagawa等(1998)从Bacillus sp. Strain ATB-1015中分离得到的褐藻胶裂解酶, 其最适温度为37℃, 在终浓度为1mmol/L EDTA的反应体系中反应15min后, 剩余酶活仅为初始值的10%。这表明Aly-B5是一种非金属蛋白酶, 并不依赖于某一种金属离子。
4 结论本文从印尼热泉样品中筛选到一株高产褐藻胶裂解酶菌株Bacillus sp. Aly-B5, 初步的酶学性质研究表明:该菌所产的褐藻胶裂解酶最适作用温度为65℃, 且具有良好的热稳定性, 在75℃时的半衰期为110min; 最适pH为7.0, 且在pH 6.0—11.0的范围内保持60%以上的酶活; 该酶是一种偏好poly G的双功能褐藻胶裂解酶, 其酶解产物主要是二糖。鉴于褐藻酸裂解酶Aly-B5良好的热稳定性和pH适应性以及对底物无特殊要求的优点, 该酶在海藻高值化利用领域具有潜在的应用前景。在接下来的工作中, 克隆获得该酶的编码基因并采用基因工程手段实现其高效异源表达是我们的工作重点。
| 李云涛, 汪立平, 张孟, 等, 2017. 鲍鱼来源褐藻胶裂解酶菌株的筛选及发酵条件优化. 大连海洋大学学报, 32(5): 574–583 |
| 李丽妍, 管华诗, 江晓路, 等, 2011. 海藻工具酶——褐藻胶裂解酶研究进展. 生物工程学报, 27(6): 838–845 |
| 邰宏博, 唐丽薇, 陈带娣, 等, 2015. 褐藻胶寡糖制备的研究进展. 生命科学研究, 19(1): 75–79 |
| 罗丹丹, 薛永常, 2016. 褐藻胶裂解酶的研究进展. 生物学杂志, 33(6): 95–98 |
| 赵凯, 许鹏举, 谷广烨, 2008. 3, 5-二硝基水杨酸比色法测定还原糖含量的研究. 食品科学, 29(8): 534–536 |
| 祝玲, 程璐, 蔡俊鹏, 2006. 褐藻胶寡糖潜在药用价值的研究进展. 中药材, 29(9): 993–996 |
| 徐凡, 林娟, 叶秀云, 等, 2017. 交替假单胞菌BYS-2产褐藻胶裂解酶条件研究. 福州大学学报(自然科学版), 45(3): 446–453 |
| 高王宇, 黄惠琴, 刘敏等, 2017. 产褐藻胶裂解酶菌株HB12274的鉴定和发酵优化. 基因组学与应用生物学, http://kns.cnki.net/kcms/detail/45.1369.Q.20170920.1644.006.html |
| 韩伟, 林娟, 谢勇, 等, 2017. 褐藻胶裂解酶基因的克隆表达及重组酶酶学性质. 微生物学通报, 44(5): 1074–1080 |
| 宋凯, 于文功, 韩峰, 等, 2003. 海洋弧菌褐藻胶裂解酶的分离纯化及性质. 生物化学与生物物理学报, 35(5): 473–477 |
| Cao L X, Xie L J, Xue X L, et al, 2007. Purification and characterization of alginate lyase from Streptomyces species strain A5 isolated from banana rhizosphere. Journal of Agricultural and Food Chemistry, 55(13): 5113–5117 DOI:10.1021/jf0704514 |
| Duan G F, Han F, Yu W G, 2009. Cloning, sequence analysis, and expression of gene alyPI encoding an alginate lyase from marine bacterium Pseudoalteromonas sp. CY24. Canadian Journal of Microbiology, 55(9): 1113–1118 DOI:10.1139/W09-051 |
| Fu X T, Lin H, Kim S M, 2007. Purification and characterization of a Na+/K+ dependent alginate lyase from turban shell gut Vibrio sp. YKW-34. Enzyme and Microbial Technology, 41(6-7): 828–834 DOI:10.1016/j.enzmictec.2007.07.003 |
| Hu X K, Jiang X L, Hwang H M, 2006. Purification and characterization of an alginate lyase from marine bacterium Vibrio sp. Mutant strain 510-64. Current Microbiology, 53(2): 135–140 |
| Kim D E, Lee E Y, Kim H S, 2009. Cloning and characterization of alginate lyase from a marine bacterium Streptomyces sp. ALG-5. Marine Biotechnology, 11(1): 10–16 DOI:10.1007/s10126-008-9114-9 |
| Kraiwattanapong J, Motomura K, Ooi T, et al, 1999. Characterization of alginate lyase (ALYⅡ) from Pseudomonas sp. OS-ALG-9 expressed in recombinant Escherichia coli. World Journal of Microbiology and Biotechnology, 15(1): 105–109 DOI:10.1023/A:1008891100111 |
| Li J W, Dong S, Song J, et al, 2011. Purification and characterization of a bifunctional alginate lyase from Pseudoalteromonas sp. SM0524. Marine Drugs, 9(1): 109–123 DOI:10.3390/md9010109 |
| Li L Y, Jiang X L, Guan H S, et al, 2011. Three alginate lyases from marine bacterium Pseudomonas fluorescens HZJ216:purification and characterization. Applied Biochemistry and Biotechnology, 164(3): 305–317 |
| Ludwig W, 2007. Nucleic acid techniques in bacterial systematics and identification. International Journal of Food Microbiology, 120(3): 225–236 DOI:10.1016/j.ijfoodmicro.2007.06.023 |
| Ma L Y, Chi Z M, Li J, et al, 2008. Overexpression of alginate lyase of Pseudoalteromonaselyakovii in Escherichia coli, purification, and characterization of the recombinant alginate lyase. World Journal of Microbiology and Biotechnology, 24(1): 89–96 DOI:10.1007/s11274-007-9443-2 |
| Matsubara Y, Kawada R, Iwasaki K I, et al, 1998. Extracellular poly(α-L-guluronate)lyase from Corynebacterium sp.:purification, characteristics, and conformational properties. Journal of Protein Chemistry, 17(1): 29–36 DOI:10.1023/A:1022534429792 |
| Miyake O, Ochiai A, Hashimoto W, et al, 2004. Origin and diversity of alginate lyases of families PL-5 and-7 in Sphingomonas sp. strain A1. Journal of Bacteriology, 186(9): 2891–2896 DOI:10.1128/JB.186.9.2891-2896.2004 |
| Nakagawa A, Ozaki T, Chubachi K, et al, 1998. An effective method for isolating alginate lyase-producing Bacillus sp. ATB-1015 strain and purification and characterization of the lyase. Journal of Applied Microbiology, 84(3): 328–335 DOI:10.1046/j.1365-2672.1998.00319.x |
| Preston L A, Wong T Y, Bender C L, et al, 2000. Characterization of alginate lyase from Pseudomonas syringae pv. syringae. Journal of Bacteriology, 182(21): 6268–6271 DOI:10.1128/JB.182.21.6268-6271.2000 |
| Rahman M M, Inoue A, Tanaka H, et al, 2011. cDNA cloning of an alginate lyase from a marine gastropod Aplysia kurodai and assessment of catalytically important residues of this enzyme. Biochimie, 93(10): 1720–1730 DOI:10.1016/j.biochi.2011.06.004 |
| Singh R P, Gupta V, Kumari P, et al, 2011. Purification and partial characterization of an extracellular alginate lyase from Aspergillus oryzae isolated from brown seaweed. Journal of Applied Phycology, 23(4): 755–762 DOI:10.1007/s10811-010-9576-9 |
| Wang Y H, Yu G L, Wang X M, et al, 2006. Purification and characterization of alginate lyase from marine Vibrio sp. YWA. Acta Biochimica et Biophysica Sinica, 38(9): 633–638 DOI:10.1111/abbs.2006.38.issue-9 |
| Xiao L, Han F, Yang Z, et al, 2006. A novel alginate lyase with high activity on acetylated alginate of Pseudomonas aeruginosa FRD1 from Pseudomonas sp. QD03. World Journal of Microbiology and Biotechnology, 22(1): 81–88 DOI:10.1007/s11274-005-7713-4 |
| Zhu B W, Huang L S X, Tan H D, et al, 2015. Characterization of a new Endo-type polyM-specific alginate lyase from Pseudomonas sp. Biotechnology Letters, 37(2): 409–415 DOI:10.1007/s10529-014-1685-0 |
 2018, Vol. 49
2018, Vol. 49


