中国海洋湖沼学会主办。
文章信息
- 秦志华, 潘柳婷, 董文宾, 单虎. 2018.
- QIN Zhi-Hua, PAN Liu-Ting, DONG Wen-Bin, SHAN Hu. 2018.
- 免疫增强剂紫锥菊(Echinacea purpurea)提取物对大菱鲆(Scophthalmus maximus)头肾内非特异性免疫基因表达量的影响
- EFFECT OF ECHINACEA PURPUREA EXTRACT ON THE NONSPECIFIC IMMUNE GENE RELATIVE EXPRESSION QUANTITY OF SCOPHTHALMUS MAXIMUS
- 海洋与湖沼, 49(2): 340-345
- Oceanologia et Limnologia Sinica, 49(2): 340-345.
- http://dx.doi.org/10.11693/hyhz20170300081
-
文章历史
- 收稿日期:2017-03-31
- 收修改稿日期:2017-11-24
2. 青岛农业大学 青岛 266109
2. Qingdao Agricultural University, Qingdao 266109, China
中药免疫增强剂能增强机体免疫功能, 我国的中药资源丰富, 其中利用中药免疫增强剂提高免疫功能已取得显著效果。例如大黄(Rheum palmatum L.)、黄莲(Coptis chinensis Franch)能引起鲤鱼(Cyprinus carpio)免疫器官质量增加、溶菌酶活性增高和吞噬细胞吞噬能力的增强, 可显著提高鲤鱼非特异性免疫能力(蔡中华等, 1998)。采用不同剂量的灰树花多糖(Polysaccharide of Grifola frondosa, PGF)来检测其对鲤鱼血清凝集抗体效价的影响, 试验组抗体水平明显高于对照组(王高学等, 2006); 分别用抗体对试验鳖进行浸泡和口服免疫, 结果表明试验组免疫力大幅提高(庄政, 2008)。添加不同水平的黄芪多糖(Astragalus polysaccharides, APS)饲喂异育银鲫(Carassius auratus gibelio), 能显著提高异育银鲫的脾脏指数(P < 0.05) (胡兵等, 2008)。利用含有90%黄芪多糖的提取物饲喂感染嗜水气单胞菌的罗非鱼(Oreochromis niloticus), 饲喂0.10%黄芪提取物比饲喂基础日粮组显著提高白细胞吞噬活性, 在第四周可以显著提高吞噬细胞的呼吸爆发活性(Ardó et al, 2008)。在彭泽鲫(Carassius auratus var. Pengze)的日粮中添加紫锥菊提取物的研究表明, 紫锥菊提取物能够促进彭泽鲫的生长, 并提高其抗氧化能力(唐雪莲等, 2012)。
大量证据表明, 渔用中药免疫增强剂可以成为增强水产动物抗病能力的有效途径。因此, 开发一些新型的渔用免疫增强剂对促进水产养殖可持续发展具有重要意义。紫锥菊(Echinacea purpurea)是目前国际上普遍关注的一种免疫增强剂和免疫调节剂, 其提取物及其制剂畅销美国医药市场(黄智慧等, 2010), 紫锥菊作为一种新型的免疫增强剂, 在水产养殖中应用较少, 任永林(2008)研究了紫锥菊提取物对鲤鱼的生产性能和免疫功能的影响, 发现其能够显著提高抗病性能。唐雪莲等(2012)在彭泽鲫日粮中添加紫锥菊提取物, 促进了其生长和抗氧化能力。目前还未见紫锥菊提取物在海水养殖动物中的应用情况。
大菱鲆(Scophthalmus maximus)是近年来推广的养殖品种, 并逐渐成为我国重要的养殖品种(雷霁霖, 2000; 马爱军等, 2002)。在欧洲, 西班牙是最大的养殖国家(Cádiz, 2015), 目前中国已经成为世界上养殖第一的大国(FAO, 2011)。但仍存在一些因素制约着大菱鲆的养殖, 出苗率降低、生长速度减慢、抗逆性差等性状退化现象(雷霁霖等, 2002), 以及疾病等都造成了巨大的经济损失(雷霁霖, 2005)。免疫能力低下是大菱鲆养殖期间高死亡率的重要原因之一。头肾是硬骨鱼类重要的造血器官(Press et al, 1999), 同时又是重要的次级淋巴样器官(Brattgjerd et al, 1996), 在特异性免疫反应等方面具有特殊作用, 但有关中药提取物紫锥菊对它的作用效果尚未见报道。本试验通过研究紫锥菊提取物对大菱鲆头肾内非特异性免疫分子基因表达量的影响, 从分子水平上进一步探讨其对大菱鲆非特异性免疫功能的影响。
1 材料与方法 1.1 试验材料 1.1.1 试验药物与试验动物试验药物紫锥菊提取物(有效成分为5.4%菊苣酸)由青岛市康地恩药业有限公司提供。试验用大菱鲆购于胶南通用水产有限公司。
1.1.2 试验仪器电泳槽:北京六一仪器厂, 型号: DYCD-31D;核酸蛋白检测仪:上海康华生化仪器厂, 型号: HD-93-1;高速冷冻离心机:德国SIGMA, 型号: 3K18;电泳仪:北京市六一仪器厂, 型号: DYY-Ⅲ12;电子恒温水浴锅:北京长风仪器仪表公司, 型号: HW.SY21-K; 荧光定量PCR仪:罗氏诊断产品(上海)有限公司, 型号: Light Cycler 480。
1.2 组织材料的准备注射试验结束后, 分别从高、中、低剂量组及空白对照组选出6尾大菱鲆, 重击头部使其死亡, 放入75%酒精中浸泡5min, 然后在无菌环境中, 分别取出高、中、低剂量组及空白对照组的大菱鲆的头肾于液氮中保存备用。
1.3 总RNA的提取按照生工生物工程股份有限公司EZ-10Total RNA Mimi-Preps Kit试剂盒说明书进行总RNA的提取, 提取的总RNA用GeneQuant核酸分析仪进行浓度的测定, 用琼脂糖凝胶电泳测RNA的完整性。
1.4 cDNA第一链合成以总RNA为模板, 按照EasyScript First-Strand cDNA Synthesis SuperMix试剂盒说明书逆转录反应合成cDNA, 逆转录产物置于–20℃保存备用。
1.5 琼脂糖凝胶电泳(1) 电泳槽的处理:电泳槽清洗后, 用无水酒精冲洗, 干燥后, 用3%双氧水室温处理10min, 最后用RNase-free H2O彻底冲洗, 插入梳子。
(2) 配制1%琼脂糖胶:称取0.25g琼脂糖, 加入30mL 1×TBE电泳缓冲液中, 微波炉加热使琼脂糖溶解均匀, 待冷却到50℃左右, 加入1.5μL 10mg/mL的E.B, 混匀, 倒入电泳凝胶板中, 除去气泡。
(3) 电泳:待凝胶凝固后, 小心取出点样梳, 在电泳槽中加入1×TBE电泳缓冲液, 将胶板放入电泳槽中, 使电泳缓冲液没过胶面。在待测样品中加入1/6体积的6×上样缓冲液, 混匀后, 用移液枪点样, 并记录样品点样顺序, 220V电泳35min。
(4) 拍照:于凝胶成像分析系统观察、拍照。
1.6 实时荧光定量PCR采用SYBR® Premix Ex Taq Ⅱ (Tli RNaseH Plus) (Code No.RR820A)进行Real Time PCR反应。PCR反应体系见表 1, 试验中所需引物见表 2。
| 试剂 | 使用量 | 终浓度 |
| SYBR® Premix Ex Taq Ⅱ (Tli RNaseH Plus) (2×) | 12.5μL | 1.0× |
| PCR Forward Primer (10μmol/L) | 1.0μL | 0.4μmol/L |
| PCR Reverse Primer (10μmol/L) | 1.0μL | 0.4μmol/L |
| RT反应液(cDNA溶液) | 2.0μL | |
| dH2O(灭菌蒸馏水溶液) | 8.5μL | |
| Total | 25.0μL |
| 目的基因 | 上游引物 | 下游引物 | 长度 |
| β-Actin | ATCGTGGGGCGCCCCAGGCACC | CTCCTTAATGTCACGCACGATTTC | 493bp |
| Transferrin | CTGTCGCTGTGGCGAAGAAGG | CGATGGGCGCTGTGCTGTTAT | 374bp |
| Lysozyme | AGCCTGGCCGACTGGGTTTG | CGCAGCGACACACAGTGAAAGTAAAG | 517bp |
| TGF-β1 | ACAAGCCGACGGGCTACCATG | CAGCAGGGCTGGGCAGAGG | 173bp |
| IL-1h | AAAGAATCTTACCTGTCTTG | TGCTGATGTTCACGCCGGAGTC | 168bp |
| C3补体 | CAACAACTATGCCACAAG | TCCGTAGACAGAGCGTAG | 123bp |
(1) 按表 1下列组分配制PCR反应液(反应液配制在冰上进行)。
(2) 进行Real Time PCR反应
按两步法PCR扩增, 程序如下:预变性95℃ 30s, 1个循环; PCR反应: 95℃ 5s, 40个循环, 60℃ 30—60s。
2 结果与分析采用∆Ct法自动进行目标基因的荧光定量分析, 再应用SPSS17.0软件对获得的实验数据进行单因素方差分析和Duncan多重比较。显著水平选为0.05, 若P < 0.05, 则为差异显著, 同时用Excel 2010软件为作图工具。
2.1 总RNA提取及检测注射28d后大菱头肾中, 所提取的总RNA, 使用酶标仪对RNA的浓度进行测定, 同时对其OD260/OD280的数值进行测量, 如果该值在1.9—2.2之间则证明所提取的RNA的质量比较高, 本实验采集样品所提取得RNA均在2.0左右, 属于可以继续实验的范围。同时通过电泳检测RNA的质量, 结果如图 1、图 2、图 3所示。每个基因的条带都清晰可见, 后续实验结果的可靠性也得到保证。
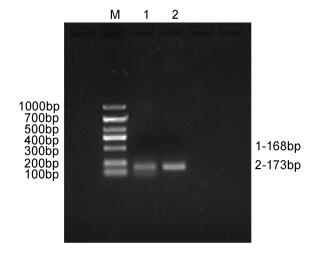 |
| 图 1 TGF-β1基因、IL-1h基因电泳图 Fig. 1 TGF-β1 gene, IL-1h gene electrophoresis chart 注: 1号条带: TGF-β1基因, 2号条带: IL-1h基因 |
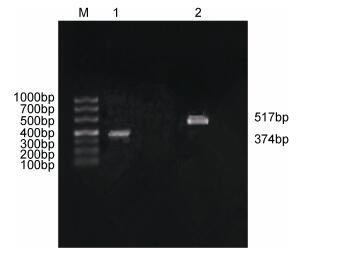 |
| 图 2 Transferrin基因、Lysozyme基因电泳图 Fig. 2 Transferrin gene, lysozyme gene electrophoresis chart 注: 1号条带: Transferrin基因, 2号条带: Lysozyme基因 |
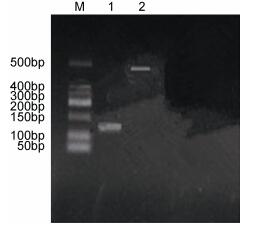 |
| 图 3 β-Actin基因、C3补体基因电泳图 Fig. 3 β-Actin gene, C3 complement gene electrophoresis chart 注: 1号条带: β-Actin基因, 2号条带: C3补体基因 |
如图 4所示, 注射28d紫锥菊提取物对大菱鲆头肾中Lysozyme基因相对表达量的影响显著(P < 0.05), 高剂量组与中剂量组与其它两个剂量组差异显著(P < 0.05), 低剂量组与空白对照组差异不显著(P > 0.05)。
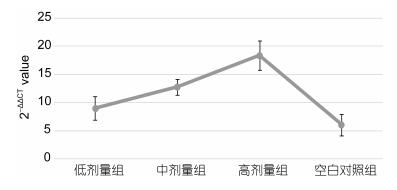 |
| 图 4 注射28d头肾中Lysozyme基因相对表达量 Fig. 4 The relative expression of lysozyme gene in head kidney after injection in 28d |
如图 5所示, 注射28d紫锥菊提取物对大菱鲆头肾中C3补体基因相对表达量的影响极显著(P < 0.01), 高剂量组与其它3个剂量组差异极显著(P < 0.01), 中剂量组和低剂量组与空白对照组差异不显著(P > 0.05)。
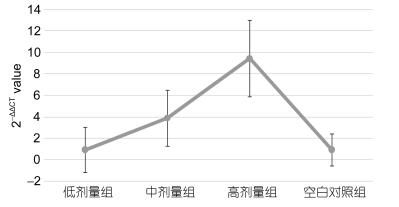 |
| 图 5 注射28d头肾中C3补体基因相对表达量 Fig. 5 Relative expression quantity of complement C3 gene in head kidney after injection in 28d |
如图 6所示, 注射28d紫锥菊提取物对大菱鲆头肾中Transferrin基因相对表达量的影响显著(P < 0.05), 高剂量组与中剂量组与其它两个剂量组差异显著(P < 0.05), 低剂量组与空白对照组差异不显著(P > 0.05)。
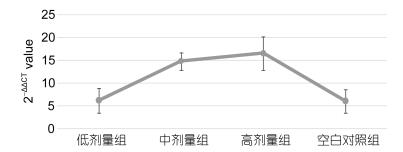 |
| 图 6 注射28d头肾中Transferrin基因相对表达量 Fig. 6 The relative expression of transferrin gene in head kidney after injection in 28d |
如图 7所示, 注射28d紫锥菊提取物对大菱鲆头肾中TGF-β1基因相对表达量的影响极显著(P < 0.01), 中剂量组与其它3个剂量组差异极显著(P < 0.01), 高剂量组和低剂量组与空白对照组差异不显著(P > 0.05)。
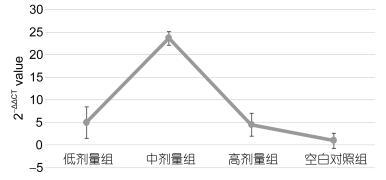 |
| 图 7 注射28d头肾中TGF-β1基因相对表达量 Fig. 7 The relative expression of head kidney TGF-β1gene after injection in 28d |
如图 8所示, 注射28d紫锥菊提取物对大菱鲆头肾中IL-1h基因相对表达量的影响极显著(P < 0.01), 中剂量组与其它3个剂量组差异极显著(P < 0.01), 高剂量组和低剂量组与空白对照组差异不显著(P > 0.05)。
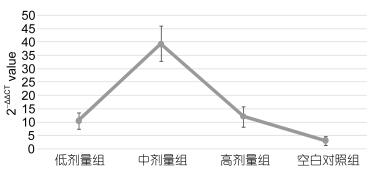 |
| 图 8 注射28d头肾中IL-1h基因相对表达量 Fig. 8 The relative expression of IL-1h gene in 28d injection head kidney |
紫锥菊作为水产动物中免疫增强剂已有报道, 但多限于蛋白质水平检测, 很少从分子水平上给与阐明, 因此很多结论不够可靠。现已从贝类(Liu et al, 2006)、虾(Sotelo-Mundo et al, 2003)、海星(Bachali et al, 2004)等多种海洋无脊椎动物中克隆出溶菌酶基因, 这为开展水产无脊椎动物非特异性免疫力分子水平检测提供良好平台, 也为证实免疫增强剂作用效果提供理论依据。本实验采用实时荧光定量PCR对大菱鲆免疫基因IgM、C3、IL-1、TGF、transferrin和lysozyme在空白对照组和免疫组大菱鲆在注射紫锥菊提取物28d后基因的相对表达量进行了分析。实验结果显示, 紫锥菊提取物对大菱鲆头肾中的相关免疫因子基因的相对表达量有不同程度的促进作用。
3.1 肌肉注射紫锥菊提取物对大菱鲆头肾中Lysozyme基因相对表达量的影响前期试验已证实, 紫锥菊提取物能够提高大菱鲆的溶菌酶活力, 本试验则在分子水平证实, 紫锥菊提取物能提高大菱鲆头肾溶菌酶mRNA表达量, 注射28d后紫锥菊提取物对大菱鲆头肾中Lysozyme基因相对表达量的影响显著, 高剂量组与中剂量组与其它两个剂量组差异显著, 低剂量组与空白对照组差异不显著。说明在一定浓度内, 紫锥菊提取物对大菱鲆头肾中Lysozyme基因相对表达量的影响随着浓度的提高而加强。研究表明, 常用免疫增强剂黄芪多糖对仿刺参体腔细胞中Lysozyme基因相对表达量的影响显著(孙永欣等, 2009), 汤菊芬等(2011)研究黄芪多糖对吉富罗非色C型溶菌酶基因表达量的影响也有类似现象。
3.2 肌肉注射紫锥菊提取物对大菱鲆头肾中C3补体基因相对表达量的影响补体系统是免疫系统的重要组成部分, 参与多重免疫反应, 是生物抵抗外界感染的第一道防线。大多数补体成分都是急性期反应蛋白, 在适当的免疫刺激后补体水平表现出上调趋势。己有试验表明, 当鲤鱼、虹蹲、斑点叉尾蛔、牙虾及斑马鱼等硬骨鱼受细菌处理后, 体内的补体成分特别是补体成分3和补体因子B的表达水平显著升高(Steel et al, 1994)。
本试验中, 以紫锥菊提取物处理大菱鲆成体后, 注射28d后紫锥菊提取物对大菱鲆头肾中C3补体基因相对表达量的影响极显著, 高剂量组与其它3个剂量组差异极显著, 中剂量组和低剂量组与空白对照组差异不显著。由此可以得出, 低浓度紫锥菊提取物对大菱鲆头肾中C3补体基因相对表达量的影响有限。
3.3 肌肉注射紫锥菊提取物对大菱鲆头肾中Transferrin基因相对表达量的影响转铁蛋白是脊椎动物体内重要的非特异免疫因子, 对细菌的繁殖起抑制作用, 是机体对抗细菌感染的重要因子(Liu et al, 2003); 也可以促进细胞的生长和增殖等(Oppenheimer, 2001)。因此, 转铁蛋白的功能可能十分广泛。
本试验将注射28d紫锥菊提取物的大菱鲆头肾中Transferrin基因相对表达量做了相关分析, 结果显示连续注射紫锥菊提取物28d对大菱鲆头肾中Transferrin基因相对表达量的影响显著, 高剂量组和中剂量组与其它两个剂量组差异显著, 低剂量组与空白对照组差异不显著。说明低浓度的紫锥菊对Transferrin基因的表达影响甚微。
3.4 肌肉注射紫锥菊提取物对大菱鲆头肾中TGF-β1基因相对表达量的影响动物体内多种细胞均可分泌非活性状态TGF-β1, 活化后的T细胞或B细胞产生的TGF-β1比静止细胞明显增高, TGF-β1的活性很多, 主要包括抑制免疫活性细胞的增值, 对细胞表型的调节, 抑制淋巴细胞的分化, 抑制细胞因子的产生等, 对机体的免疫功能起重要作用。
从对大菱鲆注射28d紫锥菊提取物TGF-β1基因的相对表达量可以看出, 对大菱鲆头肾中IL-1h基因相对表达量的影响极显著, 其中中剂量组基因相对表达量最高, 而高剂量组基因相对表达量显著降低, 但是高于空白对照组。经数据分析, 低剂量组和高剂量组对IL-1h基因相对表达量的影响并不显著。
3.5 肌肉注射紫锥菊提取物对大菱鲆头肾中IL-1h基因相对表达量的影响从对大菱鲆注射28d紫锥菊提取物IL-1h的相对表达量可以看出, 对大菱鲆头肾中IL-1h基因相对表达量的影响与对TGF-β1基因的相对表达量的影响变化趋势相类似, 其中中剂量组基因相对表达量最高, 而高剂量组和低剂量组对IL-1h基因相对表达量的影响并不显著。韩雯等(2014)利用皂角苷联合灭活疫苗免疫大菱鲆后对大菱鲆IL-1h基因表达量也有类似增强作用, 说明紫锥菊提取物对大菱鲆头肾中IL-1h基因表达有显著的增强作用, 目前影响机理尚不明确, 需要做进一步研究。
4 结论研究不同浓度紫锥菊提取物对大菱鲆头肾内非特异性免疫分子基因相对表达量的影响, 本试验通过测定Lysozyme、IL-1h、TGF-β1、Transferrin、C3补体等基因相对表达量试验结果表明, 紫锥菊提取物对大菱鲆头肾内非特异性免疫分子基因相对表达量有一定促进作用, 重新认证紫锥菊提取物能促进大菱鲆的非特异性免疫功能。
| 马爱军, 雷霁霖, 陈四清, 等, 2002. 大菱鲆产卵季节对卵子的生物学及生化特征的影响. 海洋与湖沼, 33(1): 75–82 DOI:10.11693/hyhz200201012012 |
| 王高学, 白冰, 崔婧, 等, 2006. 灰树花多糖对鲫鱼免疫功能的影响. 水产科学, 25(1): 9–12 |
| 任永林, 2008. 紫锥菊提取物对鲤生产性能和免疫功能的影响. 雅安: 四川农业大学硕士学位论文 |
| 庄政, 2008. 嗜水气单胞菌亚单位成分卵黄抗体在鳗鲡养殖中应用. 福州: 福建农林大学硕士学位论文, 10-11 |
| 汤菊芬, 吴灶和, 简纪常, 等, 2011. 注射黄芪多糖对吉富罗非鱼c型溶菌酶基因表达量的影响. 广东海洋大学学报, 31(1): 58–61 |
| 孙永欣, 徐永平, 汪婷婷, 等, 2009. 黄芪多糖对仿刺参体腔细胞中溶菌酶基因表达量的影响. 水产科学, 28(10): 572–574 DOI:10.3969/j.issn.1003-1111.2009.10.005 |
| 胡兵, 刘军, 侯永清, 等, 2008. 黄芪多糖对异育银鲫非特异性免疫力的影响. 水利渔业, 28(3): 108–111 |
| 唐雪莲, 付京花, 李志华, 等, 2012. 紫锥菊提取物对彭泽鲫生长和抗氧化反应的影响. 饲料工业, 33(14): 20–22 DOI:10.3969/j.issn.1001-991X.2012.14.005 |
| 黄智慧, 马爱军, 2010. 大菱鲆体表黏液细胞组化研究及高温胁迫对其类型和分布的影响. 水产学报, 34(5): 719–725 |
| 韩雯, 王秀华, 王玉娟, 等, 2014. 皂角苷对大菱鲆非特异免疫的增强作用. 水产学报, 38(7): 999–1008 |
| 雷霁霖, 2000. 海水养殖新品种介绍——大菱鲆. 中国水产,(4): 38–39 |
| 雷霁霖, 2005. 海水鱼类养殖理论与技术. 北京: 中国农业出版社, 321-322 |
| 雷霁霖, 门强, 2002. 大菱鲆人工繁殖与养殖技术讲座(Ⅱ). 齐鲁渔业, 19(10): 47–48 |
| 蔡中华, 陈成勋, 刑克智, 等, 1998. 四种中药对鲤鱼非特异性免疫功能的影响. 天津农学院学报, 5(2): 31–34 |
| Ardó L, Yin G J, Xu P, 2008. Chinese herbs (Astragalus membranaceus and Lonicera japonica) and boron enhance the non-specific immune response of Nile tilapia (Oreochromis niloticus) and resistance against Aeromonas hydrophila. Aquaculture, 275(1-4): 26–33 DOI:10.1016/j.aquaculture.2007.12.022 |
| Bachali S, Bailly X, Jollès J, et al, 2004. The lysozyme of the starfish Asterias rubens. A paradigmatic type i lysozyme. European Journal of Biochemistry, 271(2): 237–242 |
| Brattgjerd S, Evensen Ø, 1996. A sequential light microscopic and ultrastructural study on the uptake and handling of Vibrio salmonicida of the head kidney in experimentally infected Atlantic salmon (Salmo salar L. ). Veterinary Pathology, 33(5): 55–65 |
| Cádiz, 2015. Asociación Empresarial de Productores de Cultivos Marinos (APROMAR). La Acuicultura Marina de Peces en Espa a |
| Food and Agriculture Organization of the United Nations (FAO), 2011. The State of World Fisheries and Aquaculture (SOFIA) 2010. Rome: FAO |
| Liu M, Zhang S C, Liu Z H, et al, 2006. Characterization, organization and expression of Amphi Lys C, an acidic c-type lysozyme gene in amphioxus Branchiostoma belcheri tsingtauense. Gene, 367: 110–117 DOI:10.1016/j.gene.2005.09.017 |
| Liu Y L, Sun J H, Zhang J, et al, 2003. Effects of transferrin on the growth and proliferation of porcine hepatocytes:a comparison with epidermal growth factor and nicotinamide. Chinese Medical Journal, 116(8): 1223–1227 |
| Oppenheimer S J, 2001. Iron and its relation to immunity and infectious disease. Journal of Nutrition, 131(2): 616S–635S DOI:10.1093/jn/131.2.616S |
| Press C M, Evensen Ø, 1999. The morphology of the immune system in teleost fishes. Fish & Shellfish Immunology, 9(4): 309–318 |
| Sotelo-Mundo R R, Islas-Osuna M A, de-la-Re-Vega E, et al, 2003. cDNA cloning of the lysozyme of the white shrimp Penaeus vannamei. Fish & Shellfish Immunology, 15(4): 325–331 |
| Steel D M, Whitehead A S, 1994. The major acute phase reactants:C-reactive protein, serum amyloid P component and serum amyloid A protein. Immunology Today, 15(2): 81–88 DOI:10.1016/0167-5699(94)90138-4 |
 2018, Vol. 49
2018, Vol. 49

