中国海洋湖沼学会主办。
文章信息
- 丁丹, 潘宝平, 王玉梅, 侯梓园, 闫春财. 2018.
- DING Dan, PAN Bao-Ping, WANG Yu-Mei, HOU Zi-Yuan, YAN Chun-Cai. 2018.
- 青蛤(Cyclina sinensis)AP-1基因的克隆及在鳗弧菌(Vibrio anguillarum)侵染下的表达分析
- CLONING AND EXPRESSION OF AP-1 GENE FROM CYCLINA SINENSIS INFECTION BY VIBRIO ANGUILLARUM
- 海洋与湖沼, 49(1): 192-197
- Oceanologia et Limnologia Sinica, 49(1): 192-197.
- http://dx.doi.org/10.11693/hyhz20170700192
-
文章历史
- 收稿日期:2017-07-21
- 收修改稿日期:2017-08-23
在我国海区地带, 经济贝类中常见的当属青蛤(Cyclina sinensis)(王兴强等, 2006), 具有适应性强, 养殖产量高等经济效益(白胡木图吉力图等, 2008), 但随着国内青蛤养殖规模的逐年扩大, 导致养殖环境恶化及种质退化严重, 在我国江苏等地出现了由鳗弧菌等病原微生物引起的疾病并造成了大面积死亡现象(孙国铭等, 2004; 曹华, 2004), 青蛤的集约化养殖也遭受了极大的制约。为能适应目前的养殖业要求, 迫切需要研究其免疫防御系统和如何才能有效地防治病原微生物的侵染, 该研究结果定能为今后青蛤的大规模养殖奠定指导作用和实践价值。
转录因子中绝大部分都含有一种重要的结构域被称为亮氨酸拉链(leucine zipper), 又名碱性拉链(bZIP), 其组成包括碱性DNA的N端和亮氨酸二聚体的C端(Landschulz et al, 1988; Glover et al, 1995)。该拉链的非亮氨酸残基可决定蛋白之间的特异性结合(Alber, 1992)。转录因子-1(transcription factor gene, AP-1)则是其中重要的一种(Karin et al, 2001), Ap-1具有进化保守的bZIP功能域, 由亚家族单体: c-Jun蛋白家族(Hirai et al, 1989; Ryder et al, 1989; Hartl et al, 1991)、c-Fos蛋白家族(Nishina et al, 1990)、ATF蛋白家族、JDP蛋白家族(Aronheim et al, 1997)组成二聚体结构, 其稳定性由单体的不同组成决定。研究表明TLR、TNF和RIG等信号通路的传导(Redhu et al, 2011; Karpus et al, 2012)和干扰素、白细胞介素等细胞因子能将Ap-1基因这种具有先天免疫反应的重要因子激活(Wehkamp et al, 2004; Saadane et al, 2011)。细胞内的AP-1基因是信号传导的第三信使, 它的活性可经MAPK信号转导通路的磷酸化调控。Ap-1对病原微生物侵染会做出免疫应答, 可通过与Ap-1结构域中N端的DNA区域结合或调控其转录和翻译, 从而参与生物体内的免疫系统防御、细胞增殖、分化、编程性死亡等过程(Tan, 2012; 任毅鹏等, 2014; 魏星等, 2015)。
如今, 在脊椎动物类中关于转录因子Ap-1的报道时常能见到, 有报道显示哺乳动物的Ap-1能与基序为[TGA/C(G)TCA]的特异性DNA形成二聚体(Vesely et al, 2009; Ye et al, 2014), 这种复合体在调节炎症和控制不同类型组织或细胞的表达时均能发挥作用(Adcock, 1997; Jochum, 2001; Karin, 2001)。但在海洋无脊椎动物中这样的报道却不多, 也只有在鲍(Haliotis discus)和菲律宾蛤仔(Ruditapes philippinarum)中有, 在青蛤中关于AP-1基因的报道至今尚未发现。在研究脊椎动物Ap-1时, 发现该基因影响相关基因在免疫应答中表达, 同时还参与传导多条信号通路。鳗弧菌是制约青蛤养殖业发展的主要病原微生物, 所以开展青蛤AP-1基因的研究不但能够初步揭示软体动物先天免疫应答的作用机制, 还能为后续研究软体动物如何更好地防治病害起到指导作用(吴冰等, 2014)。
研究以生物免疫学方法为主, 从构建的转录组文库中筛选、克隆Ap-1基因cDNA序列并用在线生物学软件预测了其结构域、开放阅读框的结构和功能等。检测在鳗弧菌侵染下Ap-1基因在青蛤体内不同组织的时序表达过程, 进一步深入研究青蛤血淋巴中Ap-1基因在不同时间点的表达量变化。
1 材料与方法 1.1 实验材料 1.1.1 实验动物实验动物来自于天津大港滩涂, 将青蛤放入密度1.02—1.04g/cm3、水温21—24℃的海水中, 用0.005g/mL的小球藻饲养一周左右。然后筛选大小适中、外壳完好的个体, 平均壳宽(19.12± 0.57)mm, 平均壳长(29.14±1.23)mm, 平均壳高(29.52±1.47)mm, 进行实验。
1.1.2 材料处理用培养基将实验室低温保种的鳗弧菌(Vibrio anguillarum)在28℃下培养24h后, 用离心机离心, 重复3次无菌海水重悬, 将OD600调至0.4。依据随机分组原则, 每只青蛤分别取50mg的血淋巴、外套膜、闭壳肌、腮、肝脏等组织, 加入600μL Trizol研磨后再加400μL Trizol使其充分裂解。对照组每只注射50μL灭菌海水, 实验组青蛤注射50μL鳗弧菌, 在0、3、6、12、24、48、96h时间点抽取青蛤血淋巴, 3000r/min, 4℃, 离心10min; 加入1mL Trizol在冰中裂解5min。然后将材料放置在–80℃冰箱备用。
1.2 方法 1.2.1 青蛤Ap-1基因的筛选取健康青蛤各组织, 将其置于放有液氮容器中进行充分研磨, 然后使用QIAGEN公司的Oligotex mRNA Kits法, 加入1mL Trizol分离纯化总RNA。纯化好的mRNA用随机引物逆转录法合成cDNA。将得到的双链cDNA需经末端修饰、加尾、加测序接头、纯化、PCR技术扩增等制备过程。采用第二代测序仪完成青蛤转录组测序。得到的序列用Unigene编码蛋白框ORF测序分析、经BLAST分析、克隆检测、基因功能Go注释和代谢途径分析, 最后从中筛选得到青蛤Ap-1基因序列。
1.2.2 青蛤Ap-1基因的克隆与序列分析将筛选出的Ap-1基因全长序列, 通过Primer5.0软件设计符合要求的引物并进行基因克隆; 用BioEdit软件将克隆的序列与GenBank核酸数据库序列进行比对; SMART软件可预测该基因的结构域; 使用Open Reading Frame在线预测基因开放阅读框(ORF); 用ProtParam在线分析其分子量, 等电点, 分子式等; 用Clustal W对氨基酸序列进行多重比对和同源性分析; Ap-1信号肽用SignalP3.0查找; 用MEGA6以邻接法(NJ)构建分子系统数。
1.2.3 检测Ap-1基因在青蛤5个组织中的表达变化将提好的青蛤血淋巴、外套膜、肝脏、腮和闭壳肌等组织的RNA进行逆转录, 合成cDNA并以此作为模板, 放入–20℃备用。选用稳定性强的内参基因RT-β-actin-F, RT-β-actin-R; 特异性引物用RT-Ap-1-F, RT-Ap-1-R (表 1), 在Rotor-Gene6000实时定量PCR仪上进行反应。扩增体系为20μL, 程序为: 95℃预变性30s, 95℃变性3s, 60℃延伸15s, 40个循环。数据处理采用2–ΔΔCT法计算(Livak et al, 2001), 以RQ平均值±标准差作为基因的表达水平。然后依据SPSS软件进行t检验分析显著性差异。
| 引物 | 序列(5′—3′) |
| RT-β-actin-F | CACCACAACTGCCGAGAG |
| RT-β-actin-R | CCGATAGTGATGACCTGACC |
| RT-Ap-1-F | GGAGCAGTATTGGTCAGATT |
| RT-Ap-1-R | TCGTGTTAGCAGTGCGTAGA |
分别提取经鳗弧菌侵染后0、3、6、12、24、48、96h时间点的青蛤血淋巴总RNA, 通过逆转录合成cDNA。内参基因用RT-β-actin-F、RT-β-actin-R, 特异性引物用RT-Ap-1-F、RT-Ap-1-R, 反应体系、反应程序, 参照1.2.3。数据处理采用2–ΔΔCT法, 然后依据SPSS软件分析。
2 结果 2.1 青蛤Ap-1基因的结构分析青蛤转录组中筛选出的Ap-1基因, 其基因全长1914bp, 结构域195bp, 编码65个氨基酸, 开放阅读框为825bp, 从419bp到1243bp, 共编码274个氨基酸(图 1), 存在一个相对保守的BRLZ结构域。在GenBank的注册号为KX840340。其理论分子量为30.07kDa, 理论等电点pI=8.81, 分子式为C1298H2132 N372O417S14。氨基酸组成中亮氨酸(Leu)最高, 占8.8%,
 |
| 图 1 青蛤Ap-1基因cDNA序列的开放阅读框和结构域分析 Fig. 1 The open reading frame of Ap-1 gene and the structure domain 注:起始密码子用波浪线, 终止密码子用虚线, BRLZ结构域用双线 |
采用MEGA6.0软件以邻接法(NJ)构建了Ap-1的系统树(图 2), 用bootstrap 1000个循环检验拓扑结构的置信度。其结果显示:青蛤Ap-1与盘鲍(Haliotis discus)和菲律宾蛤仔(Ruditapes philippinarum)聚在一个分支上, 表明它们之间进化距离最近, 而黑线仓鼠(Cricetulus griseus)、非洲爪蟾(Xenopus laevis)等在另一个分支上, 说明与其进距离较远。
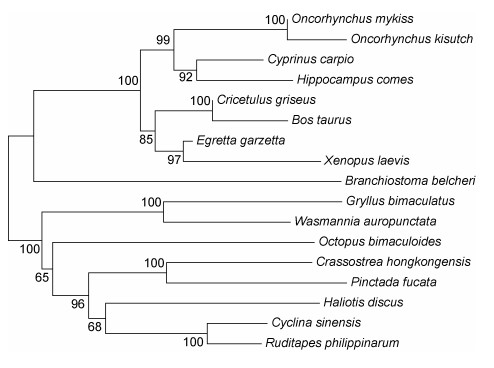 |
| 图 2 使用邻接法(NJ)构建的17个物种Ap-1氨基酸序列系统树 Fig. 2 The phylogenetic tree constructed with amino acid sequences of Ap-1 of 17 species using neighbor-joining method 注:建立系统树所用的物种以及序列号为: Ruditapes philippinarum ADZ48236.1; Crassostrea hongkongensis AHF51977.1; Haliotis discus discus ADQ43242.1; Octopus bimaculoides XP_014768778.1; Pinctada fucata AKP06506.1; Oncorhynchus mykiss CDQ60233.1; Gryllus bimaculatusm BAX36489.1; Cricetulus griseus XP_007608298.1; Wasmannia auropunctata XP_011694334.1; Egretta garzetta XP_009634534.1; Oncorhynchus kisutch XP_020354835.1; Bos taurus NP_001071295.1; Cyprinus carpio XP_018981694.1; Hippocampus comes XP_019752857.1; Xenopus laevis NP_001079363.1; Branchiostoma belcheri; XP_019631421.1; Cyclina sinensis KX840340 |
以实时荧光定量PCR方法研究Ap-1基因在青蛤组织:外套膜、闭壳肌、血淋巴、肝脏及腮的表达量变化情况, 用稳定性强的β-actin基因作为青蛤5个组织中表达量的对照组, 以AP-1基因做实验组。实验结果表明:在青蛤的5个组织中Ap-1基因均有一定程度的表达且存在差异(图 3), 其中表达量最高是在血淋巴中, 显著高于其他组织(P < 0.05), 闭壳肌表达量次之, 后面依次为腮、外套膜, 而肝脏中的表达量最低, 约占血淋巴的1/7。表明Ap-1基因在青蛤中主要通过血淋巴表达出来。
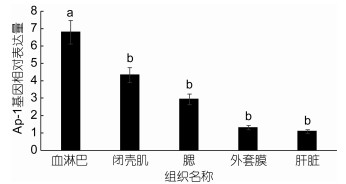 |
| 图 3 青蛤Ap-1基因在青蛤不同组织间的表达情况 Fig. 3 The expression of C. sinensis in organs revealed by real time PCR 注:柱上不同字母代表示差异显著(P < 0.05) |
用鳗弧菌侵染青蛤以后, 利用荧光定量PCR分析了青蛤Ap-1基因在血淋巴中不同时间点的表达情况变化(图 4)。结果发现, 与对照组相比, 实验组在感染后24h骤升并达到最大值, 且与对照组存在极显著性差异(P < 0.01), 约为对照组的1.5倍左右; 与各时间点的实验组相比, 感染24h的表达量最大, 有极显著性差异(P < 0.01)。48h后其表达量开始下降。
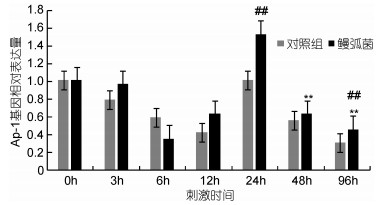 |
| 图 4 青蛤血淋巴Ap-1基因在鳗弧菌侵染下不同时间相对表达的情况 Fig. 4 The relative expression of Cs Ap-1 gene in hemolymph of C. sinensis infected by V. anguillarum in different periods 注: **表示相同时间点实验组与对照组基因的转录表达水平差异极显著(P < 0.01); ##表示该时间点对照组基因的转录表达水平与同组注射前(0h)相比差异极显著(P < 0.01) |
转录因子AP-1参与众多的生物反应, 是重要的转录因子。通过青蛤转录组文库获得了Ap-1基因的cDNA序列。青蛤Ap-1基因在结构上, 具有其蛋白家族典型的Jun功能域的N端和保守亮氨酸拉链结构域(BRLZ)的C端, 能和DNA结合形成二聚体(Glover, 1995), 青蛤Ap-1基因与大多数转录因子一样, 都在进化上相对保守。经蛋白多序列同源比对、系统进化树分析, 发现其与菲律宾蛤仔(Ruditapes philippinarum)和盘鲍(Haliotis discus)亲缘关系最近。由此可以推测, 青蛤Ap-1可能通过亮氨酸拉链结构域结合特异目标蛋白, 从而在Toll样受体和NF-KB、MAPK等信号传导通路中发挥传递、调控等功能(Tan, 2012)。
通过荧光定量PCR技术分析, Ap-1基因在青蛤血淋巴、外套膜、闭壳肌、肝脏、鳃等组织中广泛表达。说明青蛤Ap-1和杂色鲍、凡纳滨对虾和菲律宾蛤仔是相同的(De Zoysa, 2010; 吴冰等, 2014; Wu et al, 2015)。Ap-1在不同细胞或组织中的表达具有特异性, 并可调节其转录特异性基因, 这种特异性符合家族成员在组织表达中的特点。青蛤Ap-1基因在血淋巴中表达量最高, 这同样与上述三种生物相同。青蛤的先天非特异性免疫主要通过血淋巴循环, 血淋巴中含有大量吞噬细胞, 可破坏微生物的同时产生和释放抗菌物质, 在病原微生物侵染过程中发挥防御作用。当外界病原刺激青蛤时能直接接触刺激的组织是鳃, 其表达量也比较高。这与凡纳滨对虾和菲律宾蛤仔类似, 说明Ap-1不仅在影响免疫应答过程, 可能也同时参与细胞的编程性死亡(Ameryar et al, 2008)。青蛤Ap-1在肝脏中表达量最低, 这与凡纳滨对虾类似。青蛤Ap-1内参基因和凡纳滨对虾、菲律宾蛤仔和杂色鲍均一样都是用稳定性强的β-actin。而盘鲍选用核糖体蛋白L17(EF03427)作为组织表达的内参基因, 就造成青蛤Ap-1与盘鲍的血淋巴、外套膜等组织表达情况不同(De Zoysa, 2010)。
研究表明:当病原微生物侵染无脊椎动物, 如菲律宾蛤仔、杂色鲍和凡纳滨对虾时, 其血淋巴的表达量都呈现出显著性变化。本实验用鳗弧菌侵染青蛤, 检测出其血淋巴中Ap-1基因的表达量在0、3、6、12、24、48、96h呈现出不同的变化情况。当鳗弧菌刚开始侵染青蛤的0—12h过程中, 与对照组相比, AP-1基因几乎没变化或呈下降趋势。无脊椎动物的许多免疫信号通路传导和相关免疫基因的表达调控都与Ap-1基因有关。Ap-1这个下游效应基因在免疫信号传导过程中会被MAPK信号通路控制其活性(Ye et al, 2014)。青蛤IRAK-4是Toll样信号通路的上游接头分子, 在被鳗弧菌感染3h表达量达到最大值。而作为MAPK下游的Ap-1效应基因, 只能在鳗弧菌侵染一段时间后才能被激活, 像其他免疫防御基因一样参与免疫防御过程。综上分析表明:在被鳗弧菌侵染的早期免疫应答过程, AP-1基因并不参与免疫防御过程。可能因为在免疫防御的早期阶段, 参与病原微生物识别和信号传导的主要是Toll受体和其通路上游的因子(Ge, 2011)。转录因子Ap-1不能在鳗弧菌侵染的早期就像模式识别受体那样结合病毒并发挥作用。在感染后24h时, AP-1基因表达量明显高于对照组, 且与实验组相比也达到最大值, 说明Ap-1最大程度上参与了防御鳗弧菌的免疫应答过程。推测此时青蛤的非特异性免疫防线被激活, 大量血细胞得到复制并能产生许多吞噬细胞, 从而抵御鳗弧菌的侵染。说明转录因子Ap-1参与了革兰氏阴性菌引起的机体免疫信号传导。在被鳗弧菌侵染48—96h, AP-1基因的表达量与24h相比有所下降, 但仍高于对照组(P< 0.01)。
4 结论本实验利用青蛤转录组文库对Ap-1基因进行筛选、克隆、鉴定和生物学分析, 可知青蛤Ap-1基因含有其蛋白家族典型的保守的bZIP功能域。对Ap-1基因在青蛤鳃、血淋巴、肝脏、外套膜、闭壳肌等不同组织及病原微生物侵染下的血淋巴的表达特征进行了分析, 结果显示青蛤的血淋巴是其非特异性免疫过程的重要防线。作为下游效应基因的转录因子Ap-1, 在青蛤的免疫防御应答过程和重要的信号传导通路中发挥了重要作用。本实验对青蛤Ap-1基因的生物免疫学研究结果有望为今后深入了解无脊椎动物提供有价值的信息。
| 王兴强, 曹梅, 阎斌伦, 等, 2006. 青蛤的生物学及其繁殖. 水产科学, 25(6): 313–316 |
| 白胡木吉力图, 高悦勉, 姚红伟, 2008. 青蛤北方3个群体遗传多样性分析. 水产科学, 27(9): 487–489 |
| 任毅鹏, 高晶, 潘宝平, 等, 2014. 青蛤(Cyclina sinensis)TLR2基因的克隆与表达分析. 海洋与湖沼, 45(5): 1037–1043 DOI:10.11693/hyhz20140600183 |
| 孙国铭, 万夕和, 刘培庭, 等, 2004. 通州海区滩涂青蛤死亡原因的初步分析. 水产养殖, 25(2): 26–27 |
| 吴冰, 刘逸尘, 张亦陈, 等, 2014. 凡纳滨对虾Ap-1基因的克隆和表达特征分析. 水产学报, 38(9): 1294–1301 |
| 曹华, 2004. 沿海滩涂青蛤死亡原因初探及对策. 科学养鱼,(4): 47–48 |
| 魏星, 张海静, 潘宝平, 2015. 青蛤(Cyclina sinensis)IKB基因的克隆及其在鳗弧菌(Vibrio anguillarum)刺激下的表达分析. 海洋与湖沼, 46(4): 793–799 |
| Adcock I M, 1997. Transcription factors as activators of gene transcription:Ap-1 and NF-κB. Monaldi Archives for Chest Disease, 52(2): 178–186 |
| Alber T, 1992. Structure of the leucine zipper. Current Opinion in Genetics & Development, 2(2): 205–210 |
| Ameyar M, Wisniewska M, Weitzman J B, 2008. A role for Ap-1 in apoptosis:the case for and against. Biochimie, 5(8): 747–752 |
| Aronheim A, Zandi E, Hennemann H, et al, 1997. Isolation of an AP-1 repressor by a novel method for detecting protein-protein interactions. Molecular and Cellular Biology, 17(6): 3094–3102 DOI:10.1128/MCB.17.6.3094 |
| De Zoysa M, Nikapitiya C, Lee Y, et al, 2010. First molluscan transcription factor activator protein-1 (AP-1) member from disk abalone and its expression profiling against immune challenge and tissue injury. Fish & Shellfish Immunology, 29(6): 1028–1036 |
| Ge H, Wang G D, Zhang L L, et al, 2011. Molecular cloning and expression of interleukin-1 receptor associated kinase 4, an important mediator of Toll-like recptor signal pathway, from small abalone Haliotis diversicolor. Fish & Shell fish Immunology, 30(4-5): 1138–1146 |
| Glover J N M, Harrison S C, 1995. Crystal structure of the heterodimeric bZIP transcription factor c-Fos-c-Jun bound to DNA. Nature, 373(6511): 257–261 DOI:10.1038/373257a0 |
| Hartl M, Hutchins J T, Vogt P K, 1991. The chicken junD gene and its product. Oncogene, 6(9): 1623–1631 |
| Hirai S I, Ryseck R P, Mechta F, et al, 1989. Characterization of junD:a new member of the jun proto-oncogene family. The EMBO Journal, 8(5): 1433–1439 |
| Jochum W, Passegué E, Wagner E F, 2001. Ap-1 in mouse development and tumorigenesis. Oncogene, 20(19): 2401–2414 DOI:10.1038/sj.onc.1204389 |
| Karin M, Shaulian E, 2001. AP-1:linking hydrogen peroxide and oxidative stress to the control of cell proliferation and death. IUBMB Life, 52(1-2): 17–24 |
| Karpus O N, Heutinck K M, Wijnker P J M, et al, 2012. Triggering of the dsRNA sensors TLR3, MDA5 and RIG-I induces CD55 expression in synovial fibrob lasts. PLoS One, 7(5) |
| Landschulz W H, Johnson P F, McKnight S L, 1988. The leucine zipper:a hypothetical structure common to a new class of DNA binding proteins. Science, 240(4860): 1759–1764 DOI:10.1126/science.3289117 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using Real-time quantitative PCR and the 2−ΔΔCT methods. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Nishina H, Sato H, Suzuki T, et al, 1990. Isolation and characterization of fra-2, an additional member of the fos gene family. Proceedings of the National Academy of Sciences of the United States of America, 87(9): 3619–3623 DOI:10.1073/pnas.87.9.3619 |
| Redhu N S, Saleh A, Halauko A J, et al, 2011. Essential role of NF-κB and Ap-1 transcription factors in TNF-α induced TSLP expression in human air way smooth muscle cells. American Journal of Physiology Lung Cellular and Molecular Physiology, 44(3): 479–485 |
| Ryder K, Lanahan A, Perez-Albuerne E, et al, 1989. Jun-D:a third member of the jun gene family. Proceedings of the National Academy of Sciences of the United States of America, 86(5): 1500–1503 DOI:10.1073/pnas.86.5.1500 |
| Saadane A, Eastman J, Berger M, et al, 2011. Parthenolide inhibits ERK and Ap-1 which are dysreguated and contribute to excessive IL-8 expression and secretion in cystic fibrosis cells. Journal of Inflammation (London, England), 8: 26 DOI:10.1186/1476-9255-8-26 |
| Tan J, 2012. Cloning and Expression of Japanese amphioxus AP-1 transcription factor gen. Shanghai Ocean University |
| Vesely P W, Staber P B, Hoefler G, et al, 2009. Translational regulation mechanisms of AP-1 proteins. Mutation Research/Reviews in Mutation Research, 682(1): 7–12 DOI:10.1016/j.mrrev.2009.01.001 |
| Wehkamp J, Harder J, Wehkamp K, et al, 2004. NF-KB and Ap-1 mediated induction of human betade fensin-2 in intestinal epithelial cells by Escherichia coli nissle 1917:a novel effect of a probiotic bacterium. Infection and Immunology, 72(10): 5750–5758 DOI:10.1128/IAI.72.10.5750-5758.2004 |
| Wu L N, Zhang L, Zhao J M, et al, 2015. Cloning and expression of a transcription factor activator protein-1 (Ap-1) member identified from Manila clam Venerupis philippinarum. Gene, 557(1): 106–111 DOI:10.1016/j.gene.2014.12.027 |
| Ye N, Ding Y, Wild C, et al, 2014. Small molecule inhibitors targeting activator protein 1 (AP-1). Journal of Medicinal Chemistry, 57(16): 6930–6948 DOI:10.1021/jm5004733 |
 2018, Vol. 49
2018, Vol. 49


