中国海洋湖沼学会主办。
文章信息
- 叶容晖, 任海波. 2018.
- YE Rong-Hui, REN Hai-Bo. 2018.
- 三角帆蚌(Hyriopsis cumingii)叉头蛋白2(foxl2)基因和性别决定框14(sox14)基因克隆与表达分析
- MOLECULAR CLONING AND GENE EXPRESSION OF FOXL2 AND SOX14 GENE FROM HYRIOPSIS CUMINGII
- 海洋与湖沼, 49(1): 160-167
- Oceanologia et Limnologia Sinica, 49(1): 160-167.
- http://dx.doi.org/10.11693/hyhz20170600165
-
文章历史
- 收稿日期:2017-06-20
- 收修改稿日期:2017-07-18
2. 宁波海洋研究院 宁波 315012
2. Ningbo Institute of Oceanography, Ningbo 315012, China
哺乳动物中已经报道很多生殖基因参与性别分化与维持, 包括促进精巢发育的Wt1, Sf1, Sry, Sox9, Gata4, Dmrt1 (Ferguson-Smith, 2007)和促进卵巢发育的Wnt4, RSpo1, Foxl2, Dax1 (Wilhelm, 2007)。Fox (forkhead box)基因是一个转录因子家族, 包括Foxa, Foxb, Foxc, Foxl等20多种成员。它们在调节细胞生长、增殖和寿命相关基因表达中起重要作用。很多fox基因都对胚胎发育起关键作用(Tuteja et al, 2007a, b)。Fox蛋白在细胞分化时能优先结合到致密染色体区域促进染色体活化(Zaret et al, 2011)。Fox蛋白的命名是因为它们有forkhead box结构, 这是一个80—100个氨基酸的motif区域, 能结合到DNA上, 其结构也称为winged helix, 因为其类似蝴蝶的环状区域(Lehmann et al, 2003)。foxl2在一个在脊椎动物卵巢早期发育中起重要作用的保守基因, 它在哺乳动物卵巢发育中发挥功能, 是卵巢分化的标记, 特别对于颗粒细胞分化是必须的。在精巢中foxl2能抑制sox9的表达, 从而阻滞精巢发育(Yang et al, 2017)。雌性个体缺失foxl2基因后会表现为雄性, 比如敲除成年小鼠foxl2基因, 卵巢会发育成精巢(Uhlenhaut et al, 2009)。无脊椎动物中关于foxl2研究很少, 如海葵(Nematostella vectensis)中的foxl2 (Magie et al, 2005), 海胆(Strongylocentrotus purpuratus)foxl2在发育的72h内就开始高表达(Tu et al, 2006), 海绵(Suberites domuncula)foxl2在各组织中普遍表达(Adell et al, 2004), 牡蛎(Crassostrea gigas)foxl2在不同组织和发育时期表现特定的时空表达谱(Naimi et al, 2009)。
Sox基因家族编码的转录因子属于HMG-BOX超家族成员, 能结合到染色体DNA小沟内。HMG boxes在昆虫、线虫、两栖类到哺乳动物中都有分布。但是HMG boxes家族序列表现高度多样性, 只有很少的氨基酸在不同物种中保守存在。有20多种sox基因存在于人和小鼠中, 包括性别决定因子SRY。有8种sox基因存在于果蝇。所有sox基因在HMG box区域有约50%的相似性, 其余部分相似性较低(Bowles et al, 2000)。Sox家族多数成员均参与动物发育, 比如神经系统发育中, sox2、sox3和sox11参与小脑颗粒细胞的迁移, 其中sox9和sox3参与性别决定(Rex et al, 1998)。
三角帆蚌(Hyriopsis cumingii)为我国特有物种, 超过70%的世界淡水珍珠是由三角帆蚌培育而成。在蚌养殖中, 不育群体和单性群体具有十分明显的优势。性腺不发育可使能量转向体细胞生长, 提高个体的生长速度, 在珍珠生产中, 还能增加珍珠质分泌(姜卫国等, 1991; 何毛贤等, 2002), 由于没有了性腺的挤压以及降低了插核手术的难度, 有核珍珠的留核率、成珠率、正圆珠比例都显著提高, 而素珠和尾巴珠的比例显著降低(林岳光等, 1993)。在性比控制方面, 单性化养殖可以增加养殖个体平均体重、增加单位面积产出、缩短生产周期, 从而大幅提高养殖收益, 多种鱼类、甲壳类的单性化养殖已经创造了巨大的经济效益(Mohanakumaran et al, 2006; Singh, 2013)。在传统养殖条件下, 三角帆蚌3龄雄性育珠蚌产珠量比雌性高出12.4%, 产珠粒重比雌性高出13.5%; 4龄雄性育珠蚌产珠量比雌性高出17.5%, 产珠粒重比雌性高出17.9%, 证明了雄性单性化养殖在三角帆蚌育珠生产中有巨大应用价值(Zhao et al, 2013)。目前三角帆蚌性别分化和发育研究还很少, 基因信息缺乏是一个重要原因, 我们采用二代测序技术已经完成三角帆蚌生殖腺转录组测序工作, 从中获得一系列生殖相关基因。本研究以foxl2和sox14为对象, 分析其在不同组织和发育时期的的表达, 对转录组研究提供补充, 也为三角帆蚌生殖与发育生物学研究提供基础资料。
1 材料与方法 1.1 组织样本及核酸提取1龄河蚌来自浙江金华威望养殖新技术有限公司养殖场(省级三角帆蚌良种场)。选择蚌体健康无病个体, 活体解剖取外套膜, 闭壳肌, 鳃, 消化腺, 足, 精巢和卵巢。每个组织块约30mg, 液氮保存。4月三角帆蚌繁殖期, 在水温20ºC左右, 取亲蚌, 按3︰1比例放入网袋, 定期取样观察。在解剖镜下于蚌外鳃育儿囊内观察受精卵、卵裂期、囊胚期、原肠期、膜内钩介幼虫期5个时期的胚胎, 用镊子取下胚胎, –80ºC低温保存。钩介幼虫取自感染的黄颡鱼鳃。总RNA提取采用动物组织RNA提取试剂盒(上海生工生物工程有限公司)进行, 具体按照说明书完成。总RNA电泳鉴定质量, Nanodrop 2000微量紫外分光光度计检测浓度。OD260/OD280比值位于1.8和2.0之间的样本用于qRT-PCR分析。
1.2 foxl2基因序列及表达分析将三角帆蚌foxl2和sox14的DNA序列通过NCBI(https://blast.ncbi.nlm.nih.gov)BLASTN进行核酸序列比对, 搜索哺乳动物、鸟类, 爬行动物、鱼类和软体动物的基因库, 获得相似性较高的同源基因为代表进行分析。序列比对和系统进化分析使用ClustalW 1.83和MEGA 6.0软件, 用邻接法(Neighbor-joining)构建分子系统树, NJ算法采用poission correction替换模型法。树分支的可信度测序采用100次重复抽样检验。
反转录和定量PCR条件和体系参考TaKaRa公司SYBR ExScript RT-PCR Kit说明书, PCR总体系为20μL, 其它组分的含量按比例相应调整。定量PCR在Bio-Rad iCycler荧光定量PCR仪上进行, 对样品和标准品进行PCR扩增、检测和相对定量分析。取500ng卵巢总RNA反转录后获得的cDNA进行10倍梯度稀释, 作为标准品, 检测foxl2、sox14和βactin基因引物扩增效率, 检测PCR条件。基因在不同组织中的表达检测时, 5个浓度梯度标准品以DNA设置2个重复, 待测组织样品3个重复。标准曲线和基因表达水平由系统分析, 基线由软件自动设置。foxl2定量PCR引物如下, foxl2-F (GCAGAACAGCATACGGCACA)和foxl2-R (GCAGGGTCAAGGGTCCAAT)。Sox14定量PCR引物如下, sox14F: CACTGAA TGAGACCATGAAG; sox14R: ACACAGGTACAGGACCGTGTT。内标基因β actin引物序列: β-actin-F (ACGGATAACACAAGGAAAGGAAAC); β-actin-R (ATGGATGGAAACACGGCT CT)。
1.3 原位杂交根据foxl2序列中保守的部分设计引物(P1: AAACCTCCATATTCGTATGT; P2: ATATTGCGAAT ATTGCG)进行PCR扩展得到长度为420bp的DNA序列。同样设计sox14保守区引物Soxl4-F (CACTGA ATGAGACCATGAAG)和Soxl4-R (GAATTTCTCCC TTGG TTTTGTC)。扩增2个基因片段, 克隆到pGEM-T载体。通过转化大肠杆菌, 测序后获得重组质粒foxl2-pGEM-T和sox14-pGEM-T。
杂交探针合成和杂交过程参考罗氏公司DIG RNA Labeling Kit (SP6/T7)试剂盒。主要过程如下, 分别用SacII和SacI内切酶对重组质粒foxl2-pGEM-T和sox14-pGEM-T进行单酶切, 线性化重组质粒后并以此为模板, 加入底物DIG-Labeling Mix, 在体外分别用相应的T7或SP6 RNA聚合酶进行转录, 获得反义和正义地高辛标记的探针, 经过异丙醇沉淀, 75%酒精清洗, RNA探针溶于预杂交液预杂交液Hybe(罗氏公司)后, 放入–80ºC保存备用。活体取河蚌精巢和卵巢, 4%多聚甲醛固定, 4ºC过夜, 甲醇脱水后, 制备冰冻切片, 切片厚度10μm, 42ºC烘干备用后–20ºC冷冻备用。主要染色过程如下, 1×PBS洗10min, 蛋白酶K (1×PBST稀释, 终浓度为10μg/mL)处理5min, 1×PBST (1×PBST加100µL Tween 20)清洗3次, 每次15min。用预杂交液处理3h, 然后用地高辛标记的探针68ºC杂交过夜。杂交处理后, 用0.2×SSC在下浸泡1h, 血清封闭3h。显色使用原位杂交检测试剂盒Ⅱ(武汉博士德, MK1032), BCIP/NBP避光显色。在原位杂交同时, 选同一批切片做常规H.E染色, 最后显微镜检查拍照。
2 结果与分析 2.1 河蚌foxl2、sox14和wnt2基因序列比较根据同期三角帆蚌精巢和卵巢转录组测序结果, 我们获得foxl2和sox14基因的部分保守序列(图 1)。设计引物进行RT-PCR后在卵巢和精巢中获得foxl2片段长度为420bp, sox14基因长片段长度为830bp。
 |
| 图 1 三角帆蚌foxl2基因(a)和sox14基因(b)保守的cDNA序列 Fig. 1 Partial cDNA sequences of foxl2 gene (a) and sox14 gene (b) in H. cumingii |
从GenBank数据库下载foxl2和sox14在哺乳动物、鸟类, 爬行动物、鱼类和软体动物的同源基因, 利用Clustal W 1.83软件进行序列比对, Mega 6.0软件的邻接法(N-J法)构建基于核酸序列的系统进化树。结果显示, 所列物种分为5个分支, 其中三角帆蚌foxl2与牡蛎(Crassostrea gigas)、扇贝(Chlamys farreri)和青螺(Lottia gigantea)在一个分支上。哺乳动物、鸟类、爬行动物和硬骨鱼类foxl2基因分别单独聚在一起(图 2)。
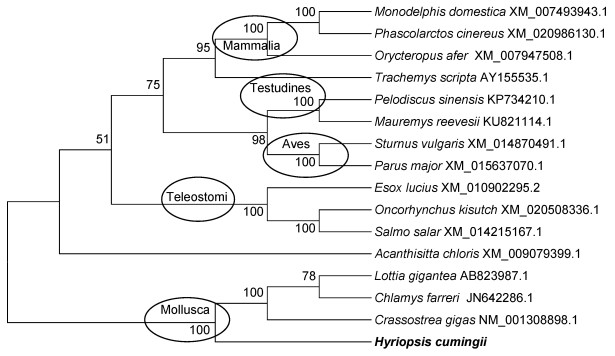 |
| 图 2 foxl2基因系统进化树 Fig. 2 Phylogenetic tree of foxl2 gene 注:使用MEGA 6.0按邻接法构建系统进化树。结点处数值代表 100次评估的自举检验置信度 |
三角帆蚌sox14在哺乳动物、鸟类、爬行动物和硬骨鱼类的同源基因也分别聚为一类, 也和牡蛎的同源性最高(图 3)。
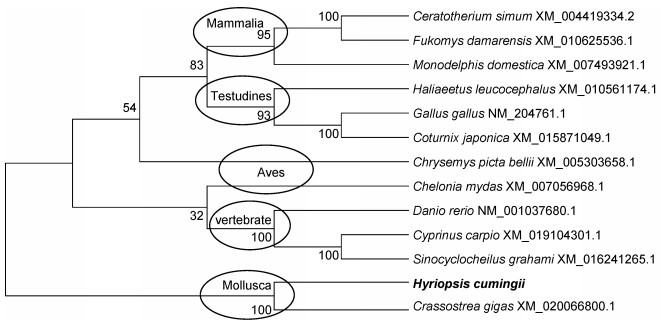 |
| 图 3 foxl2基因系统进化树 Fig. 3 Phylogenetic tree of sox14 gene 使用MEGA 6.0按邻接法构建系统进化树。结点处数值代表 100次评估的自举检验置信度 |
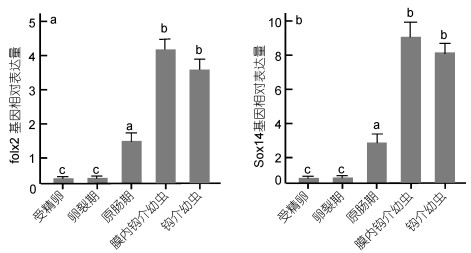
定量PCR扩增得到的foxl2基因长度为141bp, 从图 4可见, foxl2主要在闭壳肌、精巢和卵巢中表达, 以卵巢中的表达水平最高, 精巢和闭壳肌中较少, 外套膜、鳃、消化腺和足中很低(图 4a)。sox14在精巢和卵巢中高表达, 精巢是卵巢的4倍左右。其他5种组织中sox14表达量很低, 相互间没有显著性差异(图 4b)。
 |
| 图 4 foxl2基因和sox14基因在三角帆蚌各组织中的表达 Fig. 4 Expression of foxl2 and sox14 gene in various tissues of H. cumingii 图中标有不同的字母表示存在显著性差异(P<0.05) |
三角帆蚌胚胎发育时间为15d左右, foxl2在受精卵和卵裂期基本不表达, 从原肠期开始有表达, 在膜内钩介幼虫和钩介幼虫期比较高(图 5a)。Sox14也表现出和foxl2类似的模式, 在钩介幼虫期表达比最高(图 5b)。
 |
| 图 5 foxl2基因和sox14基因在三角帆蚌胚胎发育期的表达 Fig. 5 Expression of foxl2 and sox14 gene in various development stages of H. cumingii 图中标有不同的字母表示存在显著性差异(P<0.05) |
本研究采用二期卵巢进行基因表达定位, 此期卵巢最大的卵细胞直径约300µm, 结构清晰, 容易进行组织结构观察。H.E染色结果表明, 三角帆蚌生殖腺属于滤泡型, 滤泡是形成卵子和精子的部位, 滤泡密布在网状结缔组织中间。卵巢中卵细胞散在分布, 部分卵核在染色过程中被洗掉形成空泡, 卵黄已经开始形成, 着色深。颗粒细胞已经开始包围卵细胞, 卵巢间质细胞还比较多, 把卵细胞分散开(图 6a)。精巢中已经形成大量精子细胞, 精巢间质细胞少。精巢中不同的精小叶间有空隙(图 6b)。原位杂交的结果显示, foxl2基因mRNA在三角帆蚌卵巢中有明显的杂交信号, 主要分布在滤泡细胞中(图 6c)。foxl2基因mRNA在三角帆蚌精巢中有弱杂交信号, 主要分布在精巢间质细胞中(图 6d), 而加正义探针的对照组在卵巢(图 6e)和精巢(图 6f)中都没有阳性信号。
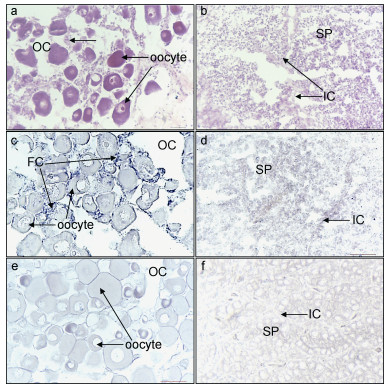 |
| 图 6 三角帆蚌foxl2基因在性腺组织原位杂交 Fig. 6 In situ hybridization of foxl2 gene in gonad of H. cumingii gonad a.卵巢HE染色100×; b.精巢HE染色100×; c.卵巢原位杂交实验组100×; d精巢原位杂交实验组400 ×; e.卵巢原位杂交对照组100×; f.精巢原位杂交实验组40 ×; OC.卵巢腔; IC:精巢间质细胞(莱氏细胞); SP:精子细胞; FC:滤泡细胞 |
Sox14基因主要在精巢间质细胞和一些发育中的精子细胞中有表达(图 7a), 卵巢中表达很低, 主要在滤泡细胞内(图 7b), 对照组都没有阳性信号(图 7c和图 7d)。
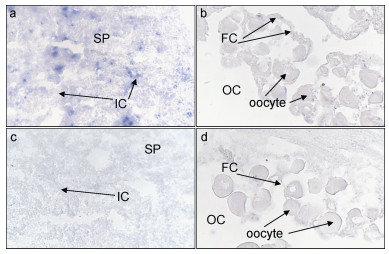 |
| 图 7 三角帆蚌soxl4基因在性腺组织原位杂交 Fig. 7 In situ hybridization of sox14 gene in gonad of H. cumingii gonad a.精巢原位杂交实验组100×; b.卵巢原位杂交实验组100×; c.精巢原位杂交对照组100×; d.卵巢巢原位杂交对照组400×。OC:卵巢腔; IC:精巢间质细胞(莱氏细胞); SP:精子细胞; FC:滤泡细胞 |
三角帆蚌缺乏基因组, 转录组是获取基因信息的主要途径, 通过转录组可以快速获得想要研究的基因(Bai et al, 2013; Zhang et al, 2016)。三角帆蚌主要产自中国, 在养殖中, 雄性单性化养殖在三角帆蚌育珠生产中能显著提高产量(Zhao et al, 2013)。但是三角帆蚌的性别发育和调控研究很少。我们在前期工作中对其精巢和卵巢表达谱进行了分析, 通过比较每个序列的测序深度, 我们发现一系列精巢和卵巢特异表达或高表达基因序列。其中foxl2和sox14分别在三角帆蚌卵巢和精巢总高表达。本文对这2个基因进行了比较深入的分析。
Foxl2在于哺乳动物中研究较多, 其主要在卵巢颗粒细胞中发挥功能。哺乳动物, 包括人、羊和老鼠性别决定就是生殖腺分化为精巢或卵巢的过程。有2条基因调控通路在雌性性别分化中起决定性作用, RSO1/WNT/CTNNB1通路和FOXL2参与的通路, foxl2作为转录因子在卵泡形成和卵巢功能维持中至关重要(Pannetier et al, 2016)。XY个体中位于Y染色体上的SRY基因会引起精巢的分化。XX个体缺乏SRY基因, 会激活相关通路, 促使卵巢发育。其中, FOXL2、WNT4和RSPO1相关基因通路对卵巢发育期关键作用, 特别是FOXL2的缺失会导致雌性不育(Elzaiat et al, 2017)。在包括哺乳动物的很多动物中, 性别决定有几个关键因子控制, 如果这些性别决定因子表达有变化, 性逆转就可能发生。以前人们普遍认为哺乳动物性别一旦决定不会再改变, 但是最近研究发现成人性别表型可能会改变, 其中dmrt1和foxl2可能起着相互协调的的关系, 维持生殖系统表型(Huang et al, 2017)。在鸡体内, Foxl2主要在卵巢颗粒细胞分化中起主要作用, 它能调节细胞因子和cAMP的表达, 最终决定卵泡的发育(Wang et al, 2017)。青鳉体内, foxl2首先在雌性个体的生殖细胞周围的体细胞中表达, 在卵巢形成初期维持颗粒细胞的功能。在成熟卵巢中, foxl2在卵黄形成前期和中期表达, 但卵黄形成后期不表达, Foxl2在精巢中不表达。说明foxl2在卵巢功能维持中起主要作用(Nakamoto et al, 2006)。达氏鳇(Huso huso)foxl2和cyp19a主要在卵巢中表达, 对卵巢发育可能是必须的(Yarmohammadi et al, 2017)。
无脊椎动物中关于foxl2研究较少, 从酵母到人有100多个fox基因, 分为18个家族(A-P), 海绵中有4种(Sd-FoxL2, Sd-FoxP, Sd-FoxD, Sd-FoxF)在发育中有差异性的表达(Adell et al, 2004).在海葵体内, Sox和fox基因家族包括一些对生殖发育、原肠形成、细胞命运分化和形态发生有重要作用的转录因子。根据他们的DNA结合区氨基酸序列不同分为多个亚群。在海葵基因组中, 能预测到14个sox基因和15个fox基因, 其中一些成员在生殖系统发育和胚层分化中表现出特定的模式, 说明它们发挥重要的功能(Magie et al, 2005)。海胆基因组中有22个fox同源基因, 其中18个和脊椎动物的sox家族的23个基因中部分同源, 有4个是海胆特有的(foxE, H, R, S)。除了foxQ1外所有的fox基因都在胚胎发育过程中表达, 很多还表现了特定的时空性。说明海胆fox家族基因发挥不同的调控功能, 但是基本上全部都参与胚胎的发育(Tu et al, 2006)。牡蛎foxl2也被鉴定出来, 定量PCR表明foxl2在生殖细胞发生时高表达, 特别是在卵黄发育阶段中增长更显著(Naimi et al, 2009)。
Sox基因家族编码的转录因子属于HMG-BOX超家族成员, 但是HMG boxes家族序列只有很少的氨基酸在不同物种中保守存在。有20多种sox基因存在于人和小鼠中, 包括性别决定因子SRY。有8种sox基因存在于果蝇。所有sox基因在HMG box区域有约50%的相似性, 其余部分相似性较低(Bowles et al, 2000)。Sox家族多数成员均参与动物发育。比如神经系统发育中, sox2、sox3和sox11参与小脑颗粒细胞的迁移(Rex et al, 1998)。其中部分成员参与性别决定, 比如雌性体内SOX3可能抑制SOX9的功能, 但是在雄性体内, SRY抑制SOX3的表达, 从而让sox9高表达, 从而促进精巢的发育(Graves, 1998)。目前为止, 还少有报道证明Sox14的动物生殖发育中发挥重要功能。
脊椎动物和无脊椎动物性别决定机制尽管有很大不同, 但是也有一定保守性, 比如有DM结构域的dmrt1基因在脊椎动物和无脊椎动物中在精巢中都显著表达, 对精巢发育有重要功能, 是一个重要的雄性别决定因子(Graves, 1998)。我们通过生殖腺转录组测序获得河蚌foxl2和sox14分别在卵巢和精巢中高表达, 其序列和表达方式即有保守性又有自己的特点。定量PCR结果也说明foxl2和sox14在三角帆蚌生殖腺和胚胎发育中表达一定时空性, 即和其他动物有相似性也有一定的特殊性。系统进化树表明三角帆蚌foxl2和sox14和软体动物同源基因聚为一支, 表达比较高的同源性。但是, 本文获得的三角帆蚌foxl2为部分cDNA序列, 无法推测出完整蛋白序列, 所以不能进行蛋白质系统进化比较和结构分析, 这将在下一步研究中进一步完善。
4 结论本文克隆了三角帆蚌2个生殖相关基因foxl2和sox14, 通过定量PCR和原位杂交的方法确定了这2个基因分别在卵巢和精巢中高表达。在不同的胚胎发育时期, 这2个基因也表现了一定的规律。结果表明foxl2和sox14在卵巢和精巢的发育和功能发挥中起重要作用, 对于胚胎发育, 特别是在组织的分化过程中也发挥功能。
| 何毛贤, 沈琪, 林岳光, 等, 2002. 合浦珠母贝二倍体、三倍体和非整倍体群体的基因杂合度与生长比较. 热带海洋学报, 21(4): 55–62 |
| 林岳光, 姜卫国., 1993. 三倍体和二倍体合浦珠母贝育珠比较初步研究. 热带海洋, 12(3): 90–94 |
| 姜卫国, 许国强, 林岳光, 等, 1991. 合浦珠母贝三倍体和二倍体的生长比较. 热带海洋, 10(3): 1–7 |
| Adell T, Müller W E G., 2004. Isolation and characterization of five Fox (Forkhead) genes from the sponge Suberites domuncula. Gene, 334: 35–46 DOI:10.1016/j.gene.2004.02.036 |
| Bai Z Y, Zheng H F, Lin J Y, et al, 2013. Comparative analysis of the transcriptome in tissues secreting purple and white nacre in the pearl mussel Hyriopsis cumingii. PLoS One, 8(1) |
| Bowles J, Schepers G, Koopman P., 2000. Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators. Dev Biol, 227(2): 239–255 DOI:10.1006/dbio.2000.9883 |
| Elzaiat M, Todeschini A L, Caburet S, et al, 2017. The genetic make-up of ovarian development and function:the focus on the transcription factor FOXL2. Clin Genet, 91(2): 173–182 DOI:10.1111/cge.2017.91.issue-2 |
| Ferguson-Smith M., 2007. The evolution of sex chromosomes and sex determination in vertebrates and the key role of DMRT1. Sex Dev, 1(1): 2–11 DOI:10.1159/000096234 |
| Graves J A M., 1998. Interactions between SRY and SOX genes in mammalian sex determination. BioEssays, 20(3): 264–269 DOI:10.1002/(SICI)1521-1878(199803)20:3<>1.0.CO;2-0 |
| Huang S S, Ye L P, Chen H L., 2017. Sex determination and maintenance:the role of DMRT1 and FOXL2. Asian J Androl, DOI:10.4103/1008-682X.194420(inPress) |
| Lehmann O J, Sowden J C, Carlsson P, et al, 2003. Fox's in development and disease. Trends Genet, 19(6): 339–344 DOI:10.1016/S0168-9525(03)00111-2 |
| Magie C R, Pang K, Martindale M Q., 2005. Genomic inventory and expression of Sox and Fox genes in the cnidarian Nematostella vectensis. Dev Genes Evol, 215(12): 618–630 DOI:10.1007/s00427-005-0022-y |
| Mohanakumaran N C, Salin K R, Raju M S, et al, 2006. Economic analysis of monosex culture of giant freshwater prawn (Macrobrachium rosenbergii De Man):a case study. Aquaculture Research, 37(9): 949–954 DOI:10.1111/are.2006.37.issue-9 |
| Naimi A, Martinez A S, Specq M L, et al, 2009. Molecular cloning and gene expression of Cg-Foxl2 during the development and the adult gametogenetic cycle in the oyster Crassostrea gigas. Comp Biochem Physiol B Biochem Mol Biol, 154(1): 134–142 DOI:10.1016/j.cbpb.2009.05.011 |
| Nakamoto M, Matsuda M, Wang D S, et al, 2006. Molecular cloning and analysis of gonadal expression of Foxl2 in the medaka, Oryzias latipes. Biochem Biophys Res Commun, 344(1): 353–361 DOI:10.1016/j.bbrc.2006.03.137 |
| Pannetier M, Chassot A A, Chaboissier M C, et al, 2016. Involvement of FOXL2 and RSPO1 in ovarian determination, development, and maintenance in mammals. Sex Dev, 10(4): 167–184 DOI:10.1159/000448667 |
| Rex M, Church R, Tointon K, et al, 1998. Granule cell development in the cerebellum is punctuated by changes in Sox gene expression. Mol Brain Res, 55(1): 28–34 DOI:10.1016/S0169-328X(97)00354-9 |
| Singh A K., 2013. Introduction of modern endocrine techniques for the production of monosex population of fishes. Gen Comp Endocrinol, 181: 146–155 DOI:10.1016/j.ygcen.2012.08.027 |
| Tu Q, Brown C T, Davidson E H, et al, 2006. Sea urchin Forkhead gene family:phylogeny and embryonic expression. Dev Biol, 300(1): 49–62 DOI:10.1016/j.ydbio.2006.09.031 |
| Tuteja G, Kaestner K H., 2007a. SnapShot:forkhead transcription factors I. Cell, 130(6): 1160 |
| Tuteja G, Kaestner K H., 2007b. SnapShot:Forkhead transcription factors Ⅱ. Cell, 131(1): 192 DOI:10.1016/j.cell.2007.09.016 |
| Uhlenhaut N H, Jakob S, Anlag K, et al, 2009. Somatic sex reprogramming of adult ovaries to testes by FOXL2 ablation. Cell, 139(6): 1130–1142 DOI:10.1016/j.cell.2009.11.021 |
| Wang J, Zhao C C, Li J Q, et al, 2017. Transcriptome analysis of the potential roles of FOXL2 in chicken pre-hierarchical and pre-ovulatory granulosa cells. Comp Biochem Physiol Part D Genomics Proteomics, 21: 56–66 DOI:10.1016/j.cbd.2016.12.003 |
| Wilhelm D, 2007. R-spondin1-discovery of the long-missing, mammalian female-determining gene?. Bioessays, 29(4): 314–318 DOI:10.1002/(ISSN)1521-1878 |
| Yang Y J, Wang Y, Li Z, et al, 2017. Sequential, divergent, and cooperative requirements of Foxl2a and Foxl2b in ovary development and maintenance of zebrafish. Genetics, 205(4): 1551–1572 DOI:10.1534/genetics.116.199133 |
| Yarmohammadi M, Pourkazemi M, Kazemi R., 2017. Differential expression of foxl2 and cyp19a1a mRNA during gonad developmental stages in great sturgeon Huso huso. J Fish Biol, 90(3): 1104–1111 DOI:10.1111/jfb.2017.90.issue-3 |
| Zaret K S, Carroll J S., 2011. Pioneer transcription factors:establishing competence for gene expression. Genes Dev, 25(21): 2227–2241 DOI:10.1101/gad.176826.111 |
| Zhang R, Wang M, Xia N, et al, 2016. Cloning and analysis of gene expression of interleukin-17 homolog in triangle-shell pearl mussel, Hyriopsis cumingii, during pearl sac formation. Fish Shellfish Immunol, 52: 151–156 DOI:10.1016/j.fsi.2016.03.027 |
| Zhao Y C, Bai Z Y, Fu L L, et al, 2013. Comparison of growth and pearl production in males and females of the freshwater mussel, Hyriopsis cumingii, in China. Aquaculture International, 21(6): 1301–1310 DOI:10.1007/s10499-013-9632-y |
 2018, Vol. 49
2018, Vol. 49

