中国海洋湖沼学会主办。
文章信息
- 宋学文, 娄宇, 依朋, 王宏伟. 2018.
- SONG Xue-Wen, LOU Yu, YI Peng, WANG Hong-Wei. 2018.
- 外来入侵海洋红藻具孔斯帕林藻Sparlingia pertusa的形态观察及分子系统分析
- MORPHOLOGICAL AND MOLECULAR STUDY ON INVASIVE MARINE RED ALGAE, SPARLINGIA PERTUSA
- 海洋与湖沼, 49(1): 78-86
- Oceanologia et Limnologia Sinica, 49(1): 78-86.
- http://dx.doi.org/10.11693/hyhz20170700195
-
文章历史
- 收稿日期:2017-07-24
- 收修改稿日期:2017-09-05
具孔斯帕林藻Sparlingia pertusa (Postels et Ruprecht) G. W. Saunders, I. M. Strachan et G. T. Kraft隶属于红藻门Rhodophyta红皮藻科Rhodymeniaceae斯帕林藻属Sparlingia G. W. Saunders, I. M. Strachan et G. T. Kraft, 目前斯帕林藻属在全世界共报道了2个种, 模式种为具孔斯帕林藻, 另一个种为S. stipitata (Kylin) N. G. Klochkova。最早Postels等(1840)发现该种并将其命名为具孔紫菜Porphyra pertusa Postels et Ruprecht, Agardh (1852)后来将其移入到了红皮藻属Rhodymenia Greville中, 重新命名为具孔红皮藻R. pertusa (Postels et Ruprecht) J. Agardh。直到1999年, Saunders等人(1999)运用形态学观察结合分子系统分析的方法, 发现具孔红皮藻与红皮藻属的模式种R. pseudopalmata (J. V. Lamouroux) P. C. Silva及其他种在外部形态和内部结构以及分子分析中存在很大差异, 认为具孔红皮藻不属于红皮藻属, 故提出了一个新属——斯帕林藻属Sparlingia G. W. Saunders, I. M. Strachan et G. T. Kraft, 该属以Shirley Sparling的姓命名, 并将具孔红皮藻移入斯帕林藻属中, 重新命名为具孔斯帕林藻。该种主要分布于北冰洋地区、北美地区及亚洲北部(日本) (Dawson, 1941)。
海洋外来物种是指出现在过去或者现在的自然分布范围以及扩散潜力之外的海洋物种、亚种或以下的分类单元, 包括该物种可能存活繁殖的部分或繁殖体(陆琴燕等, 2013)。一些海洋外来物种到达新的环境后, 因为摆脱了原有的危害, 且本身繁殖能力较强, 可能或者已经对当地的生态环境造成危害, 发展成为外来入侵种(朱建庚等, 2006)。海洋外来物种入侵现已成为海洋生态系统面临的四大威胁之一(杨圣云等, 2001), 入侵途径一般分为有意和无意两种, 有意如经济性物种的引进, 无意如航运及船舶压舱水(赵淑江等, 2005)。随着海洋运输业的高速发展, 海洋外来物种的传播与入侵日趋严重(刘艳等, 2013)。大连是一座开放的海滨城市, 也是中国北方最大的港口城市, 海洋资源丰富, 自然条件优越, 航运频繁, 为外来物种的传入提供了便利条件。近些年, 许多大型海藻入侵到大连海域, 红藻门如日本星丝藻Erythrotrichia japonica J. Tokida、加粗星丝藻Erythrotrichia incrassata T. Tanaka (栾日孝等, 2005)等, 褐藻门如粗丝多辐藻Myriactula clavata (Takamatsu) J. Feldmann (栾日孝, 2003)、有害藻类天庚点叶藻Punctaria Hesperia A. W. Setchell et N. L. Gardner (栾日孝等, 2000)、舌状酸藻Desmarestia ligulata (Stackhouse) J. V. Lamouroux (栾日孝等, 2003)等, 绿藻门如在大连小平岛海域发现的盒管藻Capsosiphon groenlandicus (J. Agardh) K. L. Vinogradova (丁兰平等, 2008)、入侵到大连瓦房店海域的强壮硬毛藻Chaetomorpha valida (J. D. Hooker et Harvey) F. T. Kützing (迟永雪等, 2009)等, 而这些外来藻类都在北太平洋地区被报道过。其中原产于澳大利亚塔斯马尼亚的强壮硬毛藻在海参养殖池中大量繁殖, 生长盛期可将海参缠绕致死, 严重影响海参养殖业的发展, 带来了巨大危害和经济损失(迟永雪等, 2009)。
2015年5月在辽宁省大连市黑石礁海域首次发现具孔斯帕林藻, 我国尚未有关该种的报道, 斯帕林藻属也未见报道。在本研究中, 对其进行了详细的形态学观察和分子系统分析, 也讨论了该种的入侵渠道, 种源地和未来扩增的趋势等。
1 材料与方法 1.1 材料采集和处理试验所用样本于2015年5月至2016年7月采自于辽宁省大连市黑石礁海域, 材料处理参照李芳(2016)的方法, 将采集后的样本编号, 新鲜样本用于制作冰冻切片, 一部分制作成硅胶干燥标本用于提取DNA, 形态完整的制作成腊叶标本。标本保存在辽宁师范大学生命科学学院植物标本馆(LNU)。
使用解剖镜和光学显微镜(Olympus BH2)观察藻体的形态结构, 用Nikon HFX-ⅡA照相机拍摄照片记录结果。
1.2 DNA提取与PCR扩增使用植物基因组DNA提取试剂盒(TIAGEN, Valencia, CA, Beijing)进行藻体DNA的提取, 将提取到的DNA进行PCR扩增。rbcL和COI基因的PCR反应程序参照李芳(2016)的设计, 检测后的样品均由上海生工生物公司纯化和测序。使用Primer5.0软件进行引物设计, 引物组合见表 1, 均由上海生工生物公司合成。
| 基因类型 | 引物 | 序列 |
| rbcL | F5 | 5′-TGGGACCCTGATTATGTA-3′ |
| R1352 | 5′-CGGTGTCTGTAGAAGTATAGTT-3′ | |
| F1 | 5′-GGATACTGGGACCCTGAT-3′ | |
| R1140 | 5′-GCCAAACTGAAGAACAACA-3′ | |
| COI | F1 | 5′-CTTGTATTTAATTTTTGGTGCATTCT-3′ |
| R661 | 5′-AAATAGATGTTGATAAAGAACAGGATC-3′ |
本研究中6个样本的rbcL基因序列与从GenBank上下载选取的红皮藻科内的斯帕林藻属的具孔斯帕林藻(Schmidt et al, 2016; Schneider et al, 2012; Suzuki et al, 2010)、红皮藻属的5个种(Filloramo et al, 2016; Gavio et al, 2003; Lozada-Troche et al, 2010)、葡萄藻属Botryocladia (J. Agardh) H. Kylin的葡萄藻B. leptopoda (J.Agardh) Kylin(Filloramo et al, 2016)、伴绵藻属Ceratodictyon Zanardini的C. repens (Kützing) R. E. Norris (Gavio et al, 2005)、金膜藻属Chrysymenia J. Agardh的金膜藻C. wrightii (Harvey) Y. Yamada (Filloramo et al, 2016)和腔腺藻属Coelothrix F. Borgesen的不规则腔腺藻C. irregularis (Harvey) F. Borgesen (Lozada-Troche et al, 2010), 以及作为外群种的红皮藻目环节藻科中环节藻属Champia Desvaux的环节藻C. parvula (C. Agardh) W. H. Harvey (Ballantine et al, 2008)和腹枝藻属Gastroclonium Kutzing的G. ovatum (Hudson) G. F. Papenfuss (Filloramo et al, 2016)与红毛菜目红毛菜科紫菜属Pyropia J. Agardh的越南紫菜P. vietnamensis (Tak. Tanaka et Pham-Hoàng Ho) J. E. Sutherland et Monotilla (Sutherland et al, 2011)等15个rbcL基因序列(表 2)进行分析比对。
| 物种 | 采集地点 | 登录号 | |
| rbcL | COI | ||
| Sparlingia pertusa (Postels et Ruprecht) G. W. Saunders, I. M. Strachan et G. T. Kraft | 中国大连(LNU20150512) | KY774847 | KY774853 |
| S. pertusa | 中国大连(LNU20150513) | KY774848 | KY774854 |
| S. pertusa | 中国大连(LNU20150515) | KY774849 | KY774855 |
| S. pertusa | 中国大连(LNU20160717) | KY774850 | KY774856 |
| S. pertusa | 中国大连(LNU20160718) | KY774851 | KY774857 |
| S. pertusa | 中国大连(LNU20160719) | KY774852 | KY774858 |
| S. pertusa | 加拿大卑诗省 | JQ907561 | HM916393 |
| S. pertusa | 日本岩手 | AB383123 | |
| S. pertusa | 美国阿拉斯加州 | KT154697 | |
| Rhodymenia corallina (Bory de Saint-Vincent) Greville | 智利科金博 | AY168657 | |
| R. pseudopalmata (J. V. Lamour) P. C. Silva | 美国德克萨斯州 | AY168656 | HM033146 |
| R. intricata (Okamura) Okamura | 韩国济州 | KU726710 | KU707844 |
| R. divaricata E. Y. Dawson | 波多黎各 | EU670597 | |
| R. stenoglossa J. Agardh | 澳大利亚维多利亚州 | KU726706 | HM033152 |
| R. leptophylla J. Agardh | 澳大利亚新南威尔士 | HM033148 | |
| R. prolificans Zanardini | 澳大利亚塔斯马尼亚 | HM033144 | |
| Botryocladia leptopoda (J. Agardh) Kylin | 菲律宾 | KU726723 | |
| B. pseudodichotoma (Farlow) Kylin | 美国加利福尼亚州 | KM254747 | |
| Ceratodictyon repens (Kutzing) Norris | 南非 | HQ400571 | |
| Chrysymenia wrightii (Harvey) Yamada | 日本 | KU726707 | KU707857 |
| Coelothrix irregularis (Harv) Borgesen | 波多黎各 | EU670598 | |
| C. irregularis | 美国 | HQ422624 | |
| Champia parvula (C. Agardh) Harvey | 波多黎各 | EU086464 | |
| C. parvula | 美国 | HQ422819 | |
| Gastroclonium ovatum (Hudson) Papenfuss | 爱尔兰 | KU726714 | KU707861 |
| Pyropia vietnamensis (Tak. Tanaka et Pham-Hoàng Ho) J. E. Sutherland et Monotilla | 印度喀拉拉邦 | HQ687544 | |
| P. vietnamensis | 巴西 | JN222751 | |
| 注:表中加粗字体为本文研究种 | |||
本研究中6个样本的COI基因序列与从GenBank中选取的红皮藻科内的斯帕林藻属的具孔斯帕林藻(Schneider et al, 2012)、红皮藻属的5个种(Filloramo et al, 2016; Saunders et al, 2010)、葡萄藻属Botryocladia的B. Pseudodichotoma (Farlow) H. Kylin (Saunders, 2014)、金膜藻属的金膜藻(Filloramo et al, 2016)和腔腺藻属的不规则腔腺藻(Sherwood et al, 2010), 以及作为外群种的红皮藻目环节藻科中环节藻属的环节藻(Sherwood et al, 2010)和腹枝藻属Gastroclonium的G. ovatum (Filloramo et al, 2016)与红毛菜目红毛菜科紫菜属的越南紫菜(Milstein et al, 2012)等12个COI基因序列(表 2)进行分析比对。
应用软件Clustalx (1.83)进行基因序列比对。使用最大似然法Maximum likelihood (ML)、临近法Neighbor joining (NJ)和最大简约法Maximum parsimony (MP)构建系统发育树, 使用MEGA6.0软件用于进行碱基差异度的分析以及系统树的构建, 计算遗传距离模型为Number of differences和Kimura 2-Parameter, Bootstrap重复1000次。使用DnaSP软件计算核苷酸多样性和单倍型多样性。
2 结果 2.1 斯帕林藻属(新拟)Sparlingia G. W. Saunders, I. W. Strachan et G. T. Kraft, 1999
成熟藻体直立, 叶片呈椭圆形, 具有不同大小的孔洞; 二叉式分枝1—2次; 圆盘形固着器; 皮层由2—3层小球形细胞组成, 髓部由3—5层椭球形薄壁细胞组成; 雌雄配子体和四分孢子体同型; 果胞枝主枝由4个细胞组成, 辅助细胞枝主枝由2个细胞组成; 囊果直径约为1mm; 成熟的四分孢子囊呈十字形分裂。
模式种: Sparlingia pertusa (Postels et Ruprecht) G. W. Saunders, I. M. Strachan et G. T. Kraft, 1999
2.2 具孔斯帕林藻(新拟, 图 1)
 |
| 图 1 具孔斯帕林藻的外部形态 Fig. 1 The morphological appearance of S. pertusa 注: A—D:雌配子体; E—G:四分孢子体 |
Porphyra pertusa Postels et Ruprecht, 1840
Rhodymenia pertusa (Postels et Ruprecht) J. Agardh, 1851
Sparlingia pertusa (Postels et Ruprecht) G. W. Saunders, I. M. Strachan et G. T. Kraft, 1999
模式标本产地:俄罗斯堪察加半岛。
外部形态:成熟藻体直立; 呈红色或暗红褐色; 二叉式分枝1—2次; 高0.2—0.8m;藻体分枝近椭圆形; 其中, 雌配子体宽30—50cm; 四分孢子体宽20—30cm; 圆盘形的固着器上长出圆柱状的柄; 藻体具有不同大小的孔洞(图 1A—G); 孔洞边缘呈波浪状(图 2A); 雌配子体和四分孢子体同型(图 1)。
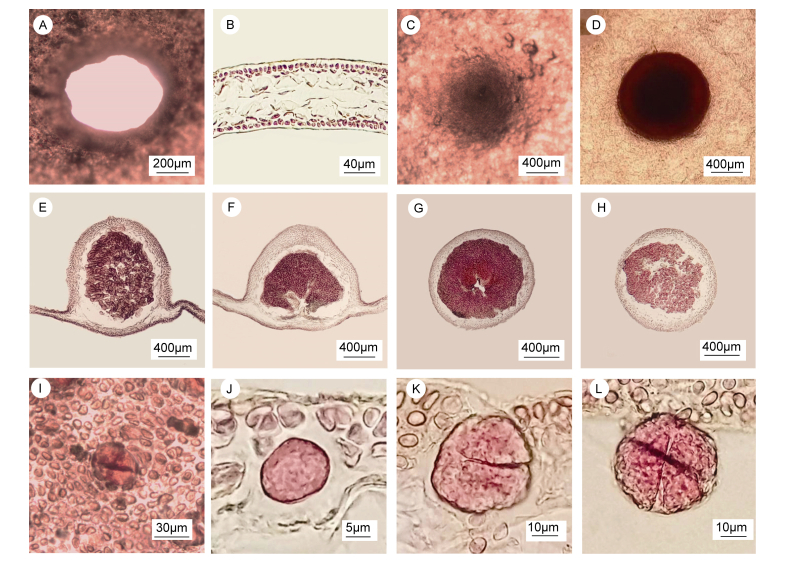 |
| 图 2 具孔斯帕林藻的营养结构和生殖结构 Fig. 2 The vegetative structure and reproductive structures of S. pertusa 注: A:藻体表面的孔洞结构; B:藻体横切面; C—D:雌配子体表面观示囊果; E—F:囊果纵切面观; G—H:囊果横切面观; I:四分孢子体表面观示四分孢子囊; J:四分孢子囊母细胞; K:二分体; L:成熟的四分孢子囊呈十字形分裂 |
营养结构:藻体由皮层和髓部组成, 厚度为90—140μm。皮层由2—3层圆球形细胞组成, 厚度为10—20μm, 细胞中含有色素; 髓部由3—5层椭球形薄壁细胞组成, 厚度为80—120μm, 中央细胞较大, 外围细胞较小(图 2B)。雌配子体和四分孢子体营养结构相同。
生殖结构:成熟囊果近圆球形, 直径1mm左右, 散落于除基部外的藻体表面, 未成熟时, 囊果微突出藻体表面且呈现肉眼可见的斑点状, 成熟后, 呈凸起状(图 2C, D); 果孢子聚集成团在囊果的中央部位(图 2E—H)。四分孢子囊由四分孢子体的皮层细胞形成, 散落分布在除基部外的藻体表面(图 2I), 微凸起状, 四分孢子囊孢子母细胞进行减数分裂, 形成二分体, 最后形成四分孢子囊, 成熟的四分孢子囊呈十字形分裂, 长30—40μm, 宽20—35μm (图 2J—L)。
习性:生长在低潮带及潮下带的岩石上(图 3)。
 |
| 图 3 具孔斯帕林藻的野外形态(箭头所指) Fig. 3 The forms of S. pertusa (arrows) in the field 注: A:雌配子体; B:四分孢子体 |
产地:辽宁大连黑石礁; 38°55′N, 121°37′E。
国外分布:俄罗斯(堪察加半岛), 日本(北海道), 加拿大, 丹麦(格陵兰), 挪威(斯匹次卑尔根岛), 北美海岸(南普吉特海湾), 美国(华盛顿)。
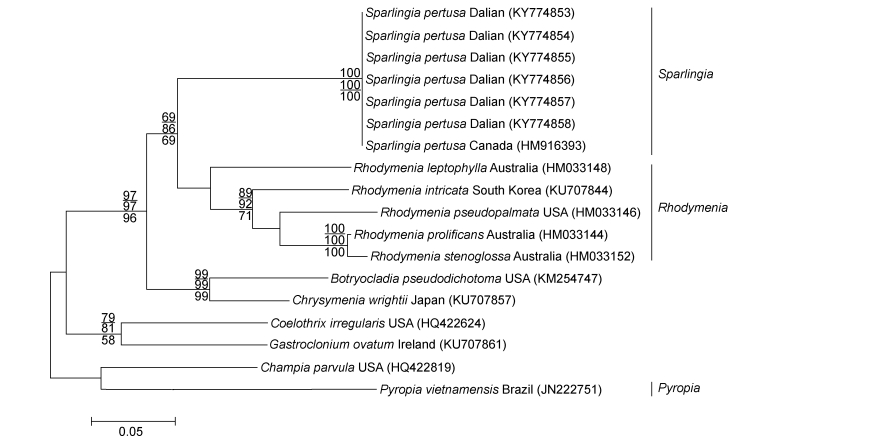
2.3 具孔斯帕林藻的分子系统分析 2.3.1 rbcL基因序列分析以红皮藻目环节藻科中环节藻属的环节藻和腹枝藻属Gastroclonium的G. ovatum与红毛菜目红毛菜科紫菜属的越南紫菜作为外群种, 结合红皮藻科主要类群序列, 基于ML法、NJ法和MP法构建了rbcL序列和COI序列的系统发育树, 三种方法所构建的发育树拓扑结构比较相似, 故均以ML法所构建系统发育树的拓扑结构显示。本研究共获得了6条rbcL基因序列, 将实验测得的具孔斯帕林藻的rbcL序列提交到GenBank中, 所获得登录号为: KY774847、KY774848、KY774849、KY774850、KY774851、KY774852, 对比矫正后的序列共21条, 序列矩阵长度为1223bp, 可变位点448个, 简约信息位点305个, 单态位点143个。结果显示, 本研究的6个样本与国外产的具孔斯帕林藻在发育树中聚在一支(图 4), 6个样本之间的rbcL基因序列无碱基差异, 它们与日本产的无碱基差异, 与美国和加拿大产的碱基序列差异为1bp (0.98%), 与同科内红皮藻属的5个种的碱基差异为137bp (10.50%)—162bp (11.07%), 与同科内葡萄藻属的葡萄藻、伴绵藻属Ceratodictyon的C. repens、金膜藻属的金膜藻和腔腺藻属的不规则腔腺藻的碱基差异分别为140bp (10.29%)、189bp (11.70%)、150bp (10.49%)、192bp (12.34%)。与外群种环节藻属的环节藻、腹枝藻属Gastroclonium的G. ovatum和紫菜属的越南紫菜的碱基差异为213bp (11.75%)、184bp (12.30%)、269bp (13.91%)。
 |
| 图 4 基于rbcL序列所构建的ML系统发育树 Fig. 4 The Maximum Likelihood (ML) tree built based on rbcL sequences 注:节点的数值表示自展支持值, 从上至下分别表示ML、NJ、MP, 自展值只显示大于50 |
本研究共获得6条COI基因序列, 将实验测得的具孔斯帕林藻的COI序列提交到GenBank中, 所获得登录号为: KY774853、KY774854、KY774855、KY774856、KY774857、KY774858, 对比矫正后的序列共18条, 序列矩阵长度为601bp, 可变位点245个, 简约信息位点195个, 单态位点50个, 所构建系统发育树的拓扑结构与rbcL序列所构建的系统发育树大致相同。序列比对结果显示, 本研究的6个样本与产自加拿大的具孔斯帕林藻在系统树中聚在一个分支中, 无碱基差异(图 5), 与同科内红皮藻属的5个种的碱基序列差异为90bp (8.78%)—97bp (9.14%), 与同科内葡萄藻属Botryocladia的B. pseudodichotoma、金膜藻属的金膜藻和腔腺藻属的不规则腔腺藻的碱基差异分别为103bp (9.28%)、104bp (9.67%)、116bp (10.16%)。与外群种环节藻属的环节藻、腹枝藻属Gastroclonium的G. ovatum和紫菜属的越南紫菜的碱基差异为130bp (10.48%)、122bp (10.15%)、147bp (11.11%)。
 |
| 图 5 基于COI序列所构建的ML系统发育树 Fig. 5 Maximum likelihood (ML) tree built based on COI sequences 注:节点的数值表示自展支持值, 从上至下分别表示ML、NJ、MP, 自展值只显示大于50 |
采自大连的标本与日本和加拿大的具孔斯帕林藻的形态描述基本一致(Dawson, 1941; Saunders et al, 1999)。根据rbcL序列所构建的系统发育树(图 4)以较高的自展支持值反映出了所采集海藻的系统发育位置, 其中本研究中的6个样本与斯帕林藻属种类聚在一起, 形成一个独立的分支, 自展值为100, 区别于其他种, 验证了本研究的6个样本为具孔斯帕林藻, 与斯帕林藻属分支距离较近的是菲律宾的葡萄藻和日本的金膜藻; 在COI序列构建的系统发育树中(图 5), 本研究的6个样本与加拿大的具孔斯帕林藻聚集在一起, 形成一个独立的小分支, 自展值为100, 区别于其他种, 与分支距离较近的是澳大利亚的Rhodymenia leptophylla和韩国的错综红皮藻Rhodymenia intricata (Okamura) K. Okamura。
如今, 随着全球经济一体化、国际贸易的发展, 各国之间航运日渐频繁(Poulter et al, 2008), 使外来海洋物种的数量越来越多。大连市位于辽东半岛最南端, 海上贸易逐年递增, 海洋养殖品种的引进可能将国外的具孔斯帕林藻的孢子携带到大连海域。而大连市是养殖太平洋牡蛎和虾夷扇贝的主要地区, 大连沿海在20世纪80年代末开始对太平洋牡蛎进行浮筏养殖(隋锡林等, 2002); 虾夷扇贝在1982年由辽宁省海洋水产科学研究院从日本北部沿海引进后进行养殖试验并推广(李华琳等, 2007)。但是目前有效的防污处理措施并不完善, 牡蛎壳、扇贝壳上通常携带大量的海藻孢子, 养殖产品的进出口作为海藻入侵最主要的原因之一已经得到广泛认可。经鉴定, 一些海膜目的物种通过这种方式已经从东北亚地区入侵到欧洲(Mineur et al, 2010)。我们在大连海域发现该种, 极有可能是该种的孢子附着在从日本进口的牡蛎壳和扇贝壳上入侵过来的。
另外, 船舶压舱水也是海洋物种入侵的主要途径之一。据估计, 在美国五大水域分离出100多种外来物种的主要原因就是船舶压舱水(邵柏, 2001), 澳大利亚的科学家们在澳大利亚沿岸鉴定出200多种外来海洋物种, 发现大多数外来物种进入的原因是船舶携带的压舱水(朱建庚等, 2006)。目前, 我国对船舶压舱水的管理较薄弱, 随着贸易的繁荣和航运的增加, 大量的海洋物种被携带到我国海域, 包括具孔斯帕林藻的孢子。因此, 船舱压舱水可作为具孔斯帕林藻入侵的原因之一。
此外, 大气中二氧化碳的浓度升高致使全球变暖(Chust et al, 2010), 海平面的上升也加剧了海水入侵, 可直接改变海滨生态系统的潮汐、水位等(Nicholls et al, 2010), 孢子随海水从堪察加半岛或日本流动到大连海域, 我们认为这也是具孔斯帕林藻出现的原因之一。地理位置上, 该种的分布范围在北温带, 约北纬38°53′至60°51′, 其中大连与俄罗斯的堪察加半岛和日本北海道的气候类型为温带季风气候, 海洋环境也较适合具孔斯帕林藻的生长繁殖。
海洋外来物种对当地的影响大致可分为3种: (1)被看成是“积极”因素, 丰富了当地生物量; (2)对当地生态系统没有任何影响; (3)对当地环境有明显影响, 如与当地种竞争, 破坏海洋生态平衡(刘艳等, 2013)。具孔斯帕林藻生长在低潮带及潮下带的岩石上, 与Klochkova等人(2009)记录的具孔斯帕林藻在海平面以下5—20米深度生长的环境相一致, 同时从2015年发现该藻后, 每年都能在大连的黑石礁发现, 采集到的数量逐年增多, 可见该藻已经在黑石礁附近海域有一定的规模, 并有扩增之势。该种的出现是否会对当地渔业发展、生态环境与社会经济建设造成较大影响还需进一步跟踪探究。
4 结论基于形态学观察和rbcL基因序列与COI基因序列分析, 发现具孔斯帕林藻Sparlingia pertusa (Postels et Ruprecht) G. W. Saunders, I. M. Strachan et G. T. Kraft为中国新纪录种, 同时发现斯帕林藻属Sparlingia G. W. Saunders, I. W. Strachan et G. T. Kraft为中国新纪录属。认为海洋经济物种的引进、各国来往船舶携带的压舱水以及海水的流动等是该种入侵的主要原因。
| 丁兰平, 栾日孝, 黄冰心, 等, 2008. 黄海西部、渤海海域盒管藻科Capsosiphonaceae(石莼目Ulvales)的分类研究. 海洋学报, 30(2): 169–174 |
| 刘艳, 吴惠仙, 薛俊增, 2013. 海洋外来物种入侵生态学研究. 生物安全学报, 22(1): 8–16 |
| 朱建庚, 张露藜, 2006. 海洋外来物种入侵与我国压载水管理. 生态经济:学术版,(10): 307–310 |
| 李芳, 2016. 四种红藻的形态学观察和分子系统学研究. 大连: 辽宁师范大学硕士学位论文, 50-51 http://cdmd.cnki.com.cn/Article/CDMD-10165-1016237620.htm |
| 李华琳, 李文姬, 薛真福, 等, 2007. 大连西部海域虾夷扇贝采苗试验. 齐鲁渔业,(12): 6–8 |
| 杨圣云, 吴荔生, 陈明茹, 等, 2001. 海洋动植物引种与海洋生态保护. 应用海洋学学报, 20(2): 259–265 |
| 迟永雪, 王丽梅, 栾日孝, 等, 2009. 中国硬毛藻属新记录种-强壮硬毛藻. 水产科学, 28(3): 162–163 |
| 陆琴燕, 刘永, 李纯厚, 等, 2013. 海洋外来物种入侵对南海生态系统的影响及防控对策. 生态学杂志, 32(8): 2186–2193 |
| 赵淑江, 朱爱意, 张晓举, 2005. 我国的海洋外来物种及其管理. 海洋开发与管理, 22(3): 58–66 |
| 栾日孝, 2003. 中国多辐藻属(Myriactula)三个新记录种. 植物研究, 23(2): 137–140 |
| 栾日孝, 栾淑君, 2005. 中国红质藻科(Erythropeltidaceae)5个新记录种. 湛江海洋大学学报, 25(6): 1–4 |
| 栾日孝, 楚志广, 安利佳, 等, 2000. 中国点叶藻科(褐藻门)三个新记录种. 植物分类学报, 38(4): 392–397 |
| 栾日孝, 楚志广, 苏乔, 等, 2003. 中国酸藻属(酸藻科)一新记录. 植物研究, 23(4): 396–398 |
| 邵柏, 2001. 加强入境船舶压舱水管理的新观念. 中国国境卫生检疫杂志, 24(1): 39–42 |
| 隋锡林, 孙景伟, 王富贵, 等, 2002. 大连沿海太平洋牡蛎大量死亡原因解析. 大连水产学院学报, 17(4): 272–278 |
| Agardh J G, 1852. Species, Genera et Ordines Algarum, Seu Descriptiones Succinctae Specierum, Generum et Ordinum, Quibus Algarum Regnum Constituitur. Lund: C. W. K. Gleerup, 337-720 http://ci.nii.ac.jp/ncid/BB10098771 |
| Ballantine D L, Lozada-Troche C, 2008. Champia harveyana sp. nov. (Champiaceae, Rhodophyta) from Puerto Rico, Caribbean Sea. Caribbean Sea, 51(5): 388–398 |
| Chust G, Caballero A, Marcos M, et al, 2010. Regional scenarios of sea level rise and impacts on Basque (Bay of Biscay) coastal habitats, throughout the 21st century. Estuarine, Coastal and Shelf Science, 87(1): 113–124 DOI:10.1016/j.ecss.2009.12.021 |
| Dawson E Y, 1941. A review of the genus Rhodymenia with descriptions of new species. Allan Hancock Pacific Expeditions, 3(8): 123 |
| Filloramo G V, Saunders G W, 2016. Application of multigene phylogenetics and site-stripping to resolve intraordinal relationships in the Rhodymeniales (Rhodophyta). Journal of Phycology, 52(3): 339–355 DOI:10.1111/jpy.2016.52.issue-3 |
| Gavio B, Fredericq S, 2003. Botryocladia caraibica (Rhodymeniales, Rhodophyta), a new species from the Caribbean. Cryptogamie Algologie, 24(2): 93–106 |
| Gavio B, Fredericq S, 2005. New Species and new records of offshore members of the Rhodymeniales (Rhodophyta) in the Northern gulf of Mexico. Gulf of Mexico Science, 23(1): 58–83 |
| Klochkova N G, Korolyova T N, Kusidi A E, 2009. Atlas of marine algae of Kamchatka and surrounding areas. Petropavlovsk-Kamchatsky:KamchatNIRO Press, 2: 186–187 |
| Lozada-Troche C A, Ballantine D L, 2010. Observations on morphology and the taxonomic affiliation of Coelothrix irregularis (Harv.) Borgesen (Rhodymeniales, Rhodophyta).. Caribbean Journal of Science, 46(1): 71–82 DOI:10.18475/cjos.v46i1.a9 |
| Milstein S, Oliveira E C, Oliveria M C, et al, 2012. Will a DNA barcoding approach be uesful to identify Porphyra species (Bangiales, Rhodophyta)?. Journal of Applied Phycology, 24(4): 837–845 DOI:10.1007/s10811-011-9702-3 |
| Mineur F, Clerck O D, Le Roux A, et al, 2010. Polyopes lancifolius (Halymeniales, Rhodophyta), a new component of the Japanese marine flora introduced to Europe. Phycologia, 49(1): 86–96 DOI:10.2216/09-45.1 |
| Nicholls R J, Cazenave A, 2010. Sea-level rise and its impact on coastal zones. Science, 328(5985): 1517–1520 DOI:10.1126/science.1185782 |
| Postels A, Ruprecht F J, 1840. Illustrationes algarum in itinere circum orbem jussu imperatoris Nicolai I. Typis Eduardi Pratz, Petropoli[St. Petersburg], pp. [i-vi]+[i]+ iv + 28. [1-2, index], [Latin: ] [-iv], -22, [1-2, index], 40 pls. |
| Poulter B, Halpin P N, 2008. Raster modelling of coastal flooding from sea-level rise. Journal of Geographical Information Science, 22(2): 167–182 DOI:10.1080/13658810701371858 |
| Saunders G W, Strachan I M, Kraft G T, 1999. The families of the order Rhodymeniales (Rhodophyta):a molecular-systematic investigation with a description of Faucheaceae fam.nov.. Phycologia, 38(1): 23–40 DOI:10.2216/i0031-8884-38-1-23.1 |
| Saunders G W, McDonald B, 2010. DNA barcoding reveals multiple overlooked Australian species of the red algal order Rhodymeniales (Florideophyceae), with resurrection of Halopeltis J. Agardh and description of Pseudohalopeltis gen. nov. Botany, 88(7): 639–667 |
| Saunders G W, 2014. Long distance kelp rafting impacts seaweed biogeography in the Northeast Pacific:the kelp conveyor hypothesis. Journal of Phycology, 50(6): 968–974 DOI:10.1111/jpy.12237 |
| Schmidt W E, Gurgel C F D, Fredericq S, 2016. Taxonomic Transfer of the Red Algal Genus Gloiosaccion to Chrysymenia (Rhodymeniaceae, Rhodymeniales), Including the Description of a New Species, Chrysymenia pseudoventricosa, for the Gulf of Mexico. Phytotaxa, 243(1): 54–70 DOI:10.11646/phytotaxa.243.1 |
| Schneider C W, Freshwater D W, Saunders G W, 2012. First report of Halopeltis (Rhodophyta, Rhodymeniaceae) from the non-tropical Northern Hemisphere:H.adnata (Okamura) comb. nov. from Korea, and H. pellucida sp. nov. and H. willisii sp. nov. from the North Atlantic.. Algae, 27(2): 95–108 DOI:10.4490/algae.2012.27.2.095 |
| Sherwood A R, Kurihara A, Conklin K Y, et al, 2010. The Hawaiian Rhodophyta Biodiversity Survey (2006-2010):a summary of principal findings. BMC Plant Biology, 10: 258 DOI:10.1186/1471-2229-10-258 |
| Sutherland J E, Lindstrom S C, Nelson W A, et al, 2011. A new look at an ancient order:generic revision of the bangiales (Rhodophyta). Journal of Phycology, 47(5): 1131–1151 DOI:10.1111/j.1529-8817.2011.01052.x |
| Suzuki M, Hashimoto T, Nakayama T, et al, 2010. Morphology and molecular relationships of Leptofauchea rhodymenioides (Rhodymeniales, Rhodophyta), a new record for Japan. Phycological Research, 58(2): 116–131 DOI:10.1111/(ISSN)1440-1835 |
 2018, Vol. 49
2018, Vol. 49


