中国海洋湖沼学会主办。
文章信息
- 马爱军, 王新安, 黄智慧, 孙志宾, 刘志峰, 崔文晓, 曲江波. 2017.
- MA Ai-Jun, WANG Xin-An, HUANG Zhi-Hui, SUN Zhi-Bin, LIU Zhi-Feng, CUI Wen-Xiao, QU Jiang-Bo. 2017.
- 大菱鲆(Scophthalmus maximus)快速生长品系和高成活率选育品系的配合力分析
- COMBINING ABILITY OF SELECTED FAST-GROWING AND HIGH SURVIVAL STRAIN OF TURBOT SCOPHTHALMUS MAXIMUS
- 海洋与湖沼, 48(5): 1100-1107
- Oceanologia et Limnologia Sinica, 48(5): 1100-1107.
- http://dx.doi.org/10.11693/hyhz20170600177
-
文章历史
- 收稿日期:2017-06-30
- 收修改稿日期:2017-07-16
2. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266071;
3. 烟台开发区天源水产有限公司 烟台 264003
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. Yantai Tianyuan Aquatic Limited Corporation, Yantai 264003, China
大菱鲆(Scophthalmus maximus)为原产于欧洲的著名海水养殖特有良种, 具有生长迅速、肉味鲜美、经济价值高等优点(Howell, 1998)。中国水产科学研究院黄海水产研究所于1992年“跨洋引种”将其引入中国, 经过一系列相关产业技术的开发研究, 使其成为我国北方沿海工厂化养殖业的主导品种(雷霁霖等, 1995; Ma et al, 2006; Ruan et al, 2010, 2011; Wang et al, 2010, 2015, 2016)。近年来, 由于大菱鲆属于外来鱼种, 长期依赖于欧洲国家提供种源, 亲鱼来源较为单一(雷霁霖等, 2005), 并且育种过程中采用的亲鱼未经过专门选优处理, 加之累代养殖和近亲交配, 以致造成种质退化现象, 生长速度减慢、成活率低、抗逆性变差等现象不断发生(Ruan et al, 2010, 2011; Wang et al, 2010, 2015, 2016; Liang et al, 2012); 调研表明, 在2000—2001年, 大菱鲆苗种经10个月的养成约30%可达到上市规格, 现在养殖10个月达到上市规格不到10%, 整批苗种达到上市规格要在18个月以上, 甚至2年。因此, 进行大菱鲆遗传改良, 培育出具有抗逆、优质、高产等优良性状的新品种, 是维持大菱鲆产业在中国可持续发展的重要保障。
针对我国大菱鲆产业发展过程中出现的种质退化现象, 项目组于2004年4月在山东烟台天源水产有限公司采用群体选育的方法, 以快速生长和高成活率为选育目标, 对来源于英国、法国、丹麦和挪威4个不同群体的大菱鲆进行遗传改良; 经过一代选育, 到2007年又采用基于电子标记辅助的大规模家系选育技术开始对大菱鲆进行了传代选育; 到2012年, 经过连续2代家系选育, 根据对选育二代家系和对照系不同生长发育阶段生长性能/成活率育种值和表型值均值的综合评定, 选育出大菱鲆快速生长新品系(fast-growing strain, 简称FG)和高成活率新品系(high survival strain, 简称HS)。
2013年1月, 从选育出的快速生长新品系和高成活率新品系中选择亲本, 采用不完全双列杂交技术开展系间杂交实验。采用群体性状表型鉴定结合配合力分析的方法, 分析不同家系的大菱鲆群体亲本、杂交组合的配合力和杂交组合的优势。综合分析不同阶段的研究结论, 筛选具有显著杂交优势的杂交组合, 为选育优质、高产的大菱鲆新品种提供基础材料。
1 材料与方法2013年1月, 从选育出的快速生长新品系和高成活率新品系中选择亲本, 采用不完全双列杂交技术开展系间杂交实验。具体过程如下:
1.1 系间杂交实验利用大规模家系选育技术培育出的5个快速生长优良家系和5个高成活率品优良家系为材料, 按照不完全双列杂交实验设计进行人工授精, 开展系间杂交实验。从每个备选家系中选取性腺发育良好的雌性个体和雄性个体, 采集卵子和精子。3尾雌鱼对3尾雄鱼, 将卵子和精子混合后缓慢搅拌均匀, 5min后在继续搅拌的同时加入海水。授精卵经漂浮分离后置于孵化箱中孵化, 初孵仔鱼转移至育苗池进行苗种培育, 苗种培育分阶段按照环境标准化和数量标准化操作程序进行培育, 以降低养殖环境对早期家系培育的影响。按照不完全双列杂交设计共计得到50个系间杂交组合。
1.2 数据采集与分析从初孵仔鱼到三级数量标准化时, 家系经历60d, 再经过三级数量标准化后1个月的中间培育, 家系培育日龄达90d左右, 即3月龄时, 幼鱼体长可达5—6cm, 此时可对幼鱼进行荧光(VIE)标记(实验表明, 此生长期不适合进行PIT标记), 以区分不同的家系, 进行家系混养。同时统计每个杂交组合家系鱼的数量, 并测量每尾鱼的重量。苗种发育到9月龄时, 可对VIE标记的个体进行PIT标记(实验表明, 此时PIT标记对鱼的伤害几乎可以忽略不计)。由于发育到这一阶段大菱鲆的死亡率较低, 通常每个家系选择50—60鱼尾进行PIT标记, 并统计每个杂交组合家系鱼的数量, 并测量每尾鱼的重量。在12和15月龄时, 同样进行体重测量和成活数量统计; 养殖死亡个体随时捞除并记录, 依据前一统计期放苗尾数及下一统计期尾数计算不同生长发育期的成活率。依据采集的各阶段体重和成活率, 估算10个雌性亲本和10个雄性亲本的一般配合力(GCA)效应值, 以及50个系间杂交组合的特殊配合力(SCA)效应值和25个组合的杂种优势率。
杂种优势率的计算公式为
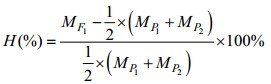
式中, MF1为群体P1和P2正反交杂交子一代群体均数, MP1和MP2为群体P1和P2自交子一代群体均数。
1.3 与普通商品苗的对比测试为评估不同发育阶段的选育进展, 将烟台天源水产有限公司同期生产的非选育普通商品苗种与选育苗种进行生长及成活率比较。成活率统计3—6、6—9、9—12和12—15月龄的存活个体, 并计算成活率。
2 结果与分析 2.1 配合力分析结果配合力包括一般配合力和特殊配合力; 一般配合力是对基因加性效应的度量, 在数值上, 一般配合力代表该亲本杂交后代平均表现的优劣, 一般配合力值高的亲本才能产生均值高的后代。表 1为10个群体体重性状、成活率性状在不同生长发育阶段的父本一般配合力效应值, 表 2为10个群体体重性状、成活率性状在不同生长发育阶段的母本一般配合力效应值。特殊配合力是对基因显性、超显性和上位等效应的度量。表 3为50个杂交组合在不同生长发育阶段的特殊配合力效应值。在筛选品种组合时, 通常应在选择一般配合力高的亲本的基础上, 再选择特殊配合力高的组合。
| 品系 | 体重 | 成活率 | |||||||
| 6月龄 | 9月龄 | 12月龄 | 15月龄 | 6月龄 | 9月龄 | 12月龄 | 15月龄 | ||
| FG1 | 16.0449 | 21.6675 | 17.9957 | 22.0228 | 6.9503 | 21.5940 | 8.8183 | 1.9140 | |
| FG2 | -4.0847 | 1.1817 | 7.6704 | 7.3343 | -18.1969 | -4.2599 | 0.2568 | -1.7165 | |
| FG3 | -5.8678 | -8.9363 | -4.2730 | -6.5946 | -20.2183 | -5.6082 | -1.7997 | -0.9914 | |
| FG4 | 7.1572 | -4.9876 | -9.0841 | -12.1600 | 17.2443 | -17.3137 | -6.9359 | -0.4545 | |
| FG5 | -12.7034 | -8.6602 | -12.8014 | -10.5279 | 14.0457 | 5.5004 | -0.0770 | 1.1750 | |
| HS1 | -5.9536 | -5.3980 | -13.4730 | -0.4433 | -8.6247 | 11.4597 | -3.4578 | 0.6703 | |
| HS2 | 14.6004 | 22.7825 | 16.4043 | 1.7216 | -5.1623 | -8.8361 | 5.8229 | 1.1969 | |
| HS3 | -6.1990 | -18.9430 | -7.1253 | -4.4866 | 3.8526 | -5.5510 | 1.8245 | 0.8916 | |
| HS4 | 2.6365 | 5.0127 | 1.3489 | 1.1673 | 0.7304 | 6.6196 | -0.6960 | 1.6067 | |
| HS5 | -4.7401 | -2.3403 | 2.3071 | 1.8374 | 8.7171 | -3.7538 | -3.2882 | -4.3383 | |
| 品系 | 体重 | 成活率 | |||||||
| 6月龄 | 9月龄 | 12月龄 | 15月龄 | 6月龄 | 9月龄 | 12月龄 | 15月龄 | ||
| FG1 | 5.8660 | 4.5085 | -1.6365 | 11.5966 | -4.3874 | 0.0782 | -3.9691 | 3.1855 | |
| FG2 | -3.4131 | -0.6117 | -12.9409 | -2.3941 | -5.9352 | -14.7848 | -0.5161 | -1.9138 | |
| FG3 | 1.7731 | 3.6371 | -14.1048 | 8.3071 | 15.7465 | 5.6778 | -3.6469 | 0.3126 | |
| FG4 | 5.5044 | 10.6858 | 27.3713 | -3.4952 | -24.5954 | 7.9692 | 7.2845 | 0.9648 | |
| FG5 | -9.9279 | -18.0144 | 0.9333 | -13.2363 | 20.0553 | 1.2926 | 0.6426 | -2.7738 | |
| HS1 | 24.9062 | 37.4062 | 51.1506 | 33.4897 | 35.4734 | 8.6309 | 2.5992 | 5.0860 | |
| HS2 | 0.6533 | 9.5423 | 7.0650 | 3.3388 | 6.5687 | -12.6445 | 2.4297 | -5.5314 | |
| HS3 | 7.0366 | -8.1435 | -7.0037 | -7.8056 | -30.0421 | 4.6267 | -2.5916 | 2.2273 | |
| HS4 | -3.2729 | -14.6195 | -19.1913 | -13.8971 | 16.0855 | -5.7199 | -1.1156 | -0.3944 | |
| HS5 | -29.1730 | -22.6055 | -31.8023 | -16.3974 | -26.2561 | 5.3901 | -1.0368 | -1.7144 | |
| 杂交组合 | 体重 | 成活率 | |||||||
| 6月龄 | 9月龄 | 12月龄 | 15月龄 | 6月龄 | 9月龄 | 12月龄 | 15月龄 | ||
| FG1♀×HS1♂ | 30.5570 | 21.7341 | 48.1552 | 47.3956 | 62.4346 | 28.6030 | 17.2189 | 7.2779 | |
| FG1♀×HS2♂ | -19.8093 | -13.0884 | -11.8886 | -11.3227 | -59.3209 | 0.1694 | -1.4977 | -1.2075 | |
| FG1♀×HS3♂ | 7.6994 | 10.0307 | 15.7096 | 13.5314 | -44.6689 | -14.6773 | -0.6794 | -3.8707 | |
| FG1♀×HS4♂ | 21.6500 | 15.0013 | 9.5484 | 7.2095 | -3.3872 | -17.2171 | -1.3944 | -0.8505 | |
| FG1♀×HS5♂ | 4.2963 | -13.0063 | 0.2710 | -4.1398 | 40.6347 | 1.3679 | -6.4500 | 0.1492 | |
| FG2♀×HS1♂ | -13.7770 | 40.0430 | -12.8318 | -5.2346 | -23.2107 | 22.7898 | -5.6197 | 5.1568 | |
| FG2♀×HS2♂ | -3.7807 | 21.1199 | 19.0965 | 16.2075 | 28.0890 | -6.9937 | -10.2338 | -1.4041 | |
| FG2♀×HS3♂ | -36.2544 | -44.5607 | -42.7741 | -40.1602 | 58.4532 | -4.6592 | 5.4336 | 3.6141 | |
| FG2♀×HS4♂ | 5.0718 | -12.3898 | -17.7620 | -12.6334 | -54.8233 | 5.5577 | -4.0496 | -2.7372 | |
| FG2♀×HS5♂ | 5.3575 | -4.3409 | -8.7084 | -8.7379 | -7.10388 | -16.5235 | 10.5383 | -4.8612 | |
| FG3♀×HS1♂ | -43.5894 | -14.6026 | -19.0022 | -16.7782 | 8.3723 | -22.3123 | -1.5244 | -12.1203 | |
| FG3♀×HS2♂ | -21.6166 | -23.1378 | -24.5083 | -20.5110 | 9.5253 | 5.4142 | 19.7754 | 1.1467 | |
| FG3♀×HS3♂ | 44.2532 | 1.5685 | 27.9390 | 31.7921 | -4.7576 | 27.8281 | -6.1563 | 4.9668 | |
| FG3♀×HS4♂ | 11.2962 | 18.4916 | 15.8721 | 9.7559 | 6.2455 | -15.2405 | -5.1086 | 5.8560 | |
| FG3♀×HS5♂ | 9.6050 | -2.3258 | -1.3150 | -4.8719 | -19.4068 | 3.4561 | -6.2384 | -1.2299 | |
| FG4♀×HS1♂ | 22.6346 | -20.9808 | -14.5955 | -29.0151 | -64.9864 | -1.0476 | 13.5005 | -4.9658 | |
| FG4♀×HS2♂ | 38.0694 | 14.4607 | 20.9239 | 14.2903 | -7.4877 | -0.4284 | 4.2677 | 6.6293 | |
| FG4♀×HS3♂ | -19.7265 | 4.4394 | -11.8630 | -9.4245 | -3.5416 | -14.9130 | -4.6592 | -2.9853 | |
| FG4♀×HS4♂ | -23.3495 | -13.0112 | -1.7116 | 6.1963 | 49.1789 | 11.5728 | -5.9405 | -1.6017 | |
| FG4♀×HS5♂ | -17.0611 | 15.0204 | 7.0532 | 17.2503 | 26.0855 | 4.3295 | -6.1161 | 2.9792 | |
| FG5♀×HS1♂ | 4.6980 | -5.4625 | -1.4778 | 2.8780 | 13.7947 | -0.5050 | -16.6087 | 6.4161 | |
| FG5♀×HS2♂ | 7.7777 | 1.4786 | -4.4288 | 1.0192 | 28.7196 | -28.7725 | -12.1966 | -5.0396 | |
| FG5♀×HS3♂ | 3.8792 | 7.2822 | 9.8439 | 5.4557 | -3.7776 | 4.5962 | 7.0070 | -1.9912 | |
| FG5♀×HS4♂ | -15.0218 | -7.3758 | -6.2063 | -10.7688 | 3.6955 | 15.2659 | 14.7766 | -2.3671 | |
| FG5♀×H5♂ | -2.0571 | 4.4835 | 2.4055 | 1.4674 | -41.4961 | 8.4845 | 4.5737 | 2.8966 | |
| FG1♂×HS1♀ | -8.3572 | -20.0832 | -0.6386 | -12.6718 | -7.6531 | -26.9532 | 3.5691 | 2.5879 | |
| FG1♂×HS2♀ | 3.6844 | 17.5250 | 14.8581 | 10.9105 | -30.5499 | -1.7519 | 12.1522 | 2.8113 | |
| FG1♂×HS3♀ | 12.3232 | -61.4615 | 39.4142 | 22.5885 | -2.5106 | 26.4641 | -3.6669 | -9.2779 | |
| FG1♂×HS4♀ | -22.7601 | -34.1670 | -38.7238 | -2.2376 | 42.7091 | -32.8368 | -8.1932 | 0.2903 | |
| FG1♂×HS5♀ | 14.9938 | 9.4072 | -14.0627 | -18.5076 | -2.2936 | 36.2985 | -2.9058 | 4.0429 | |
| FG2♂×HS1♀ | 3.0432 | 2.9147 | -7.2987 | -4.8724 | 42.7676 | 8.9117 | -9.7768 | -2.7735 | |
| FG2♂×HS2♀ | 14.8479 | -29.8516 | 8.6933 | 15.7483 | -36.0070 | 7.4476 | -5.3576 | 3.2481 | |
| FG2♂×HS3♀ | -16.4628 | -30.3066 | -14.4866 | -11.6312 | 22.2441 | -12.4963 | 2.1298 | 3.6699 | |
| FG2♂×HS4♀ | 0.9781 | 8.6512 | 14.7689 | 6.6321 | -17.8192 | -12.6284 | 3.8839 | -6.8405 | |
| FG2♂×HS5♀ | -1.8289 | -3.4674 | -1.2215 | -5.8017 | -10.2880 | 8.5853 | 9.7550 | 2.5051 | |
| FG3♂×HS1♀ | -1.6110 | -7.1376 | 1.8287 | -0.7636 | -24.9817 | 8.4426 | 8.7540 | -3.5378 | |
| FG3♂×HS2♀ | -30.5629 | -27.2773 | -26.8699 | -29.0760 | 2.4147 | 3.5646 | -17.7693 | 5.2023 | |
| FG3♂×HS3♀ | 4.6893 | -2.4834 | -6.6572 | -8.1301 | 13.0941 | 1.2137 | 3.7502 | 4.0283 | |
| FG3♂×HS4♀ | 17.3751 | 21.6449 | 21.8057 | 9.4725 | 1.2968 | -0.8702 | -4.0213 | 2.0604 | |
| FG3♂×HS5♀ | 9.5223 | 14.4624 | 8.7155 | 28.5537 | 8.1494 | -12.1855 | 8.8292 | -8.1587 | |
| FG4♂×HS1♀ | -1.6506 | 18.8256 | -9.6485 | -2.2863 | -39.0318 | -26.5566 | -4.5115 | 1.7298 | |
| FG4♂×HS2♀ | 28.2048 | -38.8137 | 24.8877 | 21.3627 | 36.4405 | -3.4936 | 13.0395 | -7.0479 | |
| FG4♂×HS3♀ | -16.0471 | -37.0216 | -13.2827 | -9.5835 | 19.4330 | 2.9650 | 0.6819 | 3.0974 | |
| FG4♂×HS4♀ | 1.9776 | -5.1748 | -9.1857 | -9.6456 | -23.39004 | 36.6834 | 5.718 | -1.8380 | |
| FG4♂×HS5♀ | -14.1302 | 14.3952 | 5.8927 | 0.5598 | 6.2151 | -9.4671 | -14.9478 | 4.4177 | |
| FG5♂×HS1♀ | 8.6414 | 10.7316 | 15.5068 | 20.9888 | 28.7815 | 36.4929 | 1.6975 | 2.0365 | |
| FG5♂×HS2♀ | -16.9069 | -21.7225 | -24.1782 | -18.7706 | 27.9982 | -6.0125 | -1.3566 | -4.1805 | |
| FG5♂×HS3♀ | 15.4866 | 8.2153 | -2.8489 | 6.5929 | -53.1228 | -19.3024 | -2.9149 | -1.2697 | |
| FG5♂×HS4♀ | 1.8928 | 8.7300 | 11.4415 | -3.9637 | -3.8543 | 11.0596 | 2.9269 | 6.3405 | |
| FG5♂×HS5♀ | -8.5311 | -6.9009 | 0.0052 | -4.8500 | -1.4831 | -22.6583 | -0.4177 | -3.0338 | |
在大菱鲆的50个杂交组合中, 以体重为指标的测试结果表明, FG1♀×HS1♂组合在6月龄、9月龄、12月龄和15月龄的特殊配合力分别为30.5570、21.7354、48.1552和47.3956, 分别排在50个组合的第3、第2、第1和第1位(表 3), 其父本的一般配合力分别为16.0449、21.6675、17.9957和22.0228, 分别排在10个父本的第1、第2、第1和第1位(表 1), 其母本的一般配合力分别为24.9062、37.4062、51.1506和33.4897, 在这4个阶段均为第1位(表 2); 以成活率为指标的测试结果表明, FG1♀×HS1♂组合在6月龄、9月龄、12月龄和15月龄的特殊配合力分别为
62.4346、28.6030、17.2189和7.2779, 分别排在50个组合的第1第4、第2和第1位(表 3), 其父本的一般配合力分别为6.9503、21.5940、8.8183和1.9140, 分别排在10个父本的第4、第1、第1和第1位(表 1), 其母本的一般配合力分别为35.4734、8.6309、2.5992和5.0860, 在这4个阶段分别排在第1、第1、第2和第1位(表 2)。
2.2 杂种优势分析结果在大菱鲆的25个杂交组合中, 以体重为指标的测试结果表明, FG1♀×HS1♂组合在6月龄、9月龄、12月龄和15月龄的杂种优势率分别为2.7421、31.0844、37.2514和40.6917, 分别排在第2、第3、第1和第1位; 以成活率为指标的测试结果表明, FG1♀×HS1♂组合在6月龄、9月龄、12月龄和15月龄的杂种优势率分别为48.1551、38.0998、39.1248和35.8881, 分别排在第4、第3、第1和第1位(表 4)。
| 杂交组合 | 体重 | 成活率 | |||||||
| 6月龄 | 9月龄 | 12月龄 | 15月龄 | 6月龄 | 9月龄 | 12月龄 | 15月龄 | ||
| FG1×HS1 | 2.7421 | 31.0844 | 37.2514 | 40.6917 | 48.1551 | 38.0998 | 39.1248 | 35.8881 | |
| FG1×HS2 | 25.4689 | 24.8177 | 22.0535 | 24.5438 | 47.3684 | 25.8869 | 32.0636 | 34.8075 | |
| FG1×HS3 | 17.9309 | 17.1601 | 16.5285 | 22.5685 | 30.5555 | 33.9921 | 31.18661 | 34.1237 | |
| FG1×HS4 | 16.4908 | 22.4337 | 16.9503 | 23.9176 | 15.4078 | 33.6775 | 30.4589 | 35.2828 | |
| FG1×HS5 | 22.701 | 23.9474 | 23.0684 | 29.5069 | -2.1754 | 34.1294 | 4.01226 | 32.9392 | |
| FG2×HS1 | 14.9501 | 13.3366 | 15.2446 | -1.9844 | -2.2410 | 24.9809 | 13.36418 | 13.0355 | |
| FG2×HS2 | 10.1697 | 25.5577 | 22.3037 | -5.7764 | -1.1791 | 12.6383 | 4.02883 | 12.9110 | |
| FG2×HS3 | 1.7963 | 21.4693 | 23.3615 | 31.0922 | 23.6812 | 11.7262 | 12.02881 | 15.5153 | |
| FG2×HS4 | 2.4901 | 32.0061 | 31.4024 | -37.2274 | -3.1956 | 13.7452 | 13.3891 | 13.7561 | |
| FG2×HS5 | -10.2002 | -11.1540 | -10.6807 | -27.1479 | -3.1778 | 0.4860 | 22.40445 | -2.7297 | |
| FG3×HS1 | -21.1738 | -12.0737 | -12.4641 | -33.7446 | -3.6033 | 12.6962 | -1.26619 | -2.4647 | |
| FG3×HS2 | -20.9039 | -19.1609 | -17.1877 | -31.9126 | -1.9253 | -6.1373 | 30.01428 | -3.1686 | |
| FG3×HS3 | -16.0542 | -21.987 | -17.6796 | -23.5887 | 50.9475 | -5.5162 | 5.64369 | -3.1881 | |
| FG3×HS4 | -16.6724 | -17.7648 | -20.2606 | 29.6841 | 39.0623 | 39.8563 | 6.07451 | 12.8835 | |
| FG3×HS5 | 2.0759 | 28.7596 | 26.2079 | 20.8006 | 35.2051 | -2.2804 | 12.83326 | 31.7945 | |
| FG4×HS1 | -1.6588 | -21.4329 | -2.6790 | 30.7424 | -42.4184 | -4.0945 | 22.40041 | 33.6665 | |
| FG4×HS2 | -20.0645 | -20.2708 | -22.1318 | 27.0731 | -1.6428 | -2.1840 | 25.20925 | 30.8345 | |
| FG4×HS3 | -29.1842 | -26.6425 | -16.5221 | -35.2325 | -6.5030 | 37.0056 | 26.25323 | 33.1156 | |
| FG4×HS4 | 25.5996 | 32.1534 | 3.8106 | -28.9452 | -1.9754 | 41.4012 | 8.93398 | 31.9503 | |
| FG4×HS5 | 29.4769 | -28.7728 | -37.9604 | -28.5256 | -1.2605 | 32.5070 | 7.43195 | 32.5267 | |
| FG5×HS1 | -12.2288 | -23.2174 | -22.4537 | 2.2156 | -3.9210 | -4.0912 | -3.4360 | 32.5139 | |
| FG5×HS2 | -16.2609 | -28.3204 | -30.4660 | -25.3207 | 35.5877 | -3.4313 | -2.69012 | 34.9276 | |
| FG5×HS3 | -18.7609 | -24.5608 | -21.3425 | -33.8612 | 51.4563 | -2.1881 | -3.03627 | 32.2909 | |
| FG5×HS4 | -24.0871 | 26.3003 | -39.0472 | -34.4817 | 36.6391 | -2.1223 | -2.73822 | 35.2388 | |
| FG5×H5 | -25.8088 | 24.7881 | -35.9624 | 29.4745 | 52.3184 | -2.5629 | -3.27133 | 30.4364 | |
综合分析50个杂交组合在6月龄、9月龄、12月龄和15月龄的特殊配合力以及亲本的一般配合力发现, FG1♀×HS1♂组合为最佳杂交组合。在6月龄、9月龄、12月龄和15月龄, FG1♀×HS1♂组合的体重分别为49.4010g、162.8510g、311.0716g和619.8467g, 比相应发育阶段的普通商品苗种提高了31.36%、44.46%、50.55%和69.06%;在3—6、6—9、9—12和12—15月龄, FG1♀×HS1♂组合的成活率分别为96.4%、98.9%、99.2%和99.0%, 比相应发育阶段的普通商品苗种分别提高了37.62%、27.55%、11.45%和6.35% (表 5, 图 1), 显示出良好的生长性能。
| 月龄 | 体重(g) | 月龄 | 成活率(%) | |||||
| FG1♀×HS1♂ | 普通商品苗种 | 提高的百分率 | FG1♀×HS1♂ | 普通商品苗种 | 提高的百分率 | |||
| 6 | 49.4010 | 37.6073 | 31.36% | 3—6 | 96.4 | 70.05 | 37.62% | |
| 9 | 162.8510 | 112.7309 | 44.46% | 6—9 | 98.9 | 77.54 | 27.55% | |
| 12 | 311.0716 | 206.6234 | 50.55% | 9—12 | 99.2 | 89.01 | 11.45% | |
| 15 | 619.8467 | 366.643 | 69.06% | 12—15 | 99.0 | 93.09 | 6.35% | |
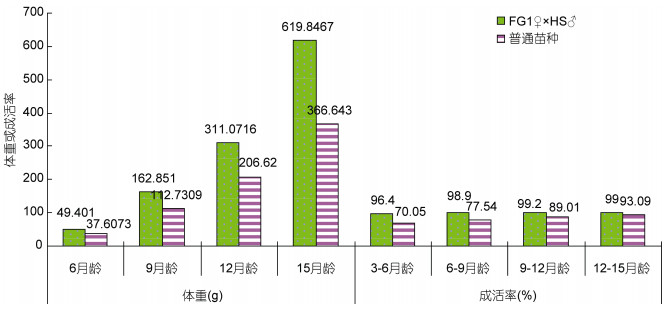 |
| 图 1 大菱鲆FG1♀×HS1♂杂交组合与普通养殖苗种生长对比试验 Fig. 1 Body weight and survival rate comparative test between combination FG1♀×HS1♂ and non-breeding strain at the different growth stages |
杂交育种是生物遗传育种领域培育新品种的重要手段, 是指不同种群、不同基因型个体间进行杂交, 并在其杂种后代中通过选择而培育成纯合品种的方法。配合力是在杂交育种中评估杂交效果和筛选优良杂交组合, 选育新品种的重要遗传学参数(Sprague et al, 1942)。配合力分为一般配合力(general combining ability, GCA)和特殊配合力(specific combining ability, SCA) (Griffing, 1956)。GCA是指一个种群和其它各种群杂交能获得的平均效果, 其遗传基础是基因的加性效应, 可以稳定遗传, 反映的是杂交亲本群平均育种值高低, 主要依靠纯繁选育提高; 对遗传力高的性状提高比较容易(Griffing, 1956)。SCA是指两个特定种群间杂交所能获得超过一般配合力的杂种优势, 其遗传基础是等位基因的显性效应、上位效应及不同基因间的相互作用等非加性基因效应, 是产生杂种优势的主要因素, 反映的是杂种群平均基因型值与亲本平均育种值之差, 其提高主要依靠杂交组合的选择(Griffing, 1956)。遗传力高的性状, 各组合的特殊配合力不会有很大差异; 遗传力低的性状, 特殊配合力可有很大差异, 因而有很大的选择余地。
在水产动物遗传育种中, 对野生牡蛎不同地理群体生长和存活性状的配合力研究发现, 牡蛎在幼虫、稚贝期的生长和存活率主要受母体效应的影响(Mallet et al, 1984); 对皱纹盘鲍不同群体的生长性状配合力和杂交优势分析发现, 生长性状的表现受加性效应和非加性效应共同影响(Deng et al, 2010); 王炳谦等(2009)利用微星标记对5不同虹鳟品系进行了遗传距离分析, 并与配合力分析相结合, 预测各品系间的杂交优势; 王浩等(2013)对凡纳滨对虾不同引进群体体重量和存活率性状的一般配合力和特殊配合力进行分析, 确定了生产优良子代的优先搭配组合。毕详等(2012)以瓯江彩鲤5个配套选育系进行双列杂交产生的F1的数据为分析对象, 利用统计学和数量遗传学方法对雄鱼性腺指数、雌鱼性腺指数、绝对繁殖力、相对繁殖力、受精率和孵化率进行了配合力测定和杂交优势分析。为瓯江彩鲤配套系育种提供了参考数据。王卫军等(2015)利用3个长牡蛎选育群体构建自交及正、反交群体, 通过分析一般配合力、特殊配合力和杂种优势效应值, 认为利用群体选育建立配套系, 对不同选育群体进行杂交育种是培育长牡蛎优良新品系的有效方法。
配套系育种是应用具有某种(些)经济性状的“专门化”品系进行杂交, 生产具有显著“杂交优势”的配套组合的一种育种方式。配套系育种在农作物、家禽和家畜育种中应用普遍, 并取得了令人瞩目的成绩(李冬, 2001; 张沅, 2001; 王爱国, 2005; 陈斌, 2007; 徐桂英等, 2011; 魏清宇等, 2011; 陈鲁妙等, 2016)。在水产动物遗传育种领域, 配套系育种也有报道, 如顾志峰等(2009)开展了马氏珠母贝的配套系育种; 毕详等(2012)开展了瓯江彩鲤的配套系育种; 林勇等(2011)和张永德等(2012)开展了罗非鱼的配套系育种; 吴廉等(2015)开展了中华绒毛蟹配套系育种; 王卫军等(2015)开展了长牡蛎的配套系育种; 唐首杰等(2016)开展了团头鲂的配套系育种研究。本研究采用选择育种(一代群体选育和两代大规模家系选育)培育出选育配套系, 即, 快速生长品系和高成活率品系, 以此为基础开展了系间杂交制种研究, 综合分析50个杂交组合在不同月龄的特殊配合力以及相应亲本的一般配合力, 发现FG1♀×HS1♂组合为最佳杂交组合。在4个不同月龄, FG1♀×HS1♂组合的体重分别为49.4010g、162.8510g、311.0716g和619.8467g, 比相应发育阶段的普通商品苗种依次提高了31.36%、44.46%、50.55%和69.06%;在3—6、6—9、9—12和12—15月龄, FG1♀×HS1♂组合的成活率分别为96.4%、98.9%、99.2%和99.0%, 比相应发育阶段的普通商品苗种分别提高了37.62%、27.55%、11.45%和6.35%, 显示出良好的生长性能。最优系间杂交组合FG1♀×HS1♂的确定, 为选育出优质、高产的大菱鲆新品种提供了基础资料。
4 结论本研究采用一代群体选育和两代大规模家系选育方法, 培育出选育配套系快速生长品系和高成活率品系, 以此为基础开展了系间杂交制种研究, 综合分析50个杂交组合在不同月龄的特殊配合力以及相应亲本的一般配合力, 发现FG1♀×HS1♂组合为最佳杂交组合。最佳系间杂交组合FG1♀×HS1♂的确定, 为选育出优质、高产的大菱鲆新品种提供了基础资料。
| 王浩, 罗坤, 栾生, 等, 2013. 凡纳滨对虾多个引进群体的杂交配合力分析. 水产学报, 37(4): 489–495 |
| 王卫军, 李琪, 杨建敏, 等, 2015. 长牡蛎(Crassostrea gigas)三个选育群体完全双列杂交后代生长性状分析. 海洋与湖沼, 46(3): 628–635 DOI:10.11693/hyhz20141100314 |
| 王炳谦, 谷伟, 高会江, 等, 2009. 利用配合力和微卫星标记预测虹鳟品系间的杂交优势. 中国水产科学, 16(2): 206–213 |
| 王爱国, 2005. 猪配套系育种目标与技术体系. 动物科学与动物医学, 22(3): 26–29 |
| 毕详, 项松平, 王剑, 等, 2012. 瓯江彩鲤配套选育系繁殖性状的配合力测定与杂交优势分析. 中国水产科学, 19(5): 775–783 |
| 李冬, 2001. 国内主要的鹌鹑品种、品系及配套系. 河南畜牧兽医, 22(10): 41 |
| 吴廉, 慈元吉, 黄姝, 等, 2015. 中华绒螯蟹配套系育种群体与野生群体的遗传比较与选择压力分析. 中国水产科学, 22(2): 204–213 |
| 张沅, 2001. 家畜育种学. 北京: 中国农业出版社, 230-254 |
| 张永德, 林勇, 唐章生, 等, 2012. 尼奥罗非鱼杂交配套系耐寒和生长性能的选育. 广西师范大学学报:自然科学版, 30(4): 92–97 |
| 陈斌, 2007. 动物遗传育种. 重庆: 重庆大学出版社, 202-223 |
| 陈鲁妙, 寿建尧, 2016. "甬优538"特征特性与机插栽培配套技术体系研究. 上海农业科技,(5): 48–49 |
| 林勇, 卢其西, 杨慧赞, 等, 2011. 八种品系罗非鱼及其尼奥罗非鱼耐寒性能的比较试验. 华北农学报, 26(S1): 278–282 DOI:10.7668/hbnxb.2011.S1.056 |
| 顾志峰, 王嫣, 石耀华, 等, 2009. 马氏珠母贝两个不同地理种群的形态性状和贝壳珍珠质颜色比较分析. 渔业科学进展, 30(1): 79–86 |
| 徐桂英, 王桂娟, 刘玉华, 2011. 康大肉兔配套系育种项目研发报告. 山东畜牧兽医, 32(11): 10–11 DOI:10.3969/j.issn.1007-1733.2011.11.008 |
| 唐首杰, 毕详, 张飞明, 等, 2016. 团头鲂9个配套组合在2龄至3龄阶段的生长性能比较. 水产科技情报, 43(6): 313–317 |
| 雷霁霖, 马爱军, 陈超, 等, 2005. 大菱鲆(Scophthalmus maximus L.)养殖现状与可持续发展. 中国工程科学, 7(5): 30–34 |
| 雷霁霖, 刘新富, 1995. 大菱鲆Scophthalmus maximus L.引进养殖的初步研究. 现代渔业信息, 10(11): 1–3 |
| 魏清宇, 李培峰, 崔少华, 等, 2011. 右玉边鸡配套系产蛋性能及蛋品质比较研究. 山西农业科学, 39(7): 723–725 |
| Deng Y W, Liu X, Zhang G F, et al, 2010. Heterosis and combining ability:a diallel cross of three geographically isolated populations of Pacific abalone Haliotis discus hannai Ino. Chinese Journal of Oceanology and Limnology, 28(6): 1195–1199 DOI:10.1007/s00343-010-9903-7 |
| Griffing B, 1956. Concept of general and specific combining ability in relation to diallel crossing systems. Australian Journal of Biological Sciences, 9(4): 463–493 DOI:10.1071/BI9560463 |
| Howell B R, 1998. Development of turbot farming in Europe. Bulletin Aquaculture Association of Canada, 98(1): 4–10 |
| Liang X M, Ma A J, Wang X A, et al, 2012. Morphological comparison between a selected fast-growing strain and the common cultured strain of turbot Scophthalmus maximus. Chinese Journal of Oceanology and Limnology, 30(4): 563–568 DOI:10.1007/s00343-012-1223-7 |
| Ma A J, Chen C, Lei J L, et al, 2006. Turbot Scophthalmus maximus:stocking density on growth, pigmentation and feed conversion. Chinese Journal of Oceanology and Limnology, 24(3): 307–312 DOI:10.1007/BF02842633 |
| Mallet A L, Haley L E, 1984. General and specific combining abilities of larval and juvenile growth and viability estimated from natural oyster populations. Marine Biology, 81(1): 53–59 DOI:10.1007/BF00397625 |
| Ruan X H, Wang W J, Kong J, et al, 2010. Genetic linkage mapping of turbot (Scophthalmus maximus L. ) using microsatellite markers and its application in QTL analysis. Aquaculture, 308(3-4): 89–100 |
| Ruan X H, Wang W J, Kong J, et al, 2011. Isolation and analysis of microsatellites in the genome of turbot (Scophthalmus maximus L.). African Journal of Biotechnology, 10(4): 507–518 |
| Sprague G F, Tatum L A, 1942. General vs.specific combining ability in single crosses of corn. Agronomy Journal, 34(4): 923–932 |
| Wang X A, Ma A J, 2016. Comparison of four nonlinear growth models for effective exploration of growth characteristics of turbot Scophthalmus maximus fish strain. African Journal of Biotechnology, 15(40): 2251–2258 DOI:10.5897/AJB |
| Wang X A, Ma A J, Huang Z H, et al, 2010. Heritability and genetic correlation of survival in turbot (Scophthalmus maximus). Chinese Journal of Oceanology and Limnology, 28(6): 1200–1205 DOI:10.1007/s00343-010-9014-5 |
| Wang X A, Ma A J, Ma D Y, 2015. Developmental quantitative genetic analysis of body weights and morphological traits in the turbot, Scophthalmus maximus. Acta Oceanologica Sinica, 34(2): 55–62 DOI:10.1007/s13131-015-0618-7 |
 2017, Vol. 48
2017, Vol. 48

