中国海洋湖沼学会主办。
文章信息
- 严珂尔, 母昌考, 王春琳, 李荣华, 杨春雷. 2017.
- YAN Ke-Er, MU Chang-Kao, WANG Chun-Lin, LI Rong-Hua, YANG Chun-Lei. 2017.
- 三疣梭子蟹 (Portunus trituberculatus) FABP基因克隆及其在卵巢发育过程中的表达特征研究
- CLONING AND EXPRESSION ANALYSIS OF FATTY ACID-BINDING PROTEIN IN OVARIAN DEVELOPMENT OF PORTUNUS TRITUBERCULATUS
- 海洋与湖沼, 48(2): 415-421
- Oceanologia et Limnologia Sinica, 48(2): 415-421.
- http://dx.doi.org/10.11693/hyhz20161100257
-
文章历史
- 收稿日期:2016-11-23
- 收修改稿日期:2016-12-02
2. 浙江海洋高效健康养殖协同创新中心 宁波 315211;
3. 象山鹤浦镇人民政府海洋与渔业办公室 象山 315733
2. Collaborative Innovation Center for Zhejiang Marine High-efficiency and Healthy Aquaculture, Ningbo 315211, China;
3. Ocean and Fishery Office of People′s Government of Hepu, Xiangshan 315733, China
脂肪酸结合蛋白 (fatty acid binding proteins, FABPs) 是一类小分子量的 (14—15kDa) 可溶性蛋白, 在无脊椎动物中广泛存在。FABP能与脂肪酸特异性结合, 是细胞内转运脂肪酸相当重要的蛋白, 它能够将脂肪酸从细胞膜运送到甘油三酯和磷脂合成或分解的位点, 主要调节脂类代谢。FABP最早是从沙漠蝗虫中分离出来 (Esteves et al, 2006), 现已发现9种组织特异性的胞内FABP:肝脏型、肠型、心脏型、脂肪细胞型、表皮型、回肠型、脑型、髓鞘型和睾丸型FABP。FABP参与了生物体的很多生命过程 (Storch et al, 2009), 除了脂肪酸的摄取、转运及代谢调节外, 还有信号转导、膜合成、酶活力的调节、参与免疫反应的调节作用 (Fu et al, 2000) 等。有大量研究表明, 脂类在蟹类性腺发育、生殖中起着极其重要的作用。蟹类的卵巢发育过程中, 尤其是卵黄合成期, 卵巢中积累了大量的脂类, 这些脂类将是后续胚胎发育重要的能量来源。三疣梭子蟹 (Portunus trituberculatus) 俗称白蟹, 属于甲壳纲、十足目、梭子蟹科, 是中国沿海的重要经济蟹类, 其卵巢发育一般分为6期 (吴旭干等, 2007)。在三疣梭子蟹的卵巢中共检测出34种脂肪酸, 而这些脂肪酸的数量和质量对胚胎发育具有很大的影响 (Lautier et al, 1988)。在三疣梭子蟹中尚未见有关于脂肪酸代谢相关研究的报道。本研究以三疣梭子蟹为材料, 克隆获得FABP基因全长cDNA, 进行了组织表达特征研究并分析了卵巢发育过程中表达水平的变化, 初步探讨三疣梭子蟹脂肪酸结合蛋白与卵巢发育的关系, 以及为三疣梭子蟹卵巢发育分子机制的解析提供理论参考。
1 材料与方法 1.1 组织取样实验所用三疣梭子蟹由宁波鑫亿鲜活水产有限公司提供。对梭子蟹低温麻醉后进行活体解剖, 分别取卵巢、肝胰腺、鳃、肌肉、心脏、眼柄和血淋巴细胞等组织和细胞存于–80℃用于RNA抽提。其中不同发育阶段卵巢通过定期取样检测后进行取样, 其他组织均取自卵巢发育Ⅳ期的雌蟹。每个组织均取6只蟹。卵巢发育程度参考吴旭干等 (2007)等的方法进行确定。
1.2 总RNA提取和cDNA的合成RNA采用RNA isoTM Plus (TaKaRa) 试剂盒按照操作说明书的方法进行抽提。取1μL RNA用于凝胶电泳检测RNA的完整性。取1μL RNA进行微量紫外分光光度计测定RNA纯度和浓度。cDNA的合成取2μg RNA采用TransScript第一链cDNA合成试剂盒合成cDNA。用于3′ RACE的cDNA采用3′-Full RACE Core Set with PrimeScriptTM RTase (TaKaRa), 按照说明书操作步骤合成。
1.3 三疣梭子蟹FABP基因cDNA全长克隆及测序根据实验室前期测序获得的三疣梭子蟹FABP的EST片段, 利用primer 5.0软件设计3′RACE特异性引物 (表 1)。FABP的3′ RACE特异性引物为3′ FABP1和3′ FABP2。PCR扩增产物经琼脂糖凝胶电泳并纯化后连接到pMD18-T载体, 转化至E. coli DH5α挑选阳性克隆进行测序 (华大基因公司)。
| 引物 | 序列(5′—3′) | 用途 |
| 3′FABP-F1 | TCTACCCTCAAGACCACCGAAGT | 3′RACE |
| 3′FABP-F2 | CTCAAGACCACCGAAGTCAAATT | 3′RACE |
| FABP-qF FABP-qR | CCCACAATGGCTCCTCCTT GACTTCGGTGGTCTTGAGGGTA |
qRT-PCR qRT-PCR |
| Beta actin-F Beta actin-R | TCACACACTGTCCCCATCTACG ACCACGCTCGGTCAGGATTTTC |
qRT-PCR qRT-PCR |
将测序获得的序列进行比对分析 (http://www.ncbi.nlm.nih.gov)。全长序列ORF的分析利用在线ORF Finder网站 (https://www.ncbi.nlm.nih.gov/orffinder/)。将根据cDNA序列推导的氨基酸序列利用ExPASy网站 (http://www.expasy.org/tools/) 提供的分析工具进行蛋白质一级序列分析, 如理化性质、亲疏水性等。信号肽分析采用SignalP 3.0程序 (http://www.cbs.dtu.dk/services/SignaIP/), 结构域利用SMART网站来进行分析 (http://smart.embl-heidelberg.de/), 同源性分析采用Cluster X多序列比对软件, 系统进化树采用Mega软件包中的邻接法 (NJ) 构建。
1.5 实时荧光定量PCR本研究选用β-actin作为内参基因 (表 1), 根据扩增得到的三疣梭子蟹FABP基因全长序列, 设计实时荧光定量引物FABP-qF和FABP-qR, 运用实时荧光定量技术分析PtFABP在三疣梭子蟹不同组织和卵巢发育各阶段的表达特征。荧光定量PCR的扩增体系为20μL, 其中包括TransStart Tip Green qPCR SuperMix (2×) 10μL, 正向引物 (10μmol/L) 0.4μL, 反向引物 (10μmol/L) 0.4μL, Passive Reference Dye (50×) 0.4μL, cDNA模板1.0μL, DEPC水7.8μL。反应程序为: 94℃ 30s; 94℃ 5s, 60℃ 30s, 40个循环; 95℃ 15s, 60℃ 1.0min, 95℃ 15s。荧光定量PCR检测结果采用2–ΔΔCt方法进行分析 (Livak et al, 2001), 数据均以平均值±标准差 (mean±SD) 表示, 经SPSS19.0软件进行方差分析 (One-Way ANOVA), P < 0.05为差异显著。
2 结果 2.1 三疣梭子蟹FABP基因cDNA全长及序列分析将测序结果进行分析和拼接后获得总长为893bp的FABP全长cDNA序列 (图 1), 包括289bp的5′端非编码区 (5′ UTR), 199bp的3′端非编码区 (3′ UTR) 和405bp的开放阅读框 (ORF)。采用ProtParam tool软件预测FABP分子式为C664H1065N175O211S8, 分子量大小为15.13kDa, 理论等电点为5.92。
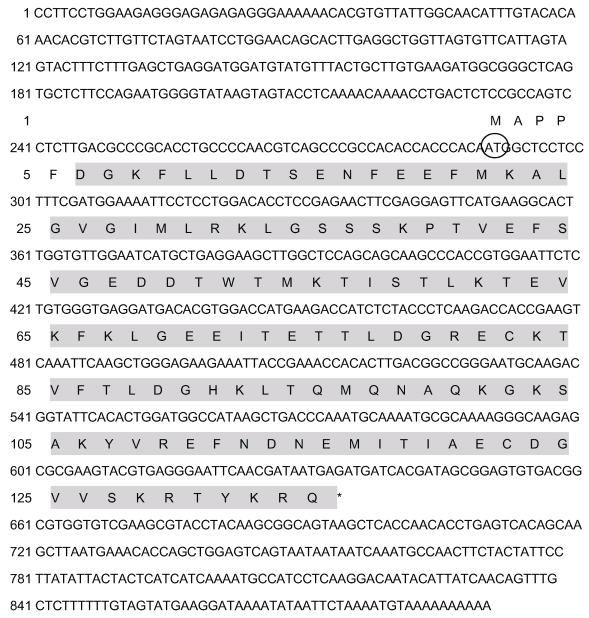 |
| 图 1 三疣梭子蟹FABP全长cDNA核苷酸序列和编码区氨基酸序列 Fig. 1 The cDNA and amino acid sequences of gene encoding FABP from P. trituberculatus 注:阴影部分表示LIPOCALIN结构域; 椭圆部分表示起始密码子; *表示终止密码子 |
 |
| 图 2 不同物种FABP氨基酸多序列比对结果 Fig. 2 Multiple alignment of the FABP amino acid sequences from different species 注:黑色阴影:相同序列; 灰色阴影:相似序列 |
经过NCBI数据库BLASTP比对, 发现FABP与Lipocalin超家族基因具有较高的同源性, PtFABP cDNA编码134个氨基酸, 蛋白分子量为15.13kDa, 其理论等电点为5.92。对编码区进行分析, 未发现有信号肽, 说明三疣梭子蟹FABP可能不属于分泌蛋白; 其氨基酸亲水性平均系数 (grand average of hydropathicity) 为–0.050, 属于亲水性蛋白。在线TMHMM工具分析发现该氨基酸序列没有跨膜结构, 进一步说明该蛋白质应该属于定位在细胞质基质或细胞器基质中的蛋白质, 不属于膜蛋白或分泌蛋白。这些基本理化性质与现有脂肪酸结合蛋白的性质一致。SMART结构域分析发现, PtFABP包含有1个Lipocalin蛋白家族典型的129个氨基酸组成的多肽保守序列, 定位在6—134位氨基酸 (图 1)。
利用NCBI BLASTP对三疣梭子蟹FABP基因编码的氨基酸序列进行同源比对, 发现三疣梭子蟹FABP与中华绒螯蟹 (Eriocheir sinensis) FABP的相似性最高, 为72%。其次是软尾太平洋螯虾 (Pacifastacus leniusculus)、红螯螯虾 (Cherax quadricarinatus)、脊尾白虾 (Palaemon carinicauda) 和拟穴青蟹 (Scylla paramamosain) 相似度分别为69%、69%、56%和53%。利用MEGA 6.0软件进行系统进化分析 (图 3), 三疣梭子蟹的FABP与中华绒螯蟹的FABP同聚一小支, 形成单独的一体。
 |
| 图 3 三疣梭子蟹FABP氨基酸序列系统进化树 Fig. 3 Phylogenetic tree analysis of FABPs from P. trituberculatus and other species |
qRT-PCR分析结果表明, FABP在雌性三疣梭子蟹 (Ⅳ期) 的肝胰腺、卵巢、肌肉等多个组织均有表达。在卵巢中表达最高, 在肝胰腺和眼柄中表达量次之, 其余组织中表达量较低 (图 4)。而且在肝胰腺和卵巢中的表达量显著高于鳃、肌肉等其他组织 (P < 0.05)。
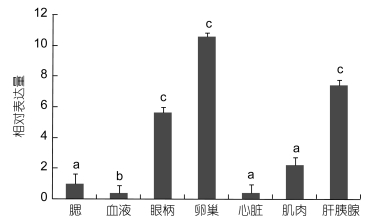 |
| 图 4 PtFABP在不同组织中的相对表达量 Fig. 4 The relative expression of FABP gene in various tissues of P. trituberculatus 注:不同字母表示不同组织间差异显著 (P < 0.05), 下同 |
不同发育阶段卵巢中FABP基因表达特征见图 5。在卵巢发育过程中, FABP的表达总趋势是先增后降。从内源性卵黄合成期 (Ⅰ期) 发育至外源性卵黄合成期 (Ⅲ期) FABP的表达量显著增加, 增长率为50%左右; 而发育到近成熟期 (成期) 表达量急剧增加, 分别为Ⅱ期和Ⅰ期表达量的5倍和10倍左右, 差异显著 (P < 0.05)。从成熟期 (Ⅴ期) 开始表达量下降, 但是与Ⅳ期表达量差异不显著 (P > 0.05), 产卵后 (Ⅵ期) 表达量继续下降, 与Ⅴ期和Ⅳ期差异显著 (P < 0.05), 但是与Ⅱ期和Ⅲ期的差异不显著 (P > 0.05)。
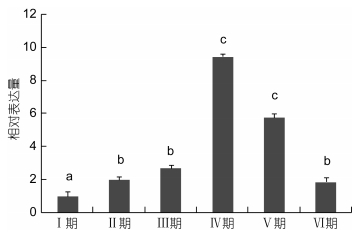 |
| 图 5 FABP在卵巢发育周期中的差异性差异 Fig. 5 The relative expression of FABP gene in ovarian development |
目前对于FABP的研究多见于植物、昆虫和哺乳动物等, 在三疣梭子蟹中还未见报道。FABP属于胞内脂质结合蛋白超家族, 具有参与脂肪酸的摄取和转运, 调节脂类代谢、参与免疫反应的调节等功能 (Tanaka et al, 2014)。FABP能够与脂肪酸特异性结合, 并将脂肪酸从细胞膜运送到甘油三酯和磷脂合成或分解的位点 (Di Pietro et al, 2001)。它不仅能结合囊泡和脂质体中的脂肪酸, 还能结合线粒体膜和脂质单层中的脂肪酸。脂肪酸结合蛋白对长链脂肪酸有较强的亲和力, 从而促进酯化反应, 促进甘油三酯的合成。本研究获得三疣梭子蟹FABP的cDNA全长, 其编码区氨基酸序列与中华绒螯蟹、红螯螯虾等物种的FABP氨基酸序列具有较高相似性, 相似度分别为72%和69%。对其序列进行分析, 发现该氨基酸序列具有一个Lipocalin结构域, 与其他的脂肪酸结合蛋白一致, 说明是FABP基因家族成员之一。从进化树结果分析发现三疣梭子蟹FABP先与甲壳动物FABP聚为一支, 再与昆虫FABP聚为一支, 这一结果符合生物在进化上的地位。
脂肪酸是构成生物的基本物质, 是细胞膜磷脂的重要成分, 直接调节细胞膜的组成及蛋白质与膜内受体, 从而引起生理功能的变化 (Das, 2006), 而脂肪酸结合蛋白对脂肪酸的吸收以及脂肪酸在细胞内的转运具有及其重要的作用。组织表达研究显示, 三疣梭子蟹FABP在肝胰腺的表达量较高, 可能与肝胰腺的功能有关, 因为肝胰腺是甲壳动物脂类储存和对脂类进行加工的主要器官, 是脂类代谢的中心 (Vogt et al, 1985)。FABP在中华绒螯蟹、日本沼虾等甲壳动物肝胰腺中表达量也很高 (丁志丽等, 2011)。FABP在眼柄中表达量中等, 因为甲壳动物眼柄中存在重要的内分泌系统, 它调控着甲壳运物的蜕皮、发育、生殖及体内的渗透压等方面。而FABP还拥有调节细胞增殖和生长、调节基因转录和信号转导、维持机体代谢内环境平衡的功能 (陈轶霞等, 2012)。由此说明在眼柄这个组织内也可能存在需要FABP的生理途径, 有待进一步实验研究。
甲壳类动物的卵巢包含有大量的长链不饱和脂肪酸 (PUFA), 丰浪 (2011)研究在中华绒鳌蟹卵巢快速发育期, 高不饱和脂肪酸 (HUFA) 是必需的脂肪酸, 一旦截断了外源的供给, 会制约卵巢发育。而HUFA在对虾卵巢发育以及胚胎发育中也起着重要作用 (Alava et al, 1993)。成永旭等 (2000)证实了中华绒螯蟹在卵巢的快速发育期内 (9月初至12月初) 需要积累大量的脂肪, 在卵巢积累脂肪的过程中, 中性脂在卵巢中的含量、中性脂和磷脂的含量都有明显的增加, 但中性脂与磷脂在总脂的比值基本稳定。Liu等 (2008)提出了一种在卵黄合成时期多不饱和脂肪酸运输到卵巢积累的模式, 而FABP作为胞内长链脂肪酸的运输者, 可以将脂肪酸定位到胞内, 起到十分重要的作用。Ravid等 (1999)发现短沟对虾 (Penaeus semisulcatus) 卵巢中的脂肪酸含量随着发育的进行而不断的增加, 直到发育成熟为止。在十足类甲壳动物卵巢发育过程中, 尤其是卵黄发生期, 卵巢积累了大量的脂肪酸, 这些脂肪酸一般是由肝胰腺转运至卵巢的 (Wen et al, 2001), 最后成为卵细胞中储存的重要的能源和结构物质。中华绒螯蟹FABP基因在卵巢中的表达量在从阶段一 (8月) 到阶段3(11月) 逐渐上升, 并且在阶段三 (11月) 达到最大值, 随后阶段4(1月) 有显著性下降 (巩亚男, 2010)。拟穴青蟹FABP从未发育期、发育早期、发育期、成熟期到成熟期具有不同的表达水平, 在成熟期之前有较高的表达量, 表明脂肪酸结合蛋白可能参与卵巢发育的过程 (Zeng et al, 2013)。本研究中, qPCR结果显示三疣梭子蟹卵巢中FABP的表达量与卵巢的发育程度成正相关, 随着卵巢的发育, FABP表达量呈现先增加在下降的趋势。从内源性卵黄合成期 (Ⅰ期) 发育至近成熟期 (至期) FABP的表达量显著增加, 并在Ⅳ期达到最大值。Ⅳ期属于梭子蟹卵巢快速发育期, FABP的表达量急剧上升与这个阶段大量脂肪酸的积累相一致。随着卵巢发育进入成熟期 (Ⅴ期), 脂肪积累速度降低, 从而FABP的表达量随着下降。产卵后, 卵巢随即进入下一个卵巢发育周期, PtFABP的表达量也逐渐恢复到卵巢发育早期的水平。由此可以说明PtFABP可能通过调节脂肪酸代谢, 从而参与卵巢发育的调控。
4 结论本研究克隆获得了三疣梭子蟹FABP基因的全长cDNA序列, 组织差异表达分析显示, 三疣梭子蟹FABP在各个组织内均有表达, 其表达水平在卵巢最高。在三疣梭子蟹卵巢发育前期FABP基因的表达量持续增加, 且在Ⅳ期达到最高值, 之后逐渐下降。这表明FABP在三疣梭子蟹的卵巢发育过程中起着重要作用, 并为后期胚胎的发育储存能量。
| 丁志丽, 陈立侨, 禹娜等, 2011. 日本沼虾脂肪酸结合蛋白基因全长cDNA的克隆及其在卵巢不同发育阶段的表达. 见: 2011年中国水产学会学术年会论文集, 厦门 |
| 丰浪, 2011. 高不饱和脂肪酸 (HUFA) 对三疣梭子蟹卵巢发育、内分泌激素以及组织生化组成的影响. 上海: 上海海洋大学硕士学位论文 |
| 巩亚男, 2010. 中华绒螯蟹 (Eriocheir sinensis) 雌蟹脂肪酸结合蛋白 (Es-FABP) 基因的克隆及组织表达分析. 上海: 华东师范大学硕士学位论文 |
| 成永旭, 堵南山, 赖伟, 2000. 中华绒螯蟹卵巢快速发育期内脂类积累以及对抱卵的影响. 水产学报, 24(2): 113–118 |
| 吴旭干, 姚桂桂, 杨筱珍, 等, 2007. 东海三疣梭子蟹第一次卵巢发育规律的研究. 海洋学报, 29(4): 120–127 |
| 陈轶霞, 骆学农, 王红宁, 2012. 脂肪酸结合蛋白及其生物学功能. 生命的化学, 32(6): 502–506 |
| Alava V R, Kanazawa A, Teshima S I, et al, 1993. Effect of dietary phospholipids and n-3 highly unsaturated fatty acids on ovarian development of kuruma prawn. Nippon Suisan Gakkaishi, 59(2): 345–351 DOI:10.2331/suisan.59.345 |
| Das U N, 2006. Essential fatty acids:biochemistry, physiology and pathology. Biotechnology Journal, 1(4): 420–439 DOI:10.1002/(ISSN)1860-7314 |
| Di Pietro S M, SantoméJ A, 2001. Structural and biochemical characterization of the lungfish (Lepidosiren paradoxa) liver basic fatty acid binding protein. Archives of Biochemistry and Biophysics, 388(1): 81–90 DOI:10.1006/abbi.2001.2277 |
| Esteves A, Ehrlich R, 2006. Invertebrate intracellular fatty acid binding proteins. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 142(3-4): 262–274 |
| Fu Y C, Luo N L, Lopes-Virella M F, 2000. Oxidized LDL induces the expression of ALBP/aP2 mRNA and protein in human THP-1 macrophages. Journal of Lipid Research, 41(12): 2017–2023 |
| Lautier J, Lagarrigue J G, 1988. Lipid metabolism of the crab Pachygrapsus marmoratus during vitellogenesis. Biochemical Systematics and Ecology, 16(2): 203–212 DOI:10.1016/0305-1978(88)90098-1 |
| Liu R Z, Li X D, Godbout R, 2008. A novel fatty acid-binding protein (FABP) gene resulting from tandem gene duplication in mammals:transcription in rat retina and testis. Genomics, 92(6): 436–445 DOI:10.1016/j.ygeno.2008.08.003 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Ravid T, Tietz A, Khayat M, et al, 1999. Lipid accumulation in the ovaries of a marine shrimp Penaeus semisulcatus(de haan). Journal of Experimental Biology, 202(13): 1819–1829 |
| Storch J, McDermott L, 2009. Structural and functional analysis of fatty acid-binding proteins. Journal of Lipid Research, 50(S): S126–S131 |
| Tanaka M, Furuhashi M, Okazaki Y, et al, 2014. Ectopic expression of fatty acid-binding protein 4 in the glomerulus is associated with proteinuria and renal dysfunction. Nephron Clinical Practice, 128(3-4): 345–351 |
| Vogt G, Storch V, Quinitio E T, et al, 1985. Midgut gland as monitor organ for the nutritional value of diets in Penaeus monodon(Decapoda). Aquaculture, 48(1): 1–12 DOI:10.1016/0044-8486(85)90047-X |
| Wen X B, Chen L Q, Ai C X, et al, 2001. Variation in lipid composition of Chinese mitten-handed crab, Eriocheir sinensis during ovarian maturation. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 130(1): 95–104 DOI:10.1016/S1096-4959(01)00411-0 |
| Zeng X L, Ye H H, Yang Y N, et al, 2013. Molecular cloning and functional analysis of the fatty acid-binding protein (Sp-FABP) gene in the mud crab (Scylla paramamosain). Genetics and Molecular Biology, 36(1): 140–147 DOI:10.1590/S1415-47572013005000007 |
 2017, Vol. 48
2017, Vol. 48


