中国海洋湖沼学会主办。
文章信息
- 杨梦香, 柴方超, 周前进, 苗亮, 黄光亮, 陈炯. 2017.
- YANG Meng-Xiang, CHAI Fang-Chao, ZHOU Qian-Jin, MIAO Liang, HUANG Guang-Liang, CHEN Jiong. 2017.
- 应用LAMP-LFD技术可视化检测河流弧菌 (Vibrio fluvialis) 的研究
- THE VISUAL DETECTION OF VIIO FLUVIALIS BY A NOVEL LAMP-LFD
- 海洋与湖沼, 48(2): 383-391
- Oceanologia et Limnologia Sinica, 48(2): 383-391.
- http://dx.doi.org/10.11693/hyhz20161100242
-
文章历史
- 收稿日期:2016-11-05
- 收修改稿日期:2016-12-20
2. 宁德市水产技术推广站 宁德 352100
2. Fisheries Technical Extension Station of Ningde, Ningde 352100, China
河流弧菌为嗜盐性革兰性阴性菌, 广泛分布于河流和近海口水域, 可导致鱼虾贝等多种水生动物患病, 是海水养殖的主要病原菌之一 (Baffone et al, 2001)。同时, 河流弧菌可从不同水体、城市污水、动物和人类粪便, 以及水产品中分离得到, 感染后导致人出现严重的水样腹泻, 伴随呕吐、腹痛、发烧, 以及不同程度的脱水等症状 (Chowdhury et al, 2012; Ramamurthy et al, 2014)。在美国, 该细菌还被认为是引起婴儿小肠结肠炎的重要病原之一 (Bellet et al, 1989)。因此, 河流弧菌已成为一种重要的全球性人兽共患病病原菌, 不仅危害水产养殖业的发展, 而且对人类健康和食品安全也构成了严重威胁, 因此亟待建立灵敏、快捷、特异的检测技术用于基层检测。
目前, 河流弧菌的检测以传统的细菌分离培养、生化鉴定为主, 但是该方法存在检测周期长、费时费力等缺点, 而且检测人员需要专业的知识背景, 远不能满足疾病的快速诊断和及时治疗。尤其, 该病原菌被认定为人兽共患病病原菌, 使得对于该病原的快速准确鉴定变得更加重要。因以蛋白或核酸为检测靶标的分子检测技术具有检测快速、高灵敏度等优点, 在病原微生物的诊断和鉴定等领域得到广泛使用, 但关于河流弧菌分子检测技术的报道还很少。基于PCR原理的核酸扩增技术均以toxR基因作为检测靶标 (Chakraborty et al, 2006; 曹际娟等, 2008; 文万侥等, 2009; Vinothkumar et al, 2013)。其中, 曹际娟等 (2008)将PCR技术与高效液相色谱联合应用于河流弧菌的检测, 也取得了较好的效果。鄢庆枇等 (2006)使用灭活的河流弧菌抗原制备了效价较高的特异性抗血清, 利用该血清建立了河流弧菌的荧光抗体检测技术应用于牙鲆 (Paralichthys olivaceus) 体内该病原的检测。已有的这些方法存在着对实验设备要求高、工作环境严格等局限性, 仅限于实验室诊断, 不能很好地在基层检测中普及推广。
环介导等温扩增技术 (loop-mediated isothermal amplification, LAMP) 自被报道以来, 凭借其低设备依赖性、高灵敏度和特异性等优势, 在病原微生物的检测领域取得了巨大成功 (Niemz et al, 2011; Mori et al, 2013)。但该方法在检测过程的某些阶段仍存在很大的提高空间。如何做到在有效、准确判读结果的基础上, 使得产物的检测过程也脱离对仪器设备的依赖, 是LAMP方法改进性研究的重要方向。LAMP-LFD技术的原理是将LAMP的反应产物与特异性的探针杂交, 通过荧光素标记在横向流动试纸条 (lateral flow dipstick, LFD) 上完成显色和结果判读。该方法无需EB等有毒试剂, 也摆脱了对仪器设备的依赖, 特异性探针可极大程度地降低了产物的假阳性。该项技术目前已成功用于ISKNV (Infectious spleen and kidney necrosis virus, 传染性脾肾坏死病毒) (Ding et al, 2010)、IMNV (Infectious myonecrosis virus, 传染性肌肉坏死病毒) (Puthawibool et al, 2009), 以及海豚链球菌 (Strepstococcus iniae) 等水产病原微生物的检测 (王瑞娜等, 2014)。
作者在本文中根据河流弧菌外膜蛋白ompU基因的保守区, 设计出3对引物和1条异硫氰酸酯荧光素标记的探针, 优化反应条件后, 建立了LAMP-LFD技术, 以期为河流弧菌的现场即时检测提供一种便捷可靠的方法。
1 材料与方法 1.1 菌种河流弧菌 (Vibrio fluvialis ATCC 33809)、嗜水气单胞菌 (Aeromonas hydrophila ATCC 7966)、哈维氏弧菌 (V. harveyi ATCC 33866) 和创伤弧菌 (V. vulnificus ATCC 27562) 购自中国普通微生物菌种保藏中心; 迟缓爱德华菌 (Edwardsiella tarda MCCC 235) 由中国海洋微生物菌种保藏管理中心惠赠; 溶藻弧菌 (V. alginolyticus ATCC 17749)、海豚链球菌 (Streptococcus iniae ATCC 29178) 购自美国菌种保藏中心; 铜绿假单胞菌 (Pseudomonas aeruginosa ATCC 9027) 和单增李斯特菌 (Listeria monocytogenes ATCC 19115) 购自广东省微生物菌种保藏中心; 鳗弧菌香鱼分离株 (V. anguillarum ayu-H080701) 为本实验室保存的菌种。其中, 河流弧菌ATCC 33809用于LAMP-LFD的条件优化和灵敏度分析实验。
1.2 方法 1.2.1 细菌的培养与基因组DNA制备将实验所需的各弧菌从–70℃取出后, 在TCBS固体培养基上划线接种, 28—30℃培养12—24h后, 挑取单菌落于碱性蛋白胨水中震荡培养至所需浓度; 海豚链球菌、迟缓爱德华菌、嗜水气单胞菌和单增李斯特菌划线接种于LB或BHI固体培养基, 于30℃或37℃培养后, 挑取单菌落, 于LB或BHI液体培养基中震荡培养至所需浓度。
新鲜培养的各细菌菌株, 菌落计数后调整浓度至1.0×108 cfu/mL, 作为起始浓度。分别取所需浓度的各实验菌株新培养液1mL, 按照基因组DNA提取试剂盒 (离心柱型) D3350-01 (Omega Bio-Tek, USA) 提取基因组DNA, 溶解于50 μL的无菌ddH2O用于PCR和LAMP实验。
1.2.2 引物设计选择已在NCBI公布的河流弧菌的外膜蛋白ompU (登录号: KC182592) 基因, 序列比对分析后, 在保守的基因区段设计3对特异性引物 (外引物VflompU-F3和VflompU-B3, 内引物VflompU-FIP和VflompU-BIP, 环引物VflompU-LF和VflompU-LB) 用于LAMP反应; 同时, 设计1条探针VflompU-HP, 可与LAMP产物特异性杂交, 并用于LFD检测, 见表 1和图 1。其中探针VflompU-HP的5′端进行异硫氰酸荧光素标记, 内引物VflompU-FIP的5′端进行生物素标记。以上探针和引物由英潍捷基 (上海) 贸易有限公司合成。另外, 将外引物VflompU-B3和VflompU-F3也作为PCR扩增的特异性引物, 扩增预期片段大小约为278bp。
| 引物 | 类型 | 长度 | 序列 (5′—3′) |
| VflompU-F3 | 上游外引物 | 18-mer | TCATGGCTTACCACGGTA |
| VflompU-B3 | 下游外引物 | 18-mer | GGTGTAAGACGCTGCTAG |
| VflompU-FIPa | (F1c+TTTT+F2) 上游内引物 | 43-mer (F1c: 21-mer F2: 18-mer) | AGTTGAACCGTCATCGCTACGttttGGCCAGTTCTCTGACCTA |
| VflompU-BIP | (B1c+TTTT+B2) 下游内引物 | 41-mer (B1c: 19-mer B2: 18-mer) | TCTACGCAATCGGCGACACttttCTTTGTCTTGGTCAGCGT |
| VflompU-LF | 上游环引物 | 20-mer | ACGGTAAGTTGCACGTAGAG |
| VflompU-LB | 下游环引物 | 19-mer | GTGAAACTAGGTGCTGGCT |
| VflompU-HPb | 杂交探针 | 21-mer | CTCTGATAACAAACAAGATGG |
| 注: a表示上游引物VflompU-FIP的5′端生物素标记; b表示VflompU-HP的5′端异硫氰酸标记 | |||
 |
| 图 1 河流弧菌外膜蛋白ompU基因的LAMP-LFD引物序列及DNA探针设计 Fig. 1 The primers and DNA probes targeting ompU gene of V. fluvialis used in LAMP-LFD assay 注: LAMP反应所用引物和LFD检测所用探针序列使用下划线或方框表示。其中, VflompU-B1c, flompU-B2c, VflompU-B3c和VflompU-LFc是引物VflompU-B1, VflompU-B2, VflompU-B3和VflompU-LF的互补序列 |
以各供试细菌的基因组DNA为模板, 参考文献的方法建立LAMP反应体系 (Ding et al, 2010), 具体组成如下 (25μL):外引物VflompU-F3和VflompU-B3各0.2μmol/L, 内引物VflompU-FIP和VflompU-BIP各1.6μmol/L, 环引物VflompU-LB和VflompU-LF各0.4μmol/L, dNTPs 1.4mmol/L, Tris-HCl (pH 8.8) 20mmol/L, KCl 10mmol/L, MgSO4 6.5mmol/L, (NH4)2SO4 10mmol/L, Triton X-100 0.1%, 8U Bst DNA聚合酶大片段 (New England Biolabs) 和2μL样品模版。Bst DNA聚合酶能够在一定的温度范围 (60—65℃) 保持其最佳活性, 根据实验室已有的研究结果结合文献报道, 得出63℃和65℃在研究中最常使用。本研究将LAMP反应的温度设定为63℃, 在此基础上筛得了LAMP引物。在上述LAMP体系中添加EvaGreen、SYTO 9等荧光染料后, 通过类似于荧光定量PCR反应的方式进行LAMP结果的判断 (定义为实时荧光LAMP反应), 即反应的实时曲线特征, 荧光强度等能够直观的显示LAMP反应的情况。研究证实, LAMP反应阳性扩增的起始时间与模板的添加量具有明显的相关性 (Zhou et al, 2014)。为确定本研究的LAMP反应时间, 我们首先将起始浓度1.0×108 CFU/mL以10倍浓度梯度进行稀释, 将所获各不同浓度的菌液按步骤1.2.1的方法提取基因组DNA, 以此为模板, 进行实时荧光LAMP反应, 反应时间为60min。根据LAMP反应阳性扩增的起始时间结合荧光曲线到达平台期的时间, 初步分析模板浓度对于LMAP反应的影响。在此基础上, 选择较低浓度的细菌基因组DNA为模板, 将接近于该浓度下获得的阳性扩增起始时间作为最短反应时间, 以5min作为时间间隔逐步延长反应时间, 进行多次LAMP反应, 确定LAMP反应的最佳反应时间。反应产物分别经1.5%的琼脂糖凝胶电泳、LFD, 以及在反应产物中添加SYBR Green I荧光染料等方法进行结果判断。
1.2.4 利用横向流动试纸条LFD检测使用生物素标记的内引物VflompU-FIP进行LAMP反应, 反应结束后不经过高温终止反应, 而是直接向反应体系中加入20pmol FITC标记的探针VflompU-HP, 63℃杂交5min; 取杂交液5μL加入到100μL LFD buffer (Milenia Biotec GmbH公司, 德国) 中混匀; 将LFD试纸条 (Milenia Biotec GmbH公司, 德国) 的检测端竖直浸入杂交液中, 静置3—5min, 以肉眼判别结果。
1.2.5 河流弧菌的LAMP-LFD特异性实验为评价河流弧菌LAMP-LFD方法的特异性, 选取与之相近的弧菌属的多个致病菌, 即哈维氏弧菌、创伤弧菌、鳗弧菌以及溶藻弧菌, 同时选择海豚链球菌、迟缓爱德华菌、铜绿假单胞菌, 单增李斯特菌以及嗜水气单胞菌等四种水产养殖或水产品中的常见病原菌。将各菌株的新培养物调整浓度至1×105CFU/mL, 按1.2.1所述, 提取基因组DNA, 并以此为模板, 利用优化的反应条件进行有生物素标记的LAMP反应, 待产物与探针杂交后, 经LFD进行结果判读; 同时LAMP产物也通过1.5%的琼脂糖凝胶电泳以及添加SYBR Green I的方法进行判读。
1.2.6 河流弧菌LAMP-LFD的灵敏度实验取培养的新鲜河流弧菌菌液, 调整至起始浓度1.0×108 CFU/mL, 进行10倍浓度梯度稀释, 按照步骤1.2.1提取基因组DNA, 各浓度制备三个平行样品。利用优化反应条件, 进行有生物素标记的LAMP反应, 产物与探针杂交后, 经LFD进行结果判读; 同时LAMP产物也通过1.5%的琼脂糖凝胶电泳以及添加SYBR Green I的方法进行判读。
同时, 我们选择由VflompU-F3\VflompU-B3为引物的PCR方法作为方法学上的比较。选择上述各稀释度的基因组DNA为模板进行PCR反应, 反应体系 (25μL) 包括: 10×PCR buffer 2.5μL, rTaq DNA聚合酶 (5U/μL) (TaKaRa, 大连) 0.15μL, dNTPs (2.5mmol/μL) 2μL, VflompU-F3 (10pmol/μL) 1μL, VflompU-B3 (10pmol/μL) 1μL, 基因组DNA模板2μL。PCR的反应程序为: 94℃预变性1 min; 94℃变性30s, 54℃退火30s, 72℃延伸30s, 30个循环; 最后在72℃延伸10min。对反应产物用1.5%琼脂糖凝胶电泳进行检测。
1.2.7 LAMP-LFD重复性实验取1mL培养的新鲜河流弧菌菌液, 计数, 调整浓度至1.0×108CFU/mL, 以此为起始浓度, 进行10倍浓度梯度稀释, 按照步骤1.2.1提取基因组DNA, 每个浓度制备三个平行样品。以此DNA为模板, 利用优化反应条件, 进行有生物素标记的LAMP反应, 产物与探针杂交后, 经LFD进行结果判读, 验证方法的可重复性; 同时, LAMP产物也利用1.5%的琼脂糖凝胶电泳和SYBR Green I染料判读结果, 并与LFD结果进行比较分析。
1.2.8 河流弧菌人工污染大黄鱼组织实验取若干份健康大黄鱼的肝脏组织100mg加入少量无菌水, 充分匀浆后, 定容至1mL。取1mL新鲜培养的河流弧菌菌液 (约1.0×108CFU/mL) 进行10倍浓度梯度稀释, 分别取浓度为1.0×101, 1.0×102, 1.0×103, 1.0×104, 1.0×105CFU/mL的菌液各1mL, 与大黄鱼肝组织匀浆液等体积混匀。每个浓度平行制备三个样品。取1mL被细菌污染的肌肉组织样品, 采用动物组织基因组DNA提取试剂盒 (TaKaRa, 大连) 提取该样品基因组DNA, 溶解于50μL的ddH2O中, 用作PCR和LAMP测试的模板。以健康大黄鱼的肝脏组织匀浆液作为阴性对照。
2 结果 2.1 LAMP扩增条件的确定将起始浓度1.0×108 CFU/mL进行倍比稀释后, 选择1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102和1.0×101CFU/mL 7个浓度梯度的基因组DNA为模板, 进行实时荧光LAMP反应。结果表明, 当以1.0×107, 1.0×106, 1.0×105, 1.0×104, 1.0×103和1.0×102CFU/mL的基因组DNA为模板时, 荧光曲线呈典型的“S”型, 扩增为阳性; 而当模板浓度降低至1.0×101CFU/mL时, 扩增结果呈阴性 (图 2a)。当阳性扩增模板浓度由1.0×107逐步降低至1.0×102 CFU/mL时, 起峰时间逐渐增加, 呈线性相关 (图 2b)。然后, 选择可引起阳性扩增的较低模板浓度1.0×102 CFU/mL为模板, 设定多个反应时间, 进行有生物素标记的LAMP反应。反应时间以20min (20min略低于该浓度下的阳性扩增起峰时间) 起, 时间间隔为5min, 判断低浓度下LAMP反应的最佳有效时间。各LAMP产物与探针VflompU-HP杂交后, 经LFD试纸条显色; 同时, 利用1.5%的琼脂糖凝胶电泳和产物中添加SYBR Green I的方法进行检测, 比较分析。结果表明, 当反应时间为20min时, LFD的检测线位置未见有条带, 结果为阴性; 当反应时间增至25min时, LFD检测线位置可见明显的条带, 结果为阴性; 当继续增加反应时间至30、35和40min时, 利用LFD均可稳定地检测为阳性 (图 2d)。利用1.5%的琼脂糖凝胶电泳检测表明, 当反应时间为25min时, 开始明显检测到典型的梯形条带, 反应时间为30min时, 梯形条带达到最为明亮, 产物量达到最大, 反应时间继续增加至40min时, 产物量未见明显增加 (图 2c); 向产物中添加SYBR Green I后观察发现, 当反应时间从25min逐渐增至40min时, 均可明显观察到LAMP产物呈现绿色变化, 反应时间为20min时, LAMP产物呈现SYBR Green I稀释后的橙色, 结果呈阴性 (图 2e)。综上, 尽管通过琼脂糖凝胶电泳的方法, 直到反应时间达到30min时才达到带型最亮, 但是利用LFD和添加SYBR Green I的方法, 在反应时间达到25min时即可稳定可靠的判定结果, 因此, 应用于LFD检测的LAMP的最佳反应时间为25min。
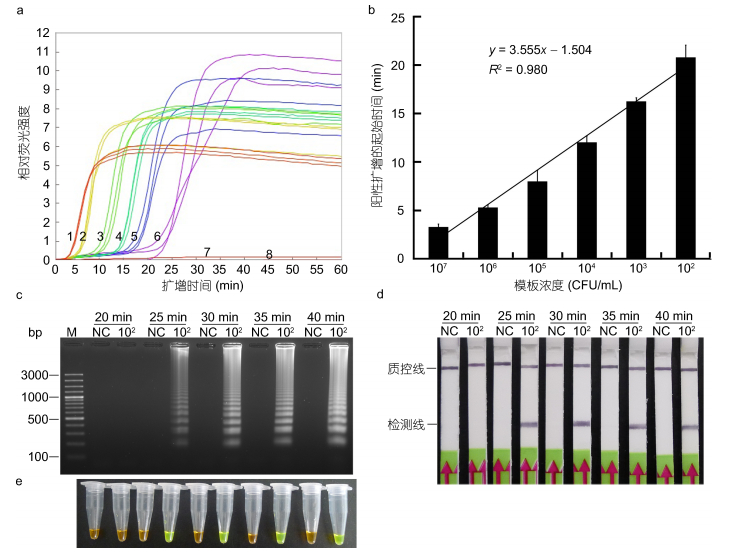 |
| 图 2 LAMP反应最适反应时间的确定 Fig. 2 Time optimization of LAMP assay for detection of V. fluvialis 注: a:不同浓度的河流弧菌基因组DNA为模板的实时荧光LAMP反应; 1—7, 模板浓度依次提取自1.0×107, 1.0×106, 1.0×105, 1.0×104, 1.0×103, 1.0×102和1.0×101 CFU/mL的细菌菌液; 8, 不加任何DNA, 用作阴性对照; M, 100bp Plus DNA ladder (Fermentas, 美国)。b:基因组DNA浓度与扩增起始时间 (起峰时间) 的关系表现出典型线性相关性。c, d和e:在以较低浓度 (1.0×102CFU/mL) 的基因组DNA为模板时, 不同反应时间下的LAMP反应, 产物分别利用琼脂糖凝胶电泳 (c), LFD (d) 和添加SYBR Green I (e) 的方式进行检测 |
选择与河流弧菌相似的创伤弧菌、哈维氏弧菌、鳗弧菌和溶藻弧菌等弧菌属的病原菌, 以及海豚链球菌、迟缓爱德华菌、铜绿假单胞菌、单增李斯特菌、嗜水气单胞菌等常见的水产病原菌的基因组DNA为模板, 63℃条件下进行有生物素标记的LAMP反应, 反应时间为25min, 产物与探针杂交后, 用于LFD检测, 分析LAMP-LFD方法的特异性。结果表明以1×105CFU/mL河流弧菌基因组DNA为模板时, LAMP产物与探针杂交后, 经LFD检测, 检测线上有明显条带, 结果呈阳性, 琼脂糖凝胶电泳以及添加SYBR Green I的方法也是显示阳性结果。当以上述5种弧菌和其他4种水产病原菌的基因组DNA为模板时, LFD的检测线位置未见有明显的条带, 结果呈阴性; 经琼脂糖凝胶电泳和添加SYBR Green I检测, 结果也是阴性。以上说明本研究公布的河流弧菌LAMP-LFD方法具有良好的特异性。
2.3 河流弧菌LAMP-LFD的灵敏度验证根据LAMP反应条件优化时获得的实时荧光LAMP数据, 以起始浓度1.0×108 CFU/mL作为最高浓度, 1.0×101 CFU/mL作为最低浓度, 在上述优化反应条件下, 进行有生物素标记的LAMP反应。结果显示, 当模板浓度从1.0×108 CFU/mL逐渐降低至1.0×102 CFU/mL时, 利用LFD方法均可稳定检测到阳性结果; 当使用1.0×101 CFU/mL的菌液作为模板时, 检测结果呈阴性。这表明经LFD检测的最低模板浓度为1.0×102 CFU/mL或4 CFU/反应 (图 4b)。同时, LAMP产物经1.5%的琼脂糖凝胶电泳和添加SYBR Green I的方法检测发现, 能够检测到的最低模板浓度同样是1.0×102 CFU/mL (图 4a, 4d)。而以VflompU-F3\VflompU-B3为引物的PCR方法可以检测到1.0×103 CFU/mL或者40CFU/反应的最低模板浓度 (图 4c)。
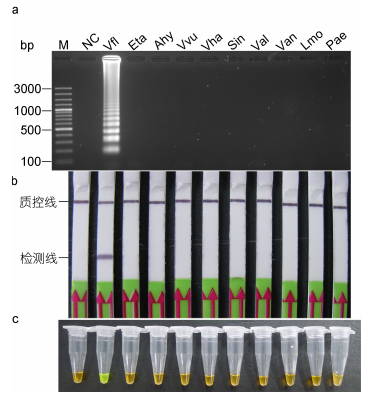 |
| 图 3 LAMP (a, c) 和LAMP-LFD (b) 的特异性实验结果 Fig. 3 Specificity test of LAMP (a, c) and LAMP-LFD (b) for detection of V. fluvialis 注: a, b和c:以各受试菌株的基因组DNA为模板, 进行有生物素标记的LAMP反应, 反应产物分别经琼脂糖凝胶电泳 (a)、LFD (b) 和添加SYBR Green I (c) 的方式进行检测. M, 同上图; NC, 以无菌去离子水作为模板; Vfl, Eta, Ahy, Vvu, Vha, Sin, Val, Van, Lmo和Pae分别代表以河流弧菌, 迟缓爱德华氏菌, 嗜水气单胞菌, 创伤弧菌, 哈维氏弧菌, 海豚链球菌, 溶藻弧菌, 鳗弧菌, 单增李斯特菌和铜绿假单胞菌的基因组DNA为模板 |
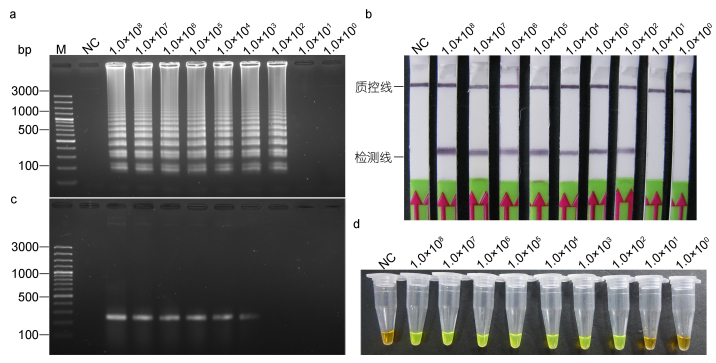 |
| 图 4 检测河流弧菌的不同方法灵敏度比较 Fig. 4 Comparison in detection limit to V. fluvialis by different motheds 注: a, d: LAMP, b: LAMP-LFD, c: PCR. M, 同上图; NC, 不添加任何DNA模板; 1.0×108 —1.0×100, 用于提取基因组DNA的不同浓度的河流弧菌菌液, 单位: CFU/mL. LAMP和LAMP-LFD检测到的最低模板浓度为1.0×102 CFU/mL; PCR方法为1.0×103 CFU/mL |
为分析河流弧菌LAMP-LFD方法的重复性, 同时评价依托于恒温水浴锅等普通仪器的LAMP-LFD的稳定性, 重新取河流弧菌的新鲜培养液, 进行倍比稀释后, 将浓度调至1.0×102CFU/mL后, 提取基因组DNA, 进行有生物素标记的LAMP反应, 反应条件为63℃温育25min。结果表明, 以最低检测浓度1.0×102 CFU/mL的河流弧菌基因组DNA为模板获得的LAMP产物, 经LFD试纸条、琼脂糖凝胶电泳, 以及添加SYBR Green I的方法均能稳定获得阳性结果; 以蒸馏水为模板时, 检测结果呈阴性, 说明依托于简单仪器的LAMP-LFD具有良好的重复性和稳定性。
2.5 采用LAMP-LFD方法检测哈维氏弧菌污染大黄鱼组织的灵敏度和适用性分析将不同浓度河流弧菌对大黄鱼的组织进行等体积污染后, 提取混合匀浆液的基因组DNA, 经LAMP-LFD和PCR分别检测, 结果显示当污染组织的菌液浓度达到1.0×103 CFU/mL时, 利用LAMP-LFD即可从污染的肝脏组织中稳定检测到病原, 灵敏度为5×102 CFU/mL或20 CFU/反应 (表 2); 当污染组织的菌液浓度达到1.0×104 CFU/mL时, 利用PCR方法即可从污染的肝脏组织中稳定地检测出病原, 达到5×103CFU/mL或200CFU/反应的灵敏度, 结果见表 2。
| 检测方法 | 已被污染大黄鱼组织所用的河流弧菌浓度 (CFU/mL) | 未被污染健康大黄鱼的肝组织 (CFU/mL) | |||||
| 1.0×105 | 1.0×104 | 1.0×103 | 1.0×102 | 1.0×101 | 1.0×105 | ||
| LAMP-LFD | + | + | + | — | — | — | |
| + | + | + | — | — | — | ||
| + | + | + | + | — | — | ||
| PCR | + | + | — | — | — | — | |
| + | + | —- | — | — | — | ||
| + | + | — | — | — | — | ||
| 注: “+”表示检测结果阳性; “-”表示检测结果阴性 | |||||||
河流弧菌是水产养殖中的一种重要病原菌, 随着海鲜产品在饮食结构比重中的逐渐增加, 由河流弧菌引发的人体疾病也越来越受到重视 (Chowdhury et al, 2012; Ramamurthy et al, 2014)。在我国, 河流弧菌已在牙鲆、石斑鱼、大黄鱼等主要养殖动物中检出 (鄢庆枇等, 2006; 王晓露等, 2008; 朱苏琴等, 2012), 成为严重威胁人体健康的潜在因素之一 (周妍妍等, 2016)。因此, 如何实现该病原的快速诊断和准确鉴定, 切断该病原在养殖、流通, 以及餐桌等环节的传播, 对于维护公共卫生健康具有重要意义。基于此, 本研究选择河流弧菌的外膜蛋白ompU基因作为检测靶标, 建立了便捷易操作的LAMP-LFD技术, 特异性地应用于组织样品中河流弧菌的检测。
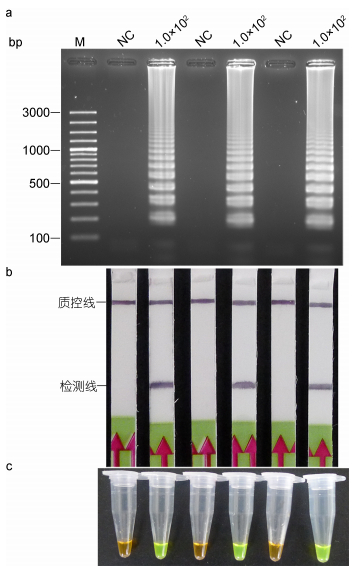 |
| 图 5 LAMP (a, c) 和LAMP-LFD (b) 的重复性试验 Fig. 5 Reproducibility of LAMP-LFD (a, c) and LAMP (b) of detection for V. fluvialis 注: M.同上图; NC:不添加任何DNA模板; 1.0×102, 最低检测浓度的河流弧菌菌液, 用于提取基因组DNA, 单位: CFU/mL |
自LAMP技术问世以来, 凭借其检测的高灵敏度、高便捷性、低设备依赖性等优点, 在微生物检测领域取得了巨大应用。本研究公布的LAMP-LFD技术, 保留了LAMP方法自有特点的基础上, 在检测便捷性、设备低依赖性等方面有了进一步提高。LAMP技术涉及的关键因素Bst DNA聚合酶可在单一温度下实现核酸的几何级数增长, 极大地降低了反应过程仪器设备的复杂度, 使得诸如恒温金属浴等简单设备都可成为反应容器, 大幅度降低仪器成本的同时, 也增加了操作的便捷性。而在LAMP产物的检测方面, 通常借助于凝胶成像系统、浊度仪, 以及荧光定量PCR仪等完成, 在仪器成本、操作便捷性方面有诸多限制; 通过添加SYBR Green I等核酸染料的方式虽然便捷, 但假阳性较高 (Borst et al, 2004)。本研究将LFD试纸条引入到LAMP产物的检测过程, 产物经约5min的探针杂交和3—5min的LFD显色, 即可判读结果, 此过程中仅需一把移液器即可完成操作, 摒弃了对于昂贵仪器的依赖, 整个产物检测在10min内即可完成, 大幅度提高了检测的便捷性和流动性, 尤其适用于基层或现场疫源地的快速检测。针对河流弧菌分子生物学检测的方法多数基于PCR的的反应原理, 从核酸扩增到利用琼脂糖凝胶电泳对扩增产物进行判读, 根据检测靶标的片段大小, 检测时程约在3h左右, 甚至更长 (Chakraborty et al, 2006; 文万侥等, 2009; Vinothkumar et al, 2013); 鄢庆枇等 (2006)建立的荧光抗体技术检测牙鲆体内河流弧菌的感染时, 整个耗时也需3h左右; 而本研究提供的LAMP-LFD技术, LAMP反应25min, 所得产物经10min左右的LFD显色过程, 整个检测时程约需35min, 耗时更短。
灵敏度是衡量核酸检测类方法的重要技术指标。文万侥等 (2009)将河流弧菌的toxR基因作为检测靶标, 建立了可特异性检测河流弧菌的PCR方法, 可从低至9.3×103 CFU/mL的菌液样品中检测到病原; Vinothkumar等 (2013)针对河流弧菌、霍乱弧菌和副溶血弧菌等3种弧菌属致病菌建立了多重PCR技术, 针对单一菌种的灵敏度为10个CFU; 鄢庆枇等 (2006)公布的荧光抗体技术能够从注射河流弧菌 (107 CFU) 24h后的牙鲆脏器中检测到该病原。本研究使用的河流弧菌LAMP-LFD技术能够从1.0×102 CFU/mL的细菌菌液或5×102 CFU/mL感染强度的组织样品中稳定检测到病原, 体现出良好的方法灵敏度。
4 结论作者在本文中以河流弧菌外膜蛋白的ompU基因为检测靶标建立了LAMP-LFD方法, 可特异性地应用于河流弧菌的检测, 并对创伤弧菌等常见的水产病原菌没有交叉反应。该方法检测用时较短, 核酸扩增仅需25min, 加之探针杂交和LFD显色, 整个时程仅需35min。该方法仍具有较高的检测灵敏度, 可达1.0×102 CFU/mL或者4CFU/反应。同时, 该方法从核酸扩增到结果展示的整个检测过程对仪器要求极其简单, 在河流弧菌的基层检测和现场快检等领域具有重要的应用潜力。
| 王晓露, 邹文政, 鄢庆枇, 等, 2008. 病原性河流弧菌对青石斑鱼体表黏液黏附特性的研究. 水产学报, 32(3): 441–447 |
| 王瑞娜, 周前进, 陈炯, 2014. 环介导等温扩增联合横向流动试纸条可视化检测海豚链球菌方法的建立. 农业生物技术学报, 22(12): 1584–1594 DOI:10.3969/j.issn.1674-7968.2014.12.014 |
| 文万侥, 谢珍玉, 徐先栋, 等, 2009. 基于toxR基因的河流弧菌PCR快速检测方法的建立. 水产科学, 28(10): 575–578 DOI:10.3969/j.issn.1003-1111.2009.10.006 |
| 朱苏琴, 纪荣兴, 苏永全, 等, 2012. 河流弧菌 (Vibrio fluvialis) 对大黄鱼 (Pseudosciaena crocea) 鳃黏液黏附特性研究. 海洋与湖沼, 43(2): 389–393 DOI:10.11693/hyhz201202030030 |
| 周妍妍, 闫东辉, 苏建荣, 2016. 临床分离河流弧菌毒力及药敏表型特征分析. 临床和实验医学杂志, 15(5): 492–495 |
| 曹际娟, 赵昕, 孙哲平, 等, 2008. PCR结合变性高效液相色谱快速检测水产品中河流弧菌. 中国卫生检验杂志, 18(11): 2187–2189 DOI:10.3969/j.issn.1004-8685.2008.11.001 |
| 鄢庆枇, 邹文政, 纪荣兴, 等, 2006. 应用荧光抗体技术检测牙鲆体内的河流弧菌. 海洋科学, 30(4): 16–19 |
| Baffone W, Citterio B, Vittoria E, et al, 2001. Determination of several potential virulence factors in Vibrio spp. isolated from sea water.Food Microbiology, 18(5): 479–488 |
| Bellet J, Klein B, Altieri M, et al, 1989. Vibrio fluvialis, an unusual pediatric enteric pathogen. Pediatric Emergency Care, 5(1): 27–28 DOI:10.1097/00006565-198903000-00008 |
| Borst A, Box A T A, Fluit A C, 2004. False-positive results and contamination in nucleic acid amplification assays:suggestions for a prevent and destroy strategy. European Journal of Clinical Microbiology and Infectious Diseases, 23(4): 289–299 DOI:10.1007/s10096-004-1100-1 |
| Chakraborty R, Sinha S, Mukhopadhyay A K, et al, 2006. Species-specific identification of Vibrio fluvialis by PCR targeted to the conserved transcriptional activation and variable membrane tether regions of the toxR gene. Journal of Medical Microbiology, 55(6): 805–808 DOI:10.1099/jmm.0.46395-0 |
| Chowdhury G, Pazhani G P, Dutta D, et al, 2012. Vibrio fluvialis in patients with diarrhea, Kolkata, India. Emerging Infectious Diseases, 18(11): 1868–1871 DOI:10.3201/eid1811.120520 |
| Ding W C, Chen J, Shi Y H, et al, 2010. Rapid and sensitive detection of infectious spleen and kidney necrosis virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Archives of Virology, 155(3): 385–389 DOI:10.1007/s00705-010-0593-4 |
| Mori Y, Kanda H, Notomi T, 2013. Loop-mediated isothermal amplification (LAMP):recent progress in research and development. Journal of Infection and Chemotherapy, 19(3): 404–411 DOI:10.1007/s10156-013-0590-0 |
| Niemz A, Ferguson T M, Boyle D S, 2011. Point-of-care nucleic acid testing for infectious diseases. Trends in Biotechnology, 29(5): 240–250 DOI:10.1016/j.tibtech.2011.01.007 |
| Puthawibool T, Senapin S, Kiatpathomchai W, et al, 2009. Detection of shrimp infectious myonecrosis virus by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. Journal of Virological Methods, 156(1-2): 27–31 DOI:10.1016/j.jviromet.2008.10.018 |
| Ramamurthy T, Chowdhury G, Pazhani G P, et al, 2014. Vibrio fluvialis:an emerging human pathogen. Frontiers in Microbiology, 5: 91 |
| Vinothkumar K, Bhardwaj A K, Ramamurthy T, et al, 2013. Triplex PCR assay for the rapid identification of 3 major Vibrio species, Vibrio cholerae, Vibrio parahaemolyticus, and Vibrio fluvialis. Diagnostic Microbiology and Infectious Disease, 76(4): 526–528 DOI:10.1016/j.diagmicrobio.2013.04.005 |
| Zhou Q J, Wang L, Chen J, et al, 2014. Development and evaluation of a real-time fluorogenic loop-mediated isothermal amplification assay integrated on a microfluidic disc chip (on-chip LAMP) for rapid and simultaneous detection of ten pathogenic bacteria in aquatic animals. Journal of Microbiological Methods, 104: 26–35 DOI:10.1016/j.mimet.2014.06.008 |
 2017, Vol. 48
2017, Vol. 48


