中国海洋湖沼学会主办。
文章信息
- 任志明, 詹萍萍, 母昌考, 李荣华, 宋微微, 杨春雷, 王春琳. 2017.
- REN Zhi-Ming, ZHAN Ping-Ping, MU Chang-Kao, LI Rong-Hua, SONG Wei-Wei, YANG Chun-Lei, WANG Chun-Lin. 2017.
- CO2驱动海洋酸化对三疣梭子蟹(Portunus trituberculatus)幼蟹甲壳结构和组成成分的影响
- OCEAN ACIDIFICATION AFFECTS CARAPACE OF CRAB PORTUNUS TRITUBERCULATUS: AN EXPERIMENT
- 海洋与湖沼, 48(1): 198-205
- Oceanologia et Limnologia Sinica, 48(1): 198-205.
- http://dx.doi.org/10.11693/hyhz20161000213
-
文章历史
- 收稿日期:2016-10-11
- 收修改稿日期:2016-10-16
2. 浙江海洋高效健康养殖协同创新中心 宁波 315211;
3. 象山鹤浦镇人民政府海洋与渔业办公室 象山 315733
2. Collaborative Innovation Center for Mariculture Industry Upgrading, Ningbo, 315211, China;
3. Ocean and Fishery Office of People's Government of Hepu, Xiangshan 315733, China
自工业革命以来,人类大量燃烧化石燃料所产生的CO2 排放至大气中,大气中约1/3 的CO2 被海洋所溶解吸收。过量溶解的CO2 破坏了海水原有的酸碱平衡,导致海水酸度增加,这种现象被称为海洋酸化(ocean acidification,OA)(Caldeira et al,2003; Doney et al,2009)。自从2003 年提出这一问题以来,已经引起世界各国的广泛关注,国内外科研工作者已经开展了广泛而深入的研究(贺仕昌等,2014; 赵信国等,2015)。
三疣梭子蟹(Portunus trituberculatus)作为我国沿海重要的水产甲壳类动物,具有很高的经济价值。海洋酸化给海洋环境带来的影响主要在于降低海水pH,扰乱海水碳酸平衡,降低碳酸钙的饱和度等(Feely et al,2004; 刘再华等,2005)。对于三疣梭子蟹来说,其甲壳的主要组成成分为甲壳素和碳酸钙(Roer et al,1984)。三疣梭子蟹一生要经历多次蜕壳,每一次蜕壳都要经历甲壳的生物钙化过程,因此,海洋酸化可能会对三疣梭子蟹的甲壳结构和组成成分产生影响。本研究通过甲壳扫描电镜观察结合甲壳素及钙镁元素含量测定方法,探讨了海洋酸化对三疣梭子蟹幼蟹甲壳结构和组成成分的影响。
1 材料与方法 1.1 材料三疣梭子蟹幼蟹取自宁波鑫亿鲜活水产有限公司,其发育阶段为幼蟹V期,C5。
各组幼蟹在实验条件下自行完成蜕壳,并待各组蜕壳为C6 期的幼蟹甲壳完全硬化后(蜕壳后48h),解剖获取各组幼蟹背甲。每组至少收集3 个背甲。
1.2 实验仪器与试剂增氧泵为惠科H8 型可充电增氧泵。CO2 加富器为青岛艾科宝生物科技有限公司生产A001 型CO2 加富器。扫描电子显微镜为日立S-3400N 型。
实验中使用的氢氧化钠、盐酸、碳酸钠、无水乙醇、叔丁醇、戊二醛、双氧水等试剂纯度均为分析纯(购自国药试剂公司)。其中,所使用的戊二醛为3%的海水稀释溶液。
1.3 实验设计本实验设置一个对照组,两个酸化胁迫组。每组设置3 个平行。对照组使用的海水为正常沙滤、漂白粉加曝气处理后充分静置的洁净海水,通有自然新鲜空气。实验组分别为OA1 组和OA2 组。OA1 组所用初始海水与对照组相同,通有经CO2 加富器混合高浓度CO2 与空气后稳定输出的混合气体,CO2 的体积分数为7.50×10-4。OA2 组通入的混合气体CO2 的体积分数为1.5×10-3。将养殖池中健康的C5 期幼蟹收集后,在洁净海水中静止培养24h,然后将幼蟹随机分配在对照组和OA1、OA2 实验组中,每组共放置18 只,连续酸化胁迫一个蜕壳周期后取样。每日傍晚投喂新鲜杂鱼肉,并及时清理残饵。
1.4 实验装置本研究所采用的实验装置为自行设计的一套实验室模拟海洋酸化系统(任志明等,2015),由实验培养箱系统,CO2 供气系统,供水系统,水体净化系统和水体加热装置组成。对照组系统与实验组系统的差别仅在于供气系统所通气体的不同。该酸化实验系统可实现长时间稳定运行,使实验所需的水体状态维持稳定,并可防止因实验个体死亡造成水体恶化,影响实验结果的可靠性。
此外,使用雷磁PHBJ-260 型便携式pH 计监测水体pH。使用FC-100 型水中二氧化碳测定仪测定水中溶解CO2 的浓度。
1.5 幼蟹甲壳表面及断面结构扫描电镜观察取蟹壳背甲鳃区部位约0.25cm2 大小较平整的甲壳,按照Chen等(2008)的方法进行处理,然后在日立S-3400N 型扫描电子显微镜上观察,记录甲壳表面及断面结构的变化情况。
1.6 幼蟹甲壳部分组成成分的测定 1.6.1 幼蟹甲壳中甲壳素含量的测定取对照组和实验组甲壳样品,分别用纯水清洗3 次,放入鼓风干燥箱中70℃充分干燥后电子天平称重并作记录。用手术剪将干燥后的甲壳破碎成小块后,放入干燥器中储存。按照李婷等人甲壳素提取制备的方法提取各组样品甲壳素(李婷等,2014)。将获得的对照组和实验组的甲壳素成品分别置于电子天平上称重。
甲壳素含量的计算公式如下: 甲壳素含量=m/M×100%,其中m 为最终获得的甲壳素质量(mg); M 为甲壳素提取前干燥甲壳的质量(mg)。
1.6.2 幼蟹甲壳中钙、镁元素含量的测定甲壳中钙、镁元素含量由青岛科标检测研究院有限公司测定完成。采用电感耦合等离子体质谱仪(Inductively coupled plasma mass spectrometry,ICP-MS 7700,美国安捷伦公司)进行元素含量测定。
1.7 数据处理与分析借助Photoshop等图像处理软件对所采集的幼蟹甲壳结构照片进行分析处理,包括甲壳厚度及结构等。运用Excel 对实验组和对照组甲壳素含量及钙元素、镁元素含量进行均值处理并比较作图。运用SPSS19.0 进行组间单因素方差(One-way ANOVA)分析酸化组和对照组间差异,P*<0.05 表示差异显著,P**<0.01 表示差异极显著。
2 结果 2.1 酸化水体pH 及水中CO2 浓度的变化自然海水经人工模拟酸化处理后,水体pH和水中CO2 浓度变化情况如表 1 所示。
| 组别 | 模拟海水CO2分压(μatm) | pH值 | 水中CO2浓度(×10-6) |
| 对照组 | 483±50 | 8.13±0.02 | 26.6±1.2 |
| OA1 | 750±50 | 7.98±0.02 | 45.2±3.6 |
| OA2 | 1500±50 | 7.75±0.03 | 79.5±4.1 |
实验水体经含有一定浓度CO2 的混合气体持续充分曝气处理后,酸化组水体pH 明显下降: 正常海水pH 为8.13±0.02,OA1 组pH 下降为7.98±0.02,OA2组pH 下降为7.75±0.03。水中CO2 浓度也明显升高,由对照组(26.6±1.2)×10-6,上升到OA1 组(45.2±3.6)×10-6,再到OA2 组(79.5±4.1)×10-6。
2.2 甲壳表面及断面结构扫描电镜观察结果经扫描电子显微镜观察并获得甲壳外表面结构图片,对比分析如图 1 所示,在甲壳表面的微刺有一定的排列规律,总体较为整齐。微刺的组合方式也有多种形式:(a)单个独立微刺,(b)2 个微刺聚集,(c)3个微刺聚集,(d)4 个微刺聚集。对照组中,单个微刺占(26.97±0.32)%,2 个微刺聚集占(33.71±0.24)%,3-4 个微刺聚集占(39.32±0.16)%。OA1 组单个微刺占(77.42±0.22)%,2 个微刺聚集占(19.35±0.13)%,3 个微刺聚集占(3.32±0.06)%,未发现4 个微刺聚集。OA2组单个微刺占(88.81±0.31)%,2 个微刺聚集占(11.19±0.16)%,未发现3 或4 个微刺聚集。
 |
| 图 1 甲壳外表面结构对比 Fig. 1 The comparison in structure of the carapacial external surface |
扫描电子显微镜观察结果表明,三疣梭子蟹具有甲壳动物典型的甲壳分层结构(图 2): 上表皮、外表皮和内表皮(Roer et al,1984)。扫描电子显微镜下对甲壳厚度进行了测量(图 3和图 4),对照组甲壳的厚度为90.20±4.85μm,OA1 组甲壳厚度为84.53±13.71μm,OA2 组甲壳厚度为61.94±13.43μm。OA1 组甲壳厚度较对照组有所降低,但无显著性差异(P = 0.453)。OA2 组甲壳的厚度极显著低于对照组(P = 0.000**)和OA1 组(P = 0.000**)。结果说明在酸化海水的影响下,三疣梭子蟹甲壳的厚度变薄,且甲壳厚度随着酸化程度的加重逐渐变薄。
 |
| 图 2 甲壳断面结构图 Fig. 2 The morphology of cross-section of the carapace |
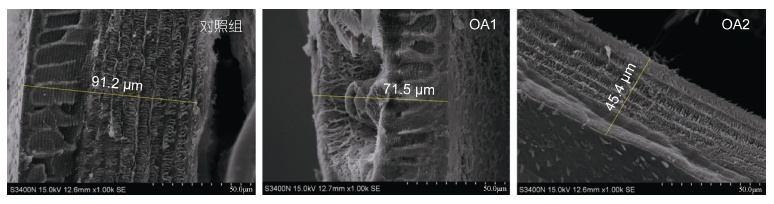 |
| 图 3 甲壳断面对比 Fig. 3 Comparison in micro-morphology of the carapace cross-section |
 |
| 图 4 甲壳厚度对比 Fig. 4 Comparison in thickness of the carapace |
通过图 5 比较对照组和实验组甲壳各壳层的厚度,发现OA1组与对照组上表皮层厚度无显著性差异,OA2组相比对照组上表皮层厚度显著降低(图 5a)。OA1 组与对照组外表皮层厚度无显著性差异,OA2 组相比对照组外表皮层厚度极显著降低(图 5b)。同时,OA1 组相比对照组内表皮层厚度显著降低,OA2 组相比对照组内表皮层厚度极显著降低(图 5c)。结果说明在高酸化程度的海水影响下,三疣梭子蟹幼蟹甲壳上表皮层、外表皮层和内表皮层厚度都有所降低,其中以对内表皮层的影响最为显著,其次是外表皮层,影响最小的是上表皮层。
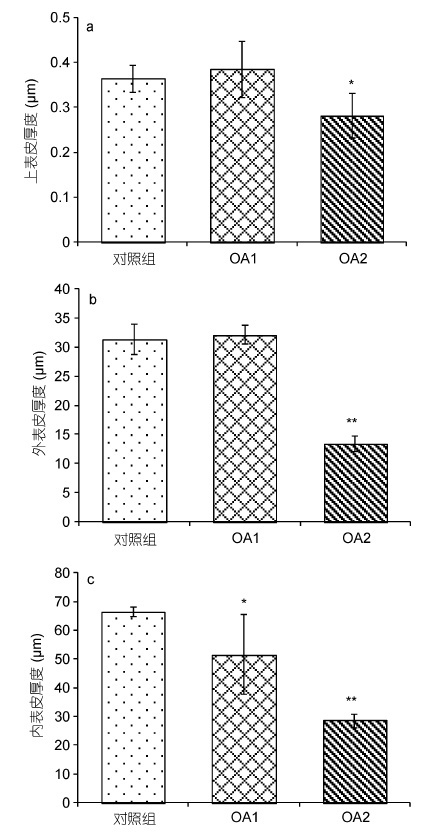 |
| 图 5 甲壳不同壳层厚度对比 Fig. 5 Comparison in thickness of different layers of the carapace 注: a 示组间甲壳上表皮层厚度比较结果; b 示组间甲壳外表皮层厚度比较结果; c 示组间甲壳内表皮层厚度比较结果 |
通过图 6 甲壳素含量对比图进行分析,可以看出在海洋酸化的影响下,两个酸化实验组(OA1和OA2)幼蟹甲壳中甲壳素含量均极显著高于对照组(P = 0.000**),而OA1 与OA2 之间无显著性差异(P = 0.248)。
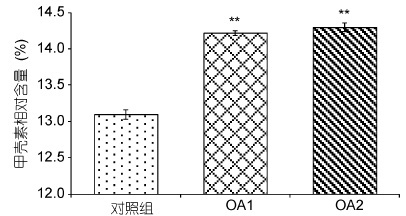 |
| 图 6 甲壳素含量对比 Fig. 6 Comparison in chitin content of the carapace |
由图 7和图 8 可以看出,在OA2 组中,幼蟹甲壳钙元素和镁元素的含量均相对于对照组有所上升,但差异不显著(P>0.05),OA1 组均无明显变化(P>0.05)。两个酸化组之间无显著性差异(P>0.05)。由图 9 可以看出,对照组的钙镁比为14.12±0.13,OA1 组和OA2 组的钙镁比分别为13.88±0.85、13.77±1.00,酸化组幼蟹甲壳钙镁比与对照组无显著性差异(P>0.05),两个酸化组之间也无显著性差异(P>0.05)。
 |
| 图 7 甲壳钙元素相对含量对比 Fig. 7 Comparison in calcium content of the carapace |
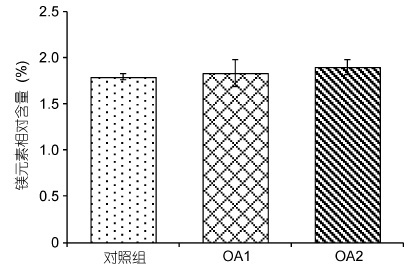 |
| 图 8 甲壳镁元素相对含量对比 Fig. 8 Comparison in magnesium content of the carapace |
 |
| 图 9 甲壳钙镁比对比 Fig. 9 Comparison in Ca/Mg ratio of the carapace |
在已有报道中,蟹类甲壳某些部位外表皮表面通常分布有微小刺状突起,一般称之为微刺,也有认为是刚毛(Watling,1989; Garm,2004)。三疣梭子蟹也不例外,在背甲上表皮的外侧有密集的微刺分布(图 1),且存在一定排列规律。在酸化海水的影响下,对照组与海洋酸化组微刺排列方式出现一定差别: 对照组中,微刺的排列组合方式中除了单个微刺(26.97±0.32)%以外,主要以2 个或3 个微刺组合的方式,占约72%以上,还发现少数4 个微刺聚集的现象。OA1 组主要为单个微刺的形式存在(77.42±0.22)%,还有少量2 个或3 个微刺聚集,未发现4 个微刺聚集。而OA2 组中微刺主要以单个微刺的形式存在(88.81±0.31)%,少量为2 个微刺组合的方式(11.19±0.16)%,未发现3 或4 个微刺聚集。海洋酸化显著地影响了甲壳外表面微刺的排列方式,酸化使微刺的排列趋于简单化。通常认为微刺不具有化学感知和机械刺激性感知的功能,而是起结构支撑和防御的功能(Watling,1989; Garm,2004),因此海洋酸化可能会减弱三疣梭子蟹甲壳结构强度和稳定性,甚至减弱对敌害生物的防御能力。
三疣梭子蟹甲壳结构主要分为: 上表皮、外表皮和内表皮(图 2)。内表皮层厚度最大,其次是外表皮,上表皮的厚度最小。甲壳主要由甲壳素、碳酸钙和蛋白质等物质组成,还由蛋白多糖、脂质及其他无机矿物等辅助组成(Nagasawa,2012)。其中,在内表皮和外表皮层,碳酸钙主要以方解石晶体的形式结合在甲壳素纤维周边,而在上表皮层碳酸钙则主要是球形方解石颗粒以脂蛋白基质包裹的形式存在(Roer et al,1984)。在外表皮和内表皮层,甲壳素-蛋白质纤维则以螺旋夹板的形式多层堆积,再结合有方解石晶体形式的碳酸钙(Chen et al,2008),从断面观察,呈规则片状结构分布(Roer et al,1984)。
本研究中,在酸化海水的影响下,高酸化程度OA2 组三疣梭子蟹幼蟹的甲壳厚度明显变薄,且与对照组存在显著性差异,中等酸化程度OA1 组甲壳的厚度有所降低,但无显著性差异(图 3 与图 4)。Taylor等(2014)的研究结果表明海洋酸化对加利福尼亚岩虾(Lysmata californica)的甲壳总厚度没有显著影响。由于物种差异,虾类甲壳要比蟹类甲壳薄很多,碳酸钙等无机矿物含量更少,甲壳素等有机物的相对含量也更高,这与其快速游动以躲避敌害生物的特性有关,因此其甲壳更为轻便(Boßelmann et al,2007)。海洋酸化对虾类与蟹类甲壳的影响存在差异,在海洋酸化影响下,虾类甲壳不易变薄,而蟹类的甲壳在酸化胁迫下可能会使碳酸钙沉积量、碳酸钙晶体构型、甲壳素纤维的排列方式等发生变化,最终导致甲壳的厚度变薄。
在本研究中,通过比较分析对照组与实验组甲壳不同壳层的厚度,结果表明高酸化程度OA2 组酸化海水会导致三疣梭子蟹幼蟹甲壳上表皮、外表皮和内表皮厚度的显著性降低。中等酸化程度OA1 组酸化海水仅显著降低了内表皮层的厚度,而对上表皮和外表皮没有显著性影响。如前面甲壳壳层组成部分的讨论,上表皮主要是由脂蛋白包裹的球形方解石颗粒组成(Roer et al,1984),且相对致密,此种碳酸钙的存在形式可能不易受到酸化的影响。而结构相对疏松的内表皮层和外表皮层,由于甲壳素纤维的排列呈疏松的蜂窝状(Raabe et al,2006),且碳酸钙呈堆积方解石晶体的形式存在(Dillaman et al,2005),导致海洋酸化对其影响更为显著。Taylor等(2014)研究表明海洋酸化对加利福尼亚虾各壳层厚度没有显著影响,这可能同样与物种差异有关。
甲壳素作为甲壳动物甲壳的主要组成成分,起到了结构支撑的重要作用,同时蛋白质、碳酸钙晶体等物质也有规律的附着在甲壳素纤维的周边,共同使甲壳表现出一定特有的物理和生理特性(Roer et al,1984)。在目前已有海洋酸化对甲壳动物的影响研究报道中,很少涉及甲壳素相对含量变化的研究。在本研究中,海洋酸化导致幼蟹甲壳中甲壳素相对含量显著升高(图 6),而Mustafa等(2015)发现海洋酸化会显著降低凡纳滨对虾(Litopenaeus vannamei)甲壳中甲壳素的含量。同时,Mustafa等(2015)认为是海洋酸化导致虾体酸中毒,显著干扰了虾体内的甲壳素合成酶、几丁质水解酶及激素等物质的平衡,在综合因素的影响下,甲壳素含量降低。由于物种差异,蟹类要比虾类具有更强的内环境调节能力(Small et al,2010),因此,三疣梭子蟹在海洋酸化的影响下,甲壳素含量的升高原因还需要进一步研究,可通过对甲壳素合成酶及几丁质水解酶基因表达的变化方面进行研究。
在海洋酸化的影响下,OA2 组中甲壳钙元素和镁元素含量较对照组均有所上升,但差异不显著。在OA1 组中,钙、镁元素含量均未出现明显变化。两个酸化组甲壳钙镁比均无明显变化。Taylor等(2014)研究发现,在酸化的影响下,加利福尼亚岩虾甲壳中钙元素含量显著升高,而镁元素含量有所上升,但无显著性差异,钙镁比则显著升高。Long等(2013b)研究了海洋酸化对堪察加拟石蟹(Paralithodes camtschaticus)和拜氏雪蟹(Chionoecetes bairdi)生物钙化的影响。结果表明海洋酸化使堪察加拟石蟹幼体钙元素含量升高,但无显著性差异; 而海洋酸化显著降低了拜氏雪蟹幼蟹甲壳的钙元素含量。此外,在Long等(2013a)更早前对堪察加拟石蟹雌性幼蟹甲壳的研究中,发现在海洋酸化条件下新形成的甲壳中,钙元素、镁元素含量低于实验初始时甲壳中的钙镁元素含量,但差异不显著,而钙镁比则显著降低(Long et al,2013a)。上述报道中,结果都表明海洋酸化会致使海洋甲壳动物甲壳中钙、镁元素含量及钙镁比在不同物种中出现不同程度的上升或下降的变化,存在明显的物种差异。Ries(2011)认为酸化海水中,过量溶解的CO2 与蟹类内在生物钙化的过程相作用,共同导致了在酸化海水环境中形成的甲壳钙元素含量升高。因为蟹类在生物钙化过程中,会提高钙化位置的pH,这就致使碳酸钙的大量沉积,钙化率提高(Small et al,2010)。对于这一观点,Pane等(2007)的研究表明许多蟹类(如: 首黄道蟹Metacarcinus magister)可以比其他海洋钙化生物更好地调节体内pH。同时,甲壳中高钙元素沉积与生物体中钙化有关的基因表达有一定关联(Todgham et al,2009)。
钙元素在甲壳中主要以碳酸钙的形式存在,而镁元素在甲壳中的存在形式及作用还不完全明确,有研究认为镁元素是以碳酸镁的形式作为钙元素的替代物存在于甲壳中(Andersson et al,2008)。目前,普遍认为钙镁比对甲壳的强度存在比例对应的关系,比如低钙镁比会使甲壳的强度增加(Magdans et al,2004)。而本研究中的钙镁比基本没有变化,这与酸化对蓝蟹(Callinectes sapidus)、美国龙虾(Homarus americanus)等甲壳类生物影响的研究中钙镁比无明显变化的结果相近(Ries,2011)。
4 结论综上所述,本研究发现海洋酸化对三疣梭子蟹幼蟹的甲壳结构和部分组成成分具有一定影响,具体表现在:(1)在海洋酸化的影响下,三疣梭子蟹幼蟹甲壳上表皮的外表面微刺排列趋于简单化,对甲壳结构强度和抵御敌害方面可能会产生一定消极影响;(2)在海洋酸化的影响下,三疣梭子蟹幼蟹的甲壳厚度变薄,并且有随海洋酸化程度的加重甲壳厚度变得更薄的趋势;(3)在海洋酸化的影响下,三疣梭子蟹幼蟹甲壳中甲壳素含量显著上升,可能与甲壳素合成酶、几丁质水解酶及激素的合成水平变化有关;(4)海洋酸化对三疣梭子蟹幼蟹的甲壳钙镁元素含量的影响较小。
| 任志明, 母昌考, 王春琳等, 2015. 一种实验室模拟海洋酸化系统:中国, CN104663560A. 2015-06-03 |
| 刘再华, DreybrodtW, 韩军, 2005. CaCO3-CO2-H2O岩溶系统的平衡化学及其分析. 中国岩溶, 24 (1) : 1–14 |
| 李婷, 胡小喜, 周幸芝, 等, 2014. 从虾蟹壳中提取甲壳素的研究进展. 食品工业, 35 (6) : 209–212 |
| 赵信国, 刘广绪, 2015. 海洋酸化对海洋无脊椎动物的影响研究进展. 生态学报, 35 (7) : 2388–2398 |
| 贺仕昌, 张远辉, 陈立奇, 等, 2014. 海洋酸化研究进展. 海洋科学, 38 (6) : 85–93 |
| Andersson A J, Mackenzie F T, Bates N R, 2008. Life on the margin:implications of ocean acidification on mg-calcite, high latitude and cold-water marine calcifiers. Marine Ecology Progress Series, 373 : 265–273 DOI:10.3354/meps07639 |
| Boßelmann F, Romano P, Fabritius H, et al, 2007. The composition of the exoskeleton of two crustacea:the American lobster Homarus americanus and the edible crab Cancer pagurus. Thermochimica Acta, 463 (1-2) : 65–68 DOI:10.1016/j.tca.2007.07.018 |
| Caldeira K, Wickett M E, 2003. Oceanography:anthropogenic carbon and ocean pH. Nature, 425 (6956) : 365 DOI:10.1038/425365a |
| Chen P Y, Lin A Y M, McKittrick J, et al, 2008. Structure and mechanical properties of crab exoskeletons. Acta Biomaterialia, 4 (3) : 587–596 DOI:10.1016/j.actbio.2007.12.010 |
| Dillaman R, Hequembourg S, Gay M, 2005. Early pattern of calcification in the dorsal carapace of the blue crab, Callinectes sapidus. Journal of Morphology, 263 (3) : 356–374 DOI:10.1002/(ISSN)1097-4687 |
| Doney S C, Tilbrook B, Roy S, et al, 2009. Surface-ocean CO2 variability and vulnerability. Deep Sea Research Part II:Topical Studies in Oceanography, 56 (8-10) : 504–511 DOI:10.1016/j.dsr2.2008.12.016 |
| Feely R A, Sabine C L, Lee K, et al, 2004. Impact of anthropogenic CO2 on the CaCO3 system in the oceans. Science, 305 (5682) : 362–366 DOI:10.1126/science.1097329 |
| Garm A, 2004. Revising the definition of the crustacean seta and setal classification systems based on examinations of the mouthpart setae of seven species of decapods. Zoological Journal of the Linnean Society, 142 (2) : 233–252 DOI:10.1111/zoj.2004.142.issue-2 |
| Long W C, Swiney K M, Foy R J, 2013a. Effects of ocean acidification on the embryos and larvae of red king crab, Paralithodes camtschaticus. Marine Pollution Bulletin, 69 (1-2) : 38–47 DOI:10.1016/j.marpolbul.2013.01.011 |
| Long W C, Swiney K M, Harris C, et al, 2013b. Effects of ocean acidification on juvenile red king crab (Paralithodes camtschaticus) and Tanner crab (Chionoecetes bairdi)growth, condition, calcification, and survival. PLoS One, 8 (4) : e60959 DOI:10.1371/journal.pone.0060959 |
| Magdans U, Gies H, 2004. Single crystal structure analysis of sea urchin spine calcites:systematic investigations of the Ca/Mg distribution as a function of habitat of the sea urchin and the sample location in the spine. European Journal of Mineralogy, 16 (2) : 261–268 DOI:10.1127/0935-1221/2004/0016-0261 |
| Mustafa S, Kharudin S N, Kian A Y S, 2015. Effect of simulated ocean acidification on chitin content in the shell of white shrimp, Litopenaeus vannamei. Journal of Fisheries Sciences Com, 9 (2) : 6–9 |
| Nagasawa H, 2012. The crustacean cuticle:structure, composition and mineralization. Frontiers in Bioscience, 4 : 711–720 |
| Pane E F, Barry J P, 2007. Extracellular acid-base regulation during short-term hypercapnia is effective in a shallow-water crab, but ineffective in a deep-sea crab. Marine Ecology Progress Series, 334 : 1–9 DOI:10.3354/meps334001 |
| Raabe D, Romano P, Sachs C, et al, 2006. Microstructure and crystallographic texture of the chitin-protein network in the biological composite material of the exoskeleton of the lobster Homarus americanus. Materials Science and Engineering:A, 421 (1-2) : 143–153 DOI:10.1016/j.msea.2005.09.115 |
| Ries J B, 2011. Skeletal mineralogy in a high-CO2 world. Journal of Experimental Marine Biology and Ecology, 403 (1-2) : 54–64 DOI:10.1016/j.jembe.2011.04.006 |
| Roer R, Dillaman R, 1984. The structure and calcification of the crustacean cuticle. American Zoologist, 24 (4) : 893–909 DOI:10.1093/icb/24.4.893 |
| Small D, Calosi P, White D, et al, 2010. Impact of medium-term exposure to CO2 enriched seawater on the physiological functions of the velvet swimming crab Necora puber. Aquatic Biology, 10 (1) : 11–21 DOI:10.3354/ab00266 |
| Taylor J R A, Gilleard J M, Allen M C, et al, 2014. Effects of CO2-induced pH reduction on the exoskeleton structure and biophotonic properties of the shrimp Lysmata californica. Scientific Reports, 5 : 10608 |
| Todgham A E, Hofmann G E, 2009. Transcriptomic response of sea urchin larvae Strongylocentrotus purpuratus to CO2-driven seawater acidification. Journal of Experimental Biology, 212 (16) : 2579–2594 DOI:10.1242/jeb.032540 |
| Watling L, 1989. A classification system for crustacean setae based on the homology concept. In:Felgenhauer B E, Watling L, Thistle A B eds. Functional Morphology of Feeding and Grooming in Crustacean. Rotterdam, the Netherlands, 15-26 |
 2017, Vol. 48
2017, Vol. 48


