中国海洋湖沼学会主办。
文章信息
- 王庆恒, 张家炜, 郝瑞娟, 黄荣莲, 杜晓东. 2017.
- WANG Qing-Heng, ZHANG Jia-Wei, HAO Rui-Juan, HUANG Rong-Lian, DU Xiao-Dong. 2017.
- 光裸星虫体腔液中卵子发生的超微结构
- ULTRASTRUCTURE OF OOGENESIS IN COELOMIC FLUID OF SIPUNCULUS NUDUS
- 海洋与湖沼, 48(1): 57-66
- Oceanologia et Limnologia Sinica, 48(1): 57-66.
- http://dx.doi.org/10.11693/hyhz20160600123
-
文章历史
- 收稿日期:2016-06-12
- 收修改稿日期:2016-10-11
光裸星虫(Sipunculus nudus)又名裸体方格星虫,为星虫动物门习见种,广泛分布于热带、亚热带和温带的海洋潮间带沿岸至30m 水深的海域,是华南地区重要的海珍品之一,具有很高的经济价值。近年来,光裸星虫已逐渐成为北部湾沿岸地区海水养殖新品种,人工增养殖技术研究涉及繁殖周期(郭学武等,1993)、亲体培育(邹杰等,2010)、苗种培育(蒋艳等,2010)、饵料开发(张琴等,2012)、机械化采捕(陈振国等,2015)等各个环节。目前,光裸星虫的基础生物学研究相对薄弱。
配子发生是动物繁殖生物学研究的重要内容,对配子发生规律和结构特征的认识有助于提高生产上的亲体促熟与催产技术水平。星虫动物的配子发生过程比较特别,发生早期就从生殖腺排放到体腔,在体腔液中游离发育至成熟。星虫动物部分物种的卵子发生已见研究报道。Gonse(1956)、Sawada(1975)分别用光镜和电镜观察了普通戈芬星虫(Golfingia vulgaris)和戈芬星虫(lkedai)体腔中的卵细胞发育过程,分为6 个和5 个不同发育时期。Rice(1974,1988,1989); Rice等(2012)在多种星虫动物配子形态、胚胎发育方面做了大量工作,并报道了光裸星虫成熟卵子的显微和超微结构; 研究表明,星虫动物多为雌雄异体,不同物种卵子的形态、大小、卵膜结构、胚胎发育过程等方面存在明显差异。兰国宝等(2002)报道光裸星虫卵细胞分期成熟,分批产卵,在广西海区的繁殖期为4-9 月,繁殖盛期为5-8 月。王庆恒等(2005)利用石蜡切片观察了光裸星虫卵子发生的显微结构,将卵母细胞发育划分为小生长期、大生长期、成熟前期和成熟期4 个阶段。顾晓英等(2009)报道,可口革囊星虫(Phascolosoma esculenta)卵子发生过程可划分为6 个阶段,卵母细胞无滤泡膜,生发泡破裂是成熟的标志。竺俊全等(2012)研究发现可口革囊星虫卵母细胞的卵黄发生途径包括线粒体、内质网、高尔基体等细胞器演变成卵黄粒以及吞饮作用形成卵黄粒,卵黄膜由卵母细胞自体形成,由纤维层、致密层、粒状突层及外膜构成。但是尚未有光裸星虫卵子发生过程的超微结构观察的详尽报道。本研究利用透射和扫描电镜技术观察了光裸星虫卵子发育过程中的超微结构的变化,旨在积累光裸星虫卵子发生的细胞学资料,为探究光裸星虫卵子发生机制,以及生殖调控与人工繁殖技术研究提供理论参考。
1 材料与方法 1.1 实验材料实验用光裸星虫采集自广东海洋大学东海岛海洋生物研究基地。活体带回实验室后置于30L 底部铺有8cm 细沙的塑料水槽中,在盐度为30 的海水中,不投饵、微充气条件下暂养24h,选择钻沙有力、体表无损伤的健康个体用于实验。
1.2 实验方法先用过滤海水清洗光裸星虫体表沙粒。然后用5mL 无菌注射器吸取3mL2.5%戊二醛后,抽取2mL星虫体腔液并转移至离心管中,加入5mL2.5%戊二醛预固定; 光学显微镜下镜检体腔液中的生殖细胞进行雌雄鉴定; 将预固定20min 后的雌性生殖细胞转移至2.5%戊二醛中继续固定40min; 0.1mol/L 磷酸缓冲液洗涤3 次; 1%锇酸固定45min,0.1mol/L 磷酸缓冲液洗涤3 次; 50%-100%乙醇逐级脱水后,将沉淀细胞分为两部分。一部分细胞以叔丁醇替代乙醇,JFD-310 真空冷冻仪干燥5min,JFC-1600 离子溅射仪中表面镀膜180s,JSM-6300 LV 扫描电子显微镜观察、拍照。另一部分细胞以环氧丙烷为过渡剂,Epon812 包埋; Leica EM UC7 超薄切片机切片; 2%醋酸双氧铀(15-20min)和3.52%柠檬酸铅(10min)双染色; JEM-1400 透射电子显微镜观察、拍照。利用电镜成像系统软件进行细胞直径、卵黄膜厚度等长度测量,测量5 次后取平均值。
2 结果光裸星虫体腔液中可见到游离发育的卵原细胞和卵母细胞。根据卵母细胞细胞器及细胞核的形态、卵黄发生情况、卵膜结构变化等特征,可将卵母细胞的发育分为卵黄形成前期、卵黄形成初期、卵黄旺盛合成期和成熟期4 个阶段。
2.1 卵原细胞光裸星虫卵原细胞呈卵圆形或近圆形,长径约9-11μm,短径为7-9μm,表面有皱褶(图 1a); 核质比大,核呈卵圆形或近圆形,长径约5-6μm,短径约4-5μm,核膜平滑,核孔很少; 核内染色质聚集为粗大颗粒沿核膜分布或在核内分散分布; 核仁小,1 个,中位或偏位(图 1b)。细胞质较少,细胞器不发达,可见少量线粒体、高尔基体和内质网。线粒体近圆形,嵴少,呈空泡状; 高尔基体不发达,膜囊数量少; 有少量囊泡状光面内质网和粗面内质网(图 1c)。
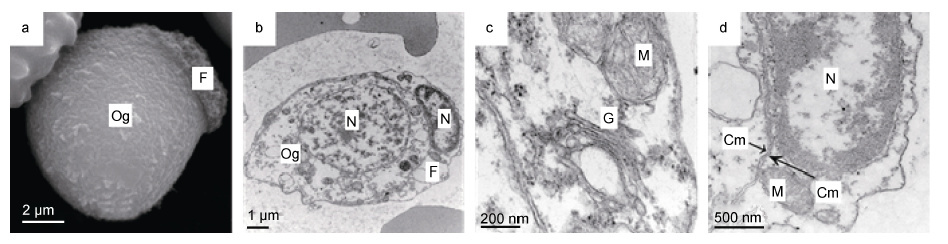 |
| 图 1 光裸星虫卵原细胞及滤泡细胞 Fig. 1 The oogonium and follicular cells of S. nudus 注: 子图a: 卵原细胞,长径和短径分别为9.7μm和8.6μm; 滤泡细胞,长径和短径分别为5.9μm和1.3μm。b: 卵原细胞与滤泡细胞,示细胞核。c: 卵原细胞局部,示线粒体和高尔基体。d: 滤泡细胞局部,示细胞核、线粒体、卵原细胞与滤泡细胞质膜紧密相贴。图中字符Cm: 细胞膜; F: 滤泡细胞; G: 高尔基体; M: 线粒体; N: 细胞核; Og: 卵原细胞 |
卵原细胞外附有1-2 个滤泡细胞。滤泡细胞呈扁盘状,表面有大量皱褶(图 1a); 核质比很大,细胞核扁盘状,占据细胞大部分体积,长径约为短径的3倍,核内染色质电子密度高,沿核膜聚集分布; 细胞质薄而延展,有少量线粒体、内质网等细胞器(图 1b、d)。滤泡细胞和卵原细胞的质膜紧密相贴(图 1d)。
2.2 卵黄形成前期卵母细胞卵黄形成前期卵母细胞呈圆形或近圆形,直径约10-25μm(图 2a),但核质比减小(图 2b),细胞核圆,中位或稍偏位; 核膜平滑,染色质为细小颗粒状,分散分布在细胞核中; 具1 个明显的核仁,偏位或中位(图 2b); 核孔增多,高电子密度的核仁外排物通过核孔进入细胞质(图 2c)。细胞质中尚未明显积累卵黄,游离核糖体较多,粗面内质网、线粒体和高尔基体数量有所增加。
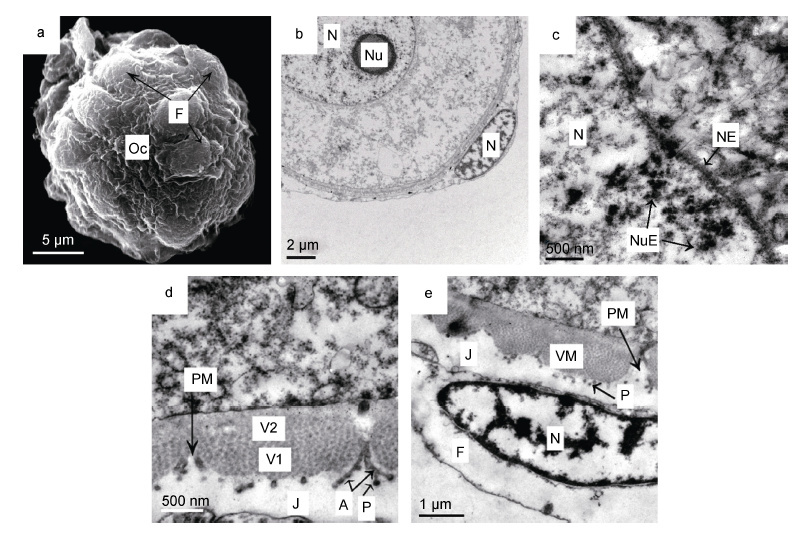 |
| 图 2 光裸星虫卵黄形成前期卵母细胞 Fig. 2 The oocyte in the pre-vitellogenic stage of S. nudus 注: 子图a: 卵黄形成前期卵母细胞,直径为20.9μm,示滤泡细胞。b: 卵黄形成前期卵母细胞和滤泡细胞,示卵母细胞核、核仁。c: 卵黄形成前期卵母细胞核膜与核仁外排物。d: 卵黄膜由颗粒层和均质层构成; 颗粒层表面有电子密度很高的粒状突,卵黄膜孔侧壁形成分支状结构连接粒状突。e: 滤泡细胞,示细胞核,滤泡细胞与卵黄膜间有胶质膜形成。图中字符A: 分支状连接结构; J: 胶质膜; Nu: 核仁;NE: 核膜; NuE: 核仁外排物; Oc: 卵母细胞; P: 粒状突; PM: 卵黄膜微孔; VM: 卵黄膜; V1: 卵黄膜外层(颗粒层); V2: 卵黄膜中层(均质层) |
卵母细胞质膜外开始形成卵黄膜,分为两层: 外层为颗粒层,具有密集的中等电子密度的颗粒,颗粒直径约为50nm,颗粒层表面分布有电子密度很高的不连续的粒状突; 内层为疏松层,呈电子密度较低的均质结构(图 2d)。初始时,颗粒层先于均质层增厚,达到600-700nm 时,不再生长; 疏松层开始很薄,但在发育过程中可不断增厚并发生结构变化。卵黄膜遍布微孔,微孔为漏斗状,侧壁在卵黄膜外表面一端形成树枝状分支连接粒状突(图 2d)。
随着卵母细胞的生长,滤泡细胞分裂增殖,数量逐渐增多,包裹在卵母细胞外形成疏松的单层滤泡膜(图 2a)。滤泡细胞形态无明显变化,染色质沿核膜或在核内聚集分布(图 2b、e)。滤泡细胞与卵黄膜间形成电子密度极低的胶质膜(图 2d、e),可随卵子发育而逐渐增厚。胶质膜有弱黏性。
2.3 卵黄形成初期卵母细胞卵母细胞直径增大至25μm 左右开始进入卵黄形成初期(图 3a),由于胶质膜易于破裂,扫描电镜下,卵黄膜上的微孔清晰可见(图 3b),卵质中出现少量卵黄粒(图 3c)。卵黄膜增厚至1.5-4μm,其中,颗粒层厚度基本保持不变; 均匀层增厚明显(图 3d)。微孔外侧开口扩大,使卵黄膜膜孔处的切面呈“山丘”状,粒状突明显,膜孔侧壁的分支连接结构增粗(图 3e)。滤泡细胞仍然为单层,细胞质中可见少量线粒体、内质网、高尔基体等细胞器。由于胶质膜有所增厚,滤泡细胞与卵黄膜间距离加大(图 3d)。
 |
| 图 3 光裸星虫卵黄形成初期卵母细胞及其卵膜 Fig. 3 The oocyte and envelope in the primary vitellogenic stage of S. nudus 注: 子图a: 卵黄形成初期卵母细胞,直径为35.5μm,示滤泡细胞、胶质膜和卵黄膜。b: 卵黄膜微孔,微孔开口平均直径300 nm。c: 卵黄形成初期卵母细胞,示滤泡细胞、胶质膜和卵黄膜,胞质内有零星卵黄粒形成。d: 卵黄膜颗粒层厚650-700nm,均质层厚1000-1100nm,示胶质膜、滤泡细胞。e: 卵黄膜孔侧壁的分支状连接结构增粗。图中字符Y: 卵黄粒 |
卵母细胞核增大,位于细胞中部; 核仁大,偏位;部分染色质形成高电子密度的团块散布于核内; 核膜不平整,形成多个突起伸入细胞质区域,核周池明显,核仁外排物明显增多(图 4a、b)。细胞质中游离核糖体丰富,颗粒增大,常形成多聚核糖体; 粗面内质网发达,呈囊泡状,上面密布核糖体; 偶见光面内质网形成不规则的多片层结构; 高尔基体膜囊和分泌泡的数量均明显增加; 线粒体数量多,部分线粒体嵴短少,呈空泡状(图 4b、c); 细胞质中常见髓样小体(图 4e)。
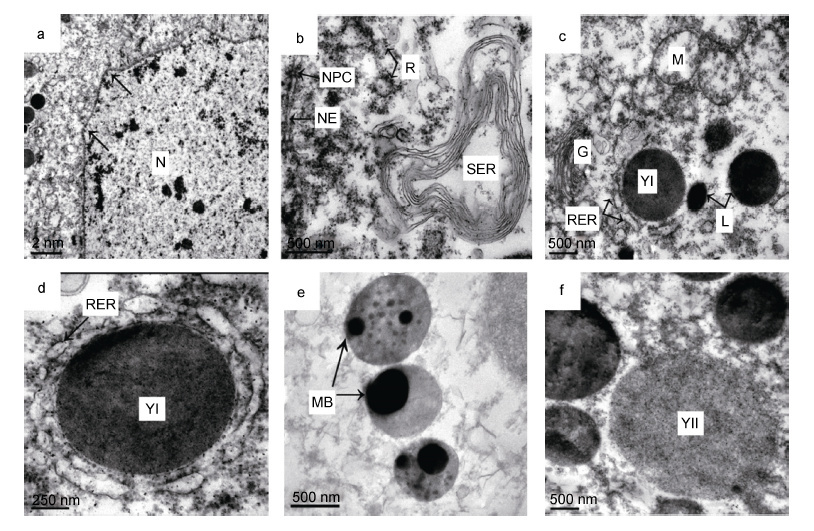 |
| 图 4 光裸星虫卵黄形成初期卵母细胞的细胞器和卵黄 Fig. 4 The organelle and yolk of oocyte in the primary vitellogenic stage of S. nudus 注: 子图a: 卵黄形成初期卵母细胞局部,示细胞核及核膜突起。b: 光面内质网形成的多片层结构、核膜和核孔复合体。c: 细胞质局部,示高尔基体、粗面内质网、溶酶体、线粒体和I 型卵黄粒。d: 被粗面内质网包围的I 型卵黄粒。e: 髓样小体。f: II 型卵黄粒。图中字符L: 溶酶体; MB: 髓样小体; NPC: 核孔复合体; R: 核糖体; RER: 粗面内质网; SER: 光面内质网; YI: I 型卵黄; YII: II 型卵黄 |
根据电子密度的差异可将卵黄粒分为2 种类型。其中,I 型卵黄电子密度高,有单层膜包裹,始终保持圆形或椭圆形结构,周围常伴有大小不等的囊泡状粗面内质网(图 4c),甚至被粗面内质网包围(图 4d)。II 型卵黄粒电子密度中等,形态为近圆形(图 4f)。卵黄发生初期,卵母细胞胞质中主要合成I 型卵黄粒。
2.4 卵黄旺盛合成期的卵母细胞卵母细胞直径增大至40μm 左右时开始大量积累卵黄,进入卵黄旺盛合成期。细胞直径迅速扩大,在制样过程中胶质膜因脱水等操作而发生显著的收缩并易于破裂、脱落(图 5a、b),卵黄膜膜孔的膜外开口明显扩大(图 5c、d)。卵黄膜逐渐增厚至4-8μm,超微结构也发生改变: 均质层密度发生变化,形成很多基本平行于卵子表面的纤维(图 5e),并逐渐加粗(图 5f)。在纤维层与卵子质膜之间出现致密的卵黄膜内层,电子密度很高,多在膜孔末端开始形成(图 5e),厚度可达2-2.5μm(图 5f)。此时,卵黄膜由外向内分为外层(颗粒层)、中层(纤维层)和内层(致密层)。卵黄膜微孔的开口逐渐增大,微孔通道横切面显示,通道由多个低电子密度的近圆形区域围成一圈,构成环状结构,每个圆形区域中央有1 个电子密度很高的核心区;在环状结构内外两侧是卵黄膜外层颗粒(图 5g)。
 |
| 图 5 光裸星虫卵黄旺盛合成期卵母细胞及其卵膜 Fig. 5 The oocyte and envelope in the active vitellogenic stage of S. nudus 注: 子图a:卵黄旺盛合成期初期的卵母细胞,直径50μm,胶质膜发生较多破裂。b: 卵黄旺盛合成期后期的卵母细胞,直径130μm,胶质膜易于脱落。c: 图a 卵黄膜局部放大,膜孔开口平均直径375nm。d: 子图b 卵黄膜局部放大,膜孔开口平均直径1.7μm。e: 卵黄旺盛合成期中期卵母细胞,卵黄膜中层增厚约6μm 并出现纤维化,开始形成高电子密度的卵黄膜内层。f: 卵黄旺盛合成期后期卵母细胞,卵黄膜内层厚达2.8-4.4μm,中层明显纤维化,示卵母细胞质膜。g: 微孔通道横切面,有多个低电子密度的近圆形区域围成一圈,构成环状结构,每个圆形区域中央有1 个电子密度很高的核心区。图中字符V3: 卵黄膜内层(致密层) |
卵母细胞核膜不平整,有多个突起伸入胞质区域,核内具1 个粗大的核仁,在核膜附近区域常见核仁外排物(图 6a)。高尔基体数量很多,部分成对出现,扁平膜囊数量多,附近有大量分泌泡(图 6b); 线粒体显著增加,常聚集在一起,部分线粒体呈杆状(图 6c)。
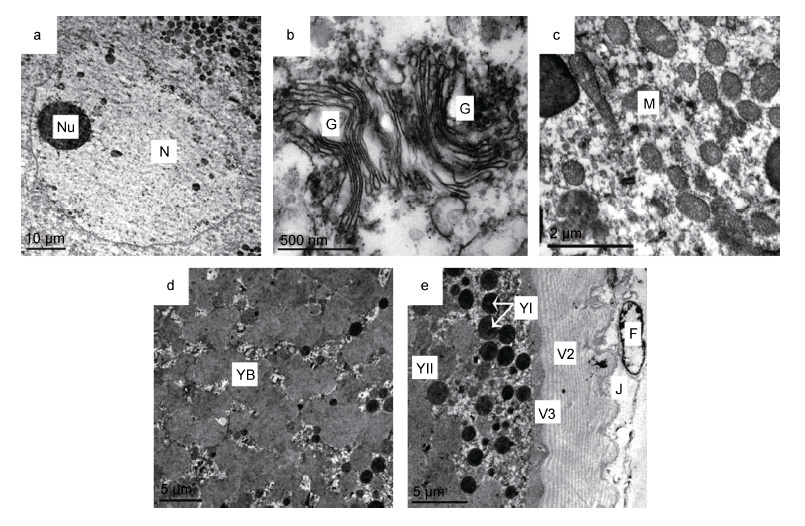 |
| 图 6 光裸星虫卵黄形成初期卵母细胞的细胞器和卵黄 Fig. 6 The organelle and yolk of oocyte in the active vitellogenic stage of S. nudus 注: 子图a: 卵黄旺盛合成期卵母细胞局部,示细胞核、核仁,近核区域尚未被卵黄占据。b: 成对出现的高尔基体。c: 大量聚集出现的线粒体。d: II 型卵黄粒融合为大块的无定形卵黄块。e: I 型卵黄粒被挤压至卵质边缘区域,但不发生融合。图中字符YB: 卵黄块 |
II 型卵黄粒数量迅速增加,并不断融合为大块的无定形卵黄块(图 6d); I 型卵黄粒逐渐被挤压至卵质边缘区域,但不发生融合,也不与II 型卵黄粒融合(图 6e)。初期,卵黄粒的分布不均匀,近核区域卵黄粒较少(图 6a); 随着发育进行,近核区域也逐渐被卵黄粒填满。
2.5 成熟期的卵母细胞卵母细胞直径约为160μm 左右时发育成熟。成熟卵母细胞的胶质膜可厚达20-25μm,但最终将和滤泡细胞一起脱落; 胶质膜已脱落的成熟的卵母细胞经后肾管收集,排放到海水中可进行受精。电镜制样过程中,胶质膜极易破裂脱落,暴露出卵黄膜(图 7a),卵黄膜膜孔开口可达2-2.5μm(图 7c)。细胞核仍然可见,但核膜突起逐渐回缩,核仁外排物少见(图 7b)。卵黄膜增厚至9-12μm,中层的纤维数量增至20 余条(图 7d、e),每条纤维由大量高电子密度的短棒状结构平行排列而构成(图 7f); 内层厚度不均,甚至局部减小(图 7d)或消失(图 7e)。
 |
| 图 7 光裸星虫成熟期卵母细胞 Fig. 7 The oocyte in the maturation stage of S. nudus 注: 子图a: 成熟的卵母细胞,直径160μm。b: 成熟卵母细胞局部,示细胞核,核膜突起已回缩,胞质中近核区域已全部被II 型卵黄块填充。c: 子图a 局部放大,卵膜孔直径平均2μm。d: 成熟卵母细胞局部,示卵黄膜中层明显纤维化,内层变薄。e: 成熟卵母细胞局部,卵黄膜内层消失。f: 卵黄膜中层纤维,示每条纤维均由大量近平行排列的短棒状结构形成。g: 走向凋亡的滤泡细胞 |
滤泡细胞核逐渐发生缢缩,染色质固缩并集聚在核膜下,走向凋亡(图 7g)。
3 讨论 3.1 卵子发生过程中细胞器的变化特点及其作用无脊椎动物的卵黄可分为内源性卵黄与外源性卵黄。其中,前者主要在卵黄发生早期,由卵母细胞自身的细胞器合成。已有研究指出,线粒体、内质网、溶酶体等细胞器均可以通过物质积累转变为内源性卵黄粒。顾海龙等(2013)报道泥蚶(Tegillarca granosa)卵黄合成中线粒体和内质网最重要,高尔基体也参与形成卵黄。朱冬发等(2006)报道内质网是东方扁虾最重要的内源性卵黄合成胞器,未观察到高尔基体液泡参与卵黄粒或脂滴的形成。姜永华等(2005)认为囊泡状粗面内质网是凡纳滨对虾(Litopenaeus vannamei)卵黄合成中最主要的细胞器,高尔基体不直接形成卵黄粒。吴明灿等(2015)则认为高尔基体、线粒体和核糖体是糙海参(Holothuria scabra)主要的内源性卵黄合成细胞器。
本研究发现,光裸星虫卵母细胞发育过程中,游离核糖体是最早大量增加的细胞器。从功能分析,这些快速增加的核糖体的合成产物除了形成内源性卵黄以外,也为细胞内膜系统的增加奠定基础。进入卵黄形成初期后,卵母细胞中溶酶体数量明显增多; 而首先形成的I 型卵黄粒具有单层膜包裹,电子密度和形态均与溶酶体相似。因此,推测I 型卵黄粒由溶酶体演变形成,是内源性卵黄。粗面内质网不直接转变为卵黄粒,而是围绕在I 型卵黄粒周围,为其生长提供卵黄蛋白等营养物。在卵黄积累过程中,线粒体数量明显增加,尽管有部分线粒体呈空泡状,但未观察到线粒体基质中电子密度明显增大、积累大量沉积物的现象,因此,光裸星虫线粒体只是为细胞代谢提供能量,间接参与卵黄形成,而不直接转变为卵黄粒。光裸星虫卵母细胞的细胞质中没有明显的脂滴形成,但在卵黄旺盛合成期,细胞中的高尔基体及其分泌囊泡数量明显增加,基于高尔基体功能的复杂性和多样性,推测高尔基体可能在多个方面参与了光裸星虫卵母细胞发育,包括内膜系统驻留蛋白合成、膜脂合成、膜蛋白糖基化等。
本研究发现,光裸星虫卵母细胞直径达到40μm 以上时,II 型卵黄快速增加,未观察到II 型卵黄与细胞器之间的密切联系,推测II 型卵黄主要属于外源性卵黄。光裸星虫身体结构简单,脏器皆浸浴在体腔液中,仅有消化道和后肾管,无肝胰脏等器官; 另一方面,如后文所述,光裸星虫滤泡细胞缺乏物质合成与分泌能力,而是发挥选择性吸收和转运作用。因此,光裸星虫外源性卵黄前体物质可能由肠道分泌到体腔液中。这与双壳类的外源性卵黄来源于消化腺(曾志南等,1991; 应雪萍,2002; 顾海龙等,2013)及甲壳类外源性卵黄可能来源于肝胰腺(堵南山等,1999)或是滤泡细胞(洪水根,1992)不同。操向文等(2009)利用石蜡切片观察发现,光裸星虫肠壁薄,浆膜层有大量圆形的颗粒细胞,这些颗粒细胞在释放了胞质颗粒后呈空泡状。某些类型的颗粒细胞的分泌活动是否与外源性卵黄的合成有关值得深入研究。
与光裸星虫不同,可口革囊星虫卵黄卵黄旺盛合成期卵母细胞中有大量脂滴(竺俊全等,2012)。类似的近缘物种卵子物质积累的差异在甲壳动物中已有报道。杨筱珍等(2009)比较发现,三疣梭子蟹(Portunus trituberculatus)和中华绒螯蟹(Eriocheir sinensis)卵母细胞中存在大量脂滴,但日本新糠虾(Neomysis japonica)卵子中却没有脂滴分布。研究表明,甲壳动物卵母细胞的脂滴主要由中性脂构成,胚胎发育过程较长的物种的卵母细胞含有较多中性脂(成永旭等,1999)。在28-29℃ 条件下,可口革囊星虫胚胎发育时间为45h30min(金春华等,2011),光裸星虫胚胎发育时间为38-40h(兰国宝等,2003),胚胎发育时间的差异可能与卵母细胞中脂滴(中性脂)积累存在相关性,但需要更多研究证据。
3.2 卵子发生过程中卵膜结构变化特点及其作用已知的星虫动物卵子均具有厚而分层的卵黄膜,并有很多卵膜孔。本研究发现,光裸星虫卵母细胞的卵黄膜分为三层。其中,中层为卵黄膜的主体,初始时为低电子密度的均质结构,很薄,在卵母细胞的发育过程中不断增厚,可达9-12μm,并不断发生纤维化,形成20 余条基本平行于卵子质膜表面的粗大纤维。作者认为,这种较厚而致密的卵黄膜有助于卵母细胞缓冲机械压力,是星虫动物对卵子游离发育方式的一种保护性适应; 卵膜孔作为外源性物质进入卵母细胞的通道,可解决较厚的卵黄膜与大量营养物质跨卵黄膜运输的矛盾。竺俊全等(2012)认为可口革囊星虫成熟卵母细胞的卵膜孔未关闭,体腔液中的营养物质仍可通过微孔进入卵内。此外,作者在胚胎发育观察中发现,光裸星虫卵膜孔与原肠胚体表纤毛形成存在相关性(另文发表)。
与大多数星虫卵母细胞卵黄膜裸露不同,光裸星虫卵黄膜外具有一层透明的胶质膜。兰国宝等(2002)显微观察认为,光裸星虫卵细胞直径在70μm 以上时,胶质膜开始形成。本研究超微结构观察发现,胶质膜在卵母细胞卵黄形成前(小于25μm)已经开始形成,研究手段分辨率的显著差异是造成本研究与上述报道结果不一致的主要原因。正常卵母细胞的胶质膜可厚达20-25μm,电子密度极低,呈完全的“透明”状,没有可见的精细结构,显然这同样在增强对卵子物理保护的同时利于物质的运输。另一方面,胶质膜具有黏性,推测含有较多的粘多糖,是否存在对卵母细胞的化学保护功能还有待深入研究。
水生生物卵母细胞外常见滤泡细胞,这些滤泡细胞(或其分化细胞)大多具有分泌功能。例如,哲罗鱼(Hucho taimen)部分滤泡细胞在卵母细胞发育到IV时相分化为颗粒细胞,胞内密集分布着大量的内质网、线粒体和分泌颗粒(张永泉等,2013)。东方扁虾的滤泡细胞富含游离核糖体、粗面内质网和线粒体,合成活性较强(朱冬发等,2006)。本研究显示,光裸星虫卵母细胞外包围着疏松排列的单层滤泡细胞,在卵子发育过程中,滤泡细胞数量有所增加,但形态结构变化小,细胞质很薄,核糖体、线粒体、内质网等细胞器少。显然,这些滤泡细胞缺乏物质合成与分泌的能力,难以满足卵母细胞发育对卵黄积累的需求。可口革囊星虫和革囊星虫(agassizii)的卵母细胞外均没有滤泡细胞,普通戈芬星虫的滤泡细胞在卵母细胞发育早期阶段即消失(Rice,1989; 竺俊全等,2012),说明这些星虫动物的滤泡细胞不参与合成卵黄前体物质。成永旭等(2002)认为锯缘青蟹(Scylla serrata)卵泡细胞没有合成与分泌的作用,而是类似于“过滤器”,允许血淋巴中的卵黄前体物质或卵黄脂蛋白通过卵泡细胞而进入卵母细胞。作者认为,光裸星虫的滤泡细胞不是外源性卵黄的合成部位,而是与锯缘青蟹卵泡细胞类似,起着选择性吸收与转运的作用。
本研究发现,采集自湛江遂溪的光裸星虫成熟卵的胶质膜厚约20-25μm,卵黄膜厚9-12μm,卵黄膜纤维多达20 余条; Rice(1989)报道光裸星虫波多黎各群体成熟卵的胶质膜为12-13μm,卵黄膜平均厚度为5μm,卵黄膜纤维仅3-4 条。两个群体成熟卵的卵膜结构存在较大差异。光裸星虫不同地理群体的成熟卵卵径也存在明显差异: 光裸星虫坦帕湾群体(Rice,1988)、波多黎各群体(Rice,1989)、厦门群体(郭学武,1993)成熟卵的平均直径分别为120、178和170μm。地理隔离造成的群体遗传结构差异可能是导致卵径大小和卵膜结构差异的主要原因,现有研究已经证实光裸星虫群体间存在明显的遗传分化: 王庆恒等(2008)报道了光裸星虫湛江群体与冲绳群体的染色体数目相同,但染色体组型明显不同; RAPD 分析(王庆恒等,2006)、16S rRNA(Du et al,2008)和COI(Du et al,2009)基因序列比较均显示,光裸星虫多态位点比例和遗传多样性指数较高,群体间分化明显。
Rice(1989)将星虫胚胎发育分为3 种类型(D 型:无幼虫直接发育; L 型: 具有完全依赖卵黄营养的幼虫期; P 型: 具有以浮游生物为营养的幼虫期),并统计了23 种星虫动物的成体规格、成熟卵形状、卵径、卵色与胚胎发育类型之间的相关性,结果显示,只有卵径与发育类型间存在显著相关(P<0.05),即D 型星虫的卵径最大(135-280μm),L 型星虫的卵径次之(125-175μm),P 型星虫卵径最小(<125μm)。可口革囊星虫和光裸星虫均需要经过担轮幼虫、海球幼体及变态等发育阶段才能发育为稚虫,为典型的P 型星虫。其中,可口革囊星虫成熟卵卵径约为115-140μm(顾晓英等,2009),与Rice 的分析结果基本一致; 但光裸星虫波多黎各(Rice,1989)、厦门(郭学武等,1993)、北海(兰国宝等,2002)、湛江群体(王庆恒等,2005)的成熟卵卵径均达到160μm 以上,不符合上述规律。
4 结论光裸星虫卵子在体腔液中游离发育,卵外有滤泡细胞。发育过程中,细胞器数量、细胞核形态、卵黄发生情况、卵膜的形态结构等发生复杂变化,可将卵母细胞的发育划分为卵黄形成前期、卵黄形成初期、卵黄旺盛合成期和成熟期4 个阶段。
| 王庆恒, 杜宇宏, 林斯里, 等, 2008. 裸体方格星虫染色体组型分析. 动物学杂志, 43 (5) : 95–98 |
| 王庆恒, 杜晓东, 李康, 2006. 光裸星虫遗传多样性的RAPD分析. 海洋水产研究, 27 (3) : 57–61 |
| 王庆恒, 杜晓东, 黄红艳, 等, 2005. 湛江地区光裸星虫的生殖细胞发育和生殖周期. 湛江海洋大学学报(自然科学版), 25 (1) : 5–9 |
| 兰国宝, 阎冰, 2002. 方格星虫繁殖生物学研究. 水产学报, 26 (6) : 503–509 |
| 兰国宝, 阎冰, 廖思明, 2003. 方格星虫胚胎与幼体发育的研究. 热带海洋学报, 22 (6) : 70–75 |
| 成永旭, 李少菁, 王桂忠, 等, 2002. 锯缘青蟹卵黄发生期卵母细胞和卵泡细胞之间的结构变化. 动物学报, 48 (1) : 80–92 |
| 成永旭, 堵南山, 赖伟, 1999. 中华绒螯蟹成熟卵巢的脂类及脂肪酸组成. 中国水产科学, 6 (1) : 79–82 |
| 朱冬发, 王桂忠, 李少菁, 2006. 东方扁虾卵子发生的超微结构. 水生生物学报, 30 (4) : 439–445 |
| 杨筱珍, 王金峰, 杨丽娜, 等, 2009. 日本新糠虾(Neomysis japonica)卵巢发育与卵子发生. 海洋与湖沼, 40 (3) : 338–346 |
| 吴明灿, 张立, 潘英, 等, 2015. 糙海参卵子发生及卵黄发生的超微结构. 热带海洋学报, 34 (3) : 68–74 |
| 邹杰, 彭慧婧, 蒋艳, 等, 2010. 方格星虫亲体培育试验. 渔业现代化, 37 (3) : 30–33 |
| 应雪萍, 2002. 文蛤卵母细胞卵黄发生的超微结构. 中国水产科学, 9 (2) : 125–128 |
| 张琴, 童潼, 童万平, 等, 2012. 饲料蛋白水平对方格星虫稚虫日增重和消化酶活性的影响. 渔业现代化, 39 (2) : 41–47 |
| 张永泉, 尹家胜, 杜佳, 等, 2013. 哲罗鱼(Hucho taimen)卵巢滤泡细胞发生的超微结构研究. 海洋与湖沼, 44 (1) : 262–266 |
| 陈振国, 班廷辉, 2015. 方格星虫捕捉机:中国, CN201420615340.0 |
| 竺俊全, 王伟, 丁理法, 2012. 可口革囊星虫(Phascolosoma esculenta)卵黄合成期卵母细胞发育及卵黄发生与卵膜形成的超微结构. 海洋与湖沼, 43 (4) : 870–876 |
| 金春华, 竺俊全, 许式见, 等, 2011. 可口革囊星虫(Phascolosoma esculenta)胚胎及幼虫发育研究. 海洋与湖沼, 42 (1) : 94–100 |
| 姜永华, 颜素芬, 宋振荣, 2005. 凡纳滨对虾卵母细胞卵黄发生的超微结构. 动物学报, 51 (1) : 133–141 |
| 洪水根, 1992. 长毛对虾卵子发生的研究II. 卵黄发生. 海洋与湖沼, 23 (3) : 280–284 |
| 顾晓英, 竺俊全, 许式见, 等, 2009. 可口革囊星虫(Phascolosoma esculenta)卵子发生的组织学研究. 海洋与湖沼, 40 (3) : 283–288 |
| 顾海龙, 林志华, 沈伟良, 等, 2013. 泥蚶初级卵母细胞发育及卵黄发生的超微结构研究. 海洋科学, 37 (1) : 49–53 |
| 郭学武, 李复雪, 1993. 光裸星虫生殖周期的研究. 热带海洋, 12 (2) : 69–76 |
| 堵南山, 赖伟, 陈鹏程, 等, 1999. 中华绒螯蟹卵黄形成的研究. 动物学报, 45 (1) : 88–92 |
| 蒋艳, 蔡德建, 邹杰, 等, 2010. 方格星虫苗种池塘中间培育试验研究. 广西科学, 17 (2) : 175–177 |
| 曾志南, 李复雪, 1991. 青蛤卵母细胞发育过程和卵黄发生的超微结构研究. 海洋学报, 13 (5) : 679–683 |
| 操向文, 王庆恒, 黄若男, 等, 2009. 光裸星虫消化系统的解剖学和组织学研究. 广东海洋大学学报, 29 (3) : 6–10 |
| Du X D, Chen Z, Deng Y W, et al, 2008. Genetic Diversity and Population Structure of the Peanut Worm (Sipunculus nudus)in Southern China as Inferred from Mitochondrial 16S rRNA Sequences. The Israeli Journal of Aquaculture-Bamidgeh, 60 (4) : 237–242 |
| Du X D, Chen Z, Deng Y W, et al, 2009. Comparative analysis of genetic diversity and population structure of Sipunculus nudus as revealed by mitochondrial COI sequences. Biochemical Genetics, 47 (11-12) : 884–891 DOI:10.1007/s10528-009-9291-x |
| Gonse P H, 1956. L'ovogenese chez Phascolosoma vulgare:Ⅱ. Recherches biométriques sur les ovocytes. Acta Zoologica, 37 (3) : 225–233 |
| Rice M E, 1974. Gametogenesis in three species of Sipuncula:Phascolosoma agassizi, Golfingia pugettensis, and Themiste pyroides. La Cellule, 79 (2-3) : 259–313 |
| Rice M E, 1988. Observations on development and metamorphosis of Siphonosoma cumanense with comparative remarks on Sipunculus nudus (Sipuncula, Sipunculidae). Bulletin of Marine Science, 42 (1) : 1–15 |
| Rice M E, 1989. Comparative observations of gametes, fertilization, and maturation in sipunculans. In:Ryland J S ed. Reproduction, Genetics and Distributions of Marine Organisms:23rd European Marine Biology Symposium.Swansea:School of Biological Sciences, University of Wales, 167-183 |
| Rice M E, Reichardt H F, Piraino J, et al, 2012. Reproduction, development, growth, and the length of larval life of Phascolosoma turnerae, a wood-dwelling deep-sea sipunculan. Invertebrate Biology, 131 (3) : 204–215 DOI:10.1111/ivb.2012.131.issue-3 |
| Sawada N, 1975. An electron microscopic study on the oogenesis of Sipunculan worms. In:Mary E, Todorovic M, eds.Proceedings of the International Symposium on the Biology of the Sipuncula and Echiura. Belgrade:Institute for Biological Research, 169-176 |
 2017, Vol. 48
2017, Vol. 48

